NUMETA PED G19 %E infüzyon için emülsiyon 1000 ml { Baxter Renal } Klinik Özellikler
{ Amino Asit + Elektrolit + Lipid + Karbonhidrat }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
NUMETA PED G19%E, 2 yaşından büyük çocuklar ve 16-18 yaş arası ergenlerde oral ya da enteral beslenmenin olanaksız, yetersiz ya da kontrendike olduğu durumlarda, parenteral beslenme amacıyla kullanılır.
4.2. Pozoloji ve uygulama şekli
Doz, oral/enteral yoldan sağlanan ek enerji ya da proteinler yanında enerji tüketimine, hastanın vücut ağırlığına, yaşına, klinik koşullarına ve NUMETA PED G19%E bileşenlerini metabolize edebilme yeteneğine göre belirlenir. İlacın toplam elektrolit ve makronutrient bileşimi, torbanın hangi odacıklarının karıştırıldığına göre değişir (Bkz. Bölüm 2).
Maksimum günlük doz aşılmamalıdır. Çoklu odacıklı torbanın statik bileşiminden dolayı, hastanın tüm besin ihtiyacını aynı anda karşılaması mümkün olmayabilir. Hastaların gerekli besin miktarlarının statik torbanın içeriğinden farklı olduğu klinik durumlar mevcut olabilir.
Bir saat içinde önerilen maksimum infüzyon hızı ve bir günde uygulanabilecek maksimum hacim ürünün bileşimine bağlıdır. Bu limitlerden daha düşük olanı, günlük uygulanabilecek miktarı belirler. Bir saatte önerilen maksimum infüzyon hızı ve bir günde uygulanabilecek maksimum hacim için aşağıdaki kılavuz verilmiştir:
| Aktive 2 odacıklı torba (775 mL) | Aktive 3 odacıklı torba (1000 mL) |
Maksimum infüzyon hızı (mL/kg/saat) | 4,7 | 4,6 |
Denkliği: |
|
|
Amino asit (g/kg/saat) | 0,14* | 0,11 |
Glukoz (g/kg/saat) | 1,17 | 0,89 |
Lipidler (g/kg/saat) | 0 | 0,13* |
Maksimum hacim (mL/kg/gün) | 64,8 | 83,6 |
Denkliği: |
|
|
Amino asit (g/kg/gün) | 1,9 | 1,9 |
Glukoz (g/kg/gün) | 16* | 16* |
Lipidler (g/kg/gün) | 0 | 2,3 |
* ESPEN-ESPGHAN (ESPEN: Avrupa Klinik Nütrisyon ve Metabolizma Derneği- ESPGHAN: Avrupa Çocuk Gastroenteroloji, Hepatoloji ve Beslenme Birliği) kılavuzlarına göre limiti belirleyen parametreler
Uygulama şekli:
Çözelti (torbada ve uygulama setinde) uygulama boyunca karışım açısından ışık maruziyetine karşı korunmalıdır (bkz. Bölüm 4.4).
Yüksek ozmolaritesi nedeniyle seyreltilmemiş NUMETA PED G19%E yalnızca santral bir venden uygulanabilir. Bununla birlikte NUMETA PED G19%E'nin yeteri kadar enjeksiyonluk su ile seyreltilmesi ozmolariteyi düşürür ve periferik yoldan infüzyonuna olanak sağlar. Aşağıdaki formülde seyreltmenin ozmolariteyi nasıl etkilediği gösterilmiştir:
Nihai ozmolarite = | Torba hacmi X Başlangıçtaki ozmolarite |
Eklenen su miktarı + Torba hacmi |
Aşağıdaki tabloda eser elementlerin, vitaminlerin ve enjeksiyonluk suyun aktive 3 odacıklı torba karışımına eklenmesi sonrası oluşan ozmolarite örneği görülmektedir:
| Amino asitler, glukoz ve lipidler (Aktive 3 odacıklı torba) |
Torbanın başlangıç hacmi (mL) | 1000 |
Başlangıç ozmolarite (yaklaşık mOsm/L) | 1460 |
Eklenen su miktarı (mL) | 1000 |
Ekleme sonrası nihai hacim (mL) | 2000 |
Ekleme sonrası ozmolarite (yaklaşık mOsm/L) | 730 |
Uygulama hızı, ilk bir saat içinde kademeli olarak arttırılmalıdır. NUMETA PED G19%E tedavisi sonlandırılırken son bir saat içindeki uygulama hızı kademeli olarak azaltılmalıdır. Uygulama hızı uygulanacak doz miktarına, günlük sıvı alımına ve infüzyon süresine göre ayarlanmalıdır (Bkz. Bölüm 4.9).
Tek bir torbanın aktive edilmesi, uygulama için askıya alınması ve infüzyonu 24 saatten uzun sürede yapılmamalıdır. Periyodik infüzyonlar hastanın metabolik toleransına göre düzenlenmelidir.
Hastanın klinik koşulları gerektirdiği sürece parenteral beslenmeye devam edilebilir.
Bu ürün elektrolit içerir. Hekimin kararı ve hastanın klinik gereksinimlerine göre istenirse elektrolit içeren ticari preparatlar eklenebilir.
Hekimin kararı ve hastanın klinik gereksinimlerine göre istenirse vitamin ve eser elementler de
eklenebilir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek / Karaciğer yetmezliği:
Böbrek yetmezliği olan hastalarda dikkatle uygulanmalıdır (Bkz. Bölüm 4.4).
Kolestaz veya karaciğer fonksiyon testlerinde yükselmeler dahil ağır karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.4).
Pediyatrik popülasyon:
NUMETA PED G19%E iki yaşından itibaren 18 yaşına kadar çocuk ve ergenlerin beslenme gereksinimleri dikkate alınarak hazırlanmıştır.
Geriyatrik popülasyon:
Bu popülasyonla ilgili ek bilgi bulunmamaktadır.
4.3. Kontrendikasyonlar
İntravenöz infüzyon için aktive edilmiş 2 odacıklı torba olarak NUMETA PED G19%E'nin uygulanmasına dair genel kontrendikasyonlar aşağıdaki gibidir:
Yumurta, soya fasulyesi veya yer fıstığı proteinlerine ya da içindeki etkin ya da Bölüm
6.1'de listelenmiş yardımcı maddelerden herhangi birine veya kabının bileşenlerine karşı bilinen aşırı duyarlılığı olanlar
Amino asit metabolizmasında doğumsal anormallik olması
Sodyum, potasyum, magnezyum, kalsiyum ve/veya fosforun plazma düzeylerinin patolojik derecede yüksek olması
Ağır hiperglisemi
Lipidlerin eklenmesi (intravenöz emülsiyon için aktive edilmiş 3 odacıklı torba olarak
NUMETA PED G19%E'nin uygulanması) aşağıdaki ek klinik durumlarda kontrendikedir:
Ağır hiperlipidemi ya da hipertrigliseridemiyle karakterize ağır lipid metabolizması bozuklukları
4.4. Özel kullanım uyarıları ve önlemleri
Eğer alerjik reaksiyona bağlı herhangi bir işaret ya da semptom gelişirse (ateş, terleme, titreme, baş ağrısı, deride döküntü ya da dispne), infüzyona hemen son verilmelidir.
NUMETA PED G19%E, mısır nişastasından temin edilen glukoz içerir. Bu yüzden mısır veya mısır ürünlerine bilinen alerjisi olan hastalarda NUMETA PED G19%E dikkatli kullanılmalıdır.
Her yaştaki hastada (yetişkinler dahil), farklı infüzyon yolları veya farklı infüzyon bölgeleri kullanılsa bile, seftriakson-kalsiyum tuzu şeklinde çökme riskinden dolayı, seftriakson, NUMETA PED G19%E de dahil olmak üzere, herhangi bir intravenöz kalsiyum içeren çözelti ile karıştırılmamalı veya eş zamanlı olarak kullanılmamalıdır.
Ancak 28 günlükten büyük olan hastalarda seftriakson ile kalsiyum içeren çözeltiler, farklı bölgelerdeki infüzyon yolları kullanılırsa veya infüzyon yolları değiştirilir veya çökelmeyi engellemek amacıyla fizyolojik tuz çözeltisi ile infüzyonlar arasında iyice yıkanırsa, ardışık uygulama yoluyla biri diğerinden sonra gelecek şekilde uygulanabilir.
Parenteral beslenme alan hastalarda pulmoner vasküler embolizm ve solunum bozukluğuna yol açan pulmoner vasküler çökelmeler bildirilmiştir. Bazı olgularda ölümcül sonuçlar meydana gelmiştir. Aşırı kalsiyum ve fosfat eklenmesi, kalsiyum fosfat çökeltilerinin oluşma riskini arttırır (Bkz. Bölüm 6.2). Ayrıca kan dolaşımında şüpheli çökelti oluşumu da rapor edilmiştir.
Çözeltinin yanı sıra, infüzyon seti ve kateter de çökeltiler açısından düzenli olarak kontrol edilmelidir.
Solunum sıkıntısı belirtilerinin oluşması halinde infüzyon durdurulmalı ve tıbbi değerlendirme başlatılmalıdır.
İlk olarak içeriğin uygunluğu kontrol edilmeden torbaya eklenti yapılmamalıdır, çünkü lipid emülsiyonda çökelti veya destabilizasyon oluşumu vasküler oklüzyona sebep olabilir (Bkz. Bölüm 4.2 ve 6.2).
Parenteral formülasyonlar için intravenöz kateterlerin kullanımı sırasında veya bu kateterlerin bakımının iyi yapılmamasına bağlı olarak enfeksiyon ve sepsis görülebilir. Hastalığın immünosüpresif etkileri ya da uygulanan ilaçlar enfeksiyon ve sepsisi teşvik edebilir. Ateş/titreme, lökositoz, damar yolu ulaşım cihazıyla ilgili teknik komplikasyonlar ve hiperglisemi açısından dikkatli semptomatik ve laboratuvar izlemlerinin yapılması enfeksiyonların erken tanısına yardımcı olabilir. Parenteral beslenmeye gereksinimi olan hastalar, malnutrisyon ve/veya altta yatan hastalıkları nedeniyle enfeksiyonlara daha yatkın olurlar. Beslenme formülasyonlarının hazırlanmasında aseptik tekniklere olduğu kadar kateter yerleştirme ve bakımına verilen önemin artırılmasıyla, septik komplikasyonların sıklığı azaltılabilir.
Diğer parenteral beslenme ürünlerinde yağ yüklenmesi sendromu rapor edilmiştir. NUMETA PED G19%E içeriğindeki yağları metabolize etme yeteneğinin azalması veya yetersiz kalması "yağ yüklenmesi sendromu"na sebep olabilir.
Ağır beslenme bozukluğu olan hastaların yeniden beslenmeye başlanmasıyla, hastalarda anabolizma arttıkça potasyum, fosfor ve magnezyumun hücre içine geçişinin artışıyla karakterize bir sendrom olan “yeniden besleme†sendromu ortaya çıkabilir. Tiamin eksikliği ve sıvı retansiyonu da gelişebilir. Parenteral beslenmenin dikkatli bir şekilde kademeli olarak artırılması ve sıvı, elektrolitler, eser elementler ile vitaminlerin düzeylerinin yakından izlenmesi önerilir.
NUMETA PED G19%E, uygun seyreltme yapılması haricinde sadece santral ven yoluyla uygulanmalıdır (Bkz. Bölüm 4.2). Çözeltinin ekstravazasyonu durumunda venöz iritasyondan veya doku hasarından kaçınmak için bileşime ek ilaç eklemesi yapılırken, son karışımın ozmolaritesi periferik bir venden uygulanmadan önce ölçülmelidir. NUMETA PED G19%E'nin periferal uygulaması yumuşak doku yaralanmasına ve cilt nekrozuna yol açan ekstravazasyona sebep olmuştur.
Primer torbada bulunan olası atık gazlardan dolayı oluşabilecek hava embolisini önlemek için
torbalar seri bağlanmamalıdır.
Gerektiği hallerde lipidler, vitaminler, ek elektrolitler ve eser elementler uygulanabilir.
Önlemler:
Geçimliliği ilk olarak onaylanmadan ve sonuçta oluşan preparasyonun stabilitesi (özellikle lipid emülsiyonun stabilitesi) olmadan, torbadaki üç odacıktan birine veya karıştırılmış çözeltiye/emülsiyona diğer tıbbi ürünler veya maddeler eklenmemelidir (Bkz. Bölüm 6.2).
NUMETA PED G19%E, uygulama tamamlanana kadar ışıktan korunmalıdır (bkz. Bölüm
4.2,Bölüm 6.3 ve Bölüm 6.6.).
Tedavi boyunca hasta, su ve elektrolit dengesi, serum ozmolaritesi, serum trigliseritleri, asit -baz dengesi, kan glukozu, karaciğer ve böbrek fonksiyon testleri, trombositler dahil kan sayımları ve koagülasyon testleri yapılarak rutin olarak izlenmelidir.
Klinik durumun stabil olmadığı durumlarda (örneğin ağır post-travmatik durumlarda, dekompanse diyabetes mellitus durumunda, dolaşım şokunun akut fazında, akut miyokart enfarktüsünde, ağır metabolik asidozda, ağır sepsiste ve hiperozmolar komada) NUMETA PED G19%E uygulaması izlenerek, dozaj hastaların klinik gereksinimlerine göre ayarlanmalıdır.
Kardiyovasküler
Pulmoner ödem ya da kalp yetmezliği olan hastalarda dikkatle uygulanmalıdır. Hastanın sıvı durumu yakından izlenmelidir.
Renal
Böbrek yetmezliği olan hastalarda dikkatle uygulanmalıdır. Bu hastalarda sıvı ve aralarında magnezyumun da bulunduğu (Bkz. Hipermagnezemi) elektrolitlerin durumu yakından izlenmelidir.
İnfüzyona başlamadan önce hastada ağır sıvı - elektrolit denge bozuklukları, ağır sıvı yüklenmesi durumları ve şiddetli metabolik bozukluklar varsa bunlar düzeltilmelidir (Bkz. Bölüm 4.3).
Hepatik / Gastrointestinal
Kolestaz veya karaciğer enzimlerinde yükselmeler dahil ağır karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır. Karaciğer fonksiyon testleri yakından izlenmelidir.
Endokrin ve Metabolizma
Besleyici maddelerin alımı hastanın gereksinimlerine göre ayarlanmadıysa veya uygulanan herhangi bir diyet bileşeninin metabolik kapasitesi tam olarak değerlendirilmediyse metabolik komplikasyonlar oluşabilmektedir.
Olumsuz metabolik etkiler nutrientlerin yetersiz ya da aşırı uygulanmasından ya da karışımın bileşiminin hastanın bireysel gereksinimlerine göre hazırlanmamış olmasından kaynaklanabilir.
Serum trigliserit konsantrasyonu ve vücudun lipidleri metabolize edebilme yeterliliği, düzenli olarak kontrol edilmelidir. Bir lipid metabolizma bozukluğundan kuşkulanılıyorsa, klinik gereksinim doğrultusunda serum trigliseritlerinin izlenmesi önerilir.
Hiperglisemi durumunda NUMETA PED G19%E'nin infüzyon hızı ayarlanmalı ve/veya insülin uygulanmalıdır (Bkz. Bölüm 4.9).
Hematolojik
Aşırı koagülasyon bozukluğu olan hastalarda dikkatli kullanılmalıdır. Kan sayımı ve koagülasyon parametreleri yakından izlenmelidir.
Hipermagnezemi
NUMETA PED G16%E maksimum dozda uygulandığında, 0.3 mmol/kg/gün magnezyum temin etmektedir. Bu durumun hipermagnezemiye yol açma olasılığı vardır.
Hipermagnezeminin belirtileri arasında genel halsizlik, hiporefleksi, bulantı, kusma, hipokalsemi, solunum yetmezliği, hipotansiyon ve aritmi bulunur. Hipermagnezeminin belirtileri fark edilemediğinde, rutin klinik muayeneye ve hastanın ihtiyacına göre magnezyum seviyelerinin başlangıçta ve daha sonra uygun aralıklarla izlenmesi tavsiye edilir. Özellikle renal fonksiyonları bozulmuş hipermagnezemi geliştirme riski yüksek olan hastalarda,
hipermagnezemi geliştirme riski yüksek olan başka ilaç kullanan hastalarda veya yakın zamanda antepartum dönemde magnezyum alan annelerin yenidoğan bebekleri gibi başka kaynaklardan magnezyum alan hastalardaönemlidir.
Serum magnezyum seviyeleri yükselirse (referans normal değer aralığı üstü), NUMETA PED G16%E infüzyonu durdurulmalı veya infüzyon hızı klinik olarak uygun ve güvenli görüldüğü şekilde azaltılmalıdır.
NUMETA PED G19%E soya yağı ihtiva eder. Fıstık ya da soyaya alerjisi olan hastalarda
kullanılmamalıdır.
Bu tıbbi ürünün üç bölmesi kullanıldığında her 100 mL'sinde 4,6 mmol sodyum ve iki bölmesi kullanıldığında her 100 mL'sinde 5,8 mmol ihtiva eder. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
Bu tıbbi ürün üç bölmesi kullanıldığında her 100 mL'sinde 19,2 g glikoz ve iki bölmesi kullanıldığında her 100 mL'sinde 24,7 g glikoz içerir. Bu, diabetes mellitus hastalarında göz önünde bulundurulmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
NUMETA PED G19%E ile herhangi bir farmakodinamik etkileşim çalışması yapılmamıştır.
NUMETA PED G19%E psödoaglütinasyon olasılığı nedeniyle, aynı infüzyon hattından aynı anda kanla birlikte verilmemelidir.
![]()
Her yaştaki hastada (yetişkinler dahil), farklı infüzyon yolları veya farklı infüzyon bölgeleri kullanılsa bile, seftriakson-kalsiyum tuzu şeklinde çökme riskinden dolayı, seftriakson, NUMETA PED G19%E de dahil olmak üzere, herhangi bir intravenöz kalsiyum içeren çözelti ile karıştırılmamalı veya eş zamanlı olarak kullanılmamalıdır (Bkz. Bölüm 4.4). Ancak 28 günlükten büyük olan hastalarda seftriakson ile kalsiyum içeren çözeltiler, farklı bölgelerdeki infüzyon yolları kullanılırsa veya infüzyon yolları değiştirilir veya çökelmeyi engellemek amacıyla fizyolojik tuz çözeltisi ile infüzyonlar arasında iyice yıkanırsa, ardışık uygulama yoluyla biri diğerinden sonra gelecek şekilde uygulanabilir.
Zeytinyağı ve soya fasulyesi yağının doğal yapısında bulunan K1 vitamini, kumarinin (veya varfarin dahil kumarin türevlerinin) antikoagülan etkinliğine karşıt bir etki oluşturabilir.
NUMETA PED G19%E'nin potasyum içeriği nedeniyle, potasyum tutucu diüretiklerle (amilorid, spironolakton, triamteren) veya ADE inhibitörleriyle, anjiyotensin II reseptör antagonistleriyle veya immünosupresan takrolimus ve siklosporinle eş zamanlı tedavi görmekte olan hastalarda hiperkalemi riski açısından özel dikkat gerekir.
Eğer lipidlerin vücuttan atılım süresinden önce kan örneği alınmışsa emülsiyonun içeriğindeki lipid, bazı laboratuvar testlerinin (örneğin bilirubin, laktat dehidrojenaz, oksijen satürasyonu, kan hemoglobini) sonuçlarını etkileyebilir. Ek lipid uygulanmadığında lipidler genellikle emülsiyon verildikten sonraki 5 ila 6 saat içinde vücuttan elimine edilirler.
Özel popülasyonlara ilişkin ek bilgiler:
Hiçbir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Hiçbir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
:Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (kontrasepsiyon): NUMETA PED G19%E'nin çocuk doğurma potansiyeli bulunan kadınlarda üreme kapasitesini etkileyip etkilemediği bilinmemektedir. Hasta, gebe kaldığında veya gebelik kararı aldığında hekimini bilgilendirmesi gerektiği hususunda uyarılmalıdır.
Gebelik dönemi
Hayvanlar üzerinde yapılan araştırmalar, gebelik / ve-veya / embriyonal / fetal gelişim / ve- veya / doğum / ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
NUMETA PED G19%E gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
NUMETA PED G19%E reçetelenmeden önce doktor tarafından her bir hasta için olası yararı/riski göz önünde bulundurulmalıdır.
Laktasyon dönemi
Bu ilacın bileşimindeki maddelerin insan sütüyle atılıp atılmadığı bilinmemektedir. Bileşimdeki bu maddelerin süt ile atılımı hayvanlar üzerinde araştırılmamıştır. Emzirmenin durdurulup durdurulmayacağına ya da NUMETA PED G19%E tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve NUMETA PED G19%E tedavisinin emziren anne açısından faydası dikkate alınmalıdır.
Üreme yeteneği / Fertilite
İnsanlardaki üreme yeteneği/fertiliteyi etkileyip etkilemediği bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
NUMETA PED G19%E parenteral uygulamaya yönelik bir tıbbi ürün olduğundan, kullanımı sırasında araç ve makine kullanımı mümkün değildir. İlacın araç ve makine kullanım yeteneği üzerindeki etkisini araştıran herhangi bir çalışma bulunmamaktadır.
4.8. İstenmeyen etkiler
NUMETA'nın güvenliliği ve uygulanması tek bir faz III çalışmasında değerlendirilmiştir. Çalışmaya yüzellidokuz (159) pediyatrik hasta dahil edilerek NUMETA uygulanmıştır.
Klinik çalışmalar ve pazarlama sonrası deneyimlerden toplanan veriler, NUMETA ile ilgili aşağıdaki advers ilaç reaksiyonlarını göstermektedir:
Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (≥1/10); yaygın ((≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Metabolizma ve beslenme hastalıkları
Yaygın: Hipofosfatemi*, hiperglisemi*, hiperkalsemi*, hipertrigliseridemi*, hiponatremi*
Yaygın olmayan: Hiperlipidemi
* Kan örnekleri infüzyon sırasında alınmıştır (aç değilken).
Hepatobiliyer hastalıklar
Yaygın olmayan: Kolestaz
Deri ve derialtı doku hastalıkları:
Bilinmiyor: Cilt nekrozu*, yumuşak doku yaralanması*
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:
Bilinmiyor: Ekstravazasyon*
* Bu advers reaksiyon, sadece yetersiz seyreltme ile periferal olarak uygulanmış olan NUMETA PED G16%E ve NUMETA Neo G13%E için bildirilmiştir (Bkz. Bölüm 4.4).
Diğer (Sınıf) Etkiler:
Diğer parenteral beslenme karışımları ile aşağıda verilen advers reaksiyonlar rapor edilmiştir:
Yağ yüklenmesi sendromu: Uygun olmayan bir uygulama (örneğin aşırı doz ve/veya önerilenden daha yüksek infüzyon hızı; Bkz. Bölüm 4.9) sebep olabilir; bunun yanında bu sendromun işaret ve semptomları, ürün talimatlara göre uygulandığında da meydana gelebilir. NUMETA PED G19%E içeriğindeki yağları ortamdan uzaklaştırma yeteneğinin azalması veya yetersiz kalması sürekli plazma klirensiyle beraber “yağ yüklenmesi sendromu†ile sonuçlanabilir. Bu sendroma hastanın klinik durumunda ani kötüleşme eşlik eder ve tipik belirtileri arasında hiperlipidemi, ateş, karaciğerde yağlı infiltrasyon (hepatomegali) karaciğer fonksiyonlarında kötüleşme, anemi, lökopeni, trombositopeni, pıhtılaşma bozuklukları ve merkezi sinir sistemi rahatsızlıkları (örneğin koma) bulunur. Lipid emülsiyonunun infüzyonu kesildiğinde, bu bulguların birçoğu genellikle gerilemektedir.
Pulmoner vasküler çökeltiler (pulmoner vasküler embolizm ve solunum bozukluğu) (Bkz. Bölüm 4.4)
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Uygulamanın uygun olmaması durumunda (doz aşımı ve/veya önerilenden daha yüksek infüzyon hızı), mide bulantısı, kusma, titreme, elektrolit bozuklukları ve hipervolemi veya asidoz meydana gelebilir ve bu durum ölümcül sonuçlara sebep olabilir. Bu gibi durumlarda, infüzyon hemen durdurulmalıdır. Tıbben uygun durumlarda daha ileri girişimler gerekebilir.
Glikoz infüzyon hızının klirensi aşması durumunda hiperglisemi, glukozüri ve hiperozmolar sendrom gelişebilir.
Lipitleri metabolize etme yeteneğinin azaldığı veya sınırlı olduğu durumlarda, “yağ yüklenmesi sendromu†meydana gelebilir. Lipid infüzyonunun kesilmesi durumunda, belirtileri geriler (Bkz. Bölüm 4.8).
Aşırı doz durumunda özel bir antidotu yoktur. Acil girişim tedbirleri arasında özellikle solunum ve kardiyovasküler sisteme yönelik olmak üzere genel destekleyici önlemler yer alır. Bazı ciddi vakalarda, hemodiyaliz, hemofiltrasyon ya da hemodiafiltrasyon gerekebilir.
Biyokimyasal parametrelerin yakından izlenmesi gerekir ve spesifik anormalliklere uygun
şekilde müdahale edilmelidir.
Basamak: İçeriğin tümüyle karışmasını sağlamak için torba en az üç defa alt-üst edilir. Karışımın görüntüsü süt beyazı bir emülsiyon şeklinde olmalıdır.
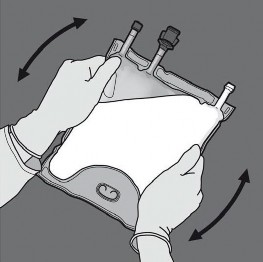
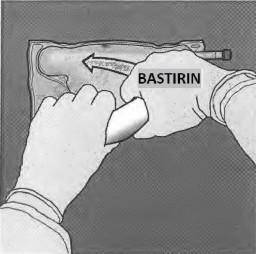
Basamak: Daha sonra aynı işlem, amino asit ve glukoz çözeltilerini içeren odacıklar arasındaki separatör tümüyle açılana kadar bu defa daha önce baskı uygulamış elle torba D askısına doğru katlanırken, torbayı katlamak için kullanılan elle baskı uygulanmalıdır.
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
İLAÇ GENEL BİLGİLERİ
Baxter Turkey Renal Hizmetler A.Ş.
| Satış Fiyatı | 3304.99 TL [ 28 Jun 2024 ] |
| Önceki Satış Fiyatı | 3304.99 TL [ 14 Jun 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681413881114 |
| Etkin Madde | Amino Asit + Elektrolit + Lipid + Karbonhidrat |
| ATC Kodu | B05BA10 |
| Birim Miktar | 1000 |
| Birim Cinsi | ML |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > Damar İçine Enjekte Edilenler > Beslenme Serumu Kombinasyonları |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |