NUMETA PED G16 %E infüzyonluk emülsiyon 500 ml { Baxter Renal } Kısa Ürün Bilgisi
{ Amino Asit + Elektrolit + Lipid + Karbonhidrat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
NUMETA PED G16%E infüzyonluk emülsiyon
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Bu ilaç üç odacıklı torbalarda ambalajlanmıştır. Her bir torba aşağıda tarif edildiği şekilde bir glukoz çözeltisi, elektrolitli pediyatrik bir amino asit çözeltisi ve bir lipid emülsiyonunun steril pirojen içermeyen kombinasyonunu içerir.
Torba hacmi | %50 glukoz çözeltisi | %5,9 elektrolitli amino asit çözeltisi | %12,5 lipid emülsiyonu |
500mL | 155 mL | 221 mL | 124 mL |
Torbanın tasarımı, lipid uygulamasının arzulanmadığı durumlarda, amino asitler ile lipid odacıkları arasındaki separatörün açılmadan kalmasını sağlayacak şekilde, yalnızca amino asitler/elektrolitler ile glukoz odacıkları arasındaki separatörün açılabilmesine olanak verir. Torba içeriğine daha sonra lipid eklenebilir veya eklenmeyebilir. Torbanın iki (2 odacıklı torba, 376 mL amino asit çözeltisi ve glukoz çözeltisi) veya üç (3 odacıklı torba, 500 mL amino asit çözeltisi, glukoz çözeltisi ve lipid emülsiyonu) odacığındaki içeriğin karıştırılmasıyla oluşan tıbbi ürün bileşimi aşağıdaki tabloda verilmiştir.
Bileşim | ||
Etkin madde | Aktive 2 odacıklı torba (376 mL) | Aktive 3 odacıklı torba (500 mL) |
Elektrolitli amino asit odacığı | ||
Alanin | 1,03 g | 1,03 g |
Arjinin | 1,08 g | 1,08 g |
Aspartik asit | 0,77 g | 0,77 g |
Sistein | 0,24 g | 0,24 g |
Glutamik asit | 1,29 g | 1,29 g |
Glisin | 0,51 g | 0,51 g |
Histidin | 0,49 g | 0,49 g |
İzolösin | 0,86 g | 0,86 g |
Lösin | 1,29 g | 1,29 g |
Lizin monohidrat (Lizin eşdeğeri) | 1,59 g (1,42 g) | 1,59 g (1,42g) |
Metiyonin | 0,31 g | 0,31 g |
Ornitin hidroklorür (Ornitin eşdeğeri) | 0,41 g (0,32 g) | 0,41 g (0,32 g) |
Fenilalanin | 0,54 g | 0,54 g |
Prolin | 0,39 g | 0,39 g |
Serin | 0,51 g | 0,51 g |
Taurin | 0,08 g | 0,08 g |
Treonin | 0,48 g | 0,48 g |
Triptofan | 0,26 g | 0,26 g |
Tirozin | 0,10 g | 0,10 g |
Valin | 0,98 g | 0,98 g |
Sodyum klorür | 0,30 g | 0,30 g |
Potasyum asetat | 1,12 g | 1,12 g |
Kalsiyum klorür dihidrat | 0,46 g | 0,46 g |
Magnezyum asetat tetrahidrat | 0,33 g | 0,33 g |
Sodyum gliserofosfat hidrat | 0,98 g | 0,98 g |
Glukoz odacığı | ||
Glukoz monohidrat (Glukoz anhidroz olarak) | 85,25 g (77,50 g) | 85,25 g (77,50 g) |
Lipid odacığı | ||
Rafine zeytinyağı (yaklaşık %80) + Rafine soya fasulyesi yağı (yaklaşık %20) | - | 15,5 g |
Yardımcı maddeler
Bileşim | ||||
| Aktive 2 odacıklı torba | Aktive 3 odacıklı torba | ||
Her bir birim hacim (mL) | 376 | 100 | 500 | 100 |
Azot (g) | 2 | 0,52 | 2 | 0,39 |
Amino asitler (g) | 13 | 3,5 | 13 | 2,6 |
Glukoz (g) | 77,5 | 20,6 | 77,5 | 15,5 |
Lipidler (g) | 0 | 0 | 15,5 | 3,1 |
Enerji |
|
|
|
|
Toplam kalori (kcal) | 362 | 96 | 517 | 103 |
Protein olmayan kalori (kcal) | 310 | 82 | 465 | 93 |
Glukoz kalorisi (kcal) | 310 | 82 | 310 | 62 |
Lipid kalorisi (kcal) | 0 | 0 | 155 | 31 |
Protein olmayan kalori/azot (kcal/g N) | 158 | 158 | 237 | 237 |
Lipid kalorisi (% protein olmayan kalori) | UD | UD | 33 | 33 |
Lipid kalorisi (% toplam kalori) | UD | UD | 30 | 30 |
Elektrolitler |
|
|
|
|
Sodyum (mmol) | 11,6 | 3.1 | 12 | 2,4 |
Potasyum (mmol) | 11,4 | 3 | 11,4 | 2,3 |
Magnezyum (mmol) | 1,6 | 0,41 | 1,6 | 0,31 |
Kalsiyum (mmol) | 3,1 | 0,82 | 3,1 | 0,62 |
Fosfat (mmol) | 3,2 | 0,85 | 4,4 | 0,87 |
Asetat (mmol) | 14,5 | 3,9 | 14,5 | 2,9 |
Malat (mmol) | 4,3 | 1,1 | 4,3 | 0,86 |
Klorür (mmol) | 13,8 | 3,7 | 13,8 | 2,8 |
Yaklaşık pH | 5,5 | 5,5 | 5,5 | 5,5 |
Yaklaşık Ozmolarite (mOsm/L) | 1585 | 1585 | 1230 | 1230 |
Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız. Hazırlanmış çözelti/emülsiyon aşağıdakileri içerir:
3. FARMASÖTİK FORMU
İnfüzyon için emülsiyon
Karışım gerçekleştirilmeden önceki görünümü:
Amino asit ve glukoz odacıklarındaki çözeltiler berrak, renksiz ya da hafif sarı görünümlüdür.
Lipid emülsiyonu homojen ve süt beyazı görünümlüdür.
TE2, V1 ve V2 ile geçimlilik
Tablo 5: Su ile seyreltme ile veya seyreltme olmadan üçü bir arada (Aktive 3 odacıklı torba) geçimliliği
Her bir 500 mL için (lipidler ile 3 odacık karışımı) | ||||||
| Seyreltme olmadan karışım | Seyreltme ile karışım | ||||
Eklentiler | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye |
Sodyum (mmol) | 12 | 4 | 16 | 12 | 0 | 12 |
Potasyum (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0 | 11,4 |
Magnezyum (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0 | 1,6 |
Kalsiyum (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0 | 3,1 |
Fosfat* (mmol) | 4,4 | 2 | 6,4 | 4,4 | 0 | 4,4 |
Eser elementler & vitaminler | - | 5 mL TE2 + ½ flakon V1 + 5 mL V2 | 5 mL TE2 + ½ flakon V1 + 5 mL V2 | - | 5 mL TE2 + ½ flakon V1 + 5 mL V2 | 5 mL TE2 + ½ flakon V1 + 5 mL V2 |
Enjeksiyonluk su | - | - | - | - | 350 mL | 350 mL |
Organik fosfat
Tablo 6: Su ile seyreltme ile veya seyreltme olmadan ikisi bir arada (Aktive 2 odacıklı torba) geçimliliği
Her bir 376 mL için (lipidler olmadan 2 odacık karışımı) | ||||||
| Seyreltme olmadan karışım | Seyreltme ile karışım | ||||
Eklentiler | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye |
Sodyum (mmol) | 11,6 | 26 | 37,6 | 11,6 | 0 | 11,6 |
Potasyum (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0 | 11,4 |
Magnezyum (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0 | 1,6 |
Kalsiyum (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0 | 3,1 |
Fosfat* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0 | 3,2 |
Eser elementler & vitaminler | - | 5 mL TE2 + ½ flakon V1 | 5 mL TE2 + ½ flakon V1 | - | 5 mL TE2 + ½ flakon V1 | 5 mL TE2 + ½ flakon V1 |
Enjeksiyonluk su | - | - | - | - | 450 mL | 450 mL |
Basamak: Torba D askısının bulunduğu tarafa döndürülerek yön değiştirilir. Separatör tamamen açılana kadar devam edilir.
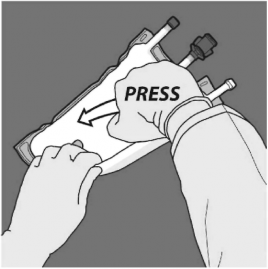
BASTIRIN
İkinci separatörün açılması tamamlanana kadar aynı şekilde işleme devam edilir.
Basamak: Bir elle torba kendi üzerine katlanırken diğeriyle uçlara doğru baskı uygulanmalıdır.
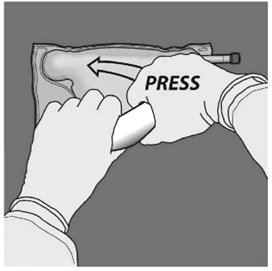
BASTIRIN
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
NUMETA PED G16%E, miadında doğmuş yenidoğan bebeklerle 2 yaşına kadar olan çocuklarda oral ya da enteral beslenmenin olanaksız, yetersiz ya da kontrendike olduğu durumlarda, parenteral beslenme amacıyla kullanılır.
4.2. Pozoloji ve uygulama şekli
Doz, oral/enteral yoldan sağlanan ek enerji ya da proteinler yanında enerji tüketimine, hastanın vücut ağırlığına, yaşına, klinik koşullarına ve NUMETA PED G16%E bileşenlerini metabolize edebilme yeteneğine göre belirlenir. İlacın toplam elektrolit ve makronutrient bileşimi, torbanın hangi odacıklarının karıştırıldığına göre değişir (Bkz. Bölüm 2).
Maksimum günlük doz aşılmamalıdır. Çoklu odacıklı torbanın statik bileşiminden dolayı, hastanın tüm besin ihtiyacını aynı anda karşılaması mümkün olmayabilir. Hastaların gerekli besin miktarlarının statik torbanın içeriğinden farklı olduğu klinik durumlar mevcut olabilir.
Bir saat içinde önerilen maksimum infüzyon hızı ve bir günde uygulanabilecek maksimum hacim ürünün bileşimine bağlıdır. Bu limitlerden daha düşük olanı, günlük uygulanabilecek miktarı belirler. Bir saatte önerilen maksimum infüzyon hızı ve bir günde uygulanabilecek maksimum hacim için aşağıdaki kılavuz verilmiştir:
| Aktive 2 odacıklı torba (376 mL) | Aktive 3 odacıklı torba (500 mL) |
Maksimum infüzyon hızı (mL/kg/saat) | 5,8 | 5,5 |
Denkliği: |
|
|
Amino asit (g/kg/saat) | 0,20* | 0,14 |
Glukoz (g/kg/saat) | 1,2 | 0,85 |
Lipidler (g/kg/saat) | 0 | 0,17* |
Maksimum hacim (mL/kg/gün) | 72,3 | 96,2 |
Denkliği: |
|
|
Amino asit (g/kg/gün) | 2,5* | 2,5* |
Glukoz (g/kg/gün) | 14,9 | 14,9 |
Lipidler (g/kg/gün) | 0 | 3 |
* ESPEN-ESPGHAN (ESPEN: Avrupa Klinik Nütrisyon ve Metabolizma Derneği- ESPGHAN: Avrupa Çocuk Gastroenteroloji, Hepatoloji ve Beslenme Birliği) kılavuzlarına göre limiti belirleyen parametreler
Uygulama şekli:
Yeni doğanlarda ve iki yaşın altındaki çocuklarda kullanıldığında, çözelti (torbada ve uygulama setinde) uygulama tamamlanana kadar ışık maruziyetinden korunmalıdır (bkz. Bölüm 4.4, Bölüm 6.3 ve Bölüm 6.6.).
Yüksek ozmolaritesi nedeniyle seyreltilmemiş NUMETA PED G16%E yalnızca santral bir venden uygulanabilir. Bununla birlikte NUMETA PED G16%E'nin yeteri kadar enjeksiyonluk su ile seyreltilmesi ozmolariteyi düşürür ve periferik yoldan infüzyonuna olanak sağlar. Aşağıdaki formülde seyreltmenin ozmolariteyi nasıl etkilediği gösterilmiştir:
Nihai ozmolarite = | Torba hacmi X Başlangıçtaki ozmolarite |
Eklenen su miktarı + Torba hacmi |
Aşağıdaki tabloda enjeksiyonluk suyun aktive 2 odacıklı torba ve aktive 3 odacıklı torba karışımına eklenmesi sonrası oluşan ozmolarite örnekleri görülmektedir:
| Amino asitler ve glukoz (Aktive 2 odacıklı torba) | Amino asitler, glukoz ve lipidler (Aktive 3 odacıklı torba) |
Torbanın başlangıç hacmi (mL) | 376 | 500 |
Başlangıç ozmolarite (yaklaşık mOsm/L) | 1585 | 1230 |
Eklenen su miktarı (mL) | 376 | 500 |
Ekleme sonrası nihai hacim (mL) | 752 | 1000 |
Ekleme sonrası ozmolarite (yaklaşık mOsm/L) | 792,5 | 615 |
Uygulama hızı, ilk bir saat içinde kademeli olarak arttırılmalıdır. NUMETA PED G16%E tedavisi sonlandırılırken son bir saat içindeki uygulama hızı kademeli olarak azaltılmalıdır. Uygulama hızı uygulanacak doz miktarına, günlük sıvı alımına ve infüzyon süresine göre ayarlanmalıdır (Bkz. Bölüm 4.9).
Tek bir torbanın aktive edilmesi, uygulama için askıya alınması ve infüzyonu 24 saatten uzun sürede yapılmamalıdır. Periyodik infüzyonlar hastanın metabolik toleransına göre düzenlenmelidir.
Hastanın klinik koşulları gerektirdiği sürece parenteral beslenmeye devam edilebilir.
Bu ürün elektrolit içerir. Hekimin kararı ve hastanın klinik gereksinimlerine göre istenirse elektrolit içeren ticari preparatlar eklenebilir.
Hekimin kararı ve hastanın klinik gereksinimlerine göre istenirse vitamin ve eser elementler de eklenebilir.
Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği:
Böbrek yetmezliği olan hastalarda dikkatle uygulanmalıdır (Bkz. Bölüm 4.4).
Kolestaz veya karaciğer fonksiyon testlerinde yükselmeler dahil ağır karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.4).
Pediyatrik popülasyon:
NUMETA PED G16%E miadında doğmuş bebeklerle iki yaşından küçük çocukların beslenme gereksinimleri dikkate alınarak hazırlanmıştır.
Geriyatrik popülasyon:
Bu popülasyonla ilgili ek bilgi bulunmamaktadır.
4.3. Kontrendikasyonlar
İntravenöz infüzyon için aktive edilmiş 2 odacıklı torba olarak NUMETA PED
G16%E'nin uygulanmasına dair genel kontrendikasyonlar aşağıdaki gibidir:
Yumurta, soya fasulyesi veya yer fıstığı proteinlerine ya da içindeki etkin ya da bölüm
6.1'de listelenmiş yardımcı maddelerden herhangi birine veya kabının bileşenlerine karşı bilinen aşırı duyarlılığı olanlar
Amino asit metabolizmasında doğumsal anormallik olması
Sodyum, potasyum, magnezyum, kalsiyum ve/veya fosforun plazma düzeylerinin patolojik derecede yüksek olması
Diğer kalsiyum içeren infüzyon çözeltileri için, yenidoğanlarda (28 günlükten az), ayrı infüzyon yolları kullanılsa bile seftriakson ile birlikte kullanımı (yenidoğanın kan dolaşımında seftriakson kalsiyum tuzu çökelmesi riski) (Bkz. Bölüm 4.4, 4.5 ve 6.2).
Ağır hiperglisemi
Lipidlerin eklenmesi (intravenöz emülsiyon için aktive edilmiş 3 odacıklı torba olarak
NUMETA PED G16%E'nin uygulanması) aşağıdaki ek klinik durumlarda kontrendikedir:
Ağır hiperlipidemi ya da hipertrigliseridemiyle karakterize ağır lipid metabolizması bozuklukları
4.4. Özel kullanım uyarıları ve önlemleri
Eğer alerjik reaksiyona bağlı herhangi bir işaret ya da semptom gelişirse (ateş, terleme, titreme, baş ağrısı, deride döküntü ya da dispne), infüzyona hemen son verilmelidir.
NUMETA PED G16%E, mısır nişastasından temin edilen glukoz içerir. Bu yüzden mısır veya mısır ürünlerine bilinen alerjisi olan hastalarda NUMETA PED G16%E dikkatli kullanılmalıdır.
1 aylıktan daha küçük, miadında doğmuş yenidoğanlarda akciğer ve böbreklerde kalsiyum- seftriakson çökeltileri ile fatal reaksiyon olguları tanımlanmıştır.
Her yaştaki hastada, farklı infüzyon yolları veya farklı infüzyon bölgeleri kullanılsa bile, seftriakson-kalsiyum tuzu şeklinde çökme riskinden dolayı, seftriakson, NUMETA PED G16%E da dahil olmak üzere, herhangi bir intravenöz kalsiyum içeren çözelti ile karıştırılmamalı veya eş zamanlı olarak kullanılmamalıdır.
Ancak 28 günlükten büyük olan hastalarda seftriakson ile kalsiyum içeren çözeltiler, farklı bölgelerdeki infüzyon yolları kullanılırsa veya infüzyon yolları değiştirilir veya çökelmeyi engellemek amacıyla fizyolojik tuz çözeltisi ile infüzyonlar arasında iyice yıkanırsa, ardışık uygulama yoluyla biri diğerinden sonra gelecek şekilde uygulanabilir.
Parenteral beslenme alan hastalarda pulmoner vasküler embolizm ve solunum bozukluğuna yol açan pulmoner vasküler çökelmeler bildirilmiştir. Bazı olgularda ölümcül sonuçlar meydana gelmiştir. Aşırı kalsiyum ve fosfat eklenmesi, kalsiyum fosfat çökeltilerinin oluşma riskini arttırır (Bkz. Bölüm 6.2). Ayrıca kan dolaşımında şüpheli çökelti oluşumu da rapor edilmiştir.
Çözeltinin yanı sıra, infüzyon seti ve kateter de çökeltiler açısından düzenli olarak kontrol edilmelidir.
Solunum sıkıntısı belirtilerinin oluşması halinde infüzyon durdurulmalı ve tıbbi değerlendirme başlatılmalıdır.
İlk olarak içeriğin uygunluğu kontrol edilmeden torbaya eklenti yapılmamalıdır, çünkü lipid emülsiyonda çökelti veya destabilizasyon oluşumu vasküler oklüzyona sebep olabilir (Bkz. Bölüm 4.2 ve 6.2).
Parenteral formülasyonlar için intravenöz kateterlerin kullanımı sırasında veya bu kateterlerin bakımının iyi yapılmamasına bağlı olarak enfeksiyon ve sepsis görülebilir. Hastalığın immünosupresif etkileri ya da uygulanan ilaçlar enfeksiyon ve sepsisi teşvik edebilir. Ateş/titreme, lökositoz, damar yolu ulaşım cihazıyla ilgili teknik komplikasyonlar ve hiperglisemi açısından dikkatli semptomatik ve laboratuvar izlemlerinin yapılması enfeksiyonların erken tanısına yardımcı olabilir. Parenteral beslenmeye gereksinimi olan hastalar, malnutrisyon ve/veya altta yatan hastalıkları nedeniyle enfeksiyonlara daha yatkın olurlar. Beslenme formülasyonlarının hazırlanmasında aseptik tekniklere olduğu kadar kateter yerleştirme ve bakımına verilen önemin artırılmasıyla, septik komplikasyonların sıklığı azaltılabilir.
Diğer parenteral beslenme ürünlerinde yağ yüklenmesi sendromu rapor edilmiştir. NUMETA PED G16%E içeriğindeki yağları metabolize etme yeteneğinin azalması veya yetersiz kalması "yağ yüklenmesi sendromu"na sebep olabilir.
Ağır beslenme bozukluğu olan hastaların yeniden beslenmeye başlanmasıyla, hastalarda anabolizma arttıkça potasyum, fosfor ve magnezyumun hücre içine geçişinin artışıyla karakterize bir sendrom olan "yeniden besleme" sendromu ortaya çıkabilir. Tiamin eksikliği ve sıvı retansiyonu da gelişebilir. Parenteral beslenmenin dikkatli bir şekilde kademeli olarak artırılması ve sıvı, elektrolitler, eser elementler ile vitaminlerin düzeylerinin yakından izlenmesi önerilir.
NUMETA PED G16%E, uygun seyreltme yapılması haricinde sadece santral ven yoluyla uygulanmalıdır (Bkz. Bölüm 4.2). Çözeltinin ekstravazasyonu durumunda venöz iritasyondan veya doku hasarından kaçınmak için bileşime ek ilaç eklemesi yapılırken, son karışımın ozmolaritesi periferik bir venden uygulanmadan önce ölçülmelidir. NUMETA PED G16%E'nin periferal uygulaması yumuşak doku yaralanmasına ve cilt nekrozuna yol açan ekstravazasyona sebep olmuştur.
Primer torbada bulunan olası atık gazlardan dolayı oluşabilecek hava embolisini önlemek için torbalar seri bağlanmamalıdır.
Gerektiği hallerde lipidler, vitaminler, ek elektrolitler ve eser elementler uygulanabilir.
Önlemler:
Geçimliliği ilk olarak onaylanmadan ve sonuçta oluşan preparasyonun stabilitesi (özellikle lipid emülsiyonun stabilitesi) olmadan, torbadaki üç odacıktan birine veya karıştırılmış çözeltiye/emülsiyona diğer tıbbi ürünler veya maddeler eklenmemelidir (Bkz. Bölüm 6.2.)
İntravenöz parenteral beslenme için ışığa maruz kalması, özellikle eser elementler ve/veya vitaminlerle karıştırıldıktan sonra, yenidoğanlarda peroksitlerin ve bozunma ürünlerinin üretimi nedeniyle klinik sonlanımda advers etkilere neden olabilir.Yenidoğanlarda ve 2 yaşın altındaki çocuklarda kullanıldığında NUMETA PED G16%E, uygulama tamamlanana kadar ışıktan korunmalıdır (bkz. Bölüm 4.2,Bölüm 6.3 ve Bölüm 6.6.).
Tedavi boyunca hasta, su ve elektrolit dengesi, serum ozmolaritesi, serum trigliseritleri, asit - baz dengesi, kan glukozu, karaciğer ve böbrek fonksiyon testleri, trombositler dahil kan sayımları ve koagülasyon testleri yapılarak rutin olarak izlenmelidir.
Klinik durumun stabil olmadığı durumlarda (örneğin ağır post-travmatik durumlarda, dekompanse diyabetes mellitus durumunda, dolaşım şokunun akut fazında, akut miyokart enfarktüsünde, ağır metabolik asidozda, ağır sepsiste ve hiperozmolar komada) NUMETA PED G16%E uygulaması izlenerek, dozaj hastaların klinik gereksinimlerine göre ayarlanmalıdır.
Kardiyovasküler
Pulmoner ödem ya da kalp yetmezliği olan hastalarda dikkatle uygulanmalıdır. Hastanın sıvı durumu yakından izlenmelidir.
Renal
Böbrek yetmezliği olan hastalarda dikkatle uygulanmalıdır. Bu hastalarda sıvı ve aralarında magnezyumun da bulunduğu (Bkz. Hipermagnezemi) elektrolitlerin durumu yakından izlenmelidir.
İnfüzyona başlamadan önce hastada ağır sıvı - elektrolit denge bozuklukları, ağır sıvı yüklenmesi durumları ve şiddetli metabolik bozukluklar varsa bunlar düzeltilmelidir (Bkz. Bölüm 4.3).
Hepatik/Gastrointestinal
Kolestaz veya karaciğer enzimlerinde yükselmeler dahil ağır karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır. Karaciğer fonksiyon testleri yakından izlenmelidir.
Endokrin ve Metabolizma
Besleyici maddelerin alımı hastanın gereksinimlerine göre ayarlanmadıysa veya uygulanan herhangi bir diyet bileşeninin metabolik kapasitesi tam olarak değerlendirilmediyse metabolik komplikasyonlar oluşabilmektedir. Olumsuz metabolik etkiler nutrientlerin yetersiz ya da aşırı uygulanmasından ya da karışımın bileşiminin hastanın bireysel gereksinimlerine göre hazırlanmamış olmasından kaynaklanabilir.
Serum trigliserit konsantrasyonu ve vücudun lipidleri metabolize edebilme yeterliliği, düzenli olarak kontrol edilmelidir. Bir lipid metabolizma bozukluğundan kuşkulanılıyorsa, klinik gereksinim doğrultusunda serum trigliseritlerinin izlenmesi önerilir.
Hiperglisemi durumunda NUMETA PED G16%E'nin infüzyon hızı ayarlanmalı ve/veya
insülin uygulanmalıdır (Bkz. Bölüm 4.9).
Hematolojik
Aşırı koagülasyon bozukluğu olan hastalarda dikkatli kullanılmalıdır. Kan sayımı ve koagülasyon parametreleri yakından izlenmelidir.
Hipermagnezemi
NUMETA PED G16%E maksimum dozda uygulandığında, 0.3 mmol/kg/gün magnezyum
temin etmektedir. Bu durumun hipermagnezemiye yol açma olasılığı vardır.
Hipermagnezeminin belirtileri arasında genel halsizlik, hiporefleksi, bulantı, kusma, hipokalsemi, solunum yetmezliği, hipotansiyon ve aritmi bulunur. Hipermagnezeminin belirtileri fark edilemediğinde, rutin klinik muayeneye ve hastanın ihtiyacına göre magnezyum seviyelerinin başlangıçta ve daha sonra uygun aralıklarla izlenmesi tavsiye edilir. Özellikle renal fonksiyonları bozulmuş hipermagnezemi geliştirme riski yüksek olan hastalarda, hipermagnezemi geliştirme riski yüksek olan başka ilaç kullanan hastalarda veya yakın zamanda antepartum dönemde magnezyum alan annelerin yenidoğan bebekleri gibi başka kaynaklardan magnezyum alan hastalardaönemlidir.
Serum magnezyum seviyeleri yükselirse (referans normal değer aralığı üstü), NUMETA PED G16%E infüzyonu durdurulmalı veya infüzyon hızı klinik olarak uygun ve güvenli görüldüğü şekilde azaltılmalıdır.
NUMETA PED G16%E soya yağı ihtiva eder. Fıstık ya da soyaya alerjisi olan hastalarda kullanılmamalıdır.
Bu tıbbi ürünün üç bölmesi kullanıldığında her 100 mL'sinde 2,4 mmol sodyum ve iki bölmesi kullanıldığında her 100 mL'sinde 3,1 mmol sodyum ihtiva eder. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
Bu tıbbi ürün üç bölmesi kullanıldığında her 100 mL'sinde 15,5 g glukoz ve iki bölmesi kullanıldığında her 100 mL'sinde 20,61 g glukoz içerir. Bu, diabetes mellitus hastalarında göz önünde bulundurulmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
NUMETA PED G16%E ile herhangi bir farmakodinamik etkileşim çalışması yapılmamıştır.
NUMETA PED G16%E psödoaglütinasyon olasılığı nedeniyle, aynı infüzyon hattından aynı anda kanla birlikte verilmemelidir.
Diğer kalsiyum içeren infüzyon çözeltileri için, NUMETA PED G16%E ile seftriaksonun eş zamanlı tedavisi yenidoğanlarda (28 günlükten az), ayrı infüzyon yolları kullanılsa bile kontrendikedir (yenidoğanın kan dolaşımında seftriakson-kalsiyum tuzu çökelmesi riski).
Her yaştaki hastada (yetişkinler dahil), farklı infüzyon yolları veya farklı infüzyon bölgeleri kullanılsa bile, seftriakson-kalsiyum tuzu şeklinde çökme riskinden dolayı, seftriakson, NUMETA PED G16%E de dahil olmak üzere, herhangi bir intravenöz kalsiyum içeren çözelti ile karıştırılmamalı veya eş zamanlı olarak kullanılmamalıdır (Bkz.
Bölüm 4.4). Ancak 28 günlükten büyük olan hastalarda seftriakson ile kalsiyum içeren çözeltiler, farklı bölgelerdeki infüzyon yolları kullanılırsa veya infüzyon yolları değiştirilir veya çökelmeyi engellemek amacıyla fizyolojik tuz çözeltisi ile infüzyonlar arasında iyice yıkanırsa, ardışık uygulama yoluyla biri diğerinden sonra gelecek şekilde uygulanabilir.
Zeytinyağı ve soya fasulyesi yağının doğal yapısında bulunan K1 vitamini, kumarinin (veya varfarin dahil kumarin türevlerinin) antikoagülan etkinliğine karşıt bir etki oluşturabilir.
NUMETA PED G16%E'nin potasyum içeriği nedeniyle, potasyum tutucu diüretiklerle (amilorid, spironolakton, triamteren) veya ADE inhibitörleriyle, anjiyotensin II reseptör antagonistleriyle veya immünosupresan takrolimus ve siklosporinle eş zamanlı tedavi görmekte olan hastalarda hiperkalemi riski açısından özel dikkat gerekir.
Eğer lipidlerin vücuttan atılım süresinden önce kan örneği alınmışsa emülsiyonun içeriğindeki lipid, bazı laboratuvar testlerinin (örneğin bilirubin, laktat dehidrojenaz, oksijen satürasyonu, kan hemoglobini) sonuçlarını etkileyebilir. Ek lipid uygulanmadığında lipidler genellikle emülsiyon verildikten sonraki 5 ila 6 saat içinde vücuttan elimine edilirler.
6.2. Geçimsizlikler
için ayrıca Bölüm 6.2'ye bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Hiçbir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Hiçbir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
:Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (kontrasepsiyon): NUMETA PED G16%E'nin çocuk doğurma potansiyeli bulunan kadınlarda üreme kapasitesini etkileyip etkilemediği bilinmemektedir. Hasta, gebe kaldığında veya gebelik kararı aldığında hekimini bilgilendirmesi gerektiği hususunda uyarılmalıdır.
Gebelik dönemi:
Hayvanlar üzerinde yapılan araştırmalar, gebelik / ve-veya / embriyonal / fetal gelişim
/ ve-veya / doğum / ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
NUMETA PED G16%E reçetelenmeden önce hekim tarafından her bir hasta için olası yararı/riski göz önünde bulundurulmalıdır.
Laktasyon dönemi:
Bu ilacın bileşimindeki maddelerin insan sütüyle atılıp atılmadığı bilinmemektedir. Bileşimdeki bu maddelerin süt ile atılımı hayvanlar üzerinde araştırılmamıştır.
Emzirmenin durdurulup durdurulmayacağına ya da NUMETA PED G16%E tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve NUMETA PED G16%E tedavisinin emziren anne açısından faydası dikkate alınmalıdır.
Üreme yeteneği/ Fertilite:
İnsanlardaki üreme yeteneği/fertiliteyi etkileyip etkilemediği bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
NUMETA PED G16%E parenteral uygulamaya yönelik bir tıbbi ürün olduğundan, kullanımı sırasında araç ve makine kullanımı mümkün değildir. İlacın araç ve makine kullanım yeteneği üzerindeki etkisini araştıran herhangi bir çalışma bulunmamaktadır.
4.8. İstenmeyen etkiler
NUMETA'nın güvenliliği ve uygulanması tek bir faz III çalışmasında değerlendirilmiştir. Çalışmaya yüz elli dokuz (159) pediyatrik hasta dahil edilerek NUMETA uygulanmıştır.
Klinik çalışmalar ve pazarlama sonrası deneyimlerden toplanan veriler, NUMETA ile ilgili aşağıdaki advers ilaç reaksiyonlarını göstermektedir:
Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (1/10); yaygın (1/100 ila <1/10); yaygın olmayan (1/1.000 ila <1/100); seyrek (1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Metabolizma ve beslenme hastalıkları:
Yaygın: Hipofosfatemi*, hiperglisemi*, hiperkalsemi*, hipertrigliseridemi*, hiponatremi*
Yaygın olmayan: Hiperlipidemi
* Kan örnekleri infüzyon sırasında alınmıştır (aç değilken).
Hepatobiliyer hastalıklar:
Yaygın olmayan: Kolestaz
Deri ve derialtı doku hastalıkları:
Bilinmiyor: Cilt nekrozu*, yumuşak doku yaralanması*
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:
Bilinmiyor: Ekstravazasyon*
* Bu advers reaksiyon, sadece yetersiz seyreltme ile periferal olarak uygulanmış olan
NUMETA PED G16%E ve NUMETA Neo G13%E için bildirilmiştir (Bkz. Bölüm 4.4).
Diğer (Sınıf) Etkiler:
Diğer parenteral beslenme karışımları ile aşağıda verilen advers reaksiyonlar rapor edilmiştir:
Yağ yüklenmesi sendromu: Uygun olmayan bir uygulama (örneğin aşırı doz ve/veya önerilenden daha yüksek infüzyon hızı; Bkz. Bölüm 4.9) sebep olabilir; bunun yanında bu sendromun işaret ve semptomları, ürün talimatlara göre uygulandığında da meydana gelebilir. NUMETA PED G16%E içeriğindeki yağları ortamdan uzaklaştırma
yeteneğinin azalması veya yetersiz kalması sürekli plazma klirensiyle beraber "yağ yüklenmesi sendromu" ile sonuçlanabilir. Bu sendroma hastanın klinik durumunda ani kötüleşme eşlik eder ve tipik belirtileri arasında hiperlipidemi, ateş, karaciğerde yağlı infiltrasyon (hepatomegali) karaciğer fonksiyonlarında kötüleşme, anemi, lökopeni, trombositopeni, pıhtılaşma bozuklukları ve merkezi sinir sistemi rahatsızlıkları (örneğin koma) bulunur. Lipid emülsiyonunun infüzyonu kesildiğinde, bu bulguların birçoğu genellikle gerilemektedir.
Pulmoner vasküler çökeltiler (pulmoner vasküler embolizm ve solunum bozukluğu) (Bkz. Bölüm 4.4)
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Uygulamanın uygun olmaması durumunda (doz aşımı ve/veya önerilenden daha yüksek infüzyon hızı), mide bulantısı, kusma, titreme, elektrolit bozuklukları ve hipervolemi veya asidoz meydana gelebilir ve bu durum ölümcül sonuçlara sebep olabilir. Bu gibi durumlarda, infüzyon hemen durdurulmalıdır. Tıbben uygun durumlarda daha ileri girişimler gerekebilir.
Glikoz infüzyon hızının klirensi aşması durumunda hiperglisemi, glukozüri ve hiperozmolar sendrom gelişebilir.
Lipitleri metabolize etme yeteneğinin azaldığı veya sınırlı olduğu durumlarda, "yağ yüklenmesi sendromu" meydana gelebilir. Lipid infüzyonunun kesilmesi durumunda, belirtileri geriler (Bkz. Bölüm 4.8).
Aşırı doz durumunda özel bir antidotu yoktur. Acil girişim tedbirleri arasında özellikle solunum ve kardiyovasküler sisteme yönelik olmak üzere genel destekleyici önlemler yer alır. Bazı ciddi vakalarda, hemodiyaliz, hemofiltrasyon ya da hemodiafiltrasyon gerekebilir.
Biyokimyasal parametrelerin yakından izlenmesi gerekir ve spesifik anormalliklere uygun
şekilde müdahale edilmelidir.
Basamak: İçeriğin tümüyle karışmasını sağlamak için torba en az üç defa alt-üst edilir. Karışımın görüntüsü süt beyazı bir emülsiyon şeklinde olmalıdır.
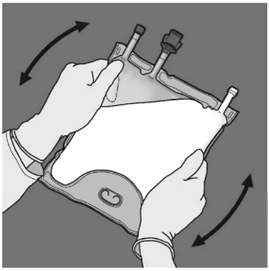
Basamak: Daha sonra aynı işlem, amino asit ve glukoz çözeltilerini içeren odacıklar arasındaki separatör tümüyle açılana kadar bu defa daha önce baskı uygulamış elle torba D askısına doğru katlanırken, torbayı katlamak için kullanılan elle baskı uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik Grubu: Parenteral beslenme çözeltileri / kombinasyonlar ATC kodu: B05 BAl0
NUMETA PED G16%E'nin bileşimindeki azot (sekizi esansiyel amino asit olmak üzere 20 adet L serisi amino asit) ve enerji (glukoz ve trigliseritler) sayesinde uygun bir azot/enerji dengesi sağlanır. Vücuttaki tüm hücrelerin normal fonksiyonlarını yürütebilmesi için azot ve enerji gereklidir. Bunun yanında azot ve enerji protein sentezinde, büyümede, yara iyileşmesinde, bağışıklık fonksiyonlarında, kas fonksiyonlarında ve diğer birçok hücresel etkinlikte de önemlidir.
Bu formülasyon aynı zamanda elektrolit de içermektedir.
Amino asit profili aşağıdaki gibidir:
Esansiyel amino asit miktarının, toplam amino asit miktarına oranı: % 47,5
Dallanmış zincirli amino asitlerin toplam amino asitlerlere oranı: % 24
NUMETA PED G16%E bileşimindeki lipid emülsiyonu, rafine zeytinyağı ile rafine soya fasulyesi yağının bileşiminden oluşur (oran yaklaşık 80/20'dir). Yağ asitlerinin yaklaşık dağılımı aşağıdaki gibidir:
% 15 doymuş yağ asitleri (SFA)
% 65 tekli doymamış yağ asitleri (MUFA)
% 20 çoklu doymamış yağ asitleri (PUFA)
Fosfolipidlerin, trigliseritlere oranı 0,06'dır. Preparatın bileşimindeki orta dereceli esansiyel yağ asidi (EFA), mevcut bir EFA yetmezliğini düzeltirken esansiyel yağ asitlerinin üst türevlerinin durumunda da düzelme sağlar.
Zeytinyağı, önemli miktarlarda alfa tokoferol içermektedir. Alfa tokoferol, orta düzeyde alınan PUFA ile birlikte, E vitamini düzeylerini normalleştirerek lipid peroksidasyonunu azaltır.
Karbonhidrat kaynağı olarak glukoz bulunmaktadır. Glukoz vücuttaki temel enerji kaynağıdır.
5.2. Farmakokinetik özellikler
Emülsiyonun içeriğinde bulunan maddelerin her biri (amino asitler, elektrolitler, glukoz, lipidler), ayrı ayrı uygulandıkları koşullardakiyle aynı şekilde dağılır, metabolize olur ve atılırlar. Ürün intravenöz yoldan verilir ve bu nedenle biyoyararlanımı %100'dür ve bileşenleri vücuttaki tüm hücrelere dağılarak bu hücrelerce metabolize edilir.
5.3. Klinik öncesi güvenlilik verileri
Üç odacıklı torbanın içeriğiyle yapılmış preklinik çalışmalarda, bu KÜB'ün diğer bölümlerinde bahsedilen risklere ek bir risk gösterilememiştir.
NUMETA PED G16%E ile (iki ya da üç odacığının içeriğiyle) yapılan herhangi bir hayvan çalışması bulunmamaktadır.
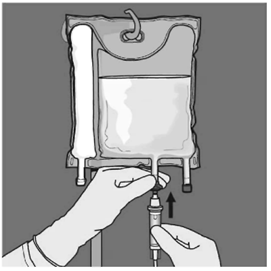
Basamak: Uygulama ucundaki koruyucu kapak çıkarılarak intravenöz uygulama seti buraya yerleştirilir.
Basamak: İçeriğin tümüyle karışmasını sağlamak için torba en az üç defa alt-üst edilmelidir. Karışımın görüntüsü berrak, renksiz ya da hafifçe sarı renkte olmalıdır.
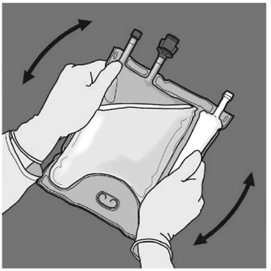
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Lipid emülsiyonu odacığı
Enjeksiyonluk yumurta fosfolipidleri (tavuk kaynaklı) Gliserol
Sodyum oleat
Sodyum hidroksit (pH ayarı için) Enjeksiyonluk su
Amino asit çözeltisi odacığı L-Malik asit (pH ayarı için) Enjeksiyonluk su
Glukoz çözeltisi odacığı Hidroklorik asit (pH ayarı için) Enjeksiyonluk su
6.2. Geçimsizlikler
için ayrıca Bölüm 6.2'ye bakınız.6.2. Geçimsizlikler
için ayrıca Bölüm 6.2'ye bakınız.
Herhangi bir parenteral beslenme karışımında olduğu gibi kalsiyum ve fosfatın oranı dikkate alınmalıdır. Aşırı kalsiyum ve fosfat eklemek, özellikle de bunların mineral tuzları kalsiyum fosfat şeklinde çökelmelere neden olabilir.
Diğer kalsiyum içeren infüzyon çözeltileri için, NUMETA PED G16%E ile seftriaksonun eş zamanlı tedavisi yenidoğanlarda (28 günlükten az), ayrı infüzyon yolları kullanılsa bile kontrendikedir (yenidoğanın kan dolaşımında seftriakson-kalsiyum tuzu çökelmesi riski, bkz. Bölüm 4.5).
Her yaştaki hastada, farklı infüzyon yolları veya farklı infüzyon bölgeleri kullanılsa bile, seftriakson-kalsiyum tuzu şeklinde çökme riskinden dolayı, seftriakson, NUMETA PED G16%E de dahil olmak üzere, herhangi bir intravenöz kalsiyum içeren çözelti ile karıştırılmamalı veya eş zamanlı olarak kullanılmamalıdır.
Çökelme riskinden dolayı, NUMETA PED G16%E ampisilin, fosfenitoin veya furosemid ile aynı infüzyon yoluyla uygulanmamalıdır.
NUMETA PED G16%E eş zamanlı olarak kanla birlikte aynı infüzyon setinden uygulanmamalıdır (Bkz. Bölüm 4.5).
NUMETA PED G16%E, sitrat-antikoagüle/korunmuş kanda veya bileşenlerinde çökelmiş ek koagülasyon riski oluşturan kalsiyum iyonları içerir.
6.3. Raf ömrü
18 ay.
Yeni doğanlarda ve iki yaşın altındaki çocuklarda kullanıldığında, çözelti (torbada ve uygulama setinde) uygulama tamamlanana kadar ışık maruziyetinden korunmalıdır (bkz. Bölüm 4.4, Bölüm 6.3 ve Bölüm 6.6.).
Rekonstitüsyon sonrası raf ömrü
İki ya da üç odacık arası separatörler açılarak karışım gerçekleştirildikten sonra, mümkün olan en kısa süre içinde kullanılması önerilmektedir. Bununla birlikte odacıklar arası separatörler açılarak karıştırıldıktan sonra, 2°C ila 8°C arasında 7 gün ve ardından 30°C'de 48 saat süreyle stabilitesini koruduğu gösterilmiştir.
İlaç eklemeleri (elektrolitler, eser elementler, vitaminler, su) yapıldıktan sonraki raf ömrü Spesifik karışımlar için, ilaç eklendikten sonra yapılan stabilite çalışmalarında 2°C ila 8°C arasında 7 gün ve ardından 30°C'de 48 saat süreyle stabilitesini koruduğu gösterilmiştir.
Mikrobiyolojik açıdan, ürünün hemen kullanılması önerilir. Hemen kullanılmadığı durumda, ilaç eklendikten sonraki kullanım öncesi saklama süresi ve koşulları uygulayıcının sorumluluğundadır ve rekonstitüsyon/seyreltme/ilaç eklemeleri kontrollü ve validasyonu aseptik koşullarda yapılmamışsa, ürün 2-8°C'de 24 saatten fazla bekletilmemelidir. Lütfen aynı zamanda Bölüm 4.2 ve Bölüm 6.6'ya bakınız.
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklanmalıdır. Dondurulmamalıdır. Koruyucu dış ambalajı içinde saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Üç odacıklı PVC olmayan torba aşağıdaki bileşenlerden oluşur:
Çok katlı bir plastik tabaka.
Lipid emülsiyon içeren odacığa iliştirilmiş kör bir uç. Bu odacığa ekleme yapılmasını engellemek için odacığın doldurulmasını takiben bu uç kapatılmıştır.
Amino asit ve glukoz çözeltisi içeren odacıklara iliştirilmiş iki uç.
Glukoz içeren odacığın ucunu kapatan bir enjeksiyon ucu.
Amino asit odacığının ucunu kapatan bir uygulama ucu.
Hiçbir bileşen doğal lateks plastiği içermez.
Hava ile temasını engellemek için torba oksijen geçirmeyen bir dış torbayla kaplıdır. Dış torba ile çok katlı torba arasında oksijen absorbanı içeren bir saşe bulunmaktadır ve oksijen indikatörü de içerir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tek kullanımlıktır.
Hasarlı torbalar kullanılmamalıdır. Torbanın ve geçici separatörlerin sağlamlığı kontrol edilmelidir. Amino asit ile glukoz çözeltileri berrak, renksiz ya da hafif sarı renkteyse, partikül içermiyorsa ve emülsiyon homojen süt görünümündeyse kullanılmalıdır.
Dış torbayı açmadan önce oksijen indikatörünün rengi kontrol edilmelidir. Bu renk "OK" sembolünün yanında basılı ve indikatör etiketinin baskılı bölümünde gösterilmiş olan renkle karşılaştırılmalıdır. Oksijen indikatörünün rengi, "OK" sembolünün yanında basılı olan referans renkle aynı değilse ürün kullanılmamalıdır.
İlaç eklemeleri
Yenidoğanlarda ve 2 yaşın altındaki çocuklarda kullanıldığında uygulama tamamlanana kadar ortam ışığından korunmalıdır. Numeta G16%E'nin özellikle eser elementler ve /veya vitaminlerle karıştırıldıktan sonra ortam ışığına maruz kalması, ışığa maruz kalmaktan korunarak azaltılabilen peroksitler ve diğer bozunma ürünleri üretir (bkz. bölüm 4.2, 4.4 ve 6.3)
Uygun eklemeler rekonstitüsyonu yapılan ürüne enjeksiyon bölgesinden yapılabilir (geçici separatörler ayrılarak iki ya da üç odacıktaki içeriğin karışımı gerçekleştirildikten sonra).
Vitamin eklemeler, karışım gerçekleştirilmeden önce (geçici separatörler ayrılarak 3 odacıktaki içeriğin karışımı gerçekleştirilmeden önce) glukoz çözeltisi içeren odacığın içine de yapılabilir.
Tanımlanmış miktarlarda eklenme ihtimali olan, ticari olarak mevcut eser element çözeltileri (TE1, TE2 ve TE4 olarak tanımlanmıştır), vitaminler (liyofilizat V1 ve emülsiyon V2 olarak tanımlanmıştır) ve elektrolitler Tablo 1-6'da sunulmuştur.
TE4, V1 ve V2 ile geçimlilik
Tablo 1: Su ile seyreltme ile veya seyreltme olmadan üçü bir arada (Aktive 3 odacıklı torba) geçimliliği
Her bir 500 mL için (lipidler ile 3 odacık karışımı) | ||||||
| Seyreltme olmadan karışım | Seyreltme ile karışım | ||||
Eklentiler | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye |
Sodyum (mmol) | 12 | 25,6 | 37,6 | 12 | 25,6 | 37,6 |
Potasyum (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 26,2 | 37,6 |
Magnezyum (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 3,6 | 5,2 |
Kalsiyum (mmol) | 3,1 | 16,4 | 19,5 | 3,1 | 8,2 | 11,3 |
Fosfat* (mmol) | 4,4 | 6,9 | 11,3 | 4,4 | 6,9 | 11,3 |
Eser elementler & vitaminler | - | 10 mL TE4 + 1 flakon V1 + 30 mL V2 | 10 mL TE4 + 1 flakon V1 + 30 mL V2 | - | 5 mL TE4 + ½ flakon V1 + 5 mL V2 | 5 mL TE4 + ½ flakon V1 + 5 mL V2 |
Enjeksiyonluk su | - | - | - | - | 350 mL | 350 mL |
Organik fosfat
Tablo 2: Su ile seyreltme ile veya seyreltme olmadan ikisi bir arada (Aktive 2 odacıklı torba) geçimliliği
Her bir 376 mL için (lipidler olmadan 2 odacık karışımı) | ||||||
| Seyreltme olmadan karışım | Seyreltme ile karışım | ||||
Eklentiler | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye |
Sodyum (mmol) | 11,6 | 26 | 37,6 | 11,6 | 0 | 11,6 |
Potasyum (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0 | 11,4 |
Magnezyum (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0 | 1,6 |
Kalsiyum (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0 | 3,1 |
Fosfat* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0 | 3,2 |
Eser elementler & vitaminler | - | 5mL TE4 + ½ flakon V1 | 5mL TE4 + ½ flakon V1 | - | 5mL TE4 + ½ flakon V1 | 5mL TE4 + ½ flakon V1 |
Enjeksiyonluk su | - | - | - | - | 450 mL | 450 mL |
Basamak: Uygulama ucundaki koruyucu kapak çıkarılarak intravenöz uygulama seti buraya yerleştirilmelidir.
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Ürünlerin Kontrolü†yönetmeliği ve “Ambalaj ve Ambalaj Atıklarının Kontrolü†yönetmeliğine uygun olarak imha edilmelidir.
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Baxter Turkey Renal Hizmetler A.Ş.
| Satış Fiyatı | 3718.79 TL [ 13 Oct 2025 ] |
| Önceki Satış Fiyatı | 3718.79 TL [ 6 Oct 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681413881107 |
| Etkin Madde | Amino Asit + Elektrolit + Lipid + Karbonhidrat |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |