NUMETA PED G16 %E infüzyonluk emülsiyon 500 ml { Baxter Renal } Farmasötik Özellikler
{ Amino Asit + Elektrolit + Lipid + Karbonhidrat }
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Lipid emülsiyonu odacığı
Enjeksiyonluk yumurta fosfolipidleri (tavuk kaynaklı) Gliserol
Sodyum oleat
Sodyum hidroksit (pH ayarı için) Enjeksiyonluk su
Amino asit çözeltisi odacığı L-Malik asit (pH ayarı için) Enjeksiyonluk su
Glukoz çözeltisi odacığı Hidroklorik asit (pH ayarı için) Enjeksiyonluk su
6.2. Geçimsizlikler
için ayrıca Bölüm 6.2'ye bakınız.6.2. Geçimsizlikler
için ayrıca Bölüm 6.2'ye bakınız.
Herhangi bir parenteral beslenme karışımında olduğu gibi kalsiyum ve fosfatın oranı dikkate alınmalıdır. Aşırı kalsiyum ve fosfat eklemek, özellikle de bunların mineral tuzları kalsiyum fosfat şeklinde çökelmelere neden olabilir.
Diğer kalsiyum içeren infüzyon çözeltileri için, NUMETA PED G16%E ile seftriaksonun eş zamanlı tedavisi yenidoğanlarda (28 günlükten az), ayrı infüzyon yolları kullanılsa bile kontrendikedir (yenidoğanın kan dolaşımında seftriakson-kalsiyum tuzu çökelmesi riski, bkz. Bölüm 4.5).
Her yaştaki hastada, farklı infüzyon yolları veya farklı infüzyon bölgeleri kullanılsa bile, seftriakson-kalsiyum tuzu şeklinde çökme riskinden dolayı, seftriakson, NUMETA PED G16%E de dahil olmak üzere, herhangi bir intravenöz kalsiyum içeren çözelti ile karıştırılmamalı veya eş zamanlı olarak kullanılmamalıdır.
Çökelme riskinden dolayı, NUMETA PED G16%E ampisilin, fosfenitoin veya furosemid ile aynı infüzyon yoluyla uygulanmamalıdır.
NUMETA PED G16%E eş zamanlı olarak kanla birlikte aynı infüzyon setinden uygulanmamalıdır (Bkz. Bölüm 4.5).
NUMETA PED G16%E, sitrat-antikoagüle/korunmuş kanda veya bileşenlerinde çökelmiş ek koagülasyon riski oluşturan kalsiyum iyonları içerir.
6.3. Raf ömrü
18 ay.
Yeni doğanlarda ve iki yaşın altındaki çocuklarda kullanıldığında, çözelti (torbada ve uygulama setinde) uygulama tamamlanana kadar ışık maruziyetinden korunmalıdır (bkz. Bölüm 4.4, Bölüm 6.3 ve Bölüm 6.6.).
Rekonstitüsyon sonrası raf ömrü
İki ya da üç odacık arası separatörler açılarak karışım gerçekleştirildikten sonra, mümkün olan en kısa süre içinde kullanılması önerilmektedir. Bununla birlikte odacıklar arası separatörler açılarak karıştırıldıktan sonra, 2°C ila 8°C arasında 7 gün ve ardından 30°C'de 48 saat süreyle stabilitesini koruduğu gösterilmiştir.
İlaç eklemeleri (elektrolitler, eser elementler, vitaminler, su) yapıldıktan sonraki raf ömrü Spesifik karışımlar için, ilaç eklendikten sonra yapılan stabilite çalışmalarında 2°C ila 8°C arasında 7 gün ve ardından 30°C'de 48 saat süreyle stabilitesini koruduğu gösterilmiştir.
Mikrobiyolojik açıdan, ürünün hemen kullanılması önerilir. Hemen kullanılmadığı durumda, ilaç eklendikten sonraki kullanım öncesi saklama süresi ve koşulları uygulayıcının sorumluluğundadır ve rekonstitüsyon/seyreltme/ilaç eklemeleri kontrollü ve validasyonu aseptik koşullarda yapılmamışsa, ürün 2-8°C'de 24 saatten fazla bekletilmemelidir. Lütfen aynı zamanda Bölüm 4.2 ve Bölüm 6.6'ya bakınız.
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklanmalıdır. Dondurulmamalıdır. Koruyucu dış ambalajı içinde saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Üç odacıklı PVC olmayan torba aşağıdaki bileşenlerden oluşur:
Çok katlı bir plastik tabaka.
Lipid emülsiyon içeren odacığa iliştirilmiş kör bir uç. Bu odacığa ekleme yapılmasını engellemek için odacığın doldurulmasını takiben bu uç kapatılmıştır.
Amino asit ve glukoz çözeltisi içeren odacıklara iliştirilmiş iki uç.
Glukoz içeren odacığın ucunu kapatan bir enjeksiyon ucu.
Amino asit odacığının ucunu kapatan bir uygulama ucu.
Hiçbir bileşen doğal lateks plastiği içermez.
Hava ile temasını engellemek için torba oksijen geçirmeyen bir dış torbayla kaplıdır. Dış torba ile çok katlı torba arasında oksijen absorbanı içeren bir saşe bulunmaktadır ve oksijen indikatörü de içerir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tek kullanımlıktır.
Hasarlı torbalar kullanılmamalıdır. Torbanın ve geçici separatörlerin sağlamlığı kontrol edilmelidir. Amino asit ile glukoz çözeltileri berrak, renksiz ya da hafif sarı renkteyse, partikül içermiyorsa ve emülsiyon homojen süt görünümündeyse kullanılmalıdır.
Dış torbayı açmadan önce oksijen indikatörünün rengi kontrol edilmelidir. Bu renk "OK" sembolünün yanında basılı ve indikatör etiketinin baskılı bölümünde gösterilmiş olan renkle karşılaştırılmalıdır. Oksijen indikatörünün rengi, "OK" sembolünün yanında basılı olan referans renkle aynı değilse ürün kullanılmamalıdır.
İlaç eklemeleri
Yenidoğanlarda ve 2 yaşın altındaki çocuklarda kullanıldığında uygulama tamamlanana kadar ortam ışığından korunmalıdır. Numeta G16%E'nin özellikle eser elementler ve /veya vitaminlerle karıştırıldıktan sonra ortam ışığına maruz kalması, ışığa maruz kalmaktan korunarak azaltılabilen peroksitler ve diğer bozunma ürünleri üretir (bkz. bölüm 4.2, 4.4 ve 6.3)
Uygun eklemeler rekonstitüsyonu yapılan ürüne enjeksiyon bölgesinden yapılabilir (geçici separatörler ayrılarak iki ya da üç odacıktaki içeriğin karışımı gerçekleştirildikten sonra).
Vitamin eklemeler, karışım gerçekleştirilmeden önce (geçici separatörler ayrılarak 3 odacıktaki içeriğin karışımı gerçekleştirilmeden önce) glukoz çözeltisi içeren odacığın içine de yapılabilir.
Tanımlanmış miktarlarda eklenme ihtimali olan, ticari olarak mevcut eser element çözeltileri (TE1, TE2 ve TE4 olarak tanımlanmıştır), vitaminler (liyofilizat V1 ve emülsiyon V2 olarak tanımlanmıştır) ve elektrolitler Tablo 1-6'da sunulmuştur.
TE4, V1 ve V2 ile geçimlilik
Tablo 1: Su ile seyreltme ile veya seyreltme olmadan üçü bir arada (Aktive 3 odacıklı torba) geçimliliği
Her bir 500 mL için (lipidler ile 3 odacık karışımı) | ||||||
| Seyreltme olmadan karışım | Seyreltme ile karışım | ||||
Eklentiler | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye |
Sodyum (mmol) | 12 | 25,6 | 37,6 | 12 | 25,6 | 37,6 |
Potasyum (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 26,2 | 37,6 |
Magnezyum (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 3,6 | 5,2 |
Kalsiyum (mmol) | 3,1 | 16,4 | 19,5 | 3,1 | 8,2 | 11,3 |
Fosfat* (mmol) | 4,4 | 6,9 | 11,3 | 4,4 | 6,9 | 11,3 |
Eser elementler & vitaminler | - | 10 mL TE4 + 1 flakon V1 + 30 mL V2 | 10 mL TE4 + 1 flakon V1 + 30 mL V2 | - | 5 mL TE4 + ½ flakon V1 + 5 mL V2 | 5 mL TE4 + ½ flakon V1 + 5 mL V2 |
Enjeksiyonluk su | - | - | - | - | 350 mL | 350 mL |
Organik fosfat
Tablo 2: Su ile seyreltme ile veya seyreltme olmadan ikisi bir arada (Aktive 2 odacıklı torba) geçimliliği
Her bir 376 mL için (lipidler olmadan 2 odacık karışımı) | ||||||
| Seyreltme olmadan karışım | Seyreltme ile karışım | ||||
Eklentiler | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye |
Sodyum (mmol) | 11,6 | 26 | 37,6 | 11,6 | 0 | 11,6 |
Potasyum (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0 | 11,4 |
Magnezyum (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0 | 1,6 |
Kalsiyum (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0 | 3,1 |
Fosfat* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0 | 3,2 |
Eser elementler & vitaminler | - | 5mL TE4 + ½ flakon V1 | 5mL TE4 + ½ flakon V1 | - | 5mL TE4 + ½ flakon V1 | 5mL TE4 + ½ flakon V1 |
Enjeksiyonluk su | - | - | - | - | 450 mL | 450 mL |
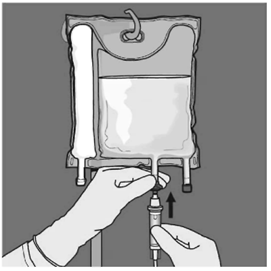
Basamak: Uygulama ucundaki koruyucu kapak çıkarılarak intravenöz uygulama seti buraya yerleştirilmelidir.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Ürünlerin Kontrolüâ yönetmeliği ve âAmbalaj ve Ambalaj Atıklarının Kontrolüâ yönetmeliğine uygun olarak imha edilmelidir.
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AMINOMIX | 8699630697579 | |
| CLINIMIX | 8699556696809 | |
| EVILO | 8699606887478 | |
| glükoz-1100 | 8699788695366 | |
| KABIVEN | 8699630697234 | |
| Diğer Eşdeğer İlaçlar |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
İLAÇ GENEL BİLGİLERİ
Baxter Turkey Renal Hizmetler A.Ş.
| Satış Fiyatı | 3718.79 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 3718.79 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681413881107 |
| Etkin Madde | Amino Asit + Elektrolit + Lipid + Karbonhidrat |
| ATC Kodu | B05BA10 |
| Birim Miktar | 500 |
| Birim Cinsi | ML |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > Damar İçine Enjekte Edilenler > Beslenme Serumu Kombinasyonları |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |