OCREVUS 300 mg/ 10ml infüzyonluk çözelti hazırlamak için konsantre (1 flakon) Saklanması
{ Okrelizumab }
Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar Roche Müstahzarları Sanayi A.Ş. | Güncelleme : 20 March 2018OCREVUS'un saklanması
OCREVUS sağlık uzmanları tarafından hastanede veya klinikte aşağıdaki koşullarda saklanacaktır:
Bu ilacı çocukların göremeyeceği ve erişemeyeceği bir yerde saklayınız.
Bu ilacı karton kutusunda ve flakon etiketinde belirtilen son kullanma tarihi geçtikten sonra kullanmayınız.
Buzdolabında saklayınız (2°C - 8°C). Dondurmayınız. Işıktan korumak için flakonları karton kutusunda saklayınız.
OCREVUS size uygulanmadan önce seyreltilmelidir. Seyreltme işlemi bir sağlık uzmanı tarafından gerçekleştirilecektir. Mikrobiyolojik açıdan, hazırlanan infüzyon hemen kullanılmalıdır. Hemen kullanılmazsa, kullanım sırasındaki saklama süreleri ve kullanım öncesi koşullar sağlık uzmanının sorumluluğundadır ve seyreltme işlemi kontrol altında ve valide edilmiş aseptik koşullarda yapılmadığı takdirde, bu süre normalde 2°C - 8°C'de 24 saatten, oda sıcaklığında 8 saatten daha uzun olmamalıdır.
OCREVUS ile polivinil klorür (PVC) veya polyolefin (PO) poşetler ve intravenöz uygulama setleri arasında uyumsuzluk gözlenmemiştir.
İlaçları atık suyla atmayınız. Bu önlem, çevrenin korunmasına yardımcı olacaktır.
Son kullanma tarihiyle uyumlu olarak kullanınız.
Ambalajdaki son kullanma tarihinden sonra OCREVUS'u kullanmayınız.
Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre, Şehircilik ve
İklim Değişikliği Bakanlığınca belirlenen toplama sistemine veriniz.
Eğer üründe ve/veya ambalajında bozukluklar fark ederseniz OCREVUS'u kullanmayınız.
Ruhsat Sahibi:
Roche Müstahzarları Sanayi A.Ş.
Uniq İstanbul, Ayazağa Cad. No:4, D/101 34396 Maslak, Sarıyer – İstanbul
Üretici:
Roche Diagnostics GmbH Sandhofer Strasse 116, 68305 Mannheim, Almanya
Bu kullanma talimatı .../.../... tarihinde onaylanmıştır.
AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR
Ayrıntılı bilgi için, Kısa Ürün Bilgisi'ni (KÜB) okuyunuz.
Biyolojik tıbbi ürünlerin izlenebilirliğini artırmak için, uygulanan ürünün ticari adı ve seri numarası net bir şekilde hasta dosyasına kaydedilmelidir.
Pozoloji
Başlangıç dozu
600 mg başlangıç dozu, iki ayrı intravenöz infüzyon olarak uygulanır; ilk 300 mg infüzyonu 2 hafta sonra ikinci 300 mg infüzyon takip eder.
Sonraki dozlar
Sonraki ocrelizumab dozları 6 ayda bir tek bir 600 mg intravenöz infüzyon olarak uygulanır (bkz. Tablo 1). İkinci doz birinci başlangıç dozu infüzyonundan 6 ay sonra uygulanmalıdır.
Her ocrelizumab dozunun arasında minimum 5 aylık ara olmalıdır.
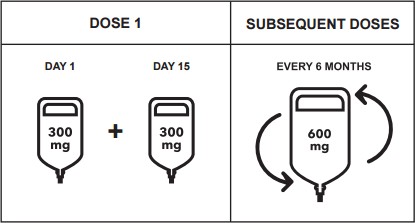
SONRAKİ DOZLAR
DOZ 1
HER 6 AYDA 1
GÜN 15
GÜN 1
Tablo 1: OCREVUS Dozu ve Uygulama Planı
İnfüzyondan önce İnfüzyonla İlişkili Reaksiyonların (İİR) yönetimi
Tedavi, ciddi infüzyonla ilişkili reaksiyonlar (İİR), aşırı duyarlılık reaksiyonları ve/yada anafilaktik reaksiyonları gibi şiddetli advers olayları idare etmek için gerekli medikal donanıma sahip deneyimli bir sağlık uzmanı tarafından başlatılmalı ve denetlenmelidir.
İİR'ler için premedikasyon
Ocrelizumab infüzyonundan önce İİR'lerin sıklığını ve şiddetini azaltmak üzere aşağıdaki iki premedikasyon uygulanmalıdır:
Her bir infüzyondan yaklaşık 30 dakika önce 100 mg intravenöz metilprednizolon (veya eşdeğeri);
Her bir infüzyondan yaklaşık 30-60 dakika önce antihistaminik bir ilaç (ör: difenhidramin);
Ayrıca, her bir infüzyondan yaklaşık 30-60 dakika önce bir ateş düşürücü (ör:parasetamol) ile ön ilaç uygulaması düşünülebilir.
İnfüzyonlar sırasında bir İİR semptomu olarak hipotansiyon görülebilir. Bu nedenle her bir OCREVUS infüzyonundan 12 saat önce ve infüzyon boyunca antihipertansif tedavilerin
kesilmesi düşünülmelidir. Konjestif kalp yetmezliği öyküsü (New York Kalp Birliği III ve IV) olan hastalar araştırılmamıştır.
Seyreltme talimatları
Ürün, bir sağlık uzmanı tarafından aseptik teknik kullanılarak hazırlanmalıdır.
Flakonu çalkalamayınız.
Seyreltilmiş infüzyon çözeltisini hazırlamak için steril bir iğne ve şırınga kullanılmalıdır.
Ürün koruyucu madde içermez ve sadece tek kullanım içindir.
Konsantre, gelişmiş opalesansla ilişkili ince yarı saydam ve/veya yansıtıcı partiküller içerebilir. Rengi bozulmuşsa veya ayrık yabancı partikül madde içeriyorsa, konsantreyi kullanmayınız.
Tıbbi ürün uygulama öncesinde seyreltilmelidir. İntravenöz uygulama için çözeltiler, ilaç ürününün izotonik 9 mg/mL (%0,9) sodyum klorür enjeksiyon için çözelti (300 mg/250 mL veya 600 mg/500 mL) içeren bir infüzyon torbasında seyreltilerek yaklaşık 1,2 mg/mL nihai ocrelizumab konsantrasyonu elde edilmesiyle hazırlanır.
Seyreltilmiş çözelti, 0,2 veya 0,22 mikron hat içi filtreli bir infüzyon seti kullanılarak uygulanmalıdır.
İntravenöz infüzyon başlatılmadan önce, düşük sıcaklıklarda çözeltinin uygulanmasından kaynaklanabilecek bir infüzyon reaksiyonunu önlemek için infüzyon torbasının içeriği oda sıcaklığında olmalıdır.
Uygulama yöntemi
Seyreltme sonrasında, tedavi özel bir boruyla intravenöz infüzyon olarak uygulanır.
İnfüzyonlar, intravenöz puşe veya bolus olarak uygulanmamalıdır.
Tablo 1. Doz ve plan
| Uygulanacak ocrelizumab Miktarı* | İnfüzyon talimatı | |
İlk doz (600 mg) İki infüzyona bölünmüş | İnfüzyon 1 | 250 mL'de 300 mg |
dakikada 30 mL/sa hızında |
|
|
| başlanmalıdır |
|
|
|
|
|
|
| 30 dakikada bir 30 |
|
|
| mL/sa. artırarak |
|
|
| maksimum 180 |
|
|
| mL/saat'e |
| İnfüzyon 2 (2 hafta sonra) | 250 mL'de 300 mg | çıkartılmalıdır
|
Sonraki dozlar (600 mg) tek infüzyon 6 ayda bir |
Seçenek 1
İnfüzyon süresi yaklaşık 3.5 saat | 500 mL'de 600 mg |
dakikada 40 mL/sa hızında başlanmalıdır |
|
|
|
|
|
|
| 30 dakikada bir 40 |
|
|
| mL/sa. artırarak |
|
|
| maksimum 200 |
|
|
| mL/saat'e |
|
|
| çıkartılmalıdır |
|
|
|
|
|
|
| yaklaşık 3,5 saat |
|
|
| boyunca |
|
|
| uygulanmalıdır |
| Veya | ||
| Seçenek 2
İnfüzyon süresi yaklaşık 2 saat | 500 mL'de 600 mg |
|
İnfüzyon sırasında ve sonrasında İİR'lerin yönetimi
Hastalar infüzyon sırasında ve infüzyon tamamlandıktan sonra en az bir saat boyunca izlenmelidir.
Tedavi Sırasındaki İnfüzyon Ayarlamaları
OCREVUS için doz azaltımı önerilmez.
Yaşamı tehdit edici İİR'ler
İnfüzyon sırasında, akut hipersensitivite veya akut solunum güçlüğü sendromu gibi yaşamı tehdit edici veya sakat bırakan bir İİR'nin belirtileri varsa, OCREVUS tedavisini derhal durdurunuz. Hasta uygun şekilde tedavi görmelidir. Bu hastalarda infüzyon kalıcı olarak kesilmelidir.
Şiddetli İİR'ler
Hasta şiddetli bir İİR veya kızarma, ateş ve boğaz ağrısı semptomlarının kompleksini yaşarsa, infüzyon hemen kesilmeli ve hasta uygun tedavi almalıdır. İnfüzyon ancak semptomlar düzeldikten sonra tekrar başlatılmalıdır. Hasta bir İİR yaşamadığı sürece ardışık yeni infüzyonlar için, infüzyonda herhangi bir ayarlama gerekmemektedir.
Hafif ila orta şiddette İİR'ler
Hasta hafif ila orta şiddette İİR (ör. baş ağrısı) yaşarsa, infüzyon oranı, olay başlangıcında verilen oranın yarısına azaltılmalıdır. Bu azaltılmış oran en az 30 dakika korunmalıdır. Tolere edilirse, infüzyon oranı hastanın başlangıç infüzyon planına göre artırılabilir. Hasta bir İİR yaşamadığı sürece ardışık yeni infüzyonlar için, infüzyonda herhangi bir ayarlama gerekmemektedir.
Bronkospazm veya astım alevlenmesi gibi şiddetli pulmoner semptomlar yaşayan hastalarda, infüzyon derhal ve kalıcı olarak durdurulmalıdır. Semptomatik tedavi uygulamasından sonra, klinik semptomlardaki ilk iyileşmeyi kötüleşme izleyebileceğinden hasta pulmoner semptomlar düzelene kadar izlenmelidir.
Aşırı duyarlılığın semptomlar açısından İİR'den ayırt edilmesi güç olabilir. İnfüzyon sırasında bir aşırı duyarlılık reaksiyonundan şüphe edilirse, infüzyon derhal ve kalıcı olarak durdurulmalıdır (bkz. ‘Aşırı Duyarlılık Reaksiyonları').
İnfüzyondan sonra:
Hastalar, infüzyon tamamlandıktan sonra en az bir saat herhangi bir İİR semptomu oluşma ihtimaline karşı gözlenmelidir.
Doktorlar hastalarını infüzyondan 24 saat sonra İİR oluşma ihtimaline karşı uyarmalıdır.
Raf ömrü
Açılmamış flakon 24 ay
Seyreltilmiş intravenöz infüzyonluk çözelti
Kullanım sırasındaki kimyasal ve fiziksel stabilitesi, 2-8°C'de 24 saat ve oda sıcaklığında 8 saat süreyle gösterilmiştir.
Mikrobiyolojik açıdan, hazırlanan infüzyon hemen kullanılmalıdır. Hemen kullanılmazsa, kullanım sırasındaki saklama süreleri ve kullanım öncesi koşullar kullanıcının sorumluluğudur ve seyreltme işlemi kontrol altında ve valide edilmiş aseptik koşullarda yapılmadığı takdirde, bu süre normalde 2-8°C'de 24 saati, oda sıcaklığında 8 saati geçmemelidir.
Bir intravenöz infüzyonun aynı gün tamamlanamaması durumunda, kalan çözelti atılmalıdır.
 Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
 Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
 Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
 Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
 Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | A16804 |
| Satış Fiyatı | 118602.86 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 118602.86 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505761978 |
| Etkin Madde | Okrelizumab |
| ATC Kodu | L04AA36 |
| Birim Miktar | 300 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ FİYATLARI
| Tarihi | İlaç Fiyatı |
|---|---|
| 24 Mar 2025 | 118,602.86 TL |
| 17 Mar 2025 | 118,602.86 TL |
| 7 Mar 2025 | 118,602.86 TL |
| 28 Feb 2025 | 118,602.86 TL |
| 21 Feb 2025 | 118,602.86 TL |
| 14 Feb 2025 | 118,602.86 TL |
| 7 Feb 2025 | 118,602.86 TL |
| 31 Jan 2025 | 118,602.86 TL |
| 2025 / 2008 İlaç Fiyatları |