OCREVUS 300 mg/ 10ml infüzyonluk çözelti hazırlamak için konsantre (1 flakon) Farmakolojik Özellikler
{ Okrelizumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ve İmmünomodülatör Ajanlar, İmmünosupresanlar, Selektif İmmünosupresanlar
ATC kodu: L04AA36
Etki mekanizması
Ocrelizumab, CD20 eksprese eden B hücrelerini seçici olarak hedefleyen bir rekombinant hümanize monoklonal antikordur.
CD20, ön-B hücreleri, olgun ve bellek B hücrelerinde bulunan ama lenfoid kök hücreleri ve plazma hücrelerinde eksprese edilmeyen bir hücre yüzeyi antijenidir.
Ocrelizumabın MS'te terapötik klinik etkilerini gösterdiği kesin mekanizmalar tam olarak açıklanmamıştır ama CD20 eksprese eden B hücrelerinin sayısı ve fonksiyonunda azalmayla immunomodülasyona neden olduğu varsayılır. Hücre yüzeyindeki bağlanmanın ardından, ocrelizumab, antikor bağımlı sellüler fagositoz (ADCP), antikor bağımlı sellüler sitotoksisite (ADCC), kompleman bağımlı sitotoksisite (CDC) ve apoptoz aracılığıyla CD20 eksprese eden B hücrelerini seçici olarak tüketir. B hücresi rekonstitüsyon kapasitesi ve önceden var olan humoral bağışıklık korunur. Ayrıca doğuştan bağışıklık ve toplam T hücresi sayıları etkilenmez.
Farmakodinamik etkiler
Ocrelizumab ile tedavi, beklenen bir farmakolojik etki olarak, tedaviden 14 gün sonra (değerlendirmenin ilk zaman noktası) kanda CD19+ B hücrelerinin hızlı tükenmesine yol açar. Bu, tedavi dönemi boyunca sürdürülmüştür. Ocrelizumabın varlığı miktar tayiniyle CD20'nin tanınmasını engellediği için, B hücre sayımları için CD19 kullanılır.
Faz III çalışmalarda, her ocrelizumab dozunun arasında, hastaların %5'ine kadarı en az bir zaman noktasında B hücresi deplesyonu (> normalin alt sınırı (NAS) veya başlangıç) sergilemiştir. B hücresi tükenmesinin derecesi ve süresi, PPMS ve RMS çalışmalarında tutarlı olmuştur.
Son Ocrelizumab infüzyonundan sonraki en uzun takip süresi (Faz II WA21493, N=51), B hücresi çoğalmasına kadar geçen medyan sürenin (hangisinin daha önce olduğuna bağlı olarak başlangıca veya LLN'ye geri dönmüştür) 72 hafta (27 - 175 haftalık aralık) olduğunu göstermektedir. Tüm hastaların yüzde doksanında, son infüzyondan yaklaşık iki buçuk yıl sonra B hücreleri LLN veya başlangıca göre çoğalmıştır.
Klinik etkililik ve güvenlilik
Ataklarla seyreden multipl skleroz formları (RMS)
Ocrelizumabın etkililiği ve güvenliliği, ataklarla seyreden MS formları olan hastalarda tasarımları aynı olan iki randomize, çift kör, çift plasebolu, aktif komparatör kontrollü klinik çalışmada (WA21092 ve WA21093) değerlendirilmiştir (2010 McDonald kriterlerine uygun olarak). Çalışma tasarımı ve çalışma popülasyonunun başlangıç özellikleri Tablo 3'te özetlenmektedir.
Demografi ve başlangıç özellikleri açısından her iki tedavi grubu iyi dengelenmiştir. Ocrelizumab alan hastalara (Grup A) 6 ayda bir 600 mg (1. Doz 2 hafta arayla 2 x 300 mg intravenöz infüzyonlar halinde) verilmiş ve sonraki dozlar tek bir 600 mg intravenöz infüzyon olarak uygulanmıştır. Grup B'deki hastalara haftada 3 kez subkütan (S.C.) enjeksiyonla İnterferon beta-1a 44 mcg verilmiştir.
Tablo 3 Çalışma Tasarımı ve Demografik Özellikler
| Çalışma 1 | Çalışma 2 | ||
Çalışma adı | WA21092 (OPERA I) (n=821) | WA21093 (OPERA II) | ||
Çalışma tasarımı | ||||
Çalışma popülasyonu | Ataklarla seyreden MS formları görülen hastalar | |||
Taramadaki hastalık öyküsü | İki yıl içinde en az iki relaps veya bir yıl içinde bir relaps; EDSS 0 ve 5,5 (5,5 dahil) arasında, | |||
Çalışma süresi | 2 yıl | |||
Tedavi grupları | Grup A: 600 mg ocrelizumab Grup B: 44 mcg SC interferon beta-1a (IFN) | |||
Başlangıçtaki özellikler | Ocrelizumab 600 mg (n=410) | IFN 44 mcg (n=411) | Ocrelizumab 600 mg (n=417) | IFN 44 mcg (n=418) |
Medyan yaş (yıl) | 37,1 | 36,9 | 37,2 | 37,4 |
Dahil edilen yaş aralığı (yıl) | 18-56 | 18-55 | 18-55 | 18-55 |
Cinsiyet dağılımı (%erkek/%kadın) | 34,1/65,9 | 33,8/66,2 | 35/65 | 33/67 |
Tanıdan bu yana geçen ortalama/medyan hastalık süresi (yıl) | 3,82/1,53 | 3,71/1,.57 | 4,15/2,1 | 4,13/1,84 |
Daha önce DMT almamış hastaların %'si** | 73,4 | 71 | 72,7 | 74,9 |
Geçen yıldaki ortalama relaps sayısı | 1,31 | 1,33 | 1,32 | 1,34 |
T1 lezyonunda Gd tutulumlu hastaların oranı | 42,5 | 38,1 | 39,0 | 41,4 |
Ortalama EDSS* | 2,82 | 2,71 | 2,73 | 2,79 |
* Genişletilmiş Yeti Yitimi Durumu Ölçeği
**Randomizasyondan önceki 2 sene içinde bir hastalık modifiye edici tedavi (DMT) ile tedavi edilmemiş hastalar
Temel klinik ve MRG etkililiği sonuçları Tablo 4 ve Şekil 1'de sunulmaktadır.
Bu çalışmaların sonuçları, interferon beta-1a 44mcg SC'ye kıyasla ocrelizumabın relapsları, MRG ile ölçülen klinik ve subklinik hastalık aktivitesi ve hastalık progresyonunu önemli ölçüde baskıladığını göstermektedir.
Tablo 4 WA21092 ve WA21093 Çalışmalarından Temel Klinik ve MRG Sonlanım Noktaları (RMS)
Sonlanım Noktaları | Çalışma 1: WA21092 (OPERA I) | Çalışma 2: WA21093 | |||
Ocrelizumab 600 mg (n=410) | IFN 44 mcg (n=411) | Ocrelizumab 600 mg (n=417) | IFN 44 mcg (n=418) | ||
Klinik Sonlanım Noktaları |
| ||||
Yıllık Relaps Oranı (primer sonlanım noktası) Rölatif Azalma | 0-156 | 0,292 | 0,155 | 0,290 | |
%46 (p<0,0001) | %47 (p<0,0001) | ||||
12 Haftalık Doğrulanmış Yeti Yitimi Progresyonu Görülen Hasta Oranı Riskte Azalma (Birleştirilmiş Analiz) Riskte Azalma (Ayrı Ayrı Çalışmalar) | %9,8 Ocrelizumab - %15,2 IFN %40 (p=0,0006) | ||||
%43 (p=0,0139) | %37 (p=0,0169) | ||||
24 Haftalık Doğrulanmış Yeti Yitimi Progresyonu Görülen Hasta Oranı (CDP) Riskte Azalma (Birleştirilmiş Analiz) Riskte Azalma (Ayrı Ayrı Çalışmalar) | %7,6 Ocrelizumab - %12,0 IFN %40 (p=0,0025) | ||||
%43 (p=0,0278) | %37 (p=0,0370) | ||||
En az 12 haftalık Doğrulanmış Yeti Yitimi İyileşmesi görülen hasta oranı(Birleştirilmiş) Rölatif Artış (Birleştirilmiş Analiz) Rölatif Artış (Ayrı Ayrı Çalışmalar) | %20,7 Ocrelizumab - %15,6 IFN | ||||
%33 (p=0,0194) | |||||
%61 (p=0,0106) | %14 (p=0,4019) | ||||
96 haftada relaps gözlenmeyen hastaların oranı | %80,4 | %66,7 | %78,9 | %64,3 | |
(p=0,0001) | (p<0,0001) | ||||
Hastalık Aktivitesi Kanıtı Görülmeyen (NEDA) Hasta Oranı Rölatif Artış | %48 | %29 | %48 | %25 | |
%64 (p<0,0001) | %89 (p<0,0001) | ||||
MRG Sonlanım Noktaları |
| ||||
MRG taraması başına ortalama Gd tutulumlu T1 lezyon sayısı Rölatif Azalma | 0,016 | 0,286 | 0,021 | 0,416 | |
%94 (p<0,0001) | %95 (p<0,0001) | ||||
MRG taraması başına yeni ve/veya büyüyen T2 hiperintens lezyonların ortalama sayısı Rölatif Azalma | 0,323 | 1,413 | 0,325 | 1,904 | |
%77 (p<0,0001) | %83 (p<0,0001) | ||||
|
|
|
|
| |
|
| ||||
24. hafta ila 96. hafta arasında beyin hacmindeki değişiklik oranı Beyin hacmi kaybında rölatif azalma | -0,572 | -0,741 | -0,638 | -0,750 | |
%22,8 (p=0,0042) | %14,9 (p=0,0900) | ||||
tahminleri
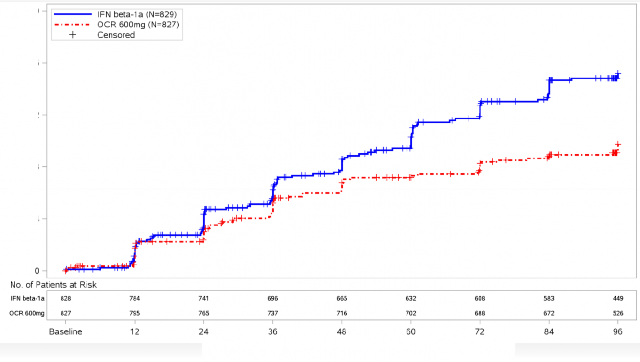
Şekil 1: En Az 12 Hafta Boyunca Sürdürülen Doğrulanmış Yeti Yitimi Progresyonunun Başlangıcına Kadar Geçen Süre ve Çift-Kör Tedavi Dönemi Boyunca Meydana Gelen İlk Nörolojik Kötüleşme Olayına İlişkin Kaplan-Meier Grafiği* (Birleştirilmiş ITT popülasyonu)*
*OPERA I ve II'nin önceden belirlenmiş birleştirilmiş analizi
En az 12 hafta sürdürülen CDP'ye kadar geçen sürenin önceden belirlenen havuzlanmış analizlerinin sonuçları (interferon beta-1a'ya kıyasla ocrelizumab için %40 risk azaltımı, (p=0,0006), en az 24 hafta sürdürülen sonuçlarla (interferon beta-1a'ya kıyasla ocrelizumab için %40 risk azaltımı, p=0,0025) son derece tutarlı olmuştur.
Çalışmalarda aktif hastalığı olan hastalar dahil edilmiştir. Bu hastalarda, klinik ve radyolojik açıdan aktif, tedavi naif ve önceki tedavilerine yetersiz cevap geliştirmiş hastalar dahildir. Çok aktif ve aktif hastalık durumu da dahil olmak üzere farklı başlangıç seviyelerinde hastalık aktiviteleri olan hasta popülasyonu analizleri, ocrelizumab etkililiğinin ARR'de ve CDP ile 12 haftada genel popülasyon ile aynı olduğunu ortaya koymuştur.
Primer progresif multipl skleroz (PPMS)
Ocrelizumabın etkililik ve güvenliliği ayrıca ana dahil etme kriterlerine (18-55 yaş (bu yaşlar dahil), taramada 3– 6,5 puan arası EDSS, MS semptomlarının ortaya çıkışından itibaren geçen hastalık süresi: taramadaki EDSS puanı ≤5olan hastalarda <10 yıl ve EDSS puanı <5olan hastalarda <15 yıl) göre hastalığın erken evresinde olan primer progresif MS'li hastalara yönelik randomize, çift-kör, plasebo-kontrollü bir çalışmada (Çalışma WA25046) değerlendirilmiştir. Hastalık aktivitesi bakımından, progresif MS'te dahi enflamatuvar etkinliğe özgü özellikler görüntülemeyle ilişkili olabilir (T1 Gd-kontrast tutan lezyonlar ve/veya aktif (yeni veya büyüyen) T2 lezyonları). Bütün hastalarda enflamatuvar etkinliği doğrulamak için MRG bulguları kullanılmalıdır. 55 yaşın üzerindeki hastalar incelenmemiştir. Çalışma tasarımı ve çalışma popülasyonunun başlangıç özellikleri Tablo 5'te sunulmuştur.
Demografik özellikler ve başlangıç özelliklerinin iki tedavi grubu arasında dengeli olduğu görülmüştür. Kraniyal MRG T1 Gd-kontrast tutan lezyonlar veya T2 lezyonları olarak enflamatuvar etkinliğe özgü görüntüleme özellikleri göstermiştir.
Faz III PPMS çalışması sırasında, hastalar her 6 ayda bir 600 mg ocrelizumab dozunu, iki hafta ara ile uygulanan 2 adet 300 mg'lık infüzyonlar şeklinde almıştır. RMS'de 600 mg infüzyonlar ve PPMS'de 300 mg x 2 infüzyonlar uyumluPK/PD profilleri göstermiştir. İnfüzyon başına İİR profilleri tek seferde 600 mg veya iki hafta arayla 300 mg doz uygulanmasından bağımsız olarak benzerdir (bkz. Bölüm 4.8 ve 5.2). Ancak 2x300 mg doz rejimi ile toplamdaki infüzyon sayısı daha yüksek olduğunda, toplam İİR sayısı daha yüksektir. Bu nedenle, Doz 1'den sonra toplam infüzyon sayısını düşürmek için (metilprednisolon ve antihistaminik ile eş zamanlı uygulanması sırasında) ocrelizumabın 600 mg'lık tek bir infüzyon olarak uygulanması tavsiye edilir (bkz. Bölüm 4.2).
Tablo 5 WA25046 Çalışmasının çalışma tasarımı, demografik ve başlangıç özellikleri
Çalışma adı | WA25046 Çalışması ORATORIO (n=732) | |
Çalışma tasarımı | ||
Çalışma popülasyonu | Primer progresif MS formu görülen hastalar | |
Çalışma süresi | Olaya dayalı (Minimum 120 hafta ve 253 doğrulanmış yeti yitimi progresyonu olayı) (Medyan takip süresi: Ocrelizumab 3 yıl, Plasebo 2,8 yıl | |
Taramadaki hastalık öyküsü | Yaş 18-55, EDSS 3 ila 6,5 | |
Tedavi grupları | Grup A: 600 mg Ocrelizumab Grup B: Plasebo, 2:1 randomizasyon | |
Başlangıçtaki özellikler | 600 mg Ocrelizumab (n=488) | Plasebo (n=244) |
Ortalama Yaş (yıl) | 44,7 | 44,4 |
Dahil edilen yaş aralığı | 20-56 | 18-56 |
Cinsiyet dağılımı (%erkek/%kadın) | 51,4/48,6 | 49,2/50,8 |
PPMS tanısından bu yana geçen ortalama/medyan hastalık süresi (yıl) | 2,9/1,6 | 2,8/1,3 |
Ortalama EDSS | 4,7 | 4,7 |
Temel klinik ve MRG etkililiği sonuçları Tablo 6 ve Şekil 2'de sunulmaktadır.
Bu çalışmanın sonuçları, ocrelizumabın plaseboya kıyasla hastalık progresyonunu önemli ölçüde geciktirdiğini ve yürüme hızındaki kötüleşmeyi azalttığını göstermektedir.
Tablo 6 WA25046 Çalışmasından (PPMS) Temel Klinik ve MRG Sonlanım Noktaları
| Çalışma 3 | |
Sonlanım Noktaları | WA25046 (ORATORIO) | |
Ocrelizumab 600 mg (n=488) | Plasebo (n=244) | |
Klinik Sonlanım Noktaları | ||
Primer etkililik sonlanım noktası 12 Haftalık Doğrulanmış Yeti Yitimi Progresyonu Görülen Hasta Oranı (primer sonlanım noktası) Riskte azalma | %30,2 | %34 |
%24 (p=0,0321) | ||
24 Haftalık Doğrulanmış Yeti Yitimi Progresyonu Görülen Hasta Oranı Riskte azalma | %28,3 | %32,7 |
%25 (p=0,0365) | ||
Başlangıca kıyasla 120. Haftada Süreli 25 Adım Yürüme Testindeki Değişiklik Oranı Yürüme süresindeki progresyon oranında rölatif azalma | 38,9 | 55,1 |
%29,4 (p=0,0404) | ||
MRG Sonlanım Noktaları | ||
Başlangıca kıyasla 120. Haftada T2 hiperintens lezyon hacmindeki değişiklik oranı | -3,4 | 7,4 |
(p< 0,0001) | ||
24. hafta ila 120. hafta arasında beyin hacmindeki değişiklik oranı Beyin hacmi kayıp oranında rölatif azalma | -0,902 | -1,093 |
%17,5 (p=0,0206) | ||
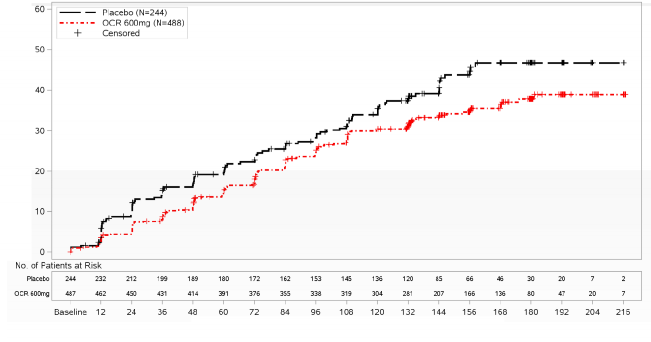
CDP riskinde %24 azalma HR (%95 GA): 0,76 (0,59,
0,98); p=0,0321
Şekil 2: Çift Kör Tedavi Döneminde Meydana Gelen İlk Nörolojik Kötüleşme Olayıyla En Az 12 Hafta Sürdürülen Doğrulanmış Sakatlık Progresyonunun Başlangıcına Kadar Geçen Sürenin Kaplan-Meier Grafiği (ITT Popülasyonu)*
* Bu analizdeki tüm hastalar en az 120 hafta boyunca takip edilmiştir. Birincil analiz değerlendirilen tüm olaylara dayanmaktadır.
Birincil sonlanım noktasına yönelik önceden tanımlanmış, yeterli güce sahip olmayan alt grup analizi, genç veya başlangıçta T1 Gd-kontrast tutan lezyonları olan hastaların yaşlı veya T1 Gd-kontrast tutan lezyonları olmayan hastalara kıyasla tedaviden daha fazla fayda sağladığını göstermektedir (≤ 45 yaş: HR 0,64 [0,45, 0,92], >45 yaş: HR 0,88 [0,62, 1,26]; başlangıçta T1 Gd-kontrast tutan lezyonları olan hastalar: HR 0,65 [0,4-1,06], T1 Gd-kontrast tutan lezyonları olmayan hastalar: HR 0,84 [0,62-1,13]).
Ayrıca, post-hoc analizler başlangıçta T1 Gd-kontrast tutan lezyonları olan genç hastalarda tedavinin daha iyi bir etki gösterdiğini ortaya koymuştur (≤ 45 yaş: HR 0,52 [0,27-1]; ≤ 46 yaş [WA25046 çalışmasındaki medyan yaş]; HR 0,48 [0,25-0,92]; <51 yaş: HR 0,53 [0,31-0,89]).
Açık Etiket Uzantısına (AEU) devam etmeden önce veya çalışma tedavisinden ayrılana kadar ek olarak yaklaşık 9 aylık kontrollü takip ve çift kör tedavi içeren Genişletilmiş Kontrollü Dönemde (GKD) post-hoc analizler gerçekleştirilmiştir. 24 haftalık Doğrulanmış Engellilik Progresyonunun (CDP) EDSS≥7 olan hastaların oranı (EDSS≥7'nin 24W-CDP'si, tekerlekli sandalyeye kadar geçen süre), tedavinin 144. haftasında plasebo grubunda %9,1 iken, ocrelizumab grubunda %4,8 olmuş ve bu oran GKD sırasında tekerlekli sandalyeye geçiş süresinin %47 risk azalmasına (HR 0,53, [0,31, 0,92]) neden olmuştur. Bu sonuçlar doğaları gereği keşif amaçlı olduğundan ve körleme kaldırıldıktan sonra veriler içerdiğinden, dikkatle yorumlanmalıdır.
Hızlandırılmış infüzyon çalışması
Hızlandırılmış (2 saatlik) ocrelizumab infüzyonunun güvenliliği, diğer hastalık modifiye edici tedavilere naif olan Ataklarla Seyreden Multipl Sklerozlu (RMS) hastalarda MA30143 (Ensemble) çalışmasının alt kolu olan prospektif, çok merkezli, randomize, çift kör, kontrollü,
paralel kollu bir çalışma ile değerlendirilmiştir. İlk doz 14 gün arayla iki 300 mg infüzyon (toplam 600 mg) olarak uygulanmıştır. Hastalar ikinci dozlarından sonra (Doz 2 ila 6) 1: 1 oranında ya ocrelizumabın 24 haftada bir uygulanan yaklaşık 3.5 saat boyunca infüze edilmiş konvansiyonel infüzyon grubuna ya da ocrelizumabın 24 haftada bir uygulanan yaklaşık 2 saat süren daha kısa infüzyon süresi grubuna randomize edilmiştir. Randomizasyon, bölgeye ve hastaların ilk randomize edildiği doza göre tabakalandırılmıştır.
Birincil sonlanım noktası, ilk randomize infüzyonu sırasında yada takip eden 24 saat içinde İİR meydana gelen hastaların oranıdır. Primer analiz 580 hasta randomize edildiğinde yapılmıştır. İlk randomize infüzyon sırasında yada takiben 24 saat içinde İİR meydana gelen hastaların oranı, hızlandırılmış infüzyonda % 24,6 iken, konvansiyonel infüzyon grubunda % 23,1 olmuştur. Tabakalı grup farkı benzerdir. Genel olarak, tüm randomize dozlarda, İİR'lerin çoğunluğu hafif veya orta düzeydeydi ve her iki grupta birer İİR olmak üzere sadece iki İİR şiddetli olmuştur. Hayatı tehdit eden, ölümcül veya ciddi İİR'lergörülmemiştir.
İmmunojenisite
MS çalışmalarındaki (WA21092, WA21093 ve WA25046) hastalar birçok zaman noktasında (başlangıç ve çalışma süresi boyunca tedavi sonrası 6 ayda bir) anti-ilaç antikorları (AİA'lar) açısından test edilmiştir. Ocrelizumab ile tedavi edilen 1311 hastadan 12'si (~%1) tedaviyle ortaya çıkan AİA'lar açısından pozitif sonuç vermiş, bunların 2'si nötralize edici antikorlar açısından pozitif sonuç vermiştir. Ocrelizumab ile ilişkili düşük AİA insidansı düşünülürse, tedaviyle ortaya çıkan AİA'ların güvenlilik ve etkililik üzerindeki etkisi değerlendirilemez.
İmmunizasyonlar
RMS hastalarında gerçekleştirilen açık etiketli, randomize bir çalışmada (N=102), aşı uygulamasından sonra 8. haftada tetanoz aşısına pozitif yanıt veren hastaların oranı, kontrol grubunda %54,5'e kıyasla ocrelizumab grubunda %23,9 olarak bulunmuştur (interferon-beta haricinde hastalığı modifiye edici herhangi bir tedavi mevcut değildir). 8. haftada anti-tetanoz toksoidine spesifik antikor titresi geometrik ortalaması sırasıyla 3,74 ve 9,81 IU/mL olarak tespit edilmiştir. Aşı uygulamasından sonra 4. haftada 23-PPV'de bulunan ≥5 serotipe verilen pozitif yanıt oranı, kontrol grubunda %100 ve ocrelizumab grubunda %71,6'dır. Ocrelizumab ile tedavi edilen hastalarda 23-PPV'den 4 hafta sonra uygulanan rapel aşısı (pekiştirme dozu/13-PCV), 23-PPV ile ortak 12 serotipe verilen yanıtı belirgin bir şekilde arttırmamıştır. Beş influenza suşuna karşı seroprotektif titreleri bulunan hastaların yüzdesi, ocrelizumab ile tedavi edilen hastalarda ve kontrol grubunda sırasıyla, aşılama öncesinde %20,0-60,0 ve %16,7-43,8 ve aşılamadan 4 hafta sonra %55,6-80,0 ve %75,0-97,0 aralıklarında
bulunmuştur. (bkz. Bölüm 4.4 ve 4.5)
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim:
Ocrelizumab intravenöz infüzyon olarak uygulanır. Diğer uygulama yollarıyla çalışma gerçekleştirilmemiştir.
Dağılım:
Merkezi dağıtım hacminin popülasyon farmakokinetiği tahmini 2,78 L olmuştur. Periferal hacim ve kompartmanlar arası klerens 2,68 L ve 0,294 L/gün olarak tahmin edilmiştir.
Biyotransformasyon:
Antikorlar ağırlıklı olarak katabolizmayla (ör: peptid ve amino asitlere yıkılma)
uzaklaştırıldığından, ocrelizumabın metabolizması üzerinde doğrudan çalışılmamıştır. Eliminasyon:
Sabit klerens 0,17 L/gün tahmin edilirken, başlangıçtaki zamana bağımlı klerens 0,0489 L/gün olarak tahmin edilmiş ve 33 haftalık yarı ömürle birlikte düşmüştür. Ocrelizumabın terminal eliminasyon yarı ömrü 26 gün olmuştur.
Doğrusallık/doğrusal olmayan durum:
MS çalışmalarında ocrelizumabın farmakokinetiği, zamana bağlı klerens ve bir IgG1 monoklonal antikor için tipik PK parametreleri sergileyen, iki bölümlü bir modelle açıklanmıştır.
Genel maruziyet (24 haftalık dozlama aralıklarında EAA), aynı dozun uygulandığı düşünülürse bekleneceği üzere, PPMS çalışmalarında 2 x 300 mg ve RMS çalışmalarında 1 x 600 mg'da aynı olmuştur. 600 mg ocrelizumabın 4. dozundan sonra eğri altı alan (EAA) 3510 mcg/mL•gün ve ortalama maksimum konsantrasyon (C) RMS'de (600 mg infüzyon) 212 mcg/mL, PPMS'de (300 mg infüzyonlar) 141 mcg/mL olmuştur.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
18 yaşının altındaki çocuklarda ocrelizumabın farmakokinetiğini araştırmak amacıyla çalışma yürütülmemiştir.
Geriyatrik popülasyon:
55 yaş ve üzerindeki hastalarda ocrelizumabın farmakokinetiğini araştırmak amacıyla çalışma yürütülmemiştir.
Böbrek yetmezliği :
Resmi farmakokinetik çalışma yürütülmemiştir. Hafif böbrek yetmezliği olan hastalar klinik çalışmalara dahil edilmiş ve bu hastalarda ocrelizumabın farmakokinetiğinde değişiklik gözlenmemiştir. Ciddi veya orta seviyede böbrek hasarı olan hastalara ait farmakokinetik veriler mevcut değildir.
Karaciğer yetmezliği :
Resmi farmakokinetik çalışma yürütülmemiştir. Hafif karaciğer yetmezliği olan hastalar klinik çalışmalara dahil edilmiş ve bu hastalarda OCREVUS'un farmakokinetiğinde değişiklik gözlenmemiştir. Ciddi veya orta seviyede karaciğer hasarı olan hastalara ait farmakokinetik veriler mevcut değildir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler; güvenlilik farmakolojisi, tekrarlı doz toksisitesi ve embriyo-fötal gelişime yönelik konvansiyonel çalışmalara dayalı olarak insanlar için özel bir risk olmadığını göstermektedir. Ocrelizumabla karsinojenisite veya mutajenisite çalışmaları yapılmamıştır.
Sinomolgus maymunları üzerinde gerçekleştirilen iki pre- ve post-natal gelişim çalışmalarında gestasyonun 20. gününden en azından doğumda kadar ocrelizumab uygulanması; glomerülopati, kemik iliğinde lenfoid folikül oluşumu, lenfoplazmasitik renal enflamasyon ve yavrunun testis ağırlığında azalmayla ilişkilendirilmiştir. Bu çalışmalarda uygulanan maternal dozlar, klinik ortamda beklenenden 4,5 ila 21 kat daha yüksek maksimum ortalama serum konsantrasyonlarına (C) neden olmuştur.
Çalışmada beş ölümcül vaka görülmüş (5/24) olup, biri prematüre doğum nedeniyle güçsüzlükle birlikte fırsatçı enfeksiyona, diğeri aktif enfeksiyonlu (mastit) bir anne hayvanın yavrusunun serebellumunu içeren bir enfektif meningoensefaliteye ve diğer üçü sarılık ve hepatik hasar kanıtı, şüphelenilen viral etiyoloji, muhtemelen bir poliomavirüse atfedilmiştir. Bu beş doğrulanmış veya şüphelenilen neonatal enfeksiyonun seyri B hücre tükenmesinden potansiyel olarak etkilenmiş olabilir. Ocrelizumab maruz kalmış anne hayvanların yenidoğan yavrularında post natal fazda B hücresi popülasyonlarının tükendiği fark edilmiştir. Emzirme döneminde sütte ölçülebilir ocrelizumab düzeyleri saptanmıştır (serum düzeylerinde kararlı durumun yaklaşık %0,2'si).
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | A16804 |
| Satış Fiyatı | 118602.86 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 118602.86 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505761978 |
| Etkin Madde | Okrelizumab |
| ATC Kodu | L04AA36 |
| Birim Miktar | 300 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Gıda Alerjisi Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |