OFEV 150 mg 60 yumuşak kapsül Kısa Ürün Bilgisi
{ Nintedanib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
OFEV 150 mg yumuşak kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir yumuşak kapsül 150 mg nintedanibe eşdeğer 180,6 mg nintedanib esilat (etansulfonat) içermektedir.
Yardımcı maddeler
Her bir yumuşak kapsül 1,8 mg soya lesitini içermektedir. Yardımcı maddelerin listesi için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Yumuşak kapsül.
Kahverengi, opak, oblong, bir yüzünde siyah Boehringer Ingelheim firma logosu ve "150" baskılı
yumuşak-jelatin kapsül.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
OFEV, yetişkinlerde, idiyopatik pulmoner fibrozis (İPF) tedavisinde endikedir.
OFEV ayrıca yetişkinlerde progresif fenotipli diğer kronik fibrozan interstisyel akciğer hastalıklarının (İAH) tedavisinde endikedir (bkz. Bölüm 5.1).
OFEV, yetişkinlerde sistemik skleroza bağlı interstisyel akciğer hastalığının (SSk-İAH) tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Tedavi, OFEV kullanımının onaylı olduğu hastalıkların yönetiminde deneyimli doktorlar tarafından başlatılmalıdır.
Önerilen OFEV dozu yaklaşık 12 saatlik aralarla günde iki kez 150 mg'dır. Günde iki kez 100 mg'lık doz, sadece günde iki kez 150 mg dozu tolere edemeyen hastalar için önerilir.
Eğer OFEV'in bir dozunun alınması unutulursa, bu doz atlanmalı ve bir sonraki planlanan zamanda ve önerilen dozla tedaviye devam edilmelidir. Eğer bir doz atlanırsa, hasta ek bir doz daha
almamalıdır. Önerilen maksimum günlük doz olan 300 mg aşılmamalıdır.
Doz ayarlamaları:
OFEV kullanımı ile ortaya çıkan advers reaksiyonların (bkz. Bölüm 4.4 ve 4.8) kontrol altına alınması için yapılabilecekler arasında, gerektiğinde uygulanacak semptomatik tedaviye ek olarak, advers reaksiyonun tedavinin devamına izin verecek derecede iyileşmesine kadarki süre boyunca, dozun azaltılması ve geçici olarak tedaviye ara verilmesi bulunur. OFEV tedavisine tam dozla (günde iki kez 150 mg) veya azaltılmış dozla (günde iki kez 100 mg) tekrar başlanabilir. Eğer hasta günde iki kez 100 mg dozu tolere edemezse, OFEV tedavisi sonlandırılmalıdır.
Uygun destekleyici tedavi (antiemetik tedavi dahil) yapılmasına rağmen diyare, bulantı ve/veya kusmanın devam etmesi halinde, dozun azaltılması veya tedaviye ara verilmesi gerekebilir. Tedavi azaltılmış dozla (günde iki kez 100 mg) veya tam dozla (günde iki kez 150 mg) tekrar başlanabilir. Semptomatik tedaviye rağmen devam eden inatçı, şiddetli diyare, bulantı ve/veya kusma söz konusu ise OFEV tedavisi kesilmelidir (bkz. Bölüm 4.4).
Aspartat aminotransferaz (AST) veya alanin aminotransferaz (ALT) değerlerinde >3x ânormalin üst sınırıâ yükselmeye bağlı olarak tedaviye ara verilmesi durumunda, transaminazlar başlangıç değerlerine döndüğünde OFEV tedavisi azaltılmış bir dozla (günde iki kez 100 mg) yeniden başlatılabilir. Doz daha sonra tam doza (günde iki kez 150 mg) arttırılabilir (bkz. Bölüm 4.4. ve 4.8).
Uygulama şekli:
OFEV oral kullanım içindir. Kapsüller yiyecekle birlikte alınmalı, su ile bütün halinde yutulmalıdır. Çiğnenmemeli veya ezilmemelidir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek yetmezliği:
Hafif- orta dereceli böbrek yetmezliği olan hastalarda başlangıç dozunun ayarlanması gerekli değildir. Nintedanibin güvenlilik, etkililik ve farmakokinetiği, şiddetli böbrek yetmezliği olan hastalarda (kreatin klerensi <30 ml/dk) çalışılmamıştır.
Karaciğer yetmezliği
Hafif karaciğer yetmezliği olan hastalarda (Child Pugh A), önerilen OFEV dozu, yaklaşık 12 saatlik aralarla günde iki kez 100 mg'dır. Hafif karaciğer yetmezliği olan hastalarda (Child Pugh A), advers reaksiyonların ortaya çıkması durumunda tedaviye ara verilmesi veya tamamen kesilmesi düşünülmelidir. Nintedanibin güvenlilik ve etkililiği, Child Pugh B ve C olarak sınıflandırılan karaciğer yetmezliği hastalarında araştırılmamıştır. Bu nedenle orta (Child Pugh B) ve şiddetli (Child Pugh C) karaciğer yetmezliği olan hastaların OFEV ile tedavisi önerilmez (bkz. Bölüm 5.2).
Pediyatrik popülasyon:
OFEV'in etkililiği ve güvenliliği, 0-18 yaşındaki çocuklarda belirlenmemiştir. Hiçbir veri mevcut değildir.
Geriyatrik popülasyon (≥ 65 yaş):
Yaşlı hastalarda nintedanibin etkililiği ve güvenliliğinde genel olarak herhangi bir farklılık gözlenmemiştir. Hastanın yaşına göre başlangıç dozunda herhangi bir ayarlama yapılması gerekli değildir. ≥75 yaşındaki hastalarda, advers etkileri yönetmek için doz azaltılması ihtiyacı daha fazla olabilir (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
Gebelik (bkz. Bölüm 4.6)
Nintedanibe, yer fıstığına, soyaya veya bölüm 6.1'de sıralanan yardımcı maddelerin herhangi birine karşı hipersensitivite durumlarında kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Gastrointestinal hastalıklar
Diyare
Klinik çalışmalarda (bkz. Bölüm 5.1) en sık bildirilen gastrointestinal advers reaksiyon diyaredir (bkz. Bölüm 4.8). Bu advers reaksiyon hastaların çoğunda hafif ila orta şiddettedir ve tedavinin ilk 3 ayında ortaya çıkar.
Pazarlama sonrasında, dehidratasyon ve elektrolit bozukluklarına yol açan ciddi diyare vakaları bildirilmiştir. Hastalar, diyarenin, ilk belirtileri ortaya çıkar çıkmaz, yeterli hidrasyon ve antidiyareik ilaçlarla (örneğin loperamid) tedavi edilmelidir. Diyare, doz azaltılmasını veya tedaviye ara verilmesini de gerektirebilir. OFEV tedavisine, azaltılmış bir dozla (günde iki kez 100 mg) veya tam dozla (günde iki kez 150 mg) tekrar başlanabilir. Semptomatik tedaviye rağmen geçmeyen inatçı, şiddetli diyare söz konusu ise, OFEV tedavisi kesilmelidir.
Bulantı ve kusma
Mide bulantısı ve kusma, sıklıkla bildirilen gastrointestinal advers reaksiyonlardır (bkz. Bölüm 4.8). Mide bulantısı ve kusma şikayeti olan hastaların çoğunda olay, hafif-orta şiddettedir. Klinik çalışmalarda, mide bulantısı, hastaların %2,1'ine, kusma, hastaların %1,4'ine kadar kısmında OFEV tedavisinin kesilmesine yol açmıştır.
Uygun destekleyici tedaviye rağmen (antiemetik tedavi dahil) semptomlar devam ederse, dozun azaltılması veya tedaviye ara verilmesi gerekebilir. Tedaviye azaltılmış dozla (günde iki kez 100 mg) veya tam dozla (günde iki kez 150 mg) yeniden başlanabilir. İnatçı şiddetli semptomlar varsa, OFEV tedavisi tamamen kesilmelidir.
Karaciğer fonksiyonu
Orta (Child Pugh B) veya şiddetli (Child Pugh C) karaciğer yetmezliği olan hastalarda OFEV'in güvenlilik ve etkililiği çalışılmamıştır. Bu nedenle, bu tip hastalarda OFEV tedavisi önerilmez (bkz. Bölüm 4.2). Artmış maruziyete bağlı olarak, hafif şiddette karaciğer yetmezliği (Child Pugh A) olan hastalarda advers reaksiyon riski artmış olabilir. Hafif karaciğer yetmezliği (Child Pugh A) olan hastalar, azaltılmış bir OFEV dozuyla tedavi edilmelidir (bkz. Bölüm 4.2 ve 5.2).
Nintedanib tedavisi ile, ölümle sonuçlanan ağır karaciğer hasarı da dahil, ilaç tedavisinin indüklediği karaciğer hasarı gözlenmiştir. Karaciğer olaylarının çoğunluğu, tedavinin ilk 3 ayında ortaya çıkar. Bu nedenle, tedavi başlamadan önce ve OFEV tedavisinin ilk ayı boyunca hepatik transaminazlar ve bilirubin düzeyleri araştırılmalıdır. Hastalar, tedavinin daha sonraki iki ayı süresince düzenli aralıklarla ve sonrasında da periyodik olarak (örneğin, her bir hasta ziyaretinde veya klinik olarak gerektikçe) izlenmelidir.
Karaciğer enzimleri (ALT, AST, kanda alkalen fosfataz (ALP), gammaglutamiltransferaz (GGT), bkz. Bölüm 4.8) ve bilirubin düzeylerindeki yükselmeler, vakaların çoğunda dozun azaltılması veya
ilacın kesilmesi ile geri döndürülebilir. Eğer transaminazlarda (AST veya ALT), >3x ânormalin üst limitiâ yükselme ölçülürse, OFEV dozunun azaltılması veya OFEV tedavisine ara verilmesi önerilir ve hasta yakından izlenmelidir. Transaminazlar başlangıç değerlerine döndüğünde, OFEV tedavisine tam dozda (günde iki kez 150 mg) yeniden başlanabilir veya azaltılmış bir dozla (yani günde iki kez 100 mg) yeniden başlanıp daha sonra tam doza çıkarılabilir (bkz. Bölüm 4.2). Karaciğer testlerinin herhangi birindeki artış karaciğer hasarının klinik belirti veya semptomları ile ilişkili bulunursa (örneğin, sarılık), OFEV tedavisine tamamen son verilmelidir. Karaciğer enzimlerindeki artışların alternatif nedenleri araştırılmalıdır.
Vücut ağırlığı düşük (<65 kg) hastalarla, Asya ırkından hastalar ve kadın hastalarda karaciğer enzimlerinin yükselme riski daha fazladır. Nintedanib maruziyeti, hasta yaşı ile lineer artış göstermiştir, bu durum, karaciğer enzimlerinin yükselmesi riskini arttırabilir (bkz. Bölüm 5.2). Bu risk faktörleri olan hastaların yakından izlenmesi önerilir.
Renal fonksiyonlar
Nintedanib kullanımı ile, bazıları fatal seyreden renal bozukluk/yetmezlik vakaları bildirilmiştir (bkz. Bölüm 4.8).
Hastalar, özellikle de renal bozukluk/yetmezlik için risk faktörleri bulunanlar, nintedanib tedavisi sırasında izlenmelidir. Renal bozukluk/yetmezlik gelişmesi halinde, tedavide ayarlama yapılması düşünülmelidir (bkz. Bölüm 4.2 Doz ayarlamaları).
Hemoraji
Vasküler endotelyal büyüme faktörü reseptörünün (VEGFR) inhibisyonu, kanama riskinde artış ile ilişkili olabilir.
Kanamaya kalıtsal olarak eğilimi olan hastalar veya tam doz antikoagülan ilaçlarla tedavi gören hastalar da dahil olmak üzere, kanama riski olduğu bilinen hastalar klinik çalışmalara dahil edilmemiştir. Pazarlama sonrası dönemde, bazıları fatal seyretmiş olan ciddi ve ciddi olmayan hemoraji vakaları, rapor edilmiştir (antikoagülan tedavi alan veya almayan veya kanamaya neden olabilecek başka bir ilaç kullanan hastalar dahil). Bu nedenle bu hastalar sadece, beklenen yarar potansiyel riske ağır basarsa OFEV ile tedavi edilmelidir.
Arteriyel tromboembolik olaylar
Yakın zamanda geçirilmiş miyokard enfarktüsü veya inme öyküsü olan hastalar klinik çalışmalara dahil edilmemiştir. Klinik çalışmalarda arteriyel tromboembolik olaylar sık olmayan şekilde bildirilmiştir (INPULSIS çalışmasında, OFEV %2,5 ve plasebo %0,7; INBUILD çalışmasında OFEV
%0,9 ve plasebo %0,9; SENSCIS çalışmasında OFEV %0,7 ve plasebo %0,7). INPULSIS çalışmalarında iskemik kalp hastalığına işaret eden advers olaylar, OFEV ve plasebo grupları arasında dengeli olmakla birlikte, miyokard-infarktüsü, OFEV grubundaki hastalarda (%1,6), plaseboya göre (%0,5), daha yüksek bir oranda görülmüştür. INBUILD çalışmasında miyokard infarktüsü düşük sıklıkta görülmüştür; OFEV %0,9 ve plasebo %0,9. SENSCIS çalışmasında miyokard enfarktüsü plasebo grubunda düşük sıklıkta (% 0,7) görülürken, OFEV grubunda görülmemiştir. Bilinen koroner arter hastalığı olan hastalar da dahil olmak üzere, kardiyovasküler riski daha yüksek olan hastaları tedavi ederken dikkatli olunmalıdır. Akut miyokard iskemisinin belirti ve semptomlarını gösteren hastalarda tedaviye ara verilmesi düşünülmelidir.
Anevrizmalar ve arter diseksiyonları
VEGF yolak inhibitörlerinin, hipertansiyonu olan veya olmayan hastalarda kullanılması, anevrizmalar ve/veya arter diseksiyonları oluşumunu kolaylaştırabilir. OFEV başlamadan önce hipertansiyon veya anevrizma öyküsü gibi risk faktörleri olan hastalarda bu risk dikkatle
değerlendirilmelidir.
Venöz tromboembolizm
Klinik çalışmalarda, nintedanib ile tedavi edilen hastalarda venöz tromboembolizm riskinde artma gözlenmemiştir. Nintedanibin etki mekanizması nedeniyle hastalar, tromboembolik olaylar açısından daha yüksek risk altında olabilir.
Gastrointestinal perforasyonlar ve iskemik kolit
Klinik çalışmalarda perforasyon yaşayan hastaların sıklığı her iki tedavi grubunda da %0,3'e kadardır. Hastalar, nintedanibin etki mekanizması nedeniyle, gastrointestinal perforasyonlar açısından daha yüksek risk altında olabilir. Pazarlama sonrası dönemde, bazıları fatal olan, gastroinstestinal perforasyon ve iskemik kolit vakaları bildirilmiştir. Daha önce abdominal ameliyat geçirmiş hastalar, peptik ülser öyküsü, divertiküler hastalık öyküsü olan veya eş zamanlı olarak kortikosteroid veya NSAİİ kullanan hastalar tedavi edilirken özellikle dikkat gösterilmelidir. OFEV ile tedaviye, abdominal ameliyattan en az 4 hafta geçtikten sonra başlanmalıdır. Gastrointestinal perforasyon veya iskemik kolit gelişen hastalarda OFEV tedavisine tamamen son verilmelidir. İstisnai olarak, iskemik kolitin tamamen çözülmesinden ve hastanın durumunun ve diğer risk faktörlerinin dikkatli bir şekilde değerlendirilmesinden sonra OFEV tedavisi yeniden başlatılabilir.
Nefrotik düzeyde proteinüri ve trombotik mikroanjiyopati
Pazarlama sonrasında, böbrek fonksiyon bozukluğu ile birlikte ya da birlikte olmaksızın çok az nefrotik düzeyde proteinüri vakası bildirilmiştir. Bireysel vakalardaki histolojik bulgular, renal trombüsü olan veya olmayan glomerüler mikroanjiyopati ile uyumludur. Rezidüel proteinüri görülen bazı vakalarda OFEV'in kesilmesinden sonra semptomların tersine döndüğü gözlenmiştir. Nefrotik sendrom belirtisi veya semptomları gelişen hastalarda tedaviye ara verilmesi düşünülmelidir.
VEGF yolu inhibitörleri, nintedanib için çok az vaka raporu dahil olmak üzere, trombotik mikroanjiyopati (TMA) ile ilişkilendirilmiştir. Nintedanib alan bir hastada TMA ile ilişkili laboratuvar veya klinik bulgular ortaya çıkarsa, nintedanib tedavisi kesilmeli ve TMA için kapsamlı değerlendirme tamamlanmalıdır.
Hipertansiyon
OFEV uygulaması, kan basıncını artırabilir. Sistemik kan basıncı, periyodik olarak ve klinik açıdan gerektiğinde ölçülmelidir.
Pulmoner hipertansiyon
Pulmoner hipertansiyonu olan hastalarda OFEV kullanımına ilişkin veriler sınırlıdır.
Ciddi pulmoner hipertansiyonu olan hastalar (kardiyak indeks ≤2 L/dk/m² veya parenteral epoprostenol/ treprostinil veya anlamlı sağ kalp yetmezliği) INBUILD ve SENSCIS çalışmalarına dahil edilmemiştir.
OFEV, şiddetli pulmoner hipertansiyonu olan hastalarda kullanılmamalıdır. Hafif ila orta şiddette pulmoner hipertansiyonu olan hastalarda yakından izlem önerilir.
Yara iyileşmesi komplikasyonu
Klinik çalışmalarda, yara iyileşmesinin bozulması şeklinde görülen olayların sıklığında bir artış gözlenmemiştir. Nintedanib, etki mekanizmasına bağlı olarak yara iyileşmesini bozabilir. Nintedanibin yara iyileşmesi üzerindeki etkisini araştıran hiçbir özel çalışma yapılmamıştır. Bu nedenle, OFEV ile tedaviye, sadece, yeterli yara iyileşmesi olduğuna klinik değerlendirme ile karar verildikten sonra başlanmalı veya perioperatif olarak ara verilmiş olması durumunda yeniden
başlanmalıdır.
Pirfenidon ile birlikte uygulama
Özel olarak tasarlanmış bir farmakokinetik çalışmada, IPF hastalarında nintedanib ile pirfenidonun eş zamanlı uygulanması araştırılmıştır. Bu sonuçlara dayanarak, kombinasyon şeklinde uygulandığında, nintedanib ile pirfenidon arasında önemli bir farmakokinetik ilaç- ilaç etkileşimini gösteren bir kanıt yoktur (bkz. Bölüm 5.2). Her iki ilacın güvenlilik profilindeki benzerlik düşünülürse, gastrointestinal ve hepatik advers olaylar dahil, ek advers reaksiyonlar beklenebilir. Pirfenidon ile eş zamanlı tedavinin yarar-risk dengesi belirlenmemiştir.
QT aralığı üzerindeki etki
Klinik çalışma programında, nintedanib için QT uzamasına dair hiçbir kanıt gözlenmemiştir (bkz. Bölüm 5.1). Diğer bazı tirozin kinaz inhibitörlerinin QT üzerinde bir etki sergilediği bilindiğinden, QTc uzaması gelişebilecek hastalarda nintedanib uygulanırken dikkatli olunmalıdır.
Alerjik reaksiyon
Diyetle alınan soya ürünlerinin soyaya alerjisi olan kişilerde, şiddetli anafilaksi dahil, alerjik reaksiyonlara neden olduğu bilinmektedir. Yer fıstığı proteinine alerjisi olduğu bilinen hastalar, soya preparatlarına karşı şiddetli reaksiyon için artmış bir risk taşırlar.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
P-glikoprotein (P-gp)
Nintedanib, bir P-gp substratıdır (bkz. Bölüm 5.2). İlaç-ilaç etkileşimi için özel olarak tasarlanmış bir çalışmada, potent bir P-gp inhibitörü olan ketokonazol ile birlikte uygulanması, nintedanibe maruziyeti EAA baz alınarak 1,61 kat, Cbaz alınarak 1,83 kat artırmıştır. Güçlü bir P-gp indükleyicisi olan rifampisinle yapılan bir ilaç-ilaç etkileşim çalışmasında, nintedanibe maruziyet, nintedanibin tek başına uygulanmasına kıyasla, rifampisinle birlikte uygulandığında EAA baz alınarak % 50,3, Cbaz alınarak % 60,3 azalmıştır. Eğer OFEV ile birlikte uygulanırsa, güçlü P- gp inhibitörleri (örneğin ketokonazol, eritromisin veya siklosporin) nintedanibe maruziyeti artırabilir. Bu gibi durumlarda hastalar, nintedanib tolerabilitesi açısından yakından izlenmelidir. Yan etkilerin ortaya çıkması durumunda, OFEV tedavisine ara verilmesi, dozun azaltılması veya tedavinin tamamen kesilmesi gerekebilir (bkz. Bölüm 4.2).
Güçlü P-gp indükleyicileri (örneğin, rifampisin, karbamazepin, fenitoin ve sarı kantaron otu) nintedanibe maruziyeti azaltabilir. Birlikte kullanım için alternatif bir ilaç seçerken, P-gp indüksiyonu potansiyeli olmayan veya bu etkisi çok az olan bir ilacın kullanımı düşünülmelidir.
Sitokrom (CYP)-enzimleri
Nintedanib biyotransformasyonunun sadece küçük bir kısmı CYP yolaklarını içerir. Nintedanib ve metabolitleri, serbest asit kısmı BIBF 1202 ve bunun glukuronidi BIBF 1202 glukuronid, preklinik çalışmalarda CYP enzimlerini inhibe etmemiş veya indüklememiştir (bkz. Bölüm 5.2). Bu nedenle, nintedanib ile CYP metabolizmasına dayanan ilaç-ilaç etkileşimi olasılığı düşük olarak kabul edilmektedir.
Diğer ilaçlarla birlikte uygulama
Nintedanibin oral hormonal kontraseptiflerle birlikte uygulanması, oral hormonal kontraseptiflerin farmakokinetiğini önemli derecede değiştirmemiştir (bkz. Bölüm 5.2).
Nintedanib ve bosentanın birlikte kullanımı nintedanibin farmakokinetik profilini etkilememiştir (bkz. Bölüm 5.2).
Özel popülasyonlara ilişkin ek bilgiler
Pediyatrik popülasyon:
Etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
:Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Nintedanib insanlarda fötal hasara neden olabilir (bkz. Bölüm 5.3). Çocuk doğurma potansiyeli olan kadınlar, OFEV ile tedavi edilirken gebe kalmaktan sakınmaları konusunda ve OFEV tedavisi başlangıcında, boyunca ve son dozdan en az 3 ay sonrasına kadar yüksek etkili kontrasepsiyon yöntemleri kullanmaları konusunda bilgilendirilmeli ve uyarılmalıdır. Nintedanib etinilestradiol ve levonorgestrelin plazma maruziyetini o denli etkilemez (bkz. Bölüm 5.2).
Oral hormonal kontraseptiflerin etkililiği, kusma ve/ veya ishal veya emilimin etkilenebileceği diğer durumlar nedeniyle tehlikeye girebilir. Bu durumları yaşayan oral hormonal kontraseptif kullanan kadınlara, yüksek etkili alternatif bir kontraseptif önlem kullanmaları tavsiye edilmelidir.
Gebelik dönemi
Gebe kadınlarda OFEV kullanımı hakkında hiçbir bilgi yoktur, ancak hayvanlar üzerindeki preklinik çalışmalar, bu etkin maddenin üreme toksisitesini göstermiştir (bkz. Bölüm 5.3). Nintedanib, insanlarda da fötal hasara neden olabileceğinden, gebelik süresince kullanılmamalıdır. (bkz. Bölüm 4.3) ve OFEV tedavisi öncesinde ve tedavi esnasında uygun görüldüğünde gebelik testi yapılmalıdır.
Kadın hastalar, OFEV ile tedavi sırasında gebe kalırlarsa doktor ya da eczacılarını bilgilendirmeleri konusunda uyarılmalıdır.
Eğer hasta OFEV alırken gebe kalırsa, tedavi durdurulmalı ve fetusa olabilecek zarar konusunda bilgilendirilmelidir.
OFEV'in gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. OFEV gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Nintedanib ve metabolitlerinin insan sütüne geçişi hakkında hiçbir bilgi yoktur. Preklinik çalışmalar, nintedanib ve metabolitlerinin emziren sıçanların sütüne az miktarda (uygulanan dozun %0,5'i veya daha azı) geçtiğini göstermiştir. Yenidoğanlar/infantlar üzerindeki olası bir risk göz ardı edilemez. OFEV ile tedavi süresince emzirmeye son verilmelidir.
Üreme yeteneği/fertilite
Preklinik araştırmalara dayanarak, erkek fertilitesinin bozulması ile ilgili hiçbir kanıt yoktur (bkz. Bölüm 5.3). Subkronik ve kronik toksisite çalışmalarında, insanlarda önerilen maksimum doz olan günde iki kez 150 mg uygulanmasıyla elde edilen maruziyet ile karşılaştırılabilir bir sistemik maruziyet düzeyinde dişi sıçanların üreme yeteneğinin bozulduğuna dair bir kanıt yoktur (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
OFEV'in araç ve makine kullanımı üzerinde etkisi düşüktür. Hastalar, OFEV ile tedavileri süresince araç veya makine kullandıklarında dikkatli olmaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Klinik çalışmalarda ve pazarlama sonrası dönemde nintedanib kullanımı ile ilişkili en sık bildirilen advers reaksiyonlar arasında diyare, bulantı, kusma, abdominal ağrı, iştah azalması, kilo kaybı ve hepatik enzimlerde yükselme bulunur.
Seçilmiş advers reaksiyonların yönetimi için bkz. Bölüm 4.4. Advers reaksiyonların tablolu özeti
Tablo 1 advers reaksiyonların özetini, MedDRA sistem organ sınıflamasına ve aşağıda tanımlanan sıklık sınıflarına göre vermektedir. Çok yaygın (≥1/10), yaygın (≥1/100 ila <1/10), yaygın olmayan (≥1/1.000 ila <1/100), seyrek (≥ 1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 1: Sıklık sınıflarına göre advers reaksiyonların özeti
| Sıklık | ||
Sistem Organ Sınıfı Tercih edilen terim | İdiyopatik pulmoner fibrozis | Progresif fenotipli diğer kronik fibrozan interstisyel akciğer hastalıkları | Sistemik skleroza bağlı interstisyel akciğer hastalığı |
Kan ve lenf sistemi hastalıkları |
| ||
Trombositopeni | Yaygın olmayan | Yaygın olmayan | Yaygın olmayan |
Metabolizma ve beslenme hastalıkları |
| ||
Vücut ağırlığında azalma | Yaygın | Yaygın | Yaygın |
İştah kaybı | Yaygın | Çok yaygın | Yaygın |
Dehidratasyon | Yaygın olmayan | Yaygın olmayan | Bilinmiyor |
Kardiyak hastalıklar |
| ||
Miyokard enfarktüsü | Yaygın olmayan | Yaygın olmayan | Bilinmiyor |
Vasküler hastalıklar |
| ||
Kanama (Bkz. Bölüm 4.4) | Yaygın | Yaygın | Yaygın |
Hipertansiyon | Yaygın olmayan | Yaygın | Yaygın |
Anevrizmalar ve arter diseksiyonları | Bilinmiyor | Bilinmiyor | Bilinmiyor |
Gastrointestinal hastalıklar |
| ||
Diyare | Çok yaygın | Çok yaygın | Çok yaygın |
Bulantı | Çok yaygın | Çok yaygın | Çok yaygın |
Abdominal ağrı | Çok yaygın | Çok yaygın | Çok yaygın |
Kusma | Yaygın | Çok yaygın | Çok yaygın |
Pankreatit | Yaygın olmayan | Yaygın olmayan | Bilinmiyor |
Kolit | Yaygın olmayan | Yaygın olmayan | Yaygın olmayan |
Hepatobiliyer hastalıklar |
|
|
|
İlaca bağlı karaciğer hasarı | Yaygın olmayan | Yaygın | Yaygın olmayan |
Hepatik enzimlerde yükselme | Çok yaygın | Çok yaygın | Çok yaygın |
Alanin aminotransferaz (ALT) yükselmesi | Yaygın | Çok yaygın | Yaygın |
Aspartat aminotransferaz (AST) yükselmesi | Yaygın | Yaygın | Yaygın |
Gamma glutamil transferaz (GGT) yükselmesi | Yaygın | Yaygın | Yaygın |
Hiperbilirubinemi | Yaygın olmayan | Yaygın olmayan | Bilinmiyor |
Kan alkalen fosfataz (ALP) düzeyinde yükselme | Yaygın olmayan | Yaygın | Yaygın |
Deri ve deri altı doku hastalıkları |
| ||
Döküntü | Yaygın | Yaygın | Yaygın olmayan |
Kaşıntı | Yaygın olmayan | Yaygın olmayan | Yaygın olmayan |
Alopesi | Yaygın olmayan | Yaygın olmayan | Bilinmiyor |
Böbrek ve idrar yolu hastalıkları |
| ||
Böbrek yetmezliği (Bkz. Bölüm 4.4) | Bilinmiyor | Bilinmiyor | Yaygın olmayan |
Proteinüri | Yaygın olmayan | Yaygın olmayan | Bilinmiyor |
Sinir sistemi hastalıkları |
| ||
Baş ağrısı | Yaygın | Yaygın | Yaygın |
Seçilmiş advers reaksiyonların açıklaması Diyare
Klinik çalışmalarda (bkz. Bölüm 5.1) bildirilen en yaygın gastrointestinal olay diyaredir. Hastaların
çoğunda bu durum hafif ila orta şiddettedir. Diyare ortaya çıkan hastaların 2/3'ünden daha fazlası, diyarenin tedavinin ilk 3 ayı içinde başladığını bildirmiştir. Hastaların çoğunda, diyare, antidiyareik tedavi, dozun azaltılması veya tedaviye ara verilmesi ile kontrol altına alınmıştır (bkz. Bölüm 4.4). Klinik çalışmalarda bildirilen diyare olaylarının özeti Tablo 2'de yer almaktadır.
Tablo 2: Klinik çalışmalarda 52 haftalık sürede diyare olayları
| INPULSIS | INBUILD | SENSCIS | |||
| Plasebo | OFEV | Plasebo | OFEV | Plasebo | OFEV |
Diyare | %18,4 | %62,4 | %23,9 | %66,9 | %31,6 | %75,7 |
Şiddetli diyare | %0,5 | %3,3 | %0,9 | %2,4 | %1,0 | %4,2 |
OFEV dozunun azaltılmasına neden olan diyare | %0 | %10,7 | %0,9 | %16,0 | %1,0 | %22,2 |
OFEV tedavisinin kesilmesine neden olan diyare | %0,2 | %4,4 | %0,3 | %5,7 | %0,3 | % 6,9 |
Hepatik enzimlerde yükselme
INPULSIS çalışmalarında karaciğer enzimlerinde yükselmeler (bkz. Bölüm 4.4), OFEV ve plasebo ile tedavi edilen hastaların sırasıyla %13,6'ya karşı %2,6'sında bildirilmiştir. INBUILD çalışmasında, karaciğer enzimlerinde yükselmeler OFEV ve plasebo ile tedavi edilen hastaların sırasıyla %22,6'ya karşı %5,7'sinde bildirilmiştir. SENSCIS çalışmasında OFEV ve plasebo tedavisi uygulanan hastaların sırasıyla % 13,2'ye karşı % 3,1'inde karaciğer enzim artışı bildirilmiştir. Karaciğer enzimlerindeki yükselmeler geri dönüşümlüdür ve klinik olarak belirgin karaciğer hastalığı
ile ilişkili değildir.
Özel popülasyonlar, diyare ve hepatik enzimlerde artış durumlarında önerilen önlemler ve doz ayarlamaları konularında daha fazla bilgi için, ek olarak, sırasıyla, 4.4 ve 4.2 bölümlerine bakınız.
Kanama
Klinik çalışmalarda, kanama yaşayan hastaların sıklığı, OFEV kolunda hafif oranda daha yüksek veya tedavi kolları arasında karşılaştırılabilir seviyededir (INPULSIS için OFEV %10,3 ve plasebo
%7,8, INBULD için OFEV %11,1 ve plasebo %12,7, SENSCIS için OFEV %11,1 ve plasebo %8,3). Ciddi olmayan epistaksis en sık bildirilen kanama olayıdır. Ciddi kanama olayları, her iki tedavi grubunda da, düşük sıklıktadır (INPULSIS için OFEV %1,3 ve plasebo: %1,4; INBUILD için OFEV
%0,9 ve plasebo %1,5; SENSCIS için OFEV %1,4 ve plasebo % 0,7).
Pazarlama sonrası kanama olayları gastrointestinal, respiratuvar ve santral sinir sistemi organlarını kapsar, ancak bunlarla sınırlı değildir. En sık görülenler gastrointestinal kanamalardır (bkz. Bölüm 4.4).
Proteinüri
Klinik çalışmalarda, proteinüri yaşayan hastaların sıklığı düşük ve tedavi kolları arasında karşılaştırılabilir olmuştur (INPULSIS için Ofev % 0,8 ve plasebo % 0,5; INBUILD için Ofev % 1,5 ve plasebo % 1,8; SENSCIS için Ofev % 1 ve plasebo % 0) . Klinik çalışmalarda nefrotik sendrom bildirilmemiştir. Pazarlama sonrasında, böbrek fonksiyon bozukluğu ile birlikte ya da birlikte olmaksızın çok az nefrotik düzeyde proteinüri vakası bildirilmiştir. Bireysel vakalardaki histolojik bulgular, renal trombüsü olan veya olmayan glomerüler mikroanjiyopati ile uyumludur. Rezidüel proteinüri görülen bazı vakalarda OFEV'in kesilmesinden sonra semptomların tersine döndüğü gözlenmiştir. Nefrotik sendrom belirtisi veya semptomları gelişen hastalarda tedaviye ara verilmesi düşünülmelidir (bkz. Bölüm 4.4).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
OFEV doz aşımı için spesifik bir antidot veya tedavi yoktur. Onkoloji programında iki hasta sekiz güne kadar süreyle günde iki kez en fazla 600 mg'lık aşırı doz almıştır. Gözlenen advers reaksiyonlar, nintedanibin bilinen güvenlilik profiliyle tutarlıdır (yani, karaciğer enzimlerinde yükselme ve gastrointestinal semptomlar). Her iki hastada da, bu advers reaksiyonlar iyileşmiştir. INPULSIS çalışmalarında bir hasta, kasıtlı olmayan bir şekilde, 21 gün süreyle 600 mg günlük doza maruz kalmıştır. Bu hastada ciddi olmayan bir advers olay (nazofarenjit) ortaya çıkmış ve uygun olmayan bu doz uygulaması sırasında düzelmiştir, başka bir olayın ortaya çıktığı bildirilmemiştir. Doz aşımı durumunda, tedaviye ara verilmeli ve uygun şekilde genel destekleyici önlemler başlanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri
ATC kodu: L01EX09
Etki mekanizması
Nintedanib, platelet kaynaklı büyüme faktörü reseptörü (PDGFR) α ve β, fibroblast büyüme faktörü reseptörü (FGFR) 1-3 ve vasküler endotelyal büyüme faktörü reseptörü (VEGFR) 1-3'ü de içeren küçük moleküllü bir tirozin kinaz inhibitörüdür. Ayrıca, nintedanib Lck (lenfosit-spesifik tirozin protein kinaz), Lyn (tirozin protein kinaz lyn), Src (proto-onkogen tirozin protein kinaz src) ve CSF1R (koloni uyarıcı faktör 1 reseptörü) kinazlarını inhibe eder. Nintedanib, bu kinazların adenozin trifosfat (ATP) bağlayan kısmına kompetetif bağlanarak, intertisyel akciğer hastalıklarında fibrotik doku remodeling patojenezinde rol oynadığı gösterilmiş olan intraselüler sinyalizasyon kaskadlarını bloke eder.
Farmakodinamik etkiler
İnsan hücrelerinin kullanıldığı in vitro çalışmalarda, nintedanibin fibrotik patojenezin başlatılması, periferik kan monositlerinden profibrotik aracı maddelerin salınması ve alternatif yolla etkinleşen makrofajlardaki polarizasyon gibi süreçleri inhibe ettiği gösterilmiştir. Ayrıca, nintedanibin organ fibrozisindeki temel süreçleri, fibroblastların proliferasyon ve migrasyonunu ve aktif miyofibroblast fenotipine dönüşümünü ve ekstraselüler matris salgılanmasını inhibe ettiği de belirlenmiştir. İPF, SSk/SSk-İAH, romatoid artrit ilebağlantılı (RA)-İAH ve diğer organ fibrozisiyle ilgili çok sayıda hayvan modelinde de nintedanib anti-enflamatuvar etki sağlamış ve akciğer, cilt, kalp, böbrek ve karaciğerde anti-fibrotik etkiler göstermiştir. Nintedanib aynı zamanda damarlar üzerinde de etki göstermiştir. Dermal mikrovasküler endotelyal hücre apoptozisini azaltmış ve vasküler düz kas hücre proliferasyonunu, pulmoner damar duvar kalınlığını ve tıkalı pulmoner damarların yüzdesini de düşürerek pulmoner vasküler remodeling'i azaltmıştır.
Klinik etkililik ve güvenlilik İdiyopatik pulmoner fibrozis (IPF)
Nintedanibin klinik etkililiği, IPF hastalarında, aynı tasarımlı iki Faz III, randomize, çift-kör, plasebo kontrollü, çalışmada (INPULSIS-1 (1199.32) ve INPULSIS-2 (1199.34)) çalışılmıştır. FVC başlangıç değeri öngörülene göre <%50 olan veya başlangıçtaki karbon monoksit difüzyon kapasitesi (DLCO, hemoglobine göre düzeltilmiş) beklenene göre <%30 olan hastalar çalışma dışı bırakılmıştır. Hastalar, 52 hafta süreyle, günde iki kez OFEV 150 mg grubuna veya plasebo grubuna 3:2 oranında randomize edilmiştir.
Primer sonlanım noktası, zorlanmış vital kapasitedeki (Forced Vital Capacity = FVC) azalmanın yıllık oranı olarak belirlenmiştir. Kilit sekonder sonlanım noktaları ise, 52. haftada Saint George Solunum Anketi (Saint George's Respiratory Questionnaire (SGRQ)) total skorunda başlangıca göre değişme ve ilk akut IPF alevlenmesine kadar geçen zamandır.
FVC değerindeki düşmenin yıllık oranı
FVC değerindeki düşmenin (mL olarak) yıllık oranı, nintedanib alan hastalarda, plasebo alanlara göre, anlamlı şekilde azalmıştır. Tedavi etkisi her iki çalışmada da tutarlıdır. Bireysel ve havuzlanmış çalışma sonuçları için bkz. Tablo 3.
|
INPULSIS-1 |
INPULSIS-2 | INPULSIS-1 ve INPULSIS-2 havuzlanmış | |||
| Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki kez |
Analiz edilen hasta sayısı |
204 |
309 |
219 |
329 |
423 |
638 |
52 haftadaki düşme oranı (SE) |
â239,9 (18,71) |
â114,7 (15,33) |
â207,3 (19,31) |
â113,6 (15,73) |
â223,5 (13,45) |
â113,6 (10,98) |
Plaseboyla karşılaştırma | ||||||
Fark |
| 125,3 |
| 93,7 |
| 109,9 |
%95 GA |
| (77,7, 172,8) |
| (44,8, 142,7) |
| (75,9, 144) |
p-değeri |
| <0,0001 |
| 0,0002 |
| <0,0001 |
Tablo 3: INPULSIS-1, INPULSIS-2 çalışmalarına ve bunların havuzlanmış verilerine göre FVC (ml) değerindeki düşmenin yıllık oranı - tedavi edilenlere ait set
1Rastgele katsayılı regresyon modeline göre tahmin edilen GA: Güven aralığı
52. haftada eksik verileri olan hastalarda, gözlenen son değerden sonra FVC azalmasının tüm plasebo hastalarındaki gibi aynı olacağını varsayan bir sensitivite analizinde, nintedanib ve plasebo arasında yıllık azalma hızındaki uyarlanmış fark, INPULSIS-1 çalışmasında 113,9 mL/yıl (% 95 GA 69,2, 158,5) ve INPULSIS-2 çalışmasında 83,3 mL/yıl (% 95 GA 37,6, 129) olmuştur.
INPULSIS-1 ve INPULSIS-2 çalışmalarının havuzlanmış analizlerine dayanarak, her iki tedavi grubunda zaman içinde başlangıca göre ortaya çıkan değişikliklerin değerlendirmesi için Şekil 1'e bakınız.
Şekil 1: FVC değerinde başlangıca göre zaman içinde gözlenen değişikliklerin ortalaması (SEM) (INPULSIS -1 ve INPULSIS-2 çalışmaları havuzlanmıştır)
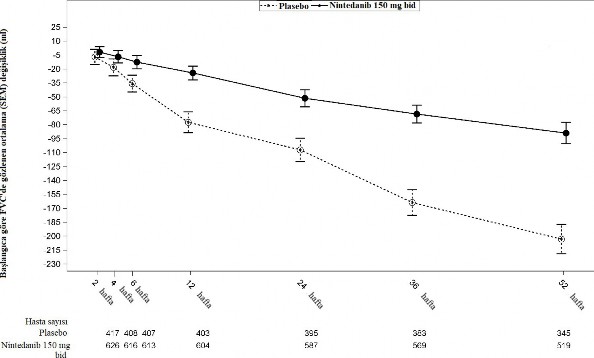
bid= günde iki kez
FVC yanıt analizi
Her iki INPULSIS çalışmasında da, âöngörülen % FVC değerindeki mutlak düşüşün %5'ten daha fazla olmadığı (Bu, IPF hastalarında mortalite riskindeki artışı gösteren eşik değeridir) hastalarâ şeklinde tanımlanan FVC yanıt verenlerin oranı, nintedanib grubunda plasebo grubuna göre, anlamlı derecede daha yüksektir. Konservatif %10 eşik değerinin kullanıldığı analizlerde de benzer sonuçlar gözlenmiştir. Bireysel ve havuzlanmış çalışma sonuçları için bkz. Tablo 4.
Tablo 4: INPULSIS-1 ve INPULSIS-2 çalışmalarına ve bunların havuzlanmış verilerine göre
52. haftada FVC yanıtı verenlerin oranı - tedavi edilenlere ait set
|
INPULSIS-1 |
INPULSIS-2 | INPULSIS-1 ve INPULSIS-2 havuzlanmış | |||
| Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki kez |
Analiz edilen hasta sayısı |
204 |
309 |
219 |
329 |
423 |
638 |
%5 eşik | ||||||
FVC yanıt |
78 (38,2) |
163 (52,8) |
86 (39,3) |
175 (53,2) |
164 (38,8) |
338 (53) |
verenlerin sayısı(%) | ||||||
Plaseboyla karşılaştırma | ||||||
Odds Oranı |
| 1,85 |
| 1,79 |
| 1,84 |
%95 GA |
| (1,28, 2,66) |
| (1,26, 2,55) |
| (1,43, 2,36) |
p-değeri |
| 0,001 |
| 0,0011 |
| <0,0001 |
%10 eşik | ||||||
FVC yanıt |
116 (56,9) |
218 (70,6) |
140 (63,9) |
229 (69,6) |
256 (60,5) |
447 (70,1) |
verenlerin sayısı(%) | ||||||
Plaseboyla karşılaştırma | ||||||
Odds Oranı |
| 1,91 |
| 1,29 |
| 1,58 |
%95 GA |
| (1,32, 2,79) |
| (0,89, 1,86) |
| (1,21, 2,05) |
p-değeri |
| 0,0007 |
| 0,1833 |
| 0,0007 |
Progresyona kadar geçen süre (öngörülen FVC değerinden ≥ %10 mutlak düşme veya ölüm)
Her iki INPULSIS çalışmasında, plaseboyla kıyaslandığında, nintedanible tedavi edilen hastalarda progresyon riski, istatistiksel açıdan anlamlı derecede azalmıştır. Havuzlanmış analizlerde, tehlike oranı 0,6'dır. Bu değer, plaseboyla kıyaslandığında, nintedanible tedavi edilen hastalarda progresyon riskinin %40 azaldığını gösterir.
Tablo 5: INPULSIS-1, INPULSIS-2 çalışmaları ve bunların havuzlanmış verilerine göre, 52 hafta boyunca öngörülen % FVC değerinde ≥%10 mutlak azalma veya ölüm yaşayan hastaların sıklığı ve progresyona kadar geçen süre - tedavi edilenlere ait set
|
INPULSIS-1 |
INPULSIS-2 | INPULSIS-1 ve INPULSIS- 2havuzlanmış | |||
| Plasebo | Ofev 150 mg Günde iki | Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki |
|
| kez |
|
|
| kez |
Risk altındaki sayı | 204 | 309 | 219 | 329 | 423 | 638 |
Olay yaşayan hastalar, N (%) | 83 (40,7) | 75 (24,3) | 92 (42) | 98 (29,8) | 175 (41,4) | 173 (27,1) |
Plaseboyla karşılaştırma | ||||||
p-değeri |
| 0,0001 |
| 0,0054 |
| <0,0001 |
Tehlike oranı |
| 0,53 |
| 0,67 |
| 0,6 |
%95 GA |
| (0,39, 0,72) |
| (0,51, 0,89) |
| (0,49, 0,74) |
52. haftada SGRQ total değerinin başlangıca göre değişimi
INPULSIS çalışmalarının havuz analizinde, başlangıç SGRQ skoru nintedanib grubunda 39,51 ve plasebo grubunda 39,58'dir. 52. haftaya kadar SGRQ total skorunda başlangıç değerine göre tahmin edilen ortalama değişme, nintedanib grubunda (3,53), plaseboya (4,96) göre daha küçüktür, tedavi grupları arasındaki farklılık, -1,43'tür (%95 GA; -3,09, 0,23; p= 0,0923). Genel olarak bakıldığında, SGRQ total skoru ile ölçülen sağlıkla ilgili yaşam kalitesi üzerinde nintedanibin etkisi orta derecededir ve bu durum plaseboya göre daha az bir kötüleşmeyi işaret eder.
İlk akut IPF alevlenmesine kadar geçen süre
INPULSIS çalışmalarının havuzlanmış analizinde, nintedanib alan hastalarda, plaseboya göre, sayısal olarak daha düşük bir ilk akut alevlenme riski gözlenmiştir. Bireysel ve havuzlanmış çalışma sonuçları için Tablo 6'ya bakınız.
Tablo 6 INPULSIS-1, INPULSIS-2 çalışmaları ve bunların havuzlanmış verilerine göre, araştırıcının bildirdiği olaylara dayanarak, 52 hafta boyunca akut IPF alevlenmesi gösteren hastaların sıklığı ve ilk alevlenmeye kadar geçen zaman analizi - Tedavi edilenlere ait set
|
INPULSIS-1 |
INPULSIS-2 | INPULSIS-1 ve INPULSIS-2 Havuzlanmış | |||
| Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki kez |
Risk altındaki sayı | 204 | 309 | 219 | 329 | 423 | 638 |
Olay yaşayan hastalar, N (%) |
11 (5,4) |
19 (6,1) |
21 (9,6) |
12 (3,6) |
32 (7,6) |
31 (4,9) |
Plaseboyla karşılaştırma | ||||||
p-değeri |
| 0,6728 |
| 0,005 |
| 0,0823 |
Tehlike oranı |
| 1,15 |
| 0,38 |
| 0,64 |
%95 GA |
| (0,54, 2,42) |
| (0,19, 0,77) |
| (0,39, 1,05) |
. Önceden belirlenmiş bir sensitivite analizinde 52 hafta içinde ortaya çıkan, karara bağlanmış en az 1 akut IPF alevlenmesine sahip hastaların sıklığı, nintedanib grubunda (hastaların % 1,9'u) plasebo grubuna (hastaların % 5,7'si) göre daha düşüktür. Havuzlanmış veriler kullanılarak karara bağlanmış alevlenme olaylarının olaya kadar geçen süre analizinde, tehlike oranı 0,32'dir (%95 GA 0,16, 0,65; p= 0,001).
Sağkalım analizi
INPULSIS çalışmalarında sağkalım verilerinin önceden tanımlanmış havuz analizlerinde, 52 hafta boyunca genel mortalite, nintedanib grubunda (%5,5) plasebo grubuna (%7,8) göre daha düşük bulunmuştur. Ölüme kadar geçen sürenin analizinde, tehlike oranı olarak 0,7 (%95 GA 0,43, 1,12; p= 0,1399) bulunmuştur. Tüm sağkalım sonlanım noktalarının sonuçları (tedavi sırasında ölüm ve solunuma bağlı ölüm gibi), nintedanib lehine tutarlı bir sayısal farklılık göstermiştir.
Tablo 7. INPULSIS-1, INPULSIS-2 çalışmaları ve bunların havuzlanmış verilerine göre 52 hafta boyunca tüm nedenlere bağlı mortalite -tedavi edilenlere ait set
|
INPULSIS-1 |
INPULSIS-2 | INPULSIS-1 ve INPULSIS-2 havuzlanmış | |||
| Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki kez | Plasebo | Ofev 150 mg Günde iki kez |
Risk altındaki sayı | 204 | 309 | 219 | 329 | 423 | 638 |
Olay yaşayan hastalar, N (%) |
13 (6,4) |
13 (4,2) |
20 (9,1) |
22 (6,7) |
33 (7,8) |
35 (5,5) |
Plaseboyla karşılaştırma | ||||||
p-değeri |
| 0,288 |
| 0,2995 |
| 0,1399 |
Tehlike oranı |
| 0,63 |
| 0,74 |
| 0,7 |
%95 GA |
| (0,29, 1,36) |
| (0,4, 1,35) |
| (0,43, 1,12) |
IPF'li hastalarda (INPULSIS-ON) OFEV ile uzun süreli tedavi
OFEV'in açık etiketli bir uzatma çalışması olan INPULSIS-ON, IPF'li 734 hastayı içermiştir. INPULSIS çalışmasında 52 haftalık tedavi periyodunu tamamlayan hastalar, INPULSIS-ON açık etiketli uzatma çalışmasında OFEV tedavisi almıştır. Hem INPULSIS hem de INPULSIS-ON çalışmalarında OFEV ile tedavi edilen hastalar için medyan maruz kalma süresi 44,7 aydır (11,9 - 68,3). Eksploratif etkililik sonlanım noktaları, 192 hafta boyunca OFEV ile tedavi edilen tüm hastalarda FVC'de â135,1 (5,8) mL / yıl olan yıllık düşüş oranını içermektedir. Bu da INPULSIS faz III çalışmalarında OFEV ile tedavi edilen hastalarda yıllık FVC düşüş oranıyla (-113,6 mL/yıl) tutarlıdır. INPULSIS-ON'daki OFEV'in advers olay profili, INPULSIS faz III çalısmasındaki profille tutarlıdır.
İleri akciğer fonksiyon bozukluğu olan IPF hastaları (INSTAGE)
INSTAGE, 24 hafta boyunca ileri akciğer fonksiyon bozukluğu (DLCO ≤% 35 öngörülen) olan IPF hastalarında çok merkezli, çok uluslu, prospektif, randomize, çift kör, paralel grup bir klinik çalışmadır. 136 hasta OFEV monoterapisi ile tedavi edilmiştir. Birincil sonlanım sonucu, başlangıca göre ayarlanmış ortalama değişikliğe göre St Georges Solunum Anketi (SGRQ) toplam skorunda W12 haftasında -0.77 birim azalma göstermiştir. Post hoc karşılaştırması, bu hastalardaki FVC'deki düşüşün, daha az ilerlemiş hastalığı olan ve INPULSIS faz III çalışmalarında OFEV ile tedavi edilen hastalardaki FVC'deki düşüş ile tutarlı olduğunu göstermiştir.
İleri akciğer fonksiyon bozukluğu olan IPF hastalarında OFEV'in güvenlilik ve tolere edilebilirlik profili, INPULSIS faz III çalışmalarında görülen ile tutarlıdır.
Günde iki kez 150 mg OFEV ve ekleme tedavisi pirfenidon ile yapılan Faz IV INJOURNEY çalışmasından elde edilen ek veriler:
Nintedanib ve pirfenidonla eş zamanlı tedavi, randomize edilmiş 105 hastada 12 hafta süreyle, günde iki kez 150 mg nintedanib ve bu tedaviye ek olarak pirfenidon tedavisi (günde üç kez 801 mg'a titre edilmiştir) ile tek başına günde iki kez 150 mg nintedanib tedavisini karşılaştıran, eksploratif, açık etiketli, randomize çalışmada araştırılmıştır. Primer sonlanım noktası, başlangıçtan 12. haftaya kadar geçen sürede gastrointestinal advers olay yaşayan hastaların yüzdesidir. Gastrointestinal advers olaylar sık olarak görülmüştür ve her bir bileşenin bilinen güvenlilik profili ile tutarlı bulunmuştur. Nintedanibe eklenen pirfenidon tedavisine karşı tek başına nintedanib uygulanmasında, sırası ile diyare, bulantı ve kusma en sık bildirilen advers olaylardır.
12. haftada, FVC değerinde başlangıca göre ortalama (SE) mutlak değişiklik, nintedanibe ekleme tedavisi olarak pirfenidon alan hastalarda (n=48) -13,3 (17,4) mL , buna karşılık, tek başına nintedanib alan hastalarda (n= 44) -40,9 (31,4) mL olmuştur.
Progresif fenotipli diğer kronik fibrozan interstisyel akciğer hastalıkları (İAH'ler)
OFEV tedavisinin progresif fenotipli diğer kronik fibrozan İAH'leri olan hastalardaki klinik etkililiği, çift kör, randomize, plasebo kontrollü bir faz III çalışmada (INBUILD) araştırılmıştır. IPF hastaları dahil edilmemiştir. Klinik olarak kronik fibrozan İAH tanısı alan hastalar, yüksek çözünürlüklü bilgisayarlı tomografide (HRCT) fibrozis ( %10'dan fazla fibrotik özellikler) mevcut olması ve klinik progresyon belirtileri (taramadan önceki 24 ay içinde ≥ %10 FVC azalması, ≥ %5 ve <%10 FVC azalması ile birlikte semptomların veya görüntüntüleme bulgularının kötüleşmesi veya semptomların ve görüntüleme bulgularının kötüleşmesi olarak tanımlanmıştır) sergilemeleri durumunda seçilmiştir. Hastaların öngörülenin %45'ine eşit veya daha yüksek bir FVC değerine ve öngörülenin %30'u ila
%80'i arasında bir DLCO değerine sahip olmaları gereklidir. Hastalarda mevcut İAH tanısına uygun hastalık yönetiminin yapılmasına karşın progresyon görülmesi gereklidir.
Toplam 663 hasta, en az 52 hafta süreyle OFEV 150 mg bid veya plasebo almak üzere 1:1 oranında randomize edilmiştir. Tüm çalışma boyunca medyan OFEV maruziyeti: 17,4 ay ve tüm çalışma boyunca ortalama OFEV maruziyeti 15,6 aydır. Randomizasyon, merkezi okuyucular tarafından değerlendirildiği üzere HRCT fibrotik paternine göre katmanlandırılmıştır. HRCT'de usual interstisyel pnömoni (UIP) benzeri fibrotik paterni olan 412 hasta ve diğer HRCT fibrotik paternleri olan 251 hasta randomize edilmiştir. Bu araştırmada analizlere yönelik olarak tanımlanan 2 ko- primer popülasyon bulunmaktadır: tüm hastalar (genel popülasyon) ve HRCT'de UIP benzeri fibrotik paterni olan hastalar. Diğer HRCT fibrotik paternleri olan hastalar ise 'tamamlayıcı' popülasyonu temsil etmiştir.
Primer sonlanım noktası, 52 haftalık dönemde zorlu vital kapasitedeki (FVC) yıllık azalma hızıdır (mL olarak). Ana sekonder sonlanım noktaları; 52. haftada King Kısa İnterstisyel Akciğer Hastalığı Anketi (K-BILD) toplam skorunda başlangıca göre elde edilen mutlak değişiklik, 52 haftalık dönemde ilk akut İAH alevlenmesine ya da ölüme kadar geçen süre ve 52 haftalık dönemde ölüme kadar geçen süre olmuştur.
Hastaların ortalama (standart sapma [SD, Min-Maks]) yaşı 65,8 (9,8, 27-87) yıl ve ortalama öngörülen FVC yüzdesi %69,0 (15,6, 42-137) olarak belirlenmiştir. Araştırmada temsil edilen gruplarda altta yatan klinik İAH tanıları; hipersensitivite pnömonisi (%26,1), otoimmün İAH'ler (%25,6), idiyopatik non-spesifik interstisyel pnömoni (%18,9), sınırlandırılamayan idiyopatik interstisyel pnömoni (%17,2) ve diğer İAH'lerdir (%12,2).
INBUILD çalışması nintedanibin özel tanı alt gruplarında yararını kanıtlamak üzere tasarlanmamış
ve bu amaca göre yönlendirilmemiştir. İAH tanılarına göre ayrılmış alt gruplardaki etkisi tutarlı bulunmuştur. Nintedanib ile deneyim, çok nadir görülen progresif fibrozan İAH'ler için sınırlıdır.
FVC'deki yıllık azalma hızı
52 hafta boyunca FVC'deki yıllık azalma hızı (mL olarak), plasebo alan hastalara kıyasla, OFEV alan hastalarda anlamlı olarak 107,0 mL azalmıştır (Tablo 8) ve bunun karşılık geldiği göreceli tedavi etkisi % 57,0'dir.
Tablo 8: 52 hafta boyunca değerlendirilen FVC'deki yıllık azalma hızı (mL)
| Plasebo | Ofev Günde iki kez 150 mg |
Analiz edilen hasta sayısı | 331 | 332 |
52 haftada azalma hızı (SE) | -187,8 (14,8) | -80,8 (15,1) |
Plaseboya kıyasla karşılaştırma | ||
Fark |
| 107,0 |
%95 GA |
| (65,4, 148,5) |
p değeri |
| <0,0001 |
HRCT'de UIP benzeri fibrotik paterni olan hastalardan oluşan ko-primer popülasyonda benzer sonuçlar gözlemlenmiştir. Ayrıca tedavi etkisinin, diğer HRCT fibrotik paternleri olan hastalardan oluşan tamamlayıcı popülasyonda tutarlı olduğu belirlenmiştir (etkileşim p değeri 0,2268) (Şekil 2).
Şekil 2 Hasta popülasyonlarında 52 haftada FVC'deki yıllık azalma hızına (ml) ilişkin forest grafiği
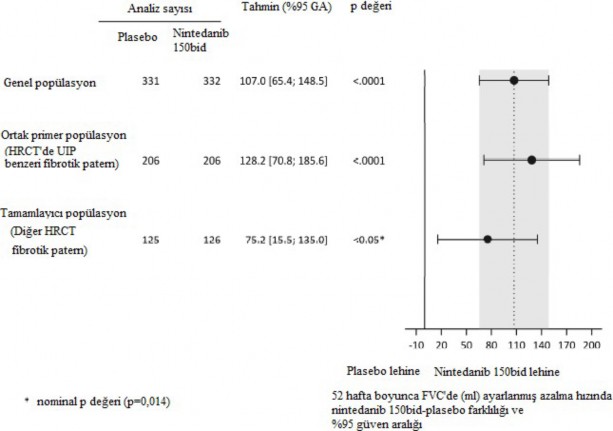
bid= günde iki kez, GA:güven aralığı
FVC'deki yıllık düşüş hızının azaltılması üzerinde OFEV etkisinin sonuçları, önceden belirlenmiş tüm duyarlılık analizlerinde doğrulanmış olup, önceden belirlenmiş etkililik alt gruplarında (örneğin, cinsiyet, yaş grubu, ırk, öngörülen başlangıç % FVC değeri ve gruplarda altta yatan asıl klinik İAH tanısı) tutarlı sonuçlar gözlemlenmiştir.
Şekil 3'te, tedavi gruplarında FVC'deki değişikliğin başlangıca göre zaman içinde değişimi gösterilmektedir.
Şekil 3 52 hafta boyunca başlangıca göre FVC'de gözlenen ortalama (SEM) değişiklik [mL]
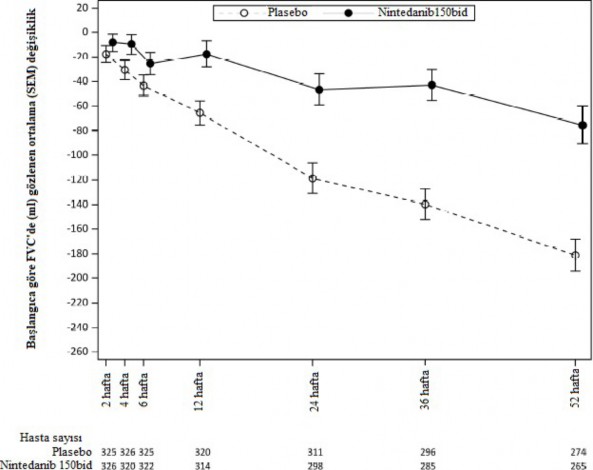
bid= günde iki kez
Ek olarak, OFEV'in 52. haftada öngörülen % FVC değerinde başlangıca göre ayarlanmış ortalama mutlak değişim üzerinde olumlu etkileri gözlenmiştir. Öngörülen % FVC değerinde başlangıçtan 52. haftaya kadar gözlenen ayarlanmış ortalama mutlak değişiklik plasebo grubuna (-%5,86) kıyasla nintedanib grubunda daha düşüktür (-%2,62). Tedavi grupları arasındaki ayarlanmış ortalama fark 3,24'tür (%95 GA: 2,09, 4,40, nominal p<0,0001).
FVC yanıt analizi
FVC yanıtı veren hastaların oranı (% FVC değerinde öngörülen göreceli düşüşün %5'ten daha büyük olmadığı hastalar olarak tanımlanmıştır), plasebo grubuna kıyasla OFEV grubunda daha yüksektir. Benzer sonuçlar, % 10'luk bir eşik değeri kullanılarak yapılan analizlerde benzer sonuçlar gözlenmiştir (Tablo 9).
Tablo 9: INBUILD çalışmasında 52. haftada FVC yanıtı veren hastaların oranı
| Plasebo | OFEV Günde iki kez 150 mg |
Analiz edilen hasta sayısı | 331 | 332 |
%5 eşik | ||
FVC yanıtı veren hastaların oranı (%) | 104 (31,4) | 158 (47,6) |
Plaseboyla karşılaştırma | ||
Olasılık (odds) oranı |
| 2,01 |
%95 GA |
| (1,46, 2,76) |
Nominal p değeri |
| <0,0001 |
%10 eşik | ||
FVC yanıtı veren hastaların sayısı (%) | 169 (51,1) | 197 (59,3) |
Plaseboyla karşılaştırma | ||
Olasılık (odds) oranı |
| 1,42 |
%95 GA |
| (1,04, 1,94) |
Nominal p değeri |
| 0,0268 |
%5'in veya %10'un üzerinde göreceli düşüş göstermeyen hastalardır (52. haftada verileri eksik olan hastalar, yanıt vermeyen hastalar olarak değerlendirilmiştir).
İlk akut İAH alevlenmesine ya da ölüme kadar geçen süre
Tüm klinik çalışma boyunca ilk akut İAH alevlenmesi veya ölüm bakımından en az bir olay görülen hastaların oranı, OFEV grubunda % 13,9 ve plasebo grubunda %19,6 olarak belirlenmiştir. HR değeri 0,67'dir (%95 GA: 0,46, 0,98; nominal p=0,0387) ve bu değer, plasebo alan hastalara kıyasla OFEV alan hastalarda ilk akut İAH alevlenmesi veya ölüm riskinde %33 oranında bir azalmayı göstermektedir (Şekil 4).
Şekil 4 Tüm araştırma genelinde ilk akut İAH alevlenmesine veya ölüme kadar geçen süreye ilişkin Kaplan-Meier grafiği
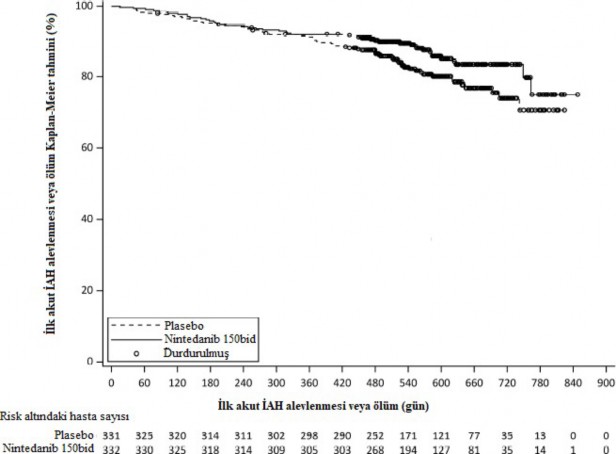
bid: günde iki kez
Sağkalım analizi
Plasebo grubu ile karşılaştırıldığında OFEV grubunda ölüm riski daha düşüktür. HR değeri 0,78'dir (%95 GA: 0,50, 1,21; nominal p=0,2594) ve bu değer, plasebo alan hastalara kıyasla OFEV alan hastalarda ölüm riskinde %22 oranında bir azalmayı göstermektedir.
Progresyona (öngörülen %FVC değerinden ≥%10 mutlak düşüş) veya ölüme kadar geçen süre INBUILD çalışmasında, progresyon (öngörülen %FVC değerinden ≥%10 mutlak düşüş) veya ölüm riski OFEV ile tedavi edilen hastalar için azalmıştır.
Bir olay yaşayan hastaların oranı OFEV grubunda % 40,4 ve plasebo grubunda % 54,7'tür. HR değeri 0,66'dır (%95 GA: 0,53, 0,83; p=0,0003) ve bu değer, plasebo alan hastalara kıyasla OFEV alan hastalarda progresyon (öngörülen %FVC değerinden ≥%10 mutlak düşüş) veya ölüm riskinde %34 oranında bir azalma olduğunu göstermektedir.
Yaşam kalitesi
52. haftada K-BILD toplam skorunda başlangıca göre elde edilen ayarlanmış ortalama değişiklik, plasebo grubunda -0,79 birim ve OFEV grubunda 0,55 birim olmuştur. Tedavi grupları arasındaki
fark 1,34 birim olmuştur (%95 GA: -0,31, 2,98; nominal p=0,1115).
52. haftada Pulmoner Fibrozis İle Yaşamak (Living with Pulmonary Fibrosis (L-PF)) anketinde semptomları dispne alan skorunda başlangıca göre ortaya çıkan ayarlanmış ortalama mutlak değişiklik, plasebo grubundaki 7,81'e kıyasla OFEV grubunda 4,28 olarak belirlenmiştir. Gruplar arasındaki ayarlanmış ortalama fark OFEV lehine -3,53 olarak hesaplanmıştır (%95 GA: -6,14, -0,92; nominal p=0,0081). 52. haftada L-PF semptomları öksürük alan skorunda başlangıca göre ortaya çıkan ayarlanmış ortalama mutlak değişiklik, plasebo grubunda 4,25'e kıyasla OFEV grubunda -1,84 olarak belirlenmiştir. Gruplar arasındaki ayarlanmış ortalama fark OFEV lehine -6,09 olarak hesaplanmıştır (%95 GA: -9,65, -2,53; nominal p=0,0008).
Sistemik skleroza bağlı interstisyel akciğer hastalığı (SSk-İAH)
Çift kör, randomize, plasebo kontrollü bir faz III çalışmada (SENSCIS) OFEV'in SSk-IAH hastalarındaki klinik etkililiği incelenmiştir. SSk-İAH tanısı için 2013 tarihli Amerikan Romatoloji Koleji/Avrupa Romatizmayla Mücadele Ligi SSk sınıflama kriterleri ve son 12 ay içerisinde çekilmiş yüksek çözünürlüklü bilgisayarlı tomografi (HRCT) görüntüleri kullanılmıştır. Toplam 580 hasta en az 52 hafta süreyle günde iki kez 150 mg OFEV ya da plasebo kullanacak şekilde 1:1 oranında randomize edilmiştir, bu hastalardan 576'sı tedavi görmüştür. Randomizasyon katmanlarını oluşturmak için antitopoizomeraz antikor durumu (ATA) kullanılmıştır. Körlemeli tedavinin 100 haftaya kadar sürdürüldüğü vakalar olmuştur (medyan OFEV maruziyet süresi 15,4 ay ve ortalama OFEV maruziyeti süresi ise 14,5 ay).
Primer sonlanım noktası 52 haftalık sürede FVC'deki azalma hızıdır. Ana sekonder sonlanım noktaları modifiye Rodnan Cilt Skoru'nda (mRSS) başlangıçtan 52. haftaya kadar mutlak değişim ve Saint George Solunum Anketi (SGRQ) total skorunda başlangıçtan 52. haftaya kadar mutlak değişimdir.
Genel popülasyonda hastaların % 75,2'si kadındır ve yaş ortalaması (standart sapma ïSD, min-maksï) 54 (12,2, 20-79) yıldır. Toplamda hastaların %51,9'unda diffüz kutanöz sistemik skleroz (SSk) ve % 48,1'inde sınırlı kutanöz SSk mevcuttur. Raynaud dışı bir semptomun ilk başlama tarihinden itibaren geçen ortalama (SD) süre 3,49 (1,7) yıldır. Hastaların %49'u başlangıçta stabil dozda mikofenolat (% 46,5 mikofenolat mofetil, % 1,9 mikofenolat sodyum, % 0,5 mikofenolik asit) kullanmaktadır. Başlangıçta mikofenolat kullanan ve kullanmayan hastaların güvenlilik profilleri karşılaştırılabilirdir.
FVC'de yıllık kayıp hızı
Plasebo kullanan hastalarla karşılaştırıldığında, OFEV kullanan hastaların FVC değerlerinde (mL) 52 haftalık süre boyunca kayıp hızı anlamlı olarak 41 mL azalmıştır (Tablo 10) ve bunun karşılık geldiği göreceli tedavi etkisi % 43,8'dir.
Tablo 10: 52 haftalık sürede FVC'deki (mL) yıllık kayıp hızı
| Plasebo | OFEV 150 mg günde iki kez |
İncelenen hasta sayısı | 288 | 287 |
52 haftada azalma hızı (SE) | -93,3 (13,5) | -52,4 (13,8) |
Plasebo ile karşılaştırma | ||
Fark |
| 41,0 |
%95 GA |
| (2,9, 79,0) |
p-değeri |
| < 0,05 |
Önceden belirlenmiş duyarlılık analizlerinde OFEV'in FVC'deki yıllık kayıp hızını azaltma etkisi benzer bulunmuş ve önceden tanımlanmış alt gruplarda (örneğin, yaş, cinsiyet ve mikofenolat kullanımına göre) heterojenite saptanmamıştır.
Ayrıca, 52. haftada akciğer fonksiyonuyla ilgili diğer sonlanım noktalarında (örneğin, 52. haftada başlangıç FVC değerine göre mutlak değişim (Şekil 5 ve Tablo 11) ve 52 haftalık sürede öngörülen FVC değerinde % olarak azalma hızı (Tablo 12)) benzer etkiler gözlenmiş olması da OFEV'in SSk- İAH progresyonunu yavaşlattığı yönünde ek kanıt sağlamaktadır. Bunun dışında, mutlak FVC değerinin beklenenden >%5 azaldığı hastaların sayısı da (OFEV grubunda %20,6, plasebo grubunda
%28,5, OR=0,65, p=0,0287) OFEV grubunda daha düşüktür. Rölatif FVC değerinde mL olarak > % 10 azalma olan hasta oranı her iki grupta karşılaştırılabilirdir (OFEV grubunda % 16,7 ve plasebo grubunda % 18,1, OR=0.91, p=0,6842). Bu analizlerde, 52. haftadaki eksik FVC değerlerinin yerine, hastanın tedavi sırasındaki en kötü değerleri konulmuştur.
100 haftaya (SENSCIS'teki maksimum tedavi süresi) kadar sürdürülen eksploratif (araştırma amaçlı) bir analizde, OFEV'in SSk-İAH progresyonunu yavaşlatıcı etkisinin 52. haftadan sonra devam ettiğini düşündüren bulgulara ulaşılmıştır.
Şekil 5: 52 haftalık sürede FVC'de (mL) başlangıca göre ortalama (SEM) değişim.
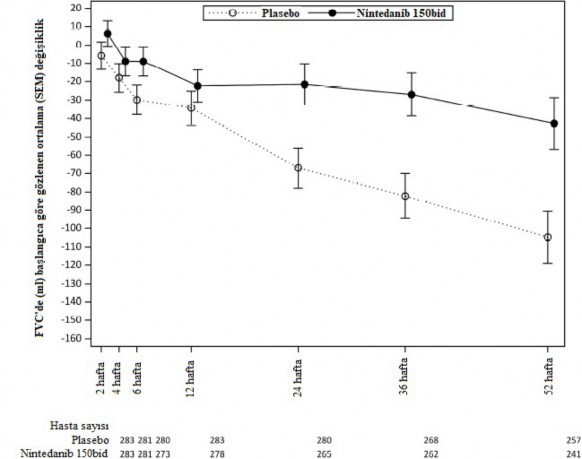
bid: günde iki kez
Tablo 11: 52. haftada FVC'de (mL) başlangıca göre mutlak değişim
| Placebo | OFEV 150 mg günde iki kez |
İncelenen hasta sayısı | 288 | 288 |
Başlangıçta ortalama (SD) | 2541 (815,5) | 2458,5 (735,9) |
52. haftada başlangıca göre ortalama (SE) değişim | -101 (13,6) | -54,6 (13,9) |
Plasebo ile karşılaştırma |
|
|
Ortalama |
| 46,4 |
%95 GA |
| (8,1, 84,7) |
p değeri |
| <0,05 |
Tablo 12: 52 haftalık sürede FVC'deki yıllık kayıp hızı (beklenenin %'si)
| Plasebo | OFEV 150 mg günde iki kez |
Değerlendirilen hasta sayısı | 288 | 287 |
52 haftada azalma hızı (SE) | -2,6 (0,4) | -1,4 (0,4) |
Plasebo ile karşılaştırma |
|
|
Farklılık |
| 1,15 |
%95 GA |
| (0,09, 2,21) |
p değeri |
| <0,05 |
52. haftada Modifiye Rodnan Cilt Skorunda (mRSS) başlangıca göre değişim
OFEV grubu (-2,17 (%95 GA -2,69, -1,65)) ve plasebo (-1,96 (%95 GA -2,48, -1,45)) grubunda
başlangıçtan 52. haftaya kadar mRSS'deki ayarlanmış ortalama mutlak değişim karşılaştırılabilirdir. Tedavi grupları arasındaki ayarlanmış ortalama farklılık -0,21'dir (%95 GA -0,94, 0,53; p=0,5785).
52. haftada S. George Solunum Anketi (SGRQ) total skorunda başlangıca göre değişim
OFEV grubu (0,81 (%95 GA -0,92, 2,55)) ve plasebo grubunda (-0,88 (%95 GA -2,58, 0,82)) başlangıçtan 52. haftaya kadar SGRQ total skorundaki ortalama mutlak değişim karşılaştırılabilirdir. Tedavi grupları arasında ayarlanmış ortalama farklılık 1,69'dur (%95 GA -0,73, 4,12; p=0,1711).
Sağkalım analizi
Çalışma boyunca mortalite oranları OFEV grubunda (n=10; % 3,5) ve plasebo grubunda (n=9; %3,1) karşılaştırılabilirdir. Çalışmanın tümü boyunca ölüme kadar geçen süre analizlerinde elde edilen HR (tehlike oranı) değeri 1,16'dır (%95 GA 0,47, 2,84; p=0,7535).
QT aralığı
Renal hücre kanserli hastalarda yapılan özel bir çalışmada, QT/QTc ölçümleri kaydedilmiş ve gerek oral tek doz 200 mg nintedanib ile ve gerekse 15 gün boyunca günde iki kez çoklu oral dozları uygulanan 200 mg nintedanib ile QTcF aralığının uzamadığı gösterilmiştir.
Pediyatrik popülasyon
Avrupa İlaç Ajansı, idiyopatik pulmoner fibrozis için pediyatrik popülasyonun tüm alt gruplarında OFEV ile yapılan çalışmaların sonuçlarını bildirme zorunluluğunu kaldırmıştır (pediyatrik kullanımla ilgili bilgi için bölüm 4.2'ye bakınız).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Nintedanib, tokluk koşullarında, yumuşak jelatin kapsül şeklinde, oral uygulamadan yaklaşık 2-4 saat sonra maksimum plazma konsantrasyonuna ulaşmıştır (aralık 0,5-8 saat). Sağlıklı gönüllülerde 100 mg dozun mutlak biyoyararlanımı %4,69 olmuştur (%90 GA: 3,615-6,078). Emilim ve biyoyararlanım, taşıyıcı etkiler ve belirgin ilk geçiş metabolizmasıyla azalır. Doz orantısallığı, nintedanib maruziyetinde artışla gösterilmiştir (doz aralığı 50-450 mg günde bir kez ve 150-300 mg günde iki kez). Kararlı durum plazma konsantrasyonlarına, en geç, dozlamanın ilk haftası içinde ulaşılmıştır.
Yemekten sonra alındığında, açlık durumundaki uygulamaya kıyasla, nintedanibe maruziyet yaklaşık
%20 artmıştır (GA: % 95,3-% 152,5) ve emilim gecikmiştir (medyan taçlıkta: 2 saat; toklukta: 3,98 saat).
Dağılım:
Nintedanib, en az bifazik dispozisyon kinetiği gösterir. İntravenöz infüzyondan sonra yüksek bir dağılım hacmi (V: 1.050 L, %45 gCV) gözlenmiştir.
Nintedanibin in vitro olarak insan plazmasında proteinlere bağlanma oranı yüksektir (bağlanma fraksiyonu %97,8). Serum albümini majör bağlanma proteini olarak kabul edilmektedir. Nintedanib, plazmada tercihli şekilde, 0,869'luk bir kan/plazma oranıyla dağılmaktadır.
Biyotransformasyon:
Nintedanibin başlıca metabolik reaksiyonu, esterazlar tarafından hidrolitik kırılmadır ve serbest asit kısmı olan BIBF 1202 ile sonuçlanır. Daha sonra BIBF 1202, uridin 5'-difosfo- glukuronosiltransferaz (UGT) enzimleri, yani UGT 1A1, UGT 1A7, UGT 1A8 ve UGT 1A10 tarafından BIBF 1202 glukuronide glukuronidlenir.
Nintedanib biyotransformasyonunun sadece küçük bir kısmı, başlıca enzim CYP 3A4 olmak üzere, CYP yolaklarından gerçekleşir. Majör CYP bağımlı metabolit, insan emilim-dağılım- metabolizma- atılım çalışmasında plazmada saptanamamıştır. İn vitro, CYP'ye bağımlı metabolizma yaklaşık
%5'ten sorumludur, buna karşılık esterle kırılma yaklaşık %25'ten sorumludur. Nintedanib, BIBF 1202 ve BIBF 1202 glukuronid, preklinik çalışmalarda CYP enzimlerini inhibe etmemiş ve indüklememiştir. Bu nedenle, nintedanib ile CYP substratları, CYP inhibitörleri veya CYP indükleyicileri arasında etkileşme beklenmez.
Eliminasyon:
İntravenöz infüzyondan sonra toplam plazma klerensi yüksektir (CL: 1,39 mL/dk, % 28,8 gCV). Değişmemiş aktif maddenin 48 saat içindeki üriner atılımı, oral uygulama sonrasında dozun yaklaşık
% 0,05'i (%31,5 gCV), intravenöz uygulamadan sonra dozun yaklaşık % 1,4'üdür (%24,2 gCV); renal klerens 20 ml/dk (%32,6 gCV) bulunmuştur. Nintedanibin oral uygulamasından sonra, ilaçla ilişkili radyoaktivitenin majör eliminasyon yolu, fekal/safra atılımıdır (dozun % 93,4'ü, % 2,61 gCV). Renal atılımın toplam klerense katkısı düşüktür (dozun % 0,649'u, % 26,3 gCV). Doza başlanmasından sonra 4 gün içinde genel geri kazanımın tamamlandığı (% 90'ın üzerinde) kabul edilmiştir. Nintedanibin terminal yarılanma ömrü 10 ila 15 saat arasındadır (% gCV yaklaşık % 50).
Doğrusallık/doğrusal olmayan durum:
Nintedanib farmakokinetiğinin zamana göre doğrusal olduğu kabul edilebilir (yani, tek doz verileri çoklu doz verilerine ekstrapole edilebilir). Çoklu uygulamalara bağlı birikim Ciçin 1,04 kat ve EAAiçin 1,38 kat olmuştur. Nintedanib çukur konsantrasyonları bir yıldan daha uzun bir süre stabil kalmıştır.
Taşınma:
Nintedanib P-gp'nin bir substratıdır. Nintedanibin bu taşıyıcı ile etkileşme potansiyeli için bölüm
4.5'e bakınız. Nintedanibin, OATP-1B1, OATP-1B3, OATP-2B1, OCT-2 veya MRP- 2'nin bir substratı veya inhibitörü olmadığı in vitro koşullarda gösterilmiştir. Nintedanib bir BCRP substratı da değildir. Yalnızca, OCT-1, BCRP ve P-gp üzerinde zayıf bir inhibitör potansiyel, in vitro koşullarda, gözlenmiştir, bu durumun klinik anlamlılığının düşük olduğu düşünülmüştür. Aynı durum, nintedanibin bir OCT-1 substratı olması için de geçerlidir.
Hastalardaki karakteristik özellikler
Nintedanibin farmakokinetik özellikleri, sağlıklı gönüllüler, IPF hastaları, progresif fenotipli diğer kronik fibrozan İAH hastaları, SSk-İAH hastaları ve kanser hastalarında benzerdir. IPF ve küçük hücreli olmayan akciğer kanseri (NSCLC) hastalarında (N = 1.191) yürütülen bir popülasyon farmakokinetiği (PopPK) analizinin ve tanımlayıcı araştırmaların sonuçlarına göre, nintedanibe maruziyet, cinsiyet (vücut ağırlığına göre düzeltilmiş), hafif ve orta dereceli böbrek yetmezliği (kreatinin klerensi ile tahmin edilen), alkol tüketimi veya P-gp genotipinden etkilenmemiştir.
Popülasyon farmakokinetiği analizleri, yaş, vücut ağırlığı ve ırk faktörlerine bağlı olarak, nintedanib maruziyeti üzerinde orta derecede etkileri işaret etmiştir (bkz. Aşağıdaki bilgiler). Maruziyetteki yüksek bireylerarası değişkenlikler nedeniyle, gözlenen bu orta dereceli etkilerin klinik olarak önemli olmadığı kabul edilmiştir (bkz. Bölüm 4.4).
Yaş:
Nintedanibe maruziyet yaşla lineer olarak artmıştır. EAA, medyan yaş olan 62 yıla göre, 45 yaşındaki bir hastada % 16 azalmış ve 76 yaşındaki bir hastada ise % 13 artmıştır. Analizlerde 29-85 yaş arası kapsanmıştır. Popülasyonun yaklaşık %5'i 75 yaşın üzerindedir. Bir popülasyon farmakokinetiği modeline göre, 65 yaş altındaki hastalarla kıyaslandığında, 75 yaş ve üzeri hastalarda nintedanib maruziyetinde yaklaşık %20-25 artış gözlenmiştir.
Pediyatrik popülasyonda çalışma yürütülmemiştir. Vücut ağırlığı:
Vücut ağırlığı ve nintedanibe maruziyet arasında ters bir korelasyon gözlenmiştir. EAA, medyan
kilo olan 71,5 kg ağırlığındaki bir hastaya göre, 50 kg'lık bir hastada (5. persentil) % 25 artmış ve 100 kg'lık bir hastada (95. persentil) % 19 azalmıştır.
Irk:
Nintedanibe popülasyon ortalama maruziyeti, beyaz ırkla kıyaslandığında (vücut ağırlığına göre düzeltme yapılarak), Korelilerde % 16-22 daha düşükken, Çinli, Tayvanlı ve Hintli hastalarda %33- 50 ve Japon hastalarda ise % 16 daha yüksek bulunmuştur. Siyah ırktan bireylere ait veriler çok sınırlıdır, ancak beyaz ırkla aynı aralıktadır.
Karaciğer bozukluğu:
Özel bir tek doz faz I çalışmasında ve sağlıklı gönüllülerle karşılaştırıldığında, Cve EAA değerlerine dayanarak nintedanibe maruziyet, hafif karaciğer yetmezliği (Child Pugh A; GA
% 90 sırasıyla, Ciçin 1,3-3,7 ve EAA için 1,2-3,8) olan gönüllülerde 2,2 kat daha yüksek bulunmuştur. Orta derecede karaciğer yetmezliği olan (Child Pugh B) gönülllülerde, sağlıklı gönüllülerle karşılaştırıldığında, maruziyet, sırasıyla, C'a (GA %90 4,4-13,2) göre, 7,6 kat ve EAA değerine (GA %90 5,7-13,1) göre 8,7 kat daha yüksek bulunmuştur. Şiddetli karaciğer yetmezliği olan bireylerde (Child Pugh C) çalışma yapılmamıştır.
Pirfenidon ile birlikte tedavi:
Özel bir farmakokinetik çalışmada, IPF hastalarında, nintedanib ile eş zamanlı pirfenidon tedavisi araştırılmıştır. Grup 1, pirfenidonun günde üç kez 801 mg'a titre edilmesinden önce ve sonra, kararlı durumda, tek doz 150 mg nintedanib almıştır (tedavi edilen hasta sayısı=20). Grup 2, günde üç kez 801 mg kararlı durum pirfenidon tedavisi almış ve eş zamanlı nintedanib tedavisinden önce ve en az 7 gün süreyle günde iki kez 150 mg nintedanib eş zamanlı uygulamasından sonra bir farmakokinetik profilleme yapılmıştır (tedavi edilen hasta sayısı=17). Grup 1'de, nintedanibin Cve EAAiçin uyarlanmış geometrik ortalaması oranları (güven aralığı (GA) %90) sırası ile %93 (%57 - %151) ve
%96 (%70 - %131) olmuştur (bireyler arası karşılaştırma için n= 12). Grup 2'de, pirfenidonun C
ve EAAiçin uyarlanmış geometrik ortalama oranları (güven aralığı (GA) %90) sırası ile %97 (% 86- % 110) ve % 95 (% 86 - % 106) olmuştur (bireyler arası karşılaştırma için n= 12).
Bu sonuçlara dayanarak, kombinasyon şeklinde uygulandığında, nintedanib ile pirfenidon arasında önemli bir farmakokinetik ilaç-ilaç etkileşimini gösteren bir kanıt yoktur (bkz. Bölüm 4.4).
Bosentan ile eşzamanlı tedavi
Özel bir farmakokinetik çalışmasında, sağlıklı gönüllülerde bosentan ile eş zamanlı OFEV tedavisi araştırılmıştır. Katılımcılara kararlı durumda günde iki kez 125 mg bosentan ile gerçekleştirilen çok dozlu tedavi öncesinde ve sonrasında 150 mg OFEV tek doz olarak uygulanmıştır. Nintedanibin Cve EAAdeğerlerine ait ayarlanmış geometrik ortalama değerler (% 90 güven aralıkları (GA)) sırasıyla %103 (% 86-% 124) ve % 99 (% 91-%107) (n=13) olarak bulunmuştur; bu bulgular nintedanibin bosentan ile birlikte uygulanmasının nintedanib farmakokinetiğini değiştirmediğini göstermektedir.
Oral hormonal kontraseptiflerle eşzamanlı tedavi
Özel bir farmakokinetik çalışmada, SSc-ILD'li kadın hastalar, en az 10 gün süreyle, günde iki kez 150 mg nintedanib dozundan önce ve sonra, 30 mcg etinilestradiol ve 150 mcg levonorgestrel kombinasyonundan oluşan tek bir doz almıştır. Ayarlanmış geometrik ortalama oranlar (% 90 güven aralığı (CI)), etinilestradiol ve levonorgestrel için sırasıyla % 101 (% 90 -% 113; Cmaks) ve % 96 (% 91 -% 102; EAA) (n = 15) olup, nintedanibin birlikte uygulanmasının etinilestradiol ve levonorgestrelin plazma maruziyeti üzerinde herhangi bir etkisi olmadığını göstermektedir.
Maruziyet yanıt ilişkisi
İPF ve progresif fenotipli diğer kronik fibrozan İAH hastalarının maruziyet yanıt ilişki analizleri, nintedanibin plazma maruziyeti ile ALT ve/veya AST yükselmeleri arasında zayıf bir ilişki olduğunu göstermiştir. Plazma maruziyeti her ne kadar risk belirleyici bir faktör olarak dışlanamaz ise de, uygulanan gerçek doz, herhangi bir yoğunluktaki diyare gelişme riskinin daha iyi bir öngörücüsü olabilir (bkz. Bölüm 4.4).
5.3. Klinik öncesi güvenlilik verileri
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Kapsül içeriği
Orta zincirli trigliseridler
Katı yağ (bitkisel kaynaklıdır) Soya lesitini (E322)
Kapsül gövdesi
Jelatin (domuz derisi kaynaklı) Gliserol (%85)
Titanyum dioksit (E171) Kırmızı demir oksit (E172) Sarı demir oksit (E172)
Baskı mürekkebi
Şellak glaze (Coccus Lacca adlı böcekten elde edilir) Siyah demir oksit (E172)
Propilen glikol (E1520)
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25 °C'nin altındaki oda sıcaklığında saklayınız. Nemden korumak için orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Her biri 10 kapsül içeren alüminyum/alüminyum blisterler, 60 kapsül içeren ambalajlarda piyasaya sunulur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kapsül içeriği ile temas edilmesi halinde eller hemen bol su ile yıkanmalıdır.
Kullanılmamış olan ürün ya da atık materyaller, âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir.
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | A16391 |
| Satış Fiyatı | 36512.32 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 36512.32 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693190093 |
| Etkin Madde | Nintedanib |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |