OPDIVO 100 mg/ 10ml IV inf. çöz. kons. içeren 1 flakon Farmakolojik Özellikler
{ Nivolumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
ine dayanarak, nivolumabın araç ve makine kullanma becerisini etkilemesi beklenmez. Yorgunluk gibi potansiyel advers reaksiyonlara yol açabilmesi nedeniyle (bkz. Bölüm 4.8), hastalara OPDIVO'nun kendilerini ters bir şekilde etkilemediğinden emin olana dek araç veya makine kullanmaları konusunda dikkatli olmaları önerilmelidir.
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar,antikor ilaç ATC kodu: L01FF01.
Etki mekanizması
Nivolumab, programlanmış ölüm-1 (PD-1) reseptörüne bağlanan ve PD-L1 ve PD-L2 ile etkileşimi bloke eden insan immünoglobulin G4 (IgG4) monoklonal antikorudur (HuMAb).
PD-1 reseptörü, T-hücre immün yanıtlarının kontrolüne katıldığı gösterilmiş olan, T-hücre aktivitesinin negatif bir düzenleyicisidir. PD-1'in, antijen sunucu hücreler tarafından ve belki de tümör veya tümör mikroçevresindeki diğer hücreler tarafından da eksprese edilebilen PD-L1 ve PD-L2 ligandlarıyla bağlanması, T-hücre proliferasyonunun ve sitokin salımının
inhibisyonu ile sonuçlanır. Nivolumab, PD-1'in PD-L1 ve PD-L2 ligandlarına bağlanmasını bloke ederek, anti-tümör yanıtlar dahil, T-hücresi yanıtlarını arttırır. Genetik olarak özdeş fare modellerinde, bloke edici PD-1 aktivitesi, tümör büyümesinin azalması ile sonuçlanmıştır.
Klinik etkililik ve güvenlilik
Doz/maruziyet etkililik ve güvenlilik ilişkilerinin modellenmesine dayanarak, her 2 haftada bir 240 mg veya her 2 haftada bir 3 mg/kg nivolumab arasında etkililik ve güvenlilik açısından klinik olarak anlamlı bir fark bulunmamaktadır. Ek olarak, bu ilişkilere dayanarak, RHK'de 4 haftada bir 480 mg veya her 2 haftada bir 3 mg/kg nivolumab dozu arasında klinik olarak anlamlı bir fark görülmemiştir.
Melanom
İlerlemiş melanom tedavisi
Dakarbazin karşısında randomize faz 3 çalışma (CA209066)
Nivolumab 3 mg/kg'ın ilerlemiş (rezeke edilemeyen veya metastatik) melanom tedavisi için güvenliliği ve etkililiği bir faz 3, randomize, çift kör çalışmada (CA209066) değerlendirilmiştir. Çalışmaya doğrulanmış, tedavi uygulanmamış, Evre III veya IV BRAF vahşi tip melanomu olan ve ECOG performans durumu 0 veya 1 olan yetişkin hastalar (18 yaş ve üzeri) dahil edilmiştir. Aktif otoimmün hastalığı, oküler melanomu veya aktif beyin ya da leptomeningeal metastazları bulunan hastalar çalışmaya alınmamıştır.
Toplam 418 hasta her 2 haftada bir 60 dakika süreyle intravenöz yoldan uygulanan 3 mg/kg dozunda nivolumab (n = 210) veya her 3 haftada bir 1000 mg/m2 dozunda dakarbazin (n = 208) almak üzere randomize edilmiştir. Randomizasyon, tümör PD-L1 durumu ve M evresi (M1c karşısında M0/M1a/M1b) ile basamaklandırılmıştır. Tedavi, klinik yarar gözlendiği sürece veya tedavi hasta tarafından artık tolere edilemeyinceye kadar sürdürülmüştür. Hastalık progresyonundan sonra tedaviye, araştırmacı tarafından belirlendiği gibi klinik yarar gören ve çalışma ilacı ile önemli bir advers olay yaşamamış olan hastalarda izin verilmiştir. Tümör değerlendirmeleri, randomizasyondan 9 hafta sonra, ardından ilk yıl her 6 haftada bir ve bunu takip eden yıllarda her 12 haftada bir, Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST), versiyon 1.1 uyarınca gerçekleştirilmiştir. Primer etkililik sonlanım noktası genel sağkalımdı (OS). Kilit sekonder etkililik sonlanım noktası ölçümleri, araştırmacı tarafından değerlendirilen progresyonsuz sağkalım (PFS) ve objektif yanıt oranı (ORR) idi.
İki grup arasında başlangıç özellikleri dengelenmişti. Yaş ortalaması 65 olup (aralık: 18 - 87)
%59'u erkek ve %99,5'i beyazdı. Başlangıç ECOG performans durumu puanı 0 (%64) veya 1 (%34) idi. Hastaların %61'i, çalışmaya girişte evre M1c hastalığa sahipti. %74'ü kutanöz melanom, %11'i mukozal melanom; %35'i ise PD-L1 pozitif melanoma sahipti (>%5 tümör hücresi membran ekspresyonu). Hastaların %16'sı, daha önce adjuvan tedavi görmüş olup en yaygın kullanılan adjuvan tedavi interferondu (%9). Hastaların %4'ünde çalışma girişinde beyin metastazı, %37'sinde ise ULN'den yüksek LDH düzeyi mevcuttu.
OS için Kaplan-Meier eğrileri Şekil 1'de gösterilmektedir.
Progresyonsuz sağkalım
Şekil 1. Kaplan-Meier OS eğrileri (CA209066)
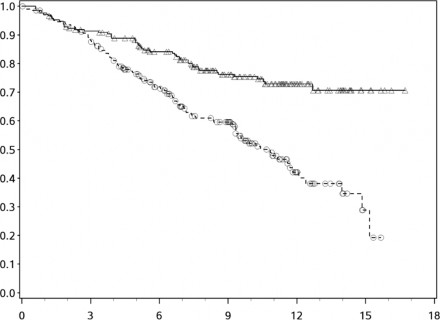
Genel Sağkalım (Ay)
Riskli gönüllülerin sayısı | ||||||
Nivolumab | ||||||
210 | 185 | 150 | 105 | 45 | 8 | 0 |
Dakarbazin | ||||||
208 | 177 | 123 | 82 | 22 | 3 | 0 |
─∆─── Nivolumab (olaylar: 50/210), medyan ve %95 GA: geçerli değil.
- - -- - - Dakarbazin (olaylar: 96/208), medyan ve %95 GA: 10,84 (9,33 - 12,09)
Gözlenen OS yararı, başlangıç ECOG performans durumu, M evresi, beyin metastaz öyküsü ve başlangıç LDH düzeyi dahil hasta alt gruplarında tutarlı şekilde gösterilmiştir.
Tümörlerin PD-L1 negatif veya PD-L1 pozitif olarak sınıflandırılmasından bağımsız olarak sağkalım yararı gözlenmiştir (%5 veya %10'luk tümör membranı ekspresyonu eşik değeri).
Elde edilen veriler, nivolumabın geç etki başlangıcına sahip olduğunu ve kemoterapiden sonra nivolumab yararının ortaya çıkmasının 2-3 ay sürebileceğini göstermiştir.
Yanıt oranları, yanıta kadar geçen süre ve yanıt süreleri Tablo 9'da gösterilmektedir.
Tablo 9: Etkililik Sonuçları (CA209066)
| nivolumab (n = 210) | dakarbazin (n = 208) |
Genel sağkalım |
| |
Olaylar | 50 (%23,8) | 96 (%46,2) |
Risk oranı | 0,42 | |
%99,79 GA | (0,25 - 0,73) | |
%95 GA | (0,3 - 0,6) | |
p-değeri | < 0,0001 | |
Medyan (%95 GA) | Erişilmedi | 10,8 (9,33 - 12,09) |
Oran (%95 GA) |
| |
6. ayda | 84,1 (78,3 - 88,5) | 71,8 (64,9 - 77,6) |
12. ayda | 72,9 (65,5 - 78,9) | 42,1 (33 - 50,9) |
Progresyonsuz sağkalım |
| |
Olaylar | 108 (%51,4) | 163 (%78,4) |
Risk oranı | 0,43 | |
%95 GA | (0,34 - 0,56) | |
p-değeri | < 0,0001 | |
Medyan (%95 GA) | 5,1 (3,48 - 10,81) | 22 (2,1 - 2,4) |
Oran (%95 GA) |
| |
6. ayda | 48 (40,8 - 54,9) | 18,5 (13,1 - 24,6) |
12. ayda | 41,8 (34 - 49,3) | NA |
Objektif yanıt | 84 (%40) | 29 (%13,9) |
(%95 GA) | (33,3 - 47) | (9,5 - 19,4) |
Olasılık oranı (%95 GA) | 4,06 (2,52 - 6,54) |
|
p-değeri | < 0,0001 |
|
Tam yanıt (CR) | 16 (%7,6) | 2 (%1) |
Kısmi yanıt (PR) | 68 (%32,4) | 27 (%13) |
Stabil hastalık (SD) | 35 (%16,7) | 46 (%22,1) |
Medyan yanıt süresi |
| |
Ay (aralık) | Erişilmedi (0 - 12,5) | 6 (1,1 - 10) |
Yanıta kadar medyan süre |
| |
Ay (aralık) | 2,1 (1,2 - 7,6) | 2,1 (1,8 - 3,6) |
Ҡgizlenen bir gözlemi gösterir.
Kemoterapi karşısında randomize faz 3 çalışma (CA209037)
Nivolumab 3 mg/kg'ın ilerlemiş (rezeke edilemeyen veya metastatik) melanom tedavisi için güvenliliği ve etkililiği bir faz 3, randomize, açık etiketli çalışmada (CA209037) değerlendirilmiştir. Çalışma ipilimumab tedavisi sırasında veya sonrasında progresyon görülen ve (BRAF V600 mutasyonu pozitif ise) BRAF kinaz inhibitörü tedavisi sırasında veya sonrasında progresyon görülen hastaları içermiştir.
Aktif otoimmün hastalığı ve oküler melanomu, aktif beyin veya leptomeningeal metastazları olanlar veya iyileşmiş bulantı, yorgunluk, infüzyon reaksiyonları veya endokrinopatiler hariç önceden ipilimumab ile ilişkili yüksek dereceli (CTCAE v4.0 uyarınca Derece 4) advers reaksiyon yaşayan hastalar çalışmaya dahil edilmemiştir.
Toplam 405 hasta her 2 haftada bir 60 dakika süreyle intravenöz yoldan uygulanan 3 mg/kg dozunda nivolumab (n = 272) veya araştırmacının kararına göre dakarbazin (her 3 haftada bir 1000 mg/m2) veya karboplatin (her 3 haftada EAA 6) ve paklitaksel (her 3 haftada bir
175 mg/m2) içeren kemoterapi (n = 133) almak üzere randomize edilmiştir. Randomizasyon, BRAF ve tümör PD L1 durumu ve önceki ipilimumab tedavisine verilen en iyi yanıta göre basamaklandırılmıştır.
Yardımcı primer etkililik sonuç ölçümleri, nivolumab tedavisi gören ilk 120 gönüllüde RECIST versiyon 1.1 kullanılarak bağımsız bir radyolojik inceleme komitesi (IRRC) tarafından ölçüldüğü gibi doğrulanmış ORR ve nivolumab ile elde edilen OS'nin kemoterapi ile karşılaştırılmasını içermiştir. İlave sonuç ölçümleri, yanıt süresi ve zamanıydı.
Hastaların medyan yaşı 60 idi (aralık: 23 - 88). Hastaların yüzde %64'ü erkekti ve %98'i beyazdı. ECOG performans skorları hastaların %61'i için 0 ve %39'u için 1 idi. Hastaların çoğunluğu (%75) çalışmaya girişte evre M1c hastalığa sahipti. Hastaların %73'ü kutanöz melanom ve %10'u mukozal melanom idi.
Önceden alınan sistemik tedavi sayısı hastaların %27'sinde 1, %51'inde 2 ve %21'inde
> 2 idi. Hastaların %22'sinin BRAF mutasyonu pozitifti ve %50'si PD-L1 pozitifti. Hastaların
%64'ü, önceki ipilimumab tedavisinden klinik yarar (CR/PR ya da SD) görmemiştir.
Başlangıç özellikleri, beyin metastazı olan hastaların oranı (nivolumab grubu ve kemoterapi grubunda sırasıyla %19 ve %13) ve başlangıç LDH düzeyi ULN'den yüksek olan hastaların oranı (sırasıyla %51 ve %35) hariç, gruplar arasında dengeliydi.
Bu nihai ORR analizi döneminde, en az 6 ay takip edilen nivolumab alan 120 hastadan ve kemoterapi alan 47 hastadan alınan sonuçlar analiz edilmiştir. Etkililik sonuçları Tablo 10'da sunulmuştur.
Tablo 10: En iyi genel yanıt, zaman ve yanıt süresi (CA209037)
| nivolumab (n = 120) | kemoterapi (n = 47) |
Objektif yanıt (IRRC) |
38 (%31,7) |
5 (%10,6) |
(%95 GA) | (23,5 - 40,8) | (3,5 - 23,1) |
Tam yanıt (CR) | 4 (%3,3) | 0 |
Kısmi yanıt (PR) | 34 (%28,3) | 5 (%10,6) |
Stabil hastalık (SD) | 28 (%23,3) | 16 (%34) |
Medyan Yanıt Süresi |
| |
Ay (aralık) | Erişilmedi | 3,6 (Mevcut değildir) |
Yanıta kadar medyan süre |
| |
Ay (aralık) | 2,1 (1,6 - 7,4) | 3,5 (2,1 - 6,1) |
Elde edilen veriler, nivolumabın geç etki başlangıcına sahip olduğunu ve kemoterapiden sonra nivolumab yararının ortaya çıkmasının 2-3 ay sürebileceğini göstermiştir.
Güncellenmiş analiz (24 aylık izlem)
Randomize edilmiş tüm hastalarda ORR nivolumab grubunda %27,2 (%95 GA: 22 – 32,9),
kemoterapi grubunda ise %9,8 (%95 GA: 5,3 – 16,1) olarak belirlenmiştir. Medyan yanıt
süresinin sırasıyla 31,9 ay (aralık: 1,4+ - 31,9) ve 12,8 ay (aralık: 1,3+ - 13,6+) olduğu tespit edilmiştir. Nivolumab – kemoterapi karşılaştırmasına ilişkin PFS HR değerinin 1,03 (%95
GA: 0,78 – 1,36) olduğu belirlenmiştir. ORR ve PFS, IRRC tarafından RECIST versiyon 1.1 ile değerlendirilmiştir.
Nihai OS analizinde nivolumab ile kemoterapi arasında istatistiksel açıdan anlamlı fark gözlenmemiştir. Primer OS analizi, takip eden tedaviler hesaba katılacak şekilde ayarlanmamıştır ve kemoterapi kolundaki hastaların 54'ü (%40,6) bir anti-PD1 tedavisi görmüştür. Tedaviyi bırakanlar, sonraki tedavilerin dengesizliği ve başlangıç faktörlerindeki farklılıklar OS'de karışıklığa neden olmuş olabilir. Kemoterapi kolundakilere kıyasla nivolumab kolunda bulunan daha fazla hastanın kötü prognostik faktörlere (yüksek LDH ve beyin metastazları) sahip olduğu belirlenmiştir.
BRAF durumuna göre etkililik:
BRAF mutasyonu-pozitif melanom görülen ve görülmeyen hastalarda nivolumaba objektif yanıtlar (eş primer sonlanım noktası tanımlamasına göre) gözlenmiştir. ORR'ler BRAF mutasyonu-pozitif alt grupta nivolumab için %17 (%95 GA: 8,4 – 29) kemoterapi için %11
(%95 GA: 2,4 – 29,2), BRAF yabanıl tip alt grupta ise sırasıyla %30 (%95 GA: 24 – 36,7) ve
%9 (%95 GA: 4,6 – 16,7) olarak belirlenmiştir.
Nivolumab-kemoterapi karşılaştırmasına ilişkin PFS HR değerleri BRAF mutasyonu-pozitif hastalar için 1,58 (%95 GA: 0,87 – 2,87), BRAF yabanıl tip hastalar içinse 0,82 (%95 GA: 0,6 – 1,12) olarak belirlenmiştir. Nivolumab-kemoterapi karşılaştırmasına ilişkin OS HR değerleri BRAF mutasyonu-pozitif hastalar için 1,32 (%95 GA: 0,75 – 2,32), BRAF yabanıl
tip hastalar içinse 0,83 (%95 GA: 0,62 – 1,11) olarak belirlenmiştir.
Tümör PD-L1 ekspresyonuna göre etkililik:
Tümör PD-L1 ekspresyonundan bağımsız şekilde nivolumaba objektif yanıtlar gözlenmiştir. Bununla birlikte, bu biyobelirtecin (tümör PD-L1 ekspresyonu) rolü tam olarak açıklığa kavuşturulmamıştır.
Tümör PD-L1 ekspresyonu ≥%1 olan hastalarda ORR nivolumab için %33,5 (n=179; %95 GA: 26,7 - 40,9) kemoterapi içinse %13,5 (n=74; %95 GA: 6,7 - 23,5) olarak belirlenmiştir. Tümör PD-L1 ekspresyonu <%1 olan hastalarda IRRC'ye göre ORR sırasıyla %13 (n=69;
%95 GA: 6,1 – 23,3) ve %12 (n=25; %95 GA: 2,5 – 31,2) olarak belirlenmiştir.
Nivolumab-kemoterapi karşılaştırmasına ilişkin PFS HR değerleri tümör PD-L1 ekspresyonu
≥%1 olan hastalarda 0,76 (%95 GA: 0,54 – 1,07), tümör PD-L1 ekspresyonu <%1 olan
hastalarda ise 1,92 (%95 GA: 1,05 – 3,5) olarak belirlenmiştir.
Nivolumab-kemoterapi karşılaştırmasına ilişkin OS HR değerleri tümör PD-L1 ekspresyonu
≥%1 olan hastalarda 0,69 (%95 GA: 0,49 – 0,96), tümör PD-L1 ekspresyonu <%1 olan
hastalarda ise 1,52 (%95 GA: 0,89 – 2,57) olarak belirlenmiştir.
Alt grupların küçük boyutu ve randomize edilmiş olan tüm popülasyonda OS'de istatistiksel açıdan anlamlı fark bulunmadığı göz önünde bulundurulduğunda, bu alt grup analizleri dikkatli şekilde yorumlanmalıdır.
Açık etiketli faz 1 doz yükseltme çalışması (MDX1106-03)
Nivolumabın güvenliliği ve etkililiği, malign melanom dahil çeşitli tümör tiplerinde yapılan bir faz 1, açık etiketli, doz yükseltme çalışmasında değerlendirilmiştir. Çalışmaya alınan daha önceden tedavi görmüş 306 hastanın 107'si melanom idi ve en fazla 2 yıl süreyle 0,1 mg/kg, 0,3 mg/kg, 1 mg/kg, 3 mg/kg veya 10 mg/kg dozunda nivolumab almışlardır. Bu hasta popülasyonunda, medyan 22,9 aylık yanıt süresi ile (%95 GA:17, NR) %9 (%95 GA: 2,6 -
22,1) 33 hastada (%31) objektif yanıt bildirilmiştir. Medyan PFS süresi 3,7 aydı (%95 GA:
1,9 - 9,3). Medyan OS 17,3 ay (%95 GA: 12,5 – 37,8), tahmini OS oranları ise 3 yılda %42
(%95 GA: 32 - 51), 4 yılda %35 (%95 GA: 26 - 44), 5 yılda ise %34 (%95 GA: 25 - 43) olarak
hesaplanmıştır (minimum izlem 45 ay).
İpilimumab monoterapisine karşı ipilimumabla kombinasyon halinde nivolumab ya da monoterapi olarak nivolumab ile randomize faz 3 çalışma (CA209067)
İpilimumab 3 mg/kg monoterapisine karşı ipilimumab ile kombinasyon halinde nivolumab 1 mg/kg veya nivolumab 3 mg/kg monoterapisinin ileri evre (rezeke edilemeyen ya da metastatik) melanom tedavisindeki güvenliliği ve etkililiği faz 3, randomize, çift-kör bir çalışmada değerlendirilmiştir (CA209067). Nivolumab içeren iki grup arasındaki farklar tanımlayıcı bir biçimde değerlendirilmiştir. Çalışma, rezeke edilemeyen doğrulanmış Evre III veya Evre IV melanomu olan yetişkin hastaları içermiştir. Hastaların ECOG performans durumu puanının 0 veya 1 olması gerekmiştir. Rezeke edilemeyen veya metastatik melanom için daha önce sistemik kanser tedavisi görmemiş olan hastalar çalışmaya kaydedilmiştir. Randomizasyondan en az 6 hafta önce tamamlandıysa, önceki adjuvan veya neoadjuvan tedaviye izin verilmiştir. Aktif otoimmün hastalığı, oküler/üveal melanom veya aktif beyin veya leptomeningeal metastazı olan hastalar çalışmaya dahil edilmemiştir.
Toplam 945 hasta; ipilimumab ile kombinasyon halinde nivolumab (n=314), nivolumab monoterapisi (n=316) ya da ipilimumab monoterapisi (n=315) almak üzere randomize edilmiştir. Kombinasyon kolundaki hastalara ilk 4 doz boyunca her 3 haftada bir 60 dakika süreyle nivolumab 1 mg/kg ve 90 dakika süreyle ipilimumab 3 mg/kg uygulanmış, bunu takiben her iki haftada bir monoterapi olarak nivolumab 3 mg/kg verilmiştir. Nivolumab monoterapi kolundaki hastalara her 2 haftada bir nivolumab 3 mg/kg uygulanmıştır. Karşılaştırma kolundaki hastalara 4 doz boyunca her 3 haftada bir intravenöz yoldan ipilimumab 3 mg/kg ve nivolumabla eşleştirilmiş plasebo uygulanmış, bunu her 2 haftada bir plasebo takip etmiştir. Randomizasyon PD-L1 ekspresyonu (≥% 5'e karşılık <% 5 tümör hücre membranı ekspresyonu), BRAF durumu ve Amerikan Ortak Kanser Komitesi (AJCC) evreleme sistemine göre aşama M'ye göre basamaklandırılmıştır. Tedaviye klinik yarar gözlenene veya tedavi artık tolere edilemeyene kadar devam edilmiştir. Tümör değerlendirmeleri randomizasyondan 12 hafta sonra, ardından ilk yıl için her 6 haftada bir ve daha sonra her 12 haftada bir yapılmıştır. Yardımcı primer sonuç ölçümleri progresyonsuz sağkalım ve OS idi. ORR ve yanıt süresi de değerlendirilmiştir.
Başlangıç özellikleri üç tedavi grubu arasında dengelenmiştir. Medyan yaş 61 yıl olup (aralık: 18 - 90), hastaların %65'i erkek ve %97'si beyazdı. ECOG performans durumu puanı 0 (%73) veya 1'di (%27). Hastaların çoğunda AJCC Evre IV hastalık (%93); çalışmaya girişte
%58'inde M1c hastalık mevcuttu. Hastaların %22'si daha once adjuvan tedavi almıştı. Hastaların %32'sinde BRAF mutasyonu pozitif melanom; %26,5'inde PD-L1 ≥ %5 tümör hücre membranı ekspresyonu mevcuttu. Hastaların %4'ü beyin metastazı öyküsüne ve hastaların %36'sı çalışmaya girişte ULN'den daha yüksek bir başlangıç LDH seviyesine sahipti. Ölçülebilir tümör PD-L1 ekspresyonu olan hastalar arasında, hastaların dağılımı üç tedavi grubunda dengelenmiştir. Tümör PD-L1 ekspresyonu, PD-L1 IHC 28-8 pharmDx tayini kullanılarak belirlenmiştir.
Primer analizde (minimum takip 9 ay), nivolumab grubunda medyan PFS 6,9 ay iken ipilimumab grubunda 2,9 aydı (HR = 0,57, %99,5 GA: 0,43, 0,76; p< 0,0001). İpilimumabla kombinasyon halindeki nivolumab grubunda medyan PFS 11,5 ay ile ipilimumab grubunda 2,9 aydı (HR = 0,42, %99,5 GA: 0,31, 0,57; p < 0,0001)
PFS sonuçları (minimum 90 aylık takip süresi ile) olarak Şekil 2'de (randomize edilmiş tüm popülasyon), Şekil 3'te (tümör PD-L1 %5 eşik değerinde) ve Şekil 4'te (tümör PD-L1 %1 eşik değerinde) gösterilmektedir.
Progresyonsuz sağkalım olasılığı
Şekil 2: Progresyonsuz sağkalım (CA209067)
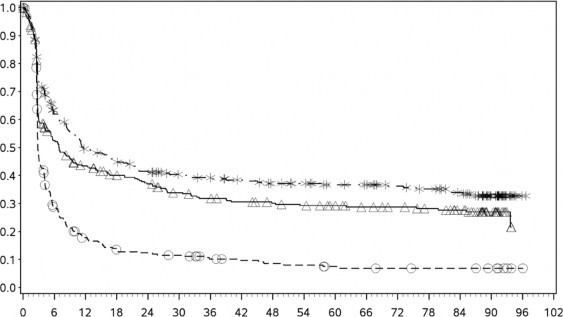
Progresyonsuz sağkalım (aylar)
Risk altındaki gönüllülerin sayısı | |||||||||||||||||
Nivolumab + ipilimumab | |||||||||||||||||
- - -* Nivolumab+ipilimumab (olaylar: 189/314), medyan ve %95 GA: 11,50 (8,90, 20,04).
12 ayda PFS oranı ve % 95 GA: %49 (44, 55), 60 ayda PFS oranı ve % 95 GA: %36 (32,
42), 90 ayda PFS oranı % 95 GA: %33 (27,39)
──∆─── Nivolumab (olaylar: 208/316), medyan ve %95 GA: 6,93 (5,13; 10,18)
12 ayda PFS oranı ve % 95 GA: %42 (36, 47), 60 ayda PFS oranı ve % 95 GA: %29 (24,
35), 90 ayda PFS oranı % 95 GA: %27 (22,33)
- - - İpilimumab (olaylar: 261/315), medyan ve %95 GA: 2,86 (2,79, 3,09).
12 ayda PFS oranı ve % 95 GA: %18 (14, 23), 60 ayda PFS oranı ve % 95 GA: %8 (5,
12), 90 ayda PFS oranı ve %95 GA CI: %7 (4,11)
İpilimumab karşısında nivolumab+ipilimumab -tehlike oranı ve %95 GA: 0,42 (0,35, 0,51)
İpilimumab karşısında nivolumab -tehlike oranı ve %95 GA: 0,53 (0,44, 0,64)
Nivolumab karşısında nivolumab+ipilimumab - tehlike oranı ve %95 GA: 0,79 (0,65, 0,97)
İpilimumaba (primer analiz) karşı Nivolumab+İpilimumab - HR (%99,5 GA): 0,42 (0,32-0,56); p- değeri: < 0,0001
İpilimumaba karşı Nivolumab (primer analiz) - HR (%99,5 GA): 0,55 (0,42-0,73); p-değeri: < 0,0001 Nivolumaba karşı Nivolumab+İpilimumab (tanımlayıcı analiz) - HR (%95 GA): 0,76 (0,62-0,95)
Şekil 3: PD-L1 ekspresyonuna göre progresyonsuz sağkalım: %5 eşik (CA209067)
Progresyonsuz sağkalım olasılığı
PD L1 ekspresyonu < %5
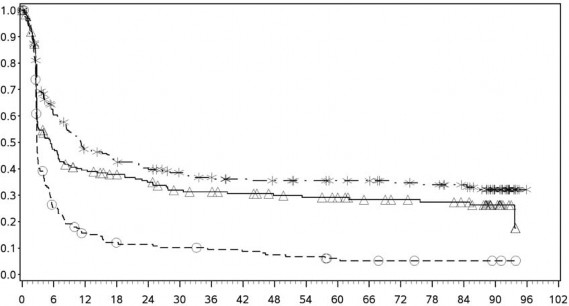
Progresyonsuz sağkalım (aylar)
Risk altındaki gönüllülerin sayısı |
Nivolumab + ipilimumab |
- - -*- - - - Nivolumab+ipilimumab (olaylar: 127/210), medyan ve %95 GA: 11,17 (7,98, 17,51)
──∆─── Nivolumab (olaylar: 139/208), medyan ve %95 GA: 5,39 (2,96, 7,13)
- - -- - - İpilimumab (olaylar: 171/202), ), medyan ve %95 GA: 2,79 (2,76, 3,02)
İpilimumab karşısında nivolumab+ipilimumab tehlike oranı ve %95 GA: 0,42 (0,33, 0,53)
İpilimumab karşısında nivolumab - tehlike oranı ve %95 GA: 0,54 (0,43, 0,68)
Nivolumab karşısında nivolumab +ipilimumab tehlike oranı ve %95 GA: 0,77 (0,61, 0,98)
Progresyonsuz sağkalım olasılığı
PD-L1 ekspresyonu ≥ %5
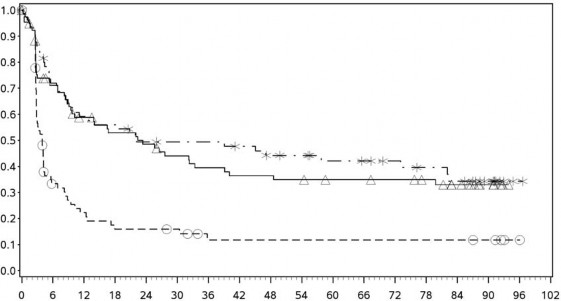
Progresyonsuz sağkalım (aylar)
Risk altındaki gönüllülerin sayısı | |||||||||||||||||
Nivolumab + ipilimumab |
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
- -* Nivolumab+ipilimumab (olaylar: 36/68), medyan ve %95 GA: 22,11 (9,72, 82,07)
──∆─── Nivolumab (olaylar: 48/80), medyan ve %95 GA: 22,34 (9,46, 39,13)
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Yeterli veri mevcut değildir.
Dağılım:
Yeterli veri mevcut değildir.
Biyotransformasyon:
Nivolumabın metabolik yolağı karakterize edilmemiştir. Tamamen insan IgG4 monoklonal antikoru olan nivolumabın, endojen IgG ile aynı şekilde katabolik yolaklar aracılığıyla küçük peptidlere ve amino asitlere bozunması beklenmektedir.
Eliminasyon:
Nivolumabın klirensi (CL) zaman içinde azalmaktadır ve başlangıç değerlerine göre meydana gelen ortalama maksimal azalma (% varyasyon katsayısı [%CV]) %26'dır (%32,6) ve bu, metastatik tümörlere sahip hastalarda 7,91 mL/saatlik (%46) bir geometrik ortalama kararlı durum klirensi (CLss) (%CV) ortaya çıkarmaktadır; CLss'deki düşüş klinik açıdan anlamlı kabul edilmemektedir. Kararlı durumda metastatik melanom hastalarındakine kıyasla melanomun tamamen rezeke edilmiş olduğu hastalarda geometrik ortalama popülasyon klirensi %24 daha düşük olduğundan, bu hastalarda nivolumabın klirensi zaman içinde azalmamaktadır. Kararlı durumda geometrik ortalama dağılım hacmi (Vd) (%CV) 6,6 L'dir (%24,4), geometrik ortalama eliminasyon yarı ömrü ise (t1/2) 25 gündür (%55,4). 2 haftada bir 3 mg/kg dozunda uygulandığında nivolumabın kararlı durum konsantrasyonlarına 12. haftada ulaşılmıştır ve sistemik birikim yaklaşık 4 kat olmuştur.
30 dakikalık bir infüzyonun ardından öngörülen nivolumab maruziyeti 60 dakikalık bir infüzyonun ardından gözlenenle karşılaştırılabilir niteliktedir.
Nivolumabın klirensi (CL) artan vücut ağırlığı ile birlikte artmıştır. Vücut ağırlığına göre normalize edilmiş doz, geniş bir vücut ağırlığı aralığında (34-162 kg), aşağı yukarı tek düze bir kararlı durum dip konsantrasyonu ortaya çıkarmıştır.
Doğrusallık/Doğrusal Olmayan Durum:
Nivolumabın farmakokinetiği 0,1 ila 10 mg/kg'lık doz aralığında doğrusaldır.
cHL hastalarında nivolumab CL, KHDAK'ne göre yaklaşık %32 daha düşük olmuştur. Adjuvan Melanom hastalarında, ilerlemiş melanoma kıyasla nivolumab başlangıç CL yaklaşık
%40 daha düşüktü ve kararlı durum CL yaklaşık %20 daha düşüktü. Mevcut güvenlilik verilerine göre, CL'deki bu azalmalar klinik olarak anlamlı değildi.
İpilimumab ile kombinasyon halinde OPDIVO:
Nivolumab 1 mg/kg, ipilimumab 3 mg/kg ile kombinasyon halinde uygulandığında, nivolumab CL değeri %29, ipilimumab CL değeri %9 artmış ve bu artış klinik olarak anlamlı kabul edilmemiştir. Nivolumab 3 mg/kg, ipilimumab 1 mg/kg ile kombinasyon halinde uygulandığında, nivolumab CL değeri %1 artmış ve ipilimumab CL değeri %1,5 azalmış ve bu değişiklikler klinik olarak anlamlı görülmemiştir.
İpilimumab ile kombinasyon halinde uygulandığında, nivolumabın CL değeri anti-nivolumab antikorlarının varlığında %20 artmış ve ipilimumabın CL değeri anti-ipilimumab
antikorlarının varlığında %5,7 artmıştır. Bu değişiklikler klinik olarak anlamlı kabul edilmemiştir.
İpilimumab ve kemoterapi ile kombinasyon halinde OPDIVO:
3 haftada bir nivolumab 360 mg, 6 haftada bir ipilimumab 1 mg/kg ve 2 kür kemoterapi ile kombinasyon halinde uygulandığında, nivolumab CL değeri yaklaşık %10 düşmüş ve ipilimumab CL değeri yaklaşık %22 artmış ve bu artış klinik olarak anlamlı kabul edilmemiştir.
Hastalardaki karakteristik özellikler:
Popülasyon FK analizinde nivolumab CL'sinde yaş, cinsiyet, ırk, solid tümör tipi, tümör boyutu ve hepatik yetmezliğe dayanarak herhangi bir fark tespit edilmemiştir. ECOG durumu, başlangıç glomerüler filtrasyon hızı (GFR), albümin, kilo ve hafif karaciğer yetmezliği nivolumab CL'sini etkilese de, bu etki klinik olarak anlamlı değildi.
Nivolumabın klasik Hodgkin lenfoma hastalarındaki CL'sinin KHDAK'li hastalardakine kıyasla yaklaşık %32 daha düşük olduğu belirlenmiştir. Mevcut güvenlilik verileri göz önünde bulundurulduğunda CL'deki bu azalma klinik açıdan anlamlı görülmemiştir.
Böbrek yetmezliği
Popülasyon FK analizlerinde böbrek yetmezliğinin nivolumab CL'si üzerindeki etkisi normal böbrek fonksiyonuna sahip olan hastalara kıyasla (GFR ≥ 90 mL/dakika/1,73 m2; n = 342) hafif (GFR < 90 ve ≥ 60 mL/min/1,73 m2; n = 379), orta (GFR < 60 ve ≥ 30 mL/min/1.73 m2; n = 179) veya şiddetli (GFR < 30 ve ≥ 15 mL/dak/1,73 m2; n = 2) böbrek yetmezliği olan hastalarda değerlendirilmiştir. Hafif veya orta şiddetli böbrek yetmezliği olan hastalarla normal böbrek fonksiyonuna sahip hastalar arasında nivolumab CL'sinde klinik olarak anlamlı farklar tespit edilmemiştir. Şiddetli böbrek yetmezliği olan hastalardan elde edilen veriler, bu popülasyonla ilgili bir sonuç çıkaramayacak kadar sınırlıdır (bkz. Bölüm 4.2).
Karaciğer yetmezliği
Bir popülasyon FK analizinde karaciğer yetmezliğinin nivolumab CL'si üzerindeki etkisi normal karaciğer fonksiyonuna sahip hastalara kıyasla (toplam bilirubin ve AST ≤ ULN; n = 804) hafif karaciğer yetmezliği (Ulusal Kanser Enstitüsünün hepatik fonksiyon bozukluğu kriterleri kullanılarak tanımlandığı şekilde toplam bilirubin > 1 × ila 1,5 × ULN veya AST > ULN; n = 92) olan hastalarda değerlendirilmiştir. Hafif karaciğer yetmezliği olan hastalarla normal karaciğer fonksiyonuna sahip hastalar arasında nivolumab CL'sinde klinik olarak anlamlı farklar tespit edilmemiştir. Nivolumab, orta (toplam bilirubin > 1,5 × ila 3 × üst normal sınır [ULN] ve herhangi bir AST) veya şiddetli (toplam bilirubin > 3 × ULN ve herhangi bir AST) karaciğer yetmezliği olan hastalarda araştırılmamıştır (bkz. Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
İLAÇ GENEL BİLGİLERİ
Bristol-Myers Squibb İlaçları Inc.
| Geri Ödeme Kodu | A16774 |
| Satış Fiyatı | 38053.16 TL [ 2 May 2025 ] |
| Önceki Satış Fiyatı | 38053.16 TL [ 25 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699726765502 |
| Etkin Madde | Nivolumab |
| ATC Kodu | L01XC17 |
| Birim Miktar | 100/10 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Porto riko ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |