OPSENTAN 10 mg film kaplı tablet (30 tablet) Farmakolojik Özellikler
{ Masitentan }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötikgrup: Diğer antihipertansifler, pulmoner arteriyel hipertansiyon için antihipertansifler
ATC kodu: C02KX04
Etki mekanizması
Endotelin (ET)-1 ve reseptörleri (ETve ET) vazokonstriksiyon, fibroz, proliferasyon, hipertrofi ve enflamasyon gibi çeşitli etkilere aracılık eder. PAH gibi hastalıklarda lokal ET sistemi yukarı regüle edilir (up-regulation) ve vasküler hipertrofi ve organ hasarında rol oynar.
Masitentan hem EThem de ETreseptörü üzerinde etkin olan oral olarak aktif, güçlü bir endotelin reseptör antagonisti olup, ETiçin ET'ye göre in vitro yaklaşık 100 kat daha seçicidir. Masitentan insan pulmoner arteriyel düz kas hücrelerinde ET reseptörleri için yüksek afinite ve sürekli bağlanma gösterir. Bu da vazokonstriksiyon ve düz kas hücresi proliferasyonuyla sonuçlanan ikinci haberci sistemlerin endotelin aracılı aktivasyonunu önler.
Klinik etkililik ve güvenlilik
Pulmoner Arteriyel Hipertansiyonu (PAH) olan hastalarda etkililik
Semptomatik PAH'ı olan 742 hastada yürütülen çok merkezli, çift kör, plasebo kontrollü, paralel gruplu, olay güdümlü, Faz 3 sonuç çalışmasında (AC-055-302/SERAPHIN), hastalar morbidite ve mortalite üzerindeki uzun süreli etkiyi değerlendirmek üzere üç tedavi grubuna randomize edilmiştir (plasebo [N = 250], günde bir kez 3 mg [N = 250] ve 10 mg [N = 242] masitentan).
Başlangıçta, kaydedilen hastaların büyük kısmına (%64), oral fosfodiesteraz inhibitörleri (%61) ve / veya inhale / oral prostanoidlerle (%6) PAH için stabil dozda spesifik bir tedavi uygulanmakta idi.
Primer sonlanım noktası, çift kör tedavinin sonuna kadar ölüm, atriyal septostomi ya da akciğer nakli, intravenöz (İ.V.) ya da subkütanöz (S.C.) prostanoidlere başlanması veya âdiğer PAH kötüleşmesi' olarak tanımlanan ilk morbidite veya mortalite olayının oluşumuna kadar geçen süre olarak belirlenmiştir. âDiğer PAH kötüleşmesi' şu üç
bileşenin birlikte varlığı olarak tanımlanmıştır: 6 dakika yürüme mesafesinde (6DYM) başlangıca göre en az %15 oranında sürekli azalma, ve PAH semptomlarının kötüleşmesi (WHO fonksiyonel sınıfının veya sağ kalp yetmezliğinin kötüleşmesi) ve PAH için yeni tedavi ihtiyacı. Tüm olaylar, tedavi randomizasyonuna körleştirilen bağımsız bir karar komitesi tarafından doğrulanmıştır.
Tüm hastalar çalışmanın sonuna kadar hayati durumları açısından takip edilmiştir. Çalışma sonu, önceden belirlenen sayıda primer sonlanım noktası olayına ulaşıldığında bildirilmiştir. Tedavi sonu ile çalışma sonu arasındaki dönemde, hastalar açık etiketli masitentan 10 mg veya alternatif PAH tedavisi alabilmiştir. Medyan çift kör tedavi süresi 115 hafta olmuştur (maksimum 188 hafta masitentan tedavisi).
Tüm hastaların ortalama yaşı 46 olup (aralık: 12-85 yaş; 20 hasta 18 yaş altı, 706 hasta 18-74 arası ve 16 hasta 75 yaş ve üzeri), gönüllülerin büyük kısmı beyaz ırk (%55) ve kadındır (%77). Hastaların yaklaşık %52, %46 ve %2'si sırasıyla WHO fonksiyonel sınıf II, III ve IV'tedir.
Çalışma popülasyonundaki en yaygın etiyoloji idiyopatik veya kalıtsal PAH olup (%57), takip eden etiyolojiler bağ doku hastalıklarına bağlı PAH (%31), düzeltilmiş basit konjenital kalp hastalığı ile ilişkili PAH (%8) ve diğer etiyolojilerle ilişkili PAH'tır (ilaç ve toksinler [%3] ve HIV [%1]).
Sonlanım noktaları
Masitentan 10 mg tedavisi, tedavi sonuna kadar kompozit morbidite-mortalite sonlanım noktasında plaseboya göre %45 oranında risk azalması sağlamıştır (tehlike oranı [HR] 0,55;
%97,5 GA: 0,39 ile 0,76; logrank p < 0,0001) [Şekil 1 ve Tablo 1]. Tedavi etkisi erken ortaya çıkmış ve çalışma boyunca sürmüştür.
Masitentan 10 mg'ın primer sonlanım noktası üzerindeki etkililiği, monoterapi veya başka bir PAH tedavisi ile kombinasyon durumunda, tüm WHO FS gruplarında (I/II ve III/IV) ve yaş, cinsiyet, etnik köken, coğrafi bölge, ve etiyoloji alt grupları arasında tutarlı olmuştur.
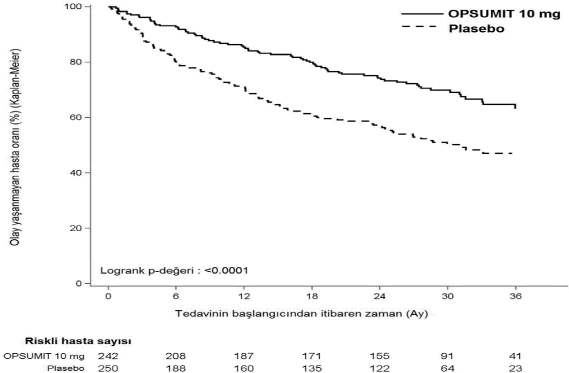
Şekil 1. SERAPHIN'de ilk morbidite-mortalite olayına ilişkin Kaplan-Meier tahminleri
Tablo 1. Sonuç olaylarının özeti
Sonlanım | Olay yaşayan hastalar | Tedavi Karşılaştırması: Masitentan 10 mg ve Plasebo | ||||
noktası ve İstatistikler |
Plasebo (N = 250) |
Masitentan 10 mg (N = 242) |
Mutlak Risk Azalması |
Relatif Risk Azalması | HR (%97,5GA) |
Logrank p değeri |
Morbidite- mortalite olayı |
%53 |
%37 |
%16 | %45 (%24; %61) | 0,55 (0,39; 0,76) |
< 0,0001 |
Ölüm n (%) |
19 (%7,6) |
14 (%5,8) |
%2 | %36 (â%42; %71) | 0,64 (0,29; 1,42) |
0,20 |
PAH Kötüleşmesi n (%) | 93 (%37,2) |
59 (%24,4) |
%13 |
%49 (%27, %65) |
0,51 (0,35; 0,73) |
< 0,0001 |
i.v./s.c. Prostanoide Başlama n (%) |
6 (%2,4) |
1 (%0,4) |
%2 | |||
Çalışma sonuna kadar tüm nedenlere bağlı ölüm sayısı masitentan 10 mg grubunda 35 ve plasebo grubunda 44'tür (HR 0,77; %97,5 GA: 0,46 ile 1,28).
Tedavi sonuna kadar PAH'a bağlı ölüm veya PAH nedeniyle hastaneye yatma riski, masitentan 10 mg (50 olay) alan hastalarda plaseboya göre (84 olay) %50 oranında azalmıştır (HR 0,50; %97,5 GA: 0,34 ile 0,75; logrank p < 0,0001). 36 ayda, plasebo alan hastaların
%44,6'sı ve masitentan 10 mg alan hastaların %29,4'ü (Mutlak Risk Azalması = %15,2) PAH nedeniyle hastaneye yatırılmış veya PAH'a bağlı bir nedenden ölmüştür.
Semptomatik sonlanım noktaları
Egzersiz kapasitesi sekonder sonlanım noktası olarak değerlendirilmiştir. Masitentan 10 mg tedavisi 6. ayda 6DYM'de 22 metrelik plaseboya göre düzeltilmiş ortalama artış sağlamıştır (%97,5 GA: 3 ile 41; p = 0,0078). 6DYM'nin fonksiyonel sınıfa göre değerlendirmesi, FS III/IV olan hastalarda başlangıçtan 6. Aya kadar 37 metrelik plaseboya göre düzeltilmiş ortalama artışla (%97,5 GA: 5 ile 69) ve FS I/II olan hastalarda 12 metrelik artışla sonuçlanmıştır (%97,5 GA: -8 ile 33). Masitentan ile elde edilen 6DYM artışı çalışma süresince korunmuştur.
Plaseboya göre 6. ayda WHO FS iyileşmesi olasılığı, masitentan 10 mg tedavisi ile %74 daha fazla bulunmuştur (risk oranı 1,74; %97,5 GA: 1,10 ile 2,74; p = 0,0063).
Masitentan 10 mg, SF-36 anketiyle değerlendirildiği üzere yaşam kalitesini artırmıştır. Hemodinamik sonlanım noktaları
Hemodinamik parametreler 6 aylık tedaviden sonra bir hasta alt grubunda (plasebo [N = 67], masitentan 10 mg [N = 57]) değerlendirilmiştir. Masitentan 10 mg ile tedavi edilen hastalar
plaseboya göre, pulmoner vasküler dirençte medyan %36,5 (%97,5 GA: %21,7 ile %49,2) azalma ve kardiyak indekste medyan 0,58 L/dk./m (%97,5 GA: 0,28 ile 0,93 L/dk./m) artış elde etmiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerMasitentan ve aktif metabolitinin farmakokinetikleri ağırlıklı olarak sağlıklı gönüllülerde belgelenmiştir. PAH hastalarında masitentana maruziyet, sağlıklı gönüllülere göre yaklaşık 1,2 kat daha yüksektir. Hastalarda masitentana göre yaklaşık 5 kat daha az güçlü olan aktif metabolite maruziyet sağlıklı gönüllülere göre yaklaşık 1,3 kat daha yüksek olmuştur. Masitentanın PAH hastalarındaki farmakokinetikleri hastalığın şiddetinden etkilenmemiştir.
Tekrarlı uygulamadan sonra masitentan farmakokinetikleri 30 mg'a kadar (30 mg dahil) dozla orantılıdır.
Emilim
Masitentanın maksimum plazma konsantrasyonlarına uygulamadan yaklaşık 8 saat sonra ulaşılır. Ardından, masitentan ve aktif metabolitinin plazma konsantrasyonları, sırasıyla yaklaşık 16 saat ve 48 saatlik görünür eliminasyon yarılanma ömrü ile, yavaş yavaş azalır.
Sağlıklı gönüllülerde, masitentan ve aktif metabolitine maruziyet gıda varlığında değişmemiştir, dolayısıyla masitentan yemekle birlikte veya yemekten bağımsız olarak alınabilir.
Dağılım
Masitentan ve aktif metaboliti temelde albümin ve daha düşük ölçüde alfa1-asit glikoprotein olmak üzere plazma proteinlerine yüksek oranda bağlanır (> %99). Masitentan ve aktif metaboliti ACT-132577, masitentan ve ACT-132577 için sırasıyla yaklaşık 50 L ve 40 L olan görünür dağılım hacminden (Vss/F) anlaşıldığı üzere dokulara iyi bir şekilde dağılır.
Biyotransformasyon
Masitentanın dört primer metabolik yolağı vardır. Sülfamidin oksidatif depropilasyonu farmakolojik olarak aktif metaboliti verir. Bu reaksiyon, CYP2C8, CYP2C9 ve CYP2C19'un küçük katkılarıyla birlikte ağırlıklı olarak CYP3A4 (yaklaşık %99) olmak üzere sitokrom P450 sistemine bağlıdır. Aktif metabolit insan plazmasında dolaşıma girer ve farmakolojik etkiye katkıda bulunuyor olabilir. Diğer metabolik yolaklar farmakolojik aktivitesi olmayan ürünler verir. Bu yolaklar için, CYP2C9 baskın bir rol oynarken, CYP2C8, CYP2C19 ve CYP3A4 minör katkı sağlar.
Eliminasyon
Masitentan yalnızca kapsamlı metabolizmadan sonra atılır. Ana atılım yolu idrar olup, dozun yaklaşık %50'si idrarla atılır.
Hastalardaki karakteristik özellikler:
Özel popülasyonlar
Yaş, cinsiyet veya etnik kökenin masitentan ve aktif metabolitinin farmakokinetikleri üzerinde klinik olarak anlamlı bir etkisi yoktur.
Böbrek yetmezliği
Şiddetli böbrek yetmezliği olan hastalarda masitentan ve aktif metabolitine maruziyet, sırasıyla, yaklaşık 1,3 ve 1,6 kat artmıştır. Bu artış klinik olarak anlamlı kabul edilmemektedir(bkz. Bölüm 4.2 ve 4.4).
Karaciğer yetmezliği
Hafif, orta derece ve şiddetli karaciğer yetmezliği olan hastalarda masitentana maruziyet sırasıyla %21, %34 ve %6 oranında azalırken, aktif metabolitine maruziyet sırasıyla %20,
%25 ve %25 oranında azalmıştır. Bu azalma klinik olarak ilgili kabul edilmemektedir (bkz. Bölüm 4.2 ve 4.4).
5.3. Klinik öncesi güvenlilik verileri
Masitentan, köpeklerde terapötik insan maruziyetine benzer maruziyetlerde kan basıncını düşürmüştür. 4-39 haftalık tedaviden sonra insan maruziyetinin 17 katı olan düzeylerde koroner arterlerde intimal kalınlaşma gözlemlenmiştir. Türe özgü hassasiyet ve güvenlik marjına bağlı olarak, bu bulgu insanla ilgisiz kabul edilmiştir.
Fare, sıçan ve köpeklerde masitentan tedavisinden sonra karaciğer ağırlığında artış ve hepatoselüler hipertrofi gözlemlenmiştir. Bu değişiklikler büyük oranda tersinir olup, karaciğerin artan metabolik talebe olumsuz olmayan adaptasyonu olarak kabul edilmiştir.
Masitentan, fare karsinojenisite çalışmasında tüm dozlarda nazal kavitenin submukozasında minimum ile hafif mukozal hiperplazi ve enflamatuvar infiltrasyona neden olmuştur. 3 aylık fare toksisitesi çalışması veya sıçan ve köpek çalışmalarında hiçbir nazal kavite bulgusu kaydedilmemiştir.
Masitentan standart in vitro ve in vivo test bataryasında genotoksik bulunmamıştır. Masitentan, insan maruziyetinin 24 katına kadar maruziyetlerde tek dozdan sonra in vivo fototoksik bulunmamıştır. 2 yıl süren karsinojenisite çalışmaları, sıçan ve farelerde insan maruziyetinin sırasıyla 18 ve 116 katı olan maruziyetlerde karsinojenik potansiyel ortaya koymamıştır.
Erkek sıçan ve köpeklerle yapılan kronik toksisite çalışmalarında, sırasıyla 11,6 ve 5,8 güvenlik marjıyla testiküler tübüler dilatasyon gözlemlenmiştir. Tübüler dilatasyon tamamen tersinirdir. Sıçanlarda 2 yıllık tedaviden sonra insan maruziyetinin 4 katı olan dozlarda testiküler tübüler atrofi görülmüştür. Sıçanlarda ömür boyu süren karsinojenisite çalışmasında ve köpeklerde tekrarlı doz toksisite çalışmasında, sıçanlarda 9,7 ve köpeklerde 23 güvenlik marjı veren maruziyetlerde hipospermatogenez gözlemlenmiştir. Fertilite için güvenlik marjları erkek sıçanlarda 18 ve dişi sıçanlarda 44 olarak belirlenmiştir. 2 yıla kadar süren tedaviden sonra farelerde herhangi bir testiküler bulgu kaydedilmemiştir.
Masitentan, tavşan ve sıçanlarda test edilen tüm dozlarda teratojenik bulunmuştur. Her iki türde kardiyovasküler anomaliler ve mandibular ark füzyon anomalileri tespit edilmiştir.
Masitentanın dişi sıçanlara geç gebelik döneminden emzirme dönemine kadar insan maruziyetinin 5 katı olan maternal maruziyetlerde uygulanması, yavru sağkalımında azalmaya ve geç intrauterin ömrü sırasında ve emzirme döneminde süt aracılığıyla masitentana maruz kalan yavrunun üreme kabiliyetinde bozulmaya neden olmuştur.
Juvenil sıçanlara doğum sonrası 4. Gün ile 114. Gün arasında uygulanan tedavi, vücut
ağırlığı artışında azalmaya neden olarak, gelişim üzerinde sekonder etkilere (testis inmesinde hafif gecikme, uzun kemik uzunluğunda tersinir azalma, uzun süreli östrus siklusu) yol açmıştır. İnsan maruziyetinin 7 katı olan maruziyetlerde pre-implantasyon ve post-implantasyon kaybında hafif artış, ortalama yavru sayısında azalma, testis ve epididimis ağırlığında azalma gözlemlenmiştir. Testiküler tübüler atrofi ve üreme değişkenleri ile sperm morfolojisi üzerindeki minimum etkiler insan maruziyetinin 3,8 katı olan maruziyetlerde kaydedilmiştir.
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
İLAÇ GENEL BİLGİLERİ
Dem İlaç San. Tic. Ltd. Şti.
| Satış Fiyatı | 38777.6 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 38777.6 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699769090265 |
| Etkin Madde | Masitentan |
| ATC Kodu | C02KX04 |
| Birim Miktar | 10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Kalp Damar Sistemi > Diğer Antihipertansifler |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |