OPTIMARK 500 mmol/ml enj. için çöz. içeren flakon 15 ml {Covidien} Saklanması
{ Gadoversetamid }
Çeşitli İlaçlar > Manyetik Rezonans Görüntüleme Kontrast Medya > Gadoversetamid Covidien Sağlık A.Ş | Güncelleme : 1 April 20115.OPTIMARK'in saklanması
OPTİMARK'ı çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. Soğutmayınız / dondurmayınız.
Işıktan korumak için orijinal ambalajında saklayınız.
Son kullanma tarihiyle uyumlu olarak kullanınız
Ambalajdaki son kullanma tarihinden sonra OPTIMARK'i kullanmayınız.
Eğer enjektörde sızıntı olduğunu fark ederseniz OPTIMARKı kullanmayınız.
Ruhsat sahibi: Mallinckrodt Sağlık A.Ş. Maslak Mah. Bilim Sk.No:5 Sun Plaza Kat 3 34398 Şişli-İSTANBUL
Üretim Yeri: 8800 Durant Road Raleigh North Carolina 27616 Amerika Birleşik Devletleri adresindeki Mallinckrodt Inc.
AŞAĞIDAKİ BİLGİLER İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR
Optimark, santral sinir sistemi (SSS) ve karaciğer manyetik rezonans görüntülemesinde (MRG) kullanılmak üzere endikedir. Optimark, kontrast artışı sağlar ve bilinen veya yüksek derecede patolojisi olan hastalarda, SSS ve karaciğerdeki fokal lezyonlann ve anormal yapıların görüntülenmesini ve karakterizasyonunu kolaylaştırır.
Özel kullanım uyarıları ve önlemleri
Kontrastsız MRG ile tespit edilebilen lezyonlann bozulmuş görüntülemesi
Paramanyetik kontrast ajanlar, kontrastsız MRGde görülen lezyonlann görüntülemesini bozabilirler. Bu durum paramanyetik kontrast ajanın etkileri ya da görüntüleme parametreleri nedeniyle olabilir. Kontrastsız bir MRG karşılaştırması yokluğunda Optimark taramaları yorumlanırken dikkat uygulanmalıdır.
Herhangi bir paramanyetik kontrast ajanda olduğu gibi, gadoversetamid ile MRG artınlması, mevcut lezyonlann görüntülemesini bozabilir. Bu lezyonlann bazılan, artınlmamış, kontrastsız, MRGde görülebilir. Bu nedenle, eşlik eden bir artınlmamış MRG yokluğunda, kontrast artınlmış MRG yorumlanırken dikkat uygulanmalıdır.
Tetkik öncesi, hastalann yeterince hidrate edilmesine dikkat edilmelidir. MR tetkiklerinde, infıizyon pompası, kalp pili, ferro-manyetik klips v.b. taşıyan hastalann hariç tutulması gibi genel kontrendikasyonlara uyulmalıdır.
Hipersensitivite
İntravenöz uygulanan tüm kontrast maddeler ve gadoversetamid ile de , kardiyovasküler, respiratuvar ve cilt reaksiyonlan formunda açığa çıkabilen, allergoid ve idiyosenkratik reaksiyonlar oluşabilir. Bu reaksiyonlann hemen hepsi, kontrast madde uygulamasının ardından yanm saat içinde olur. Aynı sınıftaki tüm diğer kontrast maddelerle olduğu gibi, nadir vakalarda geç reaksiyonlar (saatler ve günler sonra) olabilir; bununla birlikte, tamamlanmış klinik çalışmalarda hiçbir bildirim olmamıştır.
Şayet hipersensitivite reaksiyonu olur ise, kontrast madde uygulaması derhal kesilmeli ve gerekirse intravenöz tedavi başlanmalıdır.
Tetkik sırasında bir uzman gözetimi gereklidir ve bir esnek kalıcı kateter takılması tavsiye edilir. Acil durumlarda hemen aksiyonu kolaylaştırmak için, gerekli tıbbi ürünler (öm. epinefrin/adrenalin, teofilin, antihistaminikler, kortikosteroidler ve atropin), endotrakeal tüp ve ventilatör derhal hazır olmalıdır.
Aşağıdaki durumlarda hipersensitivite reaksiyonlan riski artar:
Alleıjik predispozisyonlu hastalar
Bronşiyal astımlı hastalar; bu hastalarda özellikle artmış bronkospazm riski
Önceden bir iyotlu kontrast ajanlara reaksiyon tıbbi öyküsü içeren, bir kontrast ajanlara
reaksiyon tıbbi öykülü hastalar
Kontrast madde enjeksiyonu öncesi, hastalara, herhangi bir alleıjileri(öm. deniz ürünleri veya tıbbi ürünlere alleıjiler, saman nezlesi, ürtiker) olup olmadığı, kontrast maddelere hipersensitivite gösterip göstermedikleri ve bronşiyal astımı olup olmadığı sorulmalıdır. Antihistaminiklerle ve/veya glukokortikoidlerle premedikasyon değerlendirilebilir. Beta-blokör kullanan hastalar
Beta-blokör kullanan hastalann, genellikle hipersensitivite reaksiyonlannın tedavisi için kullamlan beta-agonistlere yanıt vermemesinin kaçınılmaz olduğu göze alınmalıdır. Kardiyovasküler rahatsızlığı olan hastalar
Bu gruptaki hastalarda hipersentivite reaksiyonlan şiddetli olabilir. Özellikle ciddi kalp hastalıklan(öm. şiddetli kalp yetmezliği, koroner arter hastalığı) olan hastalarda kardiyovasküler reaksiyonlar kötüleşebilir. Bununla birlikte, bunlar, Optimarkın klinik çalışmalannda ortaya çıkmamıştır.
Santral sinir sistemi bozukluklan
Epilepsi ya da beyin lezyonlanndan şikayeti olan hastalarda, tetkik sırasında konvülsiyon ihtimali artabilir. Bu hastalan tetkik ederken tedbirler gereklidir(öm.hastanm izlenmesi) ve olası konvülsiyonlann hızlı tedavisi için gerekli ekipman ve tıbbi ürünler hazır olmalıdır. Böbrek yetmezliği ve karaciğer tranplantlı hastalar
Şiddetli böbrek yetmezliği olan(GFR<30ml/dak./1.73m2) ve karaciğer transplantasyonu geçirmiş ya da geçiriyor olan hastalarda, bazı gadolinyum içeren kontrast ajanlann kullanımı ile ilişkili nefrotik sistemik fibroz(NSF) bildirimleri olmuştur. Bu nedenle Optimark bu popülasyonlarda kullanılmamalıdır.
Orta şiddette böbrek yetmezliği olan(GFR<60ml/dak./1.73m2) hastalarda, gadolinyum içeren kontrast ajanlann kullanımı ile de NSF vakalan bildirilmiştir. Optimark, bu hastalarda dikkatle kullanılmalıdır.
Gadoversetamid diyaliz edilebilir. Mevcut zamanda hemodiyaliz almış hastalarda, Optimark uygulaması sonrası kısa bir hemodiyaliz, Optimarkm vücuttan atılmasında faydalı olabilir. Halen hemodiyaliz almamış hastalarda, NSFi önlemek ya da tedavi etmek için hemodiyalize başlamayı destekleyen hiçbir bulgu yoktur.
Çocuklar
Optimark bir otomatik enjektör ile uygulanmamalıdır. Çocuklarda, yanlışlıkla fazla dozdan sakınmak için gerekli doz el ile uygulanmalıdır.
Yeni doğanlar ve bebekler
Optimark, iki yaşın altındaki çocuklarda kullanılmamalıdır. Güvenlilik ve etkinlik, bu yaş grubunda çalışılmamıştır.
Sodyum
Bu tıbbi ürün 17 mlye kadar her dozunda 1 mmol (23 mg)dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. Daha yüksek dozlar 1 mmol ya da daha fazla sodyum içerir, bu durum,kontrollü sodyum diyetinde olan hastalar için gözönünde bulundurulmalıdır.
Serum demir ve çinko
Klinik çalışmalarda serum demir ve çinko düzeylerinde geçici düşüşler gözlenmiştir bu nedenle dikkat edilmelidir. Bunun klinik belirginliği bilinmemektedir.
Gebelik ve laktasyon
Genel tavsiye Gebelik kategorisi: C
Çocuk doğurma potansiyeline sahip kadınlar/Doğum kontrolü
Optimarkın gebe kadınlarda kullanımına ilişkin klinik deneyim mevcut değildir.
Gebelik dönemi
Optimark, kontrastlı bir MR taramasının kritik öneme sahip olduğunun saptandığı ve kabul edilebilir alternatif bir görüntülemenin mevcut olmadığı durumlar haricinde gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Gadoversetamidin anne sütüyle atılım derecesi insanlar üzerinde çalışılmamıştır. Hayvanlar üzerinde yapılan çalışmalar göz önüne alınarak atılım oranının düşük olması beklenir. Emzirilen çocuklarda klinik dozlarda beklenen etkiler görülmemiştir. Optimark emzirme döneminde kullanılabilir.
Üreme yeteneği (fertilite)
Hayvan çalışmaları, üreme toksisitesi üzerine direkt ya da indirekt zararlı etkiler göstermemiştir. İnsanlara yönelik potansiyel risk bilinmemektedir.
Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:
Optimark, bolus periferik intravenöz enjeksiyon olarak 0.2 ml/kg (0.1 mmol/kg) vücut ağırlığı dozunda uygulanmalıdır. Kontrast maddenin tam olarak enjekte edilmesini sağlamak için, enjeksiyonu takiben 5 ml %0.9 w/v sodyum klorür çözeltisi enjekte edilerek yıkama işlemi yapılmalıdır. Görüntüleme prosedürü, Optimark uygulamasından sonraki 1 saat içerisinde tamamlanmalıdır.
Kraniyal MRGde, şayet, bir tek doz kontrast ile artırılmış MRGye rağmen bir lezyon mevcudiyetine dair güçlü bir şüphe ya da lezyonlann sayısı, boyutu ve yaygınlığı hakkında daha doğru bilginin hasta yönetimini ya da tedavisini etkileme ihtimali varsa, normal renal fonksiyonlu bireylerde ilk enjeksiyonun 30 dakikası içinde, tetkikin teşhis verimini artırabilen, ikinci bir bolus enjeksiyonu 0.1 mmol/kg uygulanabilir.
Uygulama sekli
Optimark, yalnızca klinik MRG uygulaması alanında deneyimli hekimler tarafından uygulanmalıdır.
Bir esnek kalıcı venöz kateter takılması tavsiye edilir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek haşan olan hastalarda tekrarlanan dozun güvenliliği tespit edilmemiştir.
Pediyatrik popülasyon:
Güvenlilik, etkinlik ve olgunlaşmamış böbrek fonksiyonuna ilişkin çalışma yapılmaması nedeniyle 2 yaşının altında olan çocuklarda Optimarkm kullanılması tavsiye edilmemektedir. Optimark 2 yaş ve üstü çocuklarda araştınlmış ve erişkin popülasyondakine benzer bir güvenlilik profili gözlenmiştir.
Çocuklarda ve adelosanlarda tekrarlanan dozun güvenliliği tespit edilmemiştir.
Geriyatrik popülasyon:
Yaşlılarda tekrarlanan dozun güvenliliği tespit edilmemiştir.
Diğer:
Diğer gadolinium kontrast ajanlarla sınırlı veriler, bilinen bir soliter çıkarılabilir metastazı olan bir hastada ilave kraniyal metastazları dışarda bırakmak için, 0.3 mmol / kg vücut ağırlığı dozda Optimark enjeksiyonu ile bir MR tetkik, daha yüksek teşhis emniyeti sağlar.
Diğer tıbbi ürünlerle etkileşim ve diğer etkileşim şekilleri
Resmi herhangi bir etkileşim çalışması yapılmamıştır.
Optimarkın orto-krezolftalein komplekson (OCP) kolorimetrik yöntemle serum kalsiyum düzeyi ölçümünde etkileşime neden olduğu gösterilmiştir. Bununla birlikte, gadoversetamidin uygulanması serum kalsiyum düzeyinde gerçek bir düşüşe neden olmamaktadır. Gadoversetamid varlığında, bu teknikle yapılan ölçümlerde plazma kalsiyum değeri hatalı bir şekilde düşük bulunur. Bu artefaktın büyüklüğü kandaki gadoversetamid konsantrasyonuyla orantılıdır ve böbrek klerensi normal olan hastalarda enjeksiyondan yaklaşık 90 dakika sonra doğru değerler elde edilebilir. Böbrek fonksiyonu tehlikeli düzeyde olan hastalarda, gadoversetamid klerensi yavaşlar ve OCP yöntemiyle kalsiyum tayini ile etkileşim uzar. Gadoversetamid serum kalsiyum düzeyinin ölçülmesinde kullamlan diğer yöntemleri (ömeğin arsenazo III kolorimetrik yöntem, atomik absorpsiyon spektroskopisi ve indüktif olarak eşleştirilmiş plazma kütle spektroskopisi) etkilemez.
Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullamm esnasında 25 °Cnin altındaki oda sıcaklığında 24 saat süreyle kullanılabilir.
Renk değişimi ya da partikül görülürse çözelti kullanılmamalıdır.
Kullanmayı istediğiniz solüsyonu elde etmek için aşağıdaki hazırlığı yapınız:
Enjektörde sızıntı olup olmadığını kontrol ediniz. Sızıntı varsa kullanmayınız.
İtme çubuğunu çevirerek enjektör pistonunun içine soktuktan sonra itme çubuğunu yarım tur daha çevirerek gri
pistonun serbestçe dönmesini sağlayınız.
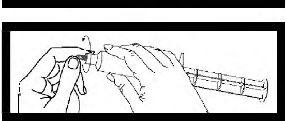
Enjektörü kullanmadan önce gri uç başlığını bükerek çıkarınız ve atınız.
Artık enjektöre iğne ya da infüzyon boru parçalarım takabilirsiniz.
Kullandıktan sonra enjektörü ve maddenin kullanılmamış kısmını atınız.
Tüm kullanılmamış ürünler ya da atık materyaller, yerel gereksinimlere uygun şekilde imha
edilmelidir.
 Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
 İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
 Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
 Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
 Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
İLAÇ GENEL BİLGİLERİ
Covidien Sağlık A.Ş
| Geri Ödeme Kodu | A11250 |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8697706771154 |
| Etkin Madde | Gadoversetamid |
| ATC Kodu | V08CA06 |
| Birim Miktar | 500 |
| Birim Cinsi | MMOL/ML |
| Ambalaj Miktarı | 15 |
| Çeşitli İlaçlar > Manyetik Rezonans Görüntüleme Kontrast Medya > Gadoversetamid |
| İthal ( ref. ülke : Portekiz ) ve Beşeri bir ilaçdır. |