PEGASYS 180 mcg 4 hazır şırınga Farmakolojik Özellikler
{ Peginterferon Alfa 2a }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: İmmünostimulan ajan/sitokin ATC kodu: L03A B11
PEG reaktifinin (bis-monometoksipolietilen glikol) interferon alfa-2a’ya konjügasyonu, polietilen glikollü bir interferon alfa-2a oluşturur. İnterferon alfa-2a, DNA rekombinant teknolojisi kullanılarak biyosentetik olarak üretilmektedir ve klonlanmış insan lökosit interferon geninin E. coli içinde kodlanması sonucunun bir ürünüdür. PEG kısmının yapısı, PEGASYS’in klinik farmakolojisini direk olarak etkilemektedir. Özellikle, 40 kD’lik PEG kısmının büyüklüğü ve dallanması, PEGASYS’in emilim, dağılım ve eliminasyon karakteristiklerini belirlemektedir.
Ribavirinin farmakodinamik özellikleri için, lütfen ribavirin ürün bilgilerine bakınız. Etki mekanizması
PEGASYS, interferon alfa-2a’nın in-vitro antiviral ve antiproliferatif aktivitelerine sahiptir. İnterferonlar, hücre yüzeyindeki spesifik reseptörlere bağlanarak kompleks hücreiçi sinyal yolunu başlatır ve gen transkripsiyonunu hızla aktive eder. İnterferon stimule edici genler, infekte hücrelerdeki viral replikasyonun inhibisyonu, hücre çoğalmasının inhibisyonu ve immün-modülasyon da dahil, pek çok biyolojik etkiyi modüle eder.
HCV RNA seviyeleri, PEGASYS’le tedavi edilen ve tedaviye yanıt veren hepatit C’li hastalarda iki aşamalı olarak azalır. İlk azalma aşaması ilk PEGASYS dozunu izleyen 24 ila 36 saat içinde gerçekleşir ve bunu takiben ikinci azalma aşaması da uzun süreli yanıt veren hastalarda sonraki 4 ila 16 hafta boyunca devam eder. Haftalık 180 mikrogram PEGASYS, standart alfa interferon ile yapılan tedaviye kıyasla, viral klerensi arttırır ve tedavinin viral sonucundaki cevapları iyileştirir.
PEGASYS, serum neopterin ve 2’,5’-oligoadenilat sentetaz gibi dengeleyici proteinlerin üretimini doza bağlı olarak stimüle eder. 2’,5’-oligoadenilat sentetazın stimülasyonu, PEGASYS 135 mikrogram ve 180 mikrogramın tek dozlarının ardından maksimumdur ve bir doz aralığı boyunca maksimumda kalır. 2’,5’-oligoadenilat sentetaz aktivitesinin büyüklüğü ve süresi, PEGASYS tarafından belirlenir ve 62 yaşından daha yaşlı kişilerde ve önemli derecede böbrek bozukluğu (kreatin klerensi 20 ila 40 mL/dk arası) olan kişilerde azalır. PEGASYS’in farmakodinamik işaretleri ile bu bulguların klinik ilişkisi bilinmemektedir.
Klinik etkinlik ve güvenlilik
Hepatit B:
Klinik çalışmalar, PEGASYS monoterapisinin, HBeAg pozitif ve HBeAg negatif/anti-HBe-pozitif olan kronik hepatit B’li hastaların tedavisinde etkili olduğunu göstermiştir.
Doğrulayıcı amaçlı klinik çalışmalar
Tüm klinik çalışmalara, HBV DNA ile ölçülen aktif viral çoğalması, yüksek ALT düzeyleri ve kronik hepatit ile uyumlu karaciğer biyopsisi bulunan kronik hepatit B’li hastalar dahil edilmiştir. Çalışma WV16241’e HBeAg negatif ve anti-HBe pozitif hastalar dahil edilirken, çalışma WV16240’a HBeAg pozitif hastalar dahil edilmiştir. Her iki çalışmada da, tedavi süresi 48 hafta olmuştur ve bunu tedavisiz 24 haftalık izleme süresi takip etmiştir. İki çalışma da PEGASYS ve plasebo, PEGASYS ve lamivudin ve tek başına lamivudini karşılaştırmıştır. Bu klinik çalışmalara, HBV-HIV koenfeksiyonlu hastalar alınmamıştır.
Her iki çalışma için izleme süresi sonundaki yanıt oranları Tablo 4’te sunulmuştur. HBV DNA, COBAS AMPLICOR HBV MONITOR tetkiki ile (saptama sınırı 200 kopya/mL) ölçülmüştür.
Tablo 4: Kroni | c Hepatit B’de Serolojik, Viral ve Biyo | kimyasal Yanıtlar | ||||
( | HBeAg pozitif "al | HBeAg ( | negatif/anti-HBe pozitif Çal | |||
PEGASYS 180 mikrogram & Plasebo (N =271) | PEGASYS 180 mikrogram & Lamivudin 100 mg (N = 271) | Lamivudin 100 mg (N = 272) | PEGASYS 180 mikrogram & Plasebo (N = 177) | PEGASYS 180 mikrogram & Lamivudin 100 mg (N = 179) | Lamivudin 100 mg (N = 181) | |
HBeAg Sero-konversiyonu | % 32 1 | % 27 | % 19 | N/A | N/A | N/A |
HBV DNA* | % 32 2 | % 34 | % 22 | % 43 5 | % 44 | % 29 |
ALT Normalleşmesi | % 41 3 | % 39 | % 28 | % 59 6 | % 60 | % 44 |
HBsAg Sero-konversiyonu | %3 4 | % 3 | % 0 | % 3 | % 2 | % 0 |
* HBeAg-pozitif hastalar için: HBV DNA < 105 kopya/mL HBeAg-negatif / anti-HBe-pozitif hastalar için: HBV DNA <2 x 104 kopya/mL
1 Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =2.00 (1.34-2.97) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) <0.001
2 Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =1.64 (1.12-2.42) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.012
3 Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =1.77 (1.23-2.54) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.002
4 Olasılık oranı tanımlanamaz p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.004
5 Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =1.84 (1.17-2.89) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.007
6 Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =1.86 (1.22-2.85) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.004
Hepatit C:
Klinik çalışmalar tek başına veya ribavirin ile kombine PEGASYS’in, kompanse karaciğer hastalığı bulunan sirozlu hastaların da dahil olduğu kronik hepatit C’li hastaların ve aynı zamanda HIV-HCV ko-enfeksiyonlu hastaların tedavisinde etkili olduğunu göstermiştir.
Naif hastalarda doğrulayıcı amaçlı klinik çalışmalar
Tüm klinik çalışmalarda, saptanabilir HCV RNA serum seviyeleri, yüksek ALT seviyeleri ve kronik hepatitle tutarlı bir karaciğer biyopsisiyle doğrulanmış, daha önce interferon almamış, kronik hepatit C’li hastalar dahil edilmiştir. Çalışma NV15495’te özellikle histolojik olarak siroz teşhisi koyulmuş (yaklaşık %80) veya siroza ilerleyen hastalar (yaklaşık %20) dahil edilmiştir. Tedavi rejimleri, tedavi süresi ve çalışma sonucu için 2. ve 3. tablolara bakınız. Viral yanıt, COBAS AMPLICOR™ HCV Test, sürüm 2.0 ile ölçüldüğünde saptanamayan HCV RNA (saptama limiti: 50 IU/mL eşdeğeri 100 kopya/mL) ve kalıcı viral yanıt, tedavinin bitişinden yaklaşık 6 ay sonra bir negatif numune olarak tanımlanmıştır.
Tablo 5: Kronik Hepatit C Hastalarında Viral Yanıt
PEGASYS Monoterapisi | PEGASYS Kombine Tedavisi | ||||||
Sirozu olan ve olmayan | Sirozu olan | Sirozu olan ve olmayan | |||||
Çalışma NV15496 + NV15497 + NV15801 | Çalışma NV15495 | Çalışma NV15942 | Çalışma NV15801 | ||||
PEGASYS 180 mikrogram (N=701) 48 hafta | İnterferon alfa-2a 6 MIU/ 3 MIU & 3 MIU (N=478) 48 hafta | PEGASYS 180 mikrogram (N=87) 48 hafta | İnterferon alfa-2a 3 MIU (N=88) 48 hafta | PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg (N=436) 48 hafta | PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg (N=453) 48 hafta | İnterferon alfa-2b 3 MIU & Ribavirin 1000/1200mg (N=444) 48 hafta | |
Tedavi sonunda yanıt | %55 - 69 | %22 - 28 | %44 | %14 | %68 | %69 | %52 |
Kalıcı Viral | |||||||
yanıt | %28 - 39 | %11 - 19 | %30* | %8* | %63 | %54** | %45** |
* Fark için %95 Güven Aralığı (GA): %11 - %33 arası p-değeri (sınıflandırılmış Cochran-Mantel - Haenszel testi) = 0.001
** Fark için %95 GA: %3 - %16 arası p-değeri (sınıflandırılmış Cochran-Mantel - Haenszel testi) = 0.003
PEGASYS ve ribavirin kombinasyonu ile tedavi edilen hastaların genotip ve viral yüklere göre viral yanıtları Tablo 6’da özet halinde verilmiştir. Çalışma NV15942’nin sonuçları genotip bazında tedavi rejimleri önerme gerekçesini vermektedir (bkz. Tablo 2).
Tedavi rejimleri arasındaki fark genel olarak viral yükten veya siroz varlığından/yokluğundan etkilenmemiştir. Bu nedenle genotip 1, 2 ve 3 için tedavi önerileri bu temel özelliklerden bağımsızdır.
Tablo 6: Kronik Hepatit C’de Genotip ve Viral Yüke Göre PEGASYS ve Ribavirin
Kombinasyon Tedavisi Sonucunda Kalıcı Viral Yanıt
Çalışma NV15942 | Çalışma NV15801 | |||||
PEGASYS 180 mikrogram & Ribavirin 800 mg 24 hafta | PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 24 hafta | PEGASYS 180 mikrogram & Ribavirin 800 mg 48 hafta | PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 48 hafta | PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 48 hafta | İnterferon alfa-2b 3 MIU & Ribavirin 1000/1200 mg 48 hafta | |
Genotip 1 | %29 (29/101) | %42 (49/118)* | %41 (102/250)* | %52 (142/271)* | %45 (134/298) | %36 (103/285) |
Düşük viral yük | %41 (21/51) | %52 (37/71) | %55 (33/60) | %65 (55/85) | %53 (61/115) | %44 (41/94) |
Yüksek viral yük | %16 (8/50) | %26 (12/47) | %36 (69/190) | %47 (87/186) | %40 (73/182) | %33 (62/189) |
Genotip 2/3 | %84 (81/96) | %81 (117/144) | %79 (78/99) | %80 (123/153) | %71 (100/140) | %61 (88/145) |
Düşük viral yük | %85 (29/34) | %83 (39/47) | %88 (29/33) | %77 (37/48) | %76 (28/37) | %65 (34/52) |
Yüksek viral yük | %84 (52/62) | %80 (78/97) | %74 (49/66) | %82 (86/105) | %70 (72/103) | %58 (54/93) |
Genotip 4 | (0/5) | (8/12) | (5/8) | (9/11) | (10/13) | (5/11) |
* PEGASYS 180 mikrogram & ribavirin 1000/1200 mg, 48 hafta ile PEGASYS 180 mikrogram & ribavirin 800 mg, 48 hafta karşılaştırması: Olasılık oranı (%95 GA) = 1.52 (1.07 ila 2.17) P-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) = 0.020
* PEGASYS 180 mikrogram & ribavirin 1000/1200 mg, 48 hafta ile PEGASYS 180 mikrogram & ribavirin 1000/1200 mg 24 hafta karşılaştırması: Olasılık oranı (%95 GA) = 2.12 (1.30 ila 3.46) P-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) = 0.002
PEGASYS’in interferon alfa-2a’ya kıyasla etki üstünlüğü, sirozlu hastalar ve HIV-HCV koenfeksiyonlu hastalar da dahil histolojik yanıt bakımından da gösterilmiştir. Genotip 1 ve 4 hastalarında tedavi süresininin 24 haftaya kısaltılmasının düşünülmesi ihtimali, NV15942 (bkz. Tablo 7) çalışmasında 4. haftada hızlı viral yanıt veren hastalarda gözlenen kalıcı hızlı viral yanıta dayanarak incelenmiştir.
Tablo 7 HCV Hastalarında PEGASYS’in Ribavirin İle Kombine Kullanımından Sonra
4. Haftada Genotip 1 ve 4 İçin Hızlı Viral Yanıta Bağlı Kalıcı Viral Yanıt
Çalışma NV15942 | ||
PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 24 hafta | PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 48 hafta | |
Genotip 1 HVY Düşük viral yük Yüksek viral yük | %90 (28/31) %93 (25/27) %75 (3/4) | %92 (47/51) %96 (26/27) %88 (21/24) |
Genotip 1 HVY olmayan Düşük viral yük Yüksek viral yük | %24 (21/87) %27 (12/44) %21 (9/43) | %43 (95/220) %50 (31/62) %41 (64/158) |
Genotip 4 HVY | (5/6) | (5/5) |
Genotip 4 HVY olmayan | (3/6) | (4/6) |
Düşük viral yük= <800,000 IU/mL: yüksek viral yük=>800,000 IU/mL
HVY= 4. haftada hızlı viral yanıt (HCV RNA saptanamaz) ve 24.haftada HCV RNA saptanamaz.
Genotip 2 veya 3 hastalarında tedavi süresinin 16 haftaya indirilmesi olasılığı, NV17317 çalışmasında, 4. haftada hızlı viral yanıtı olan hastalarda, kalıcı hızlı viral yanıta göre incelenmiştir (bkz. Tablo 8).
NV17317 çalışmasında, viral genotip 2 veya 3 ile enfekte olmuş hastalarda, tüm hastalara PEGASYS 180 mikrogram subkütan/haftada bir ve 800 mg dozda ribavirin verilmiş ve 16 ve 24 haftalık tedavilere randomize edilmişlerdir. 16 haftalık toplam tedavi 24 haftalık tedaviye denk değildir (bkz. Tablo 8). 16 haftalık tedavi (%65), 24 haftalık tedaviye (%76) göre daha düşük kalıcı viral yanıtla sonuçlanmıştır. Fakat 4 haftada HCV RNA negatif olan ve başlangıç noktasında DVY’si olan hastaların geriye dönük bir analizi 16 haftalık tedavide elde edilen kalıcı viral yanıtın 24 haftalık tedavide elde edilene yakın olduğunu göstermiştir (16 haftalık tedavide %89 ve 24 haftalık tedavide %94) (bkz. Tablo 8).
Tablo 8 HCV Hastalarında Ribavirin ile Yapılan PEGASYS Kombinasyon Tedavisi
Çalışma NV17317 | ||
PEGASYS 180 mikrogram ve Ribavirin 800 mg 16 hafta | PEGASYS 180 mikrogram ve Ribavirin 800 mg 24 hafta | |
Genotip 2 veya 3 | %65 (443/679) | %76 (478/630) |
Genotip 2 veya 3 HVY Düşük viral yük Yüksek viral yük | %82 (378/461) %89 (147/166) %78 (231/295) | %90 (370/410) %94 (141/150) %88 (229/260) |
Genotip 2 veya 3, HVY olmayan Düşük viral yük Yüksek viral yük | %30 (65/218) %44 (22/50) %26 (43/168) | %49 (108/220) %50 (25/50) %49 (83/170) |
Düşük viral yük = başlangıçta < 800,000 IU/mL; Yüksek viral yük = başlangıçta > 800,000 IU/mL, HVY = 4. haftada hızlı viral yanıt (HCV RNA negatif).
Önceki Kronik Hepatit C tedavisine yanıtsız hastalar
MV17150 çalışmasında, pegile interferon alfa-2b ve ribavirin kombinasyon tedavisine daha önce yanıt vermemiş hastalar 4 farklı tedaviye randomize edildi: 12 hafta PEGASYS 360 mikrogram/hafta bunu takip eden ilave 60 hafta 180 mikrogram/hafta; 12 hafta PEGASYS 360 mikrogram/hafta bunu takip eden ilave 36 hafta 180 mikrogram/hafta; 72 hafta PEGASYS 180 mikrogram/hafta veya 48 hafta 180 mikrogram/hafta. Bütün hastalar, PEGASYS ile kombinasyon halinde ribavirin (1000 veya 1200mg/gün) almıştır. Tüm tedavilerin 24 hafta tadavisiz takibi vardır. Tedavinin süresini karılaştıran, birleştirilmiş bir analizden kalıcı viral yanıtlar veya PEGASYS indüksyon dozları tablo 9’da özetlenmiştir.
Tablo 9 Daha önce Peginterferon alfa-2b ile tedaviye yanıtsızlarda kalıcı viral yanıt: Birleştirilmiş tedavi karşılaştırması_
MV17150 | ||||
72 Hafta grubu N=473 | 48 Hafta grubu N=469 | 360 mikrogram grubu N=473 | 180 mikrogram grubu N=469 | |
KVY | %16* | %8* | %13 | %10 |
* %95 Güvenlik Aralığı (GA) ve p değeri=0.00061
Kalıcı viral yanıt oranı, 48 hafta tedaviden sonrakine göre 72 hafta tedaviden sonra daha yüksektir.
MV17150 çalışmasında bulunan tedavi süresi ve demografisine göre kalıcı viral yanıt farklılıklar Tablo 10’da gösterilmiştir.
Tablo 10 Peginterferon alfa-2b/ribavirin ile önceki tedaviye yanıtsızlarda PEGASYS ve Ribavirin kombinasyon terapisi ile tedavi sonrası kalıcı viral yanıt_
Peginterferon alfa-2b/ribavirine yanıtsızların 48 hafta yeniden tedavisi % (N) | Peginterferon alfa-2b/ribavirine yanıtsızların 72 hafta yeniden tedavisi % (N) | |
Tüm yanıtsız hastalar | %8 (38/469) | %16 (74/473) |
Genotip 1/4 | %7 (33/450) | %15 (68/457) |
Genotip 2/3 | %25 (4/16) | %33 (5/15) |
Genotip | ||
1 | %7 (31/426) | %14 (60/430) |
2 | 0 (0/4) | %33 (1/3) |
3 | %33 (4/12) | %33 (4/12) |
4 | %8 (2/24) | %30 (8/27) |
Başlangıç viral yükü | ||
YVY (800,000 IU/mL’den yüksek) | %7 (25/363) | %12 (46/372) |
DVY (800,000 IU/mL’den düşük veya eşit) | %13 (11/84) | %31 (27/86) |
HALT-C çalışmasında, önceki peginterferon alfa veya pegile interferon alfa monoterapisi veya ribavirin ile kombinasyon tedavisine yanıt vermemiş, kronik hepatit C’si ve ileri evre fibroz veya sirozu olan hastalar, PEGASYS 180 mikrogram/hafta ve günlük ribavirin 1000/2000 mg ile tedavi edilmiştir. 20 haftalık tedaviden sonra saptanamayan düzeyde HCV RNA görülen hastalar, PEGASYS ve ribavirin ile toplam 48 haftalık tedavisinde bırakılmıştır ve sonra tedavinin bitiminden itibaren 24 hafta takip edilmiştir. Kalıcı viral yanıt önceki tedaviye göre değişmiştir. Tedavi sonuçlarının önceki ribavirin ve pegile interferon kombinasyonu tedavisine yanıtsız hastalar arasında en az olması, yanıtsız hastaların en zor tedavi edilen alt popülasyon olduğunu belirlemiştir ve kalıcı viral yanıt, MV17150’nin 48 haftalık tedavi kolunda tespit edilen ile karşılaştırılabilirdi. İnterferon veya pegile interferon monoterapisine yanıtsızlardaki yüksek kalıcı viral yanıta rağmen, tedavi edilmesi daha az zor olan yanıtsızlarda yararlılık, naif hastaların tedavisinde tespit edilene göre, önemli ölçüde düşük kalmıştır.
Tablo 11 | Tedavi süresi ve yanıtsız hastalarda KVY oranı | ||||
Tedavi süresi | İnterferon | Pegile İnterferon | İnterferon ve Ribavirin | Pegile İ Ri | nterferon ve bavirin |
48 hafta | %27(70/255)* | %34(13/38)* | %13(90/692)* | %11(7/61) * | %8(38/469)** |
72 hafta | - | - | - | - | %16(74/473)* * |
* HALT-C verileri ** MV17150 verileri
Önceki Kronik Hepatit C tedavisinden sonra nüks görülmüş hastalar
48 haftalık pegile interferon alfa-2 ve ribavirin ile tedavisinden sonra nüks görülmüş ağırlıklı genotip 1 kronik hepatit C hastalarında yapılan bir çalışmada, hastalar ya PEGASYS 180 mikrogram/hafta ve günlük ağırlığa göre ayarlanmış ribavirin rejimi ile ya da konsensüs günlük interferon (9 mikrogram) ve günlük ağırlığa göre ayarlanmış ribavirin rejimi ile 72 hafta tedavi edilmiştir. 72 hafta PEGASYS ve ribavirin kombinasyon terapisi ile tedavi edilen hastalar için kalıcı viral yanıt %42’dir. 24 haftalık PEGASYS ve ribavirin ile tedavisinden sonra nüks görülmüş genotip 2 ve 3 kronik hepatit C hastalarında yapılan açık etiketli bir çalışmada, hastalar 48 hafta PEGASYS 180 mikrogram/hafta ve günlük ribavirin 1000 veya 1200 mg (ağırlığa göre) kombinasyon terapisi ile tedavi edilmiştir ve tedavisiz 24 hafta izlenmiştir. Kalıcı viral yanıt %64’dür.
HIV-HCV Ko-enfeksiyonu
Çalışma NR 15961’de, 860 HIV-HCV ko-enfeksiyonlu hasta randomize edilerek, 48 hafta süre ile PEGASYS 180 mikrogram/hafta ve plasebo, PEGASYS 180 mikrogram/hafta ve ribavirin 800 mg/gün veya interferon alfa-2a 3 MIU haftada üç kez ve ribavirin 800 mg/gün ile tedavi edilmiş ve ardından 24 hafta süre ile tedavisiz olarak izlenmiştir. Üç tedavi grubunda kalıcı viral yanıtlar, tablo 12’de tüm hastalar için genotiplere göre özetlenmiştir.
Tablo 12: HIV-HCV Koenfeksiyonlu Hastalarda Kalıcı Viral Yanıtlar
PEGASYS 180 mikrogram | PEGASYS 180 mikrogram | İnterferon alfa-2a 3MIU + | |
+ Plasebo | + RIBAVIRIN 800 mg | RIBAVIRIN 800 mg | |
48 hafta | 48 hafta | 48 hafta | |
Tüm hastalar | %20 (58/286)* | %40 (116/289)* | %12 (33/285)* |
Genotip 1 | %14 (24/175) | %29 (51/176) | %7 (12/171) |
Genotip 2/3 | %36 (32/90) | %62 (59/95) | %20 (18/89) |
* PEGASYS 180 mikrogram & ribavirin 800 mg ile İnterferon alfa-2a 3MIU & ribavirin 800 mg karşılaştırması: %95 GA fark için: %22 ile %35 arası, p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) < 0.0001
5.2. Farmakokinetik özellikler
Genel özellikler
PEGASYS’in farmakokinetiği, sağlıklı gönüllülerde ve hepatit C virüsü ile enfekte hastalarda çalışılmıştır (bkz. Tablo 13). Kronik hepatit B’li hastalar için sonuçlar, kronik hepatit C’li hastalar için olanlarla benzerdir.
Emilim:
PEGASYS’in emilimi, dozlamadan sonraki 72 ila 96 saat sonrasında erişilen pik serum konsantrasyonları ile artar. Serum konsantrasyonları, tek bir PEGASYS 180 mikrogram subkütan enjeksiyonundan sonra 3 ila 6 saat içinde ölçülebilir. 24 saat içinde, pik serum konsantrasyonun yaklaşık %80’inine erişilir. PEGASYS’in mutlak biyoyararlanımı %84’tür ve interferon alfa-2a’nınki ile benzerdir.
Dağılım:
Peginterferon alfa-2a insanlarda intravenöz uygulamadan sonra kararlı durumdaki 6-14 litrelik dağılım hacmiyle (Vd) en fazla kan dolaşımında ve hücre dışı sıvılarda görülür. Sıçanlarda gerçekleştirilen çalışmalara göre, ilacın kanda yüksek oranda bulunmasına ek olarak karaciğer, böbrekler ve kemik iliğine de dağılmaktadır.
Metabolizma:
Metabolizma, PEGASYS için asıl klerens mekanizmasıdır. PEGASYS’in metabolik karakteri tamamen anlaşılmamıştır. İnsanlarda PEGASYS’in sistemik klerensi 100mL/saat’tir ve özgün interferon alfa-2a’dan 100 kez daha düşüktür. Sıçanlarda yapılan çalışmalar, PEGASYS’in metabolik ürünlerinin idrara ve az miktarda da safraya karıştığını göstermektedir. Tüm peginterferon alfa-2a dozunun % 10’dan daha azı böbrekler tarafından elimine edilmektedir. PEG kısmı interferon alfa-2a’ya bağlı kalırken, hem PEG hem de interferon alfa-2a metabolize olmaktadır.
Eliminasyon:
İntravenöz uygulamadan sonra, sağlıklı kişilerde PEGASYS’in terminal yarı ömrü yaklaşık 60 saat iken, standart interferon için bu süre 3-4 saattir. Hastalarda, terminal yarı ömür subkütan uygulamadan sonra, ortalama 160 saat ile (84-353 saat) daha da uzundur. Terminal yarı ömür yalnızca bileşiğin eliminasyon fazını değil, PEGASYS’in uzun süreli absorbsiyonunu da yansıtıyor olabilir.
Sağlıklı kişiler ve kronik hepatit C’li hastalarda, haftada bir PEGASYS doz uygulanmasının ardından, EAA ve Cmax’da dozla orantılı artışlar gözlenmiştir. PEGASYS’in farmakokinetik parametreleri, tek subkütan 180 mikrogram PEGASYS enjeksiyonu uygulanan sağlıklı kişiler için ve 48 hafta boyunca haftada bir 180 mikrogram PEGASYS alan kronik hepatit C’li hastalar için Tablo 13’de verilmektedir.
Tablo 13: Tek ve Çok Doz PEGASYS 180 mikrogramın Farmakokinetik Parametre’
Sağl | Çal | ||
5.2. Farmakokinetik özelliklerTek Doz Ortalama ± SD [Aral | Tek Doz Ortalama ± SD [Aral | 48. Hafta Dozu Ortalama ± SD [Aral | |
Cmax (ng/mL) | 14 ± 5 [6-26] | 15 ± 4 [7-23] | 26 ± 9 [10-40] |
Tmax (saat) | 92 ± 27 [48-168] | 80 ± 28 [23-119] | 45 ± 36 [0-97] |
EAA1-168 saat (ng*saat/mL) | 1725 ± 586 [524-3013] | 1820 ± 586 [846-2609] | 3334±994 [1265-4824] |
Klerens/F (mL/saat) | 94 ± 56 [34-337] | 83 ± 50 [33-186] | 60 ± 25 [37-142] |
48. Hafta Düşük Konsantrasyon (ng/mL) | - | - | 16 ± 6 [4-28] |
48. Hafta İçin Tepe Vadi Oran | - | - | 1.7 ± 0.4 [1.1-2.5] |
Birikme (EAA48. Hafta /EAAjek Doz) | - | - | 2.3 ± 1.0 [1.1-4.0] |
Kronik hepatit C’li hastalarda, tek doz değerleriyle karşılaştırıldığında kararlı hal serum konsantrasyonunun 2-3 kat arttığı ve haftada bir doz uygulaması ile kararlı hale 5-8 hafta süre içinde ulaşıldığı görülmüştür. Kararlı hal elde edildikten sonra, peginterferon alfa-2a birikmesi olmamaktadır. Tedavinin 48. haftasında tepe/vadi değer oranı yaklaşık 1.5 - 2’dir. Peginterferon alfa-2a serum konsantrasyonları tüm bir hafta boyunca sabit kalmaktadır (168 saat) (bkz. Şekil 1).
Şekil 1: 180 mikrogram PEGASYS Monoterapisi (NV15496) ve Ribavirin ile Kombinasyon (NV15801) Tedavisini Takiben, KHC’li Hastalarda Ortalama Kararlı Hal
Peginterferon alfa-2a Konsantrasyonları
eri
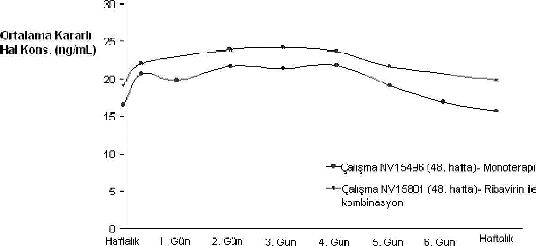
Verilen Verilen
Doz Haftalık doz som ası «jüıı olaı ak zaman Doz
Hastalardaki karakteristik özellikler
Böbrek yetmezliği olan hastalar:
Normal böbrek fonksiyonu ile önemli böbrek yetmezliği olan 23 hastada (Kreatin klerensi 20 ile <100mL/dk arası), PEGASYS farmakokinetikleri ve kreatin klerensi arasında kayda değer bir ilişki gözlenmemiştir. Hemodiyalize giren son safha böbrek hastalarında, klerenste %25 ile %45 arası azalma olur ve 135 mikrogram dozları normal böbrek fonksiyonu bulunan hastalardaki, 180 mikrogram dozları ile benzer maruziyet gösterir. Başlangıç dozundan veya böbrek yetmezliğinin seviyesinden bağımsız olarak, hastalar izlenmelidir ve advers etki oluşması durumunda tedavi süresince PEGASYS’te uygun doz azaltmaları yapılmalıdır (bkz. bölüm 4.2). Lütfen ribavirin ürün bilgilerine de bakınız.
Cinsiyet:
PEGASYS farmakokinetiği sağlıklı kadın ve erkek kişilerde karşılaştırılabilirdir. Geriyatrik popülasyon:
62 yaşından daha yaşlı kişilerde, EAA hafif düzeyde artar, ancak pik konsantrasyonları 62 yaşından yaşlı ve genç olanlarda benzerdir. İlacın vücutta tutulması, farmakodinamik yanıt ve tolerabiliteye dayanarak, yaşlı hastalarda daha düşük bir PEGASYS başlangıç dozuna gerek yoktur (bkz. bölüm 4.2).
Sirozlu Olmayan ve Sirozlu Hastalar:
PEGASYS’in farmakokinetikleri sağlıklı kişilerde ve kronik hepatit B veya kronik hepatit C’li hastalar arasında benzerdir. Sirozlu kompanse karaciğer hastalığı olan ve sirozu olmayan hastaların maruz kalma ve farmakokinetik profilleri karşılaştırılabilir düzeydedir.
Uygulama bölgesi:
5.3. Klinik öncesi güvenlilik verileri
PEGASYS ile yapılan preklinik toksisite çalışmaları, interferon türlerinin özelliklerinden dolayı sınırlıdır. Akut ve kronik toksisite çalışmaları maymunlarda yapılmıştır ve peginterferon alfa-2a verilen maymunlarda gözlenen bulgular interferon alfa-2a ile meydana gelen bulgulara benzer olmuştur.
PEGASYS ile üreme toksisitesi çalışmaları yapılmamıştır. Diğer alfa interferonlarda olduğu gibi dişi maymunlara peginterferon alfa-2a uygulamasının ardından adet döneminin uzadığı gözlenmiştir. İnterferon alfa-2a ile tedavi rhesus maymunlarındaki düşük aktivitesinde anlamlı artışla sonuçlanmıştır. Zamanında doğan yavrularda teratojenik etki gözlenmemiş olmasına karşın insanlardaki advers etkiler göz ardı edilemez.
PEGASYS ve ribavirin
PEGASYS ribavirin ile kombine halde kullanıldığında, önceden maymunlarda iki etken madde ile de ayrı ayrı görülmeyen etkilerin hiçbiri görülmemiştir. En büyük tedavi kaynaklı değişiklik hafif - orta düzeyde geri dönüşlü anemidir ve şiddeti her iki aktif maddenin de ayrı ayrı uygulanması ile görülenden fazladır.
Karsinojenez
PEGASYS, karsinojenik potansiyeli için test edilmemiştir. Mutajenez
PEGASYS, metabolik aktivasyonun varlığında veya yokluğunda, Ames bakteriyel mutajenisite tayininde ve insan lenfositlerindeki in vitro kromozomal sapma tayininde test edildiğinde, mutajenik veya klastojenik olmadığı anlaşılmıştır. Lütfen ribavirin ürün bilgilerine de bakınız.
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505950815 |
| Etkin Madde | Peginterferon Alfa 2a |
| ATC Kodu | L03AB11 |
| Birim Miktar | 180 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 4 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünostimülan İlaçlar > Peginterferon Alfa2a |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |