PERJETA 420 mg/14 ml IV konsantre infüzyon çöz. içeren 1 flakon Kısa Ürün Bilgisi
{ Pertuzumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
PERJETA 420 mg/ 14 mL konsantre infüzyon çözeltisi Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir flakon 14 mL'lik çözelti içinde 420 mg pertuzumab içerir. Çözeltinin her mL'sinde 30 mg pertuzumab bulunur.
Seyreltilmesinin ardından bir mL çözelti, başlangıç dozu için yaklaşık 3,02 mg pertuzumab ve idame dozu yaklaşık 1,59 mg pertuzumab içerir (bkz. Bölüm 6.6).
Pertuzumab, rekombinant DNA teknolojisi ile memeli (Çin hamsteri yumurtalığı) hücrelerinde üretilen bir hümanize IgG1 monoklonal antikorudur.
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Konsantre infüzyon çözeltisi
Berrak ile hafif opalesan, renksiz ile açık sarı arası renkte, sıvı.
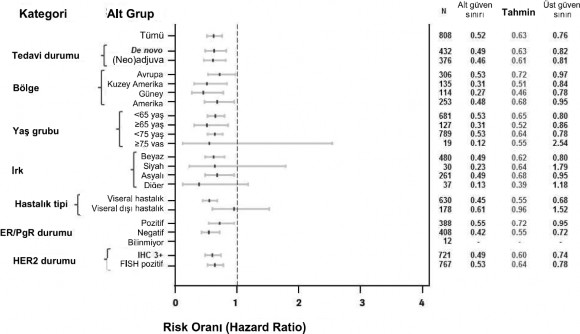
Hauck-Anderson yöntemi kullanılarak iki yanıt oranının farkı için yaklaşık %95 GA.
İlk ara analizden elde edilen veriler
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Neoadjuvan erken evre meme kanseri:
PERJETA, trastuzumab ve kemoterapi ile kombine olarak HER2-pozitif, lokal ilerlemiş, enflamatuvar ya da lokal ileri evre meme kanseri (T3-4 ve/veya Nod pozitif) olan hastaların neoadjuvan tedavisinde endikedir. Neoadjuvan PERJETA tedavisi 4 kürle sınırlıdır.
Metastatik meme kanseri:
PERJETA daha önce metastatik hastalığı için sistemik kemoterapi veya trastuzumab tedavisi almamış, ECOG performans skoru 0-1 olan, HER-2/neu pozitif olan metastatik meme kanserinde ilk seri tedavide trastuzumab ve dosetaksel kemoterapisi ile kombine olarak progresyona kadar kullanımı endikedir. PERJETA tedavisi alırken progresyon
gösteren hastalarda bir daha monoterapi veya kombinasyon tedavisinin bir parçası olarak devam edilemez.
Adjuvan veya neoadjuvan trastuzumab kullanmış hastalarda trastuzumab tedavisinin tamamlanmasından sonraki ilk 12 ay içinde veya tedavi sırasında gelişen hastalık nüksü veya progresyonunda PERJETA kullanılamaz. Adjuvan veya neoadjuvan trastuzumab tedavisinin tamamlanmasından sonraki 12 aydan sonra gelişen hastalık nüksü veya progresyonunda PERJETA trastuzumab ve dosetaksel kemoterapisi ile kombine olarak progresyona kadar kullanımı endikedir.
4.2. Pozoloji ve uygulama şekli
PERJETA tedavisi, ancak anti-kanser ajanlarının uygulanması konusunda deneyimli bir hekimin denetimi altında uygulanmalıdır. PERJETA, anafilaksiye müdahale edebilecek bir sağlık uzmanı tarafından ve acil durumda tam resüsitasyon olanaklarının bulunduğu bir ortamda uygulanmalıdır.
Pozoloji:
PERJETA ile tedavi edilen hastalar HER2 pozitif tümör durumuna sahip olmalıdır; bu durum, immünohistokimya (IHK) ile 3+ ve/veya valide edilmiş bir testle değerlendirilen in situ hibridizasyonda (ISH) > 2,0 oranıyla tanımlanır.
Kesin ve tekrarlanabilir sonuçlar elde etmek için test işlemleri, test prosedürlerinin valide edilebildiği konusunda uzman bir laboratuvarda yapılmalıdır. Tayin performansı ve yorumlama ile ilgili eksiksiz talimat için valide edilmiş HER2 test tayinlerine ilişkin kullanma talimatlarına bakınız.
Uygulama sıklığı ve süresi:
PERJETA için önerilen yükleme dozu, 60 dakikalık intravenöz infüzyon yoluyla uygulanan 840 mg ve takiben 3 haftada bir 30 ile 60 dakika süreyle uygulanan 420 mg'lık idame dozudur. Her infüzyonun tamamlanmasının ardından 30-60 dakikalık bir gözlem periyodu önerilir. Takip eden trastuzumab ya da kemoterapi infüzyonu öncesinde gözlem periyodu tamamlanmalıdır (bkz. Bölüm 4.4.).
PERJETA ve trastuzumab ardışık olarak uygulanmalıdır ve aynı infüzyon torbasında karıştırılmamalıdır. PERJETA ve trastuzumab herhangi bir sırayla verilebilir. PERJETA ile birlikte uygulandığında, trastuzumabın önerilen başlangıç yükleme dozu intravenöz infüzyon yoluyla 8 mg/kg vücut ağırlığıdır ve daha sonra bu dozu, 3 haftada bir 6 mg/kg vücut ağırlığı şeklinde, idame dozu izler.
Taksan alan hastalarda, PERJETA ve trastuzumab taksandan önce uygulanmalıdır.
PERJETA ile birlikte uygulandığında, dosetaksel için önerilen başlangıç dozu 75 mg/m'dir; daha sonra 3 haftalık plana göre uygulanır. Başlangıç dozu iyi tolere edilirse, takip eden sikluslarda dosetaksel dozu 100 mg/m değerine yükseltilebilir. Alternatif olarak, yine seçilen rejime bağlı olarak, dosetaksel başlangıçtan itibaren 3 haftada bir 100 mg/m verilebilir. Karboplatin bazlı bir rejim uygulanıyorsa, dosetaksel için önerilen doz 75 mg /m'dir (doz artışı yok).
Metastatik meme kanseri:
Metastatik meme kanserinde PERJETA trastuzumab ve dosetaksel ile birlikte uygulanmalıdır, hastalık progresyonu veya yönetilemez toksisite görülene dek, dosetaksel tedavisi kesilse dahi hastalar PERJETA ve trastuzumab ile tedaviye devam etmelidir.
Neoadjuvan erken evre meme kanseri:
Neoadjuvan tedavide, PERJETA, trastuzumab ve dosetaksel ile birlikte, erken evre meme kanseri için tam tedavi rejiminin bir parçası olarak 3 ile 4 siklus kullanılmalıdır.
Geciktirilen veya atlanan dozlar:
Geciktirilen veya atlanan doz önerileri için Tablo 1'e bakınız..
Tablo 1: Geciktirilen veya atlanan dozlar için öneriler
İki ardışık infüzyon arasındaki süre | PERJETA | Trastuzumab IV |
< 6 hafta | 420 mg PERJETA dozu en kısa sürede uygulanmalıdır. Bir sonraki planlanan doz beklenmemelidir. Daha sonra, planlanmış zamanlamaya dönülmelidir. | 6 mg/kg trastuzumab dozu en kısa sürede uygulanmalıdır. Bir sonraki planlanan doz beklenmemelidir. Daha sonra, planlanmış zamanlamaya dönülmelidir. |
≥6 hafta | 840 mg PERJETA başlangıç yükleme dozu 60 dakikalık intravenöz infüzyon olarak yeniden uygulanmalıdır ve takiben 3 haftada bir intravenöz olarak 420 mg'luk idame dozu uygulanmalıdır. | 8 mg/kg yükleme dozu intravenöz infüzyon yoluyla yaklaşık 90 dakika süreyle uygulanmalıdır ve takiben 3 haftada bir intravenöz olarak 6mg/kg idame dozu uygulanır. |
Doz değişikliği:
PERJETA ya da trastuzumab için doz azaltımı önerilmez. Trastuzumab ile ilgili detaylı bilgi için trastuzumab kısa ürün bilgisine bakınız.
Hastalar, kemoterapi ile indüklenen geri dönüşümlü miyelosüpresyon periyotları süresince tedaviye devam edebilir ancak bu zaman zarfında bu hastalara dikkatli bir şekilde nötropeni komplikasyonu takibi yapılmalıdır. Dosetaksel doz değişiklikleri için dosetaksel kısa ürün bilgisine bakınız.
Trastuzumab tedavisinin kesilmesi durumunda PERJETA ile tedavinin de kesilmesi gereklidir.
Sol ventrikül disfonksiyonu:
Konjestif kalp yetmezliğini düşündüren bulgu ve belirtiler durumunda, PERJETA ve trastuzumab kullanımına en az 3 hafta süreyle ara verilmelidir. Semptomatik kalp yetmezliğinin doğrulanması durumunda PERJETA sonlandırılmalıdır (bkz. Bölüm 4.4.).
Metastatik meme kanserli hastalar:
Hastaların tedavi öncesi sol ventriküler ejeksiyon fraksiyonu (LVEF) >%50 olmalıdır. Aşağıdaki durumlarda PERJETA ve trastuzumab kullanımına en az 3 hafta süreyle ara verilmelidir;
LVEF'in %40'ın altına düşmesi
4.3. Kontrendikasyonlar
Pertuzumaba veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı bilinen aşırı duyarlılık.
4.4. Özel kullanım uyarıları ve önlemleri
Embriyo-fetal ölüm:
PERJETA'ya maruz kalmak embriyo-fetal ölüme ve doğum kusurlarına neden olabileceği için, hastalar, PERJETA tedavisi alırken ve son PERJETA dozundan sonra 6 ay süresince etkili bir doğum kontrol yöntemi kullanmalıdır. Etkili kontrasepsiyon kullanmıyorsa, tedavi durdurulmalı veya önlem alınmalıdır.
Sol ventrikül disfonksiyonu (konjestif kalp yetmezliği dahil):
PERJETA dahil olmak üzere, HER2 aktivitesini bloke eden tıbbi ürünlerle ilgili olarak LVEF'de düşüş bildirilmiştir. Semptomatik sol ventrikül sistolik fonksiyon bozukluğu (LVD) insidansı, PERJETA'nın trastuzumab ve kemoterapi ile birlikte kullanıldığı hastalarda, trastuzumab ve kemoterapi ile tedavi edilen hastalara göre daha yüksektir. Daha önce antrasiklin veya göğüs bölgesine radyoterapi uygulanmış hastalarda LVEF düşüşü riski daha yüksek olabilir. Adjuvan tedavide semptomatik kalp yetmezliği gelişen olguların çoğu antrasiklin bazlı tedavi alan hastalarda bildirilmiştir.
PERJETA, tedavi öncesi LVEF değeri <%50; geçmiş konjestif kalp yetmezliği (KKY) hikayesi; önceki trastuzumab adjuvan tedavisinde LVEF değerinin <%50'ye düşmesi; veya kontrol edilemeyen hipertansiyon, yakın tarihli miyokard enfarktüsü, tedavi gerektiren ciddi kardiyak aritmi gibi sol ventrikül fonksiyonunu etkileyebilecek rahatsızlıklar veya önceden kümülatif >360 mg/m doksorubisine veya eşdeğeri antrasiklin maruziyeti olan hastalarda incelenmemiştir.
LVEF düzeyinin normal limitler dahilinde olduğundan emin olmak için, LVEF düzeyi, PERJETA kullanımına başlamadan önce ve tedavi sırasında düzenli aralıklarla (örneğin; neoadjuvan tedavisi sırasında bir kez ve metastatik durumda adjuvan tedavide her 12 haftada bir) değerlendirilir. LVEF iyileşme göstermezse ve bölüm 4.2'de belirtildiği gibi daha da düşerse ya da sonraki değerlendirmelerde daha fazla düşerse, söz konusu hasta için faydalar risklerden ağır basmadığı takdirde PERJETA ve trastuzumabın kesilmesi kesinlikle düşünülmelidir.
PERJETA bir antrasiklin ile birlikte kullanılmadan önce her hastada kardiyak risk dikkatle değerlendirilmeli ve hastanın medikal ihtiyacı karşısında dengelenmelidir. HER2-hedefli ajanlar ve antrasiklinlerin farmakolojik etkilerine dayanılarak, PERJETA ve antrasiklinlerin ardışık kullanımı ile karşılaştırıldığında bu ajanların eşzamanlı kullanımında kardiyak riskte bir artış beklenebilir.
APHINITY ve BERENICE çalışmalarında bir çok antrasiklin bazlı rejimin epirubisin yada doksorubisin komponentinin ardından PERJETA'nın trastuzumab ve bir taksanla kombine olarak ardışık kullanımı değerlendirilmiştir. Bununla birlikte, PERJETA ve bir antrasiklinin birlikte kullanımı ile ilgili mevcut güvenlilik verileri sınırlıdır. TRYPHAENA çalışmasında PERJETA, FEC rejiminin (5-florourasil, epirubisin, siklofosfamid) bir parçası olarak epirubisin ile eşzamanlı verilmiştir.(bkz. Bölüm 4.8 ve 5.1). Sadece önceden kemoterapi almamış hastalar tedavi edilmiş ve bu hastalar düşük kümülatif dozlarda epirubisin (300 mg/m'ye kadar) almışlardır. Bu çalışmadaki kardiyak güvenlilik aynı rejimde fakat FEC kemoterapisinin ardından PERJETA'nın ardışık verildiği hastalarda gözlemlenen ile benzerdir.
İnfüzyon reaksiyonları:
PERJETA, ölümle sonuçlanan vakaları içeren infüzyon reaksiyonlarıyla ilişkilendirilmiştir (bkz. Bölüm 4.8). İlk infüzyon sırasında ve infüzyondan sonra 60 dakika süreyle ve sonraki PERJETA infüzyonları sırasında ve infüzyonlardan sonra 30-
60 dakika süreyle hastanın yakından gözlenmesi önerilir. Belirgin bir infüzyon reaksiyonu görülürse, infüzyon yavaşlatılmalı veya kesilmelidir ve uygun tıbbi tedaviler uygulanmalıdır. Hastalar değerlendirilmelidir ve belirtiler ve bulgular tamamen düzelene kadar dikkatle izlenmelidir. Şiddetli infüzyon reaksiyonları olan hastalarda infüzyonun kalıcı olarak sonlandırılması düşünülmelidir. Bu klinik değerlendirmede, önceki reaksiyonun şiddeti ve istenmeyen etki için uygulanan tedaviye yanıt temel alınmalıdır (bkz. Bölüm 4.2).
Aşırı duyarlılık reaksiyonları/anafilaksi:
Hastalar, aşırı duyarlılık reaksiyonları açısından yakından izlenmelidir. PERJETA ile anafilaksi ve ölümle sonuçlanan vakalar dahil şiddetli aşırı duyarlılık gözlenmiştir (bkz. Bölüm 4.8). Acil durumda kullanılmak üzere, bu tip reaksiyonların tedavisine yönelik ilaçlar yanısıra, acil ekipmanı hazır bulunmalıdır. Ulusal Kanser Enstitüsü - Advers Olaylar için Ortak Terminoloji Kriterleri (NCI-CTCAE) Derece 4 aşırı duyarlılık
reaksiyonları (anafilaksi), bronkospazm veya akut solunum güçlüğü sendromu oluşması durumunda PERJETA kalıcı olarak sonlandırılmalıdır (bkz. Bölüm 4.2).
Febril nötropeni:
PERJETA, trastuzumab ve dosetaksel ile tedavi edilen hastalar, özellikle tedavinin ilk 3 siklusu süresince, plasebo, trastuzumab ve dosetaksel ile tedavi edilen hastalara oranla daha fazla febril nötropeni riski altındadır (bkz. Bölüm 4.8). Metastatik meme kanserinde CLEOPATRA çalışmasında, PERJETA ile ve plasebo ile tedavi edilen hastalarda benzer şekilde en düşük nötrofil sayıları gözlenmiştir. PERJETA ile tedavi edilen hastalarda daha yüksek febril nötropeni insidansı bu hastalardaki daha yüksek mukozit ve ishal insidansıyla ilişkilendirilebilir. Semptomatik mukozit ve ishal tedavisi düşünülmelidir. Dosetaksel uygulamasının kesilmesinin ardından febril nötropeni vakası bildirilmemiştir.
Diyare:
Pertuzumab şiddetli diyareye sebep olabilir. Diyare en sık taksan tedavi ile eş zamanlı uygulamada görülür. Genç hastalar (<60) ile karşılaştırıldığında yaşlı hastalarda (≥65) diyare riski daha yüksektir. Diyare standart uygulama ve kılavuzlara göre tedavi edilmelidir. Özellikle yaşlı hastalarda ve şiddetli veya devam eden diyare durumunda loperamid ile erken müdahale, sıvı ve elektrolit replasmanı düşünülmelidir. Hastanın durumunda bir düzelme olmaması halinde pertuzumab tedavisinin durdurulması düşünülmelidir. Diyare kontrol altına alındığında pertuzumab tedavisine devam edilebilir.
Biyoteknolojik tıbbi ürünlerin izlenebilirliğinin sağlanması için uygulanan ürünün ticari adı ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Randomize, pivotal CLEOPATRA çalışmasında, 37 hasta üzerinde yapılan alt çalışmada, PERJETA ve trastuzumab veya PERJETA ve dosetaksel arasında farmakokinetik etkileşim gözlenmemiştir. Ayrıca, popülasyon farmakokinetiği analizinde, PERJETA ve trastuzumab veya PERJETA ve dosetaksel arasında ilaç-ilaç etkileşimine dair bir kanıt ortaya konmamıştır. NEOSPHERE ve APHINITY çalışmalarından sağlanan veriler ile ilaç-ilaç etkileşiminin olmadığı doğrulanmıştır.
PERJETA, trastuzumab ve taksan kombinasyon rejimlerinde, PERJETA ve trastuzumab herhangi bir sırayla kullanılabilir ancak taksan yalnızca PERJETA ve trastuzumab uygulamasının ardından uygulanmalıdır. PERJETA ve trastuzumab, antrasiklin bazlı rejim alan hastalarda antrasiklin tedavisinin tamamlanmasından sonra uygulanmalıdır.
PERJETA'nın birlikte uygulanan sitotoksik ajanlar, dosetaksel, paklitaksel, gemsitabin, erlotinib, karboplatin ve kapesitabin farmakokinetikleri üzerindeki etkileri beş çalışmada değerlendirilmiştir. PERJETA ile bu ajanların herhangi biri arasında herhangi bir farmakokinetik etkileşim kanıtı bulunmamıştır. Bu çalışmalardaki PERJETA'nın farmakokinetiği tek ajanlı çalışmalarda gözlenenlere benzerdir.
Özel popülasyonlara ilişkin ek bilgiler:
Özel popülasyonlara ilişkin herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar PERJETA tedavisi alırken ve son PERJETA dozundan sonra 6 ay süresince etkili bir doğum koruma yöntemi kullanmalıdır.
Gebelik dönemi
Gebe kadınlarda pertuzumab kullanımına ilişkin veriler sınırlıdır.
Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesi ortaya koymuştur (bkz. Bölüm 5.3).
PERJETA'nın gebelik ve/veya fetüs/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır.
PERJETA gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
PERJETA'nın gebelik süresince ve çocuk doğurma potansiyeli olan ancak doğum kontrol yöntemi kullanmayan kadınlar tarafından kullanılması önerilmez.
Laktasyon dönemi
İnsan IgG'si insan sütünde salgılandığından ve absorpsiyon ile bebeğe zarar potansiyeli bilinmediğinden, çocuğun emzirilmesinin faydası ile kadına yönelik PERJETA tedavisinin faydaları dikkate alınarak emzirmenin veya tedavinin kesilmesi konusunda bir karar verilmelidir (bkz. Bölüm 5.2).
Üreme yeteneği/Fertilite
Pertuzumabın etkisini değerlendirmek amacıyla hayvanlarda spesifik fertilite çalışması gerçekleştirilmemiştir. Erkek üreme sistemi üzerindeki istenmeyen etkilerin riski açısından sinomolgus maymunlarında yürütülen tekrarlayan doz toksisite çalışmalarından çok sınırlı veri elde edilmiştir. Pertuzumaba maruz bırakılan cinsel açıdan olgun dişi sinomolgus maymunlarında istenmeyen etki gözlenmemiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Bildirilen istenmeyen etkiler temelinde, PERJETA'nın araç ya da makine kullanma kapasitesi üzerinde hafif etkisi vardır. PERJETA ile tedavi sırasında baş dönmesi görülebilir (bkz. Bölüm 4.8). İnfüzyon reaksiyonları oluşan hastalara, semptomlar ortadan kalkana kadar, araç ya da makine kullanmamaları tavsiye edilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özetiPERJETA'nın güvenliliği, çeşitli maligniteleri olan ve çoğunlukla başka antineoplastik ajanlarla kombinasyon halinde PERJETA ile tedavi edilmiş hastalarla yürütülen Faz I ve Faz II ve Faz III çalışmalarda 6000'den fazla hastada değerlendirilmiştir. Bu çalışmalar, CLEOPATRA (n=808), NEOSPHERE (n=417), TRYPHAENA (n=225) ve
APHINITY (n=4804) pivotal çalışmalarıdır. İnsidans ve istenmeyen etkiler PERJETA'nın monoterapi olarak ya da antineoplastik ajanlarla eşzamanlı uygulanmasına bağlı olarak farklılık göstermekle birlikte PERJETA'nın güvenliliği tüm çalışmalarda genellikle uyumlu olmuştur.
Tablo 2'de aşağıdaki pivotal klinik çalışmaların PERJETA tedavi grubundan elde edilen istenmeyen etkiler özetlenmiştir.
CLEOPATRA'da PERJETA, trastuzumab ve dosetaksel ile birlikte metastatik meme kanserli hastalara verilmiştir (n=453)
4.9. Doz aşımı ve tedavisi
PERJETA'nın maksimum tolere edilebilen dozu belirlenmemiştir. Klinik çalışmalarda 25 mg/kg'dan (1727 mg) yüksek tek dozlar test edilmemiştir.
Doz aşımı durumunda, hastalar istenmeyen olay belirtileri ve bulguları açısından yakından izlenmeli ve gerekli semptomatik tedavi başlatılmalıdır.
Simes çokluluk düzeltmesiyle Cochran-Mantel-Haenszel testinden p değeri.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajan, monoklonal antikorlar ATC kodu: L01XC13
Etki Mekanizması
Pertuzumab, insan epidermal büyüme faktörü reseptörü 2 proteininin (HER2) ekstrasellüler dimerizasyon alanını (alt alan II) spesifik olarak hedefleyen ve bu sayede HER2'nin ve EGFR, HER3 ve HER4 gibi diğer HER ailesi üyelerinin ligand bağımlı heterodimerizasyonunu bloke eden bir rekombinant hümanize monoklonal antikorudur. Sonuç olarak, PERJETA iki temel sinyal yolu (mitojenle aktive edilen protein (MAP) kinaz ve fosfoinositid 3-kinaz (PI3K)) aracılığıyla ligand tarafından başlatılan intrasellüler sinyali inhibe eder. Bu sinyal yollarının inhibisyonu, sırasıyla hücre büyümesinin durmasına ve apoptoza neden olabilir. Buna ek olarak, pertuzumab, antikor bağımlı hücre aracılı sitotoksisiteye (ADCC) aracılık eder.
Pertuzumab tek başına insan tümör hücrelerinin proliferasyonunu inhibe ederken, pertuzumabın trastuzumab ile kombinasyonu, HER2'yi aşırı eksprese eden ksenograft modellerinde antitümör aktiviteyi önemli düzeyde artırmıştır.
Klinik etkililik ve güvenlilik
![]()
PERJETA'nın HER2 pozitif meme kanserinde etkililiği metastatik meme kanserinde randomize, bir faz III çalışma ve bir tek kollu faz II çalışmada, erken evre meme kanserinde, biri kontrollü olan iki randomize neoadjuvan faz II çalışmada, bir randomize olmayan neoadjuvan faz II çalışma ve bir randomize adjuvan faz III çalışmada desteklenmektedir.
HER2 aşırı ekspresyonu bir merkez laboratuarında belirlendi ve immünohistokimya (IHK) ile 3+ skoruyla veya in situ hibridizasyonda (ISH) > 2,0 oranıyla aşağıda özetlenen çalışmalarda tanımlanmıştır.
Metastatik meme kanseri:
Trastuzumab ve dosetaksel ile kombinasyon halinde PERJETA:
CLEOPATRA (WO20298), HER2 pozitif metastatik veya lokal olarak nüks eden, rezekte edilemeyen meme kanseri olan 808 hastayı kapsayan çok merkezli, randomize, çift kör, plasebo kontrollü bir faz III klinik çalışmadır. Klinik açıdan önemli kalp riski faktörleri taşıyan hastalar çalışmaya dahil edilmemiştir (bkz. Bölüm 4.4). Beyin metastazı olan hastaların çalışma dışında bırakılması nedeniyle, PERJETA'nın beyin metastazları üzerindeki aktivitesine ilişkin veri bulunmamaktadır. Lokal olarak nüks etmiş rezekte edilemeyen meme kanserli hastalara ilişkin veriler son derece sınırlıdır. Hastalar, plasebo + trastuzumab + dosetaksel veya PERJETA + trastuzumab + dosetaksel almak üzere 1:1 oranında randomize edilmiştir.
PERJETA ve trastuzumab 3 haftalık rejimde standart dozlarda verilmiştir. Hastalar hastalık progresyonu, bilgilendirilmiş onam formunun geri çekilmesine veya kontrol altına alınamayan toksisite görülene dek PERJETA ve trastuzumab ile tedavi edilmiştir. Dosetaksel, en az 6 siklus için üç haftada bir 75 mg/m başlangıç dozunda intravenöz infüzyon olarak uygulanmıştır. Başlangıç dozu iyi tolere edildiğinde, dosetaksel dozu araştırıcının kararına bağlı olarak, 100 mg/m değerine yükseltilebilmiştir.
Çalışmanın birincil sonlanım noktası progresyonsuz sağkalımdır (PFS). PFS, bağımsız değerlendirme merkezi (IRF) tarafından değerlendirilmiş ve randomizasyon tarihinden hastalık progresyonuna veya son tümör değerlendirmesinden itibaren 18 hafta içinde gerçekleşmesi durumunda ölüme (herhangi bir nedenle) kadar olan süre olarak tanımlanmıştır. Sekonder etkililik sonlanım noktaları ise genel sağkalım (OS), PFS (araştırmacı tarafından değerlendirilen), objektif yanıt oranı (ORR), yanıt süresi ve FACT B Yaşam Kalitesi anketine göre semptom progresyonuna kadar geçen süredir.
Her tedavi grubunda hastaların yaklaşık olarak yarısında hormon reseptörü pozitif hastalık (östrojen reseptörü pozitif ve/veya progesteron reseptörü pozitif) vardır ve her tedavi grubundaki hastaların yaklaşık yarısı daha önce adjuvan veya neoadjuvan tedavi almıştır. Bu hastaların çoğu daha önce antrasiklin tedavisi, tüm hastaların ise %11'i daha önce trastuzumab tedavisi almıştır. Her iki tedavi grubundaki hastaların toplam
%43'ü önceden radyoterapi almış hastalardır. Her iki grupta da hastaların başlangıçtaki medyan LVEF değeri %65,0 olmuştur (aralık %50-%88).
CLEOPATRA çalışmasından elde edilen etkililik sonuçları Tablo 3'te özetlenmiştir. Plaseboyla tedavi edilen gruba kıyasla, PERJETA ile tedavi edilen grupta, IRF tarafından değerlendirilen PFS düzeyinde istatistiksel olarak anlamlı iyileşme
görülmüştür. Araştırıcı tarafından değerlendirilen PFS sonuçları, IRF tarafından değerlendirilen PFS sonuçlarıyla benzerdir.
Tablo 3: CLEOPATRA çalışmasının etkililik özeti
Parametre | Plasebo + trastuzumab + dosetaksel n=406 | PERJETA + trastuzumab + dosetaksel n=402 | HR (%95 GA) | p değeri |
Progresyonsuz Sağkalım (bağımsız değerlendirme) Birincil sonlanım noktası*
Ölçülebilir hastalığı olan hasta sayısı Medyan ay |
242 (%59) 12,4 |
191 (%47,5) 18,5 |
0,62 [0,51; 0,75] |
<0,0001 |
Genel Sağkalım Sekonder sonlanım noktası**
Ölçülebilir hastalığı olan hasta sayısı Medyan ay |
221 (%54,4) 40,8 |
168 (%41,8) 56,5 |
0,68 [0,56; 0,84] |
0,0002 |
Objektif Yanıt Oranı |
|
|
|
|
(ORR)^ Sekonder sonlanım |
|
|
|
|
noktası |
|
|
|
|
Ölçülebilir hastalığı olan |
|
|
|
|
hasta sayısı | 336 | 343 | ORR'deki | 0,0011 |
Yanıt verenler*** | 233 (%69,3) | 275 (%80,2) | değişiklik: |
|
| [64,1; 74,2] | [75,6; 84,3] | %10.8 |
|
ORR için %95 GA | 14 (%4,2) | 19 (%5,5 ) | [4,2, 17,5] |
|
Tam yanıt (TY) | 219 (%65,2) | 256 (%74,6) |
|
|
| 70 (%20,8) | 50 (%14,6) |
|
|
Kısmi Yanıt (KY) | 28 (%8,3) | 13 (%3,8) |
|
|
Stabil hastalık (SH) |
|
|
|
|
Progresif hastalık (PH) |
|
|
|
|
Yanıt Süresi †^ |
|
|
|
|
n= | 233 | 275 | ||
Medyan hafta | 54,1 | 87,6 | ||
Medyan için %95 GA | [46; 64] | [71; 106] |
* Primer progresyonsuz sağkalım analizi. Veri kesim tarihi: 13 Mayıs 2011.
** Olaya dayalı final genel sağ kalım analizi. Veri kesim tarihi: 11 Şubat 2014.
*** RECIST ile doğrulanan TY veya KY için en iyi genel yanıta sahip hastalar.
†TY veya KY için En İyi Genel Yanıta sahip hastalarda değerlendirilmiştir.
^ Objektif yanıt oranı ve yanıt süresi, IRF tarafından değerlendirilen tümör değerlendirmelerine dayanmaktadır.
Coğrafi bölge ve geçmiş adjuvan/neoadjuvan tedavi veya de novo metastatik meme kanseri sınıflandırma faktörlerine dayalı alt grupları içeren önceden belirlenmiş hasta alt gruplarında tutarlı bulgular gözlenmiştir (bkz. Şekil 1). Bir post hoc inceleme veri analizi, önceden trastuzumab verilen hastalarda (n=88), IRF ile değerlendirilen PFS için risk oranının 0,62 (%95 GA 0,35, 1,07), önceden trastuzumab içermeyen tedavi gören
hastalarda ise (n=288) 0,6 (%95 GA 0,43, 0,83) olduğunu ortaya koymuştur.
Şekil 1: IRF tarafından değerlendirilen PFS'nin hasta alt grubuna göre dağılımı
Olaya dayalı nihai OS analizi 389 hasta öldüğünde (plasebo uygulanan grupta 221 ve PERJETA uygulanan grupta 168) gerçekleştirilmiştir. Daha önce ara OS analizinde (primer analizden bir yıl sonra yapılmıştır) gözlenen, PERJETA uygulanan grup lehine istatistiksel anlamlı OS yararı korunmuştur (HR 0,68, p=0,0002 log-sıra testi). Ölüme kadar geçen medyan süre, plasebo uygulanan grupta 40,8 ay ve PERJETA uygulanan grupta 56,5 ay olmuştur (bkz. Tablo 3, Şekil 2).
Tanımlayıcı OS analizi çalışmanın sonunda 515 hasta öldüğünde (plasebo uygulanan grupta 280 ve PERJETA uygulanan grupta 235) gerçekleştirilmiştir. Analiz PERJETA uygulanan grupta istatiktiksel anlamlı OS yararının medyan 99 aylık (HR 0,69, p<0,0001 log-sıra testi; ölüme kadar geçen medyan süre plasebo uygulanan grupta 40,8 ay ve PERJETA uygulanan grupta 57,1 ay) takip süresinden sonra da korunduğunu göstermiştir. 8 yıllık sağkalım analizi sonuçarında 8 yıllık sağkalım oranı PERJETA uygulanan grupta %37 iken plasebo uygulanan grupta %23 olarak saptanmıştır.
Şekil 2: Kaplan-Meier Eğrisi Olaya Dayalı Genel Sağkalım
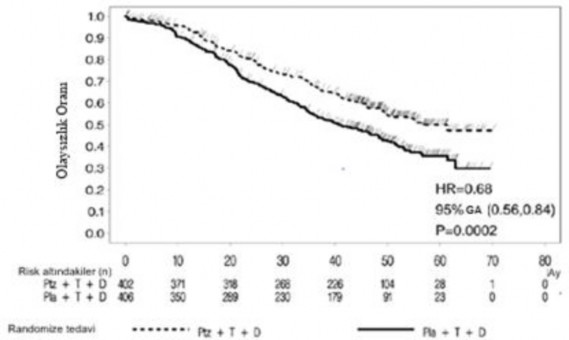
HR: Risk oranı; GA: Güven aralığı; Pla: Plasebo; Ptz: Pertuzumab; T: Trastuzumab (Herceptin); D: Dosetaksel
İki tedavi grubu arasında, FACT-B TOI-PFB skorlarıyla değerlendirilen Sağlıkla İlişkili Yaşam Kalitesi'nde istatistiksel olarak anlamlı farklılık görülmemiştir.
Ek Destekleyici Klinik Çalışma Bilgileri
B017929 – Metastatik meme kanseri için tek kollu klinik çalışma:
BO17929 faz II, randomize olmayan bir çalışmadır ve tümörleri trastuzumab tedavisi sırasında ilerleyen metastatik meme kanserli hastalarda yapılmıştır. PERJETA ve trastuzumab ile tedavi, %24,2'lik bir yanıt sağlamış, hastaların %25,8'inde en az 6 ay süreyle hastalık stabilizasyonu elde edilmiştir; bu bulgu trastuzumab sırasında progresyonu takiben PERJETA'nın aktif olduğunu göstermiştir.
Meme Kanserinin Neoadjuvan Tedavisi:
Neoadjuvan koşullarda, lokal olarak ilerlemiş ve inflamatuvar meme kanserleri, hormon reseptör durumuna bakılmaksızın yüksek riskli kabul edilirler. Erken evre meme kanserinde risk değerlendirmesinde tümör boyutu, derecesi, hormon reseptör durumu ve lenf bezi metastazlarının göz önünde bulundurulması gerekir.
Meme kanserinin neoadjuvan tedavisinde endikasyon, genel sağkalım ve hastalıksız sağkalım gibi uzun dönem sonuçlar açısından faydası saptanamayan veya net bir şekilde ölçülemeyen patolojik yanıt oranında bir artışın gösterilmesine ve hastalıksız sağkalımda düzelme eğilimlerine dayanmaktadır.
NEOSPHERE (WO20697)
NEOSPHERE, PERJETA ile yürütülen faz II, çok merkezli, çok uluslu randomize kontrollü bir çalışmadır ve önceden trastuzumab, kemoterapi veya radyoterapi almamış yeni tanılı, erken evre, inflamatuvar veya lokal olarak ilerlemiş HER2-pozitif meme kanserli (T2-4d; primer tümör > 2 cm çapında) 417 erişkin kadın hasta ile gerçekleştirilmiştir. Metastazları, bilateral meme kanseri, klinik olarak önemli kardiyak risk faktörleri (bkz. Bölüm 4.4) veya < %55 LVEF değeri olan hastalar çalışmaya dahil edilmemiştir. Hastaların çoğu 65 yaşın altındadır.
Hastalar, cerrahi öncesinde aşağıdaki neoadjuvan rejimlerden birini 4 siklus almak üzere randomize edilmiştir:
Trastuzumab artı dosetaksel
Klinik yanıt, neoadjuvan periyot sırasında en iyi genel TY veya KY yanıtına sahip hastaları temsil eder (primer meme lezyonunda).
BERENICE (WO29217)
BERENICE; HER2-pozitif lokal olarak ilerlemiş, inflamatuvar veya erken evre meme kanseri (primer tümörler > 2 cm çapında veya nod pozitif hastalık) olan 401 hastada gerçekleştirilmiş randomize olmayan, açık etiketli, çok merkezli, çok uluslu bir Faz II çalışmadır.
BERENICE çalışmasında iki paralel hasta grubu yer almıştır. Trastuzumab artı antrasiklin/taksan bazlı kemoterapi ile neoadjuvan tedavi için uygun olduğu değerlendirilen hastalar, cerrahi öncesinde aşağıdaki şekilde iki rejimden birini almak üzere randomize edilmiştir:
Kohort A – iki haftalık yoğun doz doksorubisin ve siklofosfamid ile 4 siklus, ardından trastuzumab ve paklitaksel ile kombinasyon halinde PERJETA ile 4 siklus.
5.2. Farmakokinetik özellikler
Genel özelliklerÇeşitli tiplerde ilerlemiş maligniteler bulunan, PERJETA'yı tek ajan ya da kombinasyon olarak 3 haftada bir 30-60 dakikalık intravenöz infüzyon yoluyla 2 ile 25 mg/kg aralığındaki dozlarda alan farklı klinik çalışmalara (faz I, II ve III) katılmış 481 hastadan elde edilen verilerle bir popülasyon farmakokinetik analizi yapılmıştır.
Emilim:
PERJETA intravenöz infüzyon şeklinde uygulanmaktadır. Dağılım:
Tüm klinik çalışmalar genelinde, tipik bir hastada santral (Vc) ve periferik (Vp) kompartmanda dağılım hacmi sırasıyla 3,11 litre ve 2,46 litre olmuştur.
Biyotransformasyon:
PERJETA'nın metabolizması doğrudan incelenmemiştir. Antikorlar, temel olarak katabolizma yoluyla temizlenir.
Eliminasyon:
Pertuzumabın medyan klerensi (Kl) 0,235 litre/gün, medyan yarılanma ömrü ise 18 gündür.
Doğrusallık/doğrusal olmayan durum:
PERJETA, önerilen doz aralığı dahilinde doğrusal farmakokinetik sergilemiştir.
Hastalardaki karakteristik özellikler
Yaşlı hastalar:
Popülasyon farmakokinetik analizi temelinde, 65 yaş altı (n=306) ve 65 yaş ve üzeri (n=175) hastalar arasında PERJETA farmakokinetiğinde anlamlı bir farklılık gözlenmemiştir.
Böbrek yetmezliği olan hastalar:
PERJETA için böbrek yetmezliğiyle ilgili özel çalışmalar yapılmamıştır. Popülasyon farmakokinetik analizi sonuçları temelinde, hafif (kreatinin klerensi [KrKl] 60-90 ml/dak, N=200) ve orta şiddette böbrek yetmezliği (KrKl 30-60 ml/dak, N=71) olan hastalarda PERJETA maruziyetinin, böbrek fonksiyonu normal hastaların (KrKl > 90 ml/dak, N=200) PERJETA maruziyeti ile benzerdir. KrKl aralığında (27-244 ml/dak), KrKl ve PERJETA maruziyeti arasında ilişki gözlenmemiştir.
Diğer özel popülasyonlar:
Popülasyon farmakokinetik analizi yaş, cinsiyet ve etnik kökene (Japon ve Japon olmayanlar karşılaştırıldığında) bağlı herhangi bir farmakokinetik farkını ortaya koymamıştır. Başlangıç albümin ve yağsız vücut ağırlığı klerensi etkileyen en önemli kovaryantlardır. Medyan klerens daha yüksek başlangıç albümin konsantrasyonları olan hastalarda düşerken, daha yüksek yağsız vücut ağırlığı olan hastalarda artmıştır. Ancak, önerilen PERJETA dozu ve planında gerçekleştirilen duyarlılık analizleri, bu iki kovaryantın uç değerlerinde, klinik öncesi tümör ksenograft modellerinde, belirlenen hedef kararlı durum konsantrasyonlarına ulaşma kapasitesinin anlamlı düzeyde etkilenmediğini göstermiştir. Bu nedenle, bu kovaryantlara dayanarak PERJETA dozajının ayarlanması gerekmemektedir.
NEOSPHERE ve APHINITY çalışmalarındaki pertuzumabın farmakokinetik (PK) sonuçları daha önceki popülasyon PK modelinden elde edilen tahminler ile tutarlıdır. Erken evre meme kanseri hastalarında metastatik meme kanseri hastalarına kıyasla pertuzumab farmakokinetiğinde hiçbir farklılık gözlenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Pertuzumabın etkisini değerlendirmek için hayvanlar üzerinde spesifik fertilite çalışmaları yapılmamıştır. Sinomolgus maymunu üzerinde yapılan tekrarlayan doz toksisite çalışmasında erkek üreme organları üzerindeki istenmeyen etkilere ilişkin kesin sonuçlara ulaşılamamaktadır.
Üreme toksikolojisi çalışmaları, gebe sinomolgus maymunları üzerinde (gestasyon günü (GD) 19'dan 50'ye) 30 ile 150 mg/kg başlangıç dozlarında ve ardından iki haftada bir verilen 10-100 mg/kg dozlarda yürütülmüştür. Ctemel alındığında bu doz seviyeleri insanlar için önerilen dozdan 2,5 ila 20 kat daha yüksek klinik olarak anlamlı maruziyete neden olmuştur. Pertuzumabın GD19 - GD50 aralığında (organogenez dönemi) intravenöz uygulanması embriyotoksik olmuş, GD25 - GD70 arasında embriyon-fetüs ölümü doza bağlı olarak artmıştır. 2 haftalık 10, 30 ve 100 mg/kg pertuzumab dozlarıyla (Ctemel alındığında insanlar için önerilen dozun 2,5 ile 20 kat fazlası) tedavi edilen gebe dişi maymunların embriyon-fetüs ölümü sırasıyla %33,
%50 ve %85 olmuştur. GD100'deki sezaryen doğumda, tüm pertuzumab doz gruplarında oligohidramniyoz, rölatif akciğer ve böbrek ağırlığında azalma ve renal
gelişim geriliği ile tutarlı mikroskobik böbrek hipoplazisi kanıtı saptanmıştır. Bunlara ek olarak, oligohidramniyoza sekonder fetüs büyümesinin kısıtlanmasıyla tutarlı şekilde akciğer hipoplazisi (30 mg/kg grubunda 1/6 ve 100 mg/kg grubunda 1/2), ventriküler septal defektler (30 mg/kg grubunda 1/6), ventrikül duvarında incelme (100 mg/kg grubunda 1/2) ve minör iskelet defektleri (eksternal – 30 mg/kg grubunda 3/6) tespit edilmiştir. Pertuzumab maruziyeti tüm tedavi gruplarının yavrularında GD100'deki
%29-40'lık maternal serum seviyesinde rapor edilmiştir.
Sinomolgus maymunlarında, 150 mg/kg'ye kadar haftalık intravenöz pertuzumab uygulaması genelde iyi tolere edilmiştir. 15 mg/kg ve üzeri dozlarda, tedavi ile ilişkili aralıklı hafif şiddetli ishal tespit edilmiştir. Maymunların bir alt grubunda, kronik dozlama (7 ile 26 haftalık dozlar) ciddi sekretuar ishal epizotlarına yol açmıştır. İshal, intravenöz sıvı replasmanı tedavisi dahil destekleyici bakım ile kontrol altına alınmıştır (bir hayvana ötanazi uygulanması hariç, 50 mg/kg/doz).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Glasiyel asetik asit L-Histidin
Sukroz Polisorbat 20 Enjeksiyonluk su
6.2. Geçimsizlikler
PERJETA ile polivinilklorür (PVC) veya PVC olmayan, polietilen de dahil polyolefin torbalar arasında herhangi bir uyumsuzluk gözlenmemiştir. PERJETA bu tür çözeltilerde kimyasal ve fiziksel olarak stabil olmadığından, PERJETA'yı seyreltmek için glukoz (%5) çözeltisi kullanılmamalıdır.
Bu tıbbi ürün, Bölüm 6.6'da belirtilenler dışındaki tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
Açılmamış flakon:24 ay
Seyreltilmiş çözelti:
Kullanım sırasındaki kimyasal ve fiziksel stabilite 30°C'de 24 saat için kanıtlanmıştır.
Mikrobiyolojik açıdan, ürün hemen kullanılmalıdır. Ürün hemen kullanılmazsa kullanım sırasındaki saklama süreleri ile kullanım öncesi koşullar kullanıcının sorumluluğundadır ve dilüsyon, kontrollü ve valide aseptik koşullarda gerçekleştirilmediği sürece, normalde 2 ile 8°C'de 24 saatten uzun olmayacaktır.
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında saklayınız (2ºC-8ºC). Dondurmayınız.
Flakonu ışıktan korumak için karton kutusunda saklayınız. Flakonu çalkalamayınız.
Tıbbi ürünün seyreltildikten sonraki saklama koşulları için bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
Kutuda bütil kauçuk tıpalı 14 mL çözelti içeren Tip I cam flakon. Her bir kutu 1 adet flakon içermektedir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
PERJETA herhangi bir antimikrobiyal koruyucu içermez. Bu sebeple, infüzyon için hazırlanan çözeltinin sterilitesini sağlamak için dikkatli olunmalıdır ve çözelti bir sağlık uzmanı tarafından hazırlanmalıdır.
PERJETA tek kullanımlıktır ve intravenöz infüzyon olarak uygulanır.
Flakon çalkalanmamalıdır. Flakondaki PERJETA konsantresinin 14 mL'si flakondan steril bir iğne ve enjektör ile çekilmeli ve %0,9'luk sodyum klorür içeren (9 mg/mL)
250 mL PVC veya PVC olmayan polyolefin infüzyon torbalarında çözelti hazırlanmalıdır. Seyreltmenin ardından çözeltinin 1 mL'si, iki adet flakon gerektiren başlangıç dozu için yaklaşık 3,02 mg (840 mg/278 mL) pertuzumab; bir adet flakon gerektiren idame dozu için ise yaklaşık 1,59 mg pertuzumab içermelidir (420 mg/264 mL). Torba, çözeltiyi karıştırmak üzere köpük oluşumunu önlemek için hafifçe baş aşağı çevrilmelidir.
Parenteral tıbbi ürünler, uygulama öncesinde partikül madde ve renk değişikliği açısından, görsel olarak incelenmelidir. Partikül ya da renk değişimi gözlemlenmesi durumunda çözelti kullanılmamalıdır. İnfüzyon hazırlandığında hemen uygulanmalıdır (bkz. Bölüm 6.3).
Kullanılmamış olan ürünler ya da atık materyaller, “Tıbbi Atıkların Kontrolü Yönetmeliği'' ve “Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | A15809 |
| Satış Fiyatı | 61720.83 TL [ 7 May 2025 ] |
| Önceki Satış Fiyatı | 61720.83 TL [ 2 May 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505762791 |
| Etkin Madde | Pertuzumab |
| ATC Kodu | L01XC13 |
| Birim Miktar | 420 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ve Beşeri bir ilaçdır. |