PERJETA 420 mg/14 ml IV konsantre infüzyon çöz. içeren 1 flakon Farmakolojik Özellikler
{ Pertuzumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajan, monoklonal antikorlar ATC kodu: L01XC13
Etki Mekanizması
Pertuzumab, insan epidermal büyüme faktörü reseptörü 2 proteininin (HER2) ekstrasellüler dimerizasyon alanını (alt alan II) spesifik olarak hedefleyen ve bu sayede HER2'nin ve EGFR, HER3 ve HER4 gibi diğer HER ailesi üyelerinin ligand bağımlı heterodimerizasyonunu bloke eden bir rekombinant hümanize monoklonal antikorudur. Sonuç olarak, PERJETA iki temel sinyal yolu (mitojenle aktive edilen protein (MAP) kinaz ve fosfoinositid 3-kinaz (PI3K)) aracılığıyla ligand tarafından başlatılan intrasellüler sinyali inhibe eder. Bu sinyal yollarının inhibisyonu, sırasıyla hücre büyümesinin durmasına ve apoptoza neden olabilir. Buna ek olarak, pertuzumab, antikor bağımlı hücre aracılı sitotoksisiteye (ADCC) aracılık eder.
Pertuzumab tek başına insan tümör hücrelerinin proliferasyonunu inhibe ederken, pertuzumabın trastuzumab ile kombinasyonu, HER2'yi aşırı eksprese eden ksenograft modellerinde antitümör aktiviteyi önemli düzeyde artırmıştır.
Klinik etkililik ve güvenlilik
![]()
PERJETA'nın HER2 pozitif meme kanserinde etkililiği metastatik meme kanserinde randomize, bir faz III çalışma ve bir tek kollu faz II çalışmada, erken evre meme kanserinde, biri kontrollü olan iki randomize neoadjuvan faz II çalışmada, bir randomize olmayan neoadjuvan faz II çalışma ve bir randomize adjuvan faz III çalışmada desteklenmektedir.
HER2 aşırı ekspresyonu bir merkez laboratuarında belirlendi ve immünohistokimya (IHK) ile 3+ skoruyla veya in situ hibridizasyonda (ISH) > 2,0 oranıyla aşağıda özetlenen çalışmalarda tanımlanmıştır.
Metastatik meme kanseri:
Trastuzumab ve dosetaksel ile kombinasyon halinde PERJETA:
CLEOPATRA (WO20298), HER2 pozitif metastatik veya lokal olarak nüks eden, rezekte edilemeyen meme kanseri olan 808 hastayı kapsayan çok merkezli, randomize, çift kör, plasebo kontrollü bir faz III klinik çalışmadır. Klinik açıdan önemli kalp riski faktörleri taşıyan hastalar çalışmaya dahil edilmemiştir (bkz. Bölüm 4.4). Beyin metastazı olan hastaların çalışma dışında bırakılması nedeniyle, PERJETA'nın beyin metastazları üzerindeki aktivitesine ilişkin veri bulunmamaktadır. Lokal olarak nüks etmiş rezekte edilemeyen meme kanserli hastalara ilişkin veriler son derece sınırlıdır. Hastalar, plasebo + trastuzumab + dosetaksel veya PERJETA + trastuzumab + dosetaksel almak üzere 1:1 oranında randomize edilmiştir.
PERJETA ve trastuzumab 3 haftalık rejimde standart dozlarda verilmiştir. Hastalar hastalık progresyonu, bilgilendirilmiş onam formunun geri çekilmesine veya kontrol altına alınamayan toksisite görülene dek PERJETA ve trastuzumab ile tedavi edilmiştir. Dosetaksel, en az 6 siklus için üç haftada bir 75 mg/m başlangıç dozunda intravenöz infüzyon olarak uygulanmıştır. Başlangıç dozu iyi tolere edildiğinde, dosetaksel dozu araştırıcının kararına bağlı olarak, 100 mg/m değerine yükseltilebilmiştir.
Çalışmanın birincil sonlanım noktası progresyonsuz sağkalımdır (PFS). PFS, bağımsız değerlendirme merkezi (IRF) tarafından değerlendirilmiş ve randomizasyon tarihinden hastalık progresyonuna veya son tümör değerlendirmesinden itibaren 18 hafta içinde gerçekleşmesi durumunda ölüme (herhangi bir nedenle) kadar olan süre olarak tanımlanmıştır. Sekonder etkililik sonlanım noktaları ise genel sağkalım (OS), PFS (araştırmacı tarafından değerlendirilen), objektif yanıt oranı (ORR), yanıt süresi ve FACT B Yaşam Kalitesi anketine göre semptom progresyonuna kadar geçen süredir.
Her tedavi grubunda hastaların yaklaşık olarak yarısında hormon reseptörü pozitif hastalık (östrojen reseptörü pozitif ve/veya progesteron reseptörü pozitif) vardır ve her tedavi grubundaki hastaların yaklaşık yarısı daha önce adjuvan veya neoadjuvan tedavi almıştır. Bu hastaların çoğu daha önce antrasiklin tedavisi, tüm hastaların ise %11'i daha önce trastuzumab tedavisi almıştır. Her iki tedavi grubundaki hastaların toplam
%43'ü önceden radyoterapi almış hastalardır. Her iki grupta da hastaların başlangıçtaki medyan LVEF değeri %65,0 olmuştur (aralık %50-%88).
CLEOPATRA çalışmasından elde edilen etkililik sonuçları Tablo 3'te özetlenmiştir. Plaseboyla tedavi edilen gruba kıyasla, PERJETA ile tedavi edilen grupta, IRF tarafından değerlendirilen PFS düzeyinde istatistiksel olarak anlamlı iyileşme
görülmüştür. Araştırıcı tarafından değerlendirilen PFS sonuçları, IRF tarafından değerlendirilen PFS sonuçlarıyla benzerdir.
Tablo 3: CLEOPATRA çalışmasının etkililik özeti
Parametre | Plasebo + trastuzumab + dosetaksel n=406 | PERJETA + trastuzumab + dosetaksel n=402 | HR (%95 GA) | p değeri |
Progresyonsuz Sağkalım (bağımsız değerlendirme) Birincil sonlanım noktası*
Ölçülebilir hastalığı olan hasta sayısı Medyan ay |
242 (%59) 12,4 |
191 (%47,5) 18,5 |
0,62 [0,51; 0,75] |
<0,0001 |
Genel Sağkalım Sekonder sonlanım noktası**
Ölçülebilir hastalığı olan hasta sayısı Medyan ay |
221 (%54,4) 40,8 |
168 (%41,8) 56,5 |
0,68 [0,56; 0,84] |
0,0002 |
Objektif Yanıt Oranı |
|
|
|
|
(ORR)^ Sekonder sonlanım |
|
|
|
|
noktası |
|
|
|
|
Ölçülebilir hastalığı olan |
|
|
|
|
hasta sayısı | 336 | 343 | ORR'deki | 0,0011 |
Yanıt verenler*** | 233 (%69,3) | 275 (%80,2) | değişiklik: |
|
| [64,1; 74,2] | [75,6; 84,3] | %10.8 |
|
ORR için %95 GA | 14 (%4,2) | 19 (%5,5 ) | [4,2, 17,5] |
|
Tam yanıt (TY) | 219 (%65,2) | 256 (%74,6) |
|
|
| 70 (%20,8) | 50 (%14,6) |
|
|
Kısmi Yanıt (KY) | 28 (%8,3) | 13 (%3,8) |
|
|
Stabil hastalık (SH) |
|
|
|
|
Progresif hastalık (PH) |
|
|
|
|
Yanıt Süresi †^ |
|
|
|
|
n= | 233 | 275 | ||
Medyan hafta | 54,1 | 87,6 | ||
Medyan için %95 GA | [46; 64] | [71; 106] |
* Primer progresyonsuz sağkalım analizi. Veri kesim tarihi: 13 Mayıs 2011.
** Olaya dayalı final genel sağ kalım analizi. Veri kesim tarihi: 11 Şubat 2014.
*** RECIST ile doğrulanan TY veya KY için en iyi genel yanıta sahip hastalar.
†TY veya KY için En İyi Genel Yanıta sahip hastalarda değerlendirilmiştir.
^ Objektif yanıt oranı ve yanıt süresi, IRF tarafından değerlendirilen tümör değerlendirmelerine dayanmaktadır.
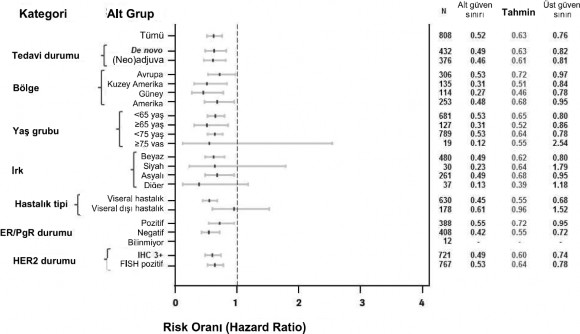
Coğrafi bölge ve geçmiş adjuvan/neoadjuvan tedavi veya de novo metastatik meme kanseri sınıflandırma faktörlerine dayalı alt grupları içeren önceden belirlenmiş hasta alt gruplarında tutarlı bulgular gözlenmiştir (bkz. Şekil 1). Bir post hoc inceleme veri analizi, önceden trastuzumab verilen hastalarda (n=88), IRF ile değerlendirilen PFS için risk oranının 0,62 (%95 GA 0,35, 1,07), önceden trastuzumab içermeyen tedavi gören
hastalarda ise (n=288) 0,6 (%95 GA 0,43, 0,83) olduğunu ortaya koymuştur.
Şekil 1: IRF tarafından değerlendirilen PFS'nin hasta alt grubuna göre dağılımı
Olaya dayalı nihai OS analizi 389 hasta öldüğünde (plasebo uygulanan grupta 221 ve PERJETA uygulanan grupta 168) gerçekleştirilmiştir. Daha önce ara OS analizinde (primer analizden bir yıl sonra yapılmıştır) gözlenen, PERJETA uygulanan grup lehine istatistiksel anlamlı OS yararı korunmuştur (HR 0,68, p=0,0002 log-sıra testi). Ölüme kadar geçen medyan süre, plasebo uygulanan grupta 40,8 ay ve PERJETA uygulanan grupta 56,5 ay olmuştur (bkz. Tablo 3, Şekil 2).
Tanımlayıcı OS analizi çalışmanın sonunda 515 hasta öldüğünde (plasebo uygulanan grupta 280 ve PERJETA uygulanan grupta 235) gerçekleştirilmiştir. Analiz PERJETA uygulanan grupta istatiktiksel anlamlı OS yararının medyan 99 aylık (HR 0,69, p<0,0001 log-sıra testi; ölüme kadar geçen medyan süre plasebo uygulanan grupta 40,8 ay ve PERJETA uygulanan grupta 57,1 ay) takip süresinden sonra da korunduğunu göstermiştir. 8 yıllık sağkalım analizi sonuçarında 8 yıllık sağkalım oranı PERJETA uygulanan grupta %37 iken plasebo uygulanan grupta %23 olarak saptanmıştır.
Şekil 2: Kaplan-Meier Eğrisi Olaya Dayalı Genel Sağkalım
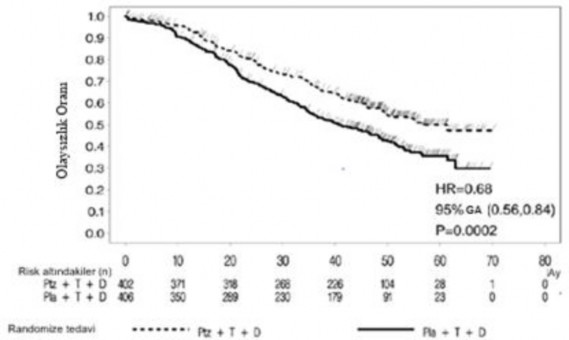
HR: Risk oranı; GA: Güven aralığı; Pla: Plasebo; Ptz: Pertuzumab; T: Trastuzumab (Herceptin); D: Dosetaksel
İki tedavi grubu arasında, FACT-B TOI-PFB skorlarıyla değerlendirilen Sağlıkla İlişkili Yaşam Kalitesi'nde istatistiksel olarak anlamlı farklılık görülmemiştir.
Ek Destekleyici Klinik Çalışma Bilgileri
B017929 – Metastatik meme kanseri için tek kollu klinik çalışma:
BO17929 faz II, randomize olmayan bir çalışmadır ve tümörleri trastuzumab tedavisi sırasında ilerleyen metastatik meme kanserli hastalarda yapılmıştır. PERJETA ve trastuzumab ile tedavi, %24,2'lik bir yanıt sağlamış, hastaların %25,8'inde en az 6 ay süreyle hastalık stabilizasyonu elde edilmiştir; bu bulgu trastuzumab sırasında progresyonu takiben PERJETA'nın aktif olduğunu göstermiştir.
Meme Kanserinin Neoadjuvan Tedavisi:
Neoadjuvan koşullarda, lokal olarak ilerlemiş ve inflamatuvar meme kanserleri, hormon reseptör durumuna bakılmaksızın yüksek riskli kabul edilirler. Erken evre meme kanserinde risk değerlendirmesinde tümör boyutu, derecesi, hormon reseptör durumu ve lenf bezi metastazlarının göz önünde bulundurulması gerekir.
Meme kanserinin neoadjuvan tedavisinde endikasyon, genel sağkalım ve hastalıksız sağkalım gibi uzun dönem sonuçlar açısından faydası saptanamayan veya net bir şekilde ölçülemeyen patolojik yanıt oranında bir artışın gösterilmesine ve hastalıksız sağkalımda düzelme eğilimlerine dayanmaktadır.
NEOSPHERE (WO20697)
NEOSPHERE, PERJETA ile yürütülen faz II, çok merkezli, çok uluslu randomize kontrollü bir çalışmadır ve önceden trastuzumab, kemoterapi veya radyoterapi almamış yeni tanılı, erken evre, inflamatuvar veya lokal olarak ilerlemiş HER2-pozitif meme kanserli (T2-4d; primer tümör > 2 cm çapında) 417 erişkin kadın hasta ile gerçekleştirilmiştir. Metastazları, bilateral meme kanseri, klinik olarak önemli kardiyak risk faktörleri (bkz. Bölüm 4.4) veya < %55 LVEF değeri olan hastalar çalışmaya dahil edilmemiştir. Hastaların çoğu 65 yaşın altındadır.
Hastalar, cerrahi öncesinde aşağıdaki neoadjuvan rejimlerden birini 4 siklus almak üzere randomize edilmiştir:
Trastuzumab artı dosetaksel
Klinik yanıt, neoadjuvan periyot sırasında en iyi genel TY veya KY yanıtına sahip hastaları temsil eder (primer meme lezyonunda).
BERENICE (WO29217)
BERENICE; HER2-pozitif lokal olarak ilerlemiş, inflamatuvar veya erken evre meme kanseri (primer tümörler > 2 cm çapında veya nod pozitif hastalık) olan 401 hastada gerçekleştirilmiş randomize olmayan, açık etiketli, çok merkezli, çok uluslu bir Faz II çalışmadır.
BERENICE çalışmasında iki paralel hasta grubu yer almıştır. Trastuzumab artı antrasiklin/taksan bazlı kemoterapi ile neoadjuvan tedavi için uygun olduğu değerlendirilen hastalar, cerrahi öncesinde aşağıdaki şekilde iki rejimden birini almak üzere randomize edilmiştir:
Kohort A – iki haftalık yoğun doz doksorubisin ve siklofosfamid ile 4 siklus, ardından trastuzumab ve paklitaksel ile kombinasyon halinde PERJETA ile 4 siklus.
5.2. Farmakokinetik özellikler
Genel özelliklerÇeşitli tiplerde ilerlemiş maligniteler bulunan, PERJETA'yı tek ajan ya da kombinasyon olarak 3 haftada bir 30-60 dakikalık intravenöz infüzyon yoluyla 2 ile 25 mg/kg aralığındaki dozlarda alan farklı klinik çalışmalara (faz I, II ve III) katılmış 481 hastadan elde edilen verilerle bir popülasyon farmakokinetik analizi yapılmıştır.
Emilim:
PERJETA intravenöz infüzyon şeklinde uygulanmaktadır. Dağılım:
Tüm klinik çalışmalar genelinde, tipik bir hastada santral (Vc) ve periferik (Vp) kompartmanda dağılım hacmi sırasıyla 3,11 litre ve 2,46 litre olmuştur.
Biyotransformasyon:
PERJETA'nın metabolizması doğrudan incelenmemiştir. Antikorlar, temel olarak katabolizma yoluyla temizlenir.
Eliminasyon:
Pertuzumabın medyan klerensi (Kl) 0,235 litre/gün, medyan yarılanma ömrü ise 18 gündür.
Doğrusallık/doğrusal olmayan durum:
PERJETA, önerilen doz aralığı dahilinde doğrusal farmakokinetik sergilemiştir.
Hastalardaki karakteristik özellikler
Yaşlı hastalar:
Popülasyon farmakokinetik analizi temelinde, 65 yaş altı (n=306) ve 65 yaş ve üzeri (n=175) hastalar arasında PERJETA farmakokinetiğinde anlamlı bir farklılık gözlenmemiştir.
Böbrek yetmezliği olan hastalar:
PERJETA için böbrek yetmezliğiyle ilgili özel çalışmalar yapılmamıştır. Popülasyon farmakokinetik analizi sonuçları temelinde, hafif (kreatinin klerensi [KrKl] 60-90 ml/dak, N=200) ve orta şiddette böbrek yetmezliği (KrKl 30-60 ml/dak, N=71) olan hastalarda PERJETA maruziyetinin, böbrek fonksiyonu normal hastaların (KrKl > 90 ml/dak, N=200) PERJETA maruziyeti ile benzerdir. KrKl aralığında (27-244 ml/dak), KrKl ve PERJETA maruziyeti arasında ilişki gözlenmemiştir.
Diğer özel popülasyonlar:
Popülasyon farmakokinetik analizi yaş, cinsiyet ve etnik kökene (Japon ve Japon olmayanlar karşılaştırıldığında) bağlı herhangi bir farmakokinetik farkını ortaya koymamıştır. Başlangıç albümin ve yağsız vücut ağırlığı klerensi etkileyen en önemli kovaryantlardır. Medyan klerens daha yüksek başlangıç albümin konsantrasyonları olan hastalarda düşerken, daha yüksek yağsız vücut ağırlığı olan hastalarda artmıştır. Ancak, önerilen PERJETA dozu ve planında gerçekleştirilen duyarlılık analizleri, bu iki kovaryantın uç değerlerinde, klinik öncesi tümör ksenograft modellerinde, belirlenen hedef kararlı durum konsantrasyonlarına ulaşma kapasitesinin anlamlı düzeyde etkilenmediğini göstermiştir. Bu nedenle, bu kovaryantlara dayanarak PERJETA dozajının ayarlanması gerekmemektedir.
NEOSPHERE ve APHINITY çalışmalarındaki pertuzumabın farmakokinetik (PK) sonuçları daha önceki popülasyon PK modelinden elde edilen tahminler ile tutarlıdır. Erken evre meme kanseri hastalarında metastatik meme kanseri hastalarına kıyasla pertuzumab farmakokinetiğinde hiçbir farklılık gözlenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Pertuzumabın etkisini değerlendirmek için hayvanlar üzerinde spesifik fertilite çalışmaları yapılmamıştır. Sinomolgus maymunu üzerinde yapılan tekrarlayan doz toksisite çalışmasında erkek üreme organları üzerindeki istenmeyen etkilere ilişkin kesin sonuçlara ulaşılamamaktadır.
Üreme toksikolojisi çalışmaları, gebe sinomolgus maymunları üzerinde (gestasyon günü (GD) 19'dan 50'ye) 30 ile 150 mg/kg başlangıç dozlarında ve ardından iki haftada bir verilen 10-100 mg/kg dozlarda yürütülmüştür. Ctemel alındığında bu doz seviyeleri insanlar için önerilen dozdan 2,5 ila 20 kat daha yüksek klinik olarak anlamlı maruziyete neden olmuştur. Pertuzumabın GD19 - GD50 aralığında (organogenez dönemi) intravenöz uygulanması embriyotoksik olmuş, GD25 - GD70 arasında embriyon-fetüs ölümü doza bağlı olarak artmıştır. 2 haftalık 10, 30 ve 100 mg/kg pertuzumab dozlarıyla (Ctemel alındığında insanlar için önerilen dozun 2,5 ile 20 kat fazlası) tedavi edilen gebe dişi maymunların embriyon-fetüs ölümü sırasıyla %33,
%50 ve %85 olmuştur. GD100'deki sezaryen doğumda, tüm pertuzumab doz gruplarında oligohidramniyoz, rölatif akciğer ve böbrek ağırlığında azalma ve renal
gelişim geriliği ile tutarlı mikroskobik böbrek hipoplazisi kanıtı saptanmıştır. Bunlara ek olarak, oligohidramniyoza sekonder fetüs büyümesinin kısıtlanmasıyla tutarlı şekilde akciğer hipoplazisi (30 mg/kg grubunda 1/6 ve 100 mg/kg grubunda 1/2), ventriküler septal defektler (30 mg/kg grubunda 1/6), ventrikül duvarında incelme (100 mg/kg grubunda 1/2) ve minör iskelet defektleri (eksternal – 30 mg/kg grubunda 3/6) tespit edilmiştir. Pertuzumab maruziyeti tüm tedavi gruplarının yavrularında GD100'deki
%29-40'lık maternal serum seviyesinde rapor edilmiştir.
Sinomolgus maymunlarında, 150 mg/kg'ye kadar haftalık intravenöz pertuzumab uygulaması genelde iyi tolere edilmiştir. 15 mg/kg ve üzeri dozlarda, tedavi ile ilişkili aralıklı hafif şiddetli ishal tespit edilmiştir. Maymunların bir alt grubunda, kronik dozlama (7 ile 26 haftalık dozlar) ciddi sekretuar ishal epizotlarına yol açmıştır. İshal, intravenöz sıvı replasmanı tedavisi dahil destekleyici bakım ile kontrol altına alınmıştır (bir hayvana ötanazi uygulanması hariç, 50 mg/kg/doz).
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | A15809 |
| Satış Fiyatı | 61720.83 TL [ 18 Apr 2025 ] |
| Önceki Satış Fiyatı | 61720.83 TL [ 14 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505762791 |
| Etkin Madde | Pertuzumab |
| ATC Kodu | L01XC13 |
| Birim Miktar | 420 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |