PHOSPHO-SODA oral LAKSATIF Kısa Ürün Bilgisi
{ Dibazik Sodyum Fosfat + Monobazik Sodyum Fosfat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
PHOSPHO -SODA21.6 g+8.1 g/45 ml oral çözelti
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
45 mL içinde:
Monobazik sodyum fosfat 21,6 g Dibazik sodyum fosfat 8,1 g
Yardımcı maddeler
45 mL içinde:
Sodyum benzoat 15,5 mg
Sodyum sakarin 150 mg
Etanol her dozda 100 mg'dan daha az miktarda içerir. Her 45 mL'lik şişe 5 g sodyum içerir.
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Oral çözelti
Berrak, renksiz, zencefil-limon kokulu, çökelti ve bulanıklık içermeyen çözelti
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Bağırsak temizleyicisi olarak, hastayı kolon cerrahisine, kolonu röntgen ya da endoskopik inceleme için hazırlamak amacıyla kullanılır.
Bağırsak temizleme ajanları, kabızlığın tedavisi için kullanıma yönelik değildir. PHOSPHO -SODA yetişkin hastaların kullanımı için endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi
Yetişkinlere iki ayrı PHOSPHO -SODA dozu uygulanır.
PHOSPHO -SODA uygulamasına hastane randevusundan bir gün önce başlanmalıdır.
Öğlen 12 öncesi hastane randevuları için sabah dozaj talimatları, öğleden sonraki randevular için de öğleden sonraki dozaj talimatlarına uyulmalıdır.
Önerilen kullanım dozu aşılmamalıdır.
Uygulama şekli:
Randevudan önceki gün
SABAH RANDEVUSU
Sabah saat 7'de kahvaltı yerine, en az bir bardak su veya "katı partikül içermeyen sıvı" içilir. Arzu edildiğinde daha fazla içilebilir.
"Katı partikül içermeyen sıvı" su, katı partikül içermeyen çorba, posasız meyve suyu, siyah çay veya sade kahve, katı partikül içermeyen karbonatlı veya karbonatsız meşrubatları içermektedir.
Doz â 45 mL PHOSPHO-SODA'yı yarım bardak (120 mL) soğuk suda karıştırınız ve hemen içiniz. Üzerine bir bardak (240 mL) soğuk su içiniz. Arzu edildiğinde daha fazla içilebilir.
Bağırsak hareketleri boyunca, kaybolan sıvıyı yerine koyabilmek için içebildiğiniz kadar ekstra sıvı içiniz.
Öğlen 13:00 - Öğle yemeği yerine en az 3 bardak dolusu (720 mL) "katı partikül içermeyen sıvı" veya su içilir. Arzu edildiğinde daha fazla içilebilir.
Akşam 19:00 - Akşam yemeği yerine en az 1 bardak dolusu "katı partikül içermeyen sıvı" veya su içilir. Arzu edildiğinde daha fazla içilebilir.
4.3. Kontrendikasyonlar
Aşağıdaki hallerde kullanılmamalıdır:
18 yaşın altındaki çocuklarda,
Bulantı, kusma veya karın ağrısı olduğunda,
Etkin madde
Böbrek yetmezliğinde
Assitte,
Bilinen veya şüphelenilen gastrointestinal obstrüksiyonda,
Megakolonda (konjenital veya sonradan edinilen),
Gastrointestinal perforasyonda,
İleus (Bağırsak tıkanıklığında)
Aktif inflamatuvar bağırsak hastalığında,
Hiperkalseminin eşlik ettiği primer hiperparatiroidizmde.
PHOSPHO-SODA diğer sodyum fosfat içeren laksatif ürünlerle birlikte kullanılmamalıdır.
4.4. Özel kullanım uyarıları ve önlemleri
PHOSPHO-SODA yaşlı hastalarda nadiren de olsa elektrolit kaybından dolayı potansiyel ve ciddi ölüm vakalarıyla ilişkilendirilmiştir. PHOSPHO-SODA'nın riskli popülasyonda tedavi başlamadan önce yarar-risk oranı dikkatlice değerlendirilmelidir.
Riskli popülasyonlarda ve bilinen kontrendikasyonu olan hastalarda PHOSPHO-SODA reçetelenirken özel olarak dikkat edilmelidir (bkz. Bölüm 4.2. ve 4.3). Yeterli hidrasyonun sağlanmasına önem verilmelidir. Tedavi öncesi ve sonrası elektrolit düzeylerinin ölçülmesi önemlidir.
Risk altındaki hastalar
Altta yatan böbrek yetmezliği için risk artışı olan hastalarda, önceden mevcut olan elektrolit bozukluklarında, elektrolit bozuklukları ile ilgili risk artışı olan hastalarda (örn. dehidratasyon, gastrik retansiyon, kolit, oral yolla yeterli miktarda sıvı alınamayan durumlar, hipertansiyon veya hastalarda dehidratasyona neden olabilecek ürünlerin kullanıldığı diğer durumlar), klinik etkisi olan veya hipovolemiye bağlı hipotansiyon, kalp hastalığı, akut miyokard enfarktüstü, stabil olmayan angina veya zayıf bünyeli, düşkün ya da yaşlı hastalarda dikkatle kullanılmalıdır. Bu risk altındaki hastalarda sodyum, potasyum, kalsiyum, klorür, bikarbonat, fosfat, kan üre azotu ve kreatinin değerleri, klinik olarak belirtildiği takdirde tedavi başlangıcında ve sonrasında elde edilmelidir.
Dehidratasyon
Bu ürün çoğunlukla 30 dakika ila 6 saat arasında etki gösterir. PHOSPHO-SODA aldıktan sonra 6 saat içinde bağırsak hareketi olmadığı takdirde hastaya, ilacın kullanımının kesilmesi ve dehidratasyon olasılığı nedeniyle derhal bir doktora başvurması talimatı verilmelidir.
Hastalar sık ve sulu dışkılama konusunda uyarılmalıdır. Dehidratasyonun önlenmesine yardımcı olması için hastalar mümkün olduğunca çok sıvı almaya teşvik edilmelidir. Etkili bir pürgatif kullanılırken yeterli sıvı alınmaması, aşırı sıvı kaybına neden olabilir. Bunun sonucunda da dehidratasyon ve hipovolemi oluşturabilir. Pürgatif kullanımına bağlı dehidratasyon ve hipovolemi, oral yoldan yetersiz sıvı alımıyla, bulantı ve kusma ile, iştahsızlıkla, antihipertansifler (ör. anjiyotensin dönüştürücü enzim (ADE) inhibitörleri, anjiyotensin reseptör blokerleri(ARB'ler),kalsiyumkanalblokerleri), diüretikler, nonsteroidal
yetmezliği ile birlikte meydana gelebilir. Sodyum fosfatlar ve PEG-3350 de dahil olmak üzere pürgatifler ile akut böbrek yetmezliğine ilişkin nadir bildirimler olmuştur.
Dehidratasyon yatkınlığı olabilecek durumları bulunan ya da glomerüler filtrasyon oranını azaltabilecek ilaç kullanan hastalarda, pürgatif preparatların kullanımından önce hidrasyon durumu değerlendirilmeli ve bu durum uygun şekilde ele alınmalıdır.
Akut fosfat nefropatisine sekonder gelişen nefrokalsinozis
Akut böbrek yetmezliği ve renal tübüllerde kalsiyum fosfat kristali birikimleri ile ilişkili olan nefrokalsinozis, bağırsak temizliği için sodyum fosfat kullanan hastalarda çok nadir olarak rapor edilmiştir. Nefrokalsinozis, kalıcı böbrek fonksiyon bozukluğu ve uzun süreli diyaliz gereksinimi ile sonuçlanabilecek ciddi bir advers olaydır. Bu raporların çoğu, hipertansiyon tedavisi için ilaç kullanan ya da diüretikler veya NSAII'ler gibi diğer ilaç ürünlerini kullanan yaşlı kadın hastalarda bildirilmiştir ve dehidratasyon ile sonuçlanabilir.
PHOSPHO-SODA reçete edilirken prosedürden önce, hazırlık sırasında ve prosedürden sonra yeterli hidrasyon sağlanmasına, önerilen doz aralıklarına uyulmasına ve ilacın bilinen kontrendikasyonlarına özellikle dikkat edilerek, özen gösterilmelidir.
Elektrolit bozuklukları
Serum sodyum ve fosfat düzeylerinde yükselme; kalsiyum ve potasyum düzeylerinde ise düşüş riski vardır ve bunların sonucunda hipernatremi, hiperfosfatemi, hipokalsemi, hipokalemi ve asidoz oluşabilir.
Konfüzyon, koma veya konvülsiyonlar gibi nörolojik bozukluklarla komplike hiponatremi meydana gelebilir.
Hipokalsemi veya hipokalemi gibi elektrolit dengesizliklerinin bir sonucu olarak nadiren hafif QT aralığı uzaması oluşabilir. Bu değişiklikler klinik açıdan anlamlı değildir.
Hipomotilite:
Hipomotilite bozukluğu olan veya gastrointestinal operasyon geçirmiş veya hipomotilite bozukluğuna yatkın diğer tıbbi durumlara sahip hastalarda dikkatli kullanılmalıdır. Hastanın kolostomisi veya ileostomisi varsa veya tuzsuz bir diyete uyması gerekiyorsa bu durum elektrolit dengesinde bozulma, dehidrasyon veya asit dengesinde bozulmaya neden olabileceğinden ilaç dikkatli kullanılmalıdır.
Lezyonlar
Endoskopide rektosigmoid bölgede tek veya çok sayıda aftoid benzeri noktasal lezyonlar gözlemlenmiştir. Bunlar kolon preparatında lenfoid foliküller veya farklı inflamatuar infiltratlar ya da epitelyal konjesyonlar/değişiklikler olarak ortaya çıkar. Bu anormallikler klinik olarak anlamlı değildir ve tedavi edilmeden spontan olarak kaybolurlar.
Bu tıbbi ürün her 45 mL'lik şişede 150 mg sodyum sakarin içerir.
Bu tıbbi ürün her 45 mL'lik şişede 5 g sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde bulunan hastalar için göz önünde bulundurulmalıdır.
Bu tıbbi ürün her 45 mL'lik şişede az miktarda, 100 mg dan az, etanol (alkol) içerir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Antihipertansif ilaçlar (ör. kalsiyum kanal blokerleri, anjiyotensin dönüştürücü enzim inhibitörleri (ADE), anjiyotensin reseptör blokerleri (ARB)), diüretikler, lityum tedavisi veya elektrolit düzeylerini hiperfosfatemi, hipokalsemi, hipokalemi, hipernatremik dehidratasyon ve asidoz oluşarak etkileyebilen diğer ilaçlarla birlikte dikkatli kullanılmalıdır.
PHOSPHO-SODA alımı sırasında gastrointestinal kanaldan ilaçların absorpsiyonu gecikebilir veya tümüyle engellenebilir. Düzenli olarak alınan oral ilaçların (ör. oral kontraseptifler, antiepileptik ilaçlar, antidiyabetikler ve antibiyotikler) etkinliği azalabilir ya da tümüyle ortadan kalkabilir. QT aralığını uzattığı bilinen ilaçları alan hastalarda da dikkatli olunması önerilir.
Paratiroid hormonu kullanan hastalarda dikkatli kullanılmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
18 yaşın altındaki çocuklarda kullanımı kontrendike olduğu için bu popülasyon ile etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
:Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): PHOSPHO-SODA ile tedavide oral kontraseptiflerin etkililiği azalabilir ya da tümüyle ortadan kalkabilir. Çocuk doğurma potansiyeli bulunan kadınlar tedavi süresi boyunca etkin bir doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi:
PHOSPHO-SODA'nın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hamilelikte maruziyet hakkında herhangi bir klinik veri yoktur. Hayvanlar üzerinde gebelik, embriyonal/fetal gelişimi, doğum ve doğum sonrası gelişim üzerindeki etkiler bakımından yapılmış herhangi bir çalışma mevcut değildir. İnsanlara yönelik potansiyel risk bilinmemektedir. PHOSPHO-SODA gerekli olmadıkça gebelik sırasında kullanılmamalıdır.
Laktasyon dönemi:
PHOSPHO-SODA'nın insan sütüne geçip geçmediği bilinmemektedir. Sodyum fosfat insan sütüne geçebileceğinden, bağırsak temizleme çözeltisinin ilk dozundan itibaren ikinci dozun 24 saat sonrasına kadar sütün sağılarak atılması tavsiye olunur. Kadınlar, PHOSPHO-SODA'nın ikinci dozunu aldıktan sonra 24 saat süreyle bebeklerini emzirmemelidir.
Üreme yeteneği/Fertilite:
PHOSPHO-SODA'nın erkek ve dişi fertilitesi üzerine etkileri ile ilgili herhangi bir çalışma mevcut değildir, veri bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
PHOSPHO-SODA dehidrasyondan dolayı baş dönmesine neden olabilir. PHOSPHO-SODA araç veya makine kullanımını hafif-orta düzeyde etkileyebilir.
4.8. İstenmeyen etkiler
Advers reaksiyonlar aşağıdakilere karşılık gelen sıklıklara göre rapor edilmiştir:
Çok yaygın (≥ 1/10), yaygın (≥ 1/100, <1/10), yaygın olmayan (≥ 1/1.000, <1/100), seyrek (≥ 1/10.000, <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her sıklık grubu içinde, istenmeyen etkiler azalan ciddiyet sırasına göre sunulmuştur.
Bağışıklık sistemi hastalıkları:
Çok seyrek: Hipersensitivite
Metabolizma ve beslenme hastalıkları:
Yaygın olmayan: Dehidratasyon
Çok seyrek: Hiperfosfatemi, hipokalsemi, hipokalemi, hipernatremi, metabolik asidoz, tetani Bilinmiyor: Konfüzyon, koma veya konvülsiyon gibi nörolojik bozukluklar ile komplike hiponatremi
Sinir sistemi hastalıkları:
Çok yaygın: Baş dönmesi Yaygın: Baş ağrısı
Çok seyrek: Bilinç kaybı, parestezi
Kardiyak hastalıklar:
Çok seyrek: Miyokard enfarktüsü, aritmi
Vasküler hastalıklar:
Çok seyrek: Hipotansiyon
Gastrointestinal hastalıklar:
Çok yaygın: Diyare, abdominal ağrı, abdominal distansiyon, bulantı
Yaygın: Kusma, anormal kolonoskopi (rektosigmoid bölgede klinik açıdan anlamlı olmayan ve tedavi edilmeden spontan olarak kaybolan tek veya çok sayıda aftoid benzeri noktasal lezyonlar)
Deri ve deri altı doku hastalıkları:
Çok seyrek: Alerjik dermatit
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları:
Çok seyrek: Kas krampı
Böbrek ve idrar yolu hastalıkları:
Seyrek: Akut fosfat nefropatisine sekonder gelişen nefrokalsinozis Çok seyrek: Akut renal yetmezlik, kronik renal yetmezlik,
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:
Çok yaygın: Ürperme, asteni Yaygın: Göğüs ağrısı
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0800 314 00 08; faks: 0312 218 35 99).
4.9. Doz aşımı ve tedavisi
PHOSPHO-SODA aşırı dozlarda kullanıldığında, çocuklara verildiğinde veya sindirim kanalında tıkanıklığı olan hastalara verildiğinde hipokalsemi, hipernatremi ve asidozun eşlik ettiği ölümcül hiperfosfatemi olguları vardır.
Aşırı doz alımı hastalarda aşağıdaki semptomlara neden olmaktadır: dehidratasyon, hipotansiyon, taşikardi, bradikardi, takipne, kardiyak arrest, şok, solunum yetmezliği, dispne, konvülsiyonlar, paralitik ileus, anksiyete, ağrı. Aşırı doz alınması serumdaki sodyum ve fosfat düzeylerinde artışa, kalsiyum ve potasyum düzeylerinde azalmaya yol açabilir. Bu vakalarda hipernatremi, hiperfosfatemi, hipokalsemi, hipokalemi ve asidoz oluşabilir.
Aşırı dozlarda, yanlışlıkla PHOSPHO-SODA verilen çocuklarda ve obstrüksiyonlu hastalarda belgelenmiş tümüyle iyileşme olguları da vardır. Bu hastalardan biri, normal dozun altı katı olan aşırı doz almıştır.
Aşırı alıma bağlı toksik etkiyi rehidratasyonla tedavi etmek mümkündür, intravenöz yoldan
%10'luk kalsiyum glukonat verilmesi gerekebilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Ozmotik etkili laksatifler ATC kodu: A06AD17
PHOSPHO-SODA ozmotik olarak ince bağırsak lümeninde sıvı tutulmasını arttırarak etki gösteren tuzlu laksatiftir. İleum içerisindeki sıvı toplanması şişkinlik oluşturur ve sırasıyla peristaltik hareketleri ve bağırsakların boşaltımını arttırır.
5.2. Farmakokinetik özellikler
Genel özellikler:Oral sodyum fosfat çözeltisinin uygulanması, sağlıklı gönüllülerde geçici serum elektrolit değişikliklerine neden olmuştur. İki yaş ve iki cinsiyet grubundaki elektrolit değişimlerinin derecesini ve sürecini değerlendirmek için oral sodyum fosfat çözeltisi alan 24 sağlıklı yetişkin gönüllüyle açık etiketli bir çalışma gerçekleştirilmiştir. Çalışma, sıvı diyeti, sodyum fosfat dozlarının zamanlaması ve uygun hidrasyon da dahil olmak üzere, kolonoskopi öncesi yaygın olarak kullanılan bağırsak hazırlığına benzeyecek şekilde tasarlanmıştır. Takip edilen 2 x 45 ml oral sodyum fosfat dozu ve katı partikül içermeyen sıvı ilavesi, ürünün onaylanmış dozlama rejimine uygun olmuştur. Çalışma popülasyonu cinsiyet ve yaş için dengelenmiştir. Araştırmaya katılanların yarısı 65 yaş ve üstü gönüllülerden oluşmuştur.
Sonuçlar her bir dozdan sonra serum sodyum ve fosfat konsantrasyonlarında bir artış göstermiş ancak potasyum ve kalsiyum azalmıştır.
Tüm gönüllüler için ortalama serum fosfat konsantrasyonu başlangıçta 3,33 mg / dL olarak ölçülmüş; daha sonra 3.saatte 6,26 mg / dL olarak doruğa ulaşmıştır. İkinci dozdan hemen önce (12.saat) 4,70 mg / dL'ye düşmüş ve 14.saatte tekrar 6,86 mg/dL ile zirveye çıktığı görülmüştür.
36. saatte, tüm serum fosfat konsantrasyonları normale dönmüştür.
Aşağıdaki şekil, her yaş cinsiyet alt grubu için ortalama serum fosfat konsantrasyonunun zaman dilimini göstermektedir. Yaşlı kadınlar en çok değişen değerleri göstermiştir.
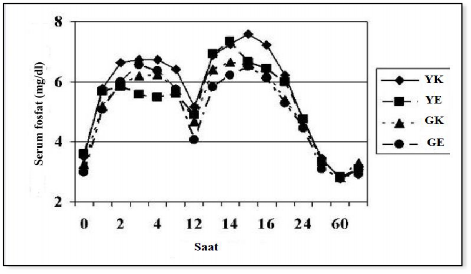
Ortalama serum sodyum konsantrasyonu normal aralıkta (134-147 mmol/L) dalgalanma göstermiş ancak 4 kişi normalin üst sınırının üzerinde sodyum değerlerine sahip olmuştur.
Serum potasyum ve kalsiyum konsantrasyonlarındaki düşüş normal bireysel aralıkta dalgalanmıştır ve daha sonra ikinci dozun uygulanmasından 12 saat sonra başlangıç değerlerine geri dönmüştür. Gönüllülerin %29'unda ilk dozun uygulanmasından sonra 36.saate kadar normal alt sınırın (8,5 mg/dL) altındaki serum kalsiyum değerleri bildirilmiştir. Bununla birlikte, hiçbir klinik hipokalsemi vakası kaydedilmemiştir.
Sonuç olarak, sağlıklı yetişkin gönüllülere 2 x 45 mL sodyum fosfat uygulanması ile serum elektrolit konsantrasyonunda meydana gelen değişiklikler klinik olarak anlamlı bulunmamıştır. Bu değişiklikler geçici olmuş ve bağırsak hazırlığı tedavisinin tamamlanmasından sonraki 12 ila 24 saat içinde normale dönmüştür.
Emilim:
Lokal aktivite gösterir ancak ilacın bir kısmı sistemik olarak emilebilir.
Dağılım:
Emilime uğrayan fosfatlar dolaşım sistemi tarafından dağılır ve böbrekler tarafından elimine edilir.
Biyotransformasyon:
Biyotransformasyonu beklenmemektedir.
Eliminasyon:
Renal ve fekal eliminasyon meydana gelir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği
Böbrek yetmezliği olan hastalarda bu durumun PHOSPHO-SODA farmakokinetiği üzerindeki etkisi araştırılmamıştır. Bu verilerin sağlıklı gönüllülerden risk altındaki hastalara (örneğin böbrek hastaları) uyarlanması mümkün değildir (Bkz. Bölüm 4.3, 4.4).
5.3. Klinik öncesi güvenlilik verileri
PHOSPHO-SODA ile hayvanlarda üreme toksisitesi ile ilgili herhangi bir çalışma yapılmamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Gliserol
Sodyum sakkarin Sodyum benzoat (E211)
Saf su
Zencefil-limon aroması:
Oleorezin Zencefil Alkol
Limon Yağı
Kısmen Deterpine Limon Yağı Sitrik Asit
Saf Su
6.2. Geçimsizlikler
Uygulanabilir değildir.
6.3. Raf ömrü
36 ay
Kutu açıldıktan sonra hemen kullanılmalıdır. Kullanılmamış çözelti atılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
PHOSPHO-SODA 45 mL ve 90 mL çözelti kutuda, plastik kapaklı polietilen şişede sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Bu ürün kullanılmadan önce su ile seyreltilmelidir.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ GENEL BİLGİLERİ
Recordati İlaç Sanayi ve Ticaret A.Ş.
| Geri Ödeme Kodu | A03048 |
| Satış Fiyatı | 109.86 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 109.86 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699559650082 |
| Etkin Madde | Dibazik Sodyum Fosfat + Monobazik Sodyum Fosfat |
| Yerli ve Beşeri bir ilaçdır. |