PIMREVA 200 mg ve 50 mg film kaplı tablet (56 tablet) Farmakolojik Özellikler
{ Alpelisib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, diğer antineoplastik ajanlar ATC kodu: L01EM03
Etki mekanizması
Alpelisib, ağırlıklı olarak PI3Kα'ya karşılık önleyici aktiviteye sahip bir fosfatidilinositol-3- kinaz (PI3K) inhibitörüdür. PI3K'nın katalitik α alt birimini kodlayan gendeki (PIK3CA) fonksiyon kazanma mutasyonları, in vitro ve in vivo modellerde PI3Kα ve AKT sinyallemesinin aktivasyonuna, hücresel transformasyona ve tümör oluşumuna yol açar.
Meme kanseri hücre dizilerinde, alpelisib, AKT dahil PI3K aşağı akım hedeflerinin fosforilasyonunu inhibe etmiş ve bir PIK3CA mutasyonu barındıran hücre dizilerinde aktivite göstermiştir.
İn vivo ortamda, alpelisib, PI3K/Akt sinyal yolunu inhibe etmiş ve meme kanseri modelleri de dahil olmak üzere ksenograft modellerinde tümör büyümesini azaltmıştır.
Alpelisib tedavisi ile PI3K inhibisyonunun meme kanseri hücrelerinde östrojen reseptörü (ER) transkripsiyonunda bir artışa neden olduğu gösterilmiştir. Alpelisib ve fulvestrant kombinasyonu, ER pozitif, PIK3CA mutasyona uğramış meme kanseri hücre dizilerinden türetilen ksenograft modellerinde tek başına tedaviye kıyasla artmış antitümör aktivitesi göstermiştir.
PI3K/AKT sinyal yolu, glukoz homeostazından sorumludur ve hiperglisemi, PI3K inhibisyonunun hedeflenen bir advers reaksiyonudur.
Klinik etkililik ve güvenlilik
PİMREVA, hastalığı aromataz inhibitörü bazlı bir tedavi (CDK4/6 kombinasyonu olsun veya olmasın) sırasında veya sonrasında progrese olmuş veya nüks etmiş olan, HR+, HER2- ilerlemiş (lokal-bölgesel tekrarlayan veya metastatik) meme kanseri olan postmenopozal kadınlarda ve erkeklerde pivotal, faz III, randomize, çift kör, plasebo kontrollü bir çalışmada değerlendirilmiştir.
Toplam 572 hasta, biri PIK3CA mutasyonu olan, diğeri ise PIK3CA mutasyonu olmayan meme kanserini içeren iki kohorta alınmıştır. Hastalar alpelisib 300 mg artı fulvestrant veya plasebo artı fulvestrant almak üzere 1: 1 oranında randomize edilmiştir. Randomizasyon, akciğer ve/veya karaciğer metastazı varlığı ve CDK4/6 inhibitörü/inhibitörleri ile önceden tedaviye göre stratifiye edilmiştir.
PIK3CA mutasyonu olan kohortta, bir veya daha fazla PIK3CA mutasyonu olan (C420R, E542K, E545A, E545D [sadece 1635G> T], E545G, E545K, Q546E, Q546R, H1047L, H1047R veya
H1047Y) 169 hasta fulvestrant ile kombinasyon halinde alpelisib almak için randomize edilmiştir ve 172 hasta fulvestrant ile kombinasyon halinde plasebo almak üzere randomize edilmiştir. Bu kohortta 170 (%49,9) hastada karaciğer/akciğer metastazı vardır ve 20 (%5,9) hastaya önceden CDK4/6 inhibitör tedavisi uygulanmıştır.
Hastaların medyan yaşı 63'tür (aralık: 25 ila 92 yıl). Hastaların %44,9'u ≥65 yaşında ve ≤85 yaşındadır. Dahil edilen hastalar Beyaz (%66,3), Asyalı (%21,7) ve Siyah veya Afro-Amerikandır (%1,2). Çalışma popülasyonu, PIK3CA mutant kohortuna kayıtlı ve alpelisib ve fulvestrant ile tedavi edilen bir erkek olguyu içermiştir. Olguların %66,0 ve %33,4'ünde ECOG performans durumu sırasıyla 0 ve 1'dir.
Hastaların %97,7'si daha önce endokrin tedavisi almıştır. Olguların %67,7'sinde çalışmaya giriş öncesinde son tedavi endokrin tedavisidir. Letrozol ve anastrozol en sık kullanılan endokrin tedaviler olmuştur. Çalışmaya kaydolmadan önce son endokrin tedavisi, olguların %47,8'inde terapötik ve olguların %51,9'unda adjuvan tedavidir. Genel olarak, hastaların %85,6'sının endokrine dirençli bir hastalığı olduğu düşünülmüştür; primer endokrin direnci (de novo direnci) hastaların %13,2 ve sekonder endokrin direnci (başlangıç yanıtını takiben nüks/progresyon)
%72,4'ünde gözlenmiştir.
Demografik özellikler ve çalışma başlangıcındaki hastalık özellikleri, ECOG performans durumu, tümör yükü ve önceki antineoplastik tedavi çalışma kolları arasında iyi dengelenmiştir.
Randomize tedavi fazı sırasında, alpelisib 300 mg veya plasebo günde bir kez sürekli olarak oral yoldan uygulanmıştır. Fulvestrant 500 mg, birinci siklusun 1 ve 15. günlerde ve daha sonra tedavi aşamasında 28 günlük bir siklusun 1. gününde (uygulama ± 3 gün) intramüsküler uygulanmıştır.
Hastaların çalışma sırasında veya hastalık ilerledikten sonra plasebodan alpelisibe geçmesine izin verilmemiştir.
Çalışma için birincil sonlanım noktası, PIK3CA mutasyonlu ileri evre kanseri olan hastalarda araştırmacı değerlendirmesine dayanan RECIST v1.1 kullanılarak progresyonsuz sağkalım (PFS) olmuştur. Önemli ikincil sonlanım noktası PIK3CA mutasyon durumu olan hastalar için genel sağkalımdır (OS).
Diğer ikincil sonlanım noktaları arasında PIK3CA mutasyonu olmayan hastalar için PFS, PIK3CA mutasyonu olmayan hastalar için OS yer almıştır.
Birincil etkililik analizi
Çalışma, nihai PFS analizinde birincil hedefine ulaşarak (veri kesme tarihi 12 Haziran 2018), PIK3CA mutant kohortunda plasebo artı fulvestrant alan hastalara kıyasla alpelisib artı fulvestrant alan hastalarda araştırmacı değerlendirmesine göre alpelisib artı fulvestrant ile tedavi lehine hastalık progresyonu veya ölüm riskinde tahmini %35 azalma ile (bkz. Tablo 8) PFS'de istatistiksel olarak anlamlı bir iyileşme olduğunu göstermiştir.
Tablo 8 Çalışma C2301- Birincil etkililik analizi -RECIST'e (FAS, PIK3CA mutasyonlu kohort) dayalı etkililik sonuçlarınıın özeti. Veri kesme tarihi: 12 Haziran 2018
| PİMREVA + fulvestrant (n=169) | Plasebo + fulvestrant (n=172) |
Medyan progresyonsuz sağkalım (PFS) (ay, %95 GA) | ||
Araştırmacının radyolojik değerlendirmesi | ||
PIK3CA mutant kohort | 11,0 | 5,7 |
(N=341) | (7,5-14,5) | (3,7-7,4) |
Tehlike oranı (% 95 GA) | 0,65 (0,50-0,85) | |
p-değeri | 0,00065 | |
Kör bağımsız inceleme komitesi değerlendirmesi* | ||
PIK3CA mutant kohort | 11,1 | 3,7 |
(N=173) | (7,3-16,8) | (2,1-5,6) |
Tehlike oranı (% 95 GA) | 0,48 (0,32-0,71) | |
p-değeri | N/A | |
GA = güven aralığı; N = hasta sayısı; N/A = uygulanamaz, tek taraflı tabakalı log-sıra testinden elde edilen p değeri. RECIST 1.1'e göre * %50 denetime dayalı yaklaşıma dayanır | ||
PIK3CA mutasyonu olan kohortta, randomizasyon stratifikasyon faktörleri ile araştırmacı değerlendirmesine göre PFS alt grup analizleri, akciğer/karaciğer metastazlarının varlığından veya yokluğundan bağımsız olarak alpelisib kolu lehine homojen ve genel olarak tutarlı bir tedavi etkisi göstermiştir.
Önceden CDK4/6 inhibitörü kullanan 20 hasta arasında tehlike oranı (HR) 0,48'dir (%95 GA: 0,17, 1,36); medyan PFS, plasebo artı fulvestrant kolunda 1,8 ay (%95 GA: 1,7, 3,6) ve alpelisib
artı fulvestrant kolunda ise 5,5 (%95 GA: 1,6, 16,8) aydır.
12 Haziran 2018 veri kesme tarihi kullanılarak, endokrin dirençli hastalar (HR = 0,64; %95 GA: 0,49, 0,85, n = 292) ve endokrin duyarlı hastalar (HR = 0,87; %95 GA: 0,35, 2,17, n = 39) alt grupları için PFS sonuçları alpelisib artı fulvestrant kolu lehine bulunmuştur. PIK3CA mutasyonu olan endokrin duyarlı hastaların sayısı sınırlıdır (n = 39) ve sonuçlar dikkatle yorumlanmalıdır.
12 Haziran 2018 veri kesme tarihi kullanılarak, başlangıçta ölçülebilir hastalığı olan hastalarda genel yanıt oranı, alpelisib artı fulvestrant kolunda %35,7 (%95 GA: 27,4, 44,7) ve plasebo artı fulvestrant kolunda %16,2'dir (%95 GA: 10,4, 23,5).
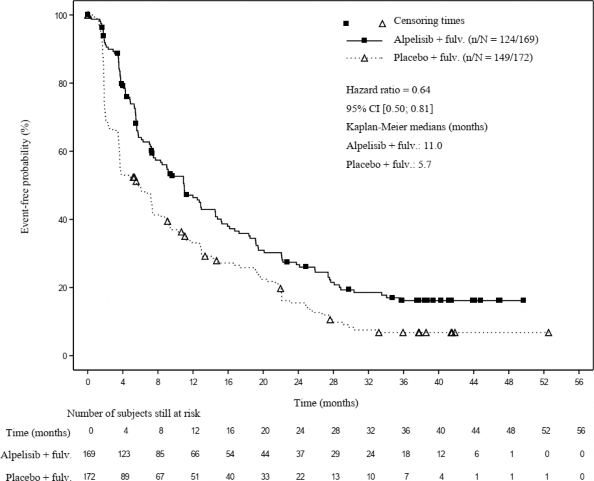
Nihai OS analizinin yapıldığı zamanda (veri kesme tarihi 23 Nisan 2020), PFS verileri için açıklayıcı bir takip etkililik analizi yapılmıştır. Randomizasyondan veri kesmeye kadar yaklaşık 42 aylık medyan süre ile rapor edilen PFS sonuçları, birincil PFS analizinden elde edilenlerle tutarlıdır. Alpelisib artı fulvestrant ile tedavi lehine progresyon veya ölüm riskinde tahmini
%36'lık bir azalma söz konusu olmuştur (HR=0.64; %95 GA: 0.50, 0.81) (Şekil 1).
Şekil 1 Çalışma C2301 - Araştırmacı değerlendirmesine göre PFS'nin Kaplan-Meier grafiği (FAS, PIK3CA mutant kohortu): 23 Nisan 2020 veri kesme tarihi ile açıklayıcı güncelleme
Nihai genel hayatta kalma analizi
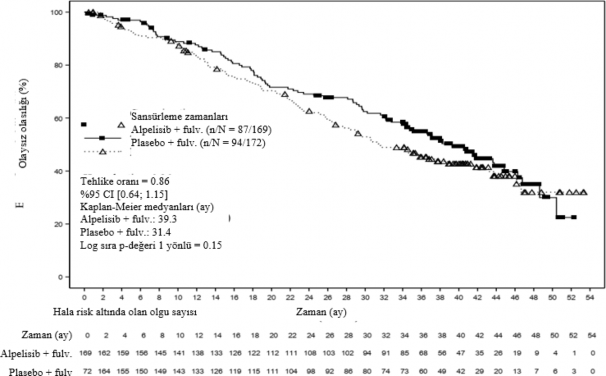
Son OS analizinde, çalışma temel ikincil hedefini karşılamamıştır. 23 Nisan 2020 veri kesme tarihi itibariyle alpelisib artı fulvestrant kolunda toplam 87 (%51,5) ve plasebo artı fulvestrant kolunda toplam 94 (%54,7) ölüm bildirilmiştir. HR 0.86 bulunmuştur (%95 GA: 0.64, 1,15; p=0,15, tek taraflı) ve önceden belirlenmiş O'Brien-Fleming etkililik sınırı p ≤0,0161 geçilmemiştir. Medyan OS, alpelisib artı fulvestrant kolunda 39,3 ay (%95 GA: 34,1, 44,9) ve plasebo artı fulvestrant kolunda 31,4 aydır (%95 GA: 26,8, 41,3) (Şekil 2).
Şekil 2 Çalışma C2301 temel ikincil analizi â23 Nisan 2020 veri kesme tarihli OS'nin Kaplan-Meier grafiği (FAS, PIK3CA mutant kohortu)
Daha önce CDK4/6i tedavisi alan hastalarda (n=20), alpelisib artı fulvestrant kolundaki medyan OS 29,8 ay (%95 GA: 6,7, 38,2), plasebo artı fulvestrant kolunda ise 12,9 aydır (%95 GA: 2,5,
34,6). (HR=0,67; %95 GA: 0,21, 2,18).
PIK3CA mutasyonu olmayan kohort
Tümörlerinde PIK3CA doku mutasyonu olmayan hastalarda PFS yararı gözlenmemiştir.
CBYL719X2102'de önceden fulvestrant kullanımı olan hastalar
Önceden fulvestrant kullanımı olan hastalar pivotal çalışmaya dahil edilmemiştir. Faz I çalışma CBYL719X2101'de, 39 olgu daha önce fulvestrant kullanıldığını bildirmiştir. PIK3CA mutasyonları ve başlangıçta ölçülebilir hastalığı olan 21 olgu için alpelisib artı fulvestrant ile tedaviye en iyi genel cevaplar 7 olguda kısmi yanıt, 11 olguda stabil hastalık ve 2 olguda progresif hastalık olmuştur. Bu nedenle, şu anda sınırlı veri nedeniyle daha önce fulvestrant ile tedavi edilen hastalarda bu tedavinin etkililiğine dair kanıt elde edilmemiştir (bkz. Bölüm 4.4).
5.2. Farmakokinetik özellikler
Alpelisibin farmakokinetiği, günde 30 ila 450 mg arasında değişen bir oral dozaj rejimindeki hastalarda araştırılmıştır. Sağlıklı gönüllülere 300 ila 400 mg arasında tekli oral dozlar verilmiştir. Farmakokinetikhemonkolojihastalarındahemdesağlıklı kişilerde benzer olmuştur.
Genel özellikler
Emilim
Alpelisibin oral uygulamasını takiben, pik plazma konsantrasyonuna (Tmaks) ulaşmak için geçen medyan süre, doz, zaman veya rejimden bağımsız olarak 2,0 ila 4,0 saat arasında değişmiştir. Emilim modellemesine dayanarak, biyoyararlanımın tokluk koşulları altında çok yüksek (>%99), ancak açlık koşulları altında (300 mg dozda ~%68,7) daha düşük olduğu tahmin edilmiştir. Günlük dozlamadan sonra alpelisibin kararlı durum plazma düzeylerine, çoğu hastada tedavinin başlamasından sonraki 3. günde ulaşılması beklenebilir.
Gıda etkisi
Alpelisibin emilimi gıdadan etkilenir. Açlık durumuna kıyasla tek bir 300 mg oral alpelisib dozundan sonra sağlıklı gönüllülerde, yüksek yağlı yüksek kalorili (YYYK) bir yemek (58,1 g yağ içeren 985 kalori) EAAinf değerini %73 ve Cmaks değerini %84 arttırmıştır ve bir DYDK yemeği (8,7 g yağ içeren 334 kalori), EAAinf değerini %77, Cmaks değerini ise %145 arttırmıştır. 0,978 (GA: 0,876, 1,09) geometrik ortalama oranı ile LFLC ile HFHC arasında EAAinf değerinde anlamlı bir fark bulunmayarak yağ içeriğinin ya da genel kalori alımının emilim üzerinde önemli bir etkiye sahip olmadığını göstermiştir. Gıda alımına yanıt olarak salgılanan safra ile gastrointestinal çözünürlükteki artış, gıda etkisinin potansiyel nedenidir. Bu nedenle, PİMREVA, her gün yaklaşık aynı saatte yemekten hemen sonra alınmalıdır.
Dağılım
Alpelisib, konsantrasyondan bağımsız olarak %10,8 serbest fraksiyon ile proteine orta derecede bağlanır. Alpelisib, kırmızı kan hücreleri ile plazma arasında ortalama 1,03 in vivo kan-plazma oranı ile eşit olarak dağılmıştır. Alpelisib, insan dışa akış taşıyıcılarının bir substratı olduğundan, insanlarda kan-beyin bariyerini geçmesi beklenmez. Alpelisibin kararlı durumdaki dağılım hacminin (Vss/F) 114 litre olduğu tahmin edilmektedir (gönüllüler arası CV %46).
Biyotransformasyon
İn vitro çalışmalar, kimyasal ve enzimatik amid hidrolizi ile hidroliz metaboliti BZG791'in oluşumunun majör bir metabolik yol olduğunu ve bunu CYP3A4'ün küçük katkısının izlediğini göstermiştir. Alpelisib hidrolizi, sistematik olarak hem kimyasal ayrışma hem de karaciğerle sınırlı olmayan her yerde aynı anda eksprese edilen yüksek kapasiteli enzimler (esterazlar, amidazlar, kolin esteraz) yoluyla enzimatik hidroliz ile meydana gelir. CYP3A4 aracılı metabolitler ve glukuronidler dozun ~%15'ine tekabül etmiştir; BZG791, dozun ~%40-45'ini oluşturmuştur. İdrar ve feçeste değişmemiş alpelisib olarak bulunan dozun geri kalanı ya alpelisib olarak atılır ya da emilmez.
Eliminasyon
Tokluk koşulları altındaki popülasyon farmakokinetik analizine dayanarak alpelisib, 9,2 l/saat (%CV %21) ile düşük klirens gösterir. Popülasyondan türetilen yarılanma ömrü, doz ve zamandan bağımsız olarak günde bir kez 300 mg dozu ile kararlı durumda 8 ila 9 saattir.
Bir insan kütle dengesi çalışmasında, oral uygulamadan sonra, alpelisib ve metabolitleri, esas olarak alpelisibin hepatobiliyer geçişi ve/veya bağırsak salgılanması yoluyla dışkıya (%81,0) atılmıştır veya BZG791'e metabolizeedilmiştir. İdrardaatılım küçüktür (%13,5), değişmemiş
alpelisib oranı %2'dir. Tek bir oral [14C] -alpelisib dozunu takiben, verilen toplam radyoaktif dozun %94,5'i 8 gün içinde tespit edilmiştir.
Doğrusallık/doğrusal olmayan durum
Farmakokinetiğin, 30 ila 450 mg arasındaki tokluk koşulları altında doz ve zamana göre doğrusal olduğu bulunmuştur. Çoklu dozlardan sonra, kararlı durumda alpelisib maruziyeti (EAA) tek bir dozdan sadece biraz daha yüksektir ve günlük dozlama rejimi ile ortalama birikim 1,3 ila 1,5'tir.
Metabolik etkileşim
CYP3A4 substratları
Hassas CYP3A4 substratı everolimus ile yapılan bir ilaç-ilaç etkileşimi çalışmasında EAA %11,2 artmıştır. CYP3A4 substratları ile ilaç etkileşimi sonucunda klinik olarak anlamlı bir değişiklik beklenmemektedir.
CYP3A4 indükleyicileri
Güçlü bir CYP3A4 indükleyicisi olan alpelisib ve rifampinin birlikte uygulandığı bir ilaç-ilaç etkileşim çalışmasında, alpelisib ve güçlü CYP3A4 indükleyicileri arasında klinik olarak anlamlı bir farmakokinetik etkileşim olduğunu doğrulamıştır (bkz. Bölüm 4.5).
Taşıyıcı tabanlı etkileşim
İn vitro verilere dayanarak, terapötik doz alan hastalarda renal organik anyon taşıyıcı OAT3'ün alpelisib (ve/veya onun metaboliti BZG791) tarafından inhibisyonu olasılık dışı bırakılamamaktadır.
Alpelisib, her yerde aynı anda eksprese edilen geri akış ileticilerine (P-gp, BCRP, MRP2, BSEP), karaciğer girişindeki çözünen taşıyıcı ileticilerine (OATP1B1, OATP1B3, OCT1) ve böbrekte çözünen taşıyıcı ileticilerine (OAT1, OAT2, MATE1, MATE2K) karşı sadece zayıf in vitro inhibisyon göstermiştir. Hem terapötik dozda hem de maksimum tolere edilen dozda bağlanmamış sistemik kararlı durum konsantrasyonları (veya karaciğer girişindeki konsantrasyonlar), deneysel olarak belirlenen bağlanmamış inhibisyon sabitlerinden veya IC50'den önemli ölçüde düşük olduğundan, bu inhibisyon klinik öneme sahip olmayacaktır. Bağırsak lümenindeki yüksek alpelisib konsantrasyonları nedeniyle, bağırsak P-gp ve BCRP üzerindeki bir etki tamamen olasılık dışı bırakılamamaktadır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği
Normal böbrek fonksiyonu olan 117 hasta (eGFR ≥90 ml/dak/1,73 m)/(CLcr ≥90 ml/dak), hafif böbrek yetmezliği (eGFR 60 ila <90 ml/dak/1,73 m)/(CLcr 60 ila <90 ml/dak) olan 108 hasta ve orta derecede böbrek yetmezliği olan 45 hastanın (eGFR 30 ila <60 ml/dak/1,73 m) ) yer aldığı bir popülasyon farmakokinetik analizine dayanarak, hafif ve orta derecede böbrek yetmezliğinin alpelisib maruziyeti üzerinde hiçbir etkisi yoktur (bkz. Bölüm 4.2).
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda yapılan farmakokinetik bir çalışmaya dayanarak, orta ve şiddetli karaciğer yetmezliğialpelisibmaruziyetiüzerindeihmal edilebilir bir etkiye sahiptir (bkz.
Bölüm 4.2). Alpelisib için ortalama maruziyet, şiddetli karaciğer yetmezliği olan hastalarda 1,26 kat artmıştır (GMR: Ciçin 1,00; EAA/ EAAiçin 1,26).
Normal karaciğer fonksiyonuna sahip 230 hasta, hafif karaciğer yetmezliği olan 41 hasta içeren ve orta derecede karaciğer yetmezliği olan hasta içermeyen bir popülasyon farmakokinetik analizine dayanarak, spesifik karaciğer yetmezliği çalışmasından elde edilen bulguları destekleyecek şekilde, hafif ve orta şiddette karaciğer yetmezliğinin alpelisib maruziyeti üzerinde herhangi bir etkisi görülmemiştir (bkz. bölüm 4.2).
Yaş, ağırlık ve cinsiyetin etkisi
Popülasyon farmakokinetik analizi, yaş, vücut ağırlığı veya cinsiyetin, alpelisibin sistemik maruziyeti üzerinde PİMREVA dozunda ayarlama gerektiren klinik olarak anlamlı bir etkisi olmadığını göstermiştir.
Irk/etnisite
Japon kanser hastalarında yapılan bir faz I çalışmasının popülasyon farmakokinetik analizleri ve farmakokinetik analizleri, etnik kökenin PİMREVA'nın sistemik maruziyeti üzerinde klinik olarak anlamlı bir etkisi olmadığını göstermiştir.
Japon hastalar için tek ve çoklu günlük PİMREVA dozlarından sonra kompartman dışı farmakokinetik parametreler, Beyaz popülasyonda bildirilenlere çok benzer bulunmuştur.
Pediatrik popülasyon
0-18 yaş arası çocuklarda PİMREVA'nın farmakokinetiği belirlenmemiştir. Veri bulunmamaktadır.
Geriyatrik popülasyon
Faz III çalışmada PİMREVA alan 284 hastanın (alpelisib artı fulvestrant kolunda) 117'si ≥65 yaş ve 34 hasta 75 ile 87 yaş aralığındadır. Bu hastalar ve genç hastalar arasında PİMREVA maruziyetinde genel bir fark gözlenmemiştir (bkz. Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi ve tekrarlanan doz toksisitesi
Gözlenen alpelisib etkilerinin çoğunluğu, artmış kan basıncı riski ve hiperglisemi ile sonuçlanan glukoz homeostazı üzerindeki etki gibi, alpelisibin PI3K yolağının p110α spesifik inhibitörü olarak farmakolojik aktivitesi ile ilişkili bulunmuştur. Kemik iliği ve lenfoid doku, pankreas ve her iki cinsiyetin bazı üreme organları, olumsuz etkiler için ana hedef organlardır. Kemik iliği ve lenfoid doku üzerindeki etkiler genellikle tedavinin kesilmesi ile geri dönüşlü olmuştur. Pankreas ve üreme organları üzerindeki etkiler tam olarak geri dönüşlü olmamış fakat geri dönüş eğilimi göstermiştir. Keşfedici sıçan çalışmalarında, deride enflamatuar değişikliklere dair kanıtlar bulunmuştur.
Kardiyovasküler güvenlilik farmakolojisi
Önerilen 300 mg/gün dozunda insanlardaki maruziyetten ~13 kat daha yüksek konsantrasyonlarda HERG kanallarının in vitro inhibisyonu (IC9,4 µM) gösterilmiştir. Köpeklerde önemli elektrofizyolojik etki görülmemiştir.
Karsinojenisite ve mutajenite
Herhangi bir karsinojenisite çalışması yapılmamıştır.
Alpelisib ile yapılan standart in vitro genotoksisite çalışmalarının sonuçları negatif olmuştur. Mikronükleus analizinin entegre edildiği bir tekrarlanan doz sıçan toksisite çalışmasında, alpelisib, önerilen insan dozu olan 300 mg'ın yaklaşık iki katı maruz kalma seviyelerinde (EAA) genotoksik değildir.
Üreme toksisitesi
Sıçanlarda ve tavşanlarda embriyo-fetal gelişim çalışmaları, organogenez sırasında alpelisibin oral yoldan uygulanmasının embriyotoksisite, fetotoksisite ve teratojenisiteye neden olduğunu göstermiştir. Sıçanlarda ve tavşanlarda, alpelisibe prenatal maruziyetin ardından implantasyon öncesi ve sonrası kayıp insidanslarında artış, fetal ağırlıklarda azalma ve fetal anormallik insidansında artış (genişlemiş beyin ventrikülü, kemik osifikasyonu ve iskelet malformasyonları) insanda önerilen en yüksek doz olan 300 mg'ın altındaki düzeylerde başladığı gözlenmiş olup bu sonuçlar klinik açıdan olası bir ilişkiye işaret etmektedir.
Tekrarlanan doz toksisitesi çalışmalarında, EAA bazında ilgili klinik dozlarda sıçanlarda vajinal veya uterus atrofisi ve östrus döngüsü varyasyonları, sıçanlarda ve köpeklerde prostat ve testis ağırlığında azalmalar ve köpeklerde prostat atrofisi gibi advers olaylar gözlenmiştir.
Erkek ve dişi sıçanlarda yapılan fertilite çalışmalarında fertilite üzerinde benzer etkiler gözlenmiştir. Dişilerde, önerilen insan dozu olan 300 mg'ın yaklaşık iki katı maruz kalma seviyelerinde (EAA), implantasyon bölgelerinin ve canlı embriyoların sayısında azalmaya yol açan implantasyon öncesi ve sonrası kayıplarda artış gözlenmiştir. Erkeklerde, sperm sayısı ve hareketlilik parametreleri dahil olmak üzere doğurganlık ve üreme performansı, önerilen 300 mg dozda insanlardaki tahmini maruziyetin (EAA) yaklaşık iki katı maruz kalma seviyelerinde etkilenmemiştir. Bununla birlikte, önerilen 300 mg'lık insan dozundaki veya altındaki maruz kalma seviyelerinde (EAA), yardımcı bez ağırlıkları (seminal veziküller, prostat) azalmış ve mikroskobik olarak sırasıyla prostat ve seminal veziküllerde atrofi ve/veya azalmış sekresyon ile ilişkilendirilmiştir.
Fototoksisite
Fare Balb/c 3T3 fibroblast hücre hattı üzerinde gerçekleştirilen bir in vitro fototoksisite testi, alpelisib için ilgili bir fototoksisite potansiyelini tanımlamamıştır.
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Satış Fiyatı | 105547.26 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 105547.26 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699074090936 |
| Etkin Madde | Alpelisib |
| ATC Kodu | L01EM03 |
| Birim Miktar | 200+50 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |