PIRFA 400 mg film kaplı tablet Farmakolojik Özellikler
{ Pirfenidon }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer immünosupresanlar ATC kodu: L04AX05
Pirfenidonun etki mekanizması tam olarak belirlenmemiştir. Bununla birlikte, çeşitli in vitro sistemlerde ve pulmoner fibröz hayvan modellerinde (bleomisin- ve transplant-indüklenmiş fibröz) veriler pirfenidonun hem antifibrotik hem de antiinflamatuvar özellikler ortaya koyduğunu gösterir.
İdiyopatik pulmoner fibrozis (İPF), tümör nekroz faktörü-alfa (TNF-α) ve interlökin-l-beta (IL- 1β) dahil proenflamatuvar sitokinlerin sentezi ve salımı tarafından etkilenen bir kronik fibrotik ve enflamatuvar pulmoner hastalıktır ve pirfenidonun çeşitli uyaranlara yanıt olarak inflamatuvar hücrelerin birikmesini azalttığı gösterilmiştir.
Pirfenidon, fibroblast proliferasyonunu fibrozis ile ilişkili proteinlerin ve sitokinlerin üretimini ve dönüştürücü büyüme faktörü-beta (TGF-β) ve trombosit kaynaklı büyüme faktörü (PDGF) gibi sitokin büyüme faktörlerine yanıt olarak hücre-dışı matrisin biyosentezindeki ve birikmesindeki artışı azaltır.
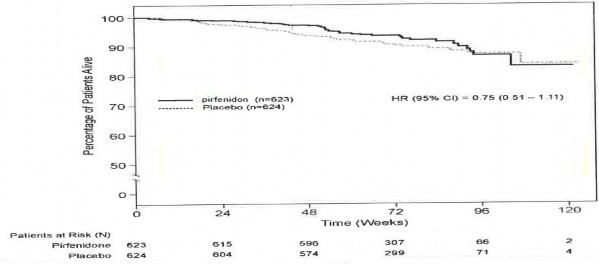
Sağkalım
Pirfenidonun plaseboya kıyasla sağkalımı, Çalışma 1, 2 ve 3'te primer son noktayı desteklemek amacıyla keşifsel analiz şeklinde hesaplanmıştır. Tüm nedenlere bağlı mortalite, çalışma süresince ve mevcut takip periyodunda, ölümün sebebine ve hastanın tedaviye devam edip etmediğine bakmaksızın değerlendirilmiştir. Tüm nedenlere bağlı mortalite, istatistiksel olarak anlamlı bir farklılık göstermemiştir (bkz. Grafik 1).
Grafik 1. Vital Durumda Tüm Nedenlere Bağlı Mortalite Kaplan-Meier Tahminleri- Çalışma Sonu: Çalışma 1, 2 ve 3
Klinik etkililik
çok-uluslu, biri (SP-3) Japonya'da yürütülmüştür.
PIPF-004 ve PIPF-006, pirfenidon 2403 mg/gün tedavisi ile plasebonun karşılaştırılmasıdır. Çalışmaların tasarımı, PIPF-004'te ara doz grubunu (1197 mg/gün) içeren birkaç istisna dışında neredeyse aynıdır. İki çalışmada da, tedavi en az 72 hafta boyunca günde üç defa uygulanmıştır. İki çalışmada da primer varış noktası, başlangıçtan 72. haftaya kadar, yüzde beklenen Zorlu Vital Kapasite (ZVK)'nin değişimidir.
PIPF-004 çalışmasında, pirfenidon alan hastalarda (N=174), plasebo alan hastalara kıyasla (N=174, p=0,00l) başlangıçtan tedavinin 72. haftasına kadar, beklenen ZVK düşüşü yüzdesi belirgin bir şekilde azalmıştır. Pirfenidon tedavisi başlangıçtan 24. (p=0,014), 36. (p<0,00l),
48. (p<0,001) ve 60. (p<0,001) haftalara kadar da, beklenen ZVK düşüşü yüzdesini belirgin bir şekilde azaltmıştır. 72.haftada, beklenen ZVK yüzdesinde başlangıçtan düşüş ≥% l0 (İPF mortalite riskinin indikatör eşiği) Pirfenidon alan hastalarda % 20, plasebo alan hastalarda
% 35 olarak gözlenmiştir (Tablo 2).
Tablo 2 PIPF-004 çalışmasında başlangıçtan 72. Haftaya beklenen ZVK yüzdesi değişiminin kategorik değerlendirmesi | ||
| Pirfenidon 2403 mg/gün (N=174) | Plasebo (N=174) |
≥% 10 azalma veya ölüm veya akciğer nakli | 35 (% 20) | 60 (% 34) |
% 10'dan daha az azalma | 97 (% 56) | 90 (% 52) |
Azalma yok (ZVK değişimi >%0) | 42 (% 24) | 24 (% 14) |
Pirfenidon alan hastalarda plasebo alan hastalara kıyasla rank ANCOVA ile önceden belirlenmiş altı dakika yürüyüş testi (6MWT) sırasında başlangıçtan 72. haftaya kadar bir fark olmasa da, rastgele bir analizde Pirfenidon alan hastaların % 37'sinde, PIPF-004'teki plasebo alan hastaların % 47'sine kıyasla 6MWT'de ≥50 m azalma gözlenmiştir.
PIPF-006 çalışmasında, Pirfenidon tedavisi (N=171) başlangıçtan 72. haftaya kadar, plasebo ile karşılaştırıldığında (N=l73; p=0,501) yüzde beklenen ZVK düşüşünü azaltmamıştır. Bununla beraber, pirfenidon tedavisi başlangıçtan 24. (p<0,001), 36. (p=0,011) ve 48. (p=0,005) haftaya kadar yüzde beklenen ZVK düşüşünü azaltmıştır. 72. Haftada, ZVK'de ≥% 10 düşüş pirfenidon alan hastaların % 23'ünde ve plasebo alan hastaların % 27'sinde görülmüştür (Tablo3).
Tablo 3 PIPF-006 çalışmasında başlangıçtan 72. Haftaya yüzde beklenen ZVK yüzdesi değişiminin kategorik değerlendirmesi | ||
| Pirfenidon 2403 mg/gün (N=171) | Plasebo (N=173) |
≥% 10 azalma veya ölüm veya akciğer nakli | 39 (% 23) | 46 (% 27) |
% 10'dan daha az azalma | 88 (% 52) | 89 (% 51) |
Azalma yok (ZVK değişimi >%0) | 44 (% 26) | 38 (% 22) |
Başlangıçtan 72. haftaya kadar 6MWT uzaklığındaki düşüş PIPF-006 (p<0.001, rank ANCOVA) çalışmasındakiplase boil ekıyaslandığındabelirgin bir şekilde azalmıştır. Ek
bir düşüşgösterdi, bu da PIPF-006'da plasebo alan hastaların % 47'sine karşılık gelmektedir.
PIPF-004 ve PIPF-006'dan elde edilen havuzlanmış hayatta kalma analizinde, ölüm oranı pirfenidon 2403 mg/gün grubunda % 7,8 iken, plasebo alan grupta % 9,8 olarak hesaplanmıştır (HR 0,77 [% 95 CI, 0,47-1,28]).
PIPF-016, 2403 mg/gün Pirfenidonun plaseboya karşı karşılaştırılmalı çalışmasıdır. Tedavi günde üç defa 52 hafta boyunca uygulanmıştır. Primer varış noktası başlangıçtan 52. haftaya kadar yüzde beklenen ZVK değişimidir. 555 hastanın tamamında, ortalama başlangıç yüzde beklenen ZVK ve %DLco sırasıyla % 68 (aralık % 48-91) ve % 42 (aralık % 27-170)'dir. Hastaların yüzde ikisinde yüzde beklenen ZVK %50'nin altındadır ve hastaların % 21'inde yüzde beklenen DLco başlangıçta % 35'in altındadır.
PIPF-016 çalışmasında, başlangıçtan tedavinin 52. haftasına kadar yüzde beklenen ZVK düşüşü, Pirfenidon alan hastalarda (N=278), plasebo alan hastalarla (N=277; p<0,000001, rank ANCOVA) kıyaslandığında, belirgin bir şekilde azalmıştır. Pirfenidon ile tedavi başlangıçtan tedavinin 13. (p<0,000001), 26. (p<0,000001) ve 39. (p=0,000002) haftasına kadar yüzde beklenen ZVK düşüşü belirgin bir şekilde azalmıştır. 52. haftada, ZVK'de ≥% 10 düşüş Pirfenidon alan hastaların % 17'sinde ve plasebo alan hastaların % 32'sinde görülmüştür (Tablo 4).
Tablo 4 PIPF-016 çalışmasında başlangıçtan 52. haftaya yüzde beklenen ZVK değişiminin kategorik değerlendirmesi | ||
| Pirfenidon 2403 mg/gün (N=278) | Plasebo (N=277) |
≥% 10 azalma veya ölüm | 46 (% 17) | 88 (% 32) |
% 10'dan daha az azalma | 169 (% 61) | 162 (% 58) |
Azalma yok (ZVK değişimi >% 0) | 63 (% 23) | 27 (% 10) |
Başlangıçtan 52. haftaya kadar 6MWT uzaklığındaki düşüş PIPF-016 (p<0,036, rank ANCOVA) çalışmasındaki plasebo ile kıyaslandığında belirgin bir şekilde azalmıştır; Pirfenidon alan hastaların % 26'sı, plasebo alan hastaların % 36'sı ile karşılaştırıldığında, 6MWT uzaklığında ≥50 m düşüş göstermiştir.
PIPF-016, PIPF-004 ve PIPF-006 çalışmalarının 12. ayda önceden belirlenmiş toplam analizinde, tüm sebep-olunmuş mortalite, Pirfenidon 2403 mg/gün grubunda (% 3,5, 623 hastanın 22'si) plasebo alan hastalarla (% 6.7, 624 hastanın 42'si) kıyaslandığında mortalite belirgin bir şekilde azdır, sonuçlanan % 48'inde ilk 12 ayda tüm sebep olunan mortalite riskinde azalma gözlenmiştir (HR 0,52 [% 95 Cl, 0,31-0,87], p=0,0107, log rank test).
Japon hastalarda yapılan çalışmada (SP3), pirfenidon 1800 mg/gün (ABD'de ve PIPF - 004/006'nın Avrupa popülasyonunda, 2403 mg/gün ile ağırlık-normalize edilmiş olarak karşılaştırılabilir) plasebo ile karşılaştırılmıştır (sırasıyla N=110, N=109). Pirfenidon ile tedavi vital kapasitede (VC) ortalama düşüşü 52. Haftada (Primer varış noktası) plasebo ile kıyaslandığında belirgin bir şekilde azalmıştır (-0,09±0,02 I karşı-0,16±0,02 I sırasıyla, p=0,042).
Pediyatrik popülasyon
Avrupa İlaç Ajansı, İPF'li pediyatrik populasyonun tüm alt kümelerinde pirfenidon ile çalışmaların sonuçlarının yayınlanması yükümlülüğünden vazgeçmiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Pirfenidon kapsüllerin gıda ile verilmesi, Cmax'ta büyük bir azalma (% 50 oranında) ve EAA'da açlık durumuna kıyasla daha küçük bir etki ile sonuçlanır. Tokluk durumunda sağlıklı yaşlı yetişkin gönüllülere (50-66 yaş) tek bir doz 801 mg oral yoldan uygulandıktan sonra, pirfenidon emilim hızı yavaşlarken tokluk durumdaki EAA değeri açlık durumundakinin yaklaşık % 80- 85'i olarak hesaplanmıştır. Açlık durumunda 801 mg tabletin üç 267 mg'lık kapsül ile karşılaştırıldığı çalışmada biyoeşdeğerlik gösterilmiştir. Tokluk durumda, 801 mg tablet, kapsüllere kıyasla EAA ölçümlerine dayanan biyoeşdeğerlik kriterlerini karşılarken, Cmax için
% 90 güven aralığı (% 108,26 - % 125,60), standart biyoeşdeğerlik sınırının) üst sınırını biraz aşmıştır (% 90 CI: % 80,00 - % 125,00). Gıdaların oral pirfenidon EAA üzerindeki etkisi, tablet ve kapsül formülasyonları arasında tutarlıydı.
Açlık durumuna kıyasla, her iki formülasyonun da gıda ile uygulanması pirfenidon Cmax değerini azaltırken, pirfenidon tabletin Cmax değeri pirfenidon kapsüllere göre biraz daha az (% 50) azaltmıştır (% 40'a karşılık % 50).
Aç karna ilaç alan gruba kıyasla, tok karna ilaç alan bireylerde, düşük yan etki insidansı (bulantı ve sersemlik) gözlenmiştir. Bu nedenle, pirfenidonun bulantı ve sersemlik insidansını azaltmak için gıda ile birlikte uygulanması tavsiye edilir.
İnsanlarda pirfenidonun mutlak biyoyararlılığı belirlenmemiştir.
Plazma Konsantrasyonları
Aç karnına alınan tek doz
Altı sağlıklı erkek yetişkine, aç karnına tek bir oral uygulama ile verilen 200 mg, 400 mg ve 600 mg pirfenidonun plazma konsantrasyonları ve farmakokinetik parametreleri Şekil 1'de ve Tablo 1'de gösterilmektedir.
Hem Cmaks hem de EAA, doz ile yaklaşık olarak karşılaştırıldığında artmıştır.
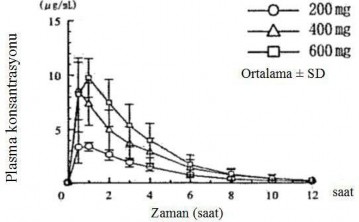
Şekil 1: Aç karnına alınan tek bir dozun ardından plasma konsantrasyonları
Tablo 1: Farmakokinetik parametreler (n=6)
Doz miktarı (mg) | C(µg/ml) | T(saat) | EAA (µg.saat/ml) | T(saat) |
200 | 3,88 ± 0,82 | 0,75 ± 0,27 | 13,97 ± 2,71 | 2,10 ± 0,45 |
400 | 9,24 ± 1,74 | 0,58 ± 0,20 | 29,10 ± 11,77 | 1,96 ± 0,55 |
600 | 10,57 ± 1,78 | 0,83 ± 0,26 | 37,03 ± 11,97 | 1,76 ± 0,40 |
(Ölçüm yöntemi: HPLC) (Ortalama ± SD)
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite ve karsinojenik potansiyel ile ilgili konvansiyonel çalışmalara dayalı klinik dışı veriler, insanlar için özel bir tehlike olmadığını ortaya koymaktadır.
Tekrarlı doz toksisite çalışmalarında fare, sıçan ve köpeklerde karaciğer ağırlık artışı gözlenmiştir; genellikle hepatik sentrilobular hipertropi ile birlikte görülür. Tedavinin kesilmesinden sonra geri dönüş gözlenmiştir. Sıçanlarda ve farelerde yürütülen karsinojenite çalışmalarında karaciğer tümörü insidansında artış gözlenmiştir. Bu hepatik bulgular hepatik mikrozomal enzimlerin indüksiyonu ile bağlantılıdır, bu etki Pirfenidon alan hastalarda gözlenmemiştir. Bu bulguların insanlar ile ilişki olduğu düşünülmemektedir.
İnsan 2403 mg/gün dozunun 37 katı olan 1500 mg/kg/gün doz uygulanan dişi sıçanlarda uterus tümörlerinde istatistikselolarakbelirginartışgözlenmiştir. Hastalık gelişme
sıçanlardaki türe spesifik endokrin metabolizmasını içeren kronik dopamin-aracılı seks hormon
dengesizliğinden dolayıdır, bu da insanlarda bulunmamaktadır.
Reprodüktif toksikoloji çalışmalarında, dişi veya erkek sıçan fertilitesinde veya yavruların postnatal gelişimi üzerinde advers etki görülmemiştir ve sıçanlarda (1.000 mg/kg/gün) veya tavşanlarda (300 mg/kg/gün) teratojenite görülmemiştir. Hayvanlarda pirfenidonun ve/veya metabolitlerinin plasental transferi, pirfenidonun ve/veya metabolitlerinin amniyotik sıvıda birikmesi ile birlikte ortaya çıkar. Yüksek dozlarda (≥450 mg/kg/gün) sıçanlarda östrus döngüsünde uzama ve düzensiz döngülerin insidansında yükselme gözlenmiştir. Yüksek dozlarda (≥1.000 mg/kg/gün) sıçanlarda hamilelik süresinde uzama ve fötal yaşam şansında azalma gözlenmiştir. Emziren sıçanlardaki çalışmalar, pirfenidonun ve/veya metabolitlerinin süte atılımının, pirfenidonun ve/veya metabolitlerinin sütte birikmesi potansiyelleri olduğunu göstermiştir.
Pirfenidon standart testler grubunda mutajenik veya genotoksik aktivite göstermemiştir ve UV maruziyet altında test edildiğinde mutajenik değildir. UV maruziyet altında test edildiğinde Pirfenidon, Çin hamsterı akciğer hücresinde fotoklastojenik miktar tayininde pozitif çıkmıştır.
Oral yoldan pirfenidon verilen kobaylarda, UVA/UVB ışığına maruz bırakıldıklarında fototoksisite ve iritasyon geliştiği kaydedilmiştir. Güneş koruyucu uygulamasıyla fototoksisite lezyonlarının şiddeti minimize edilmiştir.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Ali Raif İlaç San. A.Ş.
| Satış Fiyatı | 29541.55 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 29541.55 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699543092249 |
| Etkin Madde | Pirfenidon |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |