POMALEM 2 mg sert kapsül (21 sert kapsül) Klinik Özellikler
{ Pomalidomid }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
POMALEM, bortezomib ve deksametazon ile kombinasyon halinde, daha önce lenalidomid de dahil olmak üzere en az bir tedavi rejimi alan, bu tedavilere dirençli veya nüks eden multipl miyelomlu erişkin hastaların tedavisinde endikedir.
POMALEM, deksametazonla kombinasyon halinde, aşağıda belirtilen koşulları taşıyan multipl miyelom tanılı yetişkin hastaların tedavisinde endikedir:
Otolog kök hücre nakline uygun olmayan hastalarda bortezomib ve lenalidomid dahil en az iki dizi tedavi sonrası nüks eden veya bu tedavilere dirençli hastalık varlığında endikedir.
4.2. Pozoloji ve uygulama şekli
Tedavi, multipl miyelom tedavisinde deneyimli bir hekimin denetiminde başlatılmalı ve izlenmelidir.
Klinik veya laboratuvar bulgularına göre doza devam edilebilir veya doz ayarlaması yapılabilir (bkz. Bölüm 4.4).
Pomalidomidin bortezomib ve dekzametazon ile kombinasyonu
Önerilen başlangıç dozu, tekrarlanan 21 günlük sikluslar halinde 1 ve 14. günler arası günde bir defa ağızdan 4 mg POMALEM'dir.
Pomalidomid, Tablo 1'de gösterildiği gibi, bortezomib ve deksametazon ile kombinasyon halinde uygulanır.
Bortezomibin önerilen başlangıç dozu, Tablo 1'de gösterilen günlerde günde bir kez intravenöz veya subkütan olarak 1,3 mg/m2'dir. Önerilen deksametazon dozu, Tablo 1'de gösterilen günlerde günde bir kez oral olarak 20 mg'dır.
Bortezomib ve deksametazon ile kombine edilen pomalidomid tedavisi, hastalığın ilerlemesi veya kabul edilemez toksisite oluşana kadar verilmelidir.
Tablo 1. Bortezomib ve deksametazon ile kombinasyon halinde POMALEM için önerilen dozaj şeması
1-8.Sikluslar | Gün (21 günlük döngü) | ||||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
Pomalidomid (4 mg) | ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠|
|
|
|
|
|
|
|
Bortezomib (1,3 mg/m) | ⢠|
|
| ⢠|
|
|
| ⢠|
|
| ⢠|
|
|
|
|
|
|
|
|
|
|
Deksametazon (20 mg) * | ⢠| ⢠|
| ⢠| ⢠|
|
| ⢠| ⢠|
| ⢠| ⢠|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||
9.Siklus sonrası | Gün (21 günlük döngü) | ||||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
Pomalidomid (4 mg) | ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠|
|
|
|
|
|
|
|
Bortezomib (1,3 mg/m) | ⢠|
|
|
|
|
|
| ⢠|
|
|
|
|
|
|
|
|
|
|
|
|
|
Deksametazon (20 mg) * | ⢠| ⢠|
|
|
|
|
| ⢠| ⢠|
|
|
|
|
|
|
|
|
|
|
|
|
* 75 yaş üstü hastalar için bkz. Özel popülasyonlara ilişkin ek bilgiler.
Pomalidomid doz ayarlaması veya ara verilmesi
Yeni bir pomalidomid siklusunu başlatmak için nötrofil sayısının ≥1x10/L ve trombosit sayısının ≥50x 10/L olması gerekmektedir.
Advers reaksiyonlarla ilgili olarak pomalidomid tedavisine ara verilmesi veya dozunun azaltılması ile ilgili bilgiler, Tablo 2'de ve doz seviyeleri Tablo 3'de belirtilmiştir:
Tablo 2: Pomalidomidin doz ayarlaması için bilgiler
Toksisite | Doz ayarlaması | ||||||
Nötropeni* MNS** <0,5 x 10/L veya Febril nötropenik ateş (ateş ≥ 38,5°C ve MNS <1x 10/L) | Siklusun geri kalanı için pomalidomid tedavisine ara verilir. Haftalık TKS*** takibi yapılır. | ||||||
MNS ≥1 x 10/L'ye döndüğünde | Pomalidomid tedavisine önceki seviye düşük doz ile tekrar başlanır. | dozdan | bir | ||||
Takip eden <0,5 x 10/L'nin altına her düşüşte | Pomalidomid tedavisine ara verilir. | ||||||
MNS ≥1 x 10/L'ye döndüğünde | Pomalidomid tedavisine önceki seviye düşük doz ile tekrar başlanır. | dozdan | bir | ||||
Trombositopeni Trombosit sayısı <25 x 10/L | Siklusun geri kalanı için pomalidomid tedavisine ara verilir. Haftalık TKS*** takibi yapılır. | ||||||
Trombosit döndüğünde | sayısı | ≥50 | x | 10/L'ye | Pomalidomid tedavisine önceki seviye düşük doz ile tekrar başlanır. | dozdan | bir |
Takip eden <25 x 10/L'nin altına her düşüşte | Pomalidomid tedavisine ara verilir. | ||||||
Trombosit sayısı ≥50 x 10/L'ye döndüğünde | Pomalidomid tedavisine önceki seviye düşük doz ile tekrar başlanır. | dozdan | bir | ||||
Döküntü Döküntü = 2-3. Derece | Doz kesilmesi veya pomalidomid tedavisinin kesilmesi düşünülmelidir. | ||||||
Döküntü = Derece 4 veya kabarma (anjiyoödem, anafilaktik reaksiyon, eksfolyatif veya büllöz döküntü dahil veya Stevens-Johnson sendromu (SJS), Toksik Epidermal Nekroliz (TEN) veya Eozinofili ve Sistemik Semptomlarla İlaç Reaksiyonundan (DRESS) ile ilaç reaksiyonu şüphesi varsa) | Tedaviyi kalıcı olarak durdurun (bkz. Bölüm 4.4). | ||||||
Diğer
Diğer ≥ Derece 3 pomalidomid ile ilgili advers reaksiyonlar | Siklusun geri kalanı için pomalidomid tedavisi durdurulur. Bir sonraki döngüde tedaviye önceki dozdan bir seviye düşük doz ile devam edilir (Dozlama başlamadan önce advers reaksiyonlar geçmeli ya da ≤2. dereceye dönmelidir). | ||||||
â Bu tabloda yer alan doz ayarlama bilgileri, hem pomalidomid, bortezomib ve deksametazon kombinasyonu hem de pomalidomid dekzametazon kombinasyonu için geçerlidir.
* Nötropeni durumunda hekim büyüme faktörlerinin kullanımını göz önünde bulundurmalıdır. **MNSâMutlak Nötrofil Sayısı; ***TKSâTam Kan Sayımı
Tablo 3. Pomalidomid doz azaltma basamakları â
Doz Düzeyi | Pomalidomid dozu |
Başlangıç dozu | 4 mg |
Doz seviyesi -1 | 3 mg |
Doz seviyesi -2 | 2 mg |
Doz seviyesi -3 | 1 mg |
â Bu tabloda yer alan doz ayarlama bilgileri, hem pomalidomid, bortezomib ve deksametazon kombinasyonu hem de pomalidomid dekzametazon kombinasyonu için geçerlidir.
Dozun 1 mg'a düşürülmesi sonrasında advers reaksiyonlar ortaya çıkarsa, ilaç kesilmelidir. Güçlü CYP1A2 inhibitörleri
Güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile birlikte uygulanırsa pomalidomid dozu %50 azaltılmalıdır.
Bortezomib doz modifikasyonu veya kesilmesi
Bortezomibe bağlı advers reaksiyonlar için doz kesilmesi veya azaltmaları ile ilgili talimatlar için, hekimler bortezomib (KÜB)'ne başvurmalıdır.
Deksametazon doz modifikasyonu veya kesilmesi
Düşük doz deksametazona bağlı advers reaksiyonlar için doz kesilmesi veya azaltmaları ile ilgili talimatlar Tablo 4 ve 5'te özetlenmiştir.
Tablo 4. Deksametazon doz ayarlaması için bilgiler
Toksisite | Doz Değişikliği |
Dispepsi = 1-2. Derece
Dispepsi ≥3. Derece | Aynı dozda devam edilir ve histamin (H) blokörleri veya eşdeğerleri ile tedavi edilir. Semptomlar devam ederse, doz bir düzey azaltılır.
Semptomlar kontrol altına alınana kadar tedaviye ara verilir. Deksametazona ara verilse dahi pomalidomid tedavisine devam edilir. Tedaviye önceki dozdan daha düşük bir doz düzeyinde devam edilir ve H2 blokörü veya eşdeğeri eklenir. |
Ödem ≥3. Derece | Gerektiğinde diüretikler kullanılır ve doz bir düzey azaltılır. |
Konfüzyon veya duygu durum değişikliği ≥2. Derece | Semptomlar düzelene kadar tedaviye ara verilir. Tedaviye önceki dozdan daha düşük bir doz düzeyinde devam edilir. |
Kas güçsüzlüğü ≥2. Derece | Kas güçsüzlüğü ≤1. dereceye dönene kadar |
| tedaviye ara verilir. Tedaviye önceki dozdan daha düşük bir doz düzeyinde devam edilir. |
Hiperglisemi ≥3. Derece | Doz, bir düzey azaltılır. Gerektiğinde insülin veya oral hipoglisemik ilaçlarla tedavi edilir. |
Akut pankreatit | Deksametazon tedavi rejiminden çıkarılır. |
Diğer ≥ 3. Derece deksametazonla ilgili advers reaksiyonlar | Advers reaksiyonlar ≤2. dereceye dönene kadar deksametazon dozu durdurulur. Tedaviye önceki dozdan daha düşük bir doz düzeyinde devam edilir. |
Eğer toksisitelerin düzelmesi 14 günden fazla sürerse, deksametazon dozu bir önceki dozdan daha düşük bir doz seviyesinde devam edecektir.
Tablo 5. Deksametazon doz azaltma basamakları
Doz Düzeyi | ≤ 75 yaş Doz (Siklus 1-8: 21 günlük siklusun 1, 2, 4, 5, 8, 9, 11, 12 günleri Siklus ≥ 9: 21 günlük siklusun 1, 2, 8, 9 günleri) | > 75 yaş Doz (Siklus 1-8: 21 günlük siklusun 1, 2, 4, 5, 8, 9, 11, 12 günleri Siklus ≥ 9: 21 günlük siklusun 1, 2, 8, 9 günleri) |
Başlangıç dozu | 20 mg | 10 mg |
Doz seviyesi -1 | 12 mg | 6 mg |
Doz seviyesi -2 | 8 mg | 4 mg |
Eğer 75 yaş ve altındaki hasta 8 mg'ı veya 75 yaş üstü hasta 4 mg'ı tolere edemezse deksametazon kesilmelidir.
Tedavi rejiminin herhangi bir bileşeninin kalıcı olarak kesilmesi durumunda, kalan diğer tıbbi ürünlerin devamlılığı doktorun takdirine bağlıdır.
4.3. Kontrendikasyonlar
Gebelik,
Gebelik önleme programının tüm koşullarına uymadığı takdirde, çocuk doğurma potansiyeli olan kadınlar (bkz. bölüm 4.4 ve 4.6),
Gerekli doğum kontrol önlemlerini takip edemeyen veya önlemlerine uyamayan erkek hastalar (bkz. bölüm 4.4),
POMALEM ile kombinasyon halinde verilen diğer tıbbi ürünler hakkında bilgi için, ilgili güncel KÜB'e bakınız.
4.4. Özel kullanım uyarıları ve önlemleri
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer tıbbi ürünlere pomalidomidin etkisi
Pomalidomidin, P450 izoenzimlerinin substratları veya taşıyıcıları ile birlikte uygulanmasının, P450 izoenzim inhibisyonu veya indüksiyonu veya taşıyıcı inhibisyonuna bağlı klinik olarak anlamlı farmakokinetik ilaç-ilaç etkileşmelerine neden olması beklenmemektedir. Bu tür ilaç-ilaç etkileşim potansiyeli, pomalidomidin kombine oral kontraseptiflerin farmakokinetiği üzerine potansiyel etkisi dahil olmak üzere, klinik olarak değerlendirilmemiştir (bkz. bölüm 4.4).
Diğer tıbbi ürünlerin pomalidomide etkisi
Pomalidomid, CYP1A2 ve CYP3A4/5 tarafından kısmi olarak metabolize edilir. Ayrıca P- glikoproteinin de bir substratıdır. Pomalidomidin güçlü CYP3A4/5 ve P-gp inhibitörü olan ketokonazol ile veya güçlü CYP3A4/5 indükleyicisi olan karbamazepin ile eş zamanlı uygulanmasının, pomalidomide maruziyet üzerinde klinik olarak anlamlı etkisi bulunmamaktadır. Güçlü CYP1A2 inhibitörü olan fluvoksaminin pomalidomid ile ketokonazol varlığında eş zamanlı olarak uygulanması, pomalidomid ve ketokonazole kıyasla, pomalidomide ortalama maruziyeti %90 güven aralığı ile [%91 ila %124] %107 oranında artırmıştır. Tek başına bir CYP1A2 inhibitörünün metabolizma değişikliklerine katkısını değerlendirmek üzere yapılan ikinci bir çalışmada, pomalidomid ile tek başına fluvoksaminin eş zamanlı olarak uygulanması pomalidomide ortalama maruziyeti, tek başına pomalidomide
kıyasla %90 güven aralığı ile [%98 ila %157) %125 artırmıştır. Güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile eş zamanlı olarak uygulanırsa, pomalidomid dozu %50 azaltılmalıdır.
Pomalidomidin güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) ile eşzamanlı uygulanması halinde, hastalar advers reaksiyonlar açısından yakından takip edilmelidir.
Deksametazon
Multipl miyelom hastalarında 4 mg'a kadar olan çoklu pomalidomid dozlarıyla, 20 mg ila 40 mg arasında deksametazonun (CYP3A dahil çeşitli CYP enzimlerinin hafif ila orta derecede indükleyicisi) eş zamanlı olarak uygulanmasının, pomalidomidin tek başına uygulanmasına kıyasla, pomalidomidin farmakokinetiği üzerine herhangi bir etkisi olmamıştır.
Deksametazonun, varfarin üzerine olan etkisi bilinmemektedir. Tedavi sırasında varfarin konsantrasyonunun yakından takip edilmesi tavsiye edilir.
Özel popülasyonlara iliskin ek bilgiler Pediyatrik popülasyon:
Multipl Miyelom endikasyonu için 0-17 yaş arası çocuklarda pomalidomidin uygun bir kullanımı yoktur.
POMALEM ile kombine edilen ürünlerin diğer ilaçlar ile etkileşimleri hakkında ek bilgi için ilgili ilaçların güncel KÜB'ne bakınız.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: X
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar etkili doğum kontrol yöntemi kullanmalıdır. Pomalidomid insan semeninde bulunmaktadır. Önlem olarak pomalidomid kullanmakta olan tüm erkek hastalar, eşleri gebe ise ya da eşlerin çocuk doğurma potansiyelinin olması ve herhangi bir doğum kontrol yöntemi kullanmaması durumunda tedavi süresince, tedaviye ara verilmesi sırasında ve tedavi kesildikten sonra 7 gün süreyle prezervatif kullanmalıdır (bkz. bölüm 4.3 ve 4.4).
Çocuk doğurma potansiyeli olan kadınlar tedaviye başlamadan 4 hafta önce ve süresince (ve tedavinin ardından 4 haftaya kadar) etkili doğum kontrolü uygulamak zorundadırlar (bkz. bölüm 4.3 ve 4.4).
Pomalidomid gebelik boyunca ve gebeliği önlemek için tüm koşullara uyulmadıkça, çocuk doğurma potansiyeli olan kadınlarda kontrendikedir (bkz. bölüm 4.3 ve 4.4).
Gebelik dönemi
POMALEM gebelik döneminde kontrendikedir (bkz. bölüm 4.3).
Pomalidomidin insanlarda teratojenik etkisi olması beklenmektedir.
Pomalidomid ile tedavi edilen kadınlarda gebelik ortaya çıkması halinde, tedavi durdurulmalıdır ve hasta değerlendirme ve tavsiye için teratoloji konusunda uzman veya deneyimli bir hekime sevk edilmelidir. Pomalidomid kullanmakta olan bir erkeğin eşinde gebelik ortaya çıkması halinde, erkeğin eşinin değerlendirme ve tavsiye için teratoloji konusunda uzman veya deneyimli bir hekime sevk edilmesi önerilir.
Laktasyon dönemi
Pomalidomidin insan sütüyle atılıp atılmadığı bilinmemektedir. Pomalidomid anneye uygulandıktan sonra, emziren sıçanların sütünde tespit edilmiştir. Anne sütü alan bebeklerde pomalidomide bağlı advers reaksiyon görülme olasılığı nedeniyle, çocuk için emzirmenin ve kadın için terapinin faydalarını dikkate alarak, emzirmenin mi yoksa tedavinin mi kesileceğine dair bir karar verilmelidir.
Üreme yeteneği/Fertilite
Pomalidomidin hayvanlarda fertiliteyi olumsuz olarak etkilediği ve hayvanlarda teratojenik olduğu gösterilmiştir. Gebe tavşanlara uygulandıktan sonra, pomalidomid plasentaya geçmiştir ve fetal kanda tespit edilmiştir (bkz. bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Pomalidomidin araç ve makine kullanma yeteneği üzerine hafif veya orta derecede bir etkisi bulunmaktadır.
Pomalidomid kullanımı ile yorgunluk, depresif bilinç düzeyi, konfüzyon ve baş dönmesi bildirilmiştir. Hastalar pomalidomid ile tedavi edilirken araç, makine kullanmamaları veya tehlikeli işler yapmamaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Pomalidomidin bortezomib ve dekzametazon ile kombinasyonu
En sık bildirilen kan ve lenf sistemi hastalıkları nötropeni (%46,8), trombositopeni (%36,7) ve anemidir (%28,4). En sık bildirilen advers reaksiyon periferik duyusal nöropatidir (%47,8). En sık bildirilen 3. veya 4. derece advers reaksiyonlar, nötropeni (%41,7), trombositopeni (%27,3) ve anemi (14,0) gibi kan ve lenf sistemi hastalıklarıdır. En sık bildirilen ciddi advers reaksiyon pnömonidir (%11,5). Bildirilen diğer ciddi advers reaksiyonlar arasında pireksi (%4,0), alt solunum yolu enfeksiyonu (%2,9), pulmoner emboli (%2,9), influenza (%2,9) ve akut böbrek hasarı (%2,9) yer almaktadır.
4.9. Doz aşımı ve tedavisi
Sağlıklı gönüllülerde, pomalidomid'in 50 mg'a kadar çıkan tek doz ve multipl miyelomlu hastalarda günde bir defa çoklu 10 mg dozlarında çalışma yapılmış olup doz aşımıyla ilişkili olarak ciddi advers reaksiyonlar bildirilmemiştir. Çalışmalarda pomalidomidin hemodiyaliz ile uzaklaştırılabildiği bulunmuştur.
Doz aşımı durumunda, destek tedavisi tavsiye edilmektedir.
Farmakoterapötik grup: İmmünosupresanlar, diğer immünosupresanlar ATC kodu: L04AX06
Etki mekanizması:
Pomalidomid direkt antimiyelom tümorisidal ve immünomodülatör aktiviteye sahiptir ve multipl miyelom tümör hücrelerinin çoğalmasında rol oynayan stromal hücre desteğini inhibe eder. Pomalidomid spesifik olarak hematopoietik tümör hücrelerinin proliferasyonunu inhibe
eder ve apopitozisi indükler. Ek olarak, pomalidomid lenalidomide dirençli multipl miyelom hücre dizilerinin proliferasyonunu inhibe eder ve lenalidomide duyarlı ve lenalidomide dirençli hücre dizilerinin her ikisinde de tümör hücrelerinin apopitozisi indüklemede deksametazon ile sinerjistik etki gösterir. Pomalidomid T hücreleri ve Doğal Öldürücü (Natural Killer, NK) hücrelerinin düzenlediği bağışıklığı güçlendirir ve monositler tarafından pro-enflamatuvar sitokinlerin (örn., TNF-α ve IL-6) üretilmesini inhibe eder. Pomalidomid, endotel hücrelerinin göçü ve adhezyonunu engelleyerek, anjiyogenezi de inhibe eder.
Pomalidomid, deoksiribonükleik asit (DNA) hasar bağlayıcı protein 1 (DDB1), cullin 4 (CUL4) ve cullins-1 regülatörünü (Roc1) içeren bir E3 ligaz kompleksinin bir parçası olan protein sereblonuna (CRBN) doğrudan bağlanır ve kompleks içinde CRBN'nin otomatik ubikütinasyonunu inhibe edebilir. E3 ubikütin ligazları, çeşitli substrat proteinlerinin poli- ubikütinasyonundan sorumludur ve pomalidomid tedavisi ile gözlenen pleyiotropik hücresel etkileri kısmen açıklayabilir.
Pomalidomid in vitro varlığında substrat proteinleri Aiolos ve Ikaros, ubikütinasyon ve daha sonra doğrudan sitotoksik ve immünomodülatör etkilere yol açan bozulma için hedeflenir. İn vivo olarak, pomalidomid tedavisi, nükseden lenalidomid-refrakter multipl miyelomlu hastalarda Ikaros seviyelerinde azalmaya yol açmıştır.
Klinik etkililik ve güvenlilik
Pomalidomidin bortezomib ve deksametazon ile kombinasyon tedavisinde
Lenalidomid de dahil olmak üzere en az bir dizi tedavi almış ve son tedavide veya sonrasında hastalık progresyonu göstermiş daha önce tedavi edilen multipl miyelomlu erişkin hastalarda bortezomib ve düşük doz deksametazon (Pom+Btz+DD-Deks) ile kombinasyon halinde pomalidomidin etkililiği ve güvenliliği, Faz III çok merkezli, randomize, açık etiketli çalışmada (CC-4047-MM-007) bortezomib ve düşük doz deksametazon (Btz+DD-Dks) ile karşılaştırılmıştır. Çalışmaya toplam 559 hasta katılmıştır. 281 hasta Pom+Btz+DD-Deks kolunda ve 278 hasta Btz+DD-Deks kolunda randomize edilmiştir. Hastaların %54'ü erkektir ve genel nüfusun medyan yaşı 68'dir (min: 27 â maks: 89 yaş). Hastaların yaklaşık %70'i lenalidomid tedavisine cevap vermemiştir (Pom+Btz+DD-Deks'te %71,2, Btz+DD-Deks'te
%68,7). Hastaların yaklaşık %40'ı 1. relapstadır ve hastaların yaklaşık %73'ü önceki tedavi olarak bortezomib almıştır.
Pom+Btz+DD-deks kolundaki hastalara uygulanmıştır. Her 21 günlük siklusun 1 ila 14. günlerinde oral olarak 4 mg pomalidomid uygulanmıştır. Her iki çalışma kolundaki hastalara, 1 ila 8 siklusları için 21 günlük bir siklusun 1, 4, 8 ve 11. günlerinde ve 9 ve sonrası sikluslar için 21 günlük bir siklusun 1 ve 8. günlerinde bortezomib (1,3 mg/m2/doz) uygulanmıştır. Her iki çalışma kolundaki hastalara 1 ila 8 arasındaki sikluslar için 21 günlük bir siklusun 1, 2, 4,
5, 8, 9, 11 ve 12. günlerinde ve 9. siklustan itibaren sonraki 21 günlük döngünün 1, 2, 8 ve 9 günlerinde düşük doz deksametazon (20 mg/gün [≤ 75 yaşında] veya 10 mg/gün [> 75 yaşında]) uygulanmıştır. Toksisiteyi yönetmek için gerektiğinde dozlar azaltılmış ve tedavi geçici olarak kesilmiş veya durdurulmuştur. (bkz. Bölüm 4.2).
Tedavi amaçlı popülasyon (ITT) için birincil etkililik sonlanım noktası, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesine göre progresyonsuz sağkalım (Progression Free Survival - PFS)'dır. Ortalama 15,9 aylık takipten sonra, Pom+Btz+DD-deks kolunda medyan PFS süresi 11,20 aydır (%95 GA: 9,66; 13,73). Btz + DD-deks kolunda, medyan PFS süresi 7,1 aydır (%95 GA: 5,88; 8,48).
26 Ekim 2017 tarihli veri kesme tarihi kullanılarak genel etkililik veri özeti Tablo 10'da sunulmuştur. ITT popülasyonunda PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Tablo 10- Genel etkililik özeti
| Pom+Btz+DD-Deks (N = 281) | Btz+DD-Deks (N = 278) |
PFS (ay) |
| |
Medyana zaman (% 95 GA) | 11,20 (9,66; 13,73) | 7,10 (5,88; 8,48) |
HR (% 95 GA), P-değeri | 0,61 (0,49; 0,77); <0,0001 | |
ORR, n (%) | % 82,2 | % 50,0 |
sCR | 9 (3,2) | 2 (0,7) |
CR | 35 (12,5) | 9 (3,2) |
VGPR | 104 (37,0) | 40 (14,4) |
PR | 83 (29,5) | 88 (31,7) |
OR (95% GA) , P-değeri | 5,02 (3,35; 7,52); <0,001 | |
DoR (ay) |
| |
Medyana zaman (% 95 GA) | 13,7 (10,94 ; 18,10) | 10,94 (8,11 ; 14,78) |
HR (% 95 GA) | 0,76 (0,56; 1,02) | |
Btz = bortezomib; GA = Güven aralığı; CR = Tam yanıt; DoR = Yanıt süresi; HR = Tehlike oranı; DD-Deks = düşük doz deksametazon; OR = Olasılık oranı; ORR = Genel yanıt oranı; PFS = progresyonsuz sağkalım; POM = pomalidomid; PR = Kısmi yanıt; sCR = Kati tam yanıt VGPR = Çok iyi kısmi yanıt.
≤ 5,5 mg/L'ye karşı> 5,5 mg/L) ile CMH testine bağlıdır.
Pom+Btz+DD-deks kolunda medyan tedavi süresi 8,8 ay (12 tedavi siklusu) ve Btz+DD-deks kolunda 4,9 aydır (7 tedavi siklusu).
PFS avantajı, yalnızca bir önceki tedavi rejimini alan hastalarda daha belirgindir. Önceden bir 26 antimiyelom tedavisi alan hastalarda ortalama PFS süresi Pom+Btz+DD-deks kolunda 20,73 ay (% 95 GA: 15,11; 27,99) ve Btz+DD-deks kolunda 11,63 aydır (%95 GA: 7,52,
15,74).
Pom+Btz+DD-deks tedavisi ile %46 risk azalması gözlendi (HR = 0,54; %95 GA: 0,36;
0,82).
Şekil 1. IMWG Kriterlerine Dayalı olarak IRAC Değerlendirmesi ile Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)
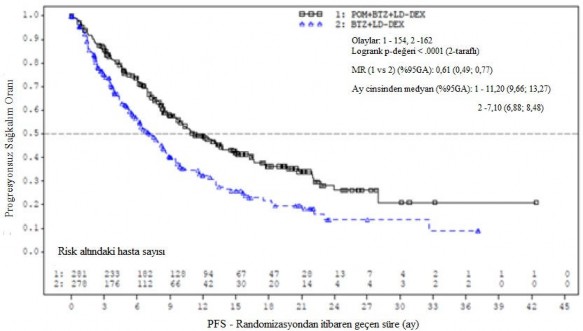
Veri kesim tarihi: 26 Ekim 2017
Genel sağkalım (OS) için 15 Eylül 2018 tarihli veri kesimi kullanılarak (26,2 aylık medyan takip süresi) yakın zamandaki ara analizine göre, Kaplan-Meier tahminleri ile medyan OS zamanı Pom+Btz+DDdeks kolu için 40,5 ay ve Btz +DDdeks kolu için 30,5 aydır (Genel olay oranı %43,3 ile birlikte HR = 0,91, % 95 GA: 0,70; 1,18,).
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
Deva Holding A.Ş.
| Satış Fiyatı | 96002.69 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 96002.69 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699525159748 |
| Etkin Madde | Pomalidomid |
| ATC Kodu | L04AX06 |
| Birim Miktar | 2 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 21 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |