RAVIRAN 200 mg film kaplı tablet (40 tablet) Kısa Ürün Bilgisi
{ Favipiravir }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
RAVİRAN 200 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Favipiravir 200 mg
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet
Açık sarı renkli, yuvarlak bikonveks tabletler.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Yeni veya yeniden ortaya çıkan influenza virüs enfeksiyonları (diğer anti-influenza virüs
ajanlarının etkili olmadığı ya da yetersiz olduğu olgularla sınırlıdır) tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Erişkinlerde doz aşağıdaki şekilde verilir:
1. gün: sabah 1600 mg (8 tablet) ve akşam 1600 mg (8 tablet) olmak üzere günde iki kez
2-5. günler: sabah 600 mg (3 tablet) ve akşam 600 mg (3 tablet) olmak üzere günde iki kez
verilir.
Kullanım süresi 5 gündür.
Uygulama şekli:
Oral uygulanır.
Özel popülasyonlara ilişkin ek bilgiler:
Karaciğer yetmezliği:
Farmakokinetik çalışmada karaciğer fonksiyon bozukluğu olan hastalarda favipiravir plazma seviyesinde artış bildirilmiştir (Bkz. Bölüm 5.2).
Böbrek yetmezliğinde kullanımı konusunda veri mevcut değildir. Ancak gut hastaalrı ya da gut
öyküsü olan hastalarda ve hiperürisemili hastalarda (kan ürik asit seviyesi artabilir ve semptomlar ağırlaşabilir) dikkatli kullanılmalıdır.(Bkz.Bölüm 4.4)
Pediyatrik popülasyon:
Pediyatrik popülasyonda kullanımı mevcut değildir. Favipiravir çocuklarda denenmemiştir.
Geriyatrik popülasyon:
Yaşlılarda sıklıkla fizyolojik işlevler azaldığından, RAVİRAN, yaşlı hastalara genel koşulları
izlenerek dikkatle uygulanmalıdır.
4.3. Kontrendikasyonlar
RAVİRAN aşağıda belirtilen hastalarda kontrendikedir.
Hamile olduğu bilinen veya hamile olduğundan şüphelenilen kadınlar (Hayvan çalışmalarında erken embriyonik ölümler ve teratojenisite gözlenmiştir Bkz. Bölüm 4.6).
İlacın herhangi bir bileşenine karşı aşırı duyarlılık öyküsü olan hastalar.
RAVİRAN çocuklarda kullanılmamalıdır.
4.4. Özel kullanım uyarıları ve önlemleri

Hayvan çalışmalarında erken embriyonik ölümler ve teratojensite gözlenmesi sebebiyle gebe ya da gebelik şüphesi olan kadınlarda favipiravir kullanılmamalıdır (Bkz.Bölüm 4.3 ve 4.6).
Çocuk doğurma potansiyeli bulunan kadınlara favipiravir uygulamadan önce negatif gebelik testi onaylanmalıdır. Tedavi sırasında ve tedavi sonlanımından sonraki 7 gün süresince en etkili kontrasepsiyon metodunun kullanılması ve tüm riskler konusunda hasta bilgilendirilmelidir (Bkz.Bölüm 4.6). Tedavi sırasında gebelik şüphesi olur ise tedavi derhal kesilmeli ve doktora başvurulmalıdır.
Favipiravir sperm içerisinde dağılır. Bu tıbbi ürün erkek hastalara uygulanırken tedavi sırasında ve tedavi sonlanımından sonraki 7 gün süresince en etkili kontrasepsiyon metodunun (erkekler kondom kullanmalıdır) kullanılması ve tüm riskler konusunda hasta bilgilendirilmelidir.Ayrıca gebe kadınlar ile cinsel ilişkiye girilmemesi konusunda hasta bilgilendirilmelidir.(Bkz.Bölüm 4.6).
Tedaviden önce hasta ve aile bireylerine etkililik ve riskler (fetüs maruziyeti riski de dahil)açıklanmalıdır.
Kullanımdan önce favipiravir kullanımının gerekliliği dikkatli bir şekilde incelenmelidir.
Favipiravir yeni veya yeniden ortaya çıkan virüs enfeksiyonları için kullanılmamıştır. Advers olaylar ve klinik çalışma sonuçlarına ilişkin bilgiler onaylanan dozdan daha düşük dozlarla yürütülen Japon klinik çalışmalarına dayanmaktadır.
Favipiravir bakteriyel enfeksiyonlara karşı etkili değildir. Favipiravirin çocuklarda kullanımı mevcut değildir.
Tedavi, influenza benzeri semptomların görülmesinden hemen sonra başlatılmalıdır.
Favipiravir yeni veya yeniden ortaya çıkan virüs enfeksiyonları için kullanılmamıştır. Advers olaylar ve klinik çalışma sonuçlarına ilişkin bilgiler onaylanan dozdan daha düşük dozlarla yürütülen Japon klinik çalışmalarına dayanmaktadır.
Gut hastalığı ya da gut geçmişi olan hastalarda, hiperürisemili hastalarda dikkatli kullanılmalıdır. Kan ürik asit düzeyi artabilir ve semptomlar ağırlaşabilir (Bkz. Bölüm 4.8).
![]()
Onaylı dozlar ile favipiravirin etkinlik ve güvenliliğini ölçmek için klinik çalışmalar yapılmamıştır. Onaylı dozaj, influenza virüsü enfeksiyonlu olan hastalarda yapılan plasebo kontrollü bir faz I/II klinik çalışmasının sonuçlarına ve yapılan farmakokinetik çalışma sonuçlarına dayanılarak belirlenmiştir. Farmakokinetik çalışmalarda karaciğer fonksiyon bozukluğu olan hastalarda favipiravir plazma düzeylerinde artış bildirilmiştir. (Bkz. Bölüm 5.2)
Nedensel ilişkisi bilinmemesine rağmen, favipiravir dahil anti-influenza virüs ajanlarının kullanımının ardından anormal davranış gibi psikonörotik semptomlar bildirilmiştir. Çocukların ve reşit olmayanların tedavisinde, anormal davranışlardan kaynaklanan düşme gibi bir kaza durumunu önlemek için hastalara ve ailelerine, anti-influenza virüs ajanlar ile tedaviye başlandıktan sonra anormal davranışların gelişebileceği ve çocuklar/reşit olmayanlar evde tedavi edildiklerinde en az 2 gün yalnız kalmamaları konusunda düzenleme yapmaları için bilgi verilmelidir. İnfuenza ensefalopatisi ile ilişkili benzer semptomlar bildirilmiş olsa bile yukarıda belirtildiği şekilde bilgilendirme yapılmalıdır.
İnfluenza enfeksiyonu bakteriyel enfeksiyonlarla komplike olabilir veya influenza benzeri semptomlarla karıştırılabilir. Bakteriyel enfeksiyon durumunda veya bakteriyel enfeksiyon olduğundan şüpheleniliyorsa, anti-bakteriyel ajanların uygulanması gibi uygun önlemler alınmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Favipiravir, sitokrom P-450 (CYP) ile metabolize edilmez, çoğunlukla aldehid oksidaz (AO) ve kısmen de ksantin oksidaz (KO) ile metabolize edilir. Favipiravir, AO ve CYP2C8'i inhibe eder, ancak CYP'i indüklemez (Bkz. Bölüm 5.2).
İlaçlar | Belirtiler, Semptomlar ve Tedavi | Mekanizma ve Risk Faktörleri |
Pirazinamid | Günde bir defa 1,5 g Pirazinamid ve günde iki defa 1200 mg/400 mg Favipiravir uygulandığında kan ürik asit seviyesi artar; tek başına pirazinamid verildiğinde kan ürik asit seviyesi 11,6 mg / dL iken Favipiravir ile kombinasyon halinde kullanıldığında 13,9 mg / dL olmuştur. | Renal tübülde ürik asitin yeniden emilmesi daha da artar. |
Repaglinid | Repaglinidinkandüzeyiartabilirverepaglinid'e | CYP2C8'in |
Favipiravir'in aşağıda belirtilen ilaçlarla birlikte kullanımında dikkatli olunmalıdır
| bağlı advers reaksiyonlar meydana gelebilir. | repaglinid düzeyini arttırır. |
Teofilin | Favipiravir'in kan seviyesi artabilir ve Favipiravir'e bağlı advers reaksiyonlar meydana gelebilir. | Ksantin oksidaz (KO) ile etkileşim Favipiravir'in kan seviyesini arttırabilir. |
Famsiklovir Sulindak | Bu ilaçların etkililiği azalabilir. | Aldehid oksidaz (AO)'ın Favipiravir ile inhibisyonu, bu ilaçların aktif formlarının kan düzeylerini azaltabilir. |
İlaç etkileşimleri:
In vitro: Favipiravir doza ve zamana bağlı bir şekilde geri dönüşü olmayan AO'yu inhibe etmiş ve doza bağlı bir şekilde CYP2C8'i inhibe etmiştir.KO için inhibitör aktivite yoktur ve CYP1A2,2C9,2C19,2D6,2E1 ve 3A4 için zayıf inhibitör aktivite vardır. Hidroksillenmiş metabolit CYP1A2, 2C8, 2C9, 2C19, 2D6, 2E1 ve 3A4'e zayıf inhibitör aktivite göstermiştir.
Favipiravirin CYP üzerindeki indüktif etkisi gözlenmemiştir.
İlaç-ilaç etkileşimi klinik çalışmalar:
Birlikte uygulanan ilaçların favipiravir'in farmakokinetiği üzerine etkileri
Birlikte kullanılan ilaçlar ve dozları |
Favipiravir dozu |
n |
Dozlama aralığı |
Favipiravir için parametre oranı (% 90 | |
C | EAA | ||||
Teofilin 1-9. günler günde iki defa 200mg, 10.gün günde bir defa 200mg |
6.gün günde iki defa 600 mg, 7-10. günler günde bir defa 600 mg |
10 |
6.gün |
1,33ï¼»1,19- 1,48ï¼½ |
1,27ï¼»1,15- 1,40ï¼½ |
7.gün |
1,03ï¼»0,92- 1,15ï¼½ |
1,17ï¼»1,04- 1,31ï¼½ | |||
Oseltamivir 1-5. günler günde iki defa 75mg, 6.Gün günde bir defa 75mg |
5. gün günde iki defa 600 mg, 6. gün günde bir defa 600 mg
|
10
|
6.gün
|
0,98ï¼»0,87- 1,10ï¼½
|
1,01ï¼»0,91- 1,11ï¼½ |
1-3. günler günde bir defa raloksifen 60 mg |
1. gün günde iki defa 1200mg, 2. gün günde iki defa 800mg, 3. gün günde bir defa 800mg |
17 |
1.gün |
1ï¼»0,90- 1,10ï¼½ |
1,03ï¼»0,95- 1,12ï¼½ |
3.gün |
0,90ï¼»0,81- 0,99ï¼½ |
0,85ï¼»0,79- 0,93ï¼½ | |||
Hidralazin 1 ve 5. günler günde bir defa 5 mg |
1. gün 1200mg / 400mg, 2. ila 4.günler günde iki defa 400mg, 5.gün günde bir defa 400mg |
14 |
1.gün |
0,99ï¼»0,92- 1,06ï¼½ |
0,99ï¼»0,92- 1,07 |
5.gün | 0,96ï¼»0,89, 1,04ï¼½ | 1,04ï¼»0,96- 1,12ï¼½ |
(1) Japon olmayan popülasyonun sonuçlarıdır.
Favipiravir'in, birlikte kullanılan ilaçların farmakokinetiği üzerine etkileri
Birlikte kullanılan ilaçlar ve dozları |
Favipiravir dozu |
n |
Dozlama aralığı |
Favipiravir için parametre oranı (% 90 CI) (Birlikte uygulanan / tek uygulanan) | |
C | EAA | ||||
Teofilin 1-9. günler günde iki defa 200 mg, 10.gün günde bir defa 200 mg |
6.gün günde iki defa 600mg, 7- 10. günler günde bir defa 600mg |
10 |
7.gün |
0,93ï¼»0,85- 1,01ï¼½ |
0,92ï¼»0,87- 0,97ï¼½ |
10.gün |
0,99ï¼»0,94- 1,04ï¼½ |
0,97ï¼»0,91- 1,03ï¼½ | |||
Oseltamivir 1-5. günler günde iki defa 75 mg, 6.gün günde bir defa 75 mg |
5. gün günde iki defa 600 mg, 6. gün günde bir defa 600 mg |
10 |
6.gün |
1,10ï¼»1,06- 1,15ï¼½ |
1,14ï¼»1,10- 1,18ï¼½ |
Asetaminofen 1 ve 5.günde günde 1 kez 650 mg | 1. gün günde iki defa 1200 mg, 2. ile 4. gün günde iki defa 800 mg, 5. günde günde bir defa 800 mg |
28 |
1.gün |
1,03ï¼»0,93- 1,14ï¼½ |
1,16ï¼»1,08- 1,25ï¼½ |
5.gün |
1,08ï¼»0,96- 1,22ï¼½ |
1,14ï¼»1,04- 1,26ï¼½ | |||
Noretindron / Etinil Estradiol kombinasyonu 1 ila 5. günler günde bir defa 1 mg / 0,035 mg |
1. gün günde iki defa 1200 mg, 2. ile 4. gün günde iki defa 800 mg, 5. gün günde bir defa 800 mg |
25 |
12.gün |
1.23ï¼»1.16, 1.30ï¼½ |
1.47ï¼»1.42, 1.52ï¼½ |
12.gün | 1,48ï¼»1,42- 1,54ï¼½ | 1,43ï¼»1,39- 1,47ï¼½ | |||
13.gün günde 0,5 mg Repaglinid | 1. gün günde iki defa 1200 mg, 2. ile 4. gün günde iki defa 800 mg, 5. gün günde bir defa 800 mg |
17 |
13.gün |
1,28ï¼»1,16- 1,41ï¼½ |
1,52ï¼»1,37- 1,68ï¼½ |
Hidralazin 1 ve 5. gün günde bir defa 5 mg
| 1. gün 1200mg / 400mg, 2. ila 4.günler günde iki defa 400 mg, 5.gün günde bir defa 400 mg |
14
|
1.gün |
0,73ï¼»0,67- 0,81ï¼½ |
0,87ï¼»0,78- 0,97ï¼½ |
5.gün |
0,79ï¼»0,71- 0,88ï¼½ |
0,91ï¼»0,82- 1,01ï¼½ |
4.6. Gebelik ve laktasyon
Gebelik kategorisi: X
Gebelik durumunda veya gebelik şüphesi olan kadınlarda uygulanmaz.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Favipiravir çocuk doğurma potansiyeli olan kadınlarda uygulanırken, tedaviye başlamadan önce gebelik testi yapılmalı ve negatif gebelik test sonucu doğrulanmalıdır. Hastaya riskler tam olarak açıklanmalı ve tedavi sonunda ve sonrasında 7 gün boyunca partneriyle birlikte en etkili doğum kontrol yöntemlerinin kullanması gerektiği iyice açıklanmalıdır. Tedavi sırasında hamilelikten şüpheleniliyorsa, tedavi derhal bırakılmalı ve hasta, bir doktora danışmalıdır.
Gebelik dönemi
RAVİRAN, hamile olduğu bilinen veya şüphelenilen kadınlara uygulanmamalıdır.
Hayvan çalışmalarında klinik maruziyete benzer veya daha düşük maruziyet düzeylerinde erken embriyonik ölümler (sıçanlar) ve teratojensite (maymun, fare, sıçan ve tavşanlar) gözlenmiştir. (Bkz.Bölüm 5.3)
Favipiravir'in gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açtığından şüphelenilmektedir.
Favipiravir gebelik döneminde kontrendikedir.
Laktasyon dönemi
RAVİRAN, laktasyon döneminde uygulandığında emzirme durdurulmalıdır (Favipiravirin ana metaboliti olan hidroksillenmiş formunun anne sütüne geçtiği bulunmuştur).
Üreme yeteneği/ Fertilite
Favipiravir sperm içerisinde dağılır. İlaç erkek hastalara uygulandığında tüm riskler açıklanmalı ve tedavi sırasında ve tedavi sonlandıktan 7 gün sonrasına kadar cinsel ilişkide en etkili doğum kontrol metotlarının kullanılması gerektiği konusunda derinlemesine bilgi verilmelidir. (erkekler kondom kullanmalıdır.)
Hayvan çalışmalarında sıçanlarda (12 haftalık) ve genç köpeklerde (7 ila 8 aylık) testiste histopatolojik değişiklikler ve farelerde (11 haftalık) anormal sperm bulguları bildirilmiştir. İlaç kesildikten sonra bu çalışmalarda iyileşme veya iyileşme eğilimi gözlenmiştir. (Bkz. Bölüm 5.3)
4.7. Araç ve makine kullanımı üzerindeki etkiler
Favipiravir dahil anti-influenza virüs ajanlarının uygulanmasından sonra anormal davranış gibi psikonörotik semptomlar bildirildiğinden ve bulanık görme yapabileceğinden hastalar araç ve makine kullanma konusundauyarılmalıdır.
4.8. İstenmeyen etkiler
Tüm ilaçlarda olduğu gibi,RAVİRAN'ın içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir
Advers ilaç reaksiyonları aşağıdaki sıklık derecesine göre belirtilmiştir:
Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1000 ila < 1/100); seyrek (≥ 1/10000 ila <1/1000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Favipiravir hiçbir zaman onaylanmış dozaj ile verilmemiştir. Japonya'da yapılan klinik çalışmalarda ve global faz III çalışmasında (onaylanan dozajdan daha düşük doz seviyeleri ile yapılan çalışmalar), güvenlik açısından değerlendirilen 501 hastanın 100'ünde (% 19,96) (anormal laboratuvar test değerleri dahil) advers reaksiyonlar gözlenmiştir. Başlıca advers reaksiyonlar 24 hastada (% 4,79) kan ürik asit seviyesinin yükselmesi, 24 hastada (% 4,79) ishal, 9 hastada (% 1,80) nötrofil sayısında azalma, 9 hastada (%1,80) AST (GOT) artışı, 8 olguda (% 1,60) ALT (GPT) artışı gözlemlenmiştir.
1) Klinik olarak anlamlı advers reaksiyonlar (benzer ilaçlar)
Diğer anti-influenza virüsü ajanları (benzer ilaçlar)ile aşağıdaki klinik olarak anlamlı advers reaksiyonlar bildirilmiştir. Hastalar dikkatle izlenmeli ve herhangi bir anormallik gözlenirse tedavi kesilmeli ve uygun önlemler alınmalıdır.
Kan ve lenf sistemi hastalıkları:
Bilinmiyor: Beyaz kan hücresi sayısında azalma, nötrofil sayısında azalma, trombosit sayısında
azalma
Bağışıklık sistemi hastalıkları:
Bilinmiyor: Şok, anafilaksi
Psikiyatrik hastalıklar:
Bilinmiyor: Nörolojik ve psikiyatrik belirtiler (bilinç bozukluğu, anormal davranış, delirium, halüsinasyon, sanrı, konvülsiyon vb.)
Solunum, göğüs bozuklukları ve mediyastinal hastalıklar:
Bilinmiyor: Zatürre
Gastrointestinal hastalıklar:
Bilinmiyor: Hemorajik kolit
Hepatobiliyer hastalıklar:
Bilinmiyor: Hepatit fulminan, karaciğer fonskiyon bozukluğu, sarılık
Deri ve deri altı doku hastalıkları:
Bilinmiyor: Toksik epidermal nekroliz (TEN), okülomukokutanöz sendrom (Stevens-Johnson
Sendromu)
Böbrek ve idrar yolu hastalıkları:
Bilinmiyor: Akut böbrek hasarı
Aşağıdaki advers reaksiyonlar, Japon klinik çalışmalarında ve küresel faz III klinik çalışmada gözlenen advers reaksiyonlardır (onay dozundan daha düşük doz seviyeleriyle yapılan çalışmalar). Bu advers reaksiyonlar meydana gelirse, semptomlara göre uygun önlemler alınmalıdır.
Kan ve lenf sistemi hastalıkları:
Yaygın: Nötrofil sayısında azalma, beyaz kan hücresi sayısında azalma
Yaygın olmayan: Beyaz kan hücresi sayısında artış, retikülosit sayısında azalma, monosit artışı
Göz hastalıkları:
Yaygın olmayan: Bulanık görme,göz ağrısı
Kulak ve iç kulak hastalıkları:
Yaygın olmayan: Vertigo
Kardiyak hastalıklar:
Yaygın olmayan: Supraventriküler ekstrasistoller
Metabolizma ve beslenme hastalıkları:
Yaygın: Kanda ürik asit artışı, kan trigliserit artışı
Yaygın olmayan: İdrarda glikoz varlığı, kan potasyumunda azalma
Solunum, göğüs bozuklukları ve mediyastinal hastalıklar:
Yaygın olmayan: Astım, orofaringeal ağrı, rinit, nazofarenjit, tonsilde polip
Gastrointestinal hastalıklar:
Yaygın: İshal (%4,79)
Yaygın olmayan: Bulantı, kusma, karın ağrısı, karın rahatsızlığı, duodenum ülseri, hematokezya, gastrit, disguzi
Hepatobiliyer hastalıklar:
Yaygın: AST (GOT) artışı, ALT (GPT) artışı, γ-GTP artışı Yaygın olmayan: Kan ALP artışı, kan bilirubin artışı
Deri ve deri altı doku hastalıkları:
Yaygın olmayan: Pigmentasyon, morarma, döküntü, egzama, kaşıntı
Araştırmalar:
Yaygın olmayan: İdrarda kan, kan CPK düzeylerinde artış
Şüpheli advers reaksiyonların raporlanması
![]()
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem
taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Veri bulunmamaktadır. Aşırı dozda alınması durumunda toksik yan etkilere yol açabilir. Özel bir antidotu olmadığından semptomatik tedavi yapılmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Sistemik kullanım için antiviraller,direkt etkili antiviraller ATC kodu: J05AX27
Etki mekanizması:
Favipiravirin hücre içinde ribosil trifosfat formuna (favipiravir RTP) metabolize olduğu ve favipiravir RTP'nin de influenza viral replikasyonunda bulunan RNA polimerazını seçici olarak inhibe ettiği düşünülmektedir. İnsan DNA polimeraz α, β ve γ'e karşı aktivitesi ile ilgili olarak, favipiravir RTP (1000 µmol/L), α üzerine inhibitör etki göstermemiş, β üzerine %9,1 â 13,5 ve γ üzerine %11,7 â 41,2 inhibitör etki göstermiştir. İnsan RNA polimeraz II üzerine favipiravir RTP'nin inhibitör konsantrasyonu (IC), 905 µmol/L'dir.
Direnç:
Favipiravire karşı tip A infuenza virüsünün duyarlılığında değişiklik, favipiravir varlığında 30 pasajdan sonra görülmemiştir ve dirençli virüsler seçilmemiştir. Global faz III çalışmaları dahil klinik çalışmalarda favipiravir'e dirençli virüslerin belirdiğine dair bilgi elde edilmemiştir.
Klinik çalışmalar:
Japonya dışında yapılan klinik çalışma sonuçları:
A tipi veya B tipi influenza hastalarında plasebo kontrollü bir faz I / II çalışması yapılmıştır (1800 mg / 800 mg BID, 1 gün boyunca günde iki defa favipiravir 1800 mg oral uygulama, ardından 4 gün boyunca günde iki defa 800 mg; 2400 mg / 600 mg TID, 1 gün boyunca 2400 mg
+ 600 mg + 600 mg favipiravir oral uygulaması, ardından 4 gün boyunca günde üç defa 600 mg)*. Primer son nokta** ile ilgili olarak, favipiravir 1800 mg / 800 mg BID (101 hasta), influenza semptomlarının hafifletilmesi için plaseboya (88 hasta) kıyasla önemli bir zaman farkı gösterir (p = 0.01, Gehan-Wilcoxon testi), ancak favipiravir 2400 mg / 600 mg TID (82 hasta) anlamlı fark gösterememiştir (p = 0.414, Gehan-Wilcoxon testi).
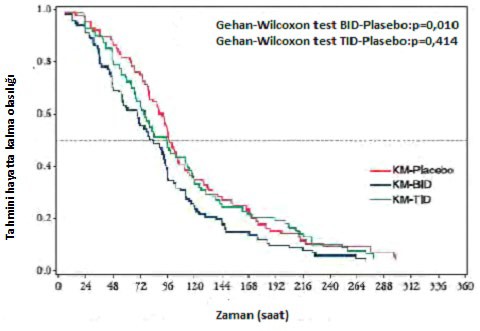
Şekil 1. İnfluenza semptomlarının hafifleme zamanı
Favipiravirin onaylanmış dozu, 1 gün boyunca günde iki defa oral olarak 1600 mg, takiben 4 gün boyunca günde iki defa oral olarak 600 mg'dır.
** 6 primer influenza semptomunu (öksürük, boğaz ağrısı, baş ağrısı, burun tıkanıklığı, vücut ağrıları, genel ağrılar, yorgunluk [yorgunluk] ve vücut sıcaklığı) hafifletmek için gereken süre.
A tipi veya B tipi influenza hastalarında iki plasebo kontrollü faz III çalışması (1 gün boyunca günde iki defa favipiravir 1800 mg oral uygulama, ardından birincil sonlanım noktası ile 4 gün boyunca günde iki defa 800 mg [1800 mg / 800 mg BID]* primer influenza semptomlarını** hafifletmek için gerekli (Çalışma 1 ve Çalışma 2) sonuçlar aşağıdaki gibidir.
Primer analiz sonuçları (ITTI Popülasyonu)
| Çalışma 1 | Çalışma 2 | ||
| Favipiravir (N=301) | Plasebo (N=322) | Favipiravir (N=301) | Plasebo (N=322) |
Vaka sayısı | 288 | 306 | 505 | 163 |
Ortalama ï¼»% 95 CIï¼½ (saatler) | 84,2ï¼»77,1, 95,7ï¼½ | 98,6ï¼»94,6, 107,1 | 77,8ï¼»72,3, 82,5ï¼½ | 83,9ï¼»76, 95,5ï¼½ |
p-değeri | 0.004 | 0.303 | ||
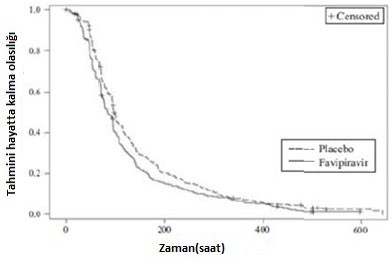
Şekil 2. Primer uç noktaya göre Kaplan-Meier Grafiği (ITTI, Çalışma 1)
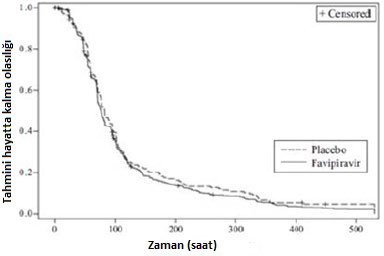
Şekil 3. Primer uç noktaya göre Kaplan-Meier Grafiği (ITTI, Çalışma 2)
5.2. Farmakokinetik özellikler
Emilim
Aşağıda tabloda belirtildiği üzere, 8 sağlıklı yetişkinde 1 gün boyunca günde 2 defa 1600 mg, daha sonra 4 gün boyunca günde 2 defa 600 mg, ardından 1 gün boyunca günde 1 defa 600 mg (1600 mg/ 600 mg BID) oral uygulamadan sonra favipiravir'in farmakokinetik parametreleri belirlenmiştir.
Dozaj |
| C(μg/mL) | EAA(μg・s/mL) | T(s) | T(s) |
1600 mg/ 600 mg BID | 1.Gün | 64,56 (17,2) | 446,09 (28,1) | 1,5 (0,75- 4) | 4,8±1,1 |
6.Gün | 64,69 (24,1) | 553,98 (31,2) | 1,5 (0,75- 2) | 5,6±2,3 |
1 Geometrik ortalama(%CV)
2 Gün 1: EAA 0-â, Gün 6:EAA 0-t
3 Medyan (min,maks)
4 ortalama±SS
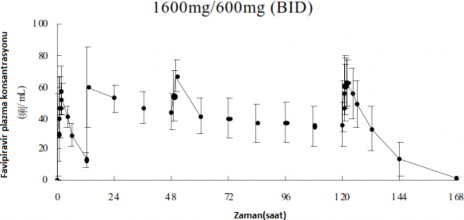
Şekil 4. Favipiravir'in plazma konsantrasyonunun zaman akışı (ortalama ± SD)
AO (aldehid oksidaz) aktivitesi az görünen sağlıklı bir yetişkine 7 gün boyunca favipiravirin çoklu oral uygulamasını takiben, değişmemiş *ilacın tahmini EAA değeri 1. günde 1452,73 μg.hr / mL ve 7. günde 1324,09 μg.hr / mL'dir.
*1.Gün 1200 mg+400 mg,2-6.Günler günde 2 kez 400 mg ve 7. Gün günde tek doz 400 mg. Favipiravir onaylı dozu 1 gün boyunca günde iki kez 1600 mg, ardından 4 gün boyunca günde iki kez 600 mg'dır.
Dağılım
Japon olmayanlarda sonuçlar;
Favipiravir 20 sağlıklı yetişkin erkek deneğe 1 gün boyunca günde iki defa 1200 mg ve ardından 4 gün boyunca günde iki defa 800 mg (1200 mg / 800 mg BID) oral yoldan uygulandığında, semendeki ilacın geometrik ortalama konsantrasyonu 18.341 μg / mL 3. günde ve tedaviden sonraki ikinci günde 0,053 μg / mL. Sperm seviyeleri tedavinin bitiminden sonraki
7 gün içinde tüm deneklerde nicelik sınırının (0,02 μg / mL) altına düştü. Spermada ilaç konsantrasyonunun plazmadakine ortalama oranı 3. günde 0,53 ve tedaviden sonraki ikinci günde 0,45'dir.
Serum protein bağlanma oranı 0,3 ila 30 μg / mL'de %53,4 ila 54,4 (in vitro, santrifüj ultrafiltrasyon).
Hayvan deneylerinde;
Maymunlara oral olarak tek bir C-favipiravir dozu verildiğinde, dokularda geniş bir şekilde dağılmıştır. Her dokunun radyoaktivitesi, uygulamadan 0,5 saat sonra zirve yaptı ve plazmada radyoaktiviteye paralel olarak değiştirdiği görülmüştür. Akciğer dokularındaki radyoaktivitenin, plazmadakine oranı uygulamadan 0,5 saat sonra 0,51'dir ve ilaç hızla enfeksiyon bölgesi olarak kabul edilen solunum dokularına dağılmıştır. Böbrek radyoaktivitesi 2,66 oranıyla plazmadan daha yüksektir. Kemikler hariç her dokudaki radyoaktivite, uygulamadan sonraki 24 saat içinde zirvenin % 2,8'ine düşmüştür.
Biyotransformasyon:
Favipiravir sitokrom P-450 (CYP) ile metabolize edilmemiş, çoğunlukla aldehid oksidaz (AO) ile metabolize edilmiş ve kısmen ksantin oksidaz (XO) ile hidroksillenmiş bir formda metabolize edilmiştir. İnsan karaciğer mikrozomlarının kullanıldığı çalışmalarda, hidroksilat oluşumu 3,98 ila 47,6 pmol / mg protein / dakika arasında değişmekte ve AO aktivitesinin maksimum 12 defa bireysel olarak değişmesi gerçekleşmiştir.Hidroksilatlıformdan başka bir metabolit olarak insan
Eliminasyon:
Favipiravir esas olarak idrar ile hidroksillenmiş bir form olarak atılmıştır ve az miktarda değişmemiş ilaç gözlenmiştir. 6 sağlıklı yetişkinle yapılan 7 günlük oral çoklu doz çalışmasında, değişmemiş ilacın ve hidroksile formun kümülatif idrar atılım oranı, son uygulamadan sonraki 48 saat boyunca sırasıyla% 0,8 ve% 53,1'dir.**
** 1.günde 1200 mg+400 mg,daha sonra 2.ve 6. günlerde günde iki kez 400 mg,ardından
7.günde günde bir kez 400 mg. Onaylanmış favipiravir dozu, ââ1 gün boyunca günde iki kez
1600 mg oral,ardından 4 gün boyunca günde iki kez 60 mg oraldır''.
Doğrusallık /Doğrusal olmayan durum:
Bilgi bulunmamaktadır.
Hastalardaki karekteristik özellikler Karaciğer yetmezliği olan hastalar:
Hepatik olan hastalarda AST (GOT) ve ALT (GPT) seviyesini yükseltebileceğinden dolayı hastalar yakından izlenmelidir. Favipiravir, hafif ve orta derecede karaciğer fonksiyon bozukluğu olan (Child-Pugh sınıflaması A ve B, her biri 6 hasta) 1 gün boyunca günde iki defa 1200 mg, ardından 4 gün boyunca günde iki defa 800 mg (1200 mg / 800 mg) hastalara oral olarak uygulandığında sağlıklı yetişkin deneklerle karşılaştırıldığında, 5. günde Cve EAA hafif karaciğer fonksiyon bozukluğu olanlarda sırasıyla 1.6 kat ve 1.7 kat, orta derecede karaciğer fonksiyon bozukluğu olanlarda sırasıyla 1.4 kat ve 1.8 kat olmuştur. Favipiravir şiddetli karaciğer fonksiyon bozukluğu olan (Child-Pugh sınıflaması C, 4 denek) 1 gün boyunca günde iki defa 800 mg ardından 2 gün boyunca günde iki defa 400 mg (800 mg / 400 mg BID) oral yoldan verildiğinde, sağlıklı yetişkin denekler, 3. günde Cve EAA sırasıyla yaklaşık 2.1 kat ve 6.3 kat olmuştur.
Onaylanmış favipiravir dozu, ââ1 gün boyunca günde iki kez 1600 mg oral, ardından 4 gün boyunca günde iki kez 600 mg oraldır''.
5.3. Klinik öncesi güvenlilik verileri
Hayvan modellerinde terapötik etki
İnfulenza vrüsleri A (H7N9), A (H1N1), pdm09 veya A (H3N2) ile aşılanan fare enfeksiyonu modellerinde, 5 günlük oral ≤60 mg/kg/gün dozda favipiravir uygulamasıyla akciğer dokularında virüs titrelerinde azalma gözlenmiştir.
İnfluenza virüsleri A (H3N2) veya A (H5N1) ile aşılanan fare enfeksiyonu modellerinde, 5 günlük oral 30 g/kg/gün dozda favipiravir uygulamasıyla terapötik etki gözlenmiştir.
İnfluenza virüsü A (H3N2) ile aşılanan SCID fare enfeksiyon modelinde, terapötik etki, 14
günlük oral 30 mg/kg/gün dozda favipiravir uygulamasıyla gözlenmiştir.
Hayvan çalışmalarında klinik maruziyete benzer veya daha düşük maruziyet düzeylerinde erken embriyonik ölümler (sıçanlar) teratojensite (maymun, fare, sıçan ve tavşanlar) gözlenmiştir.
Jüvenil köpeklerde (8 haftalık) yapılan 1 aylık çalışmada letal dozdan daha düşük dozda (60 mg/kg/gün) verilmesinden 20 gün sonra ölüm vakaları gözlenmiştir. Jüvenil hayvanlarda (6 günlük ratlar ve 8 haftalık köpeklerde) anormal yürüyüş, iskelet sistemi kas liflerinde atrofi ve papiller kaslarda dejenerasyon/nekroz/mineralizasyon bildirilmiştir.
Hayvan çalışmalarında, sıçanlarda (12 haftalık) ve genç köpeklerde (7 ila 8 aylık) testiste histopatolojik değişiklikler ve farelerde (11 haftalık) anormal sperm bulguları bildirilmiştir. İlaç kesildikten sonra bu çalışmalarda iyileşme veya iyileşme eğilimi gözlenmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Povidon K-17
Kolloidal Silikon Dioksit Hidroksipropil Selüloz Krospovidon
Sodyum Stearil Fumarat
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
9 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
40 film kaplı tablet içeren PVC/PE/PVDC/Aluminyum blister ambalajlarda kullanıma
sunulmuştur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikâ'lerine uygun olarak imha edilmelidir.
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Koçak Farma İlaç ve Kimya Sanayi A.Ş.
| Satış Fiyatı | 2539.06 TL [ 28 Jun 2024 ] |
| Önceki Satış Fiyatı | 2539.06 TL [ 14 Jun 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699828091448 |
| Etkin Madde | Favipiravir |
| Yerli ve Beşeri bir ilaçdır. |