RAVIRAN 200 mg film kaplı tablet (40 tablet) Farmakolojik Özellikler
{ Favipiravir }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Sistemik kullanım için antiviraller,direkt etkili antiviraller ATC kodu: J05AX27
Etki mekanizması:
Favipiravirin hücre içinde ribosil trifosfat formuna (favipiravir RTP) metabolize olduğu ve favipiravir RTP'nin de influenza viral replikasyonunda bulunan RNA polimerazını seçici olarak inhibe ettiği düşünülmektedir. İnsan DNA polimeraz α, β ve γ'e karşı aktivitesi ile ilgili olarak, favipiravir RTP (1000 µmol/L), α üzerine inhibitör etki göstermemiş, β üzerine %9,1 â 13,5 ve γ üzerine %11,7 â 41,2 inhibitör etki göstermiştir. İnsan RNA polimeraz II üzerine favipiravir RTP'nin inhibitör konsantrasyonu (IC), 905 µmol/L'dir.
Direnç:
Favipiravire karşı tip A infuenza virüsünün duyarlılığında değişiklik, favipiravir varlığında 30 pasajdan sonra görülmemiştir ve dirençli virüsler seçilmemiştir. Global faz III çalışmaları dahil klinik çalışmalarda favipiravir'e dirençli virüslerin belirdiğine dair bilgi elde edilmemiştir.
Klinik çalışmalar:
Japonya dışında yapılan klinik çalışma sonuçları:
A tipi veya B tipi influenza hastalarında plasebo kontrollü bir faz I / II çalışması yapılmıştır (1800 mg / 800 mg BID, 1 gün boyunca günde iki defa favipiravir 1800 mg oral uygulama, ardından 4 gün boyunca günde iki defa 800 mg; 2400 mg / 600 mg TID, 1 gün boyunca 2400 mg
+ 600 mg + 600 mg favipiravir oral uygulaması, ardından 4 gün boyunca günde üç defa 600 mg)*. Primer son nokta** ile ilgili olarak, favipiravir 1800 mg / 800 mg BID (101 hasta), influenza semptomlarının hafifletilmesi için plaseboya (88 hasta) kıyasla önemli bir zaman farkı gösterir (p = 0.01, Gehan-Wilcoxon testi), ancak favipiravir 2400 mg / 600 mg TID (82 hasta) anlamlı fark gösterememiştir (p = 0.414, Gehan-Wilcoxon testi).
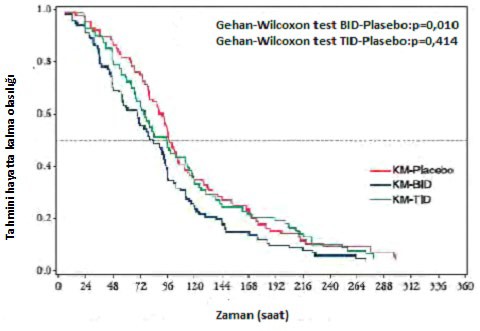
Şekil 1. İnfluenza semptomlarının hafifleme zamanı
Favipiravirin onaylanmış dozu, 1 gün boyunca günde iki defa oral olarak 1600 mg, takiben 4 gün boyunca günde iki defa oral olarak 600 mg'dır.
** 6 primer influenza semptomunu (öksürük, boğaz ağrısı, baş ağrısı, burun tıkanıklığı, vücut ağrıları, genel ağrılar, yorgunluk [yorgunluk] ve vücut sıcaklığı) hafifletmek için gereken süre.
A tipi veya B tipi influenza hastalarında iki plasebo kontrollü faz III çalışması (1 gün boyunca günde iki defa favipiravir 1800 mg oral uygulama, ardından birincil sonlanım noktası ile 4 gün boyunca günde iki defa 800 mg [1800 mg / 800 mg BID]* primer influenza semptomlarını** hafifletmek için gerekli (Çalışma 1 ve Çalışma 2) sonuçlar aşağıdaki gibidir.
Primer analiz sonuçları (ITTI Popülasyonu)
| Çalışma 1 | Çalışma 2 | ||
| Favipiravir (N=301) | Plasebo (N=322) | Favipiravir (N=301) | Plasebo (N=322) |
Vaka sayısı | 288 | 306 | 505 | 163 |
Ortalama ï¼»% 95 CIï¼½ (saatler) | 84,2ï¼»77,1, 95,7ï¼½ | 98,6ï¼»94,6, 107,1 | 77,8ï¼»72,3, 82,5ï¼½ | 83,9ï¼»76, 95,5ï¼½ |
p-değeri | 0.004 | 0.303 | ||
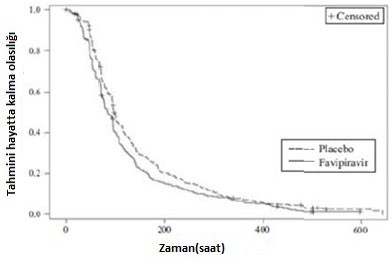
Şekil 2. Primer uç noktaya göre Kaplan-Meier Grafiği (ITTI, Çalışma 1)
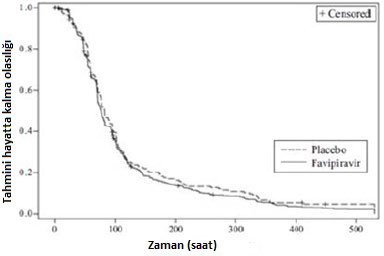
Şekil 3. Primer uç noktaya göre Kaplan-Meier Grafiği (ITTI, Çalışma 2)
5.2. Farmakokinetik özellikler
Emilim
Aşağıda tabloda belirtildiği üzere, 8 sağlıklı yetişkinde 1 gün boyunca günde 2 defa 1600 mg, daha sonra 4 gün boyunca günde 2 defa 600 mg, ardından 1 gün boyunca günde 1 defa 600 mg (1600 mg/ 600 mg BID) oral uygulamadan sonra favipiravir'in farmakokinetik parametreleri belirlenmiştir.
Dozaj |
| C(μg/mL) | EAA(μg・s/mL) | T(s) | T(s) |
1600 mg/ 600 mg BID | 1.Gün | 64,56 (17,2) | 446,09 (28,1) | 1,5 (0,75- 4) | 4,8±1,1 |
6.Gün | 64,69 (24,1) | 553,98 (31,2) | 1,5 (0,75- 2) | 5,6±2,3 |
1 Geometrik ortalama(%CV)
2 Gün 1: EAA 0-â, Gün 6:EAA 0-t
3 Medyan (min,maks)
4 ortalama±SS
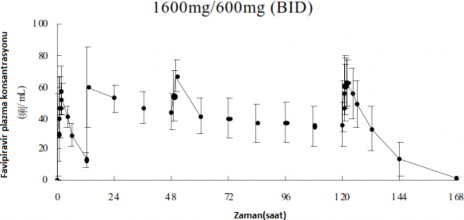
Şekil 4. Favipiravir'in plazma konsantrasyonunun zaman akışı (ortalama ± SD)
AO (aldehid oksidaz) aktivitesi az görünen sağlıklı bir yetişkine 7 gün boyunca favipiravirin çoklu oral uygulamasını takiben, değişmemiş *ilacın tahmini EAA değeri 1. günde 1452,73 μg.hr / mL ve 7. günde 1324,09 μg.hr / mL'dir.
*1.Gün 1200 mg+400 mg,2-6.Günler günde 2 kez 400 mg ve 7. Gün günde tek doz 400 mg. Favipiravir onaylı dozu 1 gün boyunca günde iki kez 1600 mg, ardından 4 gün boyunca günde iki kez 600 mg'dır.
Dağılım
Japon olmayanlarda sonuçlar;
Favipiravir 20 sağlıklı yetişkin erkek deneğe 1 gün boyunca günde iki defa 1200 mg ve ardından 4 gün boyunca günde iki defa 800 mg (1200 mg / 800 mg BID) oral yoldan uygulandığında, semendeki ilacın geometrik ortalama konsantrasyonu 18.341 μg / mL 3. günde ve tedaviden sonraki ikinci günde 0,053 μg / mL. Sperm seviyeleri tedavinin bitiminden sonraki
7 gün içinde tüm deneklerde nicelik sınırının (0,02 μg / mL) altına düştü. Spermada ilaç konsantrasyonunun plazmadakine ortalama oranı 3. günde 0,53 ve tedaviden sonraki ikinci günde 0,45'dir.
Serum protein bağlanma oranı 0,3 ila 30 μg / mL'de %53,4 ila 54,4 (in vitro, santrifüj ultrafiltrasyon).
Hayvan deneylerinde;
Maymunlara oral olarak tek bir C-favipiravir dozu verildiğinde, dokularda geniş bir şekilde dağılmıştır. Her dokunun radyoaktivitesi, uygulamadan 0,5 saat sonra zirve yaptı ve plazmada radyoaktiviteye paralel olarak değiştirdiği görülmüştür. Akciğer dokularındaki radyoaktivitenin, plazmadakine oranı uygulamadan 0,5 saat sonra 0,51'dir ve ilaç hızla enfeksiyon bölgesi olarak kabul edilen solunum dokularına dağılmıştır. Böbrek radyoaktivitesi 2,66 oranıyla plazmadan daha yüksektir. Kemikler hariç her dokudaki radyoaktivite, uygulamadan sonraki 24 saat içinde zirvenin % 2,8'ine düşmüştür.
Biyotransformasyon:
Favipiravir sitokrom P-450 (CYP) ile metabolize edilmemiş, çoğunlukla aldehid oksidaz (AO) ile metabolize edilmiş ve kısmen ksantin oksidaz (XO) ile hidroksillenmiş bir formda metabolize edilmiştir. İnsan karaciğer mikrozomlarının kullanıldığı çalışmalarda, hidroksilat oluşumu 3,98 ila 47,6 pmol / mg protein / dakika arasında değişmekte ve AO aktivitesinin maksimum 12 defa bireysel olarak değişmesi gerçekleşmiştir.Hidroksilatlıformdan başka bir metabolit olarak insan
Eliminasyon:
Favipiravir esas olarak idrar ile hidroksillenmiş bir form olarak atılmıştır ve az miktarda değişmemiş ilaç gözlenmiştir. 6 sağlıklı yetişkinle yapılan 7 günlük oral çoklu doz çalışmasında, değişmemiş ilacın ve hidroksile formun kümülatif idrar atılım oranı, son uygulamadan sonraki 48 saat boyunca sırasıyla% 0,8 ve% 53,1'dir.**
** 1.günde 1200 mg+400 mg,daha sonra 2.ve 6. günlerde günde iki kez 400 mg,ardından
7.günde günde bir kez 400 mg. Onaylanmış favipiravir dozu, ââ1 gün boyunca günde iki kez
1600 mg oral,ardından 4 gün boyunca günde iki kez 60 mg oraldır''.
Doğrusallık /Doğrusal olmayan durum:
Bilgi bulunmamaktadır.
Hastalardaki karekteristik özellikler Karaciğer yetmezliği olan hastalar:
Hepatik olan hastalarda AST (GOT) ve ALT (GPT) seviyesini yükseltebileceğinden dolayı hastalar yakından izlenmelidir. Favipiravir, hafif ve orta derecede karaciğer fonksiyon bozukluğu olan (Child-Pugh sınıflaması A ve B, her biri 6 hasta) 1 gün boyunca günde iki defa 1200 mg, ardından 4 gün boyunca günde iki defa 800 mg (1200 mg / 800 mg) hastalara oral olarak uygulandığında sağlıklı yetişkin deneklerle karşılaştırıldığında, 5. günde Cve EAA hafif karaciğer fonksiyon bozukluğu olanlarda sırasıyla 1.6 kat ve 1.7 kat, orta derecede karaciğer fonksiyon bozukluğu olanlarda sırasıyla 1.4 kat ve 1.8 kat olmuştur. Favipiravir şiddetli karaciğer fonksiyon bozukluğu olan (Child-Pugh sınıflaması C, 4 denek) 1 gün boyunca günde iki defa 800 mg ardından 2 gün boyunca günde iki defa 400 mg (800 mg / 400 mg BID) oral yoldan verildiğinde, sağlıklı yetişkin denekler, 3. günde Cve EAA sırasıyla yaklaşık 2.1 kat ve 6.3 kat olmuştur.
Onaylanmış favipiravir dozu, ââ1 gün boyunca günde iki kez 1600 mg oral, ardından 4 gün boyunca günde iki kez 600 mg oraldır''.
5.3. Klinik öncesi güvenlilik verileri
Hayvan modellerinde terapötik etki
İnfulenza vrüsleri A (H7N9), A (H1N1), pdm09 veya A (H3N2) ile aşılanan fare enfeksiyonu modellerinde, 5 günlük oral ≤60 mg/kg/gün dozda favipiravir uygulamasıyla akciğer dokularında virüs titrelerinde azalma gözlenmiştir.
İnfluenza virüsleri A (H3N2) veya A (H5N1) ile aşılanan fare enfeksiyonu modellerinde, 5 günlük oral 30 g/kg/gün dozda favipiravir uygulamasıyla terapötik etki gözlenmiştir.
İnfluenza virüsü A (H3N2) ile aşılanan SCID fare enfeksiyon modelinde, terapötik etki, 14
günlük oral 30 mg/kg/gün dozda favipiravir uygulamasıyla gözlenmiştir.
Hayvan çalışmalarında klinik maruziyete benzer veya daha düşük maruziyet düzeylerinde erken embriyonik ölümler (sıçanlar) teratojensite (maymun, fare, sıçan ve tavşanlar) gözlenmiştir.
Jüvenil köpeklerde (8 haftalık) yapılan 1 aylık çalışmada letal dozdan daha düşük dozda (60 mg/kg/gün) verilmesinden 20 gün sonra ölüm vakaları gözlenmiştir. Jüvenil hayvanlarda (6 günlük ratlar ve 8 haftalık köpeklerde) anormal yürüyüş, iskelet sistemi kas liflerinde atrofi ve papiller kaslarda dejenerasyon/nekroz/mineralizasyon bildirilmiştir.
Hayvan çalışmalarında, sıçanlarda (12 haftalık) ve genç köpeklerde (7 ila 8 aylık) testiste histopatolojik değişiklikler ve farelerde (11 haftalık) anormal sperm bulguları bildirilmiştir. İlaç kesildikten sonra bu çalışmalarda iyileşme veya iyileşme eğilimi gözlenmiştir.
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ GENEL BİLGİLERİ
Koçak Farma İlaç ve Kimya Sanayi A.Ş.
| Satış Fiyatı | 2539.06 TL [ 28 Jun 2024 ] |
| Önceki Satış Fiyatı | 2539.06 TL [ 14 Jun 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699828091448 |
| Etkin Madde | Favipiravir |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |