REAMPLA 100 mg kapsül (21 kapsül) Kısa Ürün Bilgisi
{ Palbosiklib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
REAMPLA 100 mg kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Palbosiklib 100 mg
Yardımcı maddeler
Laktoz monohidrat (sığır kaynaklı) 74,367 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Kapsül.
1 boyutunda, opak, açık turuncu gövdesi ve karamel kapağı olan, kapak üzerinde beyaz mürekkep ile âPfizerâ ve gövde üzerinde âPBC 100â yazılı sert jelatin kapsül.
Adjuvan aromataz inhibitörü alırken ilk 12 ay içinde relaps görülen hastalarda
kullanılamaz.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
REAMPLA, Hormon Reseptörü (HR) pozitif, insan epidermal büyüme faktörü 2 (HER2) negatif pre/peri/postmenopozal metastatik meme kanseri olan, adjuvan tedavinin tamamlanmasından 12 ay sonra relaps yapmış ya da ileri evre meme kanseri için daha önce hiçbir endokrin tedavi almamış hastalarda letrozol ile kombine olarak kullanılır.
REAMPLA, Östrojen reseptörü (ER) en az %10 pozitif ve HER2 (-) olan pre/peri/postmenopozal metastatik meme kanserli daha önce fulvestrant kullanmamış hastalarda:
Metastatik hastalık tedavisi için bir sıra ve en az 6 ay aromataz inhibitörü alırken klinik ve/veya radyolojik hastalık progesyonu görülenlerde fulvestrant ile birlikte kullanılır.
Adjuvan aromataz inhibitörü tedavisini en az 12 ay süreyle kullandıktan sonra ya da adjuvan aromataz inhibitörü tedavisi tamamlandıktan sonraki 12 ay içinde nüks/metastaz gelişen hastalarda fulvestrant ile birlikte kullanılır.
Metastatik hastalık nedeniyle bir sıradan daha fazla aromataz inhibitörü tedavisi almış olan hastalarda kullanılamaz.
Pre/perimenopozal kadınlarda endokrin tedavisi, luteinize edici hormon salgılatıcı hormon (LHRH) agonisti ile birleştirilmelidir.
4.2. Pozoloji ve uygulama şekli
REAMPLA tedavisi kanser ilaçlarının kullanımında deneyimli bir doktorun gözetimi altında başlanmalı ve sürdürülmelidir.
REAMPLA için önerilen doz günde bir kez oral yolla alınan 125 mg kapsüldür. Tedavi, 21 gün boyunca ilaç kullanımı ve takip eden 7 gün ilaca ara verilmesi suretiyle toplam 28 günlük sikluslardan oluşur. REAMPLA ile tedaviye, hasta tedaviden klinik fayda sağladığı sürece veya kabul edilemez toksisite meydana gene kadar devam edilmelidir.
Palbosiklib ile kullanıldığında letrozol kendi KÜB'ünde belirtilen doz şeması doğrultusunda uygulanmalıdır. Pre/perimenopozal kadınlarda palbosiklib ile letrozol kombinasyonu tedavisi her zaman bir LHRH agonisti ile birlikte uygulanmalıdır.
REAMPLA letrozol ile birlikte kullanılırken letrozolün önerilen dozu 28 günlük siklus boyunca
oral yoldan günde 2,5 mg'dır.
REAMPLA fulvestrant ile birlikte kullanılırken fulvestrant için önerilen doz 500 mg'dır. Önerilen fulverstrant dozu intramusküler yoldan 1., 15., ve 29. günlerde ve daha sonra ayda bir alınmalıdır. Fulvestrant kullanımına ilişkin detaylı bilgi için fulvestrant içeren ürünlerin kısa ürün bilgisine başvurulmalıdır. Palbosiklib ile birlikte fulvestrant tedavisine başlamadan önce ve tedavi süresi boyunca, pre/perimenopozal kadınlar yerel klinik uygulamaya göre LHRH agonistleri ile tedavi edilmelidir.
Uygulama şekli
REAMPLA oral kullanım içindir. Yiyeceklerle alınmalıdır (tutarlı palbosiklib maruziyetini sağlamak için tercihen bir öğün ile) (bkz. Bölüm 5.2). Palbosiklib greyfurt veya greyfurt suyu ile alınmamalıdır (bkz. Bölüm 4.5).
Doktor tarafından aksi belirtilmedikçe, hastalar REAMPLA'yı hergün aynı saatte almaları konusunda teşvik edilmelidir. Hasta kusarsa veya herhangi bir dozu atlarsa o gün başka bir doz uygulanmamalıdır. Bir sonraki doz vaktinde alınmalıdır.
Kapsüller bütün olarak yutulmalıdır. Hastalar kapsülleri ezmemeli, çözündürmemeli veya açmamalıdır. Kapsüller kırılmış, çatlamış veya bir şekilde bütünlüğü bozulmuş ise kullanılmamalıdır.
Doz ayarlamaları
Bireysel güvenlilik ve tolere edilebilirliğe bağlı olarak REAMPLA için doz ayarlaması
önerilmektedir.
Bazı advers reaksiyonların yönetimi tablo 1, 2 ve 3'te verilen doz azaltma programları doğrultusunda; geçici doz kesintileri/gecikmeleri ve/veya doz azaltmalarını veya dozun tamamen kesilmesini gerektirebilir (bkz. Bölüm 4.4 ve 4.8).
Tablo 1. Advers reaksiyonlar için önerilen doz ayarlamaları
Doz düzeyi | Doz |
Önerilen başlangıç dozu | 125 mg/gün |
İlk doz azaltılması | 100 mg/gün |
İkinci doz azaltılması | 75 mg/gün* |
* Dozun 75 mg/gün altına düşürülmesi gerekiyorsa tedavi kesilmelidir.
Tam kan sayımı REAMPLA tedavisine başlamadan önce, her siklus öncesi, ayrıca ilk iki siklusun 15. gününde ve klinik olarak gerekli olduğu durumlarda yapılmalıdır.
İlk 6 siklus boyunca en fazla Derece 1 ya da 2 nötropeni gelişen hastalarda, sonraki sikluslar için tam kan sayımı her 3 ayda bir, siklus öncesi ve klinik olarak gerekli olduğu durumlarda yapılmalıdır.
REAMPLA kullanmak için mutlak nötrofil sayısının (MNS) ≥1000/mm ve trombosit sayısının
≥50 000/mm olması önerilir.
Tablo 2. Doz ayarlaması ve Yönetimi - Hematolojik toksisite
CTCAE Derecesi | Doz Ayarlaması |
Derece 1 veya 2 | Doz ayarlaması gerekmemektedir. |
Derece 3 | Siklusun 1. günü Derece ≤2'ye iyileşme olana kadar REAMPLA tedavisine ara verilmelidir ve tam kan sayımı 1 hafta içinde tekrarlanmalıdır. Derece ≤2'ye iyileşme olduktan sonra bir sonraki siklus aynı dozdan başlatılmalıdır.
İlk iki siklusun 15. günü 15. günde Derece 3 ise siklusu tamamlamak için REAMPLA'ya var olan dozdan devam edilmelidir ve tam kan sayımı 22. günde tekrar edilmelidir. 22. günde Derece 4 ise aşağıdaki Derece 4 doz ayarlamaları bölümüne bakılmalıdır.
Derece 3 nötropenide uzamış iyileşme varsa (>1 hafta) veya takip eden siklusun 1. gününde rekürren Derece 3 nötropeni görülüyorsa doz azaltma düşünülmelidir. |
Derece 3 nötropeni (<1.000- 500/mm) + Ateş ≥ 38,5C ve /veya enfeksiyon | Herhangi bir anda Derece ≤2'ye iyileşme olana kadar REAMPLA'ya ara verilmelidir. Ardından bir sonraki düşük doz ile devam edilmelidir. |
Derece 4 | Herhangi bir anda Derece≤2'ye iyileşme olana kadar REAMPLA'ya ara verilmelidir. Ardından bir sonraki düşük doz ile devam edilmelidir. |
Derecelendirme CTCAE versiyon 4.0'e göre yapılmıştır.
MNS = Mutlak Nötrofil Sayısı, CTCAE= Advers Olaylar için Ortak Terminoloji Kriteri, NAL:
Normalin Alt Limiti
ile ilgili olmadığı durumlarda örn. fırsatçı enfeksiyonlar).
Tablo 3. Doz ayarlaması ve Yönetimi - Hematolojik Olmayan Toksisiteler
CTCAE Derecesi | Doz Ayarlaması |
Derece 1 veya 2 | Doz ayarlaması gerekmemektedir. |
Derece ≥3 hematolojik olmayan toksisite (medikal tedaviye rağmen devam ediyorsa) | Aşağıdaki durumlara iyileşme olana kadar beklenmelidir Ardından bir sonraki düşük doz ile devam edilmelidir. |
Derece ≤1
Derece ≤2 (hasta için güvenlilik riski olarak değerlendirilmezse)
Derecelendirme CTCAE versiyon 4.0'e göre yapılmıştır.
CTCAE= Advers Olaylar için ortak terminoloji kriteri
Ciddi interstisyel akciğer hastalığı (İAH)/pnömonit gözlenen olgularda REAMPLA kullanımı kalıcı olarak durdurulmalıdır (bkz. Bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler:
Karaciğer yetmezliği:
Hafif veya orta karaciğer yetmezliği olan hastalar (Child-Pugh sınıf A ve B) için REAMPLA doz ayarlaması gerekli değildir.
Ciddi karaciğer yetmezliği olan hastalar için (Child-Pugh sınıf C) önerilen REAMPLA dozu, Doz Şeması 3/1'de gösterildiği şekilde günde bir kez 75 mg'dır (bkz. Bölümler 4.4 ve 5.2).
Böbrek yetmezliği:
Hafif, orta veya ciddi böbrek yetmezliği olan hastalar (CrCl ≥15 mL/dak) için REAMPLA doz ayarlaması gerekli değildir. Hemodiyaliz gereken hastalarda mevcut veriler, bu popülasyonda herhangi bir doz ayarlaması önerisi yapmak için yetersizdir (bkz. Bölümler 4.4 ve 5.2).
Pediyatrik popülasyon:
REAMPLA'nın çocuklar ve 18 yaş altı ergenlerde güvenliliği ve etkililiği çalışılmamıştır. Herhangi bir veri mevcut değildir.
Geriyatrik popülasyon:
65 yaş ve üstü hastalarda REAMPLA doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
Bileşimindeki maddelerden herhangi birine karşı aşırı duyarlılığı bulunan kimselerde kullanılmamalıdır (bkz. Bölüm 6.1).
Sarı kantaron otu ile birlikte kullanımı kontrendikedir (bkz. Bölüm 4.5).
4.4. Özel kullanım uyarıları ve önlemleri
Premenopozal/perimenopozal kadınlar
Aromataz inhibitörlerinin etki mekanizması nedeniyle premenopozal/perimenopozal kadınlarda REAMPLA bir aromataz inhibitörü ile birlikte verildiğinde ovaryan ablasyon ya da bir LHRH agonisti ile baskılanması zorunludur. Palbosiklibin premenopozal/perimenopozal kadınlarda fulvestrant ile birlikte kullanılması yalnızca bir LHRH agonisti ile kombine edilerek araştırılmıştır.
İnterstisyel Akciğer Hastalığı (İAH)/Pnömonit
REAMPLA ile tedavi edilen hastalarda endokrin tedavisiyle birlikte alındığında ciddi, yaşamı
tehdit eden veya ölümcül interstisyel akciğer hastalığı (İAH) ve/veya pnömonit oluşabilir.
Klinik çalışmalarda (PALOMA-1, PALOMA-2, PALOMA-3), REAMPLA tedavisi alan hastaların %1,4'ünde herhangi bir dereceden İAH/Pnömonit, %0,1'inde Derece 3 İAH/Pnömonit olduğu saptanmış olup, Derece 4 İAH/Pnömonit veya herhangi bir ölüm vakası bildirilmemiştir. Ruhsatlandırma sonrasında ek İAH/Pnömonit olgularına rastlanmış olup, ölümlü vakalar bildirilmiştir (bkz. Bölüm 4.8).
Hastalarda İAH/Pnömonit düşündüren akciğer semptomları (örn., hipoksi, öksürük, dispne) takip edilmelidir. Yeni veya kötüleşen solunum semptomları olan ve pnömonit geliştiğinden şüphe edilen hastalarda hemen REAMPLA kulanımı durdurularak hasta değerlendirmeye tabi tutulmalıdır. Ciddi İAH veya pnömonit gözlenen olgularda ise REAMPLA kullanımı kalıcı olarak bırakılmalıdır (bkz. Bölüm 4.2).
Kritik viseral hastalık
Palbosiklibin etkililiği ve güvenliliği ciddi viseral hastalığı olan hastalarda araştırılmamıştır
(bkz. Bölüm 5.1).
Hematolojik bozukluklar
Derece 3 veya 4 nötropeni gelişen hastalar için doza ara verilmesi, doz azaltılması veya tedavi sikluslarına başlamanın geciktirilmesi önerilmektedir. Uygun şekilde izleme yapılmalıdır (bkz. Bölüm 4.2 ve 4.8).
Enfeksiyonlar
Kemik iliğini baskılayıcı özellikleri nedeniyle REAMPLA hastaların enfeksiyona eğilimli olmasına yol açabilir.
Randomize klinik çalışmalarda REAMPLA ile tedavi edilen hastalarda enfeksiyonlar, ilgili karşılaştırma koluna göre daha yüksek oranlarda bildirilmiştir. Derece 3 ve Derece 4 enfeksiyonlar REAMPLA'nın herhangi bir kombinasyonu ile tedavi edilen hastalarda sırasıyla
%5,6 ve %0,9 oranlarında gelişmiştir (bkz. Bölüm 4.8).
Hastalar enfeksiyon belirti ve bulguları açısından izlenmeli ve medikal olarak uygun şekilde
tedavi edilmelidir (bkz. Bölüm 4.2).
Doktorlar, hastalarını tüm ateş olaylarını derhal bildirmeleri konusunda bilgilendirmelidirler.
Karaciğer yetmezliği
REAMPLA orta şiddette veya ciddi karaciğer yetmezliği olan hastalarda toksisite belirtilerini yakından takip ederek dikkatli kullanılmalıdır (bkz. Bölüm 4.2 ve 5.2).
Böbrek yetmezliği
REAMPLA orta şiddette veya ciddi böbrek yetmezliği olan hastalarda toksisite belirtilerini yakından takip ederek dikkatli kullanılmalıdır (bkz. Bölüm 4.2 ve 5.2).
Güçlü CYP3A inhibitörleri veya indükleyici ile birlikte kullanımı için doz ayarlamaları
Güçlü CYP3A4 inhibitörleri toksisitede artışa neden olabilir (bkz. Bölüm 4.5). Güçlü bir CYP3A inhibitörünün REAMPLA ile birlikte kullanılmasından kaçınılmalıdır. Birlikte uygulama sadece potansiyel fayda ve zararların dikkatlice değerlendirilmesi sonrası
düşünülmelidir. Eğer hasta güçlü bir CYP3A inhibitörü ile tedavi almak zorunda ise REAMPLA dozu günde 75 mg'a düşürülmelidir. Güçlü CYP3A inhibitör kullanımı kesildiğinde REAMPLA dozu (inhibitörün 3-5 yarılanma ömründen sonra) tedaviye başlandığı zamandaki doza geri döndürülmelidir (bkz. Bölüm 4.5).
CYP3A indükleyicilerinin eş zamanlı kullanımı maruz kalınan palbosiklib seviyesinin düşmesine ve dolayısıyla etkisizlik riskine neden olabilir. Bu nedenle palbosiklibin güçlü CYP3A4 indükleyicileri ile eş zamanlı kullanılmasından kaçınılmalıdır. Orta şiddette CYP3A indükleyicileri ile eş zamanlı verilmesi durumunda palbosiklib için doz ayarlaması gerekmez (bkz. Bölüm 4.5).
Doğurma potansiyeli bulunan kadınlar veya partnerleri
Doğurma potansiyeli olan kadınların veya erkek partnerlerinin REAMPLA tedavisi sırasında etkili bir kontrasepsiyon yöntemi kullanmaları şarttır (bkz. Bölüm 4.6).
Bu tıbbi ürün laktoz ihtiva eder. Nadir kalıtımsal galaktoz intoleransı, total laktaz eksikliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
Bu tıbbi ürün, kapsül başına 1 mmol (23 mg)'dan daha az sodyum içerir, esasen âsodyum içermezâ.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Palbosiklib primer olarak CYP3A4 ve sulfotransferaz (SULT) enzimi SULT2A1 ile metabolize edilmektedir. In vivo olarak CYP3A4'ün zayıf, zamana bağımlı bir inhibitörüdür.
Diğer ilaçların palbosiklib farmakokinetiği üzerine etkisi
CYP3A inhibitörlerinin etkisi
Tek bir 125 mg palbosiklib dozu ile eş zamanlı olarak birden fazla 200 miligramlık itrakonazol dozunun verilmesi, tek başına verilen tek bir 125 miligramlık palbosiklib dozu ile karşılaştırıldığında maruz kalınan toplam palbosiklib seviyesini (EAA) ve zirve konsantrasyonunu (C) sırasıyla yaklaşık %87 ve %34 arttırmıştır. Bu sebeple palbosiklib güçlü CYP3A inhibitörleri (örn. klaritromisin, indinavir, itrakonazol, ketokonazol, lopinavir/ritonavir, nefazodon, nelfinavir, posakonazol, sakinavir, telaprevir, telitromisin, vorikonazol ve greyfurt veya greyfurt suyu) ile birlikte kullanılmamalıdır (bkz. Bölüm 4.2 ve 4.4).
Hafif ve orta güçte CYP3A inhibitörleri için doz ayarlaması yapılması gerekmez. CYP3A indükleyicilerinin etkisi
Tek başına verilen tek bir 125 miligramlık palbosiklib dozu ile karşılaştırıldığında birden fazla
600 miligramlık dozlarda rifampinin tek bir 125 miligramlık palbosiklib dozu ile eş zamanlı
verilmesi palbosiklib EAAve Cseviyelerini sırasıyla %85 ve %70 azaltmıştır.
Karbamazepin, enzalutamid, fenitoin, rifampin, ve sarı kantaron dahil ancak bunlarla sınırlı olmamak üzere güçlü CYP3A indükleyicileri ile eş zamanlı olarak uygulamasından kaçınılmalıdır (bkz. Bölümler 4.3 ve 4.4).
Tek başına verilen tek bir 125 miligramlık REAMPLA dozu ile karşılaştırıldığında, orta güçte bir CYP3A indükleyicisi olan modafinilin günde 400 mg birden fazla dozda eş zamanlı
verilmesi palbosiklib EAAve Cseviyelerini sırasıyla %32 ve %11 azaltmıştır. Orta güçte
CYP3A indükleyicileri için doz ayarlaması yapılması gerekmez (bkz. Bölüm 4.4).
Asit azaltıcı ajanların etkisi
Tok karnına (orta yağlı bir yemeği takiben) birden fazla dozda bir proton pompa inhibitörü (PPİ) olan rabeprazol ile tek doz 125 mg REAMPLA ile eş zamanlı olarak verilmesi, tek başına verilen tek bir 125 mg REAMPLA dozu ile karşılaştırıldığında, palbosiklib Cseviyesini
%41 azaltmıştır ancak EAAüzerindeki etkisi kısıtlıdır (%13 azalma).
Aç karnına birden fazla dozda bir PPİ olan rabeprazol ile tek doz 125 mg REAMPLA'nın eş zamanlı olarak verilmesi, palbosiklib EAAve Cseviyelerini sırasıyla %62 ve %80'e kadar azaltmıştır. Bu nedenle REAMPLA gıda ile birlikte tercihen bir yemek sırasında alınmalıdır (bkz. Bölümler 4.2 ve 5.2).
PPİ'lerle karşılaştırıldığında H2-reseptör antagonislerinin ve lokal antasitlerin mide pH üzerindeki etkilerinin daha düşük olduğu dikkate alındığında, palbosiklibin gıda ile birlikte alınması durumunda H2-reseptör antagonistlerinin ve lokal antasitlerin maruz kalınan palbosiklib seviyesi üzerinde klinik olarak anlamlı bir etkisinin olması beklenmez.
REAMPLA'nın diğer ilaçların farmakokinetikleri üzerindeki etkileri
Kararlı durumda günde 125 mg dozunda verildiğinde palbosiklib zayıf ve zamana bağlı bir CYP3A inhibitörüdür. Birden fazla dozda palbosiklibin midazolam ile eş zamanlı olarak verilmesi, midazolamın tek başına verilmesi ile karşılaştırıldığında midazolam EAAve Cdeğerlerini sırasıyla %61'e ve %37'ye kadar arttırmıştır.
REAMPLA bu ilaçların maruz kalınan seviyelerini arttırabileceğinden, REAMPLA ile eş zamanlı olarak verilirken terapötik indeksi dar, duyarlı CYP3A substratlarının (örneğin alfentanil, siklosporin, dihidroergotamin, ergotamin, everolimus, fentanil, pimozid, kinidin, sirolimus ve takrolimus) dozlarının azaltılması gerekebilir.
Palbosiklib ve letrozol arasında ilaç-ilaç etkileşimleri
Meme kanseri hastalarında yapılan bir klinik çalışmanın ilaç-ilaç etkileşiminin (DDI) değerlendirildiği bölümünden gelen veriler, 2 ilaç eş zamanlı olarak verildiğinde palbosiklib ile letrozol arasında ilaç etkileşimi olmadığını göstermiştir.
Tamoksifenin maruz kalınan palbosiklib seviyesi üzerindeki etkisi
Sağlıklı erkek gönüllülerde yapılan bir DDI çalışmasından gelen veriler, birden fazla dozda verilen tamoksifen ile eş zamanlı verilen tek doz palbosiklibin maruz kalınan seviyelerinin tek başına verilen palbosiklib ile kıyaslanabilir olduğunu göstermiştir.
Palbosiklib ve fulvestrant arasında ilaç-ilaç etkileşimleri
Meme kanseri hastalarında yapılan bir klinik çalışmadan elde edilen veriler, 2 ilaç eş zamanlı olarak verildiğinde palbosiklib ile fulvestrant arasında klinik önemi olan ilaç etkileşimi olmadığını göstermiştir.
Palbosiklib ve oral kontraseptifler arasında ilaç-ilaç etkileşimleri
Palbosiklib ve oral kontraseptiflerle DDI çalışmaları yapılmamıştır (bkz. Bölüm 4.6).
Taşıyıcılarla In vitro çalışmalar
In vitro verilere göre, palbosiklibin intestinal P-glikoprotein (P-gp) ve meme kanseri direnç
proteini (BCRP) aracılı taşımayı engelleyeceği öngörülmektedir. Bu nedenle palbosiklibin P-
gp (örneğin digoksin, dabigatran, kolşisin) ya da BCRP (örneğin pravastatin, rosuvastatin, sulfasalazin) substratları ile birlikte verilmesi bunların terapötik etkilerini ve advers reaksiyonlarını arttırabilir.
In vitro verilere göre, palbosiklib içeri alım organik katyonik taşıyıcısı OCT1'i inhibe edebilir ve bu durumda bu taşıyıcının ilaç substratlarının (örneğin metformin) maruz kalınan seviyelerini arttırabilir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi C'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Doğurma potansiyeli olan kadınların veya erkek partnerlerinin REAMPLA tedavisi sırasında ve tedavinin bitiminden kadınların en az 3 hafta, erkeklerin en az 14 hafta sonrasına kadar etkili bir kontrasepsiyon yöntemi (çift bariyer yöntemi; prezervatif ve diyafram gibi) kullanmaları şarttır (bkz. Bölüm 4.5). Kadınların REAMPLA tedavisi esnasında hamile kalması veya hamile kalma şüphesi mevcut olması durumunda doktorlarına başvurmaları önerilmelidir.
Gebelik dönemi
REAMPLA'nın gebe kadınlarda kullanımına ilişkin veri mevcut değildir veya sınırlı veri bulunmaktadır. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). Gebelik döneminde ve kontrasepsiyon yöntemi kullanmayan çocuk doğurma potansiyeli bulunan kadınlarda REAMPLA kullanımı önerilmemektedir. REAMPLA gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Palbosiklibin süt üretimi üzerindeki etkisine, insan sütünde mevcudiyetine veya emzirilen çocuk üzerindeki etkilerine ilişkin insanlarda veya hayvanlarda yapılmış çalışmalar bulunmamaktadır. Palbosiklibin insan sütüne geçip geçmediği bilinmemektedir. Palbsiklib alan hastalar emzirmemelidir.
Üreme yeteneği/Fertilite
Hayvanlardan elde edilen veriler temelinde, REAMPLA tedavisi esnasında erkek doğurganlığı zayıflayabilir.
Klinik dışı üreme çalışmalarında sıçanların östrus döngüsü (dişi sıçanlar) ya da çiftleşme ve fertilitesi (erkek ve dişi sıçanlar) üzerinde etki saptanmamıştır. Bununla birlikte, insanlarda fertilite hakkında elde edilmiş klinik veri yoktur. Klinik dışı güvenlilik çalışmalarından elde edilen erkek üreme organı bulgularına göre (testiste seminifer tübül dejenerasyonu, epididimal hipospermi, düşük sperm hareketliliği ve yoğunluğu ve prostat sekresyonunda azalma) palbosiklib tedavisi erkek fertilitesi için risk oluşturabilir (bkz. Bölüm 5.3). Dolayısıyla erkekler REAMPLA tedavisine başlamadan önce sperm saklama seçeneği düşünülebilir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
REAMPLA'nın araç ve makine kullanma becerisi üzerinde minör etkisi bulunmaktadır. Bununla birlikte REAMPLA yorgunluğa yol açabilir ve hastalar araç ya da makine kullanırken dikkatli olmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
REAMPLA'nın genel güvenlilik profili HR-pozitif, HER2-negatif ileri evre ya da metastatik meme kanserinde yapılan randomize klinik çalışmalarda endokrin tedavi ile kombine olarak palbosiklib alan 872 hastanın (N=527 letrozolle kombine olarak, N=345 fulvestrant ile kombine olarak) toplu verilerine dayanmaktadır.
Randomize klinik çalışmalarda palbosiklib alan hastalarda bildirilen herhangi bir Derecedeki en sık advers reaksiyonlar (≥%20) nötropeni, enfeksiyonlar, lökopeni, yorgunluk, bulantı, stomatit, anemi, diyare, alopesi ve trombositopenidir. Palbosiklibin en sık (≥%2) Derece ≥3 advers reaksiyonları nötropeni, lökopeni, enfeksiyonlar, anemi, aspartat aminotransferaz (AST) düzeylerinde artış, yorgunluk ve alanin aminotransferaz (ALT) düzeylerinde görülen artıştır.
Randomize klinik çalışmalarda kombinasyondan bağımsız olarak REAMPLA alan hastaların
%38,4'ünde advers reaksiyona bağlı olarak doz azaltılmış ya da doz değişikliği yapılmıştır.
Randomize klinik çalışmalarda kombinasyondan bağımsız olarak REAMPLA alan hastaların
%5,2'sinde advers reaksiyona bağlı olarak tedavi kalıcı olarak sonlandırılmıştır.
Advers reaksiyonların listesi
Advers reaksiyonlar sistem organ sınıfına ve sıklık kategorisine göre listelenmektedir. Sıklık kategorileri şu şekilde tanımlanmaktadır: Çok yaygın (≥l/10); yaygın (≥l/100- <1/10); yaygın olmayan (≥l/1.000 - <1/100); seyrek (≥l/10.000 - <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Her sıklık grubunda advers reaksiyonlar azalan ciddiyete göre yer almaktadır.
Tablo 4'te belirtilen yan etkiler, 3 randomize çalışmanın toplu verilerinden elde edilen advers reaksiyonları içermektedir. Final genel sağkalım analizi sırasında toplu veri kümesinde palbosiklib tedavisinin ortanca süresi 14,8 aydır.
Tablo 4. Üç randomize çalışmanın toplu verilerinden elde edilen advers reaksiyonlar
(N=872)
Sistem organ sınıfı Sıklık Tercih edilen terimáµ (PT) | Tüm Dereceler n (%) | Derece 3 n (%) | Derece 4 n (%) |
Enfeksiyonlar ve enfestasyonlar Çok yaygın Enfeksiyonlaráµ |
516 (59,2) |
49 (5,6) |
8 (0,9) |
Kan ve lenf sistemi hastalıkları Çok yaygın Nötropeni Lökopeni Anemi Trombositopeni Yaygın Febril nötropeni |
716 (82,1) |
500 (57,3) |
97 (11,1) |
424 (48,6) | 254 (29,1) | 7 (0,8) | |
258 (29,6) | 45 (5,2) | 2 (0,2) | |
194 (22,2) | 16 (1,8) | 4 (0,5) | |
12 (1,4) | 10 (1,1) | 2 (0,2) | |
Metabolizma ve beslenme hastalıkları Çok yaygın |
|
|
|
İştahta azalma | 152 (17,4) | 8 (0,9) | 0 (0,0) |
Sinir sistemi hastalıkları Yaygın Tat alma duyusunda bozulma |
79 (9,1) |
0 (0,0) |
0 (0,0) |
Göz hastalıkları Yaygın Bulanık görme Göz yaşı salgılanmasında artış Göz kuruluğu |
48 (5,5) 59 (6,8) 36 (4,1) |
1 (0,1) 0 (0,0) 0 (0,0) |
0 (0,0) 0 (0,0) 0 (0,0) |
Solunum, göğüs hastalıkları ve mediastinal hastalıkları Yaygın Epistaksis İAH/pnömonit |
77 (8,8) 12 (1,4) |
0 (0,0) 1 (0,1) |
0 (0,0) 0 (0,0) |
Gastrointestinal hastalıklar Çok yaygın Stomatit Bulantı İshal Kusma |
264 (30,3) 314 (36,0) 238 (27,3) 165 (18,9) |
8 (0,9) 5 (0,6) 9 (1,0) 6 (0,7) |
0 (0,0) 0 (0,0) 0 (0,0) 0 (0,0) |
Deri ve derialtı doku hastalıkları Çok yaygın Döküntü Alopesi Cilt kuruluğu Yaygın olmayan Kutanöz lupus eritematozus* |
158 (18,1) 234 (26,8) 93 (10,7)
1 (0,1) |
7 (0,8) Geçerli değil 0 (0,0)
0 (0,0) |
0 (0,0) Geçerli değil 0 (0,0)
0 (0,0) |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Çok yaygın Bitkinlik Asteni Ateş |
362 (41,5) 118 (13,5) 115 (13,2) |
23 (2,6) 14 (1,6) 1 (0,1) |
2 (0,2) 1 (0,1) 0 (0,0) |
Araştırmalar Çok yaygın ALT artışı AST artışı |
92 (10,6) 99 (11,4) |
18 (2,1) 25 (2,9) |
1 (0,1) 0 (0,0) |
ALT=alanin aminotransferaz; AST=aspartat aminotransferaz; İAH= İnterstitiyel akciğer hastalığı; N/n=hasta sayısı
Pazarlama sonrası tespit edilen advers ilaç reaksiyonu.
áµ PT MedDRA 17.1'e göre listelenmiştir.
áµ Enfeksiyonlar, Enfeksiyonlar ve Enfestasyonların Sistem Organ Sınıfına ait olan tüm PT'leri
kapsar.
Nötropeni şu PT'leri kapsar: Nötropeni, Azalmış nötrofil sayısı.
Lökopeni şu PT'leri kapsar: Lökopeni, Azalmış beyaz hücre sayısı.
Anemi şu PT'leri kapsar: Anemi, Düşük hemoglobin, Düşük hematokrit.
Trombositopeni şu PT'leri kapsar: Trombositopeni, Azalmış trombosit sayısı.
Stomatit şu PT'leri kapsar: Aftöz stomatit, Dudak iltihabı, Glossit, Glossodini, Ağız ülseri,
Mukoza inflamasyonu, Ağız ağrısı, Orofarengeal rahatsızlık, Orofarengeal ağrı, Stomatit.
Döküntü şu PT'leri kapsar: Döküntü, Makülopapüler döküntü, Kaşıntılı döküntü, Eritematöz
döküntü, Papüler döküntü, Dermatit, Akneiform Dermatit, Toksik deri erüpsiyonu.
İAH / pnömonit, interstisyel akciğer hastalığının (dar) Sistem Organ Sınıfına ait olan tüm
PT'leri kapsar.
Tablo 5, üç randomize çalışmanın toplu verilerinde gözlenen laboratuvar anormalliklerini
göstermektedir.
Tablo 5. Üç randomize çalışmanın toplu verilerinde gözlenen laboratuvar anormallikleri (N=872)
| REAMPLA ile Letrozol ya da Fulvestrant | Karşılaştırma kolları* | ||||
Laboratuvar anormallikleri | Tüm Derecel er % | Derece 3 % | Derece 4 % | Tüm Derecel er % | Derece 3 % | Derece 4 % |
Lökosit sayısında azalma | 97,4 | 41,8 | 1,0 | 26,2 | 0,2 | 0,2 |
Nötrofil sayısında azalma | 95,6 | 57,5 | 11,7 | 17,0 | 0,9 | 0,6 |
Anemi | 80,1 | 5,6 | N/A | 42,1 | 2,3 | N/A |
Trombosit sayısında azalma | 65,2 | 1,8 | 0,5 | 13,2 | 0,2 | 0 |
AST artışı | 55,5 | 3,9 | 0 | 43,3 | 2,1 | 0 |
ALT artışı | 46,1 | 2,5 | 0,1 | 33,2 | 0,4 | 0 |
AST=aspartat aminotransferaz; ALT=alanin aminotransferaz; N=hasta sayısı; N/A=geçerli değil.
Not: Laboratuvar sonuçları NCI CTCAE versiyon 4.0 şiddet derecesine göre derecelendirilmiştir.
* letrozol ya da fulvestrant
Seçili advers reaksiyonların tanımı
Toplamda kombinasyondan bağımsız olarak REAMPLA alan hastalardan 716'sında (%82,1)
herhangi bir derece nötropeni bildirilmiş; Derece 3 nötropeni 500 (%57,3) hastada, Derece 4
nötropeni 97 hastada (%11,1) bildirilmiştir (bkz. Tablo 4).
3 randomize klinik çalışmada herhangi bir derece nötropeninin ilk epizotuna kadar geçen
ortanca süre 15 gün (12-700 gün) ve Derece ≥3 nötropeninin ortanca süresi 7 gün olmuştur.
Fulvestrant ile kombine olarak REAMPLA alan hastaların %0,9'unda ve letrozol ile kombine
olarak palbosiklib alan hastaların %1,7'sinde febril nötropeni bildirilmiştir.
Genel olarak klinik programda REAMPLA'ya maruz kalan hastaların yaklaşık %2'sinde febril nötropeni bildirilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye
Farmakovijilans Merkezi (TUFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Palbosiklib ile doz aşımı durumunda gerek gastrointestinal (örneğin, bulantı, kusma) gerekse hematolojik (örneğin, nötropeni) toksisite oluşabilir ve bu durumda genel destekleyici bakım sağlanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapotik grup (ATC kodu): Antineoplastik ilaçlar, protein kinaz inhibitörleri, siklin-
bağımlı kinaz (CDK) inhibitörleri ATC kodu: L01EF01.
Etki mekanizması
Palbosiklib siklin bağımlı kinaz (CDK) 4'ün ve 6'nın yüksek seçiciliğe sahip, geri dönüşlü bir inhibitörüdür. Siklin D1 ve CDK 4/6, hücresel proliferasyona neden olan birden fazla sinyal yolağının akışında rol alan enzimlerdendir.
Farmakodinamik etkiler
Palbosiklib, CDK4/6'nın inhibisyonu yoluyla hücrenin G1 hücre döngüsü fazından S fazına ilerlemesini engelleyerek, hücre proliferasyonunu azaltmaktadır. Palbosiklibin moleküler profili meme kanseri hücre hattı panelinde test edilmesi; özellikle ER-pozitif meme kanserlerinde olmak üzere luminal meme kanserine karşı yüksek etkililik gösterdiğini ortaya koymuştur. Test edilen hücre hatlarında, retinoblastomun (Rb) kaybı palbosiklib etkilik kaybı ile ilişkili olmuştur. Bununla birlikte taze tümör örnekleri ile yapılan bir takip çalışmasında RB1 ekspresyonu ve tümör yanıtı arasında bir ilişki gözlemlenmemiştir. Aynı şekilde, hastadan elde edilen ksenograft (PDX) in vivo modellerde, palbosiklibe verilen yanıtla aralarında bir ilişki gözlemlenmemiştir. Mevcut klinik veriler klinik etkililik ve güvenlilik bölümünde bildirilmektedir (bkz. Bölüm 5.1).
Kardiyak Elektrofizyoloji
İleri evre meme kanseri olan 77 hastada palbosiklibin kalp atım hızı aralığına göre düzeltilmiş QT aralığı (QTc) üzerine etkisi; başlangıca göre değişiklik ve ilgili farmakokinetik verileri değerlendiren eş zamanlı elektrokardiyografi (EKG) kullanılarak değerlendirilmiştir. Palbosiklib önerilen günlük 125 mg dozunda QTc'yi klinik olarak anlamlı şekilde uzatmamıştır (Doz şeması 3/1).
Klinik etkililik ve güvenlilik
Randomize Faz 3 Çalışma PALOMA-2: letrozol ile kombine REAMPLA
ER-pozitif, HER2-negatif küratif amaçlı rezeksiyon ya da radyasyon tedavisi yapılamayan lokal olarak ilerlemiş ya da ileri evre hastalıkları için daha önce sistemik tedavi almamış metastatik meme kanseri hastası kadınlarda yapılan uluslararası, randomize, çift kör, plasebo
kontrollü, paralel gruplu, çok merkezli bir çalışmada letrozol ile kombine palbosiklib etkililiği letrozol artı plasebo ile karşılaştırmalı olarak değerlendirilmiştir.
Toplam 666 postmenopozal hasta 2:1 oranında palbosiklib ile letrozol koluna ya da plasebo ile letrozol koluna randomize edilmiş ve hastalığın yerine (viseral/viseral olmayan); (neo) adjuvan tedavinin bitiminden hastalığın nüksetmesine kadar geçen hastalıksız süreye (yeni başlayan metastatik ï£12 aya karşı >12 ay) ve önceki (neo) adjuvan kanser tedavilerin türüne (daha önce hormonal tedavi alanlara karşı daha önce hormonal tedavi almayanlar) göre ayrılmıştır. İleri evre semptomatik, viseral yayılmış, kısa sürede yaşamı tehdit eden komplikasyon gelişim riski olan hastalar (masif, kontrolsüz efüzyonları [plevral, perikardial, peritoneal], pulmoner lenfanjiti ve %50 üzerinde karaciğer tutulumu olan hastalar dahil) çalışmaya alınmak için uygun bulunmamıştır.
Hastalar, hangisi daha önce olursa objektif hastalık progresyonuna, semptomatik kötüleşmeye, kabul edilemez toksisite gelişimine, ölüme, ya da olurun geri çekilmesine kadar atandıkları tedaviyi almaya devam etmiştir. Tedavi kolları arasında çapraz geçişe izin verilmemiştir.
Hastaların başlangıçtaki demografik özellikleri ve prognostik özellikleri palbosiklib artı letrozol kolu ile plasebo artı letrozol kolları arasında uyumlu şekilde eşleştirilmiştir. Bu çalışmaya kaydedilen hastaların medyan yaşı 62 (aralık 28-89) olarak hesaplanmış ve hastaların
%48,3'ü kemoterapi alırken %56,3'ü ileri evre meme kanseri tanısından önce (neo) adjuvan anti-hormonal tedavi almış, %37,2'si ise daha önce (neo) adjuvan tedavi olarak sistemik tedavi almamıştır. Hastaların çoğunluğunda (%97,4) başlangıçta metastatik hastalık varken,
%23,6'sında yalnızca kemikte hastalık ve %49,2'sinde viseral hastalık görülmüştür.
Çalışmanın birincil sonlanım noktası araştırıcının değerlendirdiği, Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) Versiyon 1.1'e göre progresyonsuz sağkalım (PFS) olmuştur. İkincil etkililik sonlanım noktaları objektif yanıtı (OY), klinik yarar yanıtını (KYY), güvenliliği ve yaşamâkalitesinde değişikliği (YKD) kapsamıştır.
26 Şubat 2016 veri kesim tarihinde, çalışmada birincil hedef olan PFS'nin iyileştirilmesi amacına ulaşılmıştır. Gözlenen tehlike oranı (HR) palbosiklib ile letrozol lehine 0,576 (%95 güven aralığı [GA]: 0,46-0,72) ve kademeli log-sıra testi 1-yönlü p değeri <0,000001 olmuştur. 15 aylık bir ek izlemeden sonra birincil ve ikincil sonlanım noktalarının güncellenmiş bir analizi yapılmıştır (veri kesim tarihi: 31 Mayıs 2017). Toplam 405 PFS olayı gözlenmiştir; sırasıyla palbosiklib ile letrozol kolunda 245 olay (%55,2) ve karşılaştırma kolunda 160 olay (%72,1).
Tablo 6, araştırıcı ve bağımsız inceleme değerlendirmesine göre, PALOMA 2 çalışmasının
birincil ve güncellenmiş analizlerine dayanan etkililik sonuçlarını göstermektedir.
Tablo 6. PALOMA 2 (tedavi amaçlı popülasyon) â Birincil ve güncellenmiş veri kesim
tarihine göre etkililik sonuçları
| Birincil Analiz (26 Şubat 2016 Veri Kesmi) | Güncellenmiş Analiz (31 Mayıs 2017 Veri Kesmi) | ||
| REAMPLA ile Letrozol (N = 444) | Plasebo ile Letrozol (N = 222) | REAMPLA ile Letrozol (N = 444) | Plasebo ile Letrozol (N = 222) |
Bağımsız değerlendirmeye göre progresyonsuz sağkalım
Olay sayısı (%) | 194 (43,7) | 137 (61,7) | 245 (55,2) | 160 (72,1) |
Ortanca PFS [ay (%95 GA)] | 24,8 (22,1- NE) | 14,5 (12,9-17,1) | 27,6 (22,4-30,3) | 14,5 (12,3- 17,1) |
Tehlike Oranı [(%95 GA) ve p-değeri] | 0,576 (0,463-0,718), p<0,000001 | 0,563 (0,461-0,687), p<0,000001 |
Bağımsız değerlendirmeye göre progresyonsuz sağkalım
Olay sayısı (%) | 152 (34,2) | 96 (43,2) | 193 (43,5) | 118 (53,2) |
Ortanca PFS [ay (%95 GA)] | 30,5 (27,4-NE) | 19,3 (16,4- 30,6) | 35,7 (27,7- 38,9) | 19,5 (16,6- 26,6) |
Tehlike oranı (%95GA) ve tek yönlü p değeri | 0,653 (0,505-0,844), p=0,000532 | 0,611 (0,485-0,769), p=0,000012 | ||
OY* [% (%95 GA)] | 46,4 (41,7- 51,2) | 38,3 (31,9-45,0) | 47,5 (42,8-52,3) | 38,7 (32,3- 45,5) |
OY* ölçülebilir hastalık [% (%95 GA)] | 60,7 (55,2- 65,9) | 49,1 (41,4-56,9) | 62,4 (57,0-67,6) | 49,7 (42,0- 57,4) |
KYY* [% (%95 GA)] | 85,8 (82,2- 88,9) | 71,2 (64,7-77,0) | 85,6 (82,0-88,7) | 71,2 (64,7- 77,0) |
N=Hasta sayısı; GA=Güven aralığı; TE=Tahmin edilemez; OY=Objektif yanıt; KYY=Klinik yarar yanıtı; PSK=Progresyonsuz sağkalım.
* İkincil sonlanım noktalarının sonuçları RECIST 1.1 versiyonuna göre doğrulanmış ve doğrulanmamış yanıtlara dayanmaktadır.
31 Mayıs 2017 veri kesim tarihine dayalı olarak PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
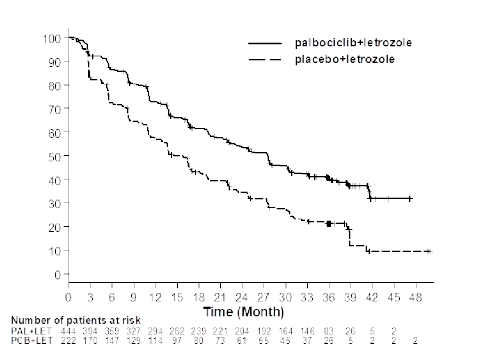
Süre (Ay)
Risk altındaki hasta sayısı
Progresyonsuz Sağkalım Olasılığı (%)
Şekil 1. Kaplan-Meier progresyonsuz sağkalım grafiği (araştırıcının değerlendirmesi, tedavi amaçlı popülasyon) â PALOMA-2 çalışması (31 Mayıs 2017)
PAL=Palbosiklib; LET=Letrozol; PCB=Plasebo.
Tedavi etkisinin iç tutarlılığını araştırmak için prognostik faktörlere ve başlangıç özelliklerine göre önceden belirlenmiş bir dizi alt grup PFS analizi yapılmıştır. Ayrıştırma faktörlerine ve
başlangıç özelliklerine göre tanımlanan ayrı hasta alt gruplarında hastalık progresyonu ve ölüm
riskinde palbosiklib ile letrozol kolu lehine bir azalma gözlenmiştir.
31 Mayıs 2017 veri kesim tarihine göre, riskteki bu düşüş şu alt gruplarda gözlenmeye devam etmiştir: (1) viseral metastazları olan hastalarda (HR= 0,62 [%95 GA: 0,47-0,81], ortanca PFS [mPFS] 19,3 aya karşılık 12,3 ay) ya da viseral metastazı olmayan hastalarda (HR= 0,50 [% 95GA: 0,37-0,67], mPFS 35,9 aya karşılık 17,0 ay) ve (2) yalnızca kemikte hastalığı olan hastalarda (HR= 0,41 [% 95 GA: 0,26-0,63], mPFS 36,2 aya karşılık 11,2 ay) ya da hastalığı
yalnızca kemikte olmayanlarda (HR= 0,62 [%95 GA: 0,50-0,78], mPFS 24,2 aya karşılık 14,5 ay) belirgin olmuştur. Benzer şekilde, immünohistokimya (IHC) ile tümörlerinde Rb proteini ekspresyonunun pozitif olduğu gösterilen 512 hastada hastalık progresyonu ve ölüm riskinde palbosiklib ile letrozol kolu lehine bir azalma gözlenmiştir (HR =0,543 [%95 GA: 0,433- 0,681], mPFS 27,4 aya karşılık 13,7 ay). IHC ile tümörlerinde Rb ekspresyonu negatif olan 51 hastada tedavi kolları arasındaki fark istatistiksel olarak anlamlı olmamıştır; palbosiklib ile letrozol koluna karşılık plasebo ile letrozol kolu sırasıyla (HR =0,868 [%95 GA: 0,424-1,777], mPFS 23,2 aya karşılık 18,5 ay).
31 Mayıs 2017 güncellenmiş veri kesim tarihine göre, viseral hastalık olan ve olmayan hasta alt gruplarında değerlendirilen ek etkililik ölçümleri (OY ve İlk tümör yanıtına kadar geçen süre (TYKGS)) Tablo 7'de gösterilmektedir.
Tablo 7. PALOMAâ2 çalışmasından viseral ve viseral dışı hastalıkta etkililik sonuçları (tedavi amaçlı popülasyon; 31 Mayıs 2017 veri kesim tarihi)
| Viseral hastalığı | Viseral dışı hastalık | ||
| REAMPLA ile letrozol (N=214) | Plasebo ile letrozol (N=110) | REAMPLA ile letrozol (N=230) | Plasebo ile letrozol (N=112) |
OY [%(% 95 GA)] | 59,8 (52,9-66,4) | 46,4 (36,8-56,1) | 36,1 (29,9-42,7) | 31,3 (22,8-40,7) |
TYKGS, Ortanca [ay (aralık)] | 5,4 (2,0-30,4) | 5,3 (2,6-27,9) | 3,0 (2,1-27,8) | 5,5 (2,6-22,2) |
N=Hasta sayısı; GA=Güven aralığı; OY= RECIST 1.1 versiyonuna göre doğrulanmış ve doğrulanmamış objektif yanıtlar; TYKGS=İlk tümör yanıtına kadar geçen süre.
Güncellenen analizler sırasında, randomizasyondan takip eden ikinci tedaviye kadar geçen medyan süre palbosiklib ile letrozol kolunda 38,8 ay ve plasebo ile letrozol kolunda 28,8 ay, HR=0,73 (%95 GA: 0,58-0,91) olmuştur.
Randomize Faz 3 Çalışma PALOMA-3: fulvestrant ile kombine REAMPLA
Menopoz durumundan bağımsız olarak, daha önce (neo) adjuvan ya da metastatik çerçevede verilen endokrin tedaviden sonra hastalığı ilerlemiş HR-pozitif, HER2-negatif, küratif amaçlı rezeksiyon ya da radyasyon tedavisi yapılamayan lokal olarak ilerlemiş ya da metastatik meme kanseri hastası kadınlarda yapılan uluslararası, randomize, çift kör, paralel gruplu, çok merkezli bir çalışmada fulvestrant ile kombine palbosiklibin etkililiği fulvestrant artı plasebo kullanımı ile karşılaştırmalı olarak değerlendirilmiştir.
İleri evre hastalık için adjuvan endokrin tedavi sırasında ya da tamamlandıktan sonra 12 ay içinde ya da önceki endokrin tedavi sırasında ya da tamamlandıktan sonra 1 ay içinde progresyon göstermiş toplam 521 premenopozal/perimenopozal ve postmenopozal dönemdeki kadın 2:1 oranında palbosiklib ile fulvestrant koluna ya da plasebo ile fulvestrant koluna randomize edilmiş; önceki hormonal tedaviye belgelenmiş duyarlılık, çalışmaya girişte menopoz durumu (premenozal/perimenopozal duruma karşılık postmenopozal durum) ve viseral metastazlarının varlığına göre gruplandırılmıştır. Premenopozal/perimenopozal kadınlar LHRH agonisti goserelin kullanmıştır. İleri evre/metastatik, semptomatik, viseral yayılmış hastalığı olan, kısa sürede yaşamı tehdit edici komplikasyon yaşama riski bulunan (masif, kontrolsüz efüzyonları [plevral, perikardial, peritoneal], pulmoner lenfanjiti ve %50 üzerinde karaciğer tutulumu olan hastalar dâhil) hastalar çalışmaya alınmak için uygun bulunmamıştır.
Hastalar, hangisi daha önce olursa nesnel hastalık progresyonuna, semptomatik kötüleşmeye, kabul edilemez toksisite gelişimine, ölüme, ya da olurun geri çekilmesine kadar atandıkları tedaviyi almaya devam etmiştir. Tedavi kolları arasında çapraz geçişe izin verilmemiştir.
Hastaların başlangıçtaki demografik özellikleri ve prognostik özellikleri palbosiklib artı fulvestrant kolu ile plasebo artı fulvestrant kolları arasında uyumlu şekilde eşleştirilmiştir. Bu çalışmaya kaydedilen hastaların medyan yaşı 57 (aralık 29-88) olmuştur. Her bir tedavi kolunda hastaların çoğunluğu beyaz ırktandı, önceki hormonal tedaviye duyarlıydı ve postmenopozal dönemdeydi. Ortalama %20 hasta pre/perimenopozaldi. Tüm hastalar daha önce sistemik tedavi almıştı ve her bir tedavi kolundaki hastaların çoğunluğu primer tanıları için daha önce bir kemoterapi almıştı. Hastaların yarısından çoğunda (%62) bir ECOG PS=0 ve %60'ında viseral metastazlar vardı ve %60'ı primer tanıları için birden fazla hormonal tedavi rejimi almışlardı.
Çalışmanın birincil sonlanım noktası, (RECIST) 1.1'e göre araştırıcının değerlendirildiği PFS olmuştur. Destekleyici PFS analizleri Bağımsız Merkezi Radyolojik Değerlendirmeye dayanmıştır. İkincil etkililik sonlanım noktaları OY, KYY, genel sağkalım (OS), güvenlilik ve ağrı sonlanım noktasında kötüleşmeye kadar geçen süreyi (TTD) kapsamıştır.
Çalışma, planlanan PFS olaylarının %82'si üzerinden yapılan ara analizde araştırıcının değerlendirdiği PFS'nin uzaması olan birincil hedefine ulaşmıştır. Sonuçlar önceden belirlenmiş Haybittle-Peto etkililik sınırını geçerek (α=0,00135), PFS'de istatistiksel olarak anlamlı bir uzama ve klinik olarak anlamlı bir tedavi etkisi göstermiştir.
Etkililik verilerinin daha ileri bir güncellemesi Tablo 8'de verilmektedir.
Ortalama 45 aylık bir takip süresinden sonra, final genel sağkalım (OS) analizi 310 olaya (randomize hastaların 60%'ı) dayalı olarak gerçekleştirildi. Palbosiklib artı fulvestrant kolundaki medyan OS'de plasebo artı fulvestrant koluna kıyasla 6,9 aylık bir fark gözlenmiştir; bu sonuç 0,0235 (tek taraflı) olarak belirlenen anlamlılık düzeyinde istatistiksel olarak anlamlı bulunmamıştır. Plasebo artı fulvestrant kolunda randomize edilen hastaların 15,5%'i, progresyon sonrası tedavi olarak palbosiklib ve diğer CDK inhibitörlerinden kullanmıştır.
Araştırıcı tarafından değerlendirilen PALOMA-3 çalışmasının PFS ve final OS sonuçları Tablo 8'de, ilgili Kaplan-Meier eğrisi Şekil 2 ve 3'te gösterilmektedir.
Tablo 8. Etkililik sonuçları â PALOMA-3 çalışması (Araştırıcının değerlendirmesi tedavi amaçlı popülasyon)
*İstatistiksel olarak anlamlı değil.
| Güncellenmiş analiz (23 Ekim 2015 veri kesmi) | |
REAMPLA ile fulvestrant (N=347) | Plasebo ile fulvestrant (N=174) | |
Progresyonsuz sağkalım (PFS) |
| |
Olay sayısı (%) | 200 (57,6) | 133 (76,4) |
Ortanca [ay (%95 GA)] | 11,2 (9,5-12,9) | 4,6 (3,5-5,6) |
Tehlike oranı (%95 GA) ve p değeri | 0,497 (0,398-0,62), p<0,000001 | |
İkincil etkililik sonlanım noktaları | ||
OY [% (%95 GA)] | 26,2 (21,7-31,2) | 13,8 (9-19,8) |
OY (ölçülebilir hastalık) [% (%95 GA] | 33,7 (28,1-39,7) | 17,4 (11,5-24,8) |
KYY [% (%95 GA)] | 68 (62,8-72,9) | 39,7 (32,3-47,3) |
Final genel sağkalım (OS) (Veri kesim tarihi 13 Nisan 2018) | ||
Olay sayısı (%) | 201 (57,9) | 109 (62,6) |
Ortanca [ay (%95 GA)] | 34,9 (28,8 â 40,0) | 28,0 (23,6 -34,6) |
Tehlike oranı (%95 GA) ve p değeri | 0,814 (0,644 - 1,029) p=0,0429 | |
KYY=Klinik yarar yanıtı; GA=Güven aralığı; N=Hasta sayısı; OY=Objektif yanıt;
İkincil sonlanım noktalarının sonuçları RECIST 1.1 versiyonuna göre doğrulanmış ve doğrulanmamış yanıtlara dayanmaktadır.
aracılığı ile log-rank testinden elde edilmiş tek taraflı p değeri
Şekil 2. Kaplan-Meier progresyonsuz sağkalım grafiği (araştırıcı değerlendirmesi, tedavi amaçlı popülasyon) â PALOMA-3 çalışması (Veri kesim tarihi 23 Ekim 2015)
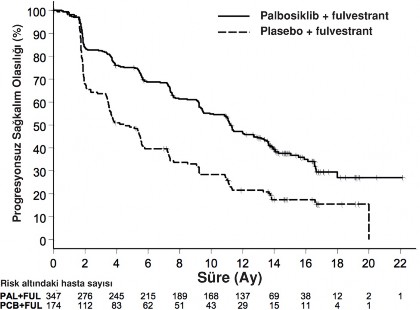
FUL=Fulvestrant; PAL=Palbosiklib; PCB=Plasebo.
Stratifikasyon faktörlerine ve başlangıç özelliklerine göre tanımlanan tüm hasta alt gruplarında, palbosiklib ile fulvestrant kolunda hastalık progresyonu ve ölüm riskinde azalma gözlenmiştir. Bu durum, premenopozal/perimenopozal kadınlarda (HR=0,46 [%95 GA: 0,28-0,75]) ve postmenopozal kadınlarda (HR = 0,52 [%95 GA: 0,4-0,66]) ve viseral metastatik hastalığı olan hastalarda (HR =0,5 [%95 GA: 0,38-0,65]) ve viseral metastazları olmayan hastalarda (HR = 0,48 [%95 GA: 0,33-0,71]) belirgin olmuştur.
Ayrıca metastatik hastalık için önceki tedavi basamaklarından bağımsız olarak fayda
gözlenmiştir; tedavi basamağı 0 (HR=0,59 [%95 GA: 0,37-0,93]), 1 (HR=0,46 [%95 GA: 0,32-
0,64]), 2 (HR=0,48 [%95 GA: 0,3-0,76]) ya da ≥3 (HR = 0,59 [%95 GA: 0,28-1,22]).
Şekil 3 Kaplan-Meier genel sağkalım grafiği (araştırıcı değerlendirmesi, tedavi amaçlı
popülasyon) â PALOMA-3 çalışması (Veri kesim tarihi 13 Nisan 2018)
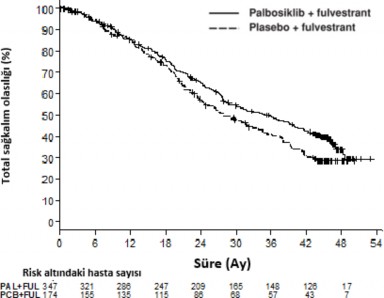
FUL=Fulvestrant; PAL=Palbosiklib; PCB=Plasebo.
Viseral hastalık olan ve olmayan hasta alt gruplarında değerlendirilen ek etkililik ölçümleri (OY
ve İlk tümör yanıtına kadar geçen süre (TYKGS)) Tablo 9'da gösterilmektedir.
Tablo 9. PALOMAâ3 çalışmasının viseral ve viseral olmayan hastalıkta etkililik sonuçları (tedavi amaçlı popülasyon)
| İç Organ Hastalığı | İç Organ Dışı Hastalık |
| ||
| REAMPLA | Plasebo | REAMPLA | Plasebo | |
ile fulvestrant | ile | ile | ile | ||
(N=206) | fulvestrant | fulvestrant | fulvestrant | ||
| (N=105) | (N=141) | (N=69) | ||
OY [%, (%95 GA)] | 35,0 | 13,3 | 13,5 | 14,5 | |
| (28,5-41,9) | (7,5-21,4) | (8,3-20,2) | (7,2-25) | |
TYKGS, Ortanca [ay | 3,8 | 5,4 | 3,7 | 3,6 | |
(aralık)] | (3,5-16,7) | (3,5-16,7) | (1,9-13,7) | (3,4-3,7) | |
N=Hasta sayısı; GA=Güven aralığı; OY= RECIST 1.1 versiyonuna göre doğrulanmış ve doğrulanmamış objektif yanıtlar; TYKGS=İlk tümör yanıtına kadar geçen süre.
Hasta tarafından bildirilen semptomlar Avrupa Kanser Araştırması ve Tedavisi Örgütü (EORTC) yaşam kalitesi anketi (QLQ)-C30 ve Meme Kanseri Modülü (EORTC QLQ-BR23) kullanılarak değerlendirilmiştir. Palbosiklib ile fulvestrant kolunda toplam 335 hasta ve tek başına fulvestrant kolunda 166 hasta başlangıçta ve başlangıçtan sonra en az bir ziyarette anketi doldurmuştur.
Kötüleşmeye kadar geçen süre, başlangıç ve başlangıca göre ağrı semptom skorlarında ≥10 puan artış olması arasında geçen süre olarak önceden tanımlanmıştır. Fulvestranta palbosiklibin eklenmesi; plasebo artı fulvestrant ile karşılaştırıldığında ağrı semptomunda kötüleşmeye kadar geçen süreyi anlamlı olarak geciktirerek bir semptom yararı sağlamıştır (ortanca 8 aya karşılık 2,8 ay; HR=0,64 [%95 GA: 0,49-0,85]; p<0,001).
Avrupa İlaç Ajansı, meme kanseri tedavisinde tüm pediatrik popülasyon alt kümelerinde REAMPLA çalışmalarının sonuçlarını sunma zorunluluğunu kaldırmıştır (pediyatrik kullanım hakkında bilgi için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Palbosiklibin farmakokinetiği, ileri meme kanseri hastalarını içeren solid tümörlü hastalarda ve
sağlıklı kişilerde karakterize edilmiştir.
Emilim:
Palbosiklibin ortalama Cdeğeri genellikle oral uygulamayı izleyen 6 ila 12 saat arasında gözlenmiştir. REAMPLA'nın oral 125 mg dozundan kullanımdan sonraki ortalama mutlak biyoyararlanımı %46'dır. 25 mg ile 225 mg doz aralığında, EAA ve Cgenellikle doz ile doğru orantılı olarak artmaktadır. 8 gün boyunca tekrar edilen günde bir defa doz alınmasının ardından kararlı duruma erişilmiştir. Tekrar edilen günde bir uygulama ile palbosiklib, 2,4'lük (1,5-4,2 aralığı) bir medyan birikim oranıyla birikmiştir.
Gıda etkisi: Açlık koşullarında palbosiklib emilimi ve maruziyeti, popülasyonun yaklaşık
%13'ünde çok düşük bir düzeyde gerçekleşmiştir. Gıda alınması, popülasyonun bu küçük alt grubunda palbosiklibe maruziyeti arttırmıştır, ancak popülasyonun geri kalan kısmında klinik olarak dikkate değer bir miktarda değiştirmemiştir. Gece boyunca aç kaldıktan sonra alınan REAMPLA ile kıyaslandığında, REAMPLA alımından bir saat önce ve iki saat sonra yüksek- yağlı gıdaların alınması durumunda palbosiklibin EAAve Cdeğerleri sırasıyla %21 ve
%38; düşük-yağlı gıdaların alınması durumunda sırasıyla %12 ve %27; ve orta-yağlı gıdaların alınması durumunda sırasıyla %13 ve %24 artmıştır. Ek olarak gıda alımı, hem bireyler arası hem de bireyiçi palbosiklib maruziyet değişkenliğini belirgin olarak azaltmıştır. Bu sonuçlara göre, palbosiklib gıda ile alınmalıdır (bkz. Bölüm 4.2).
Dağılım:
Palbosiklibin insan plazması proteinlerine in vitro bağlanması, konsantrasyondan bağımsız olarak yaklaşık %85 oranındadır. Karaciğer fonksiyonundaki kötüleşme artışı ile in vivo olarak insan plazmasında palbosiklibin ortalama serbest fraksiyonu (f) kademeli olarak artmıştır. Böbrek fonksiyonundaki kötüleşme ile in vivo insan plazmasındaki ortalama palbosiklib f'da belirgin bir eğilim gözlenmemiştir. In vitro olarak, palbosiklibin insan hepatositlerinin içine alınması başlıca pasif difüzyon yoluyla olmuştur. Palbosiklib OATP1B1'in ya da OATP1B3'ün bir substratı değildir.
Biyotransformasyon:
In vitro ve in vivo çalışmalar, palbosiklibin insanlarda büyük ölçüde hepatik metabolizmaya uğradığını göstermiştir. 125 mg [C] palbosiklibin 125 mg tek dozunun insanlara oral yolla uygulanmasının ardından, palbosiklib için majör primer metabolik yolaklar oksidasyon ve sülfonasyon olmuştur. Açilasyon ve glukuronidasyon ise minör yolaklar olarak katkı sağlamıştır. Palbosiklib, plazmada dolaşan ve ilaç kaynaklı en büyük madde olarak bulunmuştur.
Ürünün büyük çoğunluğu metabolitler şeklinde atılmıştır. Palbosiklibin sülfamik asit konjugatı, uygulanan dozun %25,8'ini oluşturan ve dışkıda bulunan ana ilaç-ilişkili bileşen olarak saptanmıştır. İnsan hepatositleri ile gerçekleştirilen in vitro çalışmalarda, karaciğer sitozolik ve S9 fraksiyonları ve rekombinant SULT enzimleri, esas olarak CYP3A'nın ve SULT2A1'in palbosiklib metabolizmasında yer aldığını ortaya koymuştur.
Eliminasyon:
İleri meme kanseri hastalarında palbosiklibin görünür oral klirensinin (CL/F) geometrik ortalaması 63 L/saat ve plazma eliminasyon yarılanma ömrü 28,8 saat olmuştur. Tek doz oral [C] palbosiklib verilen 6 sağlıklı erkek gönüllüde, toplam uygulanan radyoaktif dozun medyan %92'si 15 gün içinde geri kazanılmış; dışkı (dozun %74'ü) ana atılım yolu olmuştur, dozun %17'si ise idrar yoluyla geri kazanılmıştır. Dışkı ve idrarda değişmemiş palbosiklib atılımı sırasıyla %2 ve %7 oranında olmuştur.
In vitro olarak klinik konsantrasyonlarda palbosiklib bir CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19
ve 2D6 inhibitörü değildir ve CYP1A2, 2B6, 2C8 ve 3A4 indükleyicisi değildir.
In vitro değerlendirmeler klinik konsantrasyonlarda pablosiklibin organik anyon taşıyıcısı (OAT)1, OAT3, organik katyon taşıyıcısı (OCT)2, organik anyon taşıyıcısı polipeptid (OATP)1B1, OATP1B3 ve safra tuzu atım pompasının (BSEP) etkileri üzerinde inhibisyon potansiyelinin düşük olduğunu göstermektedir.
Doğrusallık/Doğrusal olmayan durum:
25 mg ile 225 mg doz aralığında, EAA ve Cgenellikle doz ile doğru orantılı olarak artmaktadır.
Hastalardaki karakteristik özellikler
Yaş, Cinsiyet ve Vücut Ağırlığı:
Kanser hastası 183 kişide (yaşları 22 ile 89 arasında ve vücut ağırlıkları 38 ile 123 kg arasında değişen 50 erkek ve 133 kadın hasta) yapılan bir popülasyon farmakokinetik analizine göre cinsiyetin maruz kalınan palbosiklib seviyesine etkisi bulunmamıştır ve yaş ve vücut ağırlığının maruz kalınan palbosiklib seviyesine klinik olarak önemli bir etkisi yoktur.
Pediyatrik Popülasyon:
REAMPLA'nın farmakokinetiği, 18 yaşından küçük olan hastalar üzerinde değerlendirilmemiştir.
Karaciğer yetmezliği
Farklı derecelerde karaciğer yetmezliği olan hastalarda yapılan bir farmakokinetik çalışmadan elde edilen veriler, normal karaciğer fonksiyonuna sahip gönüllülerle karşılaştırıldığında maruz kalınan serbest palbosiklib seviyesinin (serbest EAA) hafif karaciğer yetmezliği olan gönüllülerde %17 (Child-Pugh sınıf A) düştüğü ve orta (Child-Pugh sınıf B) ve ciddi (Child- Pugh sınıf C) karaciğer yetmezliği olan hastalarda sırasıyla %34 ve %77 arttığını göstermiştir. Normal karaciğer fonksiyonuna sahip gönüllülerle karşılaştırıldığında maruz kalınan serbest palbosiklibin pik seviyesi (serbest C) hafif, orta ve ciddi karaciğer yetmezliğinde sırasıyla
%7, %38 ve %72 artmıştır. Ek olarak Ulusal Kanser Enstitüsü (NCI) sınıflamasına göre hafif karaciğer yetmezliği [total bilirubin ≤ Normalin Üst Sınırı (NÜS) ve Aspartat Aminotransferaz (AST) > NÜS ya da total bilirubin >1-1,5 Ã NÜS ve herhangi bir seviyede AST] olan 40 hastayı da kapsayan 183 ileri evre kanser hastasından oluşan bir popülasyonda yapılan farmakokinetik analize göre, hafif karaciğer yetmezliğinin palbosiklibin farmakokinetiği üzerinde etkisi bulunmamıştır.
Böbrek yetmezliği
Farklı derecelerde böbrek yetmezliği olan gönüllülerde yapılan bir farmakokinetik çalışma verileri, normal böbrek fonksiyonuna (CrCl ≥90 mL/dakika) sahip gönüllülerle karşılaştırıldığında, hafif (60 mL/dakika≤CrCl<90 mL/dakika), orta (30 mL/dakika≤CrCl<60 mL/dakika) ve ciddi (CrCl <30 mL/dakika) böbrek yetmezliği olan hastalarda maruz kalınan toplam palbosiklib seviyesinin (EAA) sırasıyla %39, %42 ve %31
arttığını göstermiştir. Normal böbrek fonksiyonuna sahip gönüllülerle karşılaştırıldığında maruz kalınan palbosiklibin pik seviyesi (C) hafif, orta ve ciddi böbrek yetmezliğinde sırasıyla %17, %12 ve %15 artmıştır. Ayrıca, 73 hafif derece ve 29 orta derecede böbrek yetmezliği olan hastayı içeren toplam 183 ileri derece kanser hastasında yapılan bir popülasyon farmakokinetik analizine göre hafif ve orta böbrek yetmezliğinin palbosiklibin farmakokinetiği üzerinde etkisi bulunmamıştır. Palbosiklibin farmakokinetiği hemodiyaliz gerektiren hastalarda incelenmemiştir.
Etnik köken
Sağlıklı gönüllülerde yapılan bir farmakokinetik çalışmasında, tek bir oral dozdan sonra Asyalı olmayan gönüllülerle karşılaştırıldığında palbosiklibin EAAve Cdeğerleri Japon hastalarda sırasıyla %30 ve %35 daha yüksek bulunmuştur. Bununla birlikte bu bulgu, Japon ya da Asyalı meme kanseri hastalarında yapılan sonraki çalışmalarda birden fazla doz verildikten sonra tutarlı bir şekilde tekrarlanmamıştır. Asyalı ve Asyalı olmayan popülasyonlardaki kümülatif farmakokinetik, güvenlilik ve etkililik verilerin analizine göre, Asya ırkı için doz ayarlaması yapılmasının gerekmediği değerlendirilmektedir.
5.3. Klinik öncesi güvenlilik verileri
Sıçanlarda ve köpeklerde gerçekleştirilen 39 haftaya kadar süren çalışmalarda insanlarla potansiyel ilişkisi olabilecek primer hedef organ bulguları arasında hematolenfopoietik ve erkek üreme organı etkileri bulunmuştur. Yalnızca sıçanlarda yapılan ≥15 hafta süreli çalışmalarda glikoz metabolizması üzerindeki etkiler pankreastaki bulgularla ve gözde, dişlerde, böbrekte ve yağ dokusunda ikincil etkiler ile ilişkili bulunmuştur ve sıçanlarda kemik değişiklikler yalnızca 27 haftalık doz uygulanmasını takiben oluşmuştur. Bu sistemik toksik etkiler genel olarak EAA'ya göre klinik dozlarda maruz kalınan seviyelerde görülmüştür. Ek olarak, telemetrik olarak takip edilen köpeklerde C'a göre insanda klinik olarak maruz kalınan seviyelerin 4 katı seviyelerde kardiyovasküler etkiler (QTc uzaması, kalp atım hızında azalma ve RR aralığında ve sistolik kan basıncında artış) belirlenmiştir. 12 haftalık bir süreyle doz uygulanmadığında glikoz homeostazı, pankreas, göz, böbrek ve kemik üzerindeki etkilerin geri dönüşlü olduğu gösterilememiştir, ancak hematolenfopoietik ve erkek üreme sistemleri, dişler ve yağ dokusu üzerindeki etkilerin kısmen ya da tamamen geri döndüğü gözlenmiştir.
Karsinojenite
Palbosiklib, 6 aylık bir transgenik fare ve 2 yıllık bir sıçan çalışmasında karsinojenisite açısından değerlendirilmiştir. Palbosiklib, transgenik farelerde 60 mg/kg/gün dozuna kadar karsinojenisite açısından negatif bulunmuştur (Etki gözlenmeyen düzey [NOEL] EAA'ya göre insan klinik maruziyetinin yaklaşık 11 katı). Palbosiklib ile ilişkili neoplastik bulgular arasında 30 mg/kg/gün dozda erkek sıçanların merkezi sinir sisteminde mikroglial hücre tümörlerinin sıklığında artışı içermekte olup; dişi sıçanlarda 200 mg/kg/gün'e kadar herhangi bir dozda neoplastik bulguya rastlanmamıştır. Palbosiklib ile ilgili karsinojenisite etkilerine ilişkin NOEL, erkek ve dişilerde sırasıyla 10 mg/kg/gün (EAA'ya göre insan klinik maruziyetinin yaklaşık 2 katı) ve 200 mg/kg/gün (EAA'ya göre insan klinik maruziyetinin yaklaşık 4 katı) olmuştur. Erkek sıçan neoplastik bulgularının insanlarla ilişkisi bilinmemektedir.
Genotoksisite
Bir bakteriyel ters mutasyon (Ames) analizinde palbosiklib mutajenik bulunmamıştır ve in vitro insan lenfosit kromozumu anormalliği analizinde yapısal bir kromozom anomalisini indüklememiştir.
Palbosiklib ≥100 mg/kg/gün dozlarında in vitro olarak Çin Hamsteri Over hücrelerinde ve erkek sıçan kemik iliği hücrelerinde anöjenik bir mekanizmayla mikroçekirdekleri indüklemiştir. EAA'ya göre hayvanların maruz kaldığı anöjenisite için etki gözlenmeyen düzey, insan klinik maruziyet dozları ile karşılaştırıldığında yaklaşık 7 kat yüksektir.
Fertilitenin bozulması
Palbosiklib 300 mg/kg/gün dozuna (EAA'ya göre insan klinik maruziyetinin yaklaşık üç katı) kadar test edilen herhangi bir dozda dişi sıçanlarda çiftleşme ve fertiliteyi etkilememiştir ve tekrarlayan doz toksisite çalışmasında sıçanlarda 300 mg/kg/gün ve köpekte 3 mg/kg/gün dozlarına (EAA'ya göre insan klinik maruziyetinin sırasıyla yaklaşık 5 ve 3 katı) kadar dişi üreme organlarında advers etki gözlenmemiştir.
Sıçanlarda ve köpeklerde saptanan klinik dışı bulgulara dayanarak palbosiklibin erkek bireylerde üreme fonskiyonunu ve fertilitesini bozma potansiyeli olduğu düşünülmektedir. Testiste, epididimde, prostatta ve seminal vezikülde palbosiklibe bağlı bulgular arasında organ ağırlığında azalma, atrofi veya dejenerasyon, hipospermi, tübül içinde hücre artıklarının birikmesi, sperm hareketliliğinde ve yoğunluğunda azalma ve sekresyonda azalma vardır. Bu bulgular, sıçanlarda ve/veya köpeklerde; EAA'ya göre insan klinik maruziyetinden sırasıyla ≥9 kat daha yüksek ya da subterapötik dozlarda gözlenmiştir. Sıçanlarda ve köpeklerde sırasıyla 4 ve 12 hafta süreyle doz uygulanmadığında erkek üreme organı üzerindeki etkilerde kısmi olarak geri dönüş gözlenmiştir. Erkek üreme organı bulgularına karşın, EAA'ya göre insan klinik maruziyetinden 13 kat daha yüksek seviyelerde erkek sıçanların çiftleşme ve fertilitesi üzerinde etki saptanmamıştır.
Gelişimsel toksisite
Palbosiklib, hücre döngüsünün düzenlenmesinde rol alan siklin bağımlı kinaz 4 ve 6'nın geri dönüşlü inhibitörüdür. Bu nedenle eğer gebelik sırasında kullanılırsa fetüsün zarar görme riski vardır. Palbosiklibin gebe hayvanlarda fetotoksik olduğu saptanmıştır. ≥100 mg/kg/gün dozlarda sıçanlarda iskelet değişikliği (yedinci servikal vertebrada kot sıklığında artış) sıklığında artış gözlenmiştir. Sıçanlarda anneye toksik olan 300 mg/kg/gün dozda (EAA'ya göre insan klinik maruziyetinin 3 katı) fetal vücut ağırlığında azalma gözlenirken tavşanlarda anneye toksik olan 20 mg/kg/gün dozda (EAA'ya göre insan klinik maruziyetinin 4 katı) ön bacaklarda falanksların küçük olması dahil iskelet değişiklikleri sıklığında artış gözlenmiştir. Fetüsün gerçekte maruz kaldığı seviye ve çapraz-plasenta transferi incelenmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mikrokristalin selüloz (PH102) |
Laktoz monohidrat (Ürün sığır kaynaklı laktoz monohidrat içermektedir) |
Sodyum nişasta glikolat (Type A) (Ürün patates kaynaklı nişasta içermektedir) |
Kolloidal silikon dioksit |
Magnezyum stearat |
Jelatin Kapsül Kılıfı |
Jelatin (Ürün sığır kaynaklı jelatin içermektedir) |
Kırmızı demir oksit (E172ii) |
Sarı demir oksit (E172iii) |
Titanyum Dioksit (E171) |
Baskı Mürekkebi |
Şellak (Ürün böcek kaynaklı şellak içermektedir) |
Etanol |
Titanyum dioksit |
İzopropil alkol |
Amonyum hidroksit |
N-Butil Alkol |
Propilen glikol (E1520) |
Simetikon |
6.2. Geçimsizlikler
Bilinen bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
75, 100, 125 mg kapsüller
1 boyutunda, opak, açık turuncu gövdesi ve karamel kapağı olan, kapak üzerinde beyaz
mürekkep ile âPfizerâ ve gövde üzerinde âPBC 100â yazılı 7 veya 21 adet sert jelatin kapsül.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikleriâne uygun olarak imha edilmelidir.
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| REAMPLA | 8681308091338 | 24,406.53TL |
| REPALBO | 8699511091809 | 15,932.04TL |
| Diğer Eşdeğer İlaçlar |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Satış Fiyatı | 24406.53 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 24406.53 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308150028 |
| Etkin Madde | Palbosiklib |
| İthal ( ref. ülke : Belcika ) ve Beşeri bir ilaçdır. |