RELVAR ELLIPTA 100/25 mcg kullanıma hazır inhilasyon tozu 30 doz Kısa Ürün Bilgisi
{ Flutikazon Furoate + Vilanterol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
RELVAR ELLIPTA 100/25 mikrogram kullanıma hazır inhalasyon tozu
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir tekli inhalasyon:
Flutikazon Furoat 100 mikrogram (cihazdan salınan doz: 92 mcg)
Vilanterol (trifenatat olarak).................. 25 mikrogram (40 mikrogram vilanterol trifenatata
eşdeğerdir, cihazdan salınan vilanterol dozu: 22 mcg)
Yardımcı maddeler
Her bir doz yaklaşık olarak 25 mg laktoz (monohidrat olarak) içerir (inek sütünden elde edilir).
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Kullanıma hazır inhalasyon tozu.
Soluk mavi renkli bir inhaler kapağı ve dahili bir doz sayacı olan açık gri inhaler. ELLIPTA İnhaler, her biri beyaz bir toz içeren 30 veya 14 dozluk iki adet blister şerit içermektedir. Blister şeritlerden biri her dozda 100 mikrogram flutikazon furoat, diğeri her dozda 25 mikrogram vilanterol içerir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAH olgularında semptomları ve atak sıklığını azaltır.
4.2. Pozoloji ve uygulama şekli
Astım
Yetişkinler ve 12 yaş ve üzeri adolesanlar Önerilen doz,
günde bir defa RELVAR ELLIPTA 100/25 mikrogram inhalasyonu veya
günde bir defa RELVAR ELLIPTA 200/25 mikrogram inhalasyonudur.
Bir uzun etkili beta-agonist ile kombinasyon halinde düşük ila orta doz bir inhale kortikosteroid dozuna ihtiyaç duyan 12 yaş ve üzeri adolesanlar ve yetişkinler için 100/25 mikrogramlık RELVAR ELLIPTA başlangıç dozu düşünülmelidir. RELVAR ELLIPTA 100/25 mikrogram dozlarında hastaların yeterli düzeyde kontrol edilmemesi durumunda, doz, astım kontrolünde ek bir iyileşme sağlayabilecek olan 200/25 mikrogram düzeyine çıkarılabilir.
Dozlar arasındaki dönemde semptomlar görülürse, anında rahatlama sağlamak için inhale bir kısa etkili beta-agonist alınmalıdır.
Uyguladıkları flutikazon furoat/vilanterol dozunun optimal düzeyde kalmasını ve yalnızca hekim önerisi ile değiştirilmesini sağlamak için hastalar hekimleri tarafından düzenli olarak tekrar değerlendirilmelidir. Doz, etkin semptom kontrolü sağlayan en düşük doza ayarlanmalıdır.
Bir uzun etkili beta-agonist ile kombinasyon halinde daha yüksek bir inhale kortikosteroid dozuna ihtiyaç duyan 12 yaş ve üzeri adolesanlar ve yetişkin astım hastaları için 200/25 mikrogram RELVAR ELLIPTA dozu düşünülmelidir.
Astımlı hastalara, hastalıklarının şiddetine göre uygun flutikazon furoat dozunu ihtiva eden RELVAR ELLIPTA dozu verilmelidir. Hekimler, astım hastalarında, günde bir kez 100 mikrogram flutikazon furoat'ın, günde iki kez alınan 250 mikrogram flutikazon propiyonata; günde bir kez alınan 200 mikrogram flutikazon furoatın ise günde iki kez alınan 500 mikrogram flutikazon propiyonata yaklaşık olarak eşdeğer olduğu konusunda bilgilendirilmelidir.
KOAH
18 yaş ve üzeri yetişkinler
Önerilen doz günde bir defa RELVAR ELLIPTA 100/25 mikrogram inhalasyonudur.
Hastalar genellikle, RELVAR ELLIPTA inhalasyonundan sonra 16-17 dakika içinde akciğer fonksiyonunda bir iyileşme yaşamaktadır.
Uygulama şekli:
RELVAR ELLIPTA, yalnızca inhalasyon içindir. RELVAR ELLIPTA, her gün aynı saatte uygulanmalıdır.
İnhalasyonun ardından hasta yutmadan suyla ağzını çalkalamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Bu popülasyonda herhangi bir doz ayarlaması gerekmemektedir (bkz. Bölüm 5.2).
Karaciğer yetmezliği:
Hafif, orta ve şiddetli düzeyde karaciğer yetmezliği bulunan hastalarda gerçekleştirilen çalışmalar, sistemik flutikazon furoat maruziyetinde bir artış olduğunu göstermiştir (Cve EAA) (bkz. Bölüm 5.2).
Karaciğer yetmezliği bulunan hastalarda dozun ayarlanması konusunda dikkatli olunmalıdır. Karaciğer yetmezliği görülen hastalarda kortikosteroidlerle ilgili sistemik yan etki riski daha fazla olabilir.
Orta veya şiddetli karaciğer yetmezliği bulunan hastalarda maksimum doz 100/25 mikrogram
olmalıdır (bkz. Bölüm 4.4).
Pediyatrik popülasyon:
Astım
RELVAR ELLIPTA'nın 12 yaşın altındaki çocuklarda güvenliliği ve etkililiği henüz kanıtlanmamıştır.
KOAH
KOAH endikasyonunda, 18 yaş altı popülasyonda RELVAR ELLIPTA kullanımı geçerli değildir.
Geriyatrik popülasyon:
Bu popülasyonda herhangi bir doz ayarlaması gerekmemektedir (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
RELVAR ELLIPTA,
şiddetli süt proteini alerjisi bulunan ya da
4.4. Özel kullanım uyarıları ve önlemleri
Alevlenmeler
RELVAR ELLIPTA, akut astım semptomlarının giderilmesi için ya da kısa etkili bir bronkodilatör gerektiren KOAH'ta görülen bir akut alevlenmenin tedavisinde kullanılmamalıdır. Semptomları rahatlatmak için artan kısa etkili bronkodilatör kullanımı, kontrolün bozulduğunu göstermektedir ve hastalar bir hekim tarafından muayene edilmelidir.
Tedaviye son verilmesinin ardından semptomlar yeniden görülebileceğinden, hastalar hekim gözetimi olmadan astım ya da KOAH'ta RELVAR ELLIPTA tedavisini bırakmamalıdır.
RELVAR ELLIPTA tedavisi sırasında astımla ilgili yan etkiler ya da alevlenmeler görülebilir. Astım semptomlarının RELVAR ELLIPTA tedavisinin başlamasının ardından kontrol altına alınamaması ya da kötüleşmesi durumunda, hastalara tedaviye devam etmeleri ancak bir hekime danışmaları söylenmelidir.
Paradoksal bronkospazm
Diğer inhalasyon tedavilerinde de olduğu gibi, dozlam sonrasında hırıltıda görülen ani bir artış ile paradoksal bronkospazm oluşabilir. Bu durum, derhal kısa etkili bir inhale bronkodilatör ile tedavi edilmelidir. RELVAR ELLIPTA tedavisi derhal kesilmeli, hasta muayene edilmeli ve gerekirse alternatif bir tedavi uygulanmalıdır.
Kardiyovasküler etkiler
RELVAR ELLIPTA dahil sempatomimetik ilaçlar ile birlikte supraventriküler taşikardi ve ekstrasistoller gibi kardiyak aritmileri içeren kardiyovasküler etkiler görülebilir. Kardiyovasküler hastalık geçmişi ya da yüksek kardiyovasküler hastalık riski olan hastalar ile yapılan bir plasebo kontrollü çalışmada, flutikazon furoat/vilanterol kullanan hastalarda plasebo kullanan hastalara kıyasla kardiyovasküler ve ciddi kardiyovasküler etkilerde veya kardiyovasküler ölüm riskinde herhangi bir artış görülmemiştir (bkz. Bölüm 5.1). Ancak RELVAR ELLIPTA, şiddetli kardiyovasküler hastalık veya kalp ritim anomalileri, tirotoksikoz, düzeltilmemiş hipokalemi veya düşük serum potasyum meyili görülen hastalarda dikkatli şekilde kullanılmalıdır.
Hepatik yetmezliği olan hastalar
![]()
Orta ile ciddi hepatik yetmezliği olan hastalar için, 100/25 mikrogram dozu kullanılmalıdır ve hastalar, sistemik kortikosteroid ile ilişkili istenmeyen etkiler için izlenmelidirler (bkz. Bölüm 4.2 ve 5.2).
Sistemik kortikosteroid etkileri
Uzun süreler için reçete edilmiş yüksek dozlar başta olmak üzere, tüm inhale kortikosteroidler ile sistemik etkiler görülebilir. Bu etkilerin, oral kortikosteroidlere kıyasla görülme olasılığı daha düşüktür. Olası sistemik etkiler, Cushing sendromu, Cushingoid özellikler, adrenal süpresyonu, kemik mineral yoğunluğunda azalma, çocuklarda ve adolesanlarda büyüme geriliği, katarakt ve glokom ve daha seyrek olarak psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon ya da agresyonu (özellikle çocuklarda) içeren psikolojik ya da davranışsal etkilerdir.
Kortikosteroid içeren tüm ilaçlarla olduğu gibi RELVAR ELLIPTA, pulmoner tüberküloz ya da kronik ya da tedavi edilmemiş enfeksiyonlar görülen hastalarda dikkatli şekilde kullanılmalıdır.
Görme bozuklukları
Sistemik ve topikal kortikosteroid kullanımında görme bozuklukları rapor edilebilir. Bir hastada bulanık görüş veya diğer görme bozukluğu şikayetleri varsa hasta, sistemik ve topikal kortikosteroid kullanımı sonrası bildirilen katarakt, glokom veya santral seröz korioretinopati (CSCR) gibi olası nedenlerin değerlendirilmesi için oftalmoloji uzmanına yönlendirilmelidir.
Hiperglisemi
Diabetes mellitus öyküsü olan hastalarda kan glukoz düzeylerinde artış bildirilmiştir. Diabetes mellitus hikayesi olan hastalara reçete edilirken bu durum göz önünde bulundurulmalıdır.
KOAH hastalarında pnömoni
Kortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dâhil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoni riskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarak gösterilmemiştir.
Kortikosteroid içeren inhale ilaçlarının pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır.
Hekimler, KOAH hastalarında olası pnomöni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatli olmalıdırlar.
KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır.
Astım hastalarında pnömoni
Astım hastalarında görülen pnömoni insidansı yüksek dozda yaygındır. RELVAR ELLIPTA 200/25 mikrogram uygulanan astım hastaları, RELVAR ELLIPTA 100/25 mikrogram ya da plasebo uygulanan hastalara kıyasla artan bir pnömoni riskine sahip olabilir. Herhangi bir risk faktörü tanımlanmamıştır.
Yardımcı maddeler
Bu tıbbi ürün laktoz içermektedir. Galaktoz intoleransı, Lapp laktaz eksikliği veya glukoz- galaktoz malabsorpsiyonu gibi nadir genetik hastalığı olan hastalarda kullanılmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İnhale dozlamın ardından elde edilen düşük plazma konsantrasyonlarından dolayı klinik dozlarda RELVAR ELLIPTA'ya bağlı klinik olarak anlamlı ilaç etkileşimlerinin olası olmadığı düşünülmektedir.
Beta-blokerlerle etkileşim
Beta-adrenerjik blokerler, beta-adrenerjik agonistlerin etkisini zayıflatabilir ya da antagonize edebilir. Kullanımları için güçlü nedenler bulunmadıkça, selektif olmayan ve selektif beta adrenerjik blokerlerin eşzamanlı olarak kullanılmasından kaçınılmalıdır.
CYP3A4 inhibitörleri ile etkileşim
Flutikazon furoat ve vilanterol, CYP3A4 enziminin aracılık ettiği karaciğerdeki kapsamlı ilk geçiş metabolizması ile hızlı şekilde vücuttan uzaklaştırılmaktadır.
Sistemik flutikazon furoat ve vilanterol maruziyeti, advers reaksiyon potansiyelinde bir artışa yol açacak şekilde yükselebileceğinden, güçlü CYP3A4 inhibitörleri (örn. ketokonazol, ritonavir, kobisistat içeren ürünler) ile birlikte uygularken dikkatli olunmalıdır. Tedaviden beklenen fayda, sistemik kortikosteroid yan etki riskinden fazla olmadıkça birlikte kullanılmamalıdır; birlikte kullanım durumunda hasta sistemik kortikosteroid yan etkileri açısından takip edilmelidir.
Bir CYP3A4 ilaç etkileşimi çalışması, flutikazon furoat/ vilanterol kombinasyonu (200/25 mikrogram) ve güçlü CYP3A4 inhibitörü ketokonazol (400 mg) ile sağlıklı gönüllülerde gerçekleştirilmiştir. Birlikte uygulama, ortalama flutikazon furoat EAAve C'ı sırasıyla %36 ve %33 oranında arttırmıştır. Flutikazon furoat maruziyetindeki artış, 0-24. saatteki ağırlıklı ortalama serum kortizolünde %27 azalma ile ilişkilendirilmiştir. Birlikte uygulama, ortalama vilanterol EAA ve C'ı sırasıyla %65 ve %22 oranında arttırmıştır. Vilanterol maruziyetindeki artış; kalp atış hızı, kan potasyumu veya QTcF aralığı üzerindeki betaagonist ile ilgili sistemik etkilerde herhangi bir artış ile ilişkilendirilmemiştir.
P-glikoprotein inhibitörleri ile etkileşim
Flutikazon furoat ve vilanterol, P-glikoprotein substratlarıdır (P-gp). Vilanterol ve güçlü P-gp ve orta düzeyde CYP3A4 inhibitörü verapamilin birlikte uygulandığı, sağlıklı gönüllülerde gerçekleştirilen bir klinik farmakoloji çalışması, vilanterolün farmakokinetiği üzerinde herhangi anlamlı bir etki göstermemiştir. Spesifik bir P-gp inhibitörü ve flutikazon furoat ile klinik farmakoloji çalışmaları gerçekleştirilmemiştir.
Sempatomimetik ilaçlar
Diğer sempatomimetik ilaçlar ile eş zamanlı kullanım (tek başına veya kombinasyon terapisinin bir bölümü olarak) RELVAR ELLIPTA'nın istenmeyen etki potansiyelini artırabilir. RELVAR ELLIPTA, diğer uzun etkili betaadrenerjik agonistlerle veya uzun etkili betaadrenerjik agonistleri içeren ilaçlarla birlikte kullanılmamalıdır.
Pediyatrik popülasyon
Etkileşim çalışmaları yalnızca yetişkinlerde yapılmıştır.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur.
Gebelik dönemi
Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Flutikazon furoat/vilanterol'ün gebe kadınlarda kullanımına ilişkin sınırlı veri mevcuttur. RELVAR ELLIPTA gerekli olmadıkça gebelik döneminde kullanılmamalıdır. RELVAR ELLIPTA'nın gebe kadınlara uygulanması, ancak anneye yönelik beklenen yararı fetüse yönelik potansiyel riskten daha fazla olduğunda düşünülmelidir.
Laktasyon dönemi
Flutikazon furoat ya da vilanterol ya da metabolitlerinin insan sütüne geçişine ilişkin yeterli bilgi mevcut değildir. Bununla birlikte, diğer kortikosteroidler ve beta-agonistleri insan sütünde tespit edilmiştir (bkz. Bölüm 5.3). Emzirme çağındaki yeni doğanlara/bebeklere yönelik risk göz ardı edilemez.
Emzirmenin bebeğe ve tedavinin anneye yararı dikkate alınarak emzirmenin kesilmesi ya da
RELVAR ELLIPTA tedavisinin kesilmesi konusunda bir karara varılmalıdır.
Üreme yeteneği/Fertilite
İnsanlarda fertiliteye ilişkin veriler mevcut değildir. Hayvan çalışmaları RELVAR ELLIPTA'nın fertilite üzerinde herhangi bir etki oluşturmadığını göstermiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
RELVAR ELLIPTA'nın araç ve makine kullanma yeteneği üzerinde etkisi yoktur ya da önemsizdir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Kapsamlı astım ve KOAH klinik çalışmalarından elde edilen veriler, RELVAR ELLIPTA ile ilgili yan etkilerin sıklığını belirlemek amacıyla kullanılmıştır. Astım klinik gelişim programında, yan etkilerin entegre bir değerlendirmesinde toplam 7.034 hasta yer almıştır. KOAH klinik gelişim programında, yan etkilerin entegre bir değerlendirmesinde toplam 6.237 hasta yer almıştır.
Flutikazon furoat ve vilanterol ile en yaygın rapor edilen advers etkiler baş ağrısı ve nazofarenjit olmuştur. Pnömoni ve kırık haricinde, güvenlilik profili astım ve KOAH hastalarında benzer bulunmuştur. Klinik çalışmalar sırasında, pnömoni ve kırık vakaları KOAH hastalarında daha sık şekilde gözlenmiştir.
Aşağıda istenmeyen etkiler MedDRA vücut organ sistem sınıflandırması ve sıklığa göre liste halinde sunulmaktadır. İstenmeyen etkilerin sınıflandırılması için aşağıdaki sınıflandırma ölçeği kullanılmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her sıklık derecesi grubunda yan etkiler azalan ciddiyet sırasına göre sunulmaktadır.
Enfeksiyonlar ve enfestasyonlar
Yaygın: Pnömoni* (KOAH'lı hastalarda), üst solunum yolu enfeksiyonu, bronşit, grip, ağızda ve boğazda kandidiyazis
Bağışıklık sistemi hastalıkları
Seyrek: Anaflaksi, anjiyoödem, kaşıntı, ürtiker dahil hipersensitivite reaksiyonları
Metabolizma ve beslenme hastalıkları
Yaygın olmayan: Hiperglisemi
Psikiyatrik hastalıklar
Seyrek: Anksiyete
Sinir sistemi hastalıkları
Çok yaygın: Baş ağrısı
Seyrek: Tremor
Göz hastalıkları
Yaygın olmayan: Bulanık görme (bkz. Bölüm 4.4)
Kardiyak hastalıklar
Yaygın olmayan: Ekstrasistoller
Seyrek: Palpitasyonlar, taşikardi
Solunum, göğüs hastalıkları ve mediastinal hastalıklar
Çok yaygın: Nazofarenjit
Yaygın: Orofaringeal ağrı, sinüzit, faranjit, rinit, öksürük, disfoni Seyrek: Paradoksal bronkospazm
Gastrointestinal hastalıklar
Yaygın: Karın ağrısı
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Artralji, sırt ağrısı, kırıklar**, kas spazmları
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Pireksi
*, **Aşağıdaki â€œİşaretlenmiş yan etkilerin açıklamaları†başlığına bakınız.
İşaretlenmiş yan etkilerin açıklamaları
*Pnömoni (bkz. Bölüm 4.4)
Bir önceki yılda alevlenme öyküsü olan orta ila ciddi KOAH hastalarında (n=3255, bronkodilatör-sonrası ortalama FEVölçümü beklenenin %45'i, standart sapma (SD) %13) yürütülen birer yıllık, tekrarlıi kiça lışmanınbütünleşika nalizinde, 1.000 hasta yılında
pnömoni olay sayısı 200/25 mikrogram flutikazon furoat/vilanterol'de 97,9, 100/25
mikrogram flutikazon furoat/vilanterol'de 85,7 ve 25 mikrogram vilanterol'de 42,3 olmuştur.
1.000 hasta yılında şiddetli pnömoni için bu olay sayıları sırasıyla 33,6, 35,5 ve 7,6 olmuştur.
1.000 hasta yılında ciddi pnömoni olay sayısı 200/25 mikrogram flutikazon furoat/vilanterol'de 35,1, 100/25 mikrogram flutikazon furoat/vilanterol'de 42,9 ve 25 mikrogram vilanterol'de 12,1 olmuştur. Son olarak, maruziyet-ayarlı fatal pnömoni vakaları 200/25 mikrogram flutikazon furoat/vilanterol'de 8,8, 100/25 mikrogram flutikazon furoat/vilanterol'de 1,5 ve 25 mikrogram vilanterol'de 0 olmuştur.
Kardiyovasküler hastalık öyküsü veya artmış kardiyovasküler hastalık riski olan orta şiddette KOAH (bronkodilatör-sonrası ortalama FEVölçümü beklenenin %60'ı, standart sapma (SD)
%6) hastalarında yürütülen plasebo-kontrollü bir çalışmada (SUMMIT), flutikazon furoat/vilanterol (FF/VI), flutikazon furoat (FF), vilanterol (VI) ve plasebo ile pnömoni insidansı (sırasıyla): advers etkiler (%6, %5, %4, %5); ciddi advers etkiler (%3, %4, %3, %3);
pnömoni nedenli olduğuna karar verilen tedavi sırasında ölümler (%0,3, %0,2, %0,1, %0,2) olmuş; ayarlanmış maruziyet oranları (1.000 tedavi yılında, sırasıyla): advers etkiler (39,5, 42,4, 27,7, 38,4); ciddi advers etkiler (22,4, 25,1, 16,4, 22,2); pnömoni nedenli olduğuna karar
verilen tedavi sırasında ölümler (1,8, 1,5, 0,9, 1,4) olmuştur.
Astım hastalığına ilişkin 11 çalışmanın bütünleşik analizinde (7.034 hasta), 1.000 hasta yılında pnömoni insidansı 200/25 mikrogram flutikazon furoat/vilanterol'de 18,4, 100/25 mikrogram flutikazon furoat/vilanterol'de 9,6 ve plasebo grubunda 8,0 olmuştur.
**Kırıklar
İki adet tekrarlı 12 aylık çalışmada, toplam 3.255 KOAH hastasında genel kemik kırıkları insidansı tüm tedavi gruplarında düşük bulunmuştur ve vilanterol 25 mikrogram grubuna (<%1) kıyasla tüm RELVAR ELLIPTA gruplarında daha yüksek bir insidans görülmüştür (%2). Vilanterol 25 mikrogram grubuna kıyasla RELVAR ELLIPTA gruplarında daha fazla kırık görülmesine rağmen, tipik olarak kortikosteroid kullanımı ile ilgili kırıklar (örn. omurilik sıkışması/torakolomber vertebral kırıklar, kalça ve asetabular kırıkları) RELVAR ELLIPTA ve vilanterol tedavi gruplarının <%1'inde görülmüştür.
SUMMIT çalışması için, FF/VI, FF, VI ve plasebo ile tüm kırık olaylarının insidansı her iki kolda da %2 olmuştur; genellikle inhale kortikosteroid ile ilişkilendirilen kırıklar her iki kolda da %1'den az olmuştur. Tüm kırık olayları için maruziyet-ayarlı oranlar (1.000 hasta yılında) sırasıyla 13,6, 12,8, 13,2 ve 11,5 olmuştur; genellikle inhale kortikosteroid ile ilişkilendirilen
kırıklar için sırasıyla 3,4, 3,9, 2,4 ve 2,1'dir.
Astım hastalığına ilişkin 11 çalışmanın bütünleşik analizinde (7.034 hasta), kırık insidansı
%1'den az olmuştur ve genellikle travmayla ilişkilendirilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Semptom ve belirtiler
RELVAR ELLIPTA doz aşımı, ilacın içeriğindeki her bir bileşenin etkilerinden kaynaklanan ve diğer beta-agonistlerinin doz aşımı ile birlikte görülen ve bilinen inhale kortikosteroid sınıf etkileri ile benzer olan belirti ve semptomlar oluşturabilir (bkz. Bölüm 4.4).
Tedavi
RELVAR ELLIPTA doz aşımı için herhangi bir spesifik tedavi mevcut değildir. Doz aşımı görülmesi halinde, gerektiği şekilde uygun izleme önlemleri ile destekleyici tedavi uygulanmalıdır.
Kardiyoselektif beta-blokaj yalnızca, klinik olarak anlamlı ve destekleyici önlemlere yanıt vermeyen belirgin vilanterol doz aşımı etkilerinde kullanılmalıdır. Kardiyoselektif beta-bloke edici ilaçlar, bronkospazm öyküsü bulunan hastalarda dikkatli şekilde kullanılmalıdır.
Ayrıca ulusal zehir merkezlerinin önerilerine uygun olarak veya klinik koşulların gerektirdiği şekilde ek tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif hava yolu hastalıkları için ilaçlar, antikolinerjikler hariç kortikosteroid veya diğer ilaçlarla birlikte adrenerjikler
ATC kodu: R03AK10
Etki mekanizması:
Flutikazon furoat ve vilanterol, iki ilaç sınıfını temsil etmektedir (sentetik bir kortikosteroid ve selektif, uzun etkili bir beta-reseptör agonisti).
Farmakodinamik etkiler:
Flutikazon furoat
Flutikazon furoat, potent anti-enflamatuar etkiye sahip bir sentetik, triflorlu kortikosteroiddir. Flutikazon furoat'ın astım ve KOAH semptomları üzerindeki etkisine dair kesin mekanizma bilinmemektedir. Kortikosteroidlerin, çoklu hücre tipleri (örn. eozinofiller, makrofajlar, lenfositler) ve mediatörler (örn. enflamasyonda görülen sitokinler ve kemokinler) üzerinde çok çeşitli etkilere sahip oldukları görülmüştür.
Vilanterol trifenatat
Vilanterol trifenatat, bir selektif uzun etkili beta-adrenerjik agonisttir (LABA).
Vilanterol trifenatat dahil olmak üzere beta-adrenoseptör agonisti etkin maddelerin farmakolojik etkileri, en azından kısmen de olsa adenozin trifosfatın (ATP) siklik-3′, 5′- adenozin monofosfata (siklik AMP) dönüşmesini katalize eden enzim olan intrasellüler adenilat siklazın stimülasyonu ile ilişkilendirilebilir. Artan siklik AMP düzeyleri bronşiyal düz kasın gevşemesine ve özellikle mast hücreler olmak üzere hücrelerden ani aşırı duyarlılık mediatörlerinin salıverilmesinin inhibe edilmesine neden olmaktadır.
Kortikosteroidler ve LABA'lar arasında moleküler etkileşimler gerçekleşmektedir. Bunun sonucunda steroidler, reseptör sayısında ve hassasiyetinde artışla sonuçlanacak şekilde beta- reseptör genini aktive etmektedir veLABA'lar, steroidebağlı aktivasyon için glukokortikoid
reseptörünü hazırlamakta ve hücre nükleer translokasyonunu arttırmaktadır. Bu sinerjistik etkileşimler artmış anti-enflamatuar aktivite ile sonuçlanmaktadır. Bu aktivite, astım ve KOAH'ın patofizyolojisi ile ilgili çeşitli enflamatuar hücrelerde in vitro ve in vivo olarak gösterilmiştir. KOAH hastalarından alınan periferik mononükleer kan hücrelerinde, klinik dozlarda elde edilen konsantrasyonlarda tek başına flutikazon furoatla karşılaştırıldığında flutikazon furoat/vilanterol kombinasyonunda daha fazla anti-enflamatuar etki görülmüştür. LABA bileşiğinin artmış anti-enflamatuvar etkisi diğer inhale kortikosteroid/LABA (İKS/LABA) kombinasyonlarında görülene benzerdir.
Klinik etkililik ve güvenlilik:
Astım
Farklı sürelere sahip üç adet faz III randomize, çift kör çalışmada (HZA106827, HZA106829 ve HZA106837), dirençli astım görülen yetişkin ve adolesanlarda RELVAR ELLIPTA'nın güvenliliği ve etkililiği değerlendirilmiştir. Tüm hastalar, 1. vizit öncesinde en az 12 hafta boyunca LABA ile ya da LABA olmadan bir IKS (inhale kortikosteroid) kullanmaktaydı.
HZA106837 çalışmasında, tüm hastalar 1. vizitten bir yıl önce oral kortikosteroidlerle tedavi
gerektiren en az bir alevlenme yaşamıştır.
HZA106827 çalışması 12 hafta sürmüştür ve bu çalışmada, tümü günde bir kez uygulanmak üzere plaseboya kıyasla [n=203], RELVAR ELLIPTA 100/25 mikrogram [n=201] ve FF (flutikazon furoat) 100 mikrogram [n=205] dozlarının etkililiği değerlendirilmiştir.
HZA106829 çalışması 24 hafta sürmüş ve bu çalışmada, günde iki kez uygulanan 500 mikrogram flutikazon propiyonata (FP) [n=195] kıyasla her ikisi de günde bir kez uygulanan RELVAR ELLIPTA 200/25 mikrogram [n=197] ve FF 200 mikrogram [n=194] tedavilerinin etkililiği değerlendirilmiştir.
HZA106827/HZA106829 çalışmasında ko-primer etkililik sonlanım noktaları, tüm gönüllülerde başlangıca kıyasla tedavi periyodunun sonunda klinik vizit en düşük (bronkodilatör öncesi ve doz öncesi) FEV'de meydana gelen değişiklik ve tedavi periyodunun sonunda bir gönüllü alt grubunda dozdan sonraki 0-24 saatlik periyotta hesaplanan ağırlıklı ortalama seri FEVidi. Tedavi sırasında kurtarma ilacı kullanılmayan 24 saatlik periyotların yüzdesinde başlangıca kıyasla görülen değişiklik, güçlendirilmiş bir sekonder sonlanım noktası idi. Bu çalışmalarda görülen primer ve önemli sekonder sonlanım noktalarına yönelik sonuçlar Tablo 1'de açıklanmaktadır.
Tablo 1 - HZA106827 ve HZA106829 çalışmalarındaki primer ve önemli sekonder sonlanım noktalarının sonuçları
Çalışma No | HZA 106829 | HZA106827 | ||
FF/VI Tedavi Dozu* | Günde bir kez | Günde bir kez | Günde bir kez | Günde bir kez 100/25 |
(mikrogram) | 200/25 FF/VI'e | 200/25 FF/VI'e | 100/25 FF/VI'e | FF/VI'e |
| karşılık | karşılık | karşılık | karşılık |
| Günde bir kez FF | Günde iki kez FP | Günde bir kez FF | Günde bir kez |
| 200 | 500 | 100 | plasebo |
Dip FEV'de Başlangıca Kıyasla Görülen Değişiklik Son Gözlemin İleriye Taşınması (LOCF) | ||||
Tedavi farkı | 193mL | 210mL | 36mL | 172mL |
P değeri | p<0,001 | p<0,001 | p=0,405 | p<0,001 |
(% 95 CI) | (108, 277) | (127, 294) | (-48, 120) | (87, 258) |
Doz sonrası 0-24 saatte Ölçülen Ağırlıklı Ortalama Seri FEV | ||||
Tedavi farkı P değeri (% 95 CI) | 136mL p=0,048 (1, 270) | 206mL p=0,003 (73, 339) | 116mL p=0,06 (-5, 236) | 302mL p<0,001 (178, 426) |
Kurtarma İlacı Kullanılmayan 24 saatlik periyotların yüzdesinde başlangıca kıyasla görülen değişiklik | ||||
Tedavi farkı | 11,7% | 6,3% | 10,6% | 19,3% |
P değeri | p<0,001 | p=0,067 | p<0,001 | p<0,001 |
(% 95 CI) | (4,9, 18,4) | (-0,4, 13,1) | (4,3, 16,8) | (13,0, 25,6) |
Semptomsuz 24 saatlik periyotların yüzdesinde başlangıca kıyasla görülen değişiklik | ||||
Tedavi farkı | 8,4% | 4,9% | 12,1% | 18,0% |
P değeri | p=0,010 | p=0,137 | p<0,001 | p<0,001 |
(% 95 CI) | (2,0, 14,8) | (-1,6, 11,3 | (6,2, 18,1) | (12,0, 23,9) |
Sabah Pik Ekspiratuvar Akışta Başlangıca Kıyasla Görülen Değişiklik | ||||
Tedavi farkı | 33,5L/dak | 32,9L/ dak | 14,6L/ dak | 33,3L/ dak |
P değeri | p<0,001 | p<0,001 | p<0,001 | p<0,001 |
(% 95 CI) | (22,3, 41,7) | 24,8, 41,1) | (7,9, 21,3) | (26,5, 40,0) |
Akşam Pik Ekspiratuvar Akışta Başlangıca Kıyasla Görülen Değişiklik | ||||
Tedavi farkı | 30,7L/dak | 26,2L/ dak | 12,3L/ dak | 28,2L/ dak |
P değeri | p<0,001 | p<0,001 | p<0,001 | p<0,001 |
(% 95 CI) | (22,5, 38,9) | (18,0, 34,3) | (5,8, 18,8) | (21,7, 34,8) |
*FF/VI = flutikazon furoat/vilanterol
HZA106837, değişken tedavi sürelerine sahipti (hastaların çoğunun en az 52 hafta boyunca tedavi gördüğü minimum 24 haftadan maksimum 76 haftaya kadar). HZA106837 çalışmasında, hastalar her ikisi de günde bir kez uygulanan RELVAR ELLIPTA 100/25 mikrogram [n=1.009] ya da FF 100 mikrogram [n=1.010] dozlarını almak için randomize edilmiştir. HZA106837 çalışmasında, primer sonlanım noktası ilk şiddetli astım alevlenmesinin görüldüğü zamandır. Şiddetli astım alevlenmesi, en az 3 gün boyunca sistemik kortikosteroidlerin kullanılmasını ya da hastanın hastaneye yatırılmasını gerektiren ya da sistemik kortikosteroidlerin kullanılmasını gerektiren astımdan ötürü hastanın acile kaldırılmasını gerektiren astım hastalığının bozulması olarak tanımlanmıştır. Trough FEV'de başlangıca kıyasla ayarlanmış ortalama değişiklik de sekonder sonlanım noktası olarak değerlendirilmiştir.
HZA106837 çalışmasında, RELVAR ELLIPTA 100/25 mikrogram uygulanan hastalarda şiddetli bir astım alevlenmesi görülme riski, tek başına FF 100 mikrogram uygulamasına kıyasla %20 azalmıştır (risk oranı 0,795, p=0,036 %95 CI (0,642, 0,985)). Her hasta başına yılda şiddetli astım alevlenmesi oranı, FF 100 grubunda 0,19 (her 5 yılda yaklaşık 1) ve RELVAR ELLIPTA 100/25 mikrogram grubunda 0,14 idi (her 7 yılda yaklaşık 1). FF 100 grubuna kıyasla RELVAR ELLIPTA 100/25 mikrogram için alevlenme oranı 0,755 idi (%95 CI 0,603, 0,945). Bu oran, FF 100'e kıyasla RELVAR ELLIPTA 100/25 mikrogram uygulanan hastalar için şiddetli astım alevlenmesi oranında %25 azalma olduğunu göstermektedir (p=0,014). RELVAR ELLIPTA'nın 24 saatlik bronkodilatör etkisi, herhangi bir etkinlik kaybı olmaksızın bir yıllık tedavi periyodu boyunca korunmuştur (taşiflaksi gözlenmeden). RELVAR ELLIPTA 100/25 mikrogram dozu sürekli olarak, FF 100 mikrograma kıyasla 12., 36. ve 52. haftada ve sonlanım noktasında trough FEV'de 83 mL - 95 mL arasında bir değer göstermiştir (p<0,001 %95 CI 52, sonlanım noktasında 126mL). RELVAR ELLIPTA 100/25 grubunda hastaların %44'ü tedavi sonunda iyi kontrol edilirken (ACQ7 ≤0,75) bu oran FF 100 mikrogram grubunda hastaların %36'sı idi (p<0,001 %95 CI 1,23, 1,82).
Çalışmaların Salmeterol/Flutikazon propiyonat kombinasyonları ile karşılaştırılması
24 haftalık bir çalışmada (HZA113091), akşamları günde bir kez RELVAR ELLIPTA 100/25 mikrogram ve günde iki kez salmeterol/FP 50/250 mikrogram uygulanan kontrol altında olmayan dirençli astımlı yetişkin ve adolesan hastalarda, başlangıca kıyasla akciğer fonksiyonunda iyileşme görülmüştür. Ağırlıklı ortalama 0-24 saatlik FEVdeğerinde başlangıca kıyasla oluşan 341 mL (RELVAR ELLIPTA) ve 377 mL'lik (salmeterol/FP) ayarlanmış ortalama tedavi artışları, her iki tedavi için de 24 saat boyunca akciğer fonksiyonunda genel bir iyileşme olduğunu göstermiştir. Gruplar arasındaki -37 mL'lik ayarlanmış ortalama tedavi farkı istatistiksel olarak anlamlı değildi (p=0,162). Flutikazon furoat/vilanterol grubundaki trough FEVgönüllüleri için başlangıca göre 281 mL'lik LS ortalama değişikliği ve salmeterol/FP grubundaki gönüllülerde 300 mL'lik değişiklik (-19 mL'lik ayarlanmış ortalama farkı (%95 CI: -0,073, 0,034)) istatistiksel olarak anlamlı değildir (p=0,485).
Günde bir kere flutikazon furoat/vilanterol 100/25 ile günde iki kere salmeterol/FP 50/250'nin (dip FEV-10 mL'lik bir sınır kullanılarak) benzer etkililiğini göstermek için, günde iki kere açık etiketli salmeterol/FP 50/250 ile 4 haftalık tedavi sonrasında astımları iyi şekilde kontrol altına alınmış erişkin ve ergenlerde (N=1504) randomize, çift kör, paralel gruplu, 24 haftalık bir çalışma (201378) yürütülmüştür. Günde bir kere flutikazon furoat/vilanterole randomize edilen gönüllülerde akciğer fonksiyonu, günde iki kere salmeterol/flutikazon propiyonata randomize edilenlerle karşılaştırılabilir olmuştur [dip FEV'de fark +19 mL'dir (%95 GA:
-11, 49)].
Astım alevlenmeleri üzerindeki etkilerini uygun şekilde karşılaştırmak için Salmeterol/FP ile veya diğer IKS/LABA kombinasyonları ile karşılaştırmalı çalışmalar yapılmamıştır.
Flutikazon furoat monoterapisi
24 haftalık randomize, çift kör plasebo kontrollü çalışmada (FFA112059), dirençli astım görülen yetişkin ve adolesan hastalarda plaseboya kıyasla [n=115] günde bir kez uygulanan FF 100 mikrogram [n=114] ve günde iki kez uygulanan FP 250 mikrogramın [n=114] güvenliliği ve etkililiği değerlendirilmiştir. Tüm hastaların, vizit 1'den önce (tarama viziti) en az 4 hafta süreyle stabil dozda bir IKS kullanmış olması gerekmiştir ve vizit 1'in 4 haftasında LABA kullanımına izin verilmemiştir.
Primer etkililik sonlanım noktası, tedavi periyodu sonunda klinik vizitte trough (bronkodilatör ve doz öncesi) FEV'de başlangıca kıyasla meydana gelen değişikliktir. 24 haftalık tedavi sırasında kurtarma ilacı kullanılmayan 24 saatlik periyotların yüzdesinde başlangıca kıyasla görülen değişiklik güçlü bir sekonder sonlanım noktası idi. 24 haftalık zaman noktasında, FF ve FP, plaseboya kıyasla sırasıyla trough FEV'i 146 mL (%95 CI 36, 257mL, p=0,009) ve 145 mL (%95 CI 33, 257mL, p=0,011) arttırmıştır. FF ve FP, plaseboya kıyasla sırasıyla 24 saatlik kurtarma ilacı kullanılmayan periyotların yüzdesini %4,8 (%95 CI 6,9, 22,7, p<0,001)
ve %17,9 (%95 CI 10,0, 25,7, p<0,001) oranında artırmıştır.
Alerjen değerlendirme çalışması
edilen alerjenler, ev tozu akarı, kedi döküntüsü ya da huş ağacı polenidir; yapılan seçim her bir tarama testine dayandırılmıştır. Seri FEVölçümleri, salin inhalasyonunun ardından (başlangıç) alınan pre-alerjen değerlendirme değerleri ile benzerdi. Genel olarak, erken astım yanıtı üzerindeki en büyük etkiler, tek başına FF 100 mikrogram ya da vilanterol 25 mikrograma kıyasla RELVAR ELLIPTA 100/25 mikrogram dozlarında görülmüştür. RELVAR ELLIPTA (100/25 mikrogram) ve FF 100 mikrogram, tek başına vilanterol ile kıyaslandığında geç astım yanıtını neredeyse ortadan kaldırmıştır. RELVAR ELLIPTA 100/25 mcg, metakolin değerlendirmesi ile 22. günde değerlendirildiği üzere, monoterapilere kıyasla alerjen kaynaklı bronşiyal hiper-reaktivite karşısında anlamlı olarak daha fazla koruma sağlamıştır.
Bronkoprotektif ve HPA ekseni etkileri çalışması
Flutikazon propiyonat (FP) veya budesonide (BUD) karşı flutikazon furoatın (FF) bronkoprotektif ve HPA ekseni etkileri bir artan tekrarlı doz, plasebo kontrollü, çapraz çalışmada (203162) solunum yolu aşırı duyarlılığı ve öngörülen FEV≥65% ile karakterize olan astımı bulunan 54 yetişkin üzerinde değerlendirilmiştir. Hastalar; FF'nin (25, 100, 200,
400, 800 mikrogram/gün), FP'nin (50, 200, 500, 1.000, 2.000 mikrogram/gün), BUD'nin
(100, 400, 800, 1.600, 3.200 mikrogram/gün) veya plasebonun 5 yedi günlük doz eskalasyon aşamalarından bir veya iki tedavi periyoduna randomize edilmiştir. Her doz eskalasyon aşamasından sonra, adenozin-5'-monofosfat (AMP) etkisine (FEV[AMP PC20]'de ≥%20 düşüşe yol açan uyarıcı konsantrasyon) solunum yolu aşırı duyarlılığı ile bronş koruması ve 24 saatlik ağırlıklı ortalama plazma kortizolü değerlendirilmiştir.
Astım için onaylı terapötik doz aralığı boyunca, AMP PC20 (mg/mL) ve kortizol supresyon (%) değerleri şöyle olmuştur: FF (100 ila 200 mikrogram/gün) için 81 ila 116 mg/mL ve %7
ila %14, FP (200 ila 2.000 mikrogram/gün) için 20 ila 76 mg/mL ve %7 ila %50 ve BUD (400
ila 1.600 mikrogram/gün) için 24 ila 54 mg/mL ve %13 ila %44.
Kronik Obstrüktif Akciğer Hastalığı
KOAH klinik gelişim programında, klinik teşhisi KOAH olan hastalarda gerçekleştirilen bir adet 12 haftalık (HZC113107), iki adet 6 aylık (HZC112206, HZC112207), iki adet bir yıllık randomize kontrollü çalışma (HZC102970, HZC102871) ve bir adet uzun süreli çalışma (SUMMIT) yer almıştır. Bu çalışmalar, akciğer fonksiyonu, dispne ve orta ila şiddetli alevlenmelerin ölçülmesini içermiştir.
Altı aylık çalışmalar
HZC112206 ve HZC112207, kombinasyon tedavisinin tek başına vilanterol ve FF ve plasebo ile karşılaştırıldığı 24 haftalık randomize, çift kör, plasebo kontrollü paralel grup çalışmalarıdır. HZC112206 çalışmasında, tümü günde bir kez uygulanan FF (100 mikrogram [n=206]), vilanterol (25 mikrogram [n=205]) ve plaseboya (n = 207) kıyasla, RELVAR ELLIPTA 50/25 mikrogram [n=206] ve RELVAR ELLIPTA 100/25 mikrogramın [n=206]) etkililiği değerlendirilmiştir. HZC112207 çalışmasında, tümü günde bir kez uygulanan FF (100 mikrogram [n=204]), 200 mikrogram [n=203]) ve vilanterol (25 mikrogram [n=203]) ve plaseboya (n = 205) kıyasla, RELVAR ELLIPTA 100/25 mikrogram [n=204] ve RELVAR ELLIPTA 200/25 mikrogramın [n=205]) etkililiği değerlendirilmiştir.
Tüm hastalarda, en az 10 paket/yıl sigara içme öyküsü bulunması; salbutamol sonrası FEV/FVC oranının ≤0,70 olması; salbutamol sonrası FEVoranının beklenen değerin %70'i ya da daha düşük olması ya da taramada Değiştirilmiş Medikal Araştırma Konseyi (mMRC) dispne skorunun ≥2 (ölçek0 -4)olmasıgerekmiştir.Taramad a, HZC112206 ve HZC112207
çalışmalarında, ortalama bronkodilatör öncesi FEVdeğeri beklenenin sırasıyla %42,6 ve 43,6'sı ve ortalama reversibilite %15,9 ve %12,0 idi. Her iki çalışmadaki ko-primer sonlanım noktaları, 168. günde dozdan 0-4 saat sonra ağırlıklı ortalama FEVdeğeri ve 169. günde doz öncesi trough FEVdeğerinde başlangıca kıyasla görülen değişiklik idi.
Her iki çalışmanın entegre bir analizinde, RELVAR ELLIPTA 100/25 mikrogram, akciğer fonksiyonunda klinik olarak anlamlı iyileşmeler göstermiştir. 169. günde RELVAR ELLIPTA 100/25 mikrogram ve vilanterol, plaseboya kıyasla sırasıyla, ayarlanan ortalama trough FEVdeğerini 129mL (%95 CI:91, 167mL, p<0,001) ve 83 mL (%95 CI:46, 121mL, p<0,001)
arttırmıştır. RELVAR ELLIPTA 100/25 mikrogram, vilanterol ile kıyaslandığında (%95 CI:8, 83mL, p= 0,017), trough FEVdeğerini 46 mL arttırmıştır. 168. günde RELVAR ELLIPTA 100/25 mikrogram ve vilanterol, plaseboya kıyasla sırasıyla, ayarlanmış ağırlıklı ortalama FEVdeğerini 0-4 saatte 193mL (%95 CI:156, 230mL, p<0,001) ve 145 mL (%95 CI:108,
181mL, p<0,001) arttırmıştır. RELVAR ELLIPTA 100/25, tek başına FF ile kıyaslandığında ayarlanan ortalama ağırlıklı FEVdeğerini 0-4 saatte 148 ml arttırmıştır (%95 CI:112, 184mL, p< 0,001).
12 aylık çalışmalar
HZC102970 ve HZC102871 çalışmaları, tümü günde bir kez uygulanan 200/25 mikrogram RELVAR ELLIPTA, 100/25 mikrogram RELVAR ELLIPTA, 50/25 mikrogram RELVAR ELLIPTA ile 25 mikrogram vilanterol'ün, en az 10 paket/yıl sigara içme geçmişi olan ve salbutamol sonrası FEV/FVC oranı ≤ %70 ve salbutamol sonrası FEVdeğeri beklenen değerin ≤ %70'i olan ve vizit 1 öncesindeki 12 ay içerisinde antibiyotik ve/veya ağızdan kortikosteroid kullanımı veya hastanede yatma gerektiren ≥ 1 belgelendirilmiş KOAH alevlenmesi geçmişi olan KOAH'lı hastalardaki orta şiddetli/şiddetli alevlenmelerin yıllık oranı üzerindeki etkisini karşılaştıran, 52 haftalık, randomize, çift kör, paralel grup çalışmalarıdır. Primer sonlanım noktası, orta şiddetli ve şiddetli alevlenmelerin yıllık oranı idi. Orta şiddetli/şiddetli alevlenmeler, antibiyotik ve/veya ağızdan kortikosteroid ile tedavi veya hastanede yatışı gerektiren kötüleşme semptomları olarak tanımlanmıştır. Her iki çalışmada da, KOAH farmakoterapisini standart hale getirmek için ve 52 hafta süreyle körleşmiş çalışma ilacına randomizasyon öncesinde hastalığı stabil hale getirmek amacıyla tüm hastaların günde iki kez açık etiketli salmeterol/FP 50/250 aldığı 4 haftalık bir hazırlık periyodu olmuştur. Hazırlık periyodu öncesinde, hastalar kısa etkili bronkodilatörler dışında, daha önceki KOAH ilaçlarını kullanmayı bırakmışlardır. Tedavi süresince, inhale edilen uzun etkili bronkodilatörlerin (beta-agonist ve antikolinerjik), ipratropium/salbutamol kombinasyon ürünlerinin, oral beta-agonistlerinin ve teofilin preparatlarının eşzamanlı kullanımına izin verilmemiştir. KOAH alevlenmelerinin akut tedavisi için oral kortikosteroidlere ve antibiyotiklere belirli kullanım kılavuzları dahilinde izin verilmiştir. Çalışmalar süresince hastalar salbutamol'u, gerektiği zamanlarda kullanmışlardır.
Her iki çalışmanın sonuçları da günde bir kez 100/25 mikrogram RELVAR ELLIPTA ile tedavinin vilanterol'e kıyasla daha düşük bir orta şiddetli/şiddetli KOAH alevlenmesi oranı ile sonuçlandığını ortaya koymuştur.
Tablo 2: 12 aylık tedavi sonrasındaki alevlenme oranlarının analizi
Sonlanım Noktası | HZC102970 | HZC102871 | HZC102970 ve HZC102871 entegre edilmiş | |||
Vilanterol (n=409) | FF/VI 100/25 (n=403) | Vilanterol (n=409) | FF/VI 100/25 (n=403) | Vilanterol (n=818) | FF/VI 100/25 (n=806) | |
Orta şiddetli ve şiddetli alevlenmeler | ||||||
Ayarlanmış ortalama yıllık oran | 1,14 | 0,90 | 1,05 | 0,70 | 1,11 | 0,81 |
VI'e karşılık oran |
| 0,79 |
| 0,66 |
| 0,73 |
95% CI | (0,64, 0,97) | (0,54, 0,81) | (0,63, 0,84) | |||
p-değeri | 0,024 | <0,001 | <0,001 | |||
% azalma | 21 | 34 | 27 | |||
(95% CI) | (3, 36) | (19,46) | (16, 37) | |||
Sayı/yıl vs |
| 0,24 |
| 0,36 |
| 0,30 |
Vilanterol net farkı | (0,03, 0,41) | (0,20, 0,48) | (0,18, 0,41) | |||
(%95 CI) |
|
|
| |||
İlk alevlenmeye |
|
|
|
|
|
|
kadar geçen süre: | 0,80 | 0,72 | 0,76 | |||
Risk oranı | (0,66, 0,99) | (0,59, 0,89) | (0,66, 0,88) | |||
(95% CI) | 20 | 28 | 24 | |||
% risk azaltma |
|
|
| |||
p-değeri | 0,036 | 0,002 | p<0,001 | |||
HZC102970 ve HZC102871'nin 52. haftadaki birleştirilmiş analizinde, 100/25 mikrogram RELVAR ELLIPTA'nın 25 mikrogram vilanterol ile karşılaştırmasında, ayarlanmış ortalama trough FEVdeğerinde bir iyileşme görülmüştür (42 mL %95 CI: 19, 64 mL, p<0,001). RELVAR ELLIPTA'nın 24 saatlik bronkodilatör etkisi ilk dozdan itibaren, etkililikte herhangi bir kayıp olduğuna dair bir kanıt olmaksızın (taşifilaksi olmaksızın) bir yıllık tedavi periyodu boyunca korunmuştur.
Tüm sonuçlar değerlendirildiğinde, iki çalışmanın birleşiminde, tarama sırasında 2009 (%62) hastada kardiyovasküler öykü/risk faktörü bulunmuştur. Kardiyovasküler öykü/risk faktörü insidansı tedavi grupları arasında benzer idi ve kardiyovasküler öykü/risk faktörü alt grubundaki hastaların birçoğunda hipertansiyon (%46) bulunmakta olup, bunu hiperkolesterolemi (%29) ve diabetes mellitus (%12) takip etmiştir. Bu alt grupta, tüm popülasyona kıyasla orta şiddetli ve şiddetli alevlenmelerin azaltılmasında benzer etkiler gözlenmiştir. Kardiyovasküler öyküsü/risk faktörü bulunan hastalarda, 100/25 mikrogram RELVAR ELLIPTA, vilanterol'e kıyasla, anlamlı olarak daha düşük bir orta şiddetli/şiddetli yıllık KOAH alevlenmesi oranı ile sonuçlanmıştır (ayarlanmış ortalama yıllık oranlar sırasıyla 0,83 ve 1,18 idi, %30 azalma (%95 CI 16, %42, p<0,001). Bu alt grupta da 52. haftada 100/25 mikrogram RELVAR ELLIPTA ile 25 mikrogram vilanterol'ün karşılaştırmasında, ayarlanmış ortalama trough FEVdeğerinde iyileşmeler görülmüştür (44 mL %95 CI: 15, 73mL, (p=0,003).
1 yıldan uzun süreli çalışmalar
SUMMIT, 16,485 hastada, plasebo ile karşılaştırıldığında flutikazon furoat/vilanterol 100/25 mikrogram'ın sağkalım üzerindeki etkisini değerlendiren çok-merkezli, randomize, çift-kör bir çalışmadır. Primer sonlanım noktası tüm nedenlere bağlı mortalite ve sekonder sonlanım noktası kardiyovasküler olaylar bileşimidir (tedavi sırasında kardiyovasküler ölüm, miyokard infarktüsü, inme, stabil olmayan anjin veya geçici iskemik atak).
Randomizasyon öncesi, hastaların başlangıçtan önce kullanmakta oldukları KOAH ilaçlarını (uzun etkili bronkodilatörlerle birlikte inhale kortikosteroidler (%28), tek başına uzun etkili bronkodilatörler (%11) ve tek başına inhale kortikosteroidler (%4)) bırakmaları gerekmiştir. Sonrasında hastalar flutikazon furoat/vilanterol 100/25 mikrogram, flutikazon furoat 100 mikrogram, vilanterol 25 mikrogram veya plasebo alacak şekilde randomize edilmiş ve ortlama 1,7 yıl tedavi görmüştür (standart sapma = 0,9 yıl).
Hastaların orta şiddette KOAH'ı (bronkodilatör-sonrası ortalama FEVölçümü %60, standart sapma %6) ve karviyovasküler hastalık öyküsü veya artmış kardiyovasküler hastalık riski vardı. Çalışmanın 12 ay öncesinde, hastaların %61'i KOAH alevlenmesi bildirmemiş ve
%39'u 1 veya daha fazla orta şiddette/ciddi KOAH alevlenmesi bildirmişti.
Tüm nedenlere bağlı mortalite: flutikazon furoat/vilanterol, %6,0; plasebo, %6,7; flutikazon furoat, %6,1; vilanterol, %6,4. 100 hasta/yılda (%/yıl) maruziyet-ayarlı tüm nedenlere bağlı mortalite; flutikazon furoat/vilanterol'de %3,1/yıl, plaseboda %3,5/yıl, flutikazon furoatta
%3,2/yıl ve vilanterolde %3,4/yıl olarak bulunmuştur. Flutikazon furoat/vilanterol ile mortalite riski, plasebo ile (HR 0,88; %95 GA: 0,74 ila 1,04; p=0,137), flutikazon furoat ile (HR 0,96; %95 GA: 0,81 ila 1,15; p=0,681) veya vilanterol ile (HR 0,91; %95 GA: 0,77 ila 1,09; p=0,229) karşılaştırıldığında anlamlı derecede farklı bulunmamıştır.
Flutikazon furoat/vilanterol ile kardiyovasküler olay riski, plasebo ile (HR 0,93; %95 GA:
0,75 ila 1,14), flutikazon furoat ile (HR 1,03; %95 GA: 0,83 ila 1,28) veya vilanterol ile (HR
0,94; %95 GA: 0,76 ila 1,16) karşılaştırıldığında anlamlı derecede farklı bulunmamıştır.
Çalışmaların salmeterol/flutikazon propiyonat kombinasyonları ile karşılaştırılması
KOAH hastalarında yapılan 12 haftalık bir çalışmada (HZC113107), hem günde bir kez sabahları verilen 100/25 mikrogram RELVAR ELLIPTA hem de günde iki kez verilen salmeterol/FP 50/500 mikrogram, akciğer fonksiyonunda iyileşmelere işaret etmiştir. 130 mL (RELVAR ELLIPTA) ve 108 mL (salmeterol/FP)'nin FEV'inin 0-24. saatlerdeki ağırlıklı ortalamasında başlangıca göre ayarlanmış ortalama tedavi artışları 24 saatte her iki tedavi için de akciğer fonksiyonunda genel iyileşme sağlamıştır. Gruplar arasındaki 22 mL'lik ayarlanmış ortalama tedavi farkı (%95 CI: -18, 63mL) istatistiksel olarak anlamlı değildi (p=0,282). 85. günde trough FEV'de başlangıca göre ayarlanmış ortalama değişiklik flutikazon furoat/vilanterol grubunda 111 mLve salmeterol/FP grubunda 88 mL olmuştur; tedavi grupları arasındaki 23 mL'lik fark (%95 CI: +20, 66) klinik olarak anlamlı veya istatistiksel olarak önemli değildir (p=0,294).
KOAH alevlenmeleri üzerindeki etkilerini uygun şekilde karşılaştırmak için Salmeterol/FP ile veya diğer yerleşik bronkodilatörler ile karşılaştırmalı çalışmalar yapılmamıştır.
Pediyatrik popülasyon
Avrupa İlaç Kurumu, KOAH'ta, RELVAR ELLIPTA ürünü ile yapılan çalışmalardaki bulguların, pediyatrik popülasyonun tüm alt gruplarında sunulması zorunluluğundan feragat etmiştir (pediyatrik kullanıma ilişkin bilgiler için bkz. Bölüm 4.2).
Avrupa İlaç Kurumu, astımda, RELVAR ELLIPTA ürünü ile yapılan çalışmalardaki bulguların, pediyatrik popülasyonun bir veya daha fazla alt grubunda sunulması zorunluluğunu ertelemiştir (pediyatrik kullanıma ilişkin bilgiler için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim:
İnhalasyon yoluyla flutikazon furoat/ vilanterol olarak uygulandığında, RELVAR ELLIPTA'nın mutlak biyoyararlanımı ortalama olarak sırasıyla %15,2 ve %27,3 idi. Hem flutikazon furoatın hem de vilanterol'ün oral biyoyararlanımı düşük olup, ortalama olarak sırasıyla %1,26 ve <%2 idi. Oral biyoyararlanımının düşük olması nedeniyle, inhale edilerek uygulanmasını takiben flutikazon furoat ve vilanterol için sistemik maruziyet, primer olarak akciğere giden dozun inhale edilen kısmının emilimi yoluyla olmaktadır.
Dağılım:
İntravenöz dozun ardından, hem flutikazon furoat hem de vilanterol yaygın şekilde dağıtılırlar ve kararlı durumdaki ortalama dağılım hacimleri sırasıyla 661 L ve 165 L'dir.
Hem flutikazon furoat'ın hem de vilanterol'ün kırmızı kan hücreleri ile düşük bir ilişkisi bulunmaktadır. Flutikazon furoat ve vilanterol'ün insan plazmasındaki in vitro plazma proteinlerine bağlanması yüksek olup ortalama olarak sırasıyla >%99,6 ve %93,9 idi. Böbrek ya da karaciğer bozukluğu olan hastalarda in vitro plazma protein bağlama derecesinde herhangi bir azalma olmamıştır.
Flutikazon furoat ve vilanterol, P-glikoprotein (P-gp) için substratlardır, ancak, flutikazon furoat/vilanterol'ün P-gp inhibitörleri ile eşzamanlı uygulanmasının, flutikazon furoat veya vilanterol'ün sistemik maruziyetini değiştirmesinin olası olmadığı düşünülmektedir, çünkü her ikisi de iyi emilen moleküllerdir.
Biyotranformasyon:
İn vitro verilere dayanarak, hem flutikazon furoat hem de vilanterol'ün ana metabolizma yollarına daha çok CYP3A4 aracılık etmektedir.
Flutikazon furoat en çok, S-florometil karbotiyoat grubunun, kortikosteroid aktivitesi anlamlı olarak düşük olan metabolitlere hidrolizi ile metabolize edilmektedir. Vilanterol, en çok anlamlı olarak düşük β1- ve β2-agonist aktivitesi olan bir dizi metabolite O-dealkilasyon ile metabolize olur.
Eliminasyon:
Oral uygulamayı takiben, flutikazon furoat insanlarda metabolizma yoluyla elimine edilmiş olup neredeyse tamamı feçes yoluyla atılırken; radyoaktif olarak işaretlenmiş dozun %1'inden azı idrarla atılmıştır.
Oral yolla gerçekleştirilen radyoaktif işaretli bir insan çalışmasında, oral uygulamayı takiben, vilanterol başlıca metabolizma yoluyla eliminasyonu takiben radyoaktif dozun sırasıyla yaklaşık %70 ve %30'u idrar ve feçeste metabolitler şeklinde atılmıştır. Flutikazon furoat/vilanterol'ün inhale edilerek uygulanmasını takiben vilanterol'ün görünen plazma eliminasyon yarı ömrü ortalama olarak 2,5 saat idi. Vilanterol 25 mikrogram tekrar dozlarının inhalasyon yoluyla uygulanması ile belirlenen vilanterol birikmesi için etkin yarı ömür, astımlı kişilerde 16 saat ve KOAH'lı kişilerde 21,3 saattir.
Hastalardaki karekteristik özellikler
Çocuklar:
Adolesanlarda (12 yaş ve üstü), herhangi bir doz değişikliği önerilmemektedir.
RELVAR ELLIPTA'nın farmakokinetiği, 12 yaşın altındaki hastalarda çalışılmamıştır. RELVAR ELLIPTA'nın 12 yaşın altındaki çocuklarda güvenliliği ve etkililiği henüz kanıtlanmamıştır.
Yaşlılar:
Yaşın, flutikazon furoat ve vilanterol'ün farmakokinetiği üzerindeki etkileri, KOAH ve astım ile ilgili faz III çalışmalarda belirlenmiştir.
Yaşın (12-84), astımlı hastalarda flutikazon furoat ve vilanterol'ün farmakokinetiğini etkilediğine dair herhangi bir kanıt bulunmamıştır.
Yaşın KOAH'lı hastalarda flutikazon furoat ve vilanterol'ün farmakokinetiğini etkilediğine dair herhangi bir kanıt bulunmamıştır, ancak incelenmiş olan 41 ila 84 yaş aralığında vilanterol'ün EAAdeğerinde artış (%37) görülmüştür. Düşük vücut ağırlığına sahip (35 kg) yaşlı bir hastada (84 yaşında), vilanterol EAA'ün popülasyon tahmininden (KOAH'lı 60 yaşındaki 70 kg'lık hasta) %35 daha yüksek olduğu öngörülmektedir, C'ta ise değişiklik olmamıştır. Bu farkların klinik olarak anlamlı olması olası değildir. Astımlı hastalarda ve KOAH'lı hastalarda herhangi bir doz değişikliği önerilmemektedir.
Böbrek yetmezliği:
RELVAR ELLIPTA'nın bir klinik farmakoloji çalışması, şiddetli böbrek yetmezliğinin (kreatinin klirensi <30mL/dak) sağlıklı gönüllülere kıyasla, flutikazon furoat veya vilanterol'e anlamlı olarak daha fazla maruziyete veya daha belirgin kortikosteroid veya beta-agonist sistemik etkilerine yol açmadığını göstermiştir.
Böbrek yetmezliği olan hastalar için doz ayarlaması gerekmemektedir. Hemodiyalizin etkileri çalışılmamıştır.
Karaciğer Yetmezliği:
Karaciğer yetmezliği olan hastalarda (Child-Pugh A, B veya C), sağlıklı gönüllülere kıyasla, flutikazon furoat/vilanterol'ün 7 günlük tekrarlı dozunun ardından, flutikazon furoatın sistemik maruziyetinde bir artış olmuştur (EAAile ölçüldüğü üzere üç katına kadar). Orta şiddetli karaciğer yetmezliği olan hastalardaki (Child-Pugh B) flutikazon furoat sistemik maruziyetindeki artış (flutikazon furoat/vilanterol 200/25 mikrogram), sağlıklı gönüllülere kıyasla, serum kortizolünde ortalama %34'lük bir düşüş ile ilişkilendirilmiştir. Orta ve şiddetli karaciğer yetmezliği (Child-Pugh B ceya C) hastalarında doza göre normalleştirilmiş flutikazon furoat sistemik maruziyeti benzer olmuştur.
Flutikazon furoat/vilanterol'ün 7 günlük tekrarlı dozunun ardından; hafif, orta şiddetli veya şiddetli karaciğer yetmezliği olan gönüllülerin (Child-Pugh A, B veya C), vilanterol'e sistemik maruziyetinde anlamlı bir artış olmamıştır (Cve EAA).
Hafif veya orta şiddetli karaciğer yetmezliği (vilanterol, 25 mikrogram) veya şiddetli karaciğer yetmezliği (vilanterol, 12,5 mikrogram) olan gönüllülerde, flutikazon furoat/vilanterol kombinasyonunun, beta-adrenerjik sistemik etkiler üzerinde (kalp atış hızı veya serum potasyumu) sağlıklı gönüllülere kıyasla klinik olarak anlamlı etkileri olmamıştır.
Diğer Özel Popülasyonlar:
Astımlı gönüllülerde, Doğu Asyalı, Japon ve Güney Doğu Asyalı hastalar (gönüllülerin %12- 13'ü) için flutikazon furoat EAA, diğer ırk gruplarına kıyasla %33 ila %53 oranında daha yüksek olmuştur. Ancak, bu popülasyondaki daha yüksek sistemik maruziyetin, idrarda 24 saatlik kortizol atılımı üzerinde daha büyük bir etki ile ilişkilendirildiğine dair herhangi bir kanıt bulunmamıştır. Ortalama olarak, Asya kökenli gönüllüler için diğer ırk gruplarına kıyasla, vilanterol C'ın %220 ila %287 oranında daha yüksek olduğu ve EAA'ün benzer olduğu öngörülmektedir. Ancak, bu daha yüksek vilanterol C'ın, kalp atış hızı üzerinde klinik olarak anlamlı etkilere yol açtığına dair herhangi bir kanıt bulunmamıştır.
KOAH'lı gönüllülerde, Doğu Asyalı, Japon ve Güney Doğu Asyalı hastalar (gönüllülerin
%13-14'ü) için flutikazon furoat EAA, beyaz ırktan gönüllülere kıyasla %23 ila %30 oranında daha yüksek olmuştur. Ancak, bu popülasyondaki daha yüksek sistemik maruziyetin, idrarda 24 saatlik kortizol atılımı üzerinde daha büyük bir etki ile ilişkilendirildiğine dair herhangi bir kanıt bulunmamıştır. KOAH'lı gönüllülerde, ırk faktörünün vilanterol'ün farmakokinetik parametre tahminleri üzerinde herhangi bir etkisi olmamıştır.
Cinsiyet, Vücut Ağırlığı ve VKİ:
1.213 astımlı hastaya (712 kadın) ve 1.225 KOAH'lı hastaya (392 kadın) ait faz III verilerinin popülasyon farmakokinetik analizine dayanarak; cinsiyet, vücut ağırlığı veya VKİ (vücut kütle indeksi)'nin flutikazon furoat'ın farmakokinetiğini etkilediğine dair herhangi bir kanıt bulunmamıştır.
856 astımlı hasta (500 kadın) ve 1091 KOAH'lı hasta (340 kadın) için yapılan popülasyon farmakokinetiği analizine dayanarak; cinsiyet, vücut ağırlığı veya VKİ'nin vilanterol'ün farmakokinetiğini etkilediğine dair herhangi bir kanıt bulunmamıştır.
Cinsiyet, vücut ağırlığı veya VKİ'ye bağlı olarak herhangi bir doz ayarlaması
gerekmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı çalışmalarda flutikazon furoat ya da vilanterol ile görülen farmakolojik ve toksikolojik etkiler, tipik olarak glukokortikosteroidler ya da beta-agonistleri ile ilişkilendirilen etkilerdir. Vilanterol ile kombinasyon halinde flutikazon furoat uygulaması, herhangi bir anlamlı yeni toksisiteye yol açmamıştır.
Genotoksisite/karsinojenisite Flutikazon furoat
Flutikazon furoat, standart çalışmalarda genotoksik değildi. EAA'ya göre önerilen maksimum insan dozundakine benzer maruziyet düzeylerinde sıçanlarda ya da farelerde gerçekleştirilen yaşam boyu inhalasyon çalışmalarında da karsinojenik değildir.
Vilanterol trifenatat
Genetik toksisite çalışmaları, vilanterol'ün insanlar için genotoksik bir risk oluşturmadığını göstermektedir. Diğer betaagonistlerine yönelik bulgularla tutarlı olarak, yaşam boyu inhalasyon çalışmalarında vilanterol, dişi sıçan ve fare üreme yolunda ve sıçan hipofiz bezinde proliferatif etkilere yol açmıştır. EAA'ya göre, önerilen maksimum insan dozundakinin sırasıyla 1,2 ya da 30 katı maruziyet düzeylerinde sıçanlarda ya da farelerde görülen tümör insidansında herhangi bir artış olmamıştır.
Üreme Toksikolojisi Flutikazon furoat
Vilanterol ile kombinasyon halinde sıçanlarda gerçekleştirilen flutikazon furoat inhalasyon uygulamasının ardından görülen etkiler, tek başına flutikazon furoat uygulaması ile görülen etkilerle benzerdir.
Flutikazon furoat, sıçanlarda ya da tavşanlarda teratojenik değildi fakat sıçanlarda gelişimi geciktirmiş ve maternal olarak toksik dozlarda tavşanlarda aborsiyona neden olmuştur. EAA'a göre, önerilen maksimum insan dozundakinin yaklaşık 3 katı maruziyet düzeylerinde sıçanlarda gelişim üzerinde herhangi bir etki oluşmamıştır.
Vilanterol trifenatat
Vilanterol, sıçanlarda teratojenik değildir. Tavşanlarda gerçekleştirilen inhalasyon çalışmalarında, vilanterol, diğer betaagonistleri ile birlikte görülenlere benzer etkilere yol açmıştır (yarık damak, açık göz kapağı, sternebral füzyon ve ekstremite fleksürleri/ malrotasyon). Subkütan olarak uygulandığında, EAA'ya göre önerilen maksimum insan dozundakinin 84 katı maruziyet düzeylerinde herhangi bir etki oluşmamıştır.
Flutikazon furoat ya da vilanterol, sıçanlarda fertilite ya da pre- ve post-natal gelişim üzerinde herhangi bir istenmeyen etki oluşturmamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (inek sütünden elde edilir) Magnezyum Stearat
6.2. Geçimsizlikler
Bilinen bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay
Alüminyum kutu açıldıktan sonraki raf ömrü: 6 hafta.
6.4. Saklamaya yönelik özel tedbirler
25ºC'nin altındaki oda sıcaklığında ve nemden koruyarak saklayınız.
İnhaleri nemden korumak için kapalı alüminyum kutu içinde muhafaza ediniz ve ancak ilk
kez kullanmaya başlayacağınız zaman alüminyum kutuyu açıp inhalerinizi içinden çıkarınız.
Alüminyum kutu açıldıktan sonra inhaler en fazla 6 hafta kullanılabilir. Alüminyum kutuyu açtıktan sonra kutuyu ve kapağı atınız.
6.5. Ambalajın niteliği ve içeriği
Plastik ELLIPTA inhaler, nem çekici paket içeren bir alüminyum kutu içerisinde ambalajlanmış olan, açık gri renkli bir gövde, soluk mavi renkli bir inhaler kapağı ve bir doz sayacından oluşur. Alüminyum kutu, sıyırılarak açılan bir folyo kapak ile kapatılmıştır. İnhalerde, 14 veya 30 dozluk kullanıma hazır blisterden oluşan, her biri beyaz bir toz içeren iki adet alüminyum folyo şerit bulunmaktadır.
Tüm ticari takdim şekilleri satışa sunulmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmeğiâ€ne uygun olarak imha edilmelidir.
Kullanma Talimatı
RELVAR ELLIPTA ilk kez kullanılmaya başlanıldığında düzgün çalıştığının kontrol edilmesi ve özel bir yöntemle kullanıma hazırlanması gerekmemektedir. Sadece aşağıdaki talimatlara uyulmalıdır.
RELVAR ELLIPTA ambalajı aşağıdaki içeriklerden oluşur:
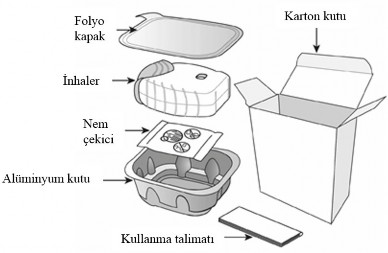
İnhaler, nemi azaltmak için nem çekici bir paket içeren alüminyum kutuda paketlenmiştir. Alüminyum kutunun kapağı açıldıktan sonra nem çekici paket atılmalıdır. Nem çekici paket açılmamalı, yutulmamalı veya teneffüs edilmemelidir. Dozu almaya hazır olana kadar alüminyum kutunun kapağı açılmamalıdır.
İnhaler alüminyum kutudan çıkarıldığında, “kapalı†pozisyonda olacaktır. İnhalerin son kullanma tarihi etiketindeki boşluğa yazılmalıdır. İnhalerin son kullanma tarihi alüminyum kutunun açılmasından sonra 6 haftadır. Son kullanma tarihinden sonra inhaler kullanılmamalıdır. Alüminyum kutu açıldıktan sonra kutu ve kapak atılabilir.
İnhaleri kullanmaya başlamadan önce aşağıdaki talimatları okuyunuz.
Eğer ilaç inhale edilmeden, inhaler kapağı açılıp kapatılırsa, bir doz harcanmış olur. Harcanan doz inhalerin içerisinde güvenle tutulur fakat artık kullanılamaz. Bir inhalasyonda yanlışlıkla ilave ilaç veya çift doz almak mümkün değildir.
Doz sayacı
Bu sayaç, inhaler içinde kaç doz ilaç kaldığını gösterir.
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| REVINTY | 8699240550776 | |
| VILACORT | 8680865270286 | 489.38TL |
| Diğer Eşdeğer İlaçlar |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A15813 |
| Satış Fiyatı | 785.62 TL [ 25 Apr 2025 ] |
| Önceki Satış Fiyatı | 785.62 TL [ 18 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522559930 |
| Etkin Madde | Flutikazon Furoate + Vilanterol |
| ATC Kodu | R03AK10 |
| Birim Miktar | 100+25 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 30 |
| Solunum Sistemi > Adrenerjikler (İnhalan) |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |