RINVOQ 15 mg uzatılmış salınımlı tablet (28 adet) Kısa Ürün Bilgisi
{ Upadasitinib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
RINVOQ 15 mg uzatılmış salımlı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir uzatılmış salımlı tablet, 15 mg upadasitinibe eşdeğer 15,4 mg upadasitinib hemihidrat
içerir.
Yardımcı maddeler
Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız.
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
RINVOQ 15 mg uzatılmış salımlı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir uzatılmış salımlı tablet, 15 mg upadasitinibe eşdeğer 15,4 mg upadasitinib hemihidrat
içerir.
Yardımcı maddeler
Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Uzatılmış salımlı tablet
Bir tarafında ‘a15' baskısı olan, mor renkli, 14 x 8 mm, oblong, bikonveks uzatılmış salımlı
tabletler.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Romatoid artrit
RINVOQ, erişkinlerde orta veya şiddetli aktif romatoid artritte bir veya daha fazla TNF blokeri kullanımına yetersiz cevap olması veya intolerans olması durumunda endikedir.
Diğer JAK inhibitörleri, biyolojik hastalık modifiye edici antiromatizmal ilaçlar (DMARD'lar), azatioprin ve siklosporin gibi potent immunsüpresiflerle birlikte kullanılması uygun değildir.
Psöriatik artrit
RINVOQ, erişkinlerde aktif psöriatik artrit tedavisinde bir veya daha fazla TNF blokeri kullanımına yetersiz cevap olması veya intolerans olması durumunda endikedir.
Diğer JAK inhibitörleri, biyolojik DMARD'lar, azatioprin ve siklosporin gibi potent immunsüpresiflerle birlikte kullanılması uygun değildir.
Aksiyal spondiloartrit
Radyografik olmayan aksiyal spondiloartrit (nr-axSpA)
RINVOQ, bir veya daha fazla TNF blokeri kullanımına yeterli cevap alınamayan veya intoleransı olan, objektif enflamasyon bulgularına sahip erişkin hastalarda aktif radyografik olmayan aksiyal spondiloartritin tedavisinde endikedir.
Diğer JAK inhibitörleri, biyolojik DMARD'lar, azatioprin ve siklosporin gibi potent immunsüpresiflerle birlikte kullanılması uygun değildir.
Ankilozan spondilit (AS, radyografik aksiyal spondiloartrit)
RINVOQ, bir veya daha fazla TNF blokeri kullanımına yeterli cevap alınamayan veya intoleransı olan aktif ankilozan spondilitli erişkin hastaların tedavisinde endikedir.
Diğer JAK inhibitörleri, biyolojik DMARD'lar, azatioprin ve siklosporin gibi potent immunsüpresiflerle birlikte kullanılması uygun değildir.
Atopik dermatit
RINVOQ, diğer sistemik tedavilere yeterli yanıt alınamayan ya da diğer sistemik tedavilerin kontraendike olduğu orta/şiddetli atopik dermatit tedavisinde endikedir.
Diğer JAK inhibitörleri, biyolojik immunomodülatörler veya diğer immunsüpresifler ile birlikte kullanılması uygun değildir.
Ülseratif kolit
RINVOQ, konvansiyonel tedaviye ve bir biyolojik ajana yetersiz yanıt veren, yanıtın kaybedildiği veya intolerans gösteren orta ila şiddetli aktif ülseratif koliti bulunan erişkin hastaların tedavisinde endikedir.
Diğer JAK inhibitörleri, ülseratif kolit için kullanılan biyolojik terapiler veya azatioprin ve siklosporin gibi potent immunsüpresifler ile birlikte kullanılması uygun değildir.
4.2. Pozoloji ve uygulama şekli
Upadasitinib tedavisi, upadasitinibin endike olduğu durumların tanı ve tedavisinde deneyimli hekimler tarafından başlatılmalı ve denetlenmelidir.
Pozoloji/uygulama sıklığı ve süresi:
Romatoid artrit, psöriyatik artrit, aksiyal spondiloartrit
Önerilen upadasitinib dozu günde bir kez 15 mg'dır.
16 haftalık tedaviden sonra klinik yanıt elde edilemeyen ankilozan spondilitli aksiyal spondiloartrit hastalarda tedavinin sonlandırılması düşünülmelidir. Başlangıçta tedaviye kısmi yanıt veren bazı hastalarda, 16 haftadan sonra tedaviye devam edilmesi durumunda sonradan iyileşme görülebilir.
Atopik dermatit
Yetişkinler
Tavsiye edilen upadasitinib dozu, hastanın bireysel durumuna göre günde bir kez 15 mg (1 adet 15 mg tablet) veya 30 mg (2 adet 15 mg tablet)'dır.
Venöz tromboembolizm (VTE), majör advers kardiyovasküler olay (MAKO) ve malignite riski daha yüksek olan hastalarda kullanılması isteniyorsa mümkün olan en düşük doz (15 mg) dikkatli kullanılmalıdır.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Upadasitinib, yalnızca aşağıdaki hastalarda uygun tedavi alternatifleri bulunmuyorsa kullanılmalıdır:
65 yaş ve üzeri;
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer tıbbi ürünlerin upadasitinib farmakokinetiğini etkileme potansiyeli
Upadasitinib, temel olarak CYP3A4 aracılığıyla metabolize edilir. Bu nedenle, upadasitinib plazma maruziyetleri, CYP3A4'ü güçlü bir şekilde inhibe eden veya indükleyen tıbbi ürünlerden etkilenebilir.
CYP3A4 inhibitörleri ile eşzamanlı kullanım
Upadasitinib maruziyeti, güçlü CYP3A4 inhibitörleriyle (ketokonazol, itrakonazol,
posakonazol, vorikonazol, klaritromisin ve greyfurt gibi) birlikte uygulandığında artar. Bir
klinik çalışmada, upadasitinibin ketokonazolle birlikte uygulanması, upadasitinib için Cve EAA (eğri altındaki alan) düzeylerinde sırasıyla %70 ve %75 artışa neden olmuştur. Güçlü CYP3A4 inhibitörleri ile kronik tedavi uygulanan hastalarda günde bir kez 15 mg upadasitinib dikkatle kullanılmalıdır. Güçlü CYP3A4 inhibitörleri ile kronik tedavi uygulanan atopik dermatitli hastalarda günde bir kez 30 mg upadasitinib önerilmemektedir. Güçlü CYP3A4 inhibitörleri kullanmakta olan ülseratif kolitli hastalarda önerilen indüksiyon dozu günde bir kez 30 mg (16 haftaya kadar) ve önerilen idame dozu ise günde bir kez 15 mg'dır (bkz. Bölüm 4.2). Uzun süreli olarak kullanıldığında güçlü CYP3A4 inhibitör tedavilerine alternatif düşünülmelidir. Upadasitinib ile tedavi sırasında greyfurt içeren yiyecek veya içeceklerden kaçınılmalıdır.
CYP3A4 indükleyicileri ile eşzamanlı kullanım
Upadasitinib maruziyeti, upadasitinibin terapötik etkisinin azalmasına yol açabilecek güçlü CYP3A4 indükleyicileri (rifampin ve fenitoin gibi) ile birlikte uygulandığında azalır. Bir klinik çalışmada, çoklu rifampisin (güçlü CYP3A indükleyicisi) dozlarının uygulanmasından sonra, birlikte upadasitinib uygulanması, upadasitinib için belirlenen Cve EAA düzeylerinde sırasıyla yaklaşık %50 ve %60 düşüşe neden olmuştur. Upadasitinib güçlü CYP3A4 indükleyicileri ile birlikte uygulandığında hastalar, hastalık aktivitesindeki değişiklikler açısından izlenmelidir.
Metotreksat ve pH modifiye edici tıbbi ürünlerin (örn., antasitler veya proton pompası
inhibitörleri) upadasitinib plazma maruziyetleri üzerinde bir etkisi yoktur.
Upadasitinibin diğer tıbbi ürünlerin farmakokinetiğini etkileme potansiyeli
Sağlıklı bireylere günde bir kez uygulanan upadasitinib 30 mg veya 45 mg çoklu dozunun, midazolam (CYP3A için hassas substrat) plazma maruziyetleri üzerinde sınırlı bir etki göstermiştir (midazolam EAA ve C'ta % 24-26 azalma) ve bu, günde bir kez verilen 30 mg veya 45 mg upadasitinibin CYP3A üzerinde zayıf bir indüksiyon etkisinin olabileceğini göstermektedir. Bir klinik çalışmada rosuvastatin ve atorvastatinin EAA değerleri sırasıyla %33 ve %23 azalmıştır ve sağlıklı bireylere günde bir kez uygulanan çoklu upadasitinib 30 mg dozlarını takiben rosuvastatinin Cdüzeyi %23 azalmıştır. Upadasitinib, atorvastatinin Cdüzeyi ya da orto-hidroksi atorvastatinin (atorvastatin için majör aktif metabolit) plazma maruziyeti üzerinde önemli bir etki göstermemiştir. Sağlıklı bireylerde günde bir kez 45 mg şeklinde verilen upadasitinib çoklu doz uygulaması dekstrometorfanın (hassas CYP2D6 substratı) EAA ve Cdeğerlerinde sırasıyla %30 ve %35 oranında sınırlı bir artışa yol açmış olup bu durum günde bir kez 45 mg upadasitinibin CYP2D6 üzerinde zayıf bir inhibitör etkisi olabileceğine işaret etmektedir. Upadasitinib ile birlikte kullanıldığında CYP3A substratları, CYP2D6 substratları, rosuvastatin veya atorvastatin için doz ayarlaması önerilmemektedir.
Upadasitinibin; etinilestradiol, levonorgestrel, metotreksat ya da CYP1A2, CYP2B6, CYP2C9 veya CYP2C19 aracılığıyla metabolizma için substrat olan tıbbi ürünlerin plazma maruziyetleri üzerinde anlamlı herhangi bir etkisi bulunmamaktadır.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin herhangi bir etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyon:
Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması yürütülmemiştir.
4.6. Gebelik ve laktasyon
Genel tavsiye:
Gebelik kategorisi: X
Çocuk doğurma potansiyeli bulunan kadınlar /Doğum kontrolü (Kontrasepsiyon)
Üreme potansiyeli olan kadınlara, tedavi sırasında ve upadasitinibin son dozunu takip eden 4 hafta boyunca etkili bir kontrasepsiyon kullanılması gerektiği tavsiye edilmelidir. Kız çocukları ve/veya ebeveynleri/bakımını üstenen kişiler, upadasitinib kullanırken hastada menarş meydana geldikten sonra tedaviyi uygulayan hekimle iletişime geçmeleri gerektiği konusunda bilgilendirilmelidir.
Gebelik dönemi
Upadasitinibin gebe kadınlarda kullanımına ilişkin veri mevcut değildir ya da sınırlı veri mevcuttur. Hayvanlardaki çalışmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Upadasitinibin sıçanlar ve tavşanlardaki in utero maruziyetinde, sıçan fetüslarının kemiklerinde ve tavşan fetüslarının kalbinde teratojenik etkisi olmuştur.
Gebelik sırasında upadasitinib kullanılması kontrendikedir (bkz. Bölüm 4.3).
Upadasitinib tedavisi uygulanan bir hastanın gebe kalması durumunda, ebeveynler fetüsun maruz kalabileceği potansiyel risk hakkında bilgilendirilmelidir.
Laktasyon dönemi
Upadasitinib/metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir. Hayvanlarda elde edilen farmakodinamik/toksikolojik veriler upadasitinibin süte geçtiğini göstermiştir (bkz. Bölüm 5.3).
Yenidoğanlar/infantlar için risk göz ardı edilemez.
Emzirme döneminde upadasitinib kullanılmamalıdır. Çocuk için emzirmenin yararı ve kadın için tedavinin yararı göz önünde bulundurularak, emzirmenin kesilmesi veya upadasitinib tedavisinin kesilmesi yönünde karar verilmelidir.
Üreme yeteneği/Fertilite
Upadasitinibin insan doğurganlığı üzerindeki etkisi değerlendirilmemiştir. Hayvan çalışmaları
fertilite ile ilgili etkiler göstermemektedir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Upadasitinibin araç ve makine kullanma yeteneği üzerinde etkisi yoktur veya ihmal edilebilir
bir etkiye sahiptir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Plasebo kontrollü romatoid artrit, psöriyatik artrit ve aksiyal spondiloartrit klinik çalışmalarında, 15 mg upadasitinib ile en yaygın olarak bildirilen advers reaksiyonlar (belirtilen endikasyonlar arasında en yüksek orana sahip endikasyonlardan en az birinde hastaların ≥%2'si) üst solunum yolu enfeksiyonları (%19,5), kan kreatin fosfokinaz (CPK) artışı (%8,6), alanin transaminaz artışı (%4,3), bronşit (%3,9), bulantı (%3,5), nötropeni (%2,8), öksürük (%2,2), aspartat transaminaz artışı (%2,2) ve hiperkolesterolemi (%2,2) olmuştur.
Plasebo kontrollü atopik dermatit klinik çalışmalarında, 15 mg veya 30 mg upadasitinib ile en yaygın olarak (hastaların ≥%2'sinde) bildirilen advers reaksiyonlar üst solunum yolu enfeksiyonu (%25,4), akne (%15,1), herpes simpleks (%8,4), baş ağrısı (%6,3), CPK düzeyinde
artış (%5,5), öksürük (%3,2), folikülit (%3,2), abdominal ağrı (%2,9), bulantı (%2,7), nötropeni
(%2,3), yüksek ateş (%2,1) ve influenza (%2,1) olmuştur.
En yaygın ciddi advers reaksiyonlar, ciddi enfeksiyonlardır (bkz. Bölüm 4.4).
Upadasitinibin uzun süreli tedaviyle gözlemlenen güvenlilik profili, genel olarak tüm endikasyonlar genelinde plasebo kontrollü dönemde görülen güvenlilik profiliyle benzer bulunmuştur.
Ülseratif kolit hastalarında plasebo kontrollü, indüksiyon ve idame tedavilerinin araştırıldığı klinik çalışmalarda, 45 mg, 30 mg veya 15 mg upadasitinib ile en yaygın olarak (hastaların ≥
%3'ünde) bildirilen advers reaksiyonlar üst solunum yolu enfeksiyonu (%19,9), kan CPK
düzeyinde artış (%7,6), akne (%6,3), nötropeni (%6), döküntü (%5,2), herpes zoster (%4,4),
hiperkolesterolemi (%4), folikülit (%3,6), herpes simpleks (%3,2) ve influenza (%3,2)
olmuştur.
Advers reaksiyonların tablosal özeti
Aşağıda listelenen advers reaksiyonlar, klinik çalışmalardan elde edilen deneyime dayanmaktadır. Aşağıda listelenen advers reaksiyonların sıklığı şu düzen kullanılarak tanımlanmaktadır: Çok yaygın: (≥1/10); yaygın: (≥1/100 ila <1/10); yaygın olmayan: (≥1/ 1000 ila <1/100); seyrek: (≥1/10000 ila <1/1000) ve çok seyrek: (<1/10000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Tablo 3'te verilen sıklıklar, romatizmal hastalık (15 mg), atopik dermatit (15 mg ve 30 mg) veya ülseratif kolit (15 mg, 30 mg ve 45 mg) ile ilgili klinik çalışmalarda upadasitinib ile bildirilen advers reaksiyon oranlarının daha yüksek olanlarına dayanmaktadır. Endikasyonlar arasında sıklık bakımından dikkate değer farklılıkların gözlemlendiği durumlar, tablonun altında yer alan dipnotlarda sunulmuştur.
Tablo 3: Advers reaksiyonlar
Sistem Organ Sınıfı
Çok yaygın
Yaygın
Yaygın olmayan
Enfeksiyonlar ve enfestasyonlar
Üst solunum yolu enfeksiyonları (URTI)
Bronşit
Herpes zoster Herpes simpleks Folikülit İnfluenza
İdrar yolu enfeksiyonu
Pnömoni
Oral kandidiyazis Divertikülit Sepsis
(Kist ve polipler de dahil olmak üzere) iyi huylu, kötü huylu ve belirlenmemiş neoplazmalar
Melanom dışı cilt kanseri
Bağışıklık sistemi hastalıkları
Ürtiker
Ciddi aşırı duyarlılık reaksiyonları
Kan ve lenf sistemi
hastalıkları
Anemi Nötropeni Lenfopeni
Metabolizma ve beslenme
hastalıkları
Hiperkolesterolemi Hiperlipidemi
Hipertrigliseridemi
Solunum, göğüs hastalıkları ve mediastinal hastalıklar
Öksürük
Gastrointestinal
hastalıklar
Karın ağrısı Mide bulantısı
Deri ve deri altı doku hastalıkları
Akne
Döküntü
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yorgunluk
Yüksek ateş
Araştırmalar
Kan CPK artması ALT yükselmesi AST yükselmesi Kilo artışı
Sinir sistemi hastalıkları
Baş ağrısı
Seçilen advers reaksiyonların tanımı
Romatoid artrit
Enfeksiyonlar
Arka planı DMARD'lar olan plasebo kontrollü klinik çalışmalarda, 12/14 hafta boyunca enfeksiyon sıklığı, plasebo grubunda %20,9 iken upadasitinib 15 mg grubunda %27,4 idi. Metotreksat (MTX) kontrollü çalışmalarda, 12/14 hafta boyunca enfeksiyon sıklığı MTX grubunda %24, upadasitinib 15 mg monoterapi grubunda ise %19,5 idi. Beş Faz 3 klinik çalışmanın tamamında (2630 hasta) upadasitinib 15 mg grubu için uzun süreli genel enfeksiyon oranı, 100 hasta-yılı başına 93,7 olaydır.
Arka planı DMARD'lar olan plasebo kontrollü klinik çalışmalarda, 12/14 hafta boyunca ciddi enfeksiyon sıklığı plasebo grubunda %0,6 iken upadasitinib 15 mg grubunda %1,2 idi. MTX kontrollü çalışmalarda, 12/14 hafta boyunca ciddi enfeksiyon sıklığı MTX grubunda %0,4, upadasitinib 15 mg monoterapi grubunda ise %0,6 idi. Beş Faz 3 klinik çalışmanın tamamında upadasitinib 15 mg grubu için uzun süreli genel ciddi enfeksiyon oranı, 100 hasta-yılı başına 3,8 olay olmuştur. En yaygın ciddi enfeksiyon pnömoni idi. Ciddi enfeksiyonların oranı uzun süreli maruz kalma ile sabit kalmıştır.
Fırsatçı enfeksiyonlar (tüberküloz hariç)
Arka planı DMARD'lar olan plasebo kontrollü klinik çalışmalarda, 12/14 hafta boyunca fırsatçı enfeksiyonların sıklığı, plasebo grubunda %0,3 iken upadasitinib 15 mg grubunda %0,5 idi. MTX kontrollü çalışmalarda, upadasitinib 15 mg monoterapi grubunda 12/14 hafta boyunca fırsatçı enfeksiyon görülmemiş, MTX grubunda ise %0,2 oranında görülmüştür. Beş Faz 3 klinik çalışmanın tamamında upadasitinib 15 mg grubu için uzun süreli genel fırsatçı enfeksiyon oranı, 100 hasta-yılı başına 0,6 olaydır.
Beş Faz 3 klinik çalışması boyunca upadasitinib 15 mg grubu için uzun süreli herpes zoster oranı, 100 hasta-yılı başına 3,7 olay olmuştur. Herpes zoster olaylarının çoğu tek bir dermatom içermiştir ve ciddi olarak değerlendirilmemiştir.
Karaciğer transaminaz yükselmeleri
Arka planı DMARD'lar olan plasebo kontrollü çalışmalarda, 12/14 haftaya kadar en az bir ölçümde alanin transaminaz (ALT) ve aspartat transaminaz (AST) yükselmelerinin ≥ 3 x normal üst sınırı (ULN), sırasıyla plasebo ile tedavi edilen hastaların %1,5 ve %0,7'sinde gözlenirken, upadasitinib 15 mg ile tedavi edilen hastaların %2,1 ve %1,5'inde gözlenmiştir. Hepatik transaminaz yükselme vakalarının çoğu asemptomatik ve geçicidir.
MTX kontrollü çalışmalarda, 12/14 haftaya kadar en az bir ölçümde ALT ve AST yükselmeleri
≥ 3 x ULN, sırasıyla MTX ile tedavi edilen hastaların %1,9 ve %0,9'unda, upadasitinib 15 mg ile tedavi edilen hastaların %0,8 ve %0,4'ünde gözlemlenmiştir.
ALT/AST'de yükselme paterni ve insidansı, uzun süreli uzatma çalışmaları da dahil olmak üzere zaman içerisinde sabit kalmıştır.
Lipid yükselmeleri
Upadasitinib 15 mg tedavisi; total kolesterol, trigliseritler, LDL kolesterol ve HDL kolesterol dahil olmak üzere lipid parametrelerinde artışlarla ilişkilendirilmiştir. LDL/HDL oranında herhangi bir değişiklik yoktur. Yükselmeler tedavinin 2. haftası ila 4. haftası arasında gözlenmiştir ve uzun süreli tedavi ile sabit kalmıştır. Kontrollü çalışmalarda başlangıç değerleri belirtilen sınırların altında olan hastalar arasında, 12/14 hafta boyunca en az bir kez belirtilen sınırların üstüne çıktığı gözlemlenen hastaların sıklığı aşağıda belirtilmektedir (izole yüksek değer saptanan hastalar dahil):
Toplam kolesterol ≥ 5,17 mmol/L (200 mg/dL): Upadasitinib 15 mg ve plasebo gruplarında sırasıyla %62'ye karşı %31
4.9. Doz aşımı ve tedavisi
Upadasitinib, klinik çalışmalarda günde bir kez 60 mg uzatılmış salımlı ile günlük EAA'ye eşdeğer dozlara kadar uygulanmıştır. Advers reaksiyonlar, daha düşük dozlarda görülenlerle karşılaştırılabilirdir ve hiçbir spesifik toksisite tespit edilmemiştir. Sistemik dolaşımdaki upadasitinibin yaklaşık %90'ı 24 saatlik doz uygulama süresi içerisinde (klinik çalışmalarda değerlendirilen doz aralığında) atılmaktadır. Doz aşımı durumunda, hastanın advers
reaksiyonların belirtileri ve semptomları açısından izlenmesi tavsiye edilmektedir. Advers reaksiyonlar gelişen hastalar, uygun tedaviyi almalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmunosüpresanlar, selektif immunosüpresanlar
ATC kodu: L04AA44
Etki mekanizması
Upadasitinib, seçici (selektif) ve geri dönüşlü (reversibl) bir Janus Kinaz (JAK) inhibitörüdür. JAK'lar; enflamatuvar yanıt, hematopoez ve immun sürveyans dahil olmak üzere çok çeşitli hücresel süreçlerde yer alan sitokin veya büyüme faktörü sinyallerini ileten hücre içi enzimlerdir. JAK enzimleri ailesi, sinyal dönüştürücülerini ve transkripsiyon aktivatörlerini (STAT'lar) fosforile etmek ve aktive etmek için çiftler halinde çalışan dört üyeden (JAK1, JAK2, JAK3 ve TYK2'yi) oluşur. Bu fosforilasyon, sırayla gen ekspresyonunu ve hücresel fonksiyonu modüle etmektedir. JAK1 enflamatuvar sitokin sinyallerinde önemliyken, JAK2 kırmızı kan hücresi olgunlaşması için önemlidir ve JAK3 sinyalleri immun sürveyans ve lenfosit fonksiyonunda rol oynamaktadır.
İnsan hücre analizlerinde upadasitinib, JAK 2 çifti aracılığıyla sinyal ileten sitokin reseptörleri üzerinden JAK1 veya JAK1/JAK 3 tarafından sinyal iletimini fonksiyonel seçicilikle inhibe etmektedir. Sinyalleri JAK1 yolu üzerinden ileten proinflamatuar sitokinler (IL-4, IL-13, IL- 22, TSLP, IL-31 ve IFN-γ dahil) atopik dermatite neden olmaktadır. JAK1'in upadasitinib ile inhibe edilmesi, egzematöz deri lezyonları ve kaşıntı gibi atopik dermatitin belirti ve semptomlarına neden olan birçok aracının sinyalini azaltmaktadır. Proinflamatuvar sitokinler (primer olarak IL-6, IL-7, IL-15 ve IFNγ), JAK1 yolağı aracılığıyla sinyal iletimi sağlamakta ve ülseratif kolit patogenezinde rol oynamaktadır. Upadasitinib ile JAK1 inhibisyonu, ülseratif kolitteki enflamatuvar yükün ve belirti ve semptomların altında yatan JAK'a bağlı sitokinlerin sinyalizasyonunu modüle etmektedir.
Farmakodinamik etkiler
IL-6 ile indüklenen STAT3 ve IL-7 ile indüklenen STAT5 fosforilasyonunun inhibisyonu Sağlıklı bireylerde, upadasitinib (hızlı salınımlı formülasyonu) uygulaması, tam kanda IL-6 (JAK1/JAK2) ile indüklenen STAT3 ve IL-7 (JAK1/JAK3) ile indüklenen STAT5 fosforilasyonunun doza ve konsantrasyona bağlı inhibisyonu ile sonuçlanmıştır. En yüksek inhibisyon, dozlamadan 1 saat sonra gözlemlenmiştir ve dozlama aralığının bitimine kadar başlangıç düzeyine yakın düzeye geri dönmüştür.
Lenfositler
Romatoid artriti olan hastalarda upadasitinib tedavisi, ortalama MLS'de başlangıçtan 36. haftaya kadar hafif, geçici bir artışla ilişkili bulunmuştur; bu durum devam eden tedaviyle, başlangıç düzeylerine veya yaklaşık olarak başlangıç düzeylerine yavaş yavaş geri dönmüştür.
hsCRP
Romatoid artriti olan hastalarda upadasitinib tedavisi, 1. hafta kadar erken bir sürede ortalama hsCRP seviyelerinde başlangıçtan itibaren sürekli tedaviyle devam eden düşüşlerle ilişkili bulunmuştur.
Aşı çalışması
Upadasitinibin inaktif pnömokok polisakkarit konjuge aşısının uygulanmasını takiben hümoral yanıt üzerindeki etkisi (13 valanlı, adsorbe), 15 mg (n=87) veya 30 mg (n=24) upadasitinib ile stabil tedavi görmekte olan 111 romatoid artrit hastasında değerlendirilmiştir. Hastalardan
%97'si (n=108) eş zamanlı metotreksat tedavisi görmekteydi. Primer sonlanım noktası, 12 pnömokok antijeninden en az 6'sı bakımından (1, 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19A, 19F ve 23F) başlangıçtan 4. haftaya kadar antikor konsantrasyonunda ≥ 2 kat artış olarak tanımlanan yeterli düzeyde hümoral yanıt elde edilen hastaların oranı olmuştur. 4. haftadaki yanıtlar, 15 mg ve 30 mg upadasitinib ile tedavi edilen hastaların sırasıyla %67,5 (%95 GA: 57,4, 77,5) ve
%56,5'inde (%95 GA: 36,3, 76,8) yeterli düzeyde hümoral yanıtın elde edildiğini göstermiştir.
Klinik etkililik ve güvenlilik
Romatoid artrit
Günde bir kez upadasitinib 15 mg'ın etkililik ve güvenliliği, orta ve şiddetli derecede aktif romatoid artriti olan ve ACR/EULAR 2010 sınıflandırma kriterlerini karşılayan beş Faz 3 randomize, çift-kör, çok merkezli çalışmada değerlendirilmiştir (bkz. Tablo 4). 18 yaş ve üstü hastalar dahil edilmiştir. Başlangıçta en az 6 hassas ve 6 şiş eklem varlığı ve hsCRP'nin yükselmesine bağlı sistemik enflamasyon kanıtı gerekmiştir. 5 yıla kadar uzun süreli uzatmaların dahil olduğu dört ve bir çalışma (SELECT-COMPARE) 10 yıla kadar uzun süreli uzatmalara dahildir.
Bu çalışmaların her birinin primer analizine, en az 1 doz upadasitinib ya da plasebo uygulanan randomize edilmiş tüm hastalar dahil edilmiş ve kategorik sonlanım noktaları için yanıt vermeyen hasta imputasyonu kullanılmıştır.
Faz 3 çalışmalarında, upadasitinib 15 mg QD (günde bir kez) ile görülen etkililik genel olarak upadasitinib 30 mg QD ile gözlemlenen etkililik ile benzer bulunmuştur.
Tablo 4: Klinik çalışmaların özeti
Çalışma adı
Popülasyon (n)
Tedavi kolları
Temel sonuç ölçümleri
SELECT-EARLY
MTX-Naif (947)
Monoterapi
(DAS28-CRP)
SELECT- MONOTHERAP Y
MTX-IR (648)
Monoterapi
Upadasitinib 15 mg
Upadasitinib 30 mg
MTX
Primer sonlanım noktası: 24. haftada klinik remisyon (DAS28- CRP)
Düşük hastalık aktivitesi
ACR50
Radyografik progresyon (mTSS)
Fiziksel fonksiyon (HAQ-DI)
SF-36 PCS
Upadasitinib 15 mg
Upadasitinib 30 mg
MTX
Primer sonlanım noktası: 14. haftada düşük hastalık aktivitesi (DAS28-CRP)
Klinik remisyon (DAS28-CRP)
ACR20
Fiziksel fonksiyon (HAQ-DI)
SF-36 PCS
Sabah tutukluğu
SELECT-NEXT
csDMARD-
IR (661)
Arka planda csDMARD'lar
(CDAI)
SELECT- COMPARE
MTX-IR (1.629)
12. haftada klinik remisyon (DAS28-CRP)
(DAS28-CRP)
(CDAI)
SELECT- BEYOND
bDMARD-
IR (499)
Arka planda csDMARD'lar
12. haftada düşük hastalık
aktivitesi (DAS28-CRP)
Kısaltmalar: ACR20 (veya 50) = Amerikan Romatoloji Derneği ≥ %20 (veya ≥ %50) iyileşme, bDMARD = Biyolojik hastalık modifiye edici anti-romatizmal ilaç, CRP = C-Reaktif Protein, DAS28
= Hastalık Aktivite Skoru 28 eklem, mTSS = Modifiye Total Sharp Skoru, csDMARD = konvansiyonel sentetik hastalık modifiye edici anti-romatizmal ilaç, HAQ-DI = Sağlık Değerlendirme Anketi Engellilik İndeksi, SF-36 PCS = Kısa Form (36) Sağlık Anketi (SF-36) Fiziksel Bileşen Anketi, CDAI = Klinik Hastalık Aktivitesi İndeksi, FACIT-F = Kronik Hastalık Tedavisi Fonksiyonel Değerlendirme-Yorgunluk skoru, IR = Yetersiz yanıt veren, MTX =
Metotreksat, n = Randomize sayı
Upadasitinib 15 mg
Upadasitinib 30 mg
Plasebo
Primer sonlanım noktası: 12. haftada düşük hastalık aktivitesi (DAS28-CRP)
Klinik remisyon (DAS28-CRP)
ACR20
Fiziksel fonksiyon (HAQ-DI)
SF-36 PCS
Düşük hastalık aktivitesi
Sabah tutukluğu
FACIT-F
Upadasitinib 15 mg
Plasebo
Adalimumab 40 mg Arka planda MTX
Primer sonlanım noktası:
Düşük hastalık aktivitesi
ACR20
Adalimumaba karşı düşük hastalık aktivitesi (DAS28- CRP)
Radyografik progresyon (mTSS)
Fiziksel fonksiyon (HAQ-DI)
SF-36 PCS
Düşük hastalık aktivitesi
Sabah tutukluğu
FACIT-F
Upadasitinib 15 mg
Upadasitinib 30 mg
Plasebo
Primer sonlanım noktası:
ACR20
Fiziksel fonksiyon (HAQ-DI)
SF-36 PCS
Klinik yanıt:
Remisyon ve düşük hastalık aktivitesi
Tüm çalışmalarda plasebo, MTX veya adalimumab ile karşılaştırıldığında, upadasitinib 15 mg ile tedavi edilen hastaların anlamlı olarak daha yüksek oranı, düşük hastalık aktivitesi (DAS28- CRP ≤3,2) ve klinik remisyon (DAS28-CRP <2,6) elde etmiştir (bkz. Tablo 5). SELECT- COMPARE çalışmasında, 12. haftada adalimumaba kıyasla anlamlı ölçüde daha yüksek olduğu belirlenen düşük hastalık aktivitesi oranları elde edilmiştir. Genel olarak düşük hastalık aktivitesi ve klinik remisyon oranları, MTX'lı ya da MTX'sız hasta popülasyonlarında tutarlı olmuştur. 3 yılda, SELECT-COMPARE çalışmasındaki hastaların 297/651'i (%45,6) ve 111/327'si (%33,9) sırasıyla orijinal randomize upadasitinib 15 mg veya adalimumab tedavisinde ve SELECT-EARLY çalışmasındaki hastaların 216/317'si (%68,1) ve 149/315'i (%47,3) sırasıyla orijinal randomize upadasitinib 15 mg tedavisi veya MTX monoterapisinde kalmıştır. Başlangıçta tayin edilen tedavilerini sürdüren hastalar arasında, düşük hastalık aktivitesi ve klinik remisyon 3 yıl boyunca devam etmiştir.
ACR yanıtı
Tüm çalışmalarda 12 haftada plasebo, MTX veya adalimumab ile karşılaştırıldığında upadasitinib ile tedavi edilen daha fazla hasta ACR20, ACR50 ve ACR70 yanıtı elde etmiştir (Tablo 5). Etkililik başlangıcına kadar geçen süre, ACR20 için daha yüksek yanıtlar, 1. hafta kadar erken bir sürede hızla görülmüştür. En az 3 yıl boyunca devam eden ACR20/50/70 yanıtlarıyla sürdürülebilir yanıt oranları (MTX'lı veya MTX'sız) gözlenmiştir.
Upadasitinib 15 mg ile tek başına veya csDMARD'larla kombinasyon halinde; plasebo, adalimumab veya MTX ile karşılaştırıldığında hassas ve şiş eklem sayıları, hasta ve hekim global değerlendirmeleri, HAQ-DI, ağrı değerlendirmesi ve hsCRP dahil olmak üzere bireysel ACR bileşenlerinde iyileşmelere neden olmuştur.
Tablo 5: Yanıt ve remisyon
Çalışma
SELECT- EARLY
MTX-Naif
SELECT- MONO
MTX-IR
SELECT- NEXT
csDMARD-IR
SELECT- COMPARE
MTX-IR
SELECT- BEYOND
bDMARD-IR
MTX
UPA
15mg
MTX
UPA
15mg
PBO
UPA
15mg
PBO
UPA
15mg
ADA
40mg
PBO
UPA
15mg
N
314
317
216
217
221
221
651
651
327
169
164
Hafta
LDA DAS28-CRP ≤3,2 (hastaların %'si)
12/14
28
53
19
45
17
48
14
45
29
14
43
2426
32
60
18
55
39
48
39
59
50
35
CR DAS28-CRP <2,6 (hastaların %'si)
12/14
14
36
8
28
10
31
6
29
18
9
29
2426
18
48
9
41
27
48
29
49
38
28
ACR20 (hastaların %'si)
12/14
54
76
41
68
36
64
36
71
63
28
65
24/26
59
79
36
67
57
48
57
74
65
54
ACR50 (hastaların %'si)
12/14
28
52
15
42
15
38
15
45
29
12
34
24/26
33
60
21
54
42
48
43
63
49
40
ACR70 (hastaların %'si)
12/14
14
32
3
23
6
21
5
25
13
7
12
24/26
18
44
10
35
23
48
29
51
36
23
CDAI ≤10 (hastaların %'si)
12/14
30
46
25
35
19
40
16
40
30
14
32
24/26
38
56
22
53
38
48
43
60
47
34
Kısaltmalar: ACR20 (veya 50 veya 70) = Amerikan Romatoloji Derneği ≥ % 20 (veya ≥ % 50 veya ≥ % 70) iyileşme; ADA = Adalimumab; CDAI = Klinik Hastalık Aktivite İndeksi; CR = Klinik Remisyon; CRP = C-Reaktif Protein, DAS28 = Hastalık Aktivite Skoru 28 eklem; IR = yetersiz yanıt veren; LDA = Düşük Hastalık Aktivitesi; MTX = Metotreksat; PBO = Plasebo; UPA= Upadasitinib
Not: 48. hafta verileri, Yanıt Vermeyen Hasta İmputasyonu kullanılarak randomize edilen gruba göre Tam Analiz setinde (FAS) gerçekleştirilen analizden edilmiştir
Radyografik yanıt
Yapısal eklem hasarının ilerlemesinin engellenmesi, SELECT-EARLY ve SELECT- COMPARE çalışmalarında 24/26. haftalarda ve 48. haftada modifiye Total Sharp Skoru (mTSS) ve bileşenleri, erozyon skoru ve eklem boşluğu daralma skoru kullanılarak değerlendirilmiştir.
Upadasitinib 15 mg tedavisinin yapısal eklem hasarı ilerlemesi için sağladığı inhibisyonun, SELECT-COMPARE çalışmasında MTX ile kombinasyon halinde kullanılan plaseboya ve SELECT-EARLY çalışmasında monoterapi olarak MTX'a kıyasla anlamlı ölçüde daha büyük olduğu saptanmıştır (bkz. Tablo 6). Erozyon ve eklem aralığında daralma skorlarına ilişkin analizlerin genel skorlarla tutarlı olduğu gözlemlenmiştir. Her iki çalışmada da, radyografik ilerleme göstermeyen hasta oranının (mTSS değişikliği ≤ 0) upadasitinib 15 mg tedavisiyle anlamlı ölçüde daha yüksek olduğu belirlenmiştir. Yapısal eklem hasarının ilerlemesinin inhibisyonu, orijinal olarak tayin edilen 15 mg upadasitinib tedavisinde kalan hastalar için her iki çalışmada 96. haftaya kadar sürdürülmüştür (SELECT-COMPARE çalışmasında 327 hastadan ve SELECT-EARLY çalışmasında 238 hastadan elde edilen sonuçlara göre).
Tablo 6: Radyografik değişimler
Çalışma
SELECT-EARLY
MTX-Naif
SELECT-COMPARE MTX-IR
Tedavi Grubu
MTX
UPA
15 mg
PBO
UPA
15 mg
ADA
40 mg
Modifiye Total Sharp Skoru, başlangıçtan itibaren ortalama değişim:
Hafta 24/26
0,7
0,1
0,9
0,2
0,1
Hafta 48
1
0,03
1,7
0,3
0,4
Radyografik progresyonu olmayan hasta yüzdesi
Hafta 24/26
77,7
87,5
76
83,5
86,8
Hafta 48
74,3
89,9
74,1
86,4
87,9
Kısaltmalar: ADA = Adalimumab; IR = Yetersiz yanıt veren; MTX = Metotreksat; PBO = Plasebo; UPA=
Upadasitinib
Fiziksel fonksiyon yanıtı ve sağlıkla ilgili sonuçlar
Upadasitinib 15 mg ile tek başına veya csDMARD'larla kombinasyon halinde tedavi, HAQ-DI ile ölçüldüğü gibi tüm karşılaştırıcılara kıyasla fiziksel fonksiyonda anlamlı olarak daha fazla iyileşme sağlamıştır (bkz. Tablo 7). SELECT-COMPARE ve SELECT-EARLY çalışmalarından elde edilen sonuçlara göre HAQ-DI'deki iyileşme, 15 mg upadasitinib ile orijinal olarak tayin edilen tedavide kalan hastalar için 3 yıl boyunca sürdürülmüştür.
Tablo 7: Başlangıçtan itibaren HAQ-DI'da ortalama değişim
Çalışma
SELECT- EARLY
MTX-Naif
SELECT-
MONO MTX-IR
SELECT-
NEXT csDMARD-IR
SELECT-COMPARE MTX-IR
SELECT-
BEYOND BIO-IR
Tedavi Grubu
MTX
UPA
15mg
MTX
UPA
15mg
PBO
UPA
15mg
PBO
UPA
15mg
ADA
40mg
PBO
UPA
15mg
N
313
317
216
216
220
216
648
644
324
165
163
Başlangıç
skoru, ortalama
1,6
1,6
1,5
1,5
1,4
1,5
1,6
1,6
1,6
1,6
1,7
Hafta
12/14
-0,5
-0,8
-0,3
-0,7
-0,3
-0,6
-0,3
-0,6
-0,5
-0,2
-0,4
Hafta 24/26
-0,6
-0,9
-0,3
-0,7
-0,6
Kısaltmalar: ADA = Adalimumab; HAQ-DI = Sağlık Değerlendirme Anketi Engellilik İndeksi; IR =
Yetersiz yanıt veren; MTX = Metotreksat; PBO = Plasebo; UPA = Upadasitinib
SELECT-MONOTHERAPY, SELECT-NEXT ve SELECT-COMPARE çalışmalarında, 15
mg upadasitinib tedavisi ortalama sabah tutukluğu süresinde plasebo veya MTX'a kıyasla anlamlı derecede daha yüksek bir düzelme sağlamıştır.
Klinik çalışmalarda, upadasitinib ile tedavi edilen hastalarda Kısa Form (36) Sağlık Anketi (SF- 36) Fiziksel Bileşen Anketi ile ölçülen hasta tarafından bildirilen yaşam kalitesinde plasebo ve MTX'a kıyasla anlamlı düzelmeler olduğu bildirilmiştir. Bunun yanı sıra, Kronik Hastalık
Tedavisi Fonksiyonel Değerlendirme-Yorgunluk skoru (FACIT-F) ile ölçüldüğü üzere, upadasitinib tedavisi uygulanan hastalarda plaseboya kıyasla yorgunlukta belirgin düzelmeler olduğu bildirilmiştir.
Psöriyatik artrit
Günde bir kez uygulanan upadasitinib 15 mg'ın etkililiği ve güvenliliği, orta ila şiddetli derecede aktif psöriyatik artritli 18 yaş ve üzerindeki hastalarda iki Faz 3 randomize, çift kör, çok merkezli, plasebo kontrollü çalışmada değerlendirilmiştir. Tüm hastalarda Psöriyatik Artrit Sınıflandırma Kriterlerine (CASPAR) göre en az 6 ay aktif psöriyatik artrit, en az 3 hassas eklem ve en az 3 şişmiş eklem ve aktif plak psöriyazisi veya plak psöriyazisi öyküsü mevcut idi. Her iki çalışmada da primer sonlanım noktası, 12. haftada ACR20 yanıtı elde eden hastaların oranıydı.
SELECT-PsA 1, en az bir biyolojik olmayan DMARD'a yetersiz yanıt veren veya intoleransı olan 1.705 hastada yapılan 24 haftalık bir çalışmaydı. Başlangıçta, hastaların 1.393'ü (%82) en az bir adet eş zamanlı biyolojik olmayan DMARD kullanıyordu. Hastaların 1.084'ü (%64) yalnızca eş zamanlı MTX alırken 311'i (%18) monoterapi almaktaydı. Hastalar günde bir kez upadasitinib 15 mg veya 30 mg, adalimumab veya plasebo almıştır. 24. haftada, plaseboya randomize edilen tüm hastalar kör bir şekilde günde bir kez upadasitinib 15 mg veya 30 mg'a geçiş yapmıştır. SELECT-PsA 1 çalışması, 5 yıla kadar devam eden uzun süreli bir uzatma dönemi içeriyordu.
SELECT-PsA 2, en az bir biyolojik DMARD'a yetersiz yanıt veren veya intoleransı olan 642 hastada yapılan 24 haftalık bir çalışmaydı. Başlangıçta, hastaların 296'sı (%46) en az bir adet eş zamanlı biyolojik olmayan DMARD kullanıyordu. Hastaların 222'si (%35) yalnızca eş zamanlı MTX alırken 345'i (%54) monoterapi almaktaydı. Hastalar günde bir kez upadasitinib 15 mg veya 30 mg veya plasebo almıştır. 24. haftada, plaseboya randomize edilen tüm hastalar kör bir şekilde günde bir kez upadasitinib 15 mg veya 30 mg'a geçiş yapmıştır. SELECT-PsA 2 çalışması, 3 yıla kadar devam eden uzun süreli bir uzatma dönemi içeriyordu.
Klinik yanıt
Her iki çalışmada da, 12. haftada ACR20 yanıtı elde eden hastaların oranı, upadasitinib 15 mg ile tedavi edilen hastalarda plaseboya kıyasla istatistiksel olarak anlamlı şekilde daha yüksek olmuştur (Tablo 8). Etkililiğin başlamasına kadar geçen sürenin, ölçütlerin tamamında kısa olduğu ve 2 hafta gibi kısa bir süre içerisinde ACR20 açısından daha iyi yanıtların görüldüğü tespit edilmiştir.
Upadasitinib 15 mg ile tedavi, plaseboya kıyasla, hassas/ağrılı ve şişmiş eklem sayıları, hasta ve hekim genel değerlendirmeleri, HAQ-DI, ağrı değerlendirmesi ve hsCRP de dahil olmak üzere bireysel ACR bileşenlerinde iyileşmeler sağlamıştır.
SELECT-PsA 1'de, 15 mg upadasitinib ile 12. haftada ACR20 yanıtı elde eden hastaların oranı açısından adalimumaba kıyasla eşdeğer etkililik sağlanmıştır, ancak adalimumaba üstünlük gösterilememiştir.
Her iki çalışmada da, primer ve kilit sekonder sonlanım noktaları açısından, tek başına veya metotreksat ile kombinasyon halinde tutarlı yanıtlar gözlenmiştir.
Upadasitinib 15 mg'ın etkililiği; başlangıç VKİ, başlangıç hsCRP ve önceki biyolojik olmayan DMARD sayısı (≤1 veya >1) da dahil olmak üzere, değerlendirilen alt gruplardan bağımsız şekilde gösterilmiştir.
Tablo 8: SELECT-PsA 1 ve SELECT-PsA 2'de klinik yanıt
Çalışma
SELECT-PsA 1
biyolojik olmayan DMARD-IR
SELECT-PsA 2 bDMARD-IR
Tedavi Grubu
PBO
UPA
15 mg
ADA
40 mg
PBO
UPA
15 mg
N
423
429
429
212
211
ACR20, hastaların %'si (%95 GA)
12. Hafta
36 (32, 41)
71 (66, 75)
65 (61, 70)
24 (18, 30)
57 (50, 64)
Plaseboya kıyasla
fark (%95 GA)
35 (28, 41)
-
33 (24, 42)
24. Hafta
45 (40, 50)
73 (69, 78)
67 (63, 72)
20 (15, 26)
59 (53, 66)
56. Hafta
74 (70, 79)
69 (64, 73)
60 (53, 66)
ACR50, hastaların %'si (%95 GA)
12. Hafta
13 (10, 17)
38 (33, 42)
38 (33, 42)
5 (2, 8)
32 (26, 38)
24. Hafta
19 (15, 23)
52 (48, 57)
44 (40, 49)
9 (6, 13)
38 (32, 45)
56. Hafta
60 (55, 64)
51 (47, 56)
41 (34, 47)
ACR70, hastaların %'si (%95 GA)
12. Hafta
2 (1, 4)
16 (12, 19)
14 (11, 17)
1 (0, 1)
9 (5, 12)
24. Hafta
5 (3, 7)
29 (24, 33)
23 (19, 27)
1 (0, 2)
19 (14, 25)
56. Hafta
41 (36, 45)
31 (27, 36)
24 (18, 30)
MDA, hastaların %'si (%95 GA)
12. Hafta
6 (4, 9)
25 (21, 29)
25 (21, 29)
4 (2, 7)
17 (12, 22)
24. Hafta
12 (9, 15)
37 (32, 41)
33 (29, 38)
3 (1, 5)
25 (19, 31)
56. Hafta
45 (40, 50)
40 (35, 44)
29 (23, 36)
Entezitin düzeldiği (LEI=0) hastaların %'si (%95 GA)
12. Hafta
33 (27, 39)
47 (42, 53)
47 (41, 53)
20 (14, 27)
39 (31, 47)
24. Hafta
32 (27, 39)
54 (48, 60)
47 (42, 53)
15 (9, 21)
43 (34, 51)
56. Hafta
59 (53, 65)
54 (48, 60)
43 (34, 51)
Daktilitin düzeldiği (LDI=0) hastaların %'si (%95 GA)
12. Hafta
42 (33, 51)
74 (66, 81)
72 (64, 80)
36 (24, 48)
64 (51, 76)
24. Hafta
40 (31, 48)
77 (69, 84)
74 (66, 82)
28 (17, 39)
58 (45, 71)
56. Hafta
75 (68, 82)
74 (66, 82)
51 (38, 64)
PASI75, hastaların %'si (%95 GA)
16. Hafta
21 (16, 27)
63 (56, 69)
53 (46, 60)
16 (10, 22)
52 (44, 61)
24. Hafta
27 (21, 33)
64 (58, 70)
59 (52, 65)
19 (12, 26)
54 (45, 62)
56. Hafta
65 (59, 72)
61 (55, 68)
52 (44, 61)
PASI90, hastaların %'si (%95 GA)
16. Hafta
12 (8, 17)
38 (32, 45)
39 (32, 45)
8 (4, 13)
35 (26, 43)
24. Hafta
17 (12, 22)
42 (35, 48)
45 (38, 52)
7 (3, 11)
36 (28, 44)
56. Hafta
49 (42, 56)
47 (40, 54)
41 (32, 49)
Kısaltmalar: ACR20 (veya 50 veya 70) = Amerikan Romatoloji Derneği ≥%20 (veya ≥%50 veya
≥% 70) iyileşme, ADA = Adalimumab; bDMARD = Biyolojik hastalık modifiye edici anti- romatizmal ilaç; IR = Yetersiz yanıt veren hasta; MDA = Minimal hastalık aktivitesi; PASI75 (veya 90) = Psöriyazis Alan ve Şiddet İndeksinde ≥%75 (veya ≥%90) iyileşme; PBO = Plasebo; UPA = Upadasitinib
Randomize tedaviyi bırakan veya değerlendirme haftasına ait verileri eksik olan hastalar, analizlerde yanıt vermeyenler olarak imputasyon uygulanmıştır. 24./56. haftadaki MDA, entezit düzelmesi ve daktilit düzelmesine ilişkin olarak, 16. haftada kurtarma tedavisi verilen gönüllüler, analizlerde yanıt vermeyenler olarak imputasyon uygulanmıştır.
Radyografik yanıt
SELECT-PsA 1'de, yapısal hasar progresyonunun inhibisyonu radyografik olarak değerlendirilmiş ve 24. haftada modifiye Total Sharp Skoru (mTSS) ve bunun bileşenleri olan erozyon skoru ve eklem boşluğu daralma skorunda başlangıca kıyasla yaşanan değişim şeklinde ifade edilmiştir.
Upadasitinib 15 mg ile tedavi, 24. haftada yapısal eklem hasarı progresyonunda plaseboya kıyasla istatistiksel olarak anlamlı ölçüde daha fazla inhibisyon sağlamıştır (Tablo 9). Erozyon ve eklem boşluğu daralma skorlarının, skorların geneliyle uyumlu olduğu bulunmuştur. Radyografik progresyon görülmeyen (mTSS'deki değişim ≤0,5) hastaların oranının, 24. haftada plaseboya kıyasla upadasitinib 15 mg ile daha yüksek olduğu bulunmuştur.
Tablo 9: SELECT-PsA 1'de radyografik değişimler
Tedavi Grubu
PBO
UPA
15 mg
ADA
40 mg
Modifiye Total Sharp Skoru, başlangıca kıyasla ortalama değişim (%95 GA)
24. Hafta
0,25 (0,13, 0,36)
-0,04 (-0,16, 0,07)
0,01 (-0,11, 0,13)
56. Hafta
0,44 (0,29, 0,59)
-0,05 (-0,20, 0,09)
-0,06 (-0,20, 0,09)
Radyografik progresyon görülmeyen hastaların oranı, % (%95 GA)
24. Hafta
92 (89, 95)
96 (94, 98)
95 (93, 97)
56. Hafta
89 (86, 92)
97 (96, 99)
94 (92, 97)
Kısaltmalar: ADA = Adalimumab; PBO = Plasebo; UPA = Upadasitinib
Fiziksel fonksiyon yanıtı ve sağlıkla ilişkili sonuçlar
SELECT-PsA 1'de, 15 mg upadasitinib ile tedavi edilen hastalar (-0,42 [%95 GA: -0,47, -0,37]),
plaseboya kıyasla (-0,14 [%95 GA: -0,18, -0,09]), 12. haftada HAQ-DI ile değerlendirilen fiziksel fonksiyonda başlangıca kıyasla istatistiksel olarak anlamlı iyileşme göstermiştir. Adalimumab ile tedavi edilen hastalarda iyileşme -0,34 olmuştur (%95 GA: -0,38, -0,29). SELECT-PsA 2'de, 15 mg upadasitinib ile tedavi edilen hastalarda (-0,30 [%95 GA: -0,37, - 0,24]), plaseboya kıyasla (-0,10 [%95 GA: -0,16, -0,03]), 12. haftada HAQ-DI ile değerlendirilen fiziksel fonksiyonda başlangıca kıyasla istatistiksel olarak anlamlı iyileşme gözlenmiştir. Fiziksel fonksiyondaki iyileşme, her iki çalışmada da 56. haftaya kadar korunmuştur.
Sağlıkla ilişkili yaşam kalitesi SF-36v2 ile değerlendirilmiştir. Her iki çalışmada da, upadasitinib 15 mg alan hastalar plaseboya kıyasla, 12. haftada Fiziksel Bileşen Özeti skorunda başlangıca kıyasla istatistiksel olarak anlamlı şekilde daha fazla iyileşme deneyimlemiştir. Her iki çalışmada da, başlangıca kıyasla gerçekleşen iyileşmeler 56. haftaya kadar devam etmiştir.
Her iki çalışmada da, upadasitinib 15 mg alan hastalarda plaseboya kıyasla, 12. haftada FACIT- F skoruyla ölçülen yorgunlukta başlangıca kıyasla istatistiksel olarak anlamlı iyileşme görülmüştür. Her iki çalışmada da, başlangıca kıyasla gerçekleşen iyileşmeler 56. haftaya kadar korunmuştur.
Başlangıçta psöriyatik spondilit, SELECT-PsA 1 ve SELECT-PsA 2'deki hastaların sırasıyla
%31 ve %34'ünde bildirilmiştir. Upadasitinib 15 mg ile tedavi edilen psöriyatik spondilitli hastalar plaseboya kıyasla, 24. haftada Bath Ankilozan Spondilit Hastalık Aktivite İndeksi (BASDAI) skorlarında başlangıca kıyasla iyileşme göstermiştir. Her iki çalışmada da, başlangıca kıyasla yaşanan iyileşmeler 56. haftaya kadar korunmuştur.
Aksiyal spondiloartrit
Radyografik olmayan aksiyal spondiloartrit
Günde bir kez uygulanan 15 mg upadasitinibin etkililiği ve güvenliliği, aktif radyografik olmayan aksiyal spondiloartritli 18 yaş ve üzeri hastalarda yapılan randomize, çift kör, çok merkezli, plasebo kontrollü bir çalışmada değerlendirilmiştir. SELECT-AXIS 2 (nr-axSpA) çalışması, en az iki NSAID'ye yetersiz yanıt vermiş ya da NSAID'lere karşı intoleransı veya kontrendikasyonu olan aktif radyografik olmayan aksiyal spondiloartritli 314 hastada yapılan
52 haftalık plasebo kontrollü bir çalışmadır. Hastalarda, artmış C-reaktif protein (CRP) düzeyleriyle (normalin üst sınırının üstünde olması olarak tanımlanır) gösterildiği üzere objektif enflamasyon bulgularının ve/veya manyetik rezonans görüntülemede (MRI) sakroiliit mevcut olması ve sakroiliak eklemlerde yapısal hasara ilişkin herhangi kesin bir radyografik kanıt bulunmaması gerekli kılınmıştır. Hastalarda, taramada ve başlangıç vizitlerinde Bath Ankilozan Spondilit Hastalık Aktivitesi İndeksi (BASDAI) skorunun ≥ 4 ve 0 – 10 puanlık bir sayısal derecelendirme ölçeğinde (NRS) Toplam Sırt Ağrısına İlişkin Hasta Değerlendirmesi skorunun ≥ 4 olması olarak tanımlandığı üzere aktif hastalık saptanmıştır. Başlangıçta, hastalarda ortalama 9,1 yıldır radyografik olmayan aksiyal spondiloartrit belirtileri vardır ve hastaların %29,1'i eş zamanlı bir csDMARD tedavisi almaktadır. Hastaların %32,9'unun bDMARD tedavisine yetersiz yanıt verdiği veya intolerans gösterdiği belirlenmiştir. Hastalar günde bir kez upadasitinib 15 mg veya plasebo almıştır. 52. haftada, plaseboya randomize edilen tüm hastalar, günde bir kez 15 mg upadasitinibe geçiş yapmıştır. Primer sonlanım noktası, 14. haftada Uluslararası SpondiloArtrit Değerlendirme Derneği 40 (ASAS40) yanıtı elde edilen hastaların oranı olarak belirlenmiştir. Bu çalışma, 2 yıla kadar devam eden uzun süreli bir uzatma dönemini içermiştir. Şimdiye dek, yalnızca 14. haftaya kadar elde edilen etkililik verileri mevcuttur ve sunulmuştur.
Klinik yanıt
SELECT-AXIS 2 (nr-axSpA) çalışmasında, 14. haftada plaseboya kıyasla 15 mg upadasitinib ile tedavi edilen hastaların anlamlı düzeyde daha büyük bir kısmında ASAS40 yanıtı elde edilmiştir (Tablo 10). 2. haftadan 14. haftaya kadar tüm zaman noktalarında tedavi grupları arasında sayısal bir fark gözlemlenmiştir.
Upadasitinib 15 mg ile tedavi, 14. haftada plaseboya kıyasla bireysel ASAS bileşenlerinde (hastalık aktivitesine ilişkin hasta genel değerlendirmesi, toplam sırt ağrısı değerlendirmesi, enflamasyon ve fonksiyon) ve hsCRP dahil olmak üzere hastalık aktivitesine ilişkin diğer ölçütlerde iyileşmelerle sonuçlanmıştır.
Upadasitinib 15 mg'ın etkililiği; cinsiyet, başlangıçtaki VKİ, radyografik olmayan aksiyal spondiloartrit semptomlarının süresi, başlangıçtaki hsCRP, MRG sakroiliit ve daha önceki bDMARD kullanımını içeren alt gruplarda gösterilmiştir.
Tablo 10 SELECT-AXIS 2 (nr-axSpA) Çalışmasında Klinik Yanıt
Tedavi Grubu
PBO
UPA 15 mg
N
157
156
ASAS40, hastaların oranı (%) (%95 GA)
14. Hafta
22,5 (16, 29,1)
44,9 (37,1, 52,7)
Plaseboya kıyasla fark (%95
GA)
22,2 (12,1, 32,3)
ASAS20, hastaların oranı (%) (%95 GA)
14. Hafta
43,8 (36, 51,5)
66,7 (59,3, 74,1)
ASAS Kısmi Remisyon, hastaların oranı (%) (%95 GA)
14. Hafta
7,6 (3,5, 11,8)
18,6 (12,5, 24,7)
BASDAI 50, hastaların oranı (%) (%95 GA)
14. Hafta
22,1 (15,5, 28,6)
42,3 (34,6, 50,1)
ASDAS-CRP'de başlangıca göre elde edilen değişiklik (%95 GA)
14. Hafta
-0,71 (-0,85, -0,56)
-1,36 (-1,50, -1,21)
ASDAS İnaktif Hastalık, hastaların oranı (%) (%95 GA)
14. Hafta
5,2 (1,7, 8,7)
14,1 (8,6, 19,6)
ASDAS Düşük Hastalık Aktivitesi, hastaların oranı (%) (%95 GA)
14. Hafta
18,3 (12,2, 24,4)
42,3 (34,6, 50,1)
Kısaltmalar: ASAS20 (veya ASAS40) = Uluslararası SpondiloArtrit Değerlendirme Derneği Ölçeğinde
≥%20 (veya ≥%40) iyileşme; ASDAS-CRP = Ankilozan Spondilit Hastalık Aktivitesi Skoru C-Reaktif Protein; BASDAI = Bath Ankilozan Spondilit Hastalık Aktivitesi İndeksi; PBO = Plasebo; UPA =
Upadasitinib
İkili sonlanım noktaları açısından, sonuçlar, çoklu impütasyon ile birlikte uygulanan yanıt vermeyen hasta impütasyonuna dayanmaktadır. Sürekli sonlanım noktaları açısından, sonuçlar, tekrarlanan ölçümler karma etki modelleri analizi kullanılarak başlangıca göre elde edilen en küçük kareler
ortalama değişikliğine dayanmaktadır.
Fiziksel fonksiyon yanıtı ve sağlıkla ilişkili sonuçlar
Upadasitinib 15 mg ile tedavi edilen hastalar, 14. haftada BASFI indeksiyle değerlendirildiği üzere plaseboya kıyasla başlangıca göre fiziksel fonksiyon bakımından anlamlı iyileşme göstermiştir.
Upadasitinib 15 mg ile tedavi edilen hastalar, 14. haftada plaseboya kıyasla toplam sırt ağrısı ve noktürnal sırt ağrısı bakımından anlamlı iyileşmeler göstermiştir.
Upadasitinib 15 mg ile tedavi edilen hastalar, 14. haftada plaseboya kıyasla ASQoL ve ASAS Sağlık İndeksiyle ölçüldüğü üzere sırasıyla sağlıkla ilişkili yaşam kalitesi ve genel sağlık bakımından anlamlı iyileşmeler göstermiştir.
Objektif enflamasyon ölçütü:
Enflamasyon bulguları MRG ile değerlendirilmiş ve sakroiliak eklemlerin Kanada Spondiloartrit Araştırma Konsorsiyumu (SPARCC) skorundaki başlangıca göre elde edilen değişiklik olarak ifade edilmiştir. 14. haftada, 15 mg upadasitinib ile tedavi edilen hastalarda, plaseboya kıyasla sakroiliak eklemlerdeki enflamasyon bulgularında anlamlı iyileşme gözlenmiştir.
Ankilozan spondilit (AS, radyografik aksiyal spondiloartrit)
Günde bir kez uygulanan 15 mg upadasitinibin etkililiği ve güvenliliği, Bath Ankilozan Spondilit Hastalık Aktivite İndeksi (BASDAI) ≥ 4 ve Hastanın Toplam Sırt Ağrısı Değerlendirmesi skoru ≥ 4'e göre aktif ankilozan spondiliti olan 18 yaş ve üzerindeki hastalarda randomize, çift kör, çok merkezli, plasebo kontrollü bir çalışmada değerlendirilmiştir. Bu çalışma, 2 yıla kadar devam eden uzun süreli bir uzatma dönemi içeriyordu.
SELECT-AXIS 1, en az iki non-steroid anti-enflamatuvar ilaca (NSAID'ler) yetersiz yanıt veren veya NSAID'lere karşı intoleransı bulunan veya NSAID'lerin kontrendike olduğu ve daha önce biyolojik DMARD'lara maruz kalmamış 187 ankilozan spondilit hastasında yapılan 14 haftalık bir çalışmaydı. Başlangıçta, hastaların ortalama ankilozan spondilit semptom süresi 14,4 yıldı ve hastaların yaklaşık %16'sı eş zamanlı bir csDMARD kullanıyordu. Hastalar günde bir kez 15 mg upadasitinib veya plasebo almıştır. 14. haftada, plaseboya randomize edilen tüm hastalar, günde bir kez upadasitinib 15 mg'a geçiş yapmıştır. Primer sonlanım noktası, 14. haftada Uluslararası SpondiloArtrit Değerlendirme Derneği 40 (ASAS40) yanıtı elde eden hastaların oranıydı.
SELECT-AXIS 2 (AS), daha önce DMARD'lara maruz kalmış 420 ankilozan spondilit hastasında yapılan (%77,4'ü bir TNF inhibitörü veya interlökin-17 inhibitörü (IL-17i) için etkisizlik yaşamıştı; %30,2'sinin intoleransı vardı; %12,9'unda daha önce ilaç maruziyeti vardı, ancak iki bDMARD'a karşı etkililik eksikliği yoktu) 14 haftalık bir çalışmaydı. Başlangıçta, hastaların ortalama ankilozan spondilit semptom süresi 12,8 yıldı ve hastaların yaklaşık %31'i eş zamanlı bir csDMARD kullanıyordu. Hastalar günde bir kez 15 mg upadasitinib veya plasebo almıştır. 14. haftada, plaseboya randomize edilen tüm hastalar, günde bir kez upadasitinib 15 mg'a geçiş yapmıştır. Primer sonlanım noktası, 14. haftada Uluslararası SpondiloArtrit Değerlendirme Derneği 40 (ASAS40) yanıtı elde eden hastaların oranıydı.
Klinik yanıt
Her iki çalışmada, 14. haftada ASAS40 yanıtı elde eden hastaların oranı, upadasitinib 15 mg ile tedavi edilen hastalarda plaseboya kıyasla anlamlı şekilde daha yüksek olmuştur (Tablo 11). ASAS40 için 2. haftada SELECT-AXIS 1'deki ve 4. haftada SELECT-AXIS 2'deki tedavi grupları arasında sayısal bir fark gözlenmiştir.
Upadasitinib 15 mg ile tedavi, plaseboya kıyasla, 14. haftada bireysel ASAS bileşenlerinde (hasta genel hastalık aktivitesi değerlendirmesi, toplam sırt ağrısı değerlendirmesi, enflamasyon ve fonksiyon) ve hsCRP da dahil olmak üzere diğer hastalık aktivitesi ölçütlerinde iyileşme sağlamıştır.
Upadasitinib 15 mg'ın etkililiği, cinsiyet, başlangıç VKİ, AS semptomlarının süresi ve başlangıç hsCRP ve daha önce bDMARD kullanımı da dahil olmak üzere, değerlendirilen alt gruplardan bağımsız şekilde gösterilmiştir.
Tablo 11: Klinik yanıt
Çalışma
SELECT-AXIS 1
bDMARD-Naif
SELECT-AXIS 2 (AS) bDMARD-IR
Tedavi Grubu
PBO
UPA 15 mg
PBO
UPA 15 mg
N
94
93
209
211
ASAS40, hastaların %'si (%95 GA)
14. Hafta
25,5 (16,7, 34,3)
51,6 (41,5, 61,8)
18,2 (13, 23,4)
44,5 (37,8, 51,3)
Plaseboya kıyasla fark
(%95 GA)
26,1 (12,6, 39,5)
26,4 (17,9, 34,9)
ASAS20, hastaların %'si (%95 GA)
14. Hafta
40,4 (30,5, 50,3)
64,5 (54,8, 74,2)
38,3 (31,7, 44,9)
65,4 (59, 71,8)
ASAS Kısmi Remisyon, hastaların %'si (%95 GA)
14. Hafta
1,1 (0, 3,1)
19,4 (11,3, 27,4)
4,3 (1,6, 7,1)
17,5 (12,4, 22,7)
BASDAI 50, hastaların %'si (%95 GA)
14. Hafta
23,4 (14,8, 32)
45,2 (35, 55,3)
16,7 (11,7, 21,8)
43,1 (36,4, 49,8)
ASDAS-CRP'de başlangıca kıyasla değişim (%95 GA)
14. Hafta
-0,54 (-0,71, -
0,37)
-1,45 (-1,62, - 1,28)
-0,49 (-0,62, -
0,37)
-1,52 (-1,64, - 1,39)
ASDAS İnaktif Hastalık, hastaların %'si (%95 GA)
14. Hafta
0
16,1 (8,7, 23,6)
1,9 (0,1, 3,8)
12,8 (8,3, 17,3)
ASDAS Düşük Hastalık Aktivitesi, hastaların %'si (%95 GA)
14. Hafta
10,6 (4,4, 16,9)
49,5 (39,3, 59,6)
10,1 (6, 14,2)
44,1 (37,4, 50,8)
ASDAS'da Majör İyileşme, hastaların %'si (%95 GA)
14. Hafta
5,3 (0,8, 9,9)
32,3 (22,8, 41,8)
4,8 (1,9, 7,7)
30,3 (24,1, 36,5)
Kısaltmalar: ASAS20 (veya ASAS40) = Uluslararası Spondilo Artrit Değerlendirme Derneğinde ≥%20 (veya
≥%40) iyileşme; ASDAS-CRP = Ankilozan Spondilit Hastalığı Aktivite Skoru C-Reaktif Protein; BASDAI
= Bath Ankilozan Spondilit Hastalık Aktivite İndeksi; PBO = Plasebo; UPA = Upadasitinib
İkili sonlanım noktalarına ilişkin olarak, 14. hafta sonuçları yanıt vermeyen hastaların imputasyonu (SELECT-AXIS 1) ve çoklu imputasyon bağlamında yanıt vermeyen hastaların imputasyonuna (SELECT- AXIS 2 [AS]) dayanmaktadır. Sürekli sonlanım noktalarına ilişkin olarak, 14. hafta sonuçları, tekrarlanan ölçüm analizine yönelik karma modeller kullanılarak elde edilen, başlangıca kıyasla en küçük kareler ortalama
değişimine dayanmaktadır.
SELECT-AXIS 1'de etkililik, Tablo 11'de sunulan sonlanım noktaları ile değerlendirildiği üzere 2 yıl boyunca sürdürülmüştür.
Fiziksel fonksiyon yanıtı ve sağlıkla ilgili sonuçlar
Her iki çalışmada, 15 mg upadasitinib ile tedavi edilen hastalar, plaseboya kıyasla, 14. haftada Bath Ankilozan Spondilit Fonksiyonel İndeksi (BASFI) ile değerlendirilen fiziksel fonksiyonda başlangıca kıyasla yaşanan değişimle anlamlı iyileşme göstermiştir. SELECT-AXIS 1'de BASFI'deki iyileşme 2 yıl boyunca sürdürülmüştür.
SELECT‑AXIS 2'de (AS), 15 mg upadasitinib ile tedavi edilen hastalar, plaseboya kıyasla, 14. haftada toplam sırt ağrısı ve noktürnal sırt ağrısında anlamlı iyileşme göstermiştir.
SELECT‑AXIS 2'de (AS), 15 mg upadasitinib ile tedavi edilen hastalar, plaseboya kıyasla, 14. haftada sırasıyla ASQoL ve ASAS Sağlık İndeksi ile ölçüldüğü üzere sağlıkla ilgili yaşam kalitesinde ve genel sağlıkta anlamlı iyileşme göstermiştir.
Entezit
SELECT‑AXIS 2'de (AS), 15 mg upadasitinib ile tedavi edilen, önceden var olan enteziti bulunan hastalar (n=310), plaseboya kıyasla, 14. haftada Maastricht Ankilozan Spondilit Entezit Skorunda (MASES) başlangıca kıyasla yaşanan değişimle ölçülen entezitte anlamlı iyileşme göstermiştir.
Spinal mobilite
SELECT‑AXIS 2'de (AS), upadasitinib 15 mg ile tedavi edilen hastalar, plaseboya kıyasla 14. haftada Bath Ankilozan Spondilit Metroloji İndeksi'ndeki (BASMI) başlangıca kıyasla yaşanan değişimle ölçülen spinal mobilitede anlamlı iyileşme göstermiştir.
Objektif enflamasyon ölçütü
Enflamasyon belirtileri MRG ile değerlendirilmiş ve omurgaya yönelik SPARCC skorunda başlangıca kıyasla yaşanan değişim şeklinde ifade edilmiştir. Her iki çalışmada 14. haftada, upadasitinib 15 mg ile tedavi edilen hastalarda, plaseboya kıyasla, omurgadaki enflamatuvar belirtilerde anlamlı iyileşme gözlenmiştir. SELECT-AXIS 1'de, MRG ile değerlendirildiği gibi enflamasyondaki iyileşme 2 yıl boyunca sürdürülmüştür.
Atopik dermatit
Günde bir kez upadasitinib 15 mg ve 30 mg'ın etkililiği ve güvenliliği randomize üç faz 3, çift kör, çok merkezli çalışmalarda (MEASURE UP 1, MEASURE UP 2 ve AD UP) toplam 2.584 hastada (12 yaş ve üzeri) değerlendirilmiştir. Upadasitinib, topikal ilaç(lar) ile yeterince kontrol edilemeyen orta veya şiddetli atopik dermatiti (AD) olan 344 adolesan ve 2.240 yetişkin hastada değerlendirilmiştir. Başlangıçta, hastalar şunların tümüne sahip olmalıydı: 0'dan 4'e artan bir şiddet ölçeğinde genel AD değerlendirmesinde (eritem, endürasyon/papülasyon ve sızma/kabuklanma) Araştırmacının Global Değerlendirmesi (vIGA-AD) skoru ≥ 3, Egzama Alanı ve Şiddeti Endeksi (EASI) skoru ≥ 16 (4 farklı vücut bölgesinde eritem, ödem/papülasyon, çizikler ve likenifikasyonun kapsamını ve şiddetini değerlendiren kompozit skor), minimum vücut yüzey alanı (BSA) ≥%10 tutulumu ve haftalık ortalama En Kötü Kaşıntı Sayısal Derecelendirme Ölçeği (NRS) ≥ 4.
Her üç çalışmada da, hastalar 16 hafta boyunca günde bir kez 15 mg, 30 mg veya eşleşen plasebo dozlarında upadasitinib almıştır. AD UP çalışmasında, hastalar aynı zamanda eş zamanlı topikal kortikosteroidler (TCS) de almıştır. Çift kör periyodun tamamlanmasının ardından, başlangıçta upadasitinibe randomize edilen hastalar, 260. haftaya kadar aynı dozu almaya devam etmiştir. Plasebo grubundaki hastalar, 260. haftaya kadar 15 mg veya 30 mg upadasitinib almak için 1:1 oranında yeniden randomize edilmiştir.
Başlangıç özellikleri
Monoterapi çalışmalarında (MEASURE UP 1 ve 2), hastaların %50'si başlangıç vIGA-AD skor 3 (orta) ve hastaların %50'sinde başlangıç vIGA-AD skor 4 (şiddetli) görülmüştür. Ortalama başlangıç EASI skoru 29,3 idi ve ortalama başlangıç haftalık ortalama En Kötü Kaşıntı NRS 7,3 idi. Eş zamanlı TCS çalışmasında (AD UP), hastaların %47,1'inde başlangıç vIGA-AD skor 3 (orta) ve hastaların %52,9'unda başlangıç vIGA-AD skor 4 (şiddetli) görülmüştür. Ortalama
başlangıç EASI skoru 29,7 idi ve ortalama başlangıç haftalık ortalama Çok Şiddetli Kaşıntı
NRS skoru 7,2 idi.
Klinik yanıt
Monoterapi (MEASURE UP 1 VE MEASURE UP 2) ve Eş Zamanlı TCS (AD UP) çalışmaları
15 mg veya 30 mg upadasitinib ile tedavi edilen anlamlı ölçüde daha yüksek oranda hastada
16. haftada plaseboya kıyasla vIGA-AD 0 veya 1, EASI 75 veya En Kötü Kaşıntı NRS ölçeğinde ≥ 4 puanlık bir iyileşme elde edilmiştir. Deri klirensi ve kaşıntı bakımından da hızlı iyileşmeler elde edilmiştir (bkz. Tablo 12).
Şekil 1'de, MEASURE UP 1 ve 2 çalışmaları için sırasıyla 16. haftaya kadar EASI 75 yanıtına ulaşan hastaların oranı ve En Kötü Kaşıntı NRS skorunda başlangıca göre elde edilen ortalama yüzde değişiklik gösterilmektedir.
Tablo 12: Upadasitinibe ilişkin etkililik sonuçları
Çalışma
MEASURE UP 1
MEASURE UP 2
AD UP
Tedavi grubu
PBO
UPA
15 mg
UPA
30 mg
PBO
UPA
15 mg
UPA
30 mg
PBO + TCS
UPA
15 mg
+ TCS
UPA
30 mg + TCS
Randomize edilen gönüllü sayısı
281
281
285
278
276
282
304
300
297
16. Hafta sonlanım noktaları, yanıt veren hasta oranı (%95 GA)
vIGA-AD
0/1
8
(5,12)
48 (42,54)
62 (56,68)
5
(2,7)
39 (33,45)
52 (46,58)
11
(7,14)
40 (34,45)
59 (53,64)
(ortak primer)
EASI 75
16
70
80
13
60
73
26
65
77
(ortak primer)
(12,21)
(64,75)
(75,84)
(9,17)
(54,66)
(68,78)
(21,31)
(59,70)
(72,82)
EASI 90
8
53
66
5
42
58
13
43
63
(5,11)
(47,59)
(60,71)
(3,8)
(37,48)
(53,64)
(9,17)
(37,48)
(58,69)
EASI 100
2
17
27
1
14
19
1
12
23
(0,3)
(12,21)
(22,32)
(0,2)
(10,18)
(14,23)
(0,3)
(8,16)
(18,27)
En Kötü
12
52
60
9
42
60
15
52
64
Kaşıntı NRS
(8,16)
(46,58)
(54,66)
(6,13)
(36,48)
(54,65)
(11,19)
(46,58)
(58,69)
(≥ 4 puanlık
iyileşme)
Erken başlangıç sonlanım noktaları, yanıt veren hasta oranı (%95 GA)
EASI 75
4
38
47
4
33
44
7
31
44
(2. Hafta)
(1,6)
(32,44)
(42,53)
(1,6)
(27,39)
(38,50)
(4,10)
(26,36)
(38,50)
En Kötü Kaşıntı NRS (1. haftada ≥ 4
puanlık iyileşme)
0
(0,1)
15 (11,19)
20 (15,24)
1
(0,2)
7(4,11)
16 (11,20)
3
(1,5)
12 (8,16)
19 (15,24)
Kısaltmalar: UPA= Upadasitinib (RINVOQ); PBO = Plasebo
Kurtarma tedavisi verilen veya verileri eksik olan gönüllüler 'yanıt vermeyen hasta' olarak değerlendirilmiştir. Plasebo grubunda 16. haftada kurtarma tedavisine rağmen EASI 75 ve vIGA-AD 0/1 kriterlerine yanıtsız olarak değerlendirilen hastaların sayı ve yüzdesi; MEASURE UP 1 çalışmasında 132 (%47), 31 (%11) ve 15 (%5,6),
MEASURE UP 2 çalışmasında 119 (%42,8), 24 (%8,7) ve 16 (%5,7), AD UP çalışmasında 78 (%25,7), 15 (%5)
ve 14 (%4,7) olarak görülmüştür.
≥ 4 puan olan hastalar)
upadasitinib tedavisine başlandıktan 2 gün sonra ve 15 mg upadasitinib tedavisine başlandıktan 1 gün sonra gibi erken bir zamanda görülmüştür.
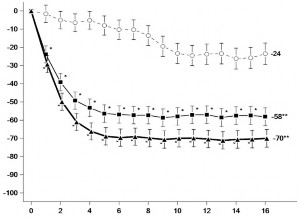
Şekil 1: MEASURE UP 1 ve MEASURE UP 2 çalışmalarında EASI 75 yanıtına ulaşan hastaların oranı ve En Kötü Kaşıntı NRS skorunda başlangıca göre elde edilen ortalama yüzde değişiklik
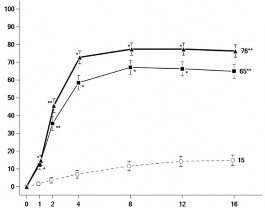
Aşağıdakilerin elde edildiği hastaların oranı: EASI 75 yanıtı
En Kötü Kaşıntı NRS skorunda başlangıca göre elde edilen ortalama yüzde değişiklik
Yanıt Oranı (%) ve %95 Güven Aralığı
Başlangıca Göre En İyi Yüzde Değişiklik (%) ve %95 Güven Aralığı
Hafta
Hafta

Plasebo

Plasebo
RINVOQ 15 mg QD

RINVOQ 15 mg QD

RINVOQ 30 mg QD

RINVOQ 30 mg QD
*: Çokluk kontrolü yapılmaksızın plaseboya karşı p < 0,001
**: Plaseboya karşı istatistiksel olarak anlamlıdır; p <0,001
Alt gruplardaki tedavi etkileri (vücut ağırlığı, yaş, cinsiyet, ırk ve daha önce immünosupresanlarla sistemik tedavi geçmişi), genel çalışma popülasyonundaki sonuçlarla tutarlı olmuştur.
15 mg veya 30 mg upadasitinib ile tedavi edilen hastalarda 16. haftada elde edilen sonuçlar 52.
hafta boyunca korunmaya devam etmiştir.
Yaşam kalitesi/hasta tarafından bildirilen sonuçlar
Tablo 13: 16. haftada upadasitinibe ilişkin olarak hasta tarafından bildirilen sonuçlar
Çalışma
MEASURE UP 1
MEASURE UP 2
Tedavi grubu
PBO
UPA
15 mg
UPA
30 mg
PBO
UPA
15 mg
UPA
30 mg
Randomize edilen hasta
sayısı
281
281
285
278
276
282
% yanıt verenler (%95 GA)
ADerm-SS Deride Ağrı
(≥ 4 puanlık iyileşme)
15
(10,20)
54
(47,60)
63 (57,69)
13
(9,18)
49 (43,56)
65 (59,71)
ADerm-IS Uyku
(≥ 12 puanlık iyileşme)
13
(9,18)
55 (48,62)
66 (60,72)
12
(8,17)
50 (44,57)
62 (56,69)
DLQI 0/1
4
(2,7)
30 (25,36)
41 (35,47)
5
(2,7)
24 (19,29)
38 (32,44)
HADS Anksiyete <8 ve HADS Depresyon < 8
14
(8,20)
46 (37,54)
49 (41,57)
11
(6,17)
46 (38,54)
56 (48,64)
Kısaltmalar: UPA= upadasitinib (RINVOQ); PBO = Plasebo; DLQI = Dermatoloji Yaşam Kalitesi İndeksi; HADS = Hastane Anksiyete ve Depresyon Ölçeği
Kurtarma tedavisi verilen veya verileri eksik olan gönüllüler 'yanıt vermeyen hasta' olarak değerlendirilmiştir.
Belirtilen eşik değerleri, klinik olarak önemli minimum önemli farklılığa (MCID) karşılık gelmektedir ve yanıtı değerlendirmek için kullanılmıştır.
Ülseratif kolit
Upadasitinibin etkililiği ve güvenliliği, şu üç çok merkezli, çift kör, plasebo kontrollü Faz 3 klinik çalışmada değerlendirilmiştir: İki adet birbirinin kopyası olan indüksiyon çalışması UC- 1 (U-ACHIEVE İndüksiyon) ile UC-2 (U-ACCOMPLISH) ve bir idame çalışması UC-3 (U- ACHIEVE İdame).
Hastalık şiddeti belirlenirken, 0 ile 9 arasında değişen ve her biri 0 (normal) ile 3 (en şiddetli) arasında skorlanan üç alt skoru olan, uyarlanmış Mayo skoru (aMS, Hekimin Global
Değerlendirmesi hariç Mayo skorlama sistemi) baz alınmıştır: Dışkı sıklığı alt skoru (SFS), rektal kanama alt skoru (RBS) ve merkezi olarak değerlendirilen endoskopi alt skoru (ES).
İndüksiyon çalışmaları (UC-1 ve UC-2)
UC-1 ve UC-2 çalışmalarında, 988 hasta (sırasıyla 473 ve 515 hasta), 8 hafta boyunca günde bir kez upadasitinib 45 mg veya plasebo almak üzere 2:1 oranında tedavi kollarına randomize edilmiş ve etkililik analizine dahil edilmiştir. Kaydedilen tüm hastalarda 2 veya 3 ES skoru ile birlikte 5 ila 9 arasında bir aMS skoru şeklinde tanımlanan orta ila şiddetli aktif ülseratif kolit vardı ve geçmiş konvansiyonel ve/veya biyolojik tedaviye yetersiz yanıt, yanıt kaybı veya intolerans da dahil olmak üzere geçmiş tedavi başarısızlığı gösterilmişti. Hastaların sırasıyla
%52'sinde (246/473) ve %51'inde (262/515) geçmişte en az 1 biyolojik tedavi altında tedavi başarısızlığı (geçmiş biyolojik tedavi başarısızlığı) görülmüştür. Hastaların sırasıyla %48'inde (227/473) ve %49'unda (253/515) geçmişte konvansiyonel tedavi altında tedavi başarısızlığı görülürken biyolojik tedavi altında (geçmişte biyolojik tedavi başarısızlığı yaşamamış olanlar) görülmemiştir.
UC-1 ve UC-2 çalışmalarında başlangıçta sırasıyla hastaların %39 ve %37'si kortikosteroidler,
%1,1 ve %0,6'sı metotreksat ve %68 ve %69'u aminosalisilatlar almaktaydı. Bu çalışmalar sırasında eş zamanlı tiopurin kullanımına izin verilmemiştir. Hastaların hastalık şiddeti hastaların %61 ve %60'ında orta dereceli (aMS ≥5, ≤7) ve hastaların %39 ve %40'ında şiddetli (aMS>7) idi.
Primer sonlanım noktası olarak, 8. haftada her aMS'e göre klinik remisyon araştırılmıştır. Tablo 14'te; klinik yanıt, mukozal iyileşme, histolojik-endoskopik mukozal iyileşme ve derin mukozal iyileşme de dahil olmak üzere primer ve kilit sekonder sonlanım noktaları gösterilmektedir.
Tablo 14: UC-1 ve UC-2 indüksiyon çalışmalarında 8. haftada primer ve kilit sekonder sonlanım son noktalarına ulaşan hastaların oranı
UC-1
(U-ACHIEVE)
UC-2
(U-ACCOMPLISH)
Sonlanım Noktası
PBO N=154
UPA
45 mg N=319
Tedaviler Arası Fark (%95 GA)
PBO N=174
UPA
45 mg N=341
Tedaviler arası fark (%95 GA)
Klinik remisyon
%4,8
%26,1
%21,6* (15,8,27,4)
%4,1
%33,5
%29* (23,2, 34,7)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
%0,4
%17,9
%17,5
%2,4
%29,6
%27,1
Geçmiş biyolojik tedavi başarısızlığı yaşamamış hastalar
%9,2
%35,2
%26
%5,9
%37,5
%31,6
Klinik yanıt
%27,3
%72,6
%46,3* (38,4,54,2)
%25,4
%74,5
%49,4* (41,7,57,1)
Önceki biyolojik tedavinin başarısız olduğu hastalar
%12,8
%64,4
%51,6
%19,3
%69,4
%50,1
Geçmiş biyolojik tedavi başarısızlığı yaşamamış hastalar
%42,1
%81,8
%39,7
%31,8
%79,8
%48
Mukozal iyileşme
%7,4
%36,3
%29,3* (22,6,35,9)
%8,3
%44
%35,1* (28,6, 41,6)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
%1,7
%27
%25,3
%4,8
%37,1
%32,3
Geçmiş biyolojik tedavi başarısızlığı yaşamamış hastalar
%13,2
%46,8
%33,6
%12
%51,2
%39,2
Histolojik-endoskopik
mukozal iyileşme
%6,6
%30,1
%23,7* (17,5, 30)
%5,9
%36,7
%30,1* (24,1, 36,2)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
%1,4
%22,7
%21,3
%4,6
%30,7
%26,1
Geçmiş biyolojik tedavi başarısızlığı yaşamamış hastalar
%11,8
%38,2
%26,4
%7,2
%42,9
%35,7
Derin mukozal
iyileşme
%1,3
%10,7
%9,7* (5,7, 13,7)
%1,7
%13,5
%11,3* (7,2, 15,3)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
0
%6,5
%6,5
%1,1
%9,2
%8,1
Geçmiş biyolojik tedavi başarısızlığı yaşamamış hastalar
%2,6
%15,4
%12,8
%2,4
%17,9
%15,5
Kısaltmalar: PBO = Plasebo; UPA= Upadasitinib; aMS = 0 ile 9 arasında değişen ve her biri 0 (normal) ila
3 (en şiddetli) arasında puanlanan üç alt puanı olan Mayo Puanlama sistemine (Pysician's Global Assessment hariç) dayalı uyarlanmış Mayo Puanı: Dışkı sıklığı alt puanı (SFS), rektal kanama alt skoru (RBS) ve merkezi olarak incelenen bir endoskopi alt skoru (ES).
*p <0,001, ayarlanmış tedaviler arası fark (%95 GA)
gösterir.
Hastalık aktivitesi ve semptomları
Kısmi uyarlanmış Mayo skoru (paMS), SFS ve RBS'den oluşmaktadır. Her paMS'e göre klinik yanıt, başlangıca kıyasla ≥1 puanlık ve ≥%30'luk bir azalma ve RBS'de ≥1 azalma veya mutlak RBS'nin ≤1 olması şeklinde tanımlanmaktadır. 2 hafta kadar erken bir dönemde her paMS'ye göre plaseboya kıyasla istatistiksel olarak anlamlı iyileşmeler görülmüştür (UC-1: %60,1'e karşı %27,3 ve UC-2: %63,3'e karşı %25,9).
Uzatılmış indüksiyon
UC-1 ve UC-2'de günde bir kez 45 mg upadasitinib ile 8 haftalık tedaviden sonra klinik yanıt elde edilemeyen toplam 125 hasta, 8 haftalık açık etiketli uzatılmış indüksiyon dönemine girmiştir. Bu ilave 8 haftalık (toplam 16 hafta) günde bir kez 45 mg upadasitinib tedavisinin ardından, hastaların %48,3'ünde her bir aMS'e göre klinik yanıt elde edilmiştir. 16 hafta süreyle
günde bir kez 45 mg upadasitinib tedavisine yanıt veren hastalar arasında, 52. haftaya gelindiğinde, günde bir kez 15 mg ve 30 mg upadasitinib idame tedavileri ile hastaların sırasıyla
%35,7'si ve %66,7'sinde her bir aMS'e göre klinik yanıt korunurken hastaların sırasıyla %19'u ve %33,3'ünde her bir aMS'e göre klinik remisyon elde edilmiştir.
İdame çalışması (UC-3)
UC-3 çalışmasının etkililik analizinde, 8 haftalık upadasitinib 45 mg günde bir kez indüksiyon tedavisi ile her aMS'ye göre klinik yanıt elde edilen 451 hasta değerlendirilmiştir. Hastalar, 52 haftaya kadar günde bir kez 15 mg upadasitinib, 30 mg upadasitinib veya plasebo alacak şekilde randomize edilmiştir.
Primer sonlanım noktası, 52. haftada her aMS'ye göre klinik remisyon olarak belirlenmiştir. Tablo 15'te; klinik remisyonun sürdürülmesi, kortikosteroid tedavisiz klinik remisyon, mukozal iyileşme, histolojik-endoskopik mukozal iyileşme ve derin mukozal iyileşme de dahil olmak üzere kilit sekonder sonlanım noktaları gösterilmektedir.
Tablo 15: UC-3 idame çalışmasında 52. haftada primer ve kilit sekonder sonlanım son noktalarına ulaşan hastaların oranı
PBO N=149
UPA
15 mg N=148
UPA
30 mg N=154
Tedaviler Arası Fark 15 mg Karşılık PBO (%95 GA)
Tedaviler Arası Fark 30 mg Karşılık PBO (%95 GA)
Klinik remisyon
%12,1
%42,3
%51,7
%30,7* (21,7, 39,8)
%39* (29,7, 48,2)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
%7,5
%40,5
%49,1
%33
%41,6
Geçmiş biyolojik tedavi başarısızlığı yaşamamış
hastalar
%17,6
%43,9
%54
%26,3
%36,3
Klinik remisyonun sürdürülmesi
N = 54
%22,2
N = 47
%59,2
N = 58
%69,7
%37,4* (20,3, 54,6)
%47* (30,7, 63,3)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
N = 22
%13,6
N = 17
%76,5
N = 20
%73
%62,8
%59,4
Geçmiş biyolojik tedavi başarısızlığı yaşamamış
hastalar
N = 32
%28,1
N = 30
%49,4
N = 38
%68
%21,3
%39,9
Kortikosteroid tedavisiz klinik remisyon
N = 54
%22,2
N = 47
%57,1
N = 58
%68
%35,4* (18,2, 52,7)
%45,1* (28,7, 61,6)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
N = 22
%13,6
N = 17
%70,6
N = 20
%73
%57
%59,4
Geçmiş biyolojik tedavi başarısızlığı yaşamamış
hastalar
N = 32
%28,1
N = 30
%49,4
N = 38
%65,4
%21,3
%37,2
Mukozal iyileşme
%14,5
%48,7
%61,6
%34,4* (25,1, 43,7)
%46,3* (36,7, 55,8)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
%7,8
%43,3
%56,1
%35,5
%48,3
Geçmiş biyolojik tedavi başarısızlığı yaşamamış hastalar
%22,5
%53,6
%66,6
%31,1
%44,1
Histolojik-endoskopik
mukozal iyileşme
%11,9
%35
%49,8
%23,8*
(14,8, 32,8)
%37,3*
(27,8, 46,8)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
%5,2
%32,9
%47,6
%27,7
%42,4
Geçmiş biyolojik tedavi başarısızlığı yaşamamış
hastalar
%20
%36,9
%51,8
%16,9
%31,8
Derin mukozal iyileşme
%4,7
%17,6
%19
%13* (6, 20)
%13,6* (6,6, 20,6)
Geçmiş biyolojik tedavinin başarısız olduğu hastalar
%2,5
%17,2
%16,1
%14,7
%13,6
Geçmiş biyolojik tedavi başarısızlığı yaşamamış
hastalar
%7,5
%18
%21,6
%10,6
%14,2
Kısaltmalar: PBO = Plasebo; UPA= Upadasitinib; aMS = 0 ile 9 arasında değişen ve her biri 0 (normal) ila 3 (en şiddetli) arasında puanlanan üç alt puanı olan Mayo Puanlama sistemine (Pysician's Global Assessment hariç) dayalı uyarlanmış Mayo Puanı: Dışkı sıklığı alt puanı (SFS), rektal kanama alt skoru (RBS) ve merkezi olarak incelenen bir endoskopi alt skoru (ES).
*p <0,001, ayarlanmış tedaviler arası fark (%95 GA)
remisyon.
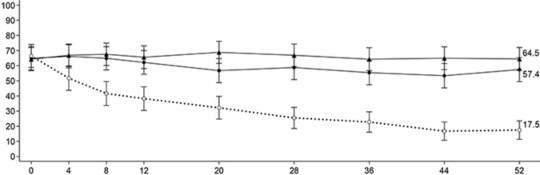
Hastalık semptomları
SFS ≤ 1 ve RBS = 0 olarak tanımlanan ve her paMS skoruna göre belirlenen semptomatik remisyon, zaman içinde plaseboya kıyasla hem günde bir kez 15 mg upadasitinib hem de 30 mg upadasitinib ile tedavi edilen daha fazla hastada 52. haftaya kadar elde edilmiştir (Şekil 2).
Cevap verenlerin yüzdesi ve
%95 Güvenlik Aralığı
Şekil 2: UC-3 idame çalışmasında zaman içinde kısmi uyarlanmış Mayo skoruna göre semptomatik remisyon elde edilen hasta oranı
Hafta

Hafta
Endoskopik değerlendirme
Endoskopik remisyon (mukozanın endoskopik görünümünün normalleşmesi) ES skoru 0 şeklinde tanımlanmıştır. 8. haftada, plaseboya kıyasla günde bir kez 45 mg upadasitinib ile tedavi edilen hastaların anlamlı şekilde daha büyük bir kısmında endoskopik remisyon elde edilmiştir (UC-1: %13,7'ye karşı %1,3, UC-2: %18,2'ye karşı %1,7). UC-3'te, günde bir kez 15 mg ve 30 mg upadasitinib ile tedavi edilen hastalarda plaseboya kıyasla anlamlı şekilde daha büyük oranda 52. haftada endoskopik remisyon elde edilmiştir (%24,2 ve %25,9'a karşı %5,6).
52. haftada mukozal iyileşmenin sürdürülmesi (friabilite olmadan ES ≤1), indüksiyon sonunda mukozal iyileşme elde eden hastalar arasında günde bir kez 15 mg ve 30 mg upadasitinib ile tedavi edilen hastalarda plaseboya kıyasla anlamlı şekilde daha yüksek oranlarda görülmüştür (%61,6 ve %69,5'e karşı %19,2).
Yaşam kalitesi
Plaseboya kıyasla günde bir kez upadasitinib ile tedavi edilen hastalar, enflamatuvar bağırsak hastalığı anketi (İBHA) ile ölçülen sağlıkla ilgili yaşam kalitesinde anlamlı şekilde daha yüksek ve klinik olarak anlamlı düzelme göstermiştir. 4 puan alan hastaların hepsinde iyileşme görülmüştür: Sistemik semptomlar (yorgunluk dahil), sosyal fonksiyon, duygusal fonksiyon ve bağırsak semptomları (karın ağrısı ve bağırsak sıkışması dahil). Günde bir kez 45 mg upadasitinib ile plaseboya kıyasla başlangıca göre 8. haftada İBHA skorundaki değişiklikler UC-1'de sırasıyla 55,3 ve 21,7 ve UC-2'de 52,2 ve 21,1 olmuştur. Başlangıca kıyasla 52. haftada İBHA skorundaki değişiklikler, günde bir kez 15, 30 mg upadasitinib ve plasebo ile tedavi edilen hastalarda sırasıyla 49,2, 58,9 ve 17,9 olmuştur.
Pediyatrik popülasyon
Yaşları 12 ila 17 arasında değişen ve orta dereceli veya şiddetli atopik dermatiti olan toplam 344 adolesan hasta, monoterapi olarak veya topikal kortikosteroidlerle kombinasyon halinde olmak üzere, 15 mg (N=114) veya 30 mg (N=114) upadasitinib ya da bu ilaçlarla eşleşen plasebo (N=116) almak üzere üç Faz 3 çalışmaya randomize edilmiştir. Etkililiğin adolesanlar ile yetişkinler arasında tutarlı olduğu belirlenmiştir. Adolesanlardaki güvenlilik profili genel olarak yetişkinlerdekiyle benzer bulunmuş olup aralarında nötropeni ve herpes zosterin de bulunduğu bazı advers olayların oranında doza bağlı artışlar görülmüştür. Her iki dozda da, nötropeni oranında yetişkinlere kıyasla adolesanlarda hafif bir artış meydana gelmiştir. Adolesanlarda 30 mg dozda görülen herpes zoster oranı yetişkinlerdekiyle benzer olmuştur. 30 mg upadasitinibin adolesanlardaki güvenlilik ve etkililik profili halen araştırılmaktadır.
Tablo 16: 16. haftada adolesanlar için upadasitinibe ilişkin olarak elde edilen etkililik sonuçları
Çalışma
MEASURE UP 1
MEASURE UP 2
AD UP
Tedavi Grubu
PBO
UPA
15 mg
PBO
UPA
15 mg
PBO + TCS
UPA
15 mg + TCS
Randomize edilen adolesan
hasta sayısı
40
42
36
33
40
39
Yanıt veren hastalar (%) (%95 GA)
vIGA-AD 0/1
8
(0,16)
38
(23,53)
3
(0,8)
42
(26,59)
8
(0,16)
31
(16,45)
EASI 75
8
(0,17)
71
(58,85)
14
(3,25)
67
(51,83)
30
(16,44)
56
(41,72)
En Kötü Kaşıntı
NRS
(≥ 4 puanlık iyileşme)
15
(4,27)
45
(30,6)
3
(0,8)
33
(16,50)
13
(2,24)
42
(26,58)
Kısaltmalar: UPA= Upadasitinib (RINVOQ); PBO = Plasebo
Kurtarma tedavisi verilen veya verileri eksik olan hastalar 'yanıt vermeyen hasta' olarak değerlendirilmiştir.
Avrupa İlaç Kurumu (EMA), kronik idiopatik artritte (romatoid artrit, psöriyatik artrit, spondiloartrit ve jüvenil idiopatik artrit dahil), atopik dermatitte ve ülseratif kolitteki pediyatrik popülasyonun bir veya daha fazla alt kümesinde upadasitinib ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünü ertelemiştir (pediyatrik kullanım hakkında bilgi için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerUpadasitinibin plazma maruziyetleri terapötik doz aralığından çok, dozla orantılıdır. Kararlı durum plazma konsantrasyonları, günde bir kez yapılan çoklu uygulamalardan sonra minimum birikme ile 4 gün içinde elde edilmektedir.
Emilim:
Upadasitinibin uzatılmış salımlı formülasyonunun oral yolla uygulanmasını takiben, upadasitinib 2 ila 4 saatlik medyan Tile emilmektedir. Upadasitinibin yağ bakımından zengin bir öğünle birlikte uygulanması, upadasitinib maruziyetleri üzerinde klinik olarak anlamlı bir etki göstermemiştir (EAA değerini %29 ve Cdüzeyini %39 ila %60 artmıştır). Klinik çalışmalarda upadasitinib yemeklerden bağımsız olarak uygulanmıştır (bkz. Bölüm 4.2). In vitro koşullarda upadasitinib, P-gp ve BCRP dışa akış taşıyıcıları için bir substrattır.
Dağılım:
Upadasitinib, plazma proteinlerine %52 oranında bağlanmaktadır. Kan/plazma oranının 1,0 olarak belirlenmesinin de gösterdiği gibi, upadasitinib plazma ve kan hücresi bileşenleri arasında benzer şekilde dağılmaktadır.
Biyotransformasyon:
Upadasitinibin metabolizmasına, CYP2D6'nın küçük bir potansiyel katkı
sıile, CYP3A4 aracılık etmektedir. Upadasitinibin farmakolojik aktivitesi ana moleküle bağlıdır. İnsanlarda radyoaktif işaretli ajan kullanılarak yapılan bir çalışmada, değişmemiş upadasitinib plazmadaki toplam radyoaktivitenin %79'unu oluştururken, ana metabolit (glukuronidasyonu izleyen mono-oksidasyon ürünü) toplam plazma radyoaktivitesinin %13'ünü oluşturmaktadır. Upadasitinib için herhangi bir aktif metabolit tanımlanmamıştır.Eliminasyon:
Tek doz uygulamasını takiben, çabuk salımlı [C]-upadasitinib çözeltisinin eliminasyonu ağırlıklı olarak idrar (%24) ve feçes (%38) yoluyla değişmemiş ana madde formunda gerçekleşmiştir. Upadasitinib dozunun yaklaşık %34'ü metabolit olarak atılmıştır. Upadasitinib ortalama terminal eliminasyon yarılanma ömrü 9 ila 14 saat arasında değişmiştir.
Doğrusallık/Doğrusal olmayan durum:
Upadasitinib plazma maruziyeti, terapötik doz aralığı boyunca dozla orantılıdır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Upadasitinib EAA'sı, normal böbrek fonksiyonuna sahip hastalara kıyasla hafif (tahmini glomerülar filtrasyon oranı 60-89 mL/dk/1,73 m), orta (tahmini glomerülar filtrasyon oranı 30- 59 mL/dk/1,73 m) ve şiddetli (tahmini glomerülar filtrasyon oranı 15-29 mL/dk/1,73 m) böbrek yetmezliği olan hastalarda sırasıyla %18, %33 ve %44 daha yüksektir. Upadasitinib C, normal ve böbrek fonksiyonu bozulmuş hastalarda benzerdir. Hafif veya orta derecede böbrek yetmezliğinin, upadasitinib maruziyeti üzerinde klinik olarak anlamlı bir etkisi yoktur (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
Hafif (Child-Pugh A) ve orta derecede (Child-Pugh B) karaciğer yetmezliğinin, upadasitinib maruziyetinde klinik olarak anlamlı hiçbir etkisi yoktur. Normal karaciğer fonksiyonuna sahip hastalara kıyasla upadasitinib EAA'sı, hafif ve orta derecede karaciğer yetmezliği olan hastalarda sırasıyla %28 ve %24 daha yüksektir. Upadasitinib C, normal karaciğer fonksiyonuna sahip hastalara kıyasla hafif karaciğer yetmezliği olan hastalarda değişmemiştir ve orta derecede karaciğer yetmezliği olanlarda %43 daha yüksektir. Şiddetli (Child Pugh C) karaciğer yetmezliği olan hastalarda upadasitinib çalışılmamıştır.
Pediyatrik popülasyon:
Upadasitinibin farmakokinetiği romatoid artrit, psöriyatik artrit, aksiyal spondiloartriti ve ülseratif koliti olan pediyatrik hastalarda henüz değerlendirilmemiştir (bkz. Bölüm 4.2).
Upadasitinibin farmakokinetiği ve kararlı durum konsantrasyonları, atopik dermatiti olan yetişkinler ve 12-17 yaş arası adolesanlarda benzerdir. Vücut ağırlığı 30 kg ila < 40 kg arasında olan adolesan hastalarda pozoloji, popülasyon farmakokinetik modellemesi ve simülasyonu kullanılarak belirlenmiştir.
Atopik dermatiti olan pediyatrik hastalarda (<12 yaş) upadasitinibin farmakokinetiği belirlenmemiştir.
İntrinsik faktörler:
Yaş, cinsiyet, vücut ağırlığı, ırk ve etnik köken, upadasitinib maruziyetinde klinik olarak anlamlı bir etkiye sahip değildir. Upadasitinibin farmakokinetiği, romatoid artrit, psöriyatik artrit, aksiyal spondiloartrit, atopik dermatit ve ülseratif kolit hastaları arasında tutarlıdır.
5.3. Klinik öncesi güvenlilik verileri
Konvansiyonel güvenlilik farmakolojisi çalışmalarına göre, klinik dışı veriler insanlar için özel bir tehlike olmadığını göstermektedir.
Erkek ve dişi Sprague-Dawley sıçanlarında gerçekleştirilen 2 yıllık bir karsinojenisite çalışmasında upadasitinib, 15 mg klinik dozun sırasıyla yaklaşık 4 ve 10 katı, 30 mg klinik dozun sırasıyla 2 ve 5 katı ve 45 mg'lik klinik dozun 1,6 ve 4 katı maruziyetlerinde (EAA'ya göre) kanserojen bulunmamıştır. Upadasitinib, CByB6F1-Tg (HRAS)2Jic transjenik farelerde 26 haftalık bir karsinojenisite çalışmasında karsinojenik bulunmamıştır.
Upadasitinib, gen mutasyonları ve kromozom bozuklukları için in vitro ve in vivo testlerin
sonuçlarına göre mutajenik veya genotoksik değildir.
Fertilite ve erken dönem embriyo gelişimi çalışmasında EAA bazında gerçekleştirilen bir çalışmada, upadasitinibin önerilen maksimum insan dozunun (MRHD) yaklaşık 16 ve 31 kat
üzerindeki maruziyetinin erkek ve dişi sıçanlardaki fertiliteye etkisi olmamıştır. Sıçanlarda yapılan bu fertilite çalışmasında, implantasyon sonrası kayıplarla ilişkili fetal rezorbsiyonlarda görülen doza bağlı artışların, upadasitinibin gelişimsel/teratojenik etkilerine bağlı olduğu kabul edilmiştir. Klinik maruziyetin altındaki maruziyet düzeylerinde (EAA'ya göre) herhangi bir advers etki gözlemlenmemiştir. İmplantasyon sonrası kayıplar, 45 mg MRHD'de (EAA'ya göre) klinik maruziyetin 8 katı maruziyet düzeylerinde gözlemlenmiştir.
Hayvanlarda gerçekleştirilen embriyofetal gelişim çalışmalarında, upadasitinibin hem sıçanlarda hem de tavşanlarda teratojenik olduğu belirlenmiştir. Upadasitinib, sıçanlarda sırasıyla 15 mg, 30 mg ve 45 mg (MRHD) dozlarda klinik maruziyetin (EAA'ya göre) 1,6, 0,8 ve 0,6 katında iskelet sistemi malformasyonlarında artışa neden olmuştur. Tavşanlarda, sırasıyla 15 mg, 30 mg ve 45 mg dozlarında (EAA'ya göre) klinik maruziyetin 15, 7,6 ve 5,6 katında kardiyovasküler malformasyonların insidansında artış gözlemlenmiştir.
Upadasitinibin emziren sıçanlara verilmesini takiben zaman içinde sütün içindeki upadasitinib konsantrasyonları maternal plazmaya göre, sütte yaklaşık 30 kat daha yüksek maruziyet ile plazmada bulunanlara genel olarak paralel olmuştur. Sütte upadasitinibe bağlı maddenin yaklaşık %97'si ana molekül olan upadasitinibtir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet içeriği:
Mikrokristalin selüloz (E460) Hipromelloz 2208
Mannitol (E421) Tartarik asit (E334) Silika, kolloidal susuz Magnezyum stearat Film kaplama:
Polivinil alkol (E1203) Makrogol 3350
Talk (E553b)
Titanyum dioksit (E171) Siyah demir oksit (E172) Kırmızı demir oksit (E172)
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklayınız.
Nemden korumak için orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
28 veya 98 adet uzatılmış salımlı tablet içeren kutularda polivinilklorür/polietilen/poliklorotrifluoroetilen - alüminyum takvim blisterler.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürün ya da atık materyaller, “Tıbbi Atıkların Kontrolü†ve “Ambalaj Atıklarının Kontrolü†yönetmeliklerine uygun olarak imha edilmelidir.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
İLAÇ GENEL BİLGİLERİ
AbbVie Tibbi İlaçlar San. Tic. Ltd. Şti.
| Satış Fiyatı | 13188.99 TL [ 18 Apr 2025 ] |
| Önceki Satış Fiyatı | 13188.99 TL [ 14 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8680656080575 |
| Etkin Madde | Upadasitinib |
| ATC Kodu | L04AA44 |
| Birim Miktar | 15 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |




