RISPERDAL CONSTA 50 mg 1 enjektör Kısa Ürün Bilgisi
{ Risperidon }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
RISPERDAL CONSTA 50 mg IM enjeksiyonluk uzatılmış salımlı süspansiyon Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Risperidon 50 mg
Sulandırıldıktan sonra, 1 ml süspansiyon 25 mg risperidon içerir.
Yardımcı maddeler
Her 1 ml süspansiyonda:
Sodyum klorür 6 mg
Sodyum hidroksit 0,54 mg
Karmeloz sodyum 40mPa.s 22,5 mg Disodyum hidrojen fosfat dihidrat 1,27 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk uzatılmış salımlı süspansiyon
Beyaz-beyazımsı serbest akıcı toz içeren flakon ve berrak, renksiz, seyreltici içeren kullanıma hazır dolu enjektör
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
RISPERDAL CONSTA şizofreni ve şizoafektif bozukluk tedavisinde endikedir. RISPERDAL CONSTA, pozitif (halüsinasyon, delüzyon, düşünce bozuklukları, saldırganlık, şüphecilik) ve/veya negatif (künt afekt, emosyonel ve sosyal çekingenlik ve konuşma yetersizliği) semptomların belirgin olduğu, erken dönem psikozlar, akut şizofrenik alevlenmeler, kronik şizofreni ve diğer psikotik durumlar dahil şizofreni hastalarının tedavisinde endikedir.
RISPERDAL CONSTA şizofreni ile ilgili afektif semptomları (depresyon, suçluluk duygusu, endişe) da azaltır.
RISPERDAL CONSTA (risperidon), duygu durum epizotlarının oluşmasını geciktirmek amacıyla bipolar I bozukluğun tedavisinde monoterapi veya lityum ve valproat tedavisine ek olarak kullanılabilir. (bkz. Bölüm 5.1).
RISPERDAL CONSTA, bipolar I bozukluğu olan hastalarda, duygu durum epizotlarının oluşmasını geciktirmek amacıyla destekleyici idame tedavisi olarak endikedir (bkz. Bölüm 5.1).
4.2. Pozoloji ve uygulama şekli
Pozoloji:RISPERDAL CONSTA iki haftada bir uygulanmalıdır. Yetişkinler
Önerilen doz iki haftada bir intramüsküler 25 mg'dır. Bazı hastalarda 37,5 mg ya da 50 mg gibi daha yüksek dozlarla yarar sağlanabilir. Klinik çalışmalarda, şizofreni hastalarında 75 mg ile ek fayda gözlenmemiştir. Bipolar bozukluğu olan hastalarda 50 mg'ın üzerindeki dozlar çalışılmamıştır. İki haftada bir 50 mg'dan daha yüksek dozlar önerilmemektedir.
İlk RISPERDAL CONSTA enjeksiyonundan sonraki üç haftalık gecikme döneminde yeterli düzeyde oral risperidon veya bir önceki antipsikotik ilaç desteği verilmelidir (bkz. Bölüm 5.2).
Başlangıç dozu
Önerilen doz iki haftada bir intramüsküler 25 mg'dır. İki hafta veya daha uzun süre sabit dozda oral risperidon kullanan hastalar için aşağıda verilen döngü dikkate alınmalıdır. 4 mg veya daha düşük dozda oral risperidon ile tedavi edilen hastalar 25 mg RISPERDAL CONSTA, daha
yüksek oral dozlarla tedavi edilen hastalar için ise 37,5 mg'lık daha yüksek RISPERDAL CONSTA dozu düşünülmelidir.
Hastalar halihazırda oral risperidon almıyorsa, I.M. başlangıç dozunu seçerken oral ön tedavi dozajı düşünülmelidir. Önerilen başlangıç dozu iki haftada bir 25 mg RISPERDAL CONSTA'dır. Oral antipsikotiklerin daha yüksek dozlarını kullananan hastalar için 37,5 mg'lık daha yüksek RISPERDAL CONSTA dozu düşünülmelidir.
İlk RISPERDAL CONSTA enjeksiyonundan sonraki üç haftalık gecikme döneminde oral risperidon veya bir önceki antipsikotik ile yeterli antipsikotik koruma sağlandığından emin olunmalıdır. (bkz. Bölüm 5.2).
RISPERDAL CONSTA, ilk RISPERDAL CONSTA enjeksiyonunu takiben üç haftalık gecikme döneminde oral risperidon veya bir önceki antipsikotik ile yeterli antipsikotik koruma sağlanmadan şizofreninin akut alevlenmelerinde kullanılmamalıdır.
İdame dozu
Çoğu hasta için önerilen doz iki haftada bir kas içine 25 mg'dır. Bazı hastalar 37,5 mg veya 50 mg şeklinde daha yüksek dozlardan fayda sağlayabilirler.
Klinik çalışmalarda 75 mg ile ek bir yarar gözlenmemiştir. 2 haftada bir 50 mg'dan yüksek dozlar önerilmez.
Uygulama sıklığı ve süresi:
Artırma yönündeki doz ayarlamaları 4 haftadan sık aralıklarla yapılmamalıdır. Bu doz ayarlamasının etkisinin, ilk yüksek doz uygulamasından sonraki 3 haftadan önce etkili olması beklenmemelidir.
Uygulama şekli:
Daha önce risperidon kullanmamış hastalarda, RISPERDAL CONSTA tedavisine başlanmadan önce oral risperidonun tolere edilebilirliğinin tayin edilmesi önerilir.
RISPERDAL CONSTA uygun emniyetli iğne kullanılarak, kalçadan (gluteal uygulama) veya omuzdan (deltoid uygulama) derin intramüsküler enjeksiyon yolu ile uygulanmalıdır. Omuzdan enjeksiyon için 1-inch'lik iğne kullanılmalıdır ve enjeksiyon omuzlar arasında dönüşümlü olarak yapılmalıdır. Kalçadan enjeksiyon için 2-inch'lik iğne kullanılmalıdır ve enjeksiyon
kalçalar arasında dönüşümlü olarak yapılmalıdır. İntravenöz yolla uygulanmamalıdır (bkz. Bölüm 4.4).
Ürünü uygulamadan önce rekonstrüksiyon ile ilgili talimatlar için bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği:
Karaciğer veya böbrek yetmezliği bulunan hastalarda RISPERDAL CONSTA kullanımına ilişkin bir çalışma yapılmamıştır.
Karaciğer veya böbrek yetmezliği bulunan hastaların RISPERDAL CONSTA ile tedavi edilmeleri gerekirse ilk hafta boyunca günde iki defa 0,5 mg oral risperidon başlangıç dozu önerilir. Tedavinin ikinci haftasında günde iki defa 1 mg ya da günde bir defa 2 mg verilebilir. En az 2 mg düzeyindeki toplam günlük oral doz iyi tolere edilebiliyorsa iki haftada bir 25 mg RISPERDAL CONSTA enjeksiyonu uygulanabilir.
İlk RISPERDAL CONSTA enjeksiyonunu takiben üç haftalık gecikme süresi boyunca yeterli antipsikotik koruma sağlanmalıdır (bkz. Bölüm 5.2).
Pediyatrik popülasyon:
RISPERDAL CONSTA'nın güvenliliği ve etkililiği 18 yaşın altındaki çocuklarda çalışılmamıştır. Veri bulunmamaktadır.
Geriyatrik popülasyon:
Doz ayarlaması gerekmez. Önerilen doz, iki haftada bir kas içine 25 mg'dır.
Hastalar hali hazırda oral risperidon almıyorsa, önerilen doz iki haftada bir 25 mg RISPERDAL CONSTA'dır. İki hafta veya daha uzun bir süredir sabit bir oral risperidon dozu ile tedavi edilen hastalar için, aşağıdaki dönüşüm şeması dikkate alınmalıdır. 4 mg veya daha düşük dozda oral risperidon ile tedavi edilen hastalar 25 mg RISPERDAL CONSTA alırken, daha yüksek oral dozlarla tedavi edilen hastalar için daha yüksek olan 37,5 mg RISPERDAL CONSTA dozu düşünülmelidir.
İlk RISPERDAL CONSTA enjeksiyonunu takiben üç haftalık bir gecikme süresi boyunca yeterli antipsikotik koruma sağlanmalıdır (bkz. Bölüm 5.2). Yaşlılarda RISPERDAL CONSTA klinik verileri sınırlıdır. RISPERDAL CONSTA yaşlılarda dikkatli kullanılmalıdır.
4.3. Kontrendikasyonlar
RISPERDAL CONSTA, etkin madde veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlı olduğu bilinen hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Daha önce risperidon kullanmamış hastalarda, RISPERDAL CONSTA tedavisine başlanmadan önce oral risperidonun tolere edilebilirliğinin tayin edilmesi önerilir (bkz. Bölüm 4.2).
Demanslı yaşlı hastalar
Konvansiyonel ve atipik antipisikotik ilaçlar demansa bağlı psikozu olan yaşlı hastaların tedavisinde kullanıldığında serebrovasküler olaylar, enfeksiyon, kalp yetmezliği ile ani ölüm vb. nedenlerle ölüm riskinde artışa neden olmaktadır.
RISPERDAL CONSTA ile demanslı yaşlı hastalar üzerinde çalışma yapılmamıştır; bu nedenle, bu hasta grubunda kullanım için endike değildir. RISPERDAL CONSTA, demansa bağlı davranışsal bozuklukların tedavisi için ruhsatlandırılmamıştır.
Demanslı yaşlılarda artmış mortalite
Oral RISPERDAL dahil, atipik antipsikotiklerle yürütülen 17 kontrollü araştırmanın meta analizinde, atipik antipsikotiklerle tedavi edilen demanslı yaşlı hastalarda, mortalitede plaseboya kıyasla artış görülmüştür. Bu popülasyonda oral RISPERDAL ile yürütülen plasebo kontrollü araştırmalarda mortalite insidansı, RISPERDAL tedavisindeki hastalarda % 4 iken, plasebo tedavisindeki hastalarda % 3,1 olmuştur. Olasılık oranı (% 95 tam güven aralığı) 1,21 (0,7-2,1). Ölen hastaların ortalama yaşı 86'ydı (aralık 67-100). İki geniş gözlemsel çalışmanın verileri, konvansiyonel antipsikotiklerle tedavi edilen demanslı yaşlı kişilerde de, tedavi görmeyenlere kıyasla, ölüm riskinde küçük bir artış olduğunu göstermiştir. Mevcut veriler, riskin gerçek boyutunun tam bir şekilde tahmin edilmesi için yetersizdir ve risk artışının nedeni
bilinmemektedir. Gözlemsel çalışmalardaki mortalite artışı bulgularının hangi oranda antipsikotik ilaca veya hastaların sahip oldukları bazı özelliklere bağlanabileceği açık değildir.
Furosemidle birlikte kullanım
Demansı olan yaşlı hastalarda oral RISPERDAL ile yürütülen plasebo kontrollü çalışmalarda, tek başına risperidon (% 3,1; ortalama yaş 84 (yaş aralığı 70-96)) veya tek başına furosemid alanlara (% 4,1; ortalama yaş 80 (yaş aralığı 67-90)) göre, furosemid+risperidon ile tedavi edilen hastalarda (% 7,3; ortalama yaş 89 (yaş aralığı 75-97)) daha yüksek mortalite oranları gözlenmiştir. Furosemid+risperidon tedavisi ile hastalarda mortalitede artış 4 klinik çalışmanın 2'sinde gözlenmiştir. Risperidonun diğer diüretiklerle birlikte uygulanması (esas olarak düşük dozda kullanılan tiyazid diüretikleri) benzer bulgular ile ilişkili değildir.
Bu bulguyu açıklayacak bir patofizyolojik mekanizma tanımlanamamış ve ölüm nedeni belli bir sebeple bağlantılı bulunmamıştır. Ancak kullanım kararından önce dikkat edilmeli ve bu kombinasyonun veya diğer güçlü diüretiklerle birlikte uygulamanın risk ve yararları değerlendirilmelidir. Risperidon ile birlikte diğer diüretiklerin kullanımında hastalarda artan mortalite insidansına rastlanmamıştır. Tedaviden bağımsız olarak dehidratasyon, mortalite için genel bir risk faktörüdür ve bu nedenle demansı olan yaşlı hastalarda dikkatle kaçınılması gerekir.
Serebrovasküler advers olaylar
Demanslı popülasyonda, bazı atipik antipsikotiklerle yapılan randomize plasebo kontrollü klinik çalışmalarda serebrovasküler advers olay riskinde yaklaşık 3 kat artış görülmüştür. Çoğunlukla demanslı yaşlı hastalarda (>65 yaş) RISPERDAL ile altı plasebo kontrollü çalışmadan toplanan veriler, serebrovasküler advers olayların (ciddi ve ciddi olmayan, birlikte) risperidon ile tedavi edilen hastaların % 3,3'ünde (33/1009) ve plasebo ile tedavi edilen hastaların % 1,2'sinde (8/712) meydana geldiğini göstermiştir. Olasılık oranı (% 95 tam güven aralığı) 2,96'dır (1,34; 7,5). Bu artan riske yönelik mekanizma bilinmemektedir. Diğer antipsikotikler ve diğer hasta popülasyonlarında artan risk göz ardı edilemez.
RISPERDAL CONSTA inme için risk faktörü taşıyan hastalarda dikkatli kullanılmalıdır.
Ortostatik hipotansiyon
Risperidonun alfa-adrenerjik reseptörleri bloke etmesine bağlı olarak özellikle tedavinin başlangıç döneminde (ortostatik) hipotansiyon görülebilir. Pazarlama sonrasında risperidon ve antihipertansif tedavinin eşzamanlı kullanılması ile klinik olarak belirgin hipotansiyon gözlenmiştir. Risperidon kardiyovasküler hastalığı (örneğin, kalp yetmezliği, miyokard enfarktüsü, ileti anomalileri, dehidratasyon, hipovolemi veya serebrovasküler hastalık) olduğu bilinen hastalarda dikkatle kullanılmalıdır. Klinik açıdan belirgin ortostatik hipotansiyon devamlı olarak görülürse RISPERDAL CONSTA tedavisinin devamının yarar/risk değerlendirmesi yapılmalıdır.
Lökopeni, nötropeni ve agranülositoz
RISPERDAL CONSTA dahil olmak üzere, antipsikotik ajanlarla lökopeni, nötropeni ve agranülositoz olayları bildirilmiştir. Pazarlama sonrası izlemde agranülositoz çok nadiren (<1/10.000 hasta) bildirilmiştir.
Klinik olarak anlamlı düzeyde düşük beyaz kan hücresi (WBC) sayımı veya ilaçla tetiklenmiş lökopeni/nötropeni öyküsüne sahip hastalar tedavinin ilk birkaç ayı boyunca izlenmeli ve ortada başka nedensel faktörler yokken WBC'de klinik olarak anlamlı bir düşüşe yönelik ilk belirtide RISPERDAL CONSTA kullanımına son verilmesi düşünülmelidir.
Klinik olarak anlamlı nötropenisi olan hastalar ateş veya diğer enfeksiyon semptomları veya belirtileri açısından dikkatle izlenmeli ve bu tür semptomlar veya belirtilerin ortaya çıkması halinde derhal tedavi edilmelidir. Şiddetli nötropenisi olan hastalar (mutlak nötrofil sayımı <1 X 10/L) RISPERDAL CONSTA kullanımına son vermeli ve hasta iyileşene kadar WBC düzeylerini takip ettirmelidir.
Tardif diskinezi/ekstrapiramidal semptomlar (TD/EPS)
Dopamin reseptör antagonisti özelliğe sahip olan ilaçlar, özellikle dil ve/veya yüzde istemsiz ritmik hareketler ile karakterize tardif diskinezi gelişimi ile ilgili bulunmuştur. Ekstrapiramidal semptomların görülmesinin tardif diskinezi gelişiminde bir risk faktörü olduğu bildirilmiştir. Tardif diskinezi bulgu veya semptomları görülürse tüm antipsikotiklerin kesilmesi düşünülmelidir.
Psikostimulanlarla (örneğin; metilfenidat) risperidonu birlikte kullanan hastalarda, ilaçlardan birini veya her ikisini ayarlarken ekstrapiramidal semptomlar ortaya çıkabileceği için dikkatli olunmalıdır. Stimulan tedavisinin kademeli olarak kesilmesi önerilir (bkz. Bölüm 4.5).
Nöroleptik malign sendrom (NMS)
Hipertermi, kas rijiditesi, otonom instabilite, bilinç değişikliği ve serum kreatinin fosfokinaz düzeyinin yükselmesi ile karakterize olan Nöroleptik Malign Sendromunun, antipsikotiklerin kullanımına bağlı olarak oluştuğu bildirilmiştir. İlave belirtiler, miyoglobinüri (rabdomiyoliz) ve akut böbrek yetmezliği olabilir. Bu durumda, RISPERDAL CONSTA dahil olmak üzere tüm antipsikotikler kesilmelidir.
Parkinson hastalığı ve Lewy cisimlerinin bulunduğu demans
Parkinson Hastalığı veya Lewy Cisimcikli Demansı (LCD) olan hastalara RISPERDAL dahil antipsikotikler reçete edilirken, hekimler risk/yarar değerlendirmesi yapmalıdır. Parkinson hastalığı risperidon ile kötüleşebilir. Her iki grupta da antipsikotik ilaçlara duyarlılık artabileceği gibi Nöroleptik Malign Sendrom riski de artabilir. Bu hastalar klinik araştırmaların dışında tutulmuşlardır. Bu artan duyarlılığın semptomları arasında, ekstrapiramidal semptomlara ek olarak, konfüzyon, obtundasyon ve sık düşmelerin olduğu postural instabilite bulunabilir.
Aşırı duyarlılık reaksiyonları
RISPERDAL CONSTA ile tedaviye başlamadan önce oral risperidon ile tolere edilebilirlik belirlenmesine rağmen, pazarlama sonrası deneyimlerde önceden oral risperidonu tolere etmiş hastalarda nadiren anafilaktik reaksiyon meydana geldiği rapor edilmiştir (bkz. bölüm 4.2 ve Bölüm 4.8).
Eğer hipersensitive reaksiyonları meydana gelirse, RISPERDAL CONSTA kullanmaya devam etmeyiniz, klinik olarak uygun genel destekleyici tedbirleri başlatınız ve belirtiler ve semptomlar ortadan kalkıncaya kadar hastayı gözlemleyiniz (bkz. Bölüm 4.3. ve Bölüm 4.8).
Hiperglisemi ve diabetes mellitus
RISPERDAL CONSTA tedavisi sırasında hiperglisemi, diabetes mellitus ve önceden var olan diyabetin alevlendiği bildirilmiştir.
Bazı olgularda, vücut ağırlığında önceden meydana gelen artışın yatkınlık kazandırıcı/zemin hazırlayan bir etmen olabileceği bildirilmiştir. Ketoasidoz ile ilişki çok nadir olarak ve diyabetik koma ile ilişki nadir olarak rapor edilmiştir. Uygun klinik izlem, kullanılan antipsikotik kılavuz kurallarına uygun olarak tavsiye edilebilir. RISPERDAL dahil olmak üzere herhangi bir atipik antipsikotik ile tedavi edilen hastalarda hiperglisemi semptomları (örneğin, polidipsi, poliüri, polifaji ve halsizlik gibi) izlenmelidir ve diyabet hastaları glukoz kontrolünün kötüleşmesi açısından düzenli olarak takip edilmelidir.
Kilo alımı
RISPERDAL CONSTA kullanımında anlamlı kilo alımı bildirilmiştir. Vücut ağırlığı düzenli olarak izlenmelidir.
Hiperprolaktinemi
Hiperprolaktinemi, RİSPERDAL CONSTA tedavisinde görülen yaygın bir yan etkidir. Prolaktin ilişkili yan etki belirtilerinin (örneğin; jinekomasti, menstrual düzensizlikler, anovülasyon, fertilite bozuklukları, libido kaybı, erektil disfonksiyon ve galaktore) görüldüğü hastalarda prolaktin plazma seviyelerinin değerlendirilmesi tavsiye edilmektedir.
Doku kültürü çalışmaları, insan meme tümörlerinde hücre büyümesinin prolaktin tarafından stimule edilebileceğini belirtmektedir. Klinik ve epidemiyolojik çalışmalarda antipsikotik kullanımı ile ilişkisi açık bir şekilde gösterilememiş olsa da, ilgili tıbbi öyküsü olan hastalarda dikkatli olunması önerilmektedir. RISPERDAL CONSTA daha önceden hiperprolaktinemisi ve olası bir prolaktine bağlı tümörü olan hastalarda dikkatli kullanılmalıdır.
QT uzaması
QT aralığı uzaması, pazarlama sonrasında çok seyrek rapor edilmiştir. Diğer antipsikotikler ile olduğu gibi, RISPERDAL CONSTA, aritmojenik etkiyi arttırabileceğinden kardiyovasküler hastalığı olan kişilerde, aile öyküsünde QT uzaması, bradikardi veya elektrolit düzensizliği olan hastalarda (hipokalemi, hipomagnezemi) ve QT aralığını uzattığı bilinen ilaçlar ile birlikte
kullanılırken dikkatli olunmalıdır. Uzamış QT Sendromu / Torsades de Pointes'e neden olabileceğinden, tanısı konmuş veya şüpheli konjenital uzamış QT sendromu veya Torsades de Pointes hastalarında RİSPERDAL CONSTA kullanılmamalıdır.
Nöbetler
RISPERDAL CONSTA, nöbet eşiğini potansiyel olarak düşüren durumlarda veya nöbet hikayesi olan hastalarda dikkatli kullanılmalıdır.
Priapizm
Alfa-adrenerjik blokör özelliğinden dolayı RISPERDAL CONSTA ile tedavi sırasında priapizm görülebilir.
Vücut sıcaklığının düzenlenmesi
Vücudun vücut sıcaklığını düşürme yeteneğinin bozulması antipsikotik ilaçlarla ilişkilendirilmiştir. Ağır egzersiz, aşırı sıcağa maruz kalma, eş zamanlı antikolinerjik ilaçlarla tedavi görme veya dehidratasyona uğrama gibi vücut ısısının artmasına katkıda bulunabilecek durumların görülebileceği hastalarda RISPERDAL CONSTA reçete edilirken, uygun koruma önlemleri alınmalıdır.
Venöz tromboembolik olay
Antipsikotik ilaçlarla venöz tromboembolizm (VTE) vakaları bildirilmiştir. Antipsikotik ilaç tedavisi gören hastalarda çoğunlukla kazanılmış VTE risk faktörleri bulunduğu için, VTE için tüm olası risk faktörleri, RISPERDAL CONSTA ile tedaviden önce ve tedavi sırasında tanımlanmalı ve koruyucu önlemler alınmalıdır.
Intraoperatif Gevşek İris Sendromu
Katarakta ameliyatı sırasında RISPERDAL CONSTA dahil alfa 1a adrenerjik antagonist etki gösteren ilaçları kullanan hastalarda Intraoperatif Gevşek İris Sendromu (IFIS) gözlenmiştir. IFIS, ameliyat sırasında ve sonrasında göz komplikasyonları riskini arttırabilir (bkz. Bölüm 4.8). Ameliyat öncesinde hastanın alfa 1a adrenerjik antagonist ilaçları geçmişte kullanmış veya halen kullanmakta olduğu göz cerrahına mutlaka iletilmelidir.
Katarakt ameliyatı öncesinde alfa 1 blokör tedavisinin kesilmesinin potansiyel faydası kanıtlanmamıştır ve antipsikotik tedavinin kesilmesinin oluşturabileceği risk göz önünde bulundurulmalıdır.
Antiemetik etki
Risperidon ile yapılan klinik öncesi çalışmalarda antiemetik etki gözlenmiştir. Bu etki, eğer insanlarda oluşursa, bağırsak tıkanması, Reye sendromu ve beyin tümörü gibi durumları veya belli ilaçların aşırı doz bulgu ve semptomlarını maskeleyebilir.
Uyku apnesi sendromu
RISPERDAL CONSTA kullanan hastalarda uyku apnesi sendromu rapor edilmiştir. Eş zamanlı olarak santral sinir sistemi depresanı kullanan hastalar ile uyku apnesi öyküsü olan ya da uyku apnesi riski taşıyan (örneğin; aşırı kilolu/obezler veya erkekler) hastalarda RISPERDAL CONSTA kullanılırken dikkatli olunmalıdır.
Böbrek veya karaciğer yetmezliği
Oral risperidon çalışılmış olmakla birlikte, RISPERDAL CONSTA böbrek veya karaciğer yetmezliği olan hastalarda çalışılmamıştır. Bu hastalarda RISPERDAL CONSTA kullanırken dikkatli olunmalıdır (bkz. Bölüm 4.2).
Uygulama
RISPERDAL CONSTA'nın kaza ile kan damarları içine uygulanmasından kaçınılmasına dikkat edilmelidir.
Yardımcı maddeler
Bu tıbbi ürün, doz başına 1 mmol (23 mg)'dan daha düşük sodyum içermektedir, yani esasında “sodyum içermez†olarak kabul edilebilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
RISPERDAL CONSTA'nın diğer ilaçlarla birlikte kullanımının etkileşimleri sistematik olarak değerlendirilmemiştir. Bu bölümde sağlanan ilaç etkileşimi verileri oral RİSPERDAL ile yapılan çalışmalara dayanmaktadır.
Farmakodinamik etkileşimler
QT aralığını uzattığı bilinen ilaçlar
Diğer antipsikotiklerde olduğu gibi, antiaritmikler (örneğin; kinidin, dizopiramid, prokainamid, propafenon, amiyodaron, sotalol), trisiklik antidepresanlar (örneğin; amitiriptilin), tetrasiklik antidepresanlar (örneğin; maprotilin), bazı antihistaminikler, diğer antipsikotikler, bazı antimalaryal ilaçlar (örneğin; kinidin ve meflokin) gibi QT aralığını uzattığı bilinen ilaçlar ile birlikte risperidon reçete edilirken dikkatli olunmalıdır. Aynı şekilde elektrolit dengesizliği (hipokalemi, hipomagnezemi) ve bradikardiye yol açabilen ya da risperidonun hepatik metabolizmasını inhibe eden ilaçlarla birlikte reçete edilirken dikkatli olunmalıdır. Bu liste bilgi vericidir, kapsamlı değildir.
Merkezi sinir sistemini etkileyen ilaçlar ve alkol
Risperidon, alkol, opiyatlar, antihistaminikler ve benzodiazepinleri de içeren diğer merkezi sinir sistemini etkileyen maddelerle kombinasyon halinde kullanılırken sedasyon riskinin artmasına karşı dikkatli olunmalıdır.
Levodopa ve dopamin agonistleri
RISPERDAL CONSTA, levodopa ve diğer dopamin agonistlerinin etkilerini antagonize edebilir. Eğer bu kombinasyon özellikle Parkinson hastalığının son aşamasında gerekli görülürse, her tedavinin en düşük etkili dozu reçete edilmelidir.
Hipotansif etkili ilaçlar
Pazarlama sonrasında risperidon ve antihipertansif tedavinin eşzamanlı kullanılması ile klinik olarak belirgin hipotansiyon gözlenmiştir.
Psikostimulanlar
Psikostimulanların (örneğin; metilfenidat) risperidon ile birlikte kullanımı, tedavinin birinde ya da her ikisinde değişiklik yapıldığında ekstrapiramidal semptomlara yol açabilir (bkz. bölüm 4.4).
Farmakokinetik etkileşimler
Risperidon, temel olarak CYP2D6 ile ve daha az olarak CYP3A4 ile metabolize edilir. Risperidon ve etkin metaboliti olan 9-hidroksirisperidon, P-glikoprotein (P-gp) substratlarıdır. CYP2D6 aktivitesini değiştiren maddeler veya CYP3A4 ve/veya P-gp aktivitesini güçlü olarak inhibe eden veya indükleyen maddeler, risperidon etkin antipsikotik fraksiyonunun farmakokinetiklerini etkileyebilir.
Güçlü CYP2D6 inhibitörleri
RISPERDAL CONSTA'nın güçlü bir CYP2D6 inhibitörü ile birlikte uygulanması, risperidonun plazma konsantrasyonlarını artırabilir, ancak etkin antipsikotik fraksiyonun plazma konsantrasyonlarını daha az artırır. Güçlü CYP2D6 inhibitörünün yüksek dozları, risperidon etkin antipsikotik fraksiyonunun (örneğin; paroksetin, aşağı bakınız) konsantrasyonlarını artırabilir. Kinidin gibi başka CYP2D6 inhibitörlerinin, risperidon plazma konsantrasyonlarını benzer şekilde etkileyebilecekleri beklenmektedir. Özellikle yüksek dozlarda olmak üzere paroksetin, kinidin veya başka bir güçlü CYP2D6 inhibitörü ile birlikte uygulama başlatıldığında veya kesildiğinde, hekim RISPERDAL CONSTA'nın dozlamasını tekrar değerlendirmelidir.
CYP3A4 ve/veya P-gp inhibitörleri
RISPERDAL CONSTA'nın güçlü bir CYP3A4 ve/veya P-gp inhibitörü ile birlikte uygulanması, risperidon etkin antipsikotik fraksiyonunun plazma konsantrasyonunu önemli ölçüde artırabilir. İtrakonazol veya başka bir güçlü CYP3A4 ve/veya P-gp inhibitörü ile birlikte uygulama başlatıldığında veya kesildiğinde, hekim RISPERDAL CONSTA'nın dozlamasını tekrar değerlendirmelidir.
CYP3A4 ve/veya P-gp indükleyicileri
RISPERSAL CONSTA'nın güçlü bir CYP3A4 ve/veya P-gp indükleyicisi ile birlikte uygulanması, risperidon etkin antipsikotik fraksiyonunun plazma konsantrasyonlarını düşürebilir. Birlikte karbamazepin veya başka bir güçlü CYP3A4 ve/veya P-gp indükleyicileri başlatıldığında veya kesildiğinde, RISPERDAL CONSTA dozu hekim tarafından tekrar değerlendirilmelidir. CYP3A4 indükleyicileri etkilerini zamana bağlı bir şekilde gösterir ve başlama sonrasında maksimal etkiye ulaşılması en az 2 hafta sürebilir. Diğer taraftan, kesilmesi durumunda, CYP3A4 indüksiyonunda azalma en az 2 hafta sürebilir.
Proteine yüksek oranda bağlanan ilaçlar
RISPERDAL CONSTA, proteine yüksek oranda bağlanan ilaçlarla birlikte alındığında, her iki ilacın da plazma proteinlerinden klinik olarak anlamlı oranda ayrılması söz konusu değildir.
İlaçların birlikte kullanımında, metabolizma yoluna veya muhtemel dozaj ayarlama ihtiyacına ilişkin bilgiler için ilgili ürün bilgisine bakılmalıdır.
Örnekler
Potansiyel olarak etkileşime giren veya risperidonla etkileşime girmediği gösterilen ilaç örnekleri aşağıda listelenmiştir:
Diğer Tıbbi Ürünlerin Risperidonun Farmakokinetiği Üzerindeki Etkisi
Antibakteriyel İlaçlar:
Orta dereceli bir CYP3A4 ve P-gp inhibitörü olan eritromisin, risperidon ve aktif antipsikotik fraksiyonunun farmakokinetiğini değiştirmez.
4.6. Gebelik ve laktasyon
Gebelik kategorisi C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
RISPERDAL CONSTA'nın çocuk doğurma potansiyeli bulunan kadınlarda kontrasepsiyon gerekliliğine işaret edecek yeterli bilgi mevcut değildir.
Gebelik dönemi
Risperidonun gebe kadınlarda kullanımı ile ilgili yeterli veri bulunmamaktadır. Hayvan çalışmalarında risperidonun teratojenik etkisine rastlanmamış; fakat diğer üreme toksisitesi tipleri görülmüştür (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebeliğin üçüncü trimesterinde antipsikotik ilaçlara (RISPERDAL CONSTA da dahil) maruz kalan yeni doğanlar, doğumu takiben şiddeti ve süresi değişebilen, ekstrapiramidal ve/veya ilaç kesilme semptomlarını içeren advers etkiler açısından risk altındadırlar. Bu semptomlar, ajitasyon, hipertoni, hipotoni, tremor, somnolans, respiratuar distres veya beslenme bozukluklarını içermektedir. Yeni doğanlar dikkatle izlenmelidir. RISPERDAL CONSTA kesinlikle gerekli olmadıkça gebelik sırasında kullanılmamalıdır.
Laktasyon dönemi
Hayvan çalışmalarında, risperidon ve 9-hidroksi-risperidon süt ile atılmaktadır. Risperidon ve 9-hidroksi-risperidonun az miktarlarda anne sütüne de geçtiği kanıtlanmıştır. Emzirilen bebeklerdeki advers reaksiyonlar ile ilgili herhangi bir veri mevcut değildir. Bu nedenle, emzirmenin çocuk açısından faydası, çocuğun karşılaşacağı potansiyel risklere karşı değerlendirilmelidir.
Üreme yeteneği/Fertilite
Dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi, RISPERDAL CONSTA prolaktin düzeyini yükseltir. Hiperprolaktinemi, hipotalamik GnRH'ı baskılayabilir ve pitüiter gonadotropin salgılanmasında azalmaya yol açabilir. Bu durum daha sonra, hem kadın hem de erkek hastalarda, gonadal steroidogenezi bozarak, reprodüktif fonksiyonu inhibe edebilir.
Klinik dışı çalışmalarda konuya ilişkin etkiler gözlenmemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
RISPERDAL CONSTA, sinir sistemi ve görme duyusuna ilişkin potansiyel etkileri nedeniyle (bkz. Bölüm 4.8), araç ve makine kullanma becerileri üzerinde minör ya da orta derecede etki gösterir. Bu nedenle hastaların, bireysel duyarlılıkları anlaşılıncaya kadar, araç ve makine kullanmaları önerilmez.
4.8. İstenmeyen etkiler
En sık bildirilen advers ilaç reaksiyonları (insidans ≥1/10); insomnia, anksiyete, baş ağrısı, üst solunum yolu enfeksiyonu, parkinsonizm ve depresyon olmuştur.
Doza bağlı oldukları görülen advers ilaç reaksiyonları, parkinsonizm ve akatizidir.
Pazarlama sonrası dönemde, enjeksiyon bölgesinde nekroz, apse, selülit, ülser, hematom, kist ve nodül gibi ciddi enjeksiyon bölgesi reaksiyonları bildirilmiştir. Bunların sıklık dereceleri bilinmemektedir. Çok az sayıdaki olguda cerrahi girişim gerekli olmuştur.
Aşağıda verilen listede, risperidon klinik araştırmalarında ve pazarlama sonrası dönemde bildirilen bütün advers ilaç reaksiyonları, RISPERDAL CONSTA klinik araştırmalarında
yapılan tahminler doğrultusundaki sıklık gruplarıyla verilmektedir. Aşağıdaki terimler ve sıklıklar kullanılmıştır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1000 ila <1/100); seyrek (≥1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Sistem Organ Sınıfı | Advers İlaç Reaksiyonları | |||||
Sıklık | ||||||
Çok yaygın |
Yaygın |
Yaygın Olmayan |
Seyrek | Çok Seyrek |
Bilinmiyor | |
Enfeksiyonlar ve enfestasyonlar | Üst solunum yolu enfeksiyonu | Pnömoni, bronşit, sinüzit, idrar yolu enfeksiyonu, grip | Solunum sistemi enfeksiyonu, sistit, kulak enfeksiyonu, göz enfeksiyonu, tonsillit, onikomikoz, selülit, enfeksiyon, lokalize enfeksiyon, viral enfeksiyon, akarodermatit, subkutan apse |
|
|
|
Kan ve lenf sistemi hastalıkları |
| Anemi | Beyaz kan hücresi sayısında azalma, trombositopeni, hematokrit değerinde (kırmızı kan hücrelerinin plazmadan ayrılmış kısmı) azalma | Agranulasitoz nötropeni, eozinofil sayısında artış |
|
|
Bağışıklık sistemi hastalıkları |
|
| Aşırı duyarlılık | Anafilaktik reaksiyon |
|
|
Endokrin hastalıkları |
| Hiperprolak- tinemi | İdrarda glukoz bulunması | Uygun olmayan antidiüretik hormon salgılama |
|
|
Metabolizma ve beslenme hastalıkları |
| Hiperglisemi, kilo alımı, kilo kaybı ,iştah artışı, | Diyabetes mellitus, anoreksi, kan kolesterol | Su intoksikasyonu, hipoglisemi, | Diyabetik ketoasidoz |
|
|
| iştah azalması | düzeyinde yükselme, kan trigliserit düzeyinde yükselme | hiperinsülinemi , polidipsi |
|
|
Psikiyatrik hastalıklar | İnsomnia, depresyon, anksiyete | Uyku bozuklukları, ajitasyon, libido azalması | Mani, kabus, konfüzyonal durum, sinirlilik, anorgazmi | Katatoni, künt duygulanım, somnambuliz, uyku ile ilişkili yeme bozukluğu |
|
|
Sinir sistemi hastalıkları | Baş ağrısı, parkinsonizm | Somnolans/ sedasyon akatizi, distoni, diskinezi, tremor, sersemlik | Tardif diskinezi, serebral iskemi, bilinç kaybı, konvülsiyon, senkop, psikomotor hiperaktivite, denge bozukluğu, anormal koordinasyon, postural sersemlik, dikkat bozukluğu, disartri, tat alma duyusunda bozulma, hipoestezi, parestezi | Nöroleptik malign sendrom, serebrovaskü- ler bozukluk, uyaranlara yanıt vermeme, depresif bilinç durumu, diyabetik koma, başta titreme |
|
|
Göz hastalıkları |
| Bulanık görme | Konjunktivit, göz kuruluğu, göz yaşarmasında artma, oküler hiperemi | Retinal arter tıkanması, glokom, göz hareket bozukluğu, göz küresinin hareketliliği, fotofobi , gözkapağı kenarında kabuklanma fotofobi, intraoperatif floppy iris sendromu (IFIS) |
|
|
Kulak ve iç kulak hastalıkları |
|
| Vertigo, kulak çınlaması, kulak ağrısı |
|
|
|
Kardiyak hastalıklar |
| Taşikardi | Atriyal fibrilasyon, atrioventriküler blok, iletim bozukluğu, elektrokardiyogra m-da QT uzaması, bradikardi, normal olmayan elektrokardiyogra m,palpitasyonlar | Sinüs aritmisi |
|
|
Vasküler hastalıklar |
| Hipertansi- yon, hipotansiyon | Ortostatik hipotansiyon | Akciğer embolisi, venöz tromboz, kızarma |
|
|
Solunum, göğüs bozuklukları ve mediastinal hastalıklar |
| Dispne, faringolarin- geal ağrı, öksürük, burun tıkanıklığı | Hiperventilasyon, solunum yolu tıkanıklığı, hırıltılı solunum, burun kanaması | Uyku apnesi sendromu, aspirasyon, pnömonisi, pulmoner tıkanıklık, raller, disfoni, solunum bozukluğu |
|
|
Gastro- intestinal hastalıklar |
| Abdominal ağrı, kusma, abdominal rahatsızlık, diyare, bulantı, konstipasyon, gastroenterit, diş ağrısı, dispepsi, ağız kuruluğu | Gaita kaçırma, disfaji, midede veya bağırsakta gaz birikimi | Pankreatit, bağırsak tıkanıklığı, dudak iltihabı (şilit), şişmiş dil, fekalom | İleus |
|
Hepato-bilier hastalıklar |
| Transaminaz- larda artışı, gama- glutamil- transferazlar- da artışı | Hepatik enzim artışı | Sarılık |
|
|
Deri ve deri altı doku hastalıkları |
| Döküntü | Kaşıntı, alopesi, egzama, kuru cilt, eritem, deride renk değişikliği, akne, seboreik dermatit | İlaç döküntüsü, kepek, ürtiker, hiperkeratozis, cilt rahatsızlığı cilt lezyonu | Anjiyoödem | Stevens- Johnson sendromu/ toksik epidermal nekroliz |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları |
| Kas spazmları, kas-iskelet ağrısı, sırt ağrısı, artralji | Kan kreatin fosfokinaz düzeyinde artış, eklem sertliği, eklem şişliği, kas zayıflığı, boyun ağrısı | Rabdomiyoliz, duruş anormalliği |
|
|
Böbrek ve idrar yolu hastalıkları |
| İdrar tutamama | Pollaküri, idrar retansiyonu, dizüri |
|
|
|
Gebelik, puerperiyum durumları ve perinatal hastalıkları |
|
|
| Yenidoğanda ilaç yoksunluk sendromu |
|
|
Üreme sistemi ve meme hastalıkları |
| Erektil disfonksiyon, amenore, galaktore | Boşalma bozukluğu, menstrüasyonda gecikme, menstrüel bozukluk, jinekomasti, seksüel disfonksiyon, meme ağrısı, meme rahatsızlığı, vajinal akıntı | Priapizm, meme dolgunluğu, meme akıntısı, meme büyümesi |
|
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar |
| Ödem yüksek ateş, göğüs ağrısı, asteni, yorgunluk, ağrı, enjeksiyon bölgesinde reaksiyon | Yüzde ödem, titreme, vücut sıcaklığında artış, anormal yürüyüş biçimi, susama, göğüste rahatsızlık hissi, keyifsizlik, anormal hissetme, endurasyon | Hipotermi, vücut sıcaklığında azalma, periferik soğukluk, ilaç yoksunluk sendromu, rahatsızlık |
|
|
Yaralanma, zehirlenme ve enjeksiyon sırasında komplikas- yonlar |
| Düşme | Enjeksiyon sırasında ağrı |
|
|
|
Ekstrapiramidal bozukluk ortaya çıkabilir: Parkinsonizm (tükürük salgısında artış, kas- iskelet katılığı, parkinsonizm, ağızda sulanma, dişli çark rijiditesi, bradikinezi, hipokinezi, maske yüz, kaslarda gerginlik, akinezi, ense sertliği, kaslarda sertlik, parkinsoniyen adım, anormal glabella refleksi, parkinsoniyen dinlenme tremoru), akatizi (akatizi, huzursuzluk, hiperkinezi ve huzursuz bacak sendromu), tremor, diskinezi (diskinezi, kaslarda seğirme, koreatetozis, atetozis ve miyoklonus), distoni. Distoni şunları kapsamaktadır; distoni, hipertoni, tortikollis, istemsiz kas kasılmaları, kas kasılması, blefarospazm, okulogirasyon, dilde paralizi, fasyal spazm, laringospazm, miyotoni, opistotonus, orofaringeal spazm, plörototonus, dilde spazm ve trismus. Mutlaka ekstrapiramidal orijine sahip olması gerekmeyen, daha geniş bir semptom spektrumunun verildiğine dikkat edilmelidir. İnsomnia şunları içerir; başlangıçta gözlenen uykusuzluk, orta dönem uykusuzluğu. Konvülsiyon şunları içerir; grand-mal konvülsiyon. Menstrüel bozukluk şunları içerir; düzensiz menstrüasyon, oligomenore. Ödem şunları içerir; yaygın ödem, periferik ödem, gode bırakan ödem.
Paliperidon formülasyonlarıyla kaydedilen istenmeyen etkiler
Paliperidon, risperidonun aktif metabolitidir. Bu nedenle, bu bileşenlerin advers reaksiyon profilleri (hem oral hem de enjektabl formülasyonlar dahil) birbirleri için geçerlidir. Yukarıdaki advers reaksiyonlara ek olarak, paliperidon ürünleriyle aşağıdaki advers reaksiyon kaydedilmiştir ve RISPERDAL CONSTA ile de meydana gelmesi beklenebilir:
Kardiyak hastalıklar
Postüral ortostatik taşikardi sendromu Anaflaktik reaksiyon
Pazarlama sonrası deneyimde, önceden oral risperidonu tolere etmiş hastalarda ender olarak, RISPERDAL CONSTA enjeksiyonundan sonra anafilaktik reaksiyon olguları bildirilmiştir (bkz; bölüm 4.4).
Sınıf etkileri
Diğer antipsikotiklerde olduğu gibi, risperidon ile pazarlama sonrası dönemde çok ender olarak QT uzaması olguları bildirilmiştir. QT aralığını uzatan antipsikotikler ile bildirilen sınıfla ilişkili diğer kardiyak etkiler ventriküler aritmi, ventriküler fibrilasyon, ventriküler taşikardi, ani ölüm, kardiyak arrest ve Torsades de Pointes'dir.
Venöz tromboembolizm
Antipsikotik ilaçlarla venöz tromboembolizm olguları (pulmoner embolizm dahil) ve derin ven trombozu olguları bildirilmiştir (sıklık bilinmemektedir).
Kilo artışı
On iki haftalık çift kör, plasebo kontrollü çalışmada, RISPERDAL CONSTA kullanan hastaların % 9'u, plasebo ile tedavi edilen hastaların % 6'sı ile karşılaştırıldığında, sonlanım noktasında vücut ağırlığının ≥ % 7'lik bir ağırlık artışı görülmüştür. Bir yıl süreli açık etiketli RISPERDAL CONSTA çalışmasında, hasta bireylerdeki vücut ağırlığı değişimleri, genellikle başlangıç döneminin ± % 7 sınırları arasındaydı; hastaların % 25'inde vücut ağırlığında ≥ % 7'lik bir artış görüldü.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Parenteral uygulama ile doz aşımı görülme olasılığı oral uygulamaya göre daha düşük olduğundan, oral uygulamaya ilişkin bilgiler sunulmuştur.
Belirtiler
Genellikle, bildirilen bulgu ve belirtiler ilacın bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, sersemlik ile sedasyon, taşikardi ile hipotansiyon ve ekstrapiramidal
semptomlardır. Doz aşımında QT uzaması ve konvülsiyonlar bildirilmiştir. Oral RISPERDAL ve paroksetinin birlikte kullanımındaki doz aşımı ile ilişkili olarak Torsades de Pointes bildirilmiştir.
Akut doz aşımı durumlarında birden fazla ilaç ihtimali düşünülmelidir.
Tedavi
Solunum yolu açılmalı ve açık tutulmalı, yeterli oksijenlenme ve ventilasyon sağlanmalıdır. Hemen kardiyovasküler izleme başlatılmalı ve sürekli elektrokardiyografi ile muhtemel aritmiler takip edilmelidir.
RISPERDAL'e özgü bir antidot yoktur. Bu yüzden uygun destekleyici önlemler alınmalıdır. Hipotansiyon ve dolaşım kollapsı, intravenöz sıvı ve/veya sempatomimetiklerle gerektiği gibi tedavi edilmelidir. Şiddetli ekstrapiramidal belirtilerde antikolinerjik tedavi uygulanmalıdır. Hasta durumu düzelinceye kadar yakın tıbbi gözlem altında tutulmalı ve izlenmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik Grup: Diğer antipsikotikler ATC Kodu: N05AX08Etki mekanizması
Risperidon benzersiz özellikleri olan seçici bir monoaminerjik antagonisttir. Serotonin 5-HTve dopamin Dreseptörlerine yüksek oranda bağlanır. Alfa-adrenerjik reseptörlere, daha az oranda H-histamin reseptörlerine ve alfa-adrenerjik reseptörlere de bağlanır. Risperidonun kolinerjik reseptörlere afinitesi yoktur. Risperidon, güçlü bir dopamin Dreseptörü antagonisti olarak, şizofrenideki pozitif semptomları düzeltir. Motor aktivitede depresyona ve katalepsi oluşumuna klasik nöroleptiklerden daha az neden olur. Dengeli bir santral serotonin ve dopamin reseptörleri antagonizması, ekstrapiramidal yan etkileri azaltabilir ve tedavinin etkililiğini şizofreninin negatif ve pozitif semptomlarına yayabilir.
Klinik etkinlik
RISPERDAL CONSTA'nın (25 mg ve 50 mg), psikotik bozukluk (şizofreni/şizoafektif bozukluk) belirtilerinin kontrol altına alınmasındaki etkililiği, şizofreni için DSM-IV kriterlerine uyan yetişkin psikotik hastalarda (yatan ve ayakta tedavi gören), 12 haftalık, plasebo kontrollü bir çalışma ile ispatlanmıştır.
![]()
![]()
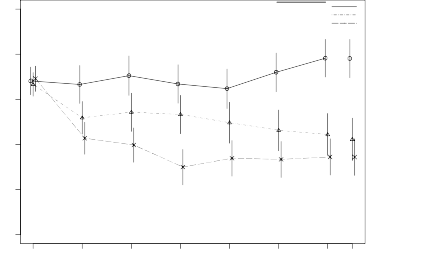
Stabil şizofreni hastaları üzerinde yapılan 12 haftalık karşılaştırmalı bir çalışmada, RISPERDAL CONSTA'nın oral tablet formülasyonu kadar etkili olduğu gösterilmiştir. Ayrıca açık etiketli bir çalışmada, RISPERDAL CONSTA'nın uzun-dönem (50 hafta) güvenlilik ve etkililiği, şizofreni veya şizoafektif bozukluk için DSM-IV kriterlerine uyan stabil psikotik hastalar (yatan ve ayakta tedavi gören) üzerinde değerlendirilmiştir. Bu zaman içerisinde RISPERDAL CONSTA ile etkililik kalıcı olmuştur (Şekil 1).
Şekil 1. Şizofreni hastalarında zaman içinde toplam PANSS skoru ortalaması (LOCF).
5.2. Farmakokinetik özellikler
Genel ÖzelliklerEmilim:
RISPERDAL CONSTA'dan risperidonun emilimi tamdır.
Tek intramusküler RISPERDAL CONSTA enjeksiyonundan sonra salınım profili şöyledir: Başlangıçta az miktarda risperidon (dozun < % 1'i) salıverilir ve bunu 3 haftalık bir gecikme süresi izler. Risperidonun asıl salınımı 3. haftadan sonra başlar, 4. haftadan 6. haftaya kadar devam eder ve 7. haftada azalır. Bu nedenle RISPERDAL CONSTA tedavisinin ilk 3 haftası süresince oral antipsikotik desteği sağlanmalıdır (bkz. Bölüm 4.2).
Salınım profili ve doz uygulama rejiminin kombinasyonu (her iki haftada bir intramusküler enjeksiyon), kalıcı terapötik plazma konsantrasyonlarıyla sonuçlanır. Terapötik plazma
konsantrasyonları, son RISPERDAL CONSTA enjeksiyonundan 4 ile 6 hafta sonrasına kadar devam eder.
25 ya da 50 mg RISPERDAL CONSTA ile iki haftada bir tekrarlı intramusküler enjeksiyonlardan sonra, aktif antipsikotik fraksiyonun medyan çukur ve doruk konsantrasyonları, sırasıyla 9,9-19,2 ng/ml ve 17,9-45,5 ng/ml arasında dalgalanma gösterir. İki haftada bir 25-50 mg enjekte edilen hastalarda uzun dönemli (12 ay) kullanım sırasında risperidon birikimi gözlenmemiştir.
Yukarıdaki çalışmalar kalçaya intramusküler enjeksiyon ile yapılmıştır. Aynı dozlardaki intramusküler omuz ve kalça enjeksiyonları biyoeşdeğerdir ve böylelikle birbirlerinin yerine kullanılabilir niteliktedirler.
Dağılım:
Risperidon hızla dağılır. Dağılım hacmi 1-2 L/kg'dır. Risperidon plazmada albumin ve alfa- asit glikoproteinine bağlanır. Plazma proteinlerine bağlanma oranları risperidon için % 90, aktif metaboliti 9-hidroksi-risperidon için % 77'dir.
Biyotransformasyon:
Risperidon, CYP2D6 aracılığı ile farmakolojik aktivitesi risperidona benzeyen 9-hidroksi- risperidona metabolize olur. Risperidon ve 9-hidroksi-risperidon birlikte aktif antipsikotik fraksiyonu oluşturur. CYP2D6 genetik polimorfizm göstermektedir. Hızlı CYP2D6 metabolize ediciler risperidonu hızla 9-hidroksi-risperidona dönüştürürken, yavaş CYP2D6 metabolize edicilerde bu dönüşüm çok daha yavaş gerçekleşir. Hızlı metabolize ediciler, yavaş CYP2D6 metabolize edicilere kıyasla daha düşük risperidon ve daha yüksek 9-hidroksi-risperidon konsantrasyonlarına sahip olmakla birlikte, risperidon ve 9-hidroksi-risperidon kombinasyonunun (yani, aktif antipsikotik fraksiyon) farmakokinetiği, tek ve çoklu dozlardan sonra, hızlı ve yavaş CYP2D6 metabolize edicilerde benzer niteliktedir.
Risperidonun başka bir metabolik yolağı N-dealkilasyondur. İnsan karaciğer mikrozomlarıyla yapılan in vitro çalışmalarda, klinikteki kullanım konsantrasyonlarındaki risperidonun, sitokrom P450 izoenzimleriyle (CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5) metabolize edilen ilaçların metabolizmalarını önemli ölçüde inhibe etmediği gösterilmiştir.
Eliminasyon:
Oral risperidon uygulamasından bir hafta sonra, dozun % 70'i idrar ve % 14'ü feçes ile itrah edilir. İdrardaki risperidon ve 9-hidroksi-risperidon, oral yolla uygulanan dozun % 35-45'ini temsil eder. Geri kalan kısım inaktif metabolitlerdir. Eliminasyon fazı, son RISPERDAL CONSTA enjeksiyonundan yaklaşık 7-8 hafta sonra tamamlanmaktadır.
Doğrusallık /Doğrusal Olmayan Durum:
İki haftada bir enjekte edilen 25-50 mg doz aralığındaki risperidonun farmakokinetiği doğrusaldır.
Hastalardaki karakteristik özellikler
Yaşlılar:
Oral risperidon ile yapılan bir tek-doz farmakokinetik çalışmasında, yaşlılarda ortalama olarak
% 43 daha yüksek aktif antipsikotik fraksiyon plazma konsantrasyonları, % 38 daha uzun bir yarı ömür ve aktif antipsikotik fraksiyonun klirensinde % 30 azalma görülmüştür.
Böbrek yetmezliği:
Orta derecede böbrek yetmezliği olan yetişkinlerde aktif fraksiyonun klirensi, sağlıklı genç yetişkinlerinkinin yaklaşık % 48' dir (yaş aralığı 25-35 yaş). Şiddetli derecede böbrek yetmezliği olan yetişkinlerde aktif fraksiyonun klirensi, sağlıklı genç yetişkinlerinkinin yaklaşık % 31' dir. Aktif fraksiyonun yarılanma ömrü genç yetişkinlerde 16,7 saat, orta derecede böbrek yetmezliği olan yetişkinlerde 24,9 saat (ya da genç yetişkinlerden yaklaşık 1,5 kat daha uzun) ve şiddetli böbrek yetmezliği olanlarda 28,8 saat (genç yetişkinlerden yaklaşık 1,7 kat daha uzun)' dur.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda risperidonun plazma konsantrasyonları normaldir ancak plazmadaki ortalama serbest risperidon fraksiyonu yaklaşık % 37,1 artmıştır. Bu verilere göre orta ve şiddetli karaciğer yetmezliği olan yetişkinlerde, risperidon ve risperidonun aktif fraksiyonunun oral klirensi ve eliminasyon yarı ömrü genç sağlıklı yetişkinlerden anlamlı derecede farklı değildir.
Farmakokinetik/farmakodinamik ilişkiler:
Etkinlik ve güvenliliğin değerlendirildiği Faz-III çalışmalarının hiçbirinde değerlendirme vizitleri arasında aktif antipsikotik fraksiyonun plazma konsantrasyonları ile total PANNS
(Pozitif ve Negatif Sendrom Ölçeği) ve total ESRS (Ekstrapiramidal Semptom Derecelendirme Ölçeği) puanlarındaki değişiklikler arasında herhangi bir ilişki gözlenmemiştir.
Cinsiyet, ırk ve sigara alışkanlığı:
Bir popülasyon farmakokinetik analizinde, cinsiyet, ırk ya da sigara alışkanlığının risperidon ya da aktif antipsikotik fraksiyonun farmakokinetikleri üzerinde belirgin etki göstermedikleri belirlenmiştir.
5.3. Klinik öncesi güvenlilik verileri
Sıçan ve köpeklerde risperidon ile yapılan (sub)kronik toksisite çalışmalarına benzer şekilde, RISPERDAL CONSTA ile tedavinin (12 aya dek intramüsküler enjeksiyon) majör etkileri, risperidonun farmakodinamik aktivitesiyle ilişkili olarak prolaktin-aracılı meme bezi stimülasyonu, erkek ve dişi üreme sistemlerinde değişiklikler ve santral sinir sistemi (SSS) etkileridir. Genç sıçanlarla oral risperidon ile yapılan bir toksisite çalışmasında, artan yavru mortalitesi ve fiziksel gelişimde gecikme gözlenmiştir. Oral risperidon tedavisi gören genç köpeklerle yapılan 40 haftalık çalışmada cinsel olgunlaşma gecikmiştir. EAA (Eğri Altı Alan) temelinde, köpeklerde uzun kemik gelişimi, adolesanlarda uygulanan maksimum insan oral dozunun 3,6 katı dozlarda (1,5 mg/gün) etkilenmemiş iken, uzun kemikler ve cinsel olgunlaşma üzerindeki etkiler adolesanlarda uygulanan maksimum insan oral dozunun 15 katı dozlarda gözlenmiştir.
Risperidon sıçan ve tavşanlarda teratojenik bulunmamıştır. Risperidon ile yürütülen sıçan üreme çalışmalarında, anne-babanın çiftleşme davranışları üzerinde ve yavruların doğum ağırlıkları ve hayatta kalmaları üzerinde advers etkiler görülmüştür. Sıçanlarda intrauterin risperidon maruziyeti, yetişkin dönemde kognitif defisitler ile ilişkili bulunmuştur. Başka dopamin antagonistleri gebe hayvanlara uygulandığında, yavruların öğrenme ve motor gelişimleri üzerinde negatif etkilere yol açmıştır.
Erkek ve dişi sıçanlara 12 ve 24 ay boyunca 40 mg/kg/2 hafta dozlarında yapılan RISPERDAL CONSTA uygulaması osteodistrofiye neden olmuştur. Osteodistrofi için sıçanlarda etkili olan doz, mg/m bazında incelendiğinde, önerilen maksimum insan dozunun 8 katı olmuştur ve önerilen maksimum dozda insanlarda beklenen maksimum maruziyetin iki katı bir plazma maruziyeti ile ilişkilidir. 12 ay boyunca 20 mg/kg/2 hafta'ya kadar dozlarda RISPERDAL CONSTA tedavisi alan köpeklerde osteodistrofi gözlenmemiştir. Bu doz, insanlarda önerilen maksimum dozun 14 katı plazma maruziyeti sağlamaktadır.
Genotoksik potansiyele ilişkin hiçbir bulgu yoktur.
Güçlü bir dopamin D2-antagonistinden bekleneceği gibi, sıçanlar ve fareler üzerinde yürütülen oral karsinojenite çalışmalarında, hipofiz bezi adenomaları (fare), endokrin pankreas adenomaları (sıçan) ve meme bezi adenomalarında (her iki tür) artış görülmüştür.
Wistar (Hannover) sıçanları üzerinde RISPERDAL CONSTA ile (5 ve 40 mg/kg/2 hafta dozlar) yürütülen bir intramüsküler karsinojenite çalışmasında, 40 mg/kg dozda endokrin pankreas, hipofiz bezi ve adrenal medulla tümörleri insidansında artış gözlenirken, 5 ve 40 mg/kg dozlarda ise meme bezi tümörleri gelişmiştir. Oral ve intramusküler doz uygulamasıyla gözlenen bu tümörler, uzun süreli dopamin D2 antagonizması ve hiperprolaktinemiye bağlı olabilir. Doku kültürü çalışmaları, insan meme tümörlerindeki hücre büyümesinin prolaktin tarafından uyarılabileceğini göstermektedir. RISPERDAL CONSTA ile tedavi edilen sıçanlardaki adrenal medulla tümörlerinin insidansını artırdığı varsayılan hiperkalsemi ise, her iki doz grubunda da gözlenmiştir. Hiperkalseminin insanlarda feokromasitomaya yol açtığına dair bulgu yoktur.
40 mg/kg/2 hafta dozlarda RISPERDAL CONSTA ile tedavi edilen erkek sıçanlarda, renal tubüler adenomalar meydana gelmiştir. Düşük doz grubunda, NaCl % 0,9 grubunda ya da mikroküre taşıyıcılı kontrol grubunda renal tümör gözlenmemiştir. RISPERDAL CONSTA ile tedavi edilen erkek Wistar (Hannover) sıçanlarındaki renal tümörlerin mekanizması bilinmemektedir. Oral risperidon ile yapılan karsinojenite çalışmalarında, Wistar (Wiga) sıçanlarda ya da Swiss farelerde tedavi ile ilişkili renal tümör insidansında artış ortaya çıkmamıştır. Türler arasında tümör organ profilleri arasındaki farklılığı ortaya koymak için yapılan çalışmalar, karsinojenite çalışmasında kullanılan Wistar (Hannover) türünün, oral karsinojenite çalışmalarında kullanılan Wistar (Wiga) türüne göre, spontan yaşa bağlı non- neoplastik renal değişiklikler, serum prolaktin artışları ve risperidona bağımlı renal değişiklikler açısından büyük ölçüde farklılık gösterdiğini ortaya koymuştur. Kronik olarak RISPERDAL CONSTA tedavisi alan köpeklerde böbrek ile ilgili değişiklikler olduğuna dair veri yoktur.
Osteodistrofinin, prolaktin ile ilişkili tümörlerin ve sıçan türlerine spesifik oldukları varsayılan renal tümörlerin insandaki risk açısından önemi bilinmemektedir.
Yüksek doz RISPERDAL CONSTA uygulamalarından sonra köpekler ve sıçanlarda enjeksiyon bölgesinde lokal irritasyon gözlenmiştir. Sıçanlarda yapılan 24 ay süreli IM karsinojenite çalışmasında, taşıyıcı veya aktif ilaç grubunda enjeksiyon bölgesi tümörlerinde artış gözlenmemiştir.
In vitro ve in vivo hayvan modellerinde, risperidonun yüksek dozlarda QT aralığında uzamaya neden olabileceği gösterilmiştir; bu uzama hastalarda teorik olarak Torsades de Pointes riskinde artış ile ilişkilendirilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
RISPERDAL CONSTA uzatılmış salımlı enjeksiyonluk süspansiyon için toz
7525 DLJN1 poli-(d,l-laktid-ko-glikolid) polimer
Seyreltici
Polisorbat 20
Karmeloz sodyum 40mPa.s Disodyum hidrojen fosfat dihidrat Susuz sitrik asit
Sodyum klorür Sodyum hidroksit Enjeksiyonluk su
6.2. Geçimsizlikler
RISPERDAL CONSTA bölüm 6.6'da sözü edilenlerin dışında herhangi bir ilaç veya sıvı ile karıştırılmamalı veya seyreltilmemelidir.
6.3. Raf ömrü
36 ay (2-8 °C'de)
Seyreltildikten sonra: Kullanım sırasındaki fiziksel ve kimyasal stabilitesinin 25°C'de 24 saat olduğu kanıtlanmıştır. Mikrobiyolojik açıdan bakıldığında ürün hemen kullanılmalıdır. Hemen kullanılmadığı takdirde, kullanım sırasındaki saklama süresi ve koşulları, kullanıcının sorumluluğundadır ve normal şartlarda çözündürme, kontrollü ve valide edilmiş aseptik
koşullarda gerçekleştirilmediği sürece seyreltildikten sonra 25°C'de 6 saatten fazla saklanmamalıdır.
6.4. Saklamaya yönelik özel tedbirler
2-8°C arası sıcaklıklarda (buzdolabında) saklayınız. Işıktan koruyunuz.
25°C üzerindeki sıcaklıklara maruz bırakmayınız.
Eğer buzdolabında saklanamıyorsa, RISPERDAL CONSTA uygulamadan önce en fazla 7 gün süresince 25°C altındaki oda sıcaklıklarında saklanmalıdır.
Buzdolabında saklanmayan ürünü 25°C üzerindeki sıcaklıklara maruz bırakmayınız.
6.5. Ambalajın niteliği ve içeriği
İğnesiz flakon kullanım aparatı
RISPERDAL CONSTA 25 mg uzatılmış salımlı enjeksiyonluk süspansiyon içeren bir flakon
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmeliği''ne uygun olarak imha edilmelidir.
Önemli bilgiler
![]()
RISPERDAL CONSTA başarılı bir şekilde uygulanması için bu Kullanma Talimatındaki maddelere sıkı bir şekilde uyulması gereklidir.
30 dakika bekleyiniz.
Doz ambalajını buzdolabından çıkararak sulandırma öncesinde en az 30 dakika oda sıcaklığında bekletiniz.
Başka herhangi bir şekilde ısıtmayınız. Verilen parçaları kullanınız
Bu doz ambalajındaki bileşenler özel olarak RISPERDAL CONSTA ile birlikte kullanım için tasarlanmıştır. RISPERDAL CONSTA yalnızca doz ambalajında verilen seyrelticide seyreltilmelidir.
Doz ambalajındaki HERHANGİ bir bileşeni değiştirmeyiniz.
Süspansiyonu sulandırma sonrasında saklamayınız
Çökelmeyi önlemek için dozu sulandırma sonrasında en kısa süre içerisinde uygulayınız.
Uygun dozaj
![]()
TEK KULLANIMLIK CİHAZ
Amaçlanan RISPERDAL CONSTA dozunun verildiğinden emin olmak için flakonun tüm içeriği uygulanmalıdır.
Tekrar kullanmayınız. Tıbbi cihazlar amaçlanan şekilde uygulanmak açısından özgün materyal özellikler gerektirir. Bu özellikler yalnızca tek kullanıma yönelik olarak doğrulanmıştır. Sonraki kullanımına yönelik olarak cihazın tekrar uygulanmasına yönelik herhangi çaba, cihazın bütünlüğünü olumsuz olarak etkileyebilir veya performansta bozulmaya neden olabilir.
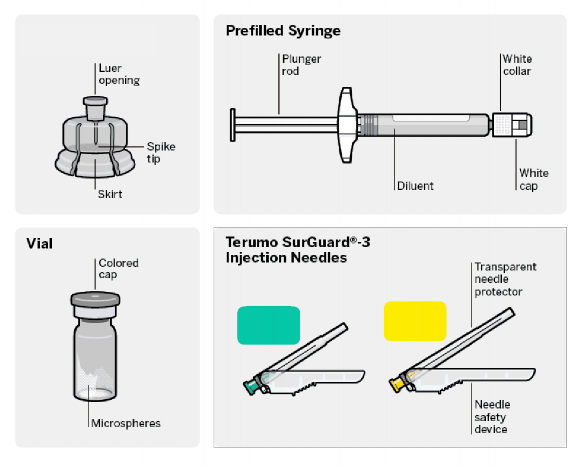
Deltoid
2.5 cm
Flakon Adaptörü
Kullanıma Hazır Enjektör
Enjeksiyon İğneleri
Flakon
Doz ambalajı içerikleri
Bileşenler kurulur
Adım 1
Flakon adaptörü flakona bağlanır
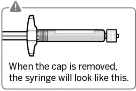
Flakonun kapağı çıkarılır Flakonun renkli kapağı çıkarılır.
Gri tıpanın üst kısmı alkollü pamuk ile silinir.
Flakon adaptörü hazırlanır
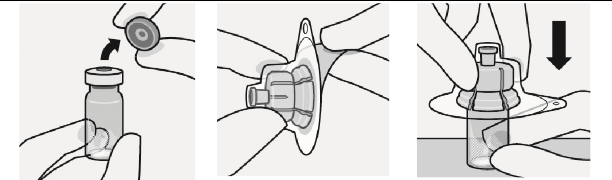
Steril blister gösterildiği gibi tutulur. Koruyucu kağıt soyularak çıkarılır.
Flakon adaptörü blisterden
çıkarılmaz.
Flakon adaptörü flakona bağlanır
Flakon sert bir yüzeye konur ve altından tutulur. Flakon adaptörü gri kauçuk tıpa üzerinde ortalanır. Flakon adaptörü, yerine sabit bir şekilde oturana kadar
Açık havada kurumaya bırakılır.
Gri kauçuk tıpa
çıkarılmaz.
Sivri uca herhangi bir zamanda dokunulmaz. Bu, kontaminasyona neden olur.
flakonun üzerine doğru bastırılır.
Yanlış
Flakon adaptörü açılı olarak yerleştirilmemelidir; aksi takdirde seyreltici flakona transfer üzerinde sızıntı yapabilir.
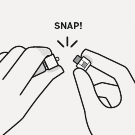
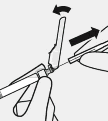
Kullanıma hazır enjektör flakon adaptörüne bağlanır
![]()

Steril blister çıkarılır
Flakon sızıntıyı önlemek için dik konumda tutulur. Flakonun alt kısmı tutulur ve çıkarmak için steril blister çekilir.
Çalkalanmaz.
Flakon adaptörünün üzerindeki açık luer açıklığına
Uygun şekilde kavranır Enjektörün ucundaki beyaz manşondan tutulur.
Enjektör kurulum sırasında cam silindirden tutulmaz.
Kapak çıkarılır Beyaz manşon tutularak beyaz kapak çekilir.
Beyaz kapak döndürülmez veya kesilmez.
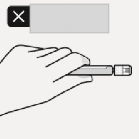
Yanlış
Enjektör ucuna dokunulmaz. Bu, kontaminasyona neden olacaktır.
Kırılmış kapak atılabilir.
Enjektör flakon adaptörüne bağlanır
Flakon adaptörü sabit kalması için etekten tutulur.
Enjektör, beyaz manşondan tutulur, ardından ucu, flakon adaptörünün luer açıklığına takılır.
Cam enjektör silindiri tutulmaz. Bu, beyaz manşonun gevşemesine veya çıkmasına neden olur.
dokunulmaz. Bu, kontaminasyona neden olur.
Enjektör flakon adaptörüne sert bir saat yönünde dönüş hareketi ile tam oturana kadar takılır.
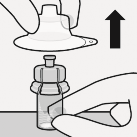
Mikroküreler sulandırılır
Adım 2
Fazla sıkılmaz. Fazla sıkılma enjektör ucunun kırılmasına neden olabilir.
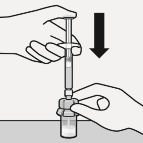
Seyreltici enjekte edilir
Tam miktarda seyreltici enjektörden flakona enjekte edilir.
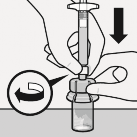
Mikroküreler seyrelticide askıya alınır
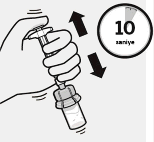
![]()

Piston çubuğu tutularak, gösterildiği gibi en az 10 saniye şiddetli bir şekilde çalkalanır.
Süspansiyon kontrol edilir. Uygun şekilde karıştırıldığında, süspansiyon tek düze, yoğun ve süt benzeri bir renkte görülür.
Mikroküreler sıvıda görünür olacaktır.
Süspansiyonun çökelmemesi için derhal sonraki adıma geçilir.
Süspansiyon enjektöre aktarılır
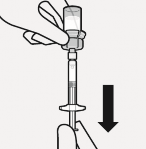
Flakon tamamen ters çevrilir. Tüm içeriği flakondan enjektöre çekmek için piston çubuğu yavaşça aşağı doğru çekilir.
Flakon adaptörü çıkarılır
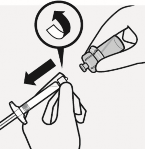
Beyaz manşon enjektör üzerinde tutulur ve flakon adaptöründen sökülür.
Flakon etiketi bölümü delikli yerden yırtılır. Çıkarılmış etiket tanıma amaçlarına yönelik olarak enjektöre uygulanır.
Flakon ve flakon adaptörü uygun şekilde atılır.

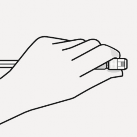
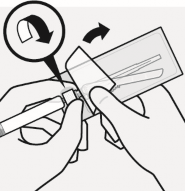
İğne takılır
Adım 3
Uygun iğne seçilir Enjeksiyon konumuna dayanarak uygun iğne seçilir (gluteal veya deltoid)
İğne takılır
Blister kesesi kısmen soyulur ve iğnenin alt kısmını gösterildiği gibi tutmak için kullanılır
Enjektördeki beyaz manşonu tutarak, enjektör sert bir saat yönünde dönme hareketiyle tam oturana kadar iğne luer bağlantısına takılır.
İğne luer açıklığına dokunulmaz. Bu, kontaminasyona neden olur.
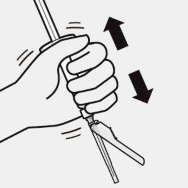
Mikroküreler tekrar askıya alınır
Blister kesesi tamamen çıkarılır.
Enjeksiyondan hemen önce, çökelme meydana gelmiş olabileceğinden enjektör sert bir şekilde tekrar çalkalanır.
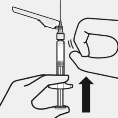
Şeffaf iğne koruyucu çıkarılır
İğne güvenlik cihazı gösterildiği gibi enjektörden geriye doğru çıkarılır.
Ardından enjektör üzerindeki beyaz manşon tutularak şeffaf iğne koruyucu dikkatli bir şekilde düz olarak çekilir.
Luer bağlantısı gevşeyebilece- ğinden şeffaf iğne koruyucusu döndürülmez.
Hava baloncukları çıkarılır İğne dik
konumda tutulur ve hava baloncuklarının üste çıkması için hafifçe vurulur. Havayı uzaklaştırmak için yavaşça ve dikkatli bir şekilde piston çubuğu yukarı doğru itilir.
Enjekte edilir
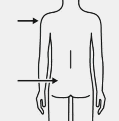
Enjektörün tüm içeriği intramuskuler olarak (IM) hastanın gluteal veya deltoid kasına derhal enjekte edilir.
Gluteal enjeksiyon, gluteal alanın üst dış çeyreğine yapılmalıdır.
İntravenöz olarak uygulanmaz.
İğne güvenlik cihazına sabitlenir.
Bir eli kullanarak, iğne güvenlik cihazı, 45 derecelik açı ile sert ve düz bir yüzey üzerinde takılır. İğne güvenlik cihazına tamamen takılana kadar sert, hızlı bir hareketle bastırılır
İğne batma yaralanmaları önlenir:
İki el kullanılmaz
İğne güvenlik cihazı kasten çıkarılmaz veya yanlış kullanılmaz.
İğnenin bükülmesi veya zarar görmesi durumunda iğne düz hale getirilmez veya güvenlik cihazı takılmaz.
İğneler uygun şekilde bertaraf edilir
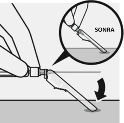
Doz enjekte edilir
Adım 4
İğne güvenlik cihazının tamamen takıldığından emin olmak için kontrol edilir.
Uygun keskici ve delici alet atık kutusuna atılır.
Ayrıca doz ambalajında verilen kullanılmamış iğne de atılır.
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| NEORIS | 8697930021292 | |
| NODIREP | 8699821090110 | |
| PERILIFE | 8699559090079 | |
| RESTELA | 8699525094384 | |
| RICUS | 8699578095413 | 55.47TL |
| Diğer Eşdeğer İlaçlar |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Geri Ödeme Kodu | A06816 |
| Satış Fiyatı | 2121.96 TL [ 8 Aug 2025 ] |
| Önceki Satış Fiyatı | 2121.96 TL [ 1 Aug 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593781032 |
| Etkin Madde | Risperidon |
| İthal ( ref. ülke : Portekiz ) ve Beşeri bir ilaçdır. |