RONSENGLOB %5 100 ml IV infüzyon için çözelti içeren flakon { Sentinus } Klinik Özellikler
{ Human Immunglobulin G }
KLİNİK ÖZELLLİKLER
4.1. Terapötik endikasyonlar
İmmun yetmezlik durumlarında replasman tedavisi için;
Antikor üretiminin bozulduğu primer (Konjenital) immun yetmezliklerde,
4.2. Pozoloji ve uygulama şekli
:
Replasman tedavisi immün yetmezlikler konusunda deneyimli bir uzman hekimin denetiminde başlatılmalı ve izlenmelidir.
4.2. Pozoloji ve uygulama şekli
:
Replasman tedavisinde hastadaki farmakokinetik ve klinik yanıta bağlı olarak dozun bireysel şekilde ayarlanması gerekebilir.
Primer immün yetmezliklerde replasman tedavisi:
Doz, bir sonraki infüzyondan önce ölçülen serum IgG düzeyinin en az 500-600 mg/dL düzeyinde kararlı olarak sürdürülmesini sağlayacak şekilde ayarlanmalıdır. Bu dengenin sağlanabilmesi için tedavinin başlangıcından itibaren 3-6 ay gereklidir.
Önerilen başlangıç dozu bir seferde verilen 0,4-0,8 g/kg infüzyonu takiben her 3-4 haftada bir uygulanan en az 0,2g/kg'dır.
Serum immnünglobulin düzeyinin 500-600 mg/dL olacak şekilde sabit tutulabilmesi için gereken
doz ortalama 0,2-0,8 g/kg düzeyindedir.
Kararlı serum düzeyi sağlandıktan sonra doz aralığı 3 ile 4 hafta arasında değişir.
Hastanın klinik yanıtı ile birlikte kararlı serum düzeyleri ölçülmeli ve değerlendirilmelidir. Klinik yanıta bağlı olarak (ör, enfeksiyon sıklığı) daha yüksek kararlı serum düzeylerinin sağlanması amacıyla doz ve/veya doz aralığının ayarlanması düşünülebilir.
Sekonder immün yetmezlikte replasman tedavisi:
Sekonder immün yetmezlikte replasman tedavisinde tavsiye edilen doz 3-4 haftada bir uygulanan 0,2-0,4 g/kg'dır.
Primer immun trombositopenide:
İki alternatif doz şeması vardır:
Birinci gün 0,8-1 g/kg dozunda uygulanır; doz, 3 gün içerisinde bir kez tekrarlanabilir veya
4.3. Kontrendikasyonlar
RONSENGLOB insan immunoglobulini veya diğer insan kan ürünlerine karşı şiddetli veya anaflaktik aşırı duyarlılık hikayesi olan bireylerde kontrendikedir.
IgA'ya karşı IgE aracılıklı antikorlara sahip olduğu bilinen seçici IgA eksikliği olan çok ender kişiler RONSENGLOB kullanmamalıdır.
Yukarıda belirtilen durumlar dışında, RONSENGLOB'un bebeklerde kontrendike olduğuna dair bir veri bulunmamaktadır.

4.4. Özel kullanım uyarıları ve önlemleri
Virüs güvenliğiRONSENGLOB, insan plazmasından elde edilmektedir. İnsan plazmasından elde edilen ilaçlar, virüsler ve teorik olarak Varyant Creutzfeldt-Jacob (v-CJD) gibi, çeşitli hastalıklara yol açabilen enfeksiyon yapıcı ajanlar içerebilirler. RONSENGLOB'da Varyant Creutzfeldt-Jacob hastalığının bulaşma riski teorik olarak minimumken, klasik Creutzfeldt-Jacob hastalığının bulaşma riski hiçbir kanıtla desteklenemez. Alınan önlemlere rağmen, bu tür ürünler halen potansiyel olarak hastalık bulaştırabilir.
Bu tip ürünlerin enfeksiyon yapıcı ajanları bulaştırma riski, plazma verenlerin belirli virüslere önceden maruz kalıp kalmadığının izlenmesi, belirli virüs enfeksiyonlarının halihazırda varlığının test edilmesi ve belirli virüslerin yok edilmesi ve/veya inaktivasyonu ile azaltılmıştır. Bütün bu önlemlere rağmen, bu ürünler hala potansiyel olarak hastalık bulaştırabilirler. Ayrıca, henüz bilinmeyen enfeksiyon yapıcı ajanların bu ürünlerin içerisinde bulunma ihtimali mevcuttur.
HIV, HBV, HCV gibi zarflı virüsler ve HAV gibi zarflı olmayan virüsler için etkili önlemlerin alınmasına dikkat edilmelidir. Parvovirüs B19 gibi zarflı olmayan virüslere karşı alınan tedbirler sınırlı sayıda olabilir. Parvovirüs B19 enfeksiyonu, gebelikte (fetal infeksiyon) ve immün yetmezlik ya da kırmızı kan hücre üretiminde artış olan hastalarda tehlikeli olabilir (hemolotik anemi gibi).
Doktor, bu ilacı hastaya reçete etmeden veya uygulamadan önce hastası ile risk ve yararlarını tartışmalıdır.
Ayrıca;
RONSENGLOB kullanılması gerekiyorsa, hastalık yapıcı etkenlerin bulaşmasını önlemek için uygun aşıların (Hepatit A, Hepatit B vb.) yaptırılması önerilebilir.
Hastalar açısından RONSENGLOB her uygulandığında, hastayla ürünün seri numarası arasındaki başlantının korunabilmesi için, ürünün adı ve seri numarası kaydedilmelidir.
Bazı olumsuz etkiler infüzyon hızıyla ilgili olabilir. “Pozoloji ve uygulama şekli†bölümünde önerilen infüzyon hızına hassasiyetle uyulmalıdır. İnfüzyon süresince hastalar herhangi bir semptomun gelişmesi açısından monotorize edilmeli ve dikkatle izlenmelidir. Aşağıdaki durumlarda bu olumsuz etkiler daha sık görülebilir:
-Yüksek infüzyon hızı
-IgA yetmezliği olan ya da olmayan hipogamaglobulinemi ya da agamaglobulinemi
-İlk kez insan normal immünoglobulini uygulaması yapılacak hastalar ya da nadiren, kullanılan normal insan immünoglobulin preparatı değiştirildiğinde ya da en son uygulamadan sonra uzun bir süre geçmişse
Gerçek aşırı duyarlılık reaksiyonları nadirdir ve çok seyrek olarak anti-IgA antikoru olan IgA yetmezlikli vakalarda görülmektedir.
Nadiren insan normal immünoglobulini, daha önce insan normal immünoglobulin tedavisi uygulanmış ve tedaviyi tolere edebilmiş hastalarda bile anafilaktik reaksiyonla birlikte kan basıncında düşmeye neden olabilmektedir.
Potansiyel komplikasyonlardan korunabilmek için;
-İnsan normal immünoglobulinine karşı duyarlı olmayan hastalarda başlangıçta preparatı yavaş infüzyon ile uygulayınız (dakikada 0.01 mL/kg).
-Hastalar infüzyon süresince dikkatle takip edilmelidir. Özellikle, daha önce insan normal immünoglobulini infüzyonu uygulanmamış, farklı bir preparat uygulanmış ya da daha önceki infüzyondan sonra uzun süre geçmiş hastalar, potansiyel istenmeyen etkilerin belirtilerini tesbit etmek için ilk infüzyon süresince ve infüzyondan sonraki ilk saat boyunca dikkatle izlenmelidir. Diğer tüm hastalar da uygulamadan sonra en az 20 dakika süreyle izlenmelidir.
Hemolitik anemi
IVIG ürünleri hemolizis olarak hareket edebilecek ve kırmızı kan hücrelerinin (RBC) immünoglobulinle in vivo kaplanmasını indükleyerek pozitif doğrudan antiglobulin reaksiyonu (Coomb testi) ve nadiren hemolize neden olan kan grubu antikorları içerebilir. Hemolitik anemi, artan RBC sekestrasyonundan dolayı IVIG tedavisinin ardından gelişebilir. IVIG alıcıları, hemoliz klinik işaret ve belirtileri açısından izlenmelidir.
Bazı vakalarda, hemolizis ile ilişkili böbrek fonksiyon bozukluğu/böbrek yetmezliği veya dissemine intravasküler koagülasyon bozukluğu oluşabilir.
Aşağıda belirtilen risk faktörleri hemolizis gelişimi ile ilişkilendirilir; -yüksek doz kullanım, - tek seferde uygulama veya bölünmüş dozlar şeklinde birkaç gün süre ile uygulama -kişinin imflamatuvar durumu ile ilişkili olarak, A, B ve AB kan grubuna sahip kişilerde
IVIG alıcıları hemolizisin klinik semptom ve belirileri açısından takip edilmelidir. IVIG infüzyonu sırasında veya sonrasında hemolizis oluşursa IVIg uygulaması hemen kesilmelidir. (bkz. Bölüm 4.8. Olası Yan Etkiler-Hemolizis).
Aseptik menenjit sendromu
Nadir olarak IVIG tedavisi sonucu aseptik menenjit sendromu oluşumu bildirilmiştir. Sendrom genellikle, immunoglobulin intravenöz tedavisini takip eden birkaç saat ile 2 günlük süre içerisinde başlar. Şiddetli baş ağrısı, ense sertliği, uyuşukluk, ateş, foto-fobi, ağrılı göz hareketleri, mide bulantısı ve kusma gibi semptom ve belirtiler ile tanımlanır. Böyle semptom ve belirtiler gösteren hastalar Menenjit'in diğer sebeplerini eleyebilmek için, beyin omurilik sıvısı (CSF) çalışmalarını da kapsayan, tam bir nörolojik incelemeden geçirilmelidirler.
Tromboembolizm
IVIG uygulaması ile miyokard infarktüsü, inme, pulmoner emboli ve immünoglobulinin yüksek akış hızı nedeniyle kan viskozitesinde görülen göreceli artışa bağlı olduğu sanılan, derin ven trombozu gibi tromboembolik vakalar arasındaki bağlantıyı gösteren klinik kanıtlar mevcuttur. Obez hastalarda ve ileri yaş, hipertansiyon, diabetes mellitus ve vasküler hastalık ya da trombotik atak öyküsü, edinsel ya da kalıtsal trombofilik hastalıklar gibi trombotik olay açısından önceden var olan risk faktörlerini taşıyan hastalarda, IVIG reçetelenip infüzyonu uygulanırken dikkatli hareket edilmelidir. Tromboembolitik yan etki reaksiyonları için riskli hastalarda, IVIG ürünleri mümkün olan en düşük infüzyon hızında ve dozunda verilmelidir.
Akut böbrek yetmezliği
IVIG tedavisi uygulanan hastalarda akut böbrek yetmezliği gelişebildiği bildirilmiştir. Bu olguların çoğunda daha önceden bir böbrek yetmezliği, diabetes mellitus, hipovolemi ya da aşırı kilo bulunması, önceden nefrotoksik ilaç kullanım öyküsü veya kişinin 65 yaşın üzerinde olması gibi risk faktörleri olduğu bildirilmiştir.
Böbrek fonksiyon bozukluğu gelişmesi durumunda IVIG infüzyonunun durdurulması düşünülmelidir.
Böbrek fonksiyon bozukluğu ya da böbrek yetmezliğinin değişik IVIG preparatlarımn kullanımıyla ilişkili olabileceği bildirilmiş olmasına rağmen, olguların çoğundan, stabilizasyon amacıyla sukroz içeren preparatlar sorumlu tutulmaktadır. Risk altındaki hastalarda, sukroz içermeyen preparatların kullanımı düşünülmelidir.
Akut renal yetmezlik veya tromboembolik istenmeyen etki riski bulunan hastalarda, IVIG preparatları uygulanabilir en düşük infüzyon hızında ve dozda kullanılmalıdır.
IVIG uygulanan tüm hastalarda aşağıdaki konular dikkatle değerlendirilmelidir:
-IVIG infüzyonundan önce yeterli hidrasyonun sağlanması
-İdrar miktarının izlenmesi
-Serum kreatinin düzeylerinin izlenmesi
-Beraberinde Henle kıvrımına etki eden diüretiklerin kullanımından kaçınılması
İstenmeyen etki görülmesi halinde, uygulama hızı azaltılmalı ya da uygulama durdurulmalıdır. İstenmeyen etkinin tipine ve şiddetine göre tedavi gerekebilir. Şok gelişmesi durumunda, standart tıbbi şok tedavisi uygulanmalıdır.
Diabetes mellitus hastaları için RONSENGLOB'un daha düşük konsantrasyonlara seyreltilmesi gerekiyorsa, seyreltme işlemi için %5 Glukoz çözeltisi kullanımı düşünülmelidir.
RONSENGLOB maltoz içerir; %5 dekstroz (DW5) veya %5 enjeksiyonluk glukoz çözeltisiyle 1-2 defa seyreltilebilir. Bu, diyabet hastalarında göz önünde bulundurulmalıdır.
Kan glukoz testi: Maltoz içeren parenteral ilaç ürünleri glukoz dehidrojenaz pirrolokinolinekinonlu (GDH-PQQ) test çubuklarının kullanıldığı kan glukoz monitörlerinin yorumlarını etkileyebilir. GDH-PQQ bazlı glukoz monitorizasyon sistemleri RONSENGLOB'daki maltoz ile reaksiyona girip infüzyon gününde kan glukozunun yanlış olarak yüksek görünmesine yol açabilirler. Kandaki glukozun monitarizasyonu gereken hastalara RONSENGLOB alırken örneğin glukoz dehidrojenaz nikotin adenin dinukleotid (GDH-NAD), glukoz oksidaz ya da glukoz heksokinaz test metodları gibi maltoz ile reaksiyona girmeyen metodları tercih etmeleri önerilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Canlı virüs aşıları ile etkileşim:
RONSENGLOB içerisinde bulunan antikorlar; kızamık, kabakulak, kızamıkçık ve varicella gibi canlı ve zayıflatılmış aşıların etkinliğini en az 6 hafta olmak üzere 3 aya kadar bozabilir.
Dolayısıyla, bu aşıların uygulanması, RONSENGLOB uygulamasından 3 ay sonrasına veya daha uzun süreye ertelenmelidir. Kızamık hastalarında bu durum 1 yıla kadar sürebilir. Bu nedenle kızamık aşısı uygulanan hastalarda antikor düzeyleri kontrol edilmelidir. Aynı sebeple, eğer hastanın durumu acil değilse, RONSENGLOB uygulanması belirtilen aşıların uygulanmasından 3-4 hafta sonrasına kadar ertelenmelidir. Eğer hasta söz konusu aşıların yapılmasını takiben 3 ila 4 hafta içerisinde RONSENGLOB almışsa, aşılama işlemi RONSENGLOB'un son verildiği tarihten 3 ay sonra tekrar edilmelidir.
Serolojik testlerle etkileşim:
İnsan normal immünoglobulin enjeksiyonundan sonra pasif olarak transfer edilmiş antikorların hastanın kanında geçici olarak yükselmesi, serolojik testlerde yanlış pozitif sonuçlara neden olur.
A, B, D gibi eritrosit antijenlerine karşı olan antikorların pasif geçişi, antiglobulin testi (Coombs testi) gibi kırmızı hücre allo-antikor serolojik testleriyle etkileşebilir. RONSENGLOB maltoz içermesi nedeniyle kan glukoz düzeyini etkileyebilir.
RONSENGLOB'un hastanın alıyor olabileceği diğer ilaçlardan ayrı olarak verilmesi tavsiye edilir. Ürün, diğer üreticilerin IVIG ürünleriyle karıştırılmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Özel popülasyonlara ilişkin etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon
RONSENGLOB ile pediyatrik popülasyonda bir etkileşim çalışması yapılmamıştır.
Geriyatrik popülasyon
RONSENGLOB ile geriyatrik popülasyonda bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/doğum kontrolü (kontrasepsiyon) RONSENGLOB'un çocuk doğurma potansiyeli bulunan kadınlarda ve gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Gebelik dönemi
RONSENGLOB'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik / ve-veya / embriyonal / fetal gelişim / veveya/ doğum / ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebe kadınlara verilirken tedbirli olunmalıdır. RONSENGLOB gebelik döneminde gerekli olmadıkça kullanılmamalıdır.
Laktasyon dönemi
RONSENGLOB'un hamilelerde güvenli kullanımı kontrollü klinik çalışmalarla değerlendirilmemiştir. Bu nedenle emziren annelerde dikkatli kullanılmalıdır. RONSENGLOB anne sütü ile atılmaktadır (süte geçmektedir). Ancak RONSENGLOB'un tüm dozlarında, emzirilen çocuk üzerinde herhangi bir olumsuz etki öngörülmemektedir. Aksine, anne sütüne geçerek yeni doğana koruyucu antikorların geçmesine katkıda bulunabilir.
Üreme yeteneği / fertilite
Hayvan üreme çalışmaları yürütülmemiştir. İnsanlardaki üreme yeteneği / fertiliteyi etkileyip etkilemediği bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
İnfüzyon seti ile bir sağlık kuruluşunda uygulanan bir üründür. Araç ve makina kullanımına ilişkin herhangi bir etki gözlenmemiştir. Ancak RONSENGLOB kullanımına ilişkin baş dönmesi, sersemlik hissi ve bulantı gibi durumlar görüldüğünde, araç ve makine kullanılmamalı veya söz konusu etkilerin düzelmesi beklenmelidir.
4.8. İstenmeyen etkiler
İntravenöz insan normal immünoglobulin uygulamasında başağrısı, ateş, titreme, ürperti, kabartı, baş dönmesi, ürtiker, hırıltı ya da göğüs sıkışması, bulantı, kusma, sertlik, sırt ağrısı, göğüs ağrısı, kas krampları ve kan basıncında değişiklikler gibi bazı istenmeyen yan etkiler sıklıkla görülebilir.
İnsan normal immünoglobulinleri kan basıncında seyrek olarak ani düşüklüklere sebep olabilir ve izole bazı vakalarda önceki uygulamada hasta hipersensitivite reaksiyonu göstermemiş olsa bile anafilaktik şok gelişebilir.
Geri dönüşümlü aseptil menenjit, izole bazı vakalarda geri dönüşümlü, hemolitik anemi/hemoliz, karaciğer transaminazlarda, geçici artış ve nadir vakalarda, geçici kutanöz reaksiyonlar insan normal immünoglobulin ile gözlemlenmiştir.
Serum kreatinin seviyesinde artış ve/veya akut renal yetmezlik gözlemlenmiştir.
Çok Seyrek: Miyokardiyal İnfarktüs, İnme, pulmoner emboli ve derin ben trombozu gibi tromboembolik reaksiyonlar.
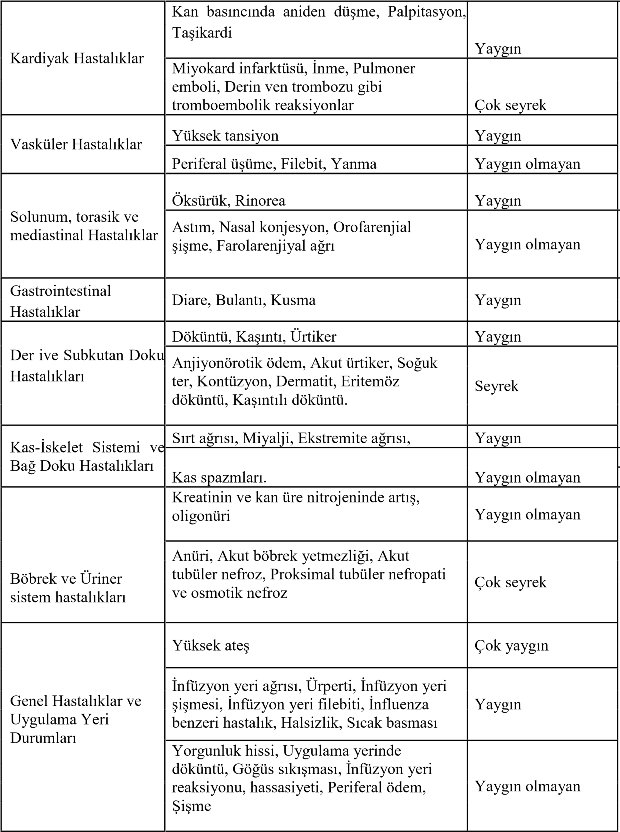
RONSENGLOB ile bir klinik çalışma ve retrospektif bir çalışma yapılmıştır. Klinik çalışmada doğumdan 1 saat sonra yaşından 65 yaşına kadar 124 hasta RONSENGLOB infüzyonu almıştır. Bir hastada geçici baş ağrısı gözlemlenmiş ve daha önceden Sulfanilamide ve penisiline anaflaktik cevaplar veren bir hastada da geçici ürtiker ve kaşıntı gözlemlenmiştir. Retrospektif çalışmada 1634 Hasta RONSENGLOB İnfüzyonu almıştır ve çalışmalar süresince ciddi advers etki görülmemiştir ve infüzyon başına genel advers olay oranı 0.016 olarak bulunmuştur. Klinik çalışmada ve retrospektif çalışmada bildirilmiş ciddi olmayan advers etkiler MedDRA Sistem organ sınıfı ve frekansı olarak kategorize edilip, aşağıdaki tabloda özetlenmiştir.
Şu terimler ve sıklık dereceleri kullanılmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1000 ila <1/100); seyrek (≥ 1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
RONSENGLOB ile yapılan klinik çalışma ve retospektrif çalışmalardaki advers ilaç reaksiyon frekansları | ||
MedDRA Sistem Organ Sınıfları | MedDRA Tercih Edilen Tanım | ADR Frekans Kategorisi |
Enfeksiyonlar ve enfestasyonlar | Bronşit, Nazofarenjit | Yaygın |
Kronik sinüzit, Fungal enfeksiyon, Enfeksiyon, Böbrek enfeksiyonu, Sinüzit, Üst solunum yolları enfeksiyonu, Bakteriyel idrar yolu enfeksiyonu |
Yaygın olmayan | |
Kan ve lenfatik sistem hastalıkları |
Anemi/Hemolisiz, Lenfadenopati |
Yaygın olmayan |
Endokrin Hastalıklar | Tiroid hastalıkları | Yaygın olmayan |
Psikolojik Hastalıklar | Anksiyete | Yaygın olmayan |
Sinir Sistemi Hastalıkları | Baş ağrısı | Çok yaygın |
Migren | Yaygın | |
Uykusuzluk, Amnezi, Yanma hiss, Dizartri, Disguzi Sersemlik hissi | Yaygın olmayan | |
Aseptik menenjit sendromu | Çok seyrek | |
Göz Hastalıkları | Konjunktivit, Göz ağrısı, Göz şişmesi | Yaygın olmayan |
Kulak ve İç Kulak Hastalıkları | Vertigo, Orta kulakta sıvı | Yaygın olmayan |
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, eposta: tufam@titck.gov.tr; tel: 0800 3140008; faks: 0312 2183599)
4.9. Doz aşımı ve tedavisi
Doz aşımına ilişkin herhangi bir klinik çalışma yürütülmemiştir. Önerilenden daha fazla doz uygulanması, kanın yoğunlaşmasına ve kan hacminin artmasına, sonuç olarak, özellikle yaşlı hastalarda ve böbrek problemleri olan hastalarda, kalp yükünde artışa yol açabilir. Tedavi semptomatik olarak yapılmalıdır. Bazen diyaliz yapılması gerekebilir
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ GENEL BİLGİLERİ
Sentinus İlaç A.Ş.
| Geri Ödeme Kodu | A12796 |
| Satış Fiyatı | 31126.32 TL [ 2 May 2025 ] |
| Önceki Satış Fiyatı | 30925.45 TL [ 25 Apr 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Mor Reçeteli bir ilaçdır. |
| Barkodu | 8681248076020 |
| Etkin Madde | Human Immunglobulin G |
| ATC Kodu | J06BA02 |
| Birim Miktar | 0.05 |
| Birim Cinsi | G |
| Ambalaj Miktarı | 100 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > İmmünoglobülinler > İmmunglobulin |
| İthal ( ref. ülke : Cin ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |