RYDAPT 25 mg yumuşak kapsül (112 kapsül) Farmakolojik Özellikler
{ Midostaurin }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri ATC kodu: L01EX10
Etki mekanizması:
Midostaurin FLT3 ve KIT kinaz dahil olmak üzere birden fazla reseptör tirozin kinazı inhibe eder. Midostaurin, ITD ve TKD mutant reseptörlerin ekspresyonunu ya da yabanıl tip reseptörlerin aşırı ekspresyonunu yapan lösemik hücrelerde FLT3 reseptör sinyallemesini inhibe eder ve hücre döngüsünü durdurarak apoptozu indükler. İn vitro veriler midostaurinin hastalarda elde edilen maruziyet düzeylerinde D816V mutant KIT reseptörlerini inhibe ettiğini göstermektedir (ortalama elde edilen maruziyet > IC). İn vitro veriler KIT yabanıl tip reseptörlerinin, bu konsantrasyonlarda çok daha düşük ölçüde inhibe edildiğine işaret etmektedir (ortalama elde edilen maruziyet < IC). Midostaurin, aberan KIT D816V aracılı sinyallemeye müdahale eder ve mast hücre proliferasyonunu, sağkalımını ve histamin serbestlenmesini inhibe eder.
Midostaurin ayrıca PDGFR (trombosit türevli büyüme faktörü reseptörü) ya da VEGFR2 (vasküler endotelyal büyüme faktörü reseptörü 2) gibi birçok diğer reseptör tirozin kinazı ve ayrıca serin/treonin kinaz ailesi PKC'nin (protein kinaz C) bazı üyelerini de inhibe eder.
Midostaurin bu kinazların katalitik alanına bağlanır ve hücrelerdeki ilgili büyüme faktörlerinin mitojenik sinyallemesini inhibe ederek büyümenin durmasına yol açar.
Midostaurin, kemoterapötik ajanlarla (sitarabin, doksorubisin, idarubisin ve daunorubisin) kombinasyon halinde, FLT3-ITD ekspresyonu yapan AML hücre hatlarında sinerjik büyüme inhibisyonuna yol açmıştır.
Farmakodinamik etkiler:
Mürin modellerinde ve insanlarda iki temel metabolit belirlenmiştir: CGP62221 ve CGP52421. FLT3-ITD ekspresyonu yapan hücrelerle gerçekleştirilen proliferasyon deneylerinde, CGP62221 ana bileşiğe benzer bir potens sergilemiştir; diğer yandan, CGP52421 yaklaşık 10-kat daha az potent bulunmuştur.
Kardiyak elektrofizyoloji:
Günde iki kere 75 mg dozla 192 sağlıklı gönüllü üzerinde gerçekleştirilen bir QT çalışmasında, midostaurin ve CGP62221 ile klinik açıdan anlamlı QT uzaması gözlenmemiştir; ancak çalışma süresi, uzun etkili metabolit CGP52421'in QTc uzaması etkilerini tahmin etmek için yeterince uzun değildir. Dolayısıyla midostaurinin ve her iki metabolitin konsantrasyonuyla birlikte QTcF'deki başlangıca göre değişim, ilerlemiş SM, SM-AHN ve MCL'si olan 116 hastada gerçekleştirilen bir faz II çalışmada daha ayrıntılı olarak araştırılmıştır. Günde iki kere 100 mg dozda ulaşılan medyan pik Ckonsantrasyonlarda, midostaurin, CGP62221 ya da CGP52421, klinik açıdan anlamlı QTcF uzamasına yol açma potansiyeli sergilememiştir; çünkü bu konsantrasyon düzeylerinde öngörülen değişimin üst sınırları 10 milisaniyeden düşüktür (sırasıyla 5,8, 2,4 ve 4 msan). İlerlemiş SM, SM-AHN ve MCL popülasyonunda hastaların %25,4'ü 450 msn'den yüksek ve
%4,7'si 480 msn'den yüksek QTcF ile en az bir EKG ölçümüne sahiptir. Klinik etkililik:
AML
Plasebo artı standart kemoterapi karşısında standart kemoterapiyle kombinasyon halinde ve ayrıca tekli ajan idame tedavisi olarak midostaurinin etkililik ve güvenliliği, bir randomize, çift kör, faz III çalışmada 717 hasta üzerinde (18 ila 60 yaş) araştırılmıştır. Bir klinik çalışma deneyimi ile belirlenmiş, yeni tanı konmuş FLT3-mutasyonlu AML hastaları, ardışık olarak, standart daunorubisin (1.-3. günlerde günlük 60 mg/m) / sitarabin (1.-7. günlerde günlük 200
mg/m) indüksiyonu ve yüksek doz sitarabin (1., 3., 5. günlerde 12 saatte 1 3 g/m) konsolidasyonu ile kombinasyon halinde günde iki kere 50 mg midostaurin (n=360) veya plasebo (n=357) (1:1) ve bunu takiben 12 siklusa kadar (28 gün/siklus) başlangıç randomizasyonuna göre kesintisiz midostaurin ya da plasebo tedavisi alacak şekilde randomize edilmiştir. Çalışma çeşitli AML ile ilişkili sitogenetik anormallikleri olan hastaları içerse de, akut premiyelositik lösemisi (M3) ya da tedaviye bağlı AML'si olan hastalar hariç tutulmuştur. Hastalar FLT3 mutasyon durumuna göre sınıflandırılmıştır: TKD, <0,7 allelik oranla ITD ve ≥0,7 allelik oranla ITD.
İki tedavi grubu, hastalık özellikleriyle ilgili başlangıç demografikleri açısından genel olarak dengelenmiştir. Hastaların medyan yaşı 47'dir (aralık: 18 ila 60 yıl), hastaların çoğunda ECOG performans durumu 0 veya 1'dir (% 88,3) ve hastaların çoğunluğunda yeni tanı AML söz konusudur (% 95). Irk bilgisi bildirilmiş olan hastalar arasında % 88,1'i beyaz ırka mensuptur. Hastaların çoğunda (% 77,4) FLT3-ITD mutasyonları olduğu, çoğunluğunda (%
47,6) allelik oranının düşük olduğu (<0,7) hastaların % 22,6'sında FLT3-TKD mutasyonları olduğu belirlenmiştir. Midostaurin kolunda hastaların % 48'i, plasebo kolunda ise hastaların
% 41'i erkektir.
Hematopoietik kök hücre nakline (SCT) devam eden hastalar, kök hücre infüzyonundan önce ya da infüzyon sırasında çalışma tedavisi almayı bırakmıştır. Genel SCT oranı midostaurin artı standart kemoterapi kolunda % 59,4 (214/360) ve plasebo artı standart kemoterapi kolunda % 55,2 (197/357) olarak belirlenmiştir. Tüm hastalar sağkalım açısından takip edilmiştir.
Çalışmanın birincil sonlanım noktası, randomizasyon tarihinden herhangi bir nedenle ölüme kadar geçen süre olarak ölçülen genel sağkalımdır (OS). Birincil analiz, son hastanın randomizasyonundan itibaren minimum yaklaşık 3,5 yıllık bir takipten sonra yapılmıştır. Çalışmada, plasebo artı standart kemoterapi karşısında midostaurin artı standart kemoterapi için ölüm riskinde % 23'lük bir azalmaya birlikte OS'de istatistiksel olarak anlamlı bir iyileşme olduğu gösterilmiştir (bkz. Tablo 6 ve Şekil 1).
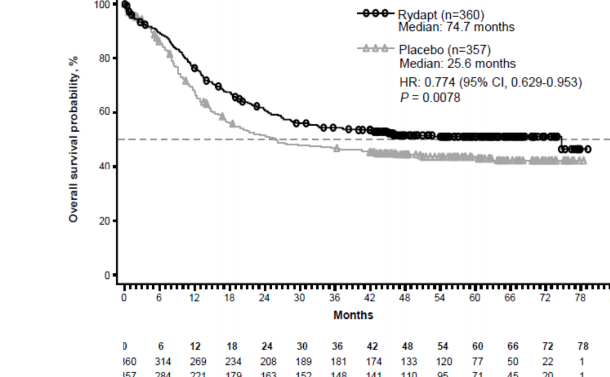
Risk altındaki hastalar
Ay
Ay
To pla m sa ğk alı m ola sılı ğı,
%
RYDAPT (n=360)
Medyan: 74.7 ay
Plasebo (n=357) Medyan: 25.6 ay
Şekil 1 Genel sağkalım için Kaplan-Meier eğrisi, SCT için sansürlenmemiş
Kritik ikincil sonlanım noktası olaysız sağkalımdır (EFS; bir EFS olayı, protokol tedavisi başlatıldıktan sonraki 60 gün içinde tam remisyon (CR) elde edememe, relaps ya da herhangi bir nedenle ölüm olarak tanımlanmıştır). EFS, plasebo artı standart kemoterapi ile karşılaştırıldığında midostaurin artı standart kemoterapiyle istatistiksel olarak anlamlı bir iyileşme göstermiştir (HR: 0,78 [% 95 GA, 0,66 ila 0,93] p = 0,0024), ve medyan EFS
sırasıyla 3 ay ila 8,2 ay; bkz. Tablo 5.
Tablo 5 Midostaurinin AML'de etkililiği
Etkililik Parametresi | Midostaurin n=360 | Plasebo n=357 | HR* (%95 GA) | P- değeri |
Genel Sağkalım (OS) |
|
|
|
|
Medyan OS (ay) (%95 GA) | 74,7 (31,5-NE) | 25,6 (18,6-42.9) | 0,77 (0,63-0,95) | 0,0078 |
5. yılda Kaplan-Meier tahminleri (%95 GA) | 0,51 (0,45-0,56) | 0,43 (0,38-0,49) |
|
|
Olaysız Sağkalım (EFS) |
|
|
|
|
Tedavi başlangıcından sonraki 60 gün içinde CR'ler göz önünde bulundurularak medyan EFS (ay) (%95 GA) | 8,2 (5,4-10,7) | 3,0 (1,9-5,9) | 0,78 (0,66-0,93) | 0,0024 |
İndüksiyon sırasında herhangi bir zamandaki CR'ler göz önünde bulundurularak medyan EFS (ay) (%95 GA) | 10,2 (8,1-13,9) | 5,6 (2,9-6,7) | 0,73 (0,61-0,87) | 0,0001 |
Hastalıksız Sağkalım (DFS) |
|
|
|
|
Medyan DFS (ay) (%95 GA) | 26,7 (19,4-NE) | 15,5 (11,3-23,5) | 0,71 (0,55-0.92) | 0,0051 |
Tam Remisyon (CR) |
|
|
|
|
Tedavi başlangıcından sonraki 60 gün içinde (%) | 212 (58,9) | 191 (53,5) | NE | 0,073 |
İndüksiyon sırasında herhangi bir zamanda (%) | 234 (65,0) | 207 (58,0) | NE | 0,027 |
Kümülatif relaps insidansı (CIR) |
|
|
|
|
Medyan (%95 GA) | NE (25,7-NE) | 17,6 (12,7-46,3) | 0,68 (0,52-0,89) | 0,0023 |
*Randomizasyon FLT3 mutasyon faktörüne göre sınıflandırılmış Cox regresyon modeli kullanılarak tahmin edilmiş tehlike oranı (HR) | ||||
Midostaurin kolu için gün 60 itibariyle CR oranı bakımından midostaurin lehine olan (% 58,9 karşısında % 53,5; p=0,073), indüksiyon sırasındaki tüm CR'ler göz önünde bulundurulduğunda devam eden (% 65 karşısında % 58; p=0,027) bir trend söz konusu olmuştur. Buna ek olarak, indüksiyon sırasında tam remisyon elde eden hastalarda, 12. aydaki kümülatif relaps insidansı midostaurin kolunda % 26 karşısında plasebo kolunda % 41 bulunmuştur.
SCT zamanında sansürlenen gerek OS gerekse EFS için duyarlılık analizleri de, plaseboya kıyasla midostaurin artı standart kemoterapi ile klinik faydayı desteklemiştir.
SCT durumuna göre OS sonuçları Şekil 2'de gösterilmektedir. EFS için, çalışma tedavisi başladıktan sonraki 30 gün içindeki remisyonlar göz önünde bulundurulduğunda, HR değeri SCT'li hastalar için 0,602 (% 95 GA: 0,372-0,974) ve SCT'siz hastalar için 0,827 (% 95 GA: 0,689-0,993) olarak midostaurin lehine sonuç vermiştir.
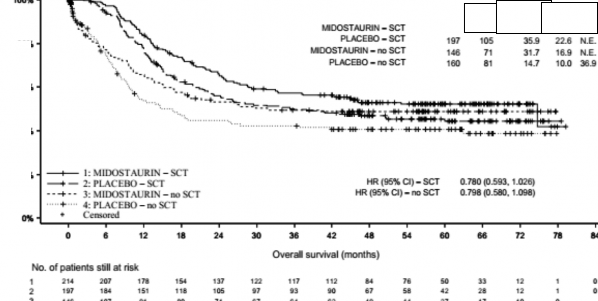
Şekil 2 AML'de SCT durumuna göre genel sağkalım için Kaplan Meier eğrisi
Bir alt grup analizinde kadınlarda göze çarpan bir OS faydası gözlenmemiştir ancak tüm ikincil etkililik sonlanım noktalarında bir tedavi faydası gözlenmiştir (bkz. Tablo 6).
Tablo 6 AML'de cinsiyete göre OS, EFS, CR, DFS ve CIR'a genel bakış
Sonlanım noktası | Genel %95 GA | Erkekler %95 GA | Kadınlar %95 GA |
OS (HR) | 0,774 | 0,533 | 1,007 |
| (0,629-0,953) | (0,392-0,725) | (0,757-1,338) |
EFS (CR indüksiyon) | 0,728 | 0,660 | 0,825 |
(HR) | (0,613-0,866) | (0,506-0,861) | (0,656-1,037) |
CR indüksiyon (OR) | 0,743* | 0,675* | 0,824* |
| (0,550-1,005) | (0,425-1,072) | (0,552-1,230) |
DFS (CR indüksiyon) | 0,663 | 0,594 | 0,778 |
(HR) | (0,516-0,853) | (0,408-0,865) | (0,554-1,093) |
CIR (CR indüksiyon) | 0,676 | 0,662 | 0,742 |
(HR) | (0,515-0,888) | (0,436-1,006) | (0,516-1,069) |
*Olasılık oranı şu şekilde hesaplanmıştır (Tedavide tam remisyon yok/ Tedavide tam remisyon var) / (Plaseboda tam remisyon yok/ Plaseboda tam remisyon var HR= Tehlike oranı; OR=olasılık oranı | |||
60-70 yaş arası hastalardaki etkililik ve güvenlilik, FLT3-ITD mutasyonlu AML hastalarında allojenik SCT dahil konsolidasyon, tekli ajan idame tedavisi ve yoğun indüksiyon ile kombinasyon halinde midostaurinin incelendiği faz II, tek kollu, araştırmacı tarafından başlatılan bir çalışmada değerlendirilmiştir. Nihai analize göre, 2 yılda (birincil sonlanım notası) EFS oranı %34 (%95 CI: 27, 44) ve 60 yaşından büyük hastalarda (440 hastadan 128'i) medyan genel sağkalım 22,7 aydır.
İlerlemiş SM, SM-AHN ve MCL
Hep birlikte ilerlemiş sistemik mastositoz (SM) olarak anılan ilerlemiş SM, SM-AHN ve MCL'li hastalarda midostaurinin etkililiği, açık etiketli, tek kollu ve çok merkezli iki çalışmada (toplam 142 hasta) değerlendirilmiştir.
Pivotal çalışma, ilerlemiş SM'si olan 116 hasta üzerinde gerçekleştirilen çok merkezli, tek kollu bir faz II çalışmadır (Çalışma CPKC412D2201). Midostaurin, hastalık progresyonu ya da tolere edilemeyen toksisiteye kadar günde iki kere 100 mg olarak oral yoldan uygulanmıştır. Kaydedilen 116 hastanın 89'u yanıt değerlendirmesi için uygun kabul edilmiştir ve birincil etkililik popülasyonunu oluşturmuştur. Bunların içinde 73 hastada ilerlemiş SM (57'sinde AHNMD) ve 16'sında MCL (6'sında AHNMD) tespit edilmiştir. Birincil etkililik popülasyonunda medyan yaş 64'tür ve hastaların yarısı ≥65'tir. Hastaların yaklaşık üçte biri (%36) ilerlemiş SM, SM-AHN veya MCL için daha önce anti-neoplastik tedavi görmüştür. Başlangıçta birincil etkililik popülasyonunda, hastaların % 65'inde ≥1 ölçülebilir C bulgusu (trombositopeni, hipoalbuminemi, anemi, yüksek total bilirubini, transfüzyona bağımlı anemi, kilo kaybı, nötropeni, yüksek ALT veya AST) belirlenmiştir. Hastaların % 82'sinde KIT D816V mutasyonu tespit edilmiştir.
Birincil sonlanım noktası toplam yanıt oranıdır (ORR). Yanıt oranları değiştirilmiş Valent ve Cheson kriterlerine göre değerlendirilmiş ve yanıtlar bir çalışma yürütme komitesi tarafından doğrulanmıştır. İkincil sonlanım noktaları şunları kapsamaktadır: yanıt süresi, yanıta kadar geçen süre ve toplam sağkalım. Midostaurinin yanıtları Tablo 7'de sunulmaktadır. KIT D816V durumundan, daha önceki tedavilerin sayısından ve bir AHNMD'nin varlığı ya da yokluğundan bağımsız olarak aktivite gözlenmiştir. Gerek KIT D816V mutasyonu pozitif hastalarda (ORR=% 63) gerekse KIT D816V yabanıl tip veya bilinmeyen hastalarda (ORR=% 43,8) doğrulanmış yanıtlar gözlenmiştir. Bununla birlikte KIT D816V pozitif hastalar 33,9 ay (% 95 GA: 20,7-42) için medyan sağkalım KIT D816V yabanıl tip veya bilinmeyen hastalara kıyasla (10 ay (% 95 GA: 6,9-17,4) daha uzun olmuştur. Hastaların % 46'sında kemik iliği filtrasyonunda % 50'yi aşan azalma ve % 58'sinde serum triptaz düzeylerinde % 50'yı aşan azalma olmuştur. Dalak hacmi, en az 1 başlangıç sonrası değerlendirmesi olan hastaların % 68,9'unda ≥%10 azalmıştır (hastaların % 26,7'sinde ≥% 35 azalma vardır; bu da palpasyonla
% 50 azalmaya tekabül etmektedir).
Yanıta kadar geçen medyan süre 0,3 aydır (aralık: 0,1 ila 3,7 ay). Medyan takip süresi 43 aydır.
Tablo 7 İlerlemiş SM, SM-AHN ve MCL'de RYDAPT'ın etkililiği: birincil etkililik popülasyonu
| Tümü N=89 | İlerlemiş SM N=16 | SM-AHN N=57 | MCL N=16 |
Birincil sonlanım noktası |
|
|
|
|
Genel yanıt, n (%) | 53 (59,6) | 12 (75,0) | 33 (57,9) | 8 (50,0) |
(%95 GA) | (48,6-69,8) | (47,6-92,7) | (44,1-70,9) | (24,7-75,3) |
Majör yanıt, n (%) | 40 (44,9) | 10 (62,5) | 23 (40,4) | 7 (43,8) |
Kısmi yanıt, n (%) | 13 (14,6) | 2 (12,5) | 10 (17,5) | 1 (6,3) |
Stabil hastalık, n (%) | 11 (12,4) | 1 (6,3) | 7 (12,3) | 3 (18,8) |
Progresif hastalık, n (%) | 10 (11,2) | 1 (6,3) | 6 (10,5) | 3 (18,8) |
İkincil sonlanım noktaları |
|
|
|
|
Medyan yanıt süresi, ay (%95 | 18,6 | 36,8 | 10,7 | NR |
GA) | (9,9-34,7) | (5,5-NE) | (7,4-22,8) | (3,6-NE) |
Medyan genel sağkalım, ay (%95 GA) | 26,8 (17,6-34,7) | 51,1 (28,7-NE) | 20,7 (16,3-33,9) | 9,4 (7,5-NE) |
5 yılda Kaplan-Meier tahminleri (%95 GA) | 26,1 (14,6-39,2) | 34,8 (1,7-76,2) | 19,9 (8,6-34,5) | 33,7 (12,3-56,8) |
NE: Tahmin Edilmemiştir; NR: Ulaşılmamıştır Çalışma dışı anti-neoplastik tedavi alan hastaların, yeni tedavide progrese olduğu kabul edilmiştir. | ||||
Her ne kadar çalışma, modifiye Valent ve Cheson kriterlerine göre değerlendirilmek üzere tasarlanmış olsa da, post hoc açıklayıcı analiz olarak etkililik 2013 International Working Group - Myeloproliferative Neoplasms Research ve Treatment - European Competence Network on Mastocytosis (IWG-MRT-ECNM) konsensus kriterlerine göre de değerlendirilmiştir. RYDAPT'a yanıt herhangi bir hüküm olmadan uygulanan bir kompütasyonel algoritma kullanılarak tespit edilmiştir. 116 hastanın 113'ünde IWG yanıt kriterlerine göre belirlenen C bulguları söz konusu olmuştur (C bulgusu olarak assit hariç tutularak). Tüm yanıtlar göz önünde bulundurulmuş ve 12 haftalık doğrulama gerektirmiştir (bkz. Tablo 8).
Tablo 8 Algoritmik yaklaşım kullanılarak IWG-MRT-ECNM konsensus kriterlerine göre midostaurinin ilerlemiş SM, SM-AHN ve MCL'de etkililiği
| Değerlendirilen tüm hastalar | İlerlemiş SM | SM-AHN | MCL | Bilinmeyen alt tip |
| N=113 | N=15 | N=72 | N=21 | N=5 |
Genel yanıt oranı, n (%) | 32 (28,3) | 9 (60) | 15 (20,8) | 7 (33,3) | 1 (20) |
(%95 GA) | (20,2-37,6) | (32,3-83,7) | (12,2-32) | (14,6-57) | (0,5-71,6) |
En iyi genel yanıt, n (%) |
|
|
|
|
|
Tam remisyon | 1 (0,9) | 0 | 0 | 1 ( 4,8) | 0 |
Kısmi remisyon | 17 (15) | 5 (33,3) | 8 (11,1) | 3 (14,3) | 1 (20) |
Klinik düzelme | 14 (12,4) | 4 (26,7) | 7 (9,7) | 3 (14,3) | 0 |
Yanıt süresi * |
|
|
|
|
|
n/N (%) | 11/32 (34,4) | 4/9 (44,4) | 4/15 (26,7) | 3/7 (42,9) | 0/1 (0) |
medyan (%95 GA) | NE (27-NE) | 36,8 (10,3-36,8) | NE (17,3-NE) | NE (4,1-NE) | NE |
Genel sağkalım |
|
|
|
|
|
n/N (%) | 65/113 (57,5) | 4/15 (26,7) | 49/72 (68,1) | 12/21 (57,1) | 0/5 (0) |
medyan (%95 GA) | 29,9 (20,3-42) | 51,1 (34,7-NE) | 22,1 (16,8-32,2) | 22,6 (8,3-NE) | NE |
* Yanıtlar için doğrulama süresi: 12 hafta Analizde C bulgusu olarak assit dışlanmaktadır. Çalışma dışı anti-neoplastik tedavi alan hastaların, yeni tedavide progrese olduğu kabul edilmiştir. | |||||
Destekleyici çalışma, ilerlemiş SM, SM-AHN ve MCL'si olan 26 hasta üzerinde gerçekleştirilmiş bir tek kollu, çok merkezli, açık etiketli bir faz II çalışmadır (CPKC412A2213). Midostaurin 28 günden oluşan sikluslarda günde iki kere 100 mg olarak oral yoldan uygulanmıştır. İkinci siklus sonunda majör yanıt (MR) ya da kısmı yanıtın (PR) olmaması, çalışma tedavisinin bırakılmasına yol açmıştır. 20 (% 76,9) hastada ilerlemiş SM (17'sinde [% 85] AHNMD) ve 6 hastada (% 23,1) MCL vardır (2'sinde [% 33,3] AHNMD). Medyan yaş 64,5'tir ve hastaların yarısı ≥65 yaşındadır. Başlangıçta hastaların % 88,5'inde >1
C bulgusu belirlenmiştir ve hastaların % 69,2'sine daha önce en az bir tane anti-neoplastik rejim uygulanmıştır.
Birincil sonlanım noktası, tedavinin ilk iki siklusu sırasında Valent kriterleri tarafından değerlendirilmiş ORR'dir. On dokuz hasta (% 73,1; % 95 GA = [52,2-88,4]), tedavinin ilk iki siklusu sırasında bir yanıta ulaşmıştır (13 MR; 6 PR). Medyan takip süresi 73 aydır ve medyan yanıt süresine ulaşılmamıştır. Medyan genel sağkalım 40 aydır (hastalar, tedavi bırakıldıktan sonra sağkalım için yalnızca en fazla bir yıl takip edilmiştir).
Pediyatrik popülasyon
Bir Faz II çalışmada, midostaurin, FLT3 mutasyonlu yeni tanı konmuş AML'li pediyatrik hastalarda kemoterapi ile kombinasyon halinde araştırılmıştır. Çalışmaya katılan üç FLT3 mutasyonlu AML hastasından, 2 hastada (10 ve 14 yaş) kemoterapi (1-5 günde 2 g/m/gün
sitarabin, 1-5 günde 30 mg/m/gün fludarabin ve 2.,4. ve 6. günlerde 12 mg/m/gün idarubisini içeren) ile kombinasyon halinde midostaurinin ikinci indüksiyon döngüsünden sonra (günde iki kez 30 mg/m) doz sınırlayıcı toksisiteler (DLT'ler) gözlemlenmiştir. Her iki hasta da, belirgin şekilde gecikmiş hematolojik iyileşmeler göstermiştir (örn., birinci hastada tedavide 44 gün , ikinci hastada tedavide 51 gün süren uzun süreli 4. derece trombositopeni ve ikinci hastada tedavide 46 gün süren 4. derece nötropeni). Her iki hastaya da birinci indüksiyon döngüsünde sitarabin, etoposid ve idarubisin ile kombinasyon halinde midostaurin uygulanmıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerMidostaurin iyi emilim ve kötü çözünürlüğe sahip bir bileşiktir. Metabolitlerinden ikisi farmakolojik aktiviteler göstermiştir (CGP52421 ve CGP62221). Çoklu dozlardan sonra midostaurin ve CGP62221'in farmakokinetiği zamana bağlı olmuş, yaklaşık ilk haftada bir ilk artış gözlenmiş, bunu 28. günde konsantrasyonlarda kararlı duruma ulaşana dek bir düşüş izlemiştir. CGP52421 konsantrasyonlarının midostaurin ve CGP62221 kadar anlamlı ölçüde azaldığı görülmemektedir.
Emilim:
Oral uygulama sonrasında midostaurinin mutlak biyoyararlanımı bilinmemektedir.
İnsanlarda midostaurinin oral uygulama sonrası emilimi hızlıdır ve toplam radyoaktivitenin t'ı dozdan 1-3 saat sonra gözlenmiştir. Popülasyon farmakokinetik analizi hastalarda emilimin günde iki kez 50 mg'ın üzerindeki dozlarda dozla orantılı değerden düşük olduğunu göstermiştir.
Sağlıklı gönüllülerde, tek doz 50 mg midostaurinin tok karnına uygulanmasından sonra midostaurinin EAA değeri 20800 ng*s/ml'ye yükselmiş ve Cdeğeri 963 ng/ml'ye düşmüştür (bkz. Bölüm 4.5). Benzer şekilde CGP52421 ve CGP62221 için de EAA değeri sırasıyla 19000 ve 29200 ng*s/ml'ye yükselmiş ve Cdeğeri 172 ve 455 ng/ml'ye düşmüştür. Ayrıca, yüksek oranda yağ içeren bir öğünle birlikte pik konsantrasyona kadar geçen süre uzamıştır. ttüm entiteler için uzamış, midostaurin medyan tdeğeri 3 saat olmuş, CGP52421 ve CGP62221 için tdeğeri sırasıyla 6 ve 7 saate uzamıştır.
Klinik çalışmalarda RYDAPT'ın etkililiği ve güvenliliği, hafif bir öğünle uygulama
sonrasında incelenmiştir. İlerlemiş SM, SM-AHN ve MCL hastalarında tok karnına midostaurinin 100 mg'lık tek dozunun uygulanmasının ardından midostaurinin EAA, Cve tdeğerleri sırasıyla 49600 ng*s/ml, 2940 ng/ml ve 3 saat olmuştur. CGP52421 için EAAve Cdeğerleri sırasıyla 2770 ng*s/ml ve 299 ng/ml bulunmuştur. CGP62221 için ise EAAve Cdeğerleri sırasıyla 8700 ng*s/ml ve 931 ng/ml olmuştur. Midostaurinin günde iki kez 100 mg oral dozlarından sonra AML ve İlerlemiş SM, SMAHN, MCL hastalarında Cplazma midostaurin değerleri sırasıyla 919 ve 1060 ng/ml olmuştur. AML ve ilerlemiş SM, SM-AHN, MCL popülasyonunda CGP62221'in Cdeğeri sırasıyla 1610 ng/ml ve 2020 ng/ml bulunmuştur. AML ve ilerlemiş SM, SM-AHN, MCL popülasyonunda ise CGP52421'in değeri sırasıyla 8630 ng/ml ve 2860 ng/ml ölçülmüştür.
Dağılım:
Midostaurin, 95,2 L (Vz/F) geometrik ortalamasıyla yüksek bir doku dağılımına sahiptir. Midostaurin ve metabolitleri, eritrositlerden ziyade büyük oranda plazmada dağılır. İn vitro veriler, midostaurinin, albümin, α1-asit glikoprotein (AGP) ve lipoprotein gibi plazma proteinlerine % 98'den yüksek bir oranda bağlandığını göstermiştir.
Biyotransformasyon:
Midostaurin temelde oksidatif yolaklarla olmak üzere CYP3A4 aracılığıyla metabolize edilir. Başlıca plazma bileşenleri midostaurin ve iki majör aktif metabolit olan CGP62221 (O- demetilasyon yoluyla) ve CGP52421'i (hidroksilasyon yoluyla) içermiş olup bunlar, midostaurinin 50 mg'lık tek dozundan 96 saat sonra toplam plazma maruziyetinin sırasıyla % 27,7 ± 2,7'si ve % 38 ± 6,6'sını oluşturmaktadır.
Eliminasyon:
Midostaurin, CGP62221 ve CGP52421'in plazmadaki medyan terminal yarı-ömrü yaklaşık olarak 20,9, 32,3 ve 471 saattir. Sağlıklı gönüllülerde görünür plazma klirensi (CL/F) 2,4-3,1 l/saat bulunmuştur. AML ve ilerlemiş SM, SM-AHN ve MCL hastalarında kararlı durumda midostaurin klirens için popülasyon farmakokinetiği tahminleri 5,9 l/s ve 4,4 l/s olmuştur. İnsan Kütle Denge çalışmasının bulguları, fekal atılımın, büyük oranda metabolitleri şeklinde (dozun % 73'ü) olmak üzere, temel atılım yolu olduğunu göstermiştir (dozun % 78'i); diğer yandan değişmemiş midostaurin, dozun % 3'ünü oluşturmaktadır. Dozun yalnızca % 4'ü idrarda tespit edilmiştir.
Doğrusallık/doğrusal olmayan durum:
Genel olarak midostaurin ve metabolitleri, 25 mg ila 100 mg aralığındaki tek bir dozdan sonra doz-oransallığından önemli bir sapma göstermemiştir. Diğer yandan, günde 50 mg ila 225 mg aralığındaki çoklu dozlardan sonra maruziyette doz oransallığından daha düşük bir artış olmuştur.
Çoklu oral dozları takiben, midostaurin zamana bağlı bir farmakokinetik sergilemiştir; ilk haftada plazma konsantrasyonlarında bir başlangıç artışı olmuş (pik C) ve daha sonra bunu, yaklaşık 28 gün sonraki kararlı duruma kadar zaman içinde bir azalma takip etmiştir (2,5 kat azalma). Midostaurinin azalan konsantrasyonlarının kesin mekanizması net olmamakla birlikte olasılıkla midostaurin ve iki aktif metaboliti CGP52421 ve CGP62221'in CYP3A4 üzerindeki oto-indüksiyon özelliklerinden kaynaklanmaktadır. CGP62221 metabolitinin farmakokinetiği benzer bir eğilim sergilemiştir. Diğer yandan, bir aylık tedaviden sonra midostaurin ile karşılaştırıldığında, CGP52421 konsantrasyonları, ilerlemiş SM, SM-AHN ve MCL için 2,5 kata kadar ve AML için 9 kata kadar artış göstermiştir.
İlaç-ilaç etkileşim potansiyelinin in vitro değerlendirmesi
İn vitro verilere dayanarak, midostaurin ve aktif metabolitleri olan, CGP52421 ve CGP62221'in CYP1A2 ve CYP2E1'nin inhibitörleri ve CYP2B6 (CAR aracılı indüksiyon) ve CYP1A2'nin (AhR aracılı indüksiyon) indükleyicileri oldukları kabul edilir.
In vitro deneyler, midostaurinin, CGP52421 ve CPG62221'in BCRP ve BSEP'yi potansiyel olarak inhibe edebileceğini göstermiştir. Fizyolojik temelli farmakokinetik (PBPK) modellerinin kullanıldığı simülasyonlar, kararlı durumda günde iki kez 50 mg veya 100 mg dozda verilen midostaurinin klinik olarak anlamlı OATP1B inhibisyonuna neden olmasının olası olmadığını öngörmüştür.
Hastalardaki karakteristik özellikler
Yaşlı hastalar:
Farmakokinetik analizlere dayalı olarak, 65 ile 85 yaş arası hastalarda midostaurin ve iki aktif metabolitinin farmakokinetiği üzerinde yaşın önemli bir etkisi tanımlanmamıştır. İlerlemiş SM, SM-AHN ve MCL ya da AML'si olan yetişkin hastalarda, herhangi bir midostaurin doz ayarlaması gerekli değildir.
Pediyatrik hastalar
RYDAPT'ın çocuklar ve adölesanlarda kullanımı önerilmemektedir (bkz. Bölüm 4.2). Pediyatrik hastalarda midostaurinin farmakokinetiği, bir popülasyon farmakokinetiği yaklaşımı kullanılarak, AML ya da MLL-rearranged ALL'li 22 hastada (12'si 0-2 yaş ve 10'u 10-17 yaş) gerçekleştirilen bir faz I, doz yükseltme monoterapi çalışmasında araştırılmıştır. Midostaurinin farmakokinetiği, tek ve çoklu dozlardan sonra 30 mg/m ve 60 mg/m dozları ile doz orantısaldan düşük olmuştur. Pediyatrik hastalardaki sınırlı farmakokinetik veriler nedeniyle, erişkinlerdeki midostaurin farmakokinetiği ile bir karşılaştırma yapılamamaktadır.
Cinsiyet
Midostaurin ve aktif metabolitlerinin klirensi üzerinde cinsiyetin etkisiyle ilgili popülasyon farmakokinetik model analizlerine dayalı olarak, istatistiksel olarak anlamlı bir bulgunun olmadığı görülmüş ve maruziyette beklenen değişikliklerin (<%20) klinik açıdan önemli olmadığı düşünülmüştür. Cinsiyete dayalı olarak midostaurin doz ayarlaması gerekli değildir.
Irk
Beyaz ve Siyah gönüllüler arasında farmakokinetik profil açısından farklılık yoktur. Sağlıklı Japon gönüllüler üzerinde gerçekleştirilen bir faz I çalışmaya göre, Beyazlar ve Siyahlar üzerinde gerçekleştirilen diğer farmakokinetik çalışmalarda gözlenenlerle karşılaştırıldığında, midostaurinin ve metabolitlerinin (CGP62221 ve CGP52421) farmakokinetik profilleri benzerdir. Etnisiteye dayalı olarak midostaurin doz ayarlaması gerekli değildir.
Karaciğer yetmezliği olan hastalar
Özel bir karaciğer yetmezliği çalışmasında, başlangıçta hafif veya orta derecede karaciğer yetmezliği (sırasıyla, Child-Pugh Sınıf A veya B) olan hastalarda 6 gün boyunca günde iki kez 50 mg ve 7. günde tek bir 50 mg dozun oral yoldan uygulanmasından sonra ve şiddetli karaciğer yetmezliği olan hastalarda (Child-Pugh Sınıf C) 50 mg'lık tek doz uygulamasını takiben midostaurinin sistemik maruziyeti, normal karaciğer fonksiyonuna sahip kontroller ile
karşılaştırmalı olarak değerlendirilmiştir. Tüm gruplar için tek veya tekrarlanan dozların ardından 2 ila 3 saat sonra maksimum midostaurin konsantrasyonuna ulaşılmıştır. 1. günde, EAAve C, sağlıklı gönüllüler için sırasıyla 8130 ng*sa/ml ve 1206 ng/ml olmuştur. EAA, hafif ve orta derecede karaciğer yetmezliği olan hastalarda sırasıyla %39 ve %36 oranında azalmıştır. 7. günde, EAA(1. günden 7. güne Ceğrisi altındaki maruziyet) sağlıklı gönüllülerde 5410 ng*sa/ml iken hafif ve orta derecede karaciğer yetmezliği olan hastalarda sırasıyla %35 ve %20 azalmıştır. EAAda 7. günde sırasıyla %28 ve %20 azalmıştır.
Şiddetli karaciğer yetmezliği olan gönüllülerin, kontrol grubuna kıyasla daha düşük geometrik ortalama Cve midostaurin EAAdeğerlerine sahip olduğu görülmüştür (C: 1360 ng/ml, EAA: 30100 ng.sa/ml). Midostaurinin Cve EAAdeğerleri şiddetli karaciğer yetmezliği olan hastalarda sırasıyla ortalama %78 ve %59 azalmıştır.
Son olarak, hastalardan elde edilen uzun vadeli veriler bir popülasyon farmakokinetiği yaklaşımı kullanılarak analiz edilmiştir. İlerlemiş SM, SM-AHN, MCL ve AML popülasyonlarında hafif veya orta derecede karaciğer yetmezliği olan hastalarda karaciğer yetmezliğinin herhangi bir etkisi tanımlanamamıştır.
Genel olarak, normal karaciğer fonksiyonu olan gönüllülere kıyasla hafif, orta veya şiddetli karaciğer yetmezliği olan hastalarda plazma midostaurin ve metabolitlerine (CGP62221 ve CGP5242) maruziyette (EAA) bir artış olmamıştır. Başlangıçta hafif veya orta derecede karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği olan hastalarda midostaurin ve aktif metaboliti CGP62221'e maruziyet, normal karaciğer fonksiyonu olan hastalara göre önemli ölçüde daha düşüktür (bkz. Bölüm 4.2). Bununla birlikte, şiddetli karaciğer yetmezliği olan hastalarda doz ayarlamasının gerekli olduğunu düşündürecek yeterli etkililik verisi bulunmamaktadır.
Böbrek yetmezliği olan hastalar
Renal eliminasyon, midostaurin eliminasyonu için minör bir yolaktır. Midostaurin için özel bir böbrek yetmezliği çalışması yürütülmemiştir. Popülasyon farmakokinetiği analizleri, AML'li (n=180) ve ilerlemiş SM, SM-AHN ve MCL'li (n=141) hastalarda yapılan klinik çalışmalarda elde edilen veriler kullanılarak yürütülmüştür. Dahil edilen 321 hastanın 177'sinde daha önceden var olan hafif (n=113), orta (n=60) ya da şiddetli (n=4) böbrek yetmezliği (15 ml/dak.
≤ kreatinin klirensi [CrCL] <90 ml/dak.) bulunduğu görülmüştür. 144 hastada başlangıçta normal böbrek fonksiyonu (CrCL>90 ml/min) görülmüştür. Popülasyon farmakokinetiği analizlerine dayalı olarak, midostaurin klirensi böbrek yetmezliğinden anlamlı oranda etkilenmemiştir ve dolayısıyla hafif ila orta şiddetli böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir.
5.3. Klinik öncesi güvenlilik verileri
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Satış Fiyatı | 287287.29 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 287287.29 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504190151 |
| Etkin Madde | Midostaurin |
| ATC Kodu | L01EX10 |
| Birim Miktar | 25 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 112 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |