SALOFALK 1G rektal köpük Kısa Ürün Bilgisi
{ Mesalazin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SALOFALK® 1 g rektal köpük
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir tüp, birim dozunda etkin madde olarak 1 g mesalazin içerir.
Yardımcı maddeler
Sodyum metabisülfit (E 223) 0,05 g Setostearil alkol 0,0091 g
Propilen glikol 3,4364 g
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Rektal köpük
SALOFALK®, grimsi beyaz veya kırmızımsı eflatun renkli kremsi dolgun köpük.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Sigmoid kolon ve rektumun aktif ve hafif ülseratif kolitlerinin tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresiYetişkinler:
Günde bir kez yatmadan önce iki uygulama yapılır.
Hasta bu köpük miktarını tutmada zorluk çekiyorsa, köpük ikiye bölünerek de uygulanabilir: biri akşamın ilk saatlerinde ve diğeri gece yatmadan önce (ilk tek dozun boşaltılmasından sonra) veya sabah erken saatlerde uygulanabilir.
En iyi sonuç SALOFALK® uygulamasından önce bağırsakların boşaltılmasıyla elde edilmiştir. Genellikle hafif ülseratif kolitin akut atakları 4-6 hafta içinde yatışır. İdame tedaviye, bu
preparasyon için önerilen bir dozda, ürünün diğer formu olan oral mesalazin (örn. Salofalk® Granu-Stix) ile devam edilmesi önerilir.
Uygulama şekli:
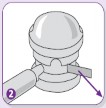
Rektal
SALOFALK mutlaka oda sıcaklığında (20-25ºC) kullanılmalıdır (ayrıca bkz. bölüm 6.4).
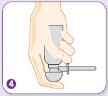
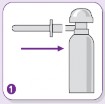
Aplikatörü spreyin başına takınız. Sprey kutuyu içeriğinin karışması için yaklaşık 20 saniye çalkalayınız. |
İlk kullanımda pompa altındaki güvenlik kilidini (plastik parça) çıkarınız. |
Pompa başlığının işaretle gösterilen bölümünü sprey ucu ile aynı hizaya gelene kadar çeviriniz. Sprey kutusu şu anda kullanıma hazırdır. |
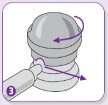
| İşaret parmağınızı pompa kapağının üstüne koyunuz ve spreyi baş aşağı gelecek biçimde çeviriniz. Spreyin gerektiği şekilde çalışması için işaret parmağınız pompa başlığı ile birlikte aşağıyı göstermelidir. |
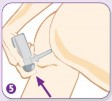
| Aplikatörü mümkün olduğunca rektum içine yerleştiriniz. Rahat bir uygulama için bir ayağınız yerdeyken diğerini bir sandalyeye veya tabureye koyunuz. Bir kez pompaya basınız ve yavaşça serbest bırakınız. İkinci uygulama için pompaya tekrar basınız ve yavaşça serbest bırakınız. Halen bir miktar köpük gelmeye devam ettiğinden, aplikatörü uygulama yaptıktan 10-15 saniye sonra çıkarınız, aksi takdirde köpük aplikatörden dışarı akar. |
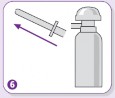
| Uygulama sonrası aplikatör atılır ve plastik torba içinde olmak kaydıyla evsel atık olarak imha edilir. Diğer bir uygulama için yeni aplikatör kullanılır. |
Özel popülasyonlara ilişkin ek bilgiler Böbrek/ Karaciğer yetmezliği:
Karaciğer fonksiyon bozukluğu olan hastalarda dikkatli kullanılmalıdır.
Böbrek fonksiyonları bozuk olan hastalarda kullanılması önerilmez. Tedavi sırasında böbrek fonksiyonları bozulursa, mesalazinin yol açtığı renal toksisite düşünülmelidir.
Şiddetli böbrek ve karaciğer yetmezliği olan hastalarda kontrendikedir.
Pediyatrik popülasyon:
SALOFALK®'ın çocuklarda etkili olduğuna dair çok az deneyim ve sınırlı sayıda doküman vardır.
Geriyatrik popülasyon:
Geriyatrik popülasyon için pozoloji bilinmemektedir.
4.3. Kontrendikasyonlar
SALOFALK® aşağıdaki durumlarda kontrendikedir:
Salisilatlara ya da 6.1 bölümünde listelenen diğer bileşenlere karşı bilinen duyarlılığı olanlarda
4.4. Özel kullanım uyarıları ve önlemleri
Tedaviye başlamadan önce ve tedavi sırasında hekimin isteğine göre kan testleri (tam kan sayımı; ALT veya AST gibi karaciğer fonksiyon testleri ve serum kreatinin) ve idrar tahlili (dipstick test) yapılmalıdır. Kılavuz olarak, kontroller tedaviye başlandıktan 14 gün sonra yapılmalı ve 4 haftalık aralarla 2-3 kez tekrarlanmalıdır.
Bulgular normal ise, tedavi sonrası kontroller 3 aylık aralarla yapılabilir. Ek semptomlar ortaya
çıkarsa, bu testler hemen yapılmalıdır.
Karaciğer fonksiyon bozukluğu olan hastalarda dikkatli kullanılmalıdır. Böbrek fonksiyonları bozuk olan hastalarda kullanılması önerilmez.
Tedavi sırasında böbrek fonksiyonları bozulursa, mesalazinin yol açtığı renal toksisite düşünülmelidir.
Mesalazin kullanımı ile % 100 mesalazin içerikli taşlar içeren nefrolitiazis vakaları rapor edilmiştir. Tedavi sırasında yeterli sıvı alımının sağlanması önerilir.
Mesalazin, sodyum hipokloritli ağartıcıyla temas ettikten sonra (örneğin, bazı ağartıcılarda bulunan sodyum hipokloritle temizlenen tuvaletlerde) idrarda kırmızı-kahverengi renk değişikliğine neden olabilir.
Özellikle astım olmak üzere akciğer fonksiyon bozukluğu olan hastalar SALOFALK® tedavisi
sırasında çok dikkatli bir şekilde izlenmelidir.
Şiddetli kutanöz advers reaksiyonlar
Mesalazin tedavisiyle ilişkili olarak, eozinofilinin ve sistemik semptomların eşlik ettiği ilaç etkileşimi (DRESS), Stevens-Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN) dahil olmak üzere şiddetli kutanöz advers reaksiyonlar (SCAR) bildirilmiştir. Deri döküntüsü, mukoza lezyonları veya diğer herhangi bir aşırı duyarlılık bulgusu gibi bulgu ve belirtiler ilk ortaya çıktığında mesalazin tedavisi kesilmelidir.
Sülfasalazin içeren ilaçlarla advers ilaç reaksiyonları görülme öyküsü olan hastalarda, SALOFALK® tedavisine yalnızca dikkatli bir hekim muayenesi ile başlanmalıdır. SALOFALK® abdominal kramplar, akut karın ağrısı, ateş, şiddetli baş ağrısı ve deride döküntü gibi akut intolerans reaksiyonlarına neden olursa tedavi hemen kesilmelidir.
Bu ilacın içeriğindeki setostearil alkol, lokal deri reaksiyonlarına (örneğin kontakt dermatite) neden olabilir.
SALOFALK® içeriğindeki propilen glikol deride iritasyona neden olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Karşılıklı etkileşime ilişkin özel araştırmalar yapılmamıştır.
Mesalazin beraberinde azatioprin, 6-merkaptopürin ya da tioguanin ile tedavi görmekte olan hastalarda; azatioprinin, 6-merkaptopürinin ya da tioguaninin miyelosüpresif etkilerinde olası artış dikkate alınmalıdır.
Mesalazinin, varfarinin antikoagülan etkisini azaltmasına ilişkin zayıf kanıt vardır.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
SALOFALK®'ın çocuklarda etkili olduğuna dair çok az deneyim ve sınırlı sayıda doküman vardır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)
SALOFALK®'ın çocuk doğurma potansiyeli bulunan kadınlara herhangi bir etkisi veya doğum kontrolü (kontrasepsiyon) için kullanılan ilaçlarla herhangi bir etkileşimi bildirilmemiştir.
Gebelik dönemi
SALOFALK®'ın gebe kadınlardaki kullanımına ilişkin yeterli veri yoktur. Sınırlı sayıda gebelikte maruz kalma olgularına ilişkin veriler, mesalazinin gebelik üzerinde ya da fetüsün/yenidoğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli bir epidemiyolojik veri elde edilmemiştir.
Oral yol ile alınan mesalazinde, hayvanlar üzerinde yapılan çalışmalar, gebelik/embriyonal/fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir.
SALOFALK® rektal köpük ile hayvanlar üzerinde çalışma mevcut değildir.
İzole tek bir vakada gebelik sırasında yüksek mesalazin dozunun uzun süreli uygulanması neticesinde (2-4 g/gün, oral) bir yenidoğanda böbrek yetmezliği bildirilmiştir.
SALOFALK®, gebelik sırasında ancak beklenen faydanın potansiyel riskten fazla olması halinde uygulanmalıdır.
Laktasyon dönemi
N-asetil-5-aminosalisilik asit ve daha az miktarda mesalazin anne sütüne geçmektedir. Mesalazinin kadınlarda emzirme dönemine etkisi ile ilgili sınırlı deneyim mevcuttur. Diyare gibi aşırı duyarlılık reaksiyonları emzirilen bebeklerde göz ardı edilemez.
Emzirmenin durdurulup durdurulmayacağına ya da SALOFALK® tedavisinin durdurulup durdurulmayacağına/ tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve SALOFALK® tedavisinin emziren anne açısından faydası dikkate alınmalıdır. Eğer bebekte diyare gelişirse, emzirmeye son verilmelidir.
Üreme yeteneği/Fertilite
Rektal yol ile alınan mesalazin için hayvanlarda üreme toksisitesi ile ilgili çalışmalar yapılmamıştır, insanlarda üreme yeteneği/fertilite üzerine etkisi bilinmemektedir. Oligospermi çok seyrek görülen istenmeyen etki olarak bildirilmiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanma yeteneği üzerinde hiçbir etki görülmemiştir ya da ihmal edilebilir
derecede etki görülmüştür.
4.8. İstenmeyen etkiler
Aşağıdaki sıklık verilerine göre yan etkiler değerlendirilmiştir:
Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1.000 ila < 1/100); seyrek (≥ 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Kan ve lenf sistemi hastalıkları
Çok seyrek: Bozulan kan sayımı (aplastik anemi, agranülositoz, pansitopeni, nötropeni,
lökopeni, trombositopeni)
Bağışıklık sistemi hastalıkları
Çok seyrek: Alerjik egzantem, ilaç ateşi, lupus eritomatozus sendromu, pankolit gibi aşırı duyarlılık reaksiyonları
Sinir sistemi hastalıkları Seyrek: Baş ağrısı, sersemlik Çok seyrek: Periferal nöropati
Kardiyak hastalıklar
Seyrek: Miyokardit, perikardit
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Çok seyrek: Alerjik ve fibrotik akciğer reaksiyonları (dispne, öksürük, bronkospazm, alveolit, pulmoner eozinofili, akciğer infiltrasyonu, pnömoni)
Gastrointestinal hastalıklar
Seyrek: Karın ağrısı, diyare, gaz, bulantı ve kusma
Çok seyrek: Akut pankreatit
Hepatobiliyer hastalıklar
Çok seyrek: Karaciğer fonksiyon testlerinde değişiklikler (transaminazlarda ve kolestaz parametrelerinde artış), hepatit, kolestatik hepatit
Deri ve derialtı doku hastalıkları
Seyrek: Işığa duyarlılık*
Çok seyrek: Alopesi (saç dökülmesi)
Bilinmiyor: Eozinofilinin ve sistemik semptomların eşlik ettiği ilaç etkileşimi (DRESS),
Stevens-Johnson sendromu (SJS), toksik epidermal nekroliz (TEN)
Mesalazin tedavisiyle ilişkili olarak, eozinofilinin ve sistemik semptomların eşlik ettiği ilaç etkileşimi (DRESS), Stevens-Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN) dahil olmak üzere şiddetli kutanöz advers reaksiyonlar (SCAR) bildirilmiştir (bkz. Bölüm 4.4).
*Işığa duyarlılık
Atopik dermatit ve atopik egzama gibi önceden var olan cilt rahatsızlığı olan hastalarda daha ciddi reaksiyonlar bildirilmiştir.
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Çok seyrek: Miyalji, artralji
Böbrek ve idrar yolu hastalıkları
Çok seyrek: Akut ve kronik interstisyel nefrit ve böbrek yetmezliğini içeren böbrek fonksiyon bozuklukları
Bilinmiyor: Nefrolitiazis (Bkz. Bölüm 4.4.)
Üreme sistemi hastalıkları
Çok seyrek: Oligospermi (geri dönüşümlü)
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Karın şişkinliği
Yaygın olmayan: Anal rahatsızlık, uygulama bölgesi iritasyonu, ağrılı rektal tenezm
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Aşırı doz üzerine (örneğin oral olarak aşırı dozda mesalazin ile intihar teşebbüsü) renal veya hepatik toksisite göstermeyen seyrek veriler vardır. Özel bir antidotu yoktur, tedavi semptomatik ve destekleyicidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İntestinal anti-inflamatuvar ajan
ATC kodu: A07EC02
Anti-inflamatuvar etki mekanizması bilinmemektedir. İn vitro çalışmaların sonuçları
lipoksijenaz inhibisyonunun etkili olabileceğini göstermektedir.
Bağırsak mukozasındaki prostaglandin içeriği üzerine etkisi de gösterilmiştir. Mesalazin (5- aminosalisilik asit/5-ASA) reaktif oksijen bileşenlerin radikal tutucusu olarak da etki göstermektedir.
Mesalazin, bağırsak mukozasında lokal olarak etkilidir ve bağırsağın luminal bölümünün mukoza ve submukoza dokusunda etki gösterir. Mesalazinin, inflamasyon bölgesinde bulunması önemlidir. Bu nedenle mesalazinin sistemik biyoyararlanım/plazma konsantrasyonları, terapötik etkinlik ile değil güvenlilik ile ilişkili bir faktördür.
5.2. Farmakokinetik özellikler
Emilim:
Mesalazin emilimi en yüksek oranda bağırsağın proksimal bölgelerinde, en düşük oranda da bağırsağın distal bölgelerinde gerçekleşir.
Mesalazinin emilimi hızlıdır. Mesalazin ve mesalazinin metaboliti N-Ac-5-ASA'nın pik plazma konsantrasyonlarına yaklaşık 4 saat sonra ulaşılır. Bununla birlikte, köpüğün 2 g mesalazin rektal dozunun plazma konsantrasyonları ile mesalazinin 250 mg oral dozu karşılaştırıldığında, yaklaşık 0,4 mikrogram/ml'de maksimum konsantrasyonlarına ulaşılır. Pre-sistemik metabolizma hızlıdır ve ayrıca N-Ac-5-ASA mesalazin gibi maksimum plazma konsantrasyonuna yaklaşık 4 saat sonra ulaşır, fakat plazma konsantrasyonları 2 mikrogram/ml ile yaklaşık 4-5 kat daha fazladır.
Dağılım:
Farmakosintigrafik/farmakokinetik bir kombinasyon çalışması, SALOFALK® dağılımının homojen, hızlı ve yaklaşık 1 saat içinde tamamlandığını göstermiştir. Dağılım, inflamasyonun yayılımına bağlı olarak bağırsak bölgesi rektum, sigmoid kolon ve kolonun sol tarafına ulaşır.
Biyotransformasyon:
Mesalazin presistemik olarak bağırsak mukozasında ve karaciğerde farmakolojik açıdan inaktif metaboliti olan N-asetil-5-aminosalisilik asite (N-Ac-5-ASA) dönüşür. Asetilasyon, hastanın asetilatör fenotipinden bağımsız olarak gerçekleşmektedir. Bazı asetilasyon işlemleri kalın bağırsak bakterileri tarafından oluşmaktadır. Mesalazin ve N-asetil-5-aminosalisilik asidin proteine bağlanma oranları sırasıyla % 43 ve % 78'dir.
Eliminasyon:
Mesalazin ve metaboliti olan N-Ac-5-ASA feçes (büyük kısmı) renal (miktarı uygulama şekline, farmasötik formuna ve mesalazinin salınma yoluna bağlı olarak %20 - %50 arasında değişir) ve biliyer (küçük bir kısmı) yollar ile atılmaktadır. Renal atılım temelde N-Ac-5-ASA şeklinde gerçekleşir. Ağız yoluyla toplam uygulanan mesalazin dozunun yaklaşık %1'i temelde N-Ac-5-ASA şeklinde anne sütüne geçer.
Doğrusallık/Doğrusal olmayan durum:
Veri yoktur.
5.3. Klinik öncesi güvenlilik verileri
İyi rektal tolerans gösteren köpekler üzerindeki lokal tolerans çalışması dışında SALOFALK® ile preklinik çalışmalar yapılmamıştır.
Preklinik veriler güvenlilik farmakolojisi, genotoksisite, karsinojenite (sıçanlarda) ya da üreme toksisitesi ile ilgili olarak özel bir zarar ortaya çıkarmamıştır.
Yüksek doz oral mesalazin ile yapılan tekrarlayan doz çalışmalarında, böbrek toksisitesi (renal papiler nekroz ve proksimal kıvrımlı tüplerde ya da tüm nefronda epitelyal hasar) görülmüştür. Bu bulgunun klinik önemi bilinmemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum metabisülfit (E 223) Setostearil alkol
Polisorbat 60 Disodyum edetat Propilen glikol Propan
n-bütan İzobütan Azot gazı
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25oC'nin altında oda sıcaklığında saklayınız ve ışıktan koruyunuz.
6.5. Ambalajın niteliği ve içeriği
Poliamid-imid veya epoksid-fenolik reçineden yapılmış uygun bir iç yüzey örtücüsü ile poliester veya poliasetal valf gövdesi, ölçme başlığı ve koruyucudan oluşan 5 ml'lik bir ölçme valfı bulunan ve LDPE koruyucu traya yerleştirilmiş 14 adet beyaz PVC aplikatör ile perçinlenmiş alüminyum tüp.
PVC aplikatör, beyaz yumuşak parafın (BP) ve sıvı parafinden (Ph. Eur. 7:3) oluşan bir merhem
ile kaplanmıştır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller ‘Tıbbi Atıkların Kontrolü Yönetmeliği' ve ‘Ambalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ASAMESA | 8699819911311 | 659.59TL |
| ASAZIN | 8699293925972 | 888.52TL |
| E.S. | 8680400771124 | |
| ENCOLİT | ||
| MESAFALK | 8681801920999 | 783.82TL |
| Diğer Eşdeğer İlaçlar |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |