SANDOSTATIN LAR 10 mg 1 flakon Kısa Ürün Bilgisi
{ Oktreotid }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SANDOSTATİN® LAR® 10 mg enjeksiyonluk süspansiyon için toz ve çözücü Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Oktreotid* (serbest peptid olarak) 10 mg (*11,2 mg oktreotid asetat'a eşdeğerdir.)
Yardımcı maddeler
Sodyum karboksi metil selüloz 14 mg
Yardımcı maddeler
3. FARMASÖTİK FORMU
Enjeksiyonluk süspansiyon için toz ve çözücü
Enjeksiyonluk kuru etkin madde içeren renksiz cam flakon ve çözücü içeren şırınga.
Flakonlar, beyaz ila sarımsı bir renk tonu içeren beyaz toz halinde etkin madde içerir. Enjeksiyonluk süspansiyon için verilen çözücü berrak ve renksiz ila hafif sarı veya kahverengi renktedir.
Adım
Seyreltici çözelti ile dolu enjektörün başlığını çıkarın ve enjektörü flakon adaptörüne vidalayın.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Cerrahi tedavinin veya radyoterapinin uygun olmadığı ya da etkisiz kaldığı hastalarda veya radyoterapinin tam etkisini göstermesine kadar geçen ara dönemde akromegali tedavisinde (bkz. Bölüm 4.2).
Karsinoid sendromun özelliklerini taşıyan karsinoid tümörler gibi fonksiyonel gastro- entero-pankreatik endokrin tümörlere eşlik eden semptomları olan hastaların tedavisinde (bkz. Bölüm 5.1).
Orta bağırsaktan kaynaklanan veya primer kaynağı bilinmeyen ancak orta bağırsak dışı bölgelerden kaynaklanan tümörlerin ekarte edilmiş olduğu, ilerlemiş nöroendokrin tümörleri olan hastaların tedavisinde.
TSH salgılayan hipofiz adenomlarının tedavisinde:
Cerrahi tedavi ve/veya radyoterapiden sonra salgı normalize olmadığında
4.2. Pozoloji ve uygulama şekli
Akromegalide:Tedaviye 3 ay boyunca her 4 haftada bir 20 mg SANDOSTATİN LAR kullanarak başlanması önerilir. SANDOSTATİN LAR tedavisi, son uygulanan subkutan SANDOSTATİN dozundan sonraki gün başlatılabilir. Daha sonraki dozaj ayarlamaları, klinik semptomlar ve serumdaki büyüme hormonu (GH) ve insülin-benzeri büyüme faktörü 1/somatomedin C (IGF 1) düzeyleri göz önünde bulundurularak yapılmalıdır.
Bu 3 aylık uygulama sırasında klinik semptomları ve biyokimyasal parametreleri (GH; IGF 1) tamamen kontrol altına alınamayan (GH konsantrasyonları hala 2,5 mikrogram/litreden yüksek olan) hastalarda doz, her 4 haftada bir 30 mg'a yükseltilebilir. Eğer 3 ay sonra hastanın biyokimyasal parametreleri (GH; IGF 1) ve/veya klinik semptomları 30 mg'lık dozda tamamen kontrol altına alınamıyorsa, doz her 4 haftada bir 40 mg'a yükseltilebilir. 40 mg üzerindeki dozlar önerilmez.
3 ay boyunca her 4 haftada bir uygulanan 20 miligramlık dozla GH konsantrasyonları daima < 1 mikrogram/litre bulunan, serum IGF 1 konsantrasyonları normale dönen ve akromegalinin reversibl nitelikteki hemen bütün belirtileri/semptomları ortadan kalkan hastalarda tedaviye, her 4 haftada bir 10 mg SANDOSTATİN LAR kullanarak devam edilebilir. Ancak özellikle bu hasta grubunda olmak üzere düşük SANDOSTATİN LAR dozlarının kullanılması sırasında serum GH ve IGF 1 konsantrasyonlarının ve klinik belirtilerin/semptomların yeterince kontrol altında olup olmadığının yakından izlenmesi önerilir.
Stabil SANDOSTATİN LAR dozu alan hastalarda her 6 ayda bir GH ve insülin-benzeri büyüme faktörü (IGF 1) değerlerine bakılmalıdır.
Gastro-entero-pankreatik endokrin tümörlerde:
Fonksiyonel gastro-entero-pankreatik endokrin tümörler ile ilişkili semptomları olan hastaların tedavisi:
Tedaviye 4 haftada bir 20 mg SANDOSTATİN LAR kullanılarak başlanması önerilir. İlk SANDOSTATİN LAR enjeksiyonunu izleyen 2 hafta boyunca, önceden etkili olduğu bilinen subkutan SANDOSTATİN dozlarının kullanılmaya devam edilmesi gerekir.
3 aylık tedaviyle semptomları ve biyolojik parametreleri iyi bir şekilde kontrol altına giren
hastalarda doz, her 4 haftada bir 10 mg SANDOSTATİN LAR olarak düşürülebilir.
3 aylık tedaviyle semptomları yalnızca kısmen kontrol altına alınabilen hastalarda doz, her
4 haftada bir 30 mg SANDOSTATİN LAR olmak üzere yükseltilebilir.
SANDOSTATİN LAR tedavisi sırasında gastro-entero-pankreatik tümörlere eşlik eden semptomları artabilen hastalarda, SANDOSTATİN LAR tedavisinde önce kullanılmakta olan dozda subkutan SANDOSTATİN kullanılması önerilir. Bu durum daha çok, SANDOSTATİN LAR tedavisinin ilk 2 ayında, oktreotid konsantrasyonları terapötik değerlere ulaşıncaya kadar gözlenebilmektedir.
Orta bağırsaktan kaynaklanan veya primer kaynağı bilinmeyen ancak orta bağırsak dışı bölgelerden kaynaklanan tümörlerin ekarte edilmiş olduğu ilerlemiş nöroendokrin tümörleri olan hastaların tedavisi:
Önerilen SANDOSTATİN LAR dozu, 4 haftada bir uygulanan 30 mg'dır (bkz. Bölüm 5.1). Tümör progresyonu yokken tümör kontrolü için SANDOSTATİN LAR tedavisine devam edilmelidir.
TSH salgılayan adenomların tedavisi:
SANDOSTATİN LAR ile tedaviye, herhangi bir doz ayarlaması düşünülmeden 3 ay süreyle 4 haftalık aralıklarla 20 mg dozunda başlanmalıdır. Doz daha sonra TSH ve tiroid hormonu yanıtına bağlı olarak ayarlanır.
Uygulama şekli:
Doktor tarafından başka şekilde tavsiye edilmediği takdirde;
SANDOSTATİN LAR, yalnızca derin intragluteal (derin intramüsküler) enjeksiyon yoluyla uygulanmalıdır. Arka arkaya yapılacak enjeksiyonlarda sağ ve sol kalçalar sırayla kullanılmalıdır (bkz. Bölüm 6.6).
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek fonksiyonlarının bozuk olması, subkutan SANDOSTATİN tedavisi sırasında oktreotid EAA değerini etkilememiş olduğundan bu gibi hastalarda SANDOSTATİN LAR dozunun değiştirilmesi gerekmez.
Karaciğer yetmezliği:
SANDOSTATİN subkutan ve intravenöz olarak kullanıldığı bir çalışmada eliminasyon kapasitesinin karaciğer sirozu vakalarında azalabildiği, yağlı karaciğer hastalıklarında ise böyle bir azalmanın söz konusu olmadığı gösterilmiştir. Bazı durumlarda karaciğer yetmezliği olan hastalarda doz ayarlaması gerekebilir.
Pediyatrik popülasyon:
SANDOSTATİN LAR'ın çocuklarda kullanılması konusundaki deneyimler sınırlıdır.
Geriyatrik popülasyon:
Yaşı 65 veya daha fazla olan vakalarda subkutan SANDOSTATİN kullanılarak yapılan bir çalışmada herhangi bir doz ayarlanmasına ihtiyaç duyulmamış olduğundan bu hasta grubunda SANDOSTATİN LAR dozunun ayarlanmasına ihtiyaç yoktur.
4.3. Kontrendikasyonlar
Oktreotide veya bileşiminde yer alan (bkz. Bölüm 6.1) herhangi bir yardımcı maddeye karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Genel:
Büyüme hormonu salgılayan hipofiz tümörleri bazen büyüyerek görme alanı kusurları gibi ağır komplikasyonlara neden olabildiğinden, bütün hastaların dikkatle izlenmesi şarttır. Tümörün büyüdüğünü gösteren kanıtlar ortaya çıkarsa, daha başka tedavi yaklaşımlarına başvurulması önerilir.
Akromegalik kadın hastalarda GH düzeylerindeki azalmanın terapötik yararları ve IGF-1 konsantrasyonunun normale dönmesi fertilitenin geri dönmesini sağlayabilmektedir. Çocuk doğurma potansiyeline sahip kadın hastalara oktreotid ile tedavi sırasında gerekirse uygun doğum kontrolü kullanmaları tavsiye edilmelidir.
Oktreotid ile uzun süreli tedavilerde hastalarda tiroid fonksiyonları izlenmelidir. Oktreotid tedavisi esnasında hepatik fonksiyon izlenmelidir.
Kardiyovasküler ilişkili olaylar:
Yaygın bradikardi vakaları bildirilmiştir. Beta-blokörler, kalsiyum kanal blokörleri, veya sıvı elektrolit dengesini kontrol eden ilaçların doz ayarlanması gerekebilir (bkz. Bölüm 4.5).
Safra kesesi ve ilişkili olaylar:
Kolelitiyazis, SANDOSTATİN tedavisi esnasında oldukça yaygın görülen bir olay olup, kolesistit ve safra kanalında dilatasyonla ilişkilendirilebilir (bkz. Bölüm 4.8). Ek olarak, pazarlama sonrası deneyime göre, SANDOSTATİN LAR alan hastalarda kolelityazisin bir komplikasyonu olarak kolanjit vakaları bildirilmiştir. SANDOSTATİN LAR tedavisine başlanmadan önce ve daha sonra da her 6 ayda bir safra kesesinin ultrasonla muayenesi önerilir.
Glukoz metabolizması:
Büyüme hormonu, glukagon ve insülin salgılanmasını inhibe etmesi nedeniyle SANDOSTATİN LAR glukoz kontrolünü etkileyebilir. Öğün sonrası glukoz toleransı bozulabilir. SANDOSTATİN subkutan ile tedavi edilen hastalarda bildirildiği gibi bazı vakalarda, kronik uygulamanın sonucu olarak inatçı hiperglisemi durumu gelişebilir. Hipoglisemi de rapor edilmiştir.
Aynı zamanda Tip I diabetes mellitusu olan hastalarda, SANDOSTATİN LAR muhtemelen glikoz regülasyonu üzerine etki eder ve insülin gereksinimini azaltabilir. Non-diyabetik ve kısmi bozulmamış insülin rezervli Tip II diyabetiklerde SANDOSTATİN Subkutan uygulanması öğün sonrası gliseminin artması ile sonuçlanır. Böylece bu hastalarda glikoz toleransının ve antidiabetik tedavinin izlenmesi önerilir.
İnsulinoması olan hastalarda, GH ve glukagon salgısını inhibe etme gücünün insüline kıyasla daha fazla olması ve insülin üzerindeki inhibitör etkisinin daha kısa sürmesi nedeniyle oktreotid, hipogliseminin süresini ve derinliğini artırabilir. Bu hastalar yakından izlenmelidir.
Beslenme:
Oktreotid, bazı hastalarda diyet ile alınan yağların emilimini değiştirebilir.
Oktreotid tedavisi kullanan bazı hastalarda, azalmış vitamin Bdüzeyleri ve anormal Schilling testleri gözlemlenmiştir. Vitamin Beksikliği hikayesi olan hastalarda SANDOSTATİN LAR ile tedavi süresince vitamin Bseviyelerinin izlenmesi tavsiye edilir.
Pankreas fonksiyonu:
Gastroenteropankreatik nöroendokrin tümörleri için oktreotid tedavisi alan bazı hastalarda pankreas ekzokrin yetmezliği (PEY) gözlenmiştir. PEY semptomları arasında steatore, gevşek dışkı, abdominal şişkinlik ve kilo kaybı sayılabilir. Semptomatik hastalarda PEY için klinik kılavuzlara göre tarama ve uygun tedavi düşünülmelidir.
Sodyum İçeriği:
Bu tıbbi ürün her “dozâ€unda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında
“sodyum içermezâ€.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
SANDOSTATİN LAR, birlikte eşzamanlı olarak kullanıldığında beta blokörler, kalsiyum kanalı blokörleri veya sıvı ve elektrolit dengesini kontrol eden ajanlar gibi tıbbi ürünlerin dozunda ayarlama gerekli olabilir (bkz. Bölüm 4.4).
SANDOSTATİN LAR, birlikte eşzamanlı olarak kullanıldığında insülin ve anti-diyabetik
tıbbi ürünlerin dozunda ayarlamalar gerekli olabilir (bkz. Bölüm 4.4)
Oktreotidin barsaklardaki siklosporin emilimini azalttığı ve simetidin emilimini geciktirdiği bulunmuştur.
Oktreotid ve bromokriptinin birlikte eş zamanlı olarak kullanılması, bromokriptin biyoyararlanımını artırır.
Sınırlı sayıda yayınlanmış literatür somatostatin analoglarının, büyüme hormonunun baskılanması sonucu sitokrom P450 enzim sistemi ile metabolize edildiği bilinen bileşiklerin metabolik klerensini azaltabildiğini göstermektedir. Oktreotid'in bu etkiye sahip olabileceği göz ardı edilemeyeceğinden başlıca CYP3A4 yoluyla metabolize olan diğer ilaçlardan düşük terapötik indekse sahip olanların (kinidin, terfenadin) dikkatli kullanılması gerekir.
Radyoaktif somatostatin analogları ile birlikte eş zamanlı kullanım
Somatostatin ve oktreotid gibi analogları, somatostatin reseptörlerine yarışmalı olarak bağlanır ve radyoaktif somatostatin analoglarının etkililiğine müdahale edebilir. Somatostatin reseptörlerine bağlanan bir radyofarmasötik olan Lutesyum (177 Lu) oksodotreotid uygulamasından en az 4 hafta önce SANDOSTATİN LAR uygulamasından kaçınılmalıdır. Gerekirse hastalar, lutesyum (177Lu) oksodotreotid uygulamasından 24 saat öncesine kadar kısa etkili somatostatin analogları ile tedavi edilebilir.
Lutesyum (177Lu) oksodotreotid uygulamasından sonra, SANDOSTATİN LAR ile tedaviye 4 ila 24 saat içinde devam edilebilir ve bir sonraki lutesyum (177Lu) oksodotreotid uygulamasından 4 hafta önce SANDOSTATİN LAR ile tedavi tekrar kesilmelidir.
Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği:
Böbrek yetmezliği popülasyonu için etkileşim çalışması bulunmamaktadır.
Karaciğer yetmezliği:
Karaciğer yetmezliği popülasyonu için etkileşim çalışması bulunmamaktadır.
Pediyatrik popülasyon:
Pediyatrik popülasyon için etkileşim çalışması bulunmamaktadır.
Geriyatrik popülasyon:
Geriyatrik popülasyon için etkileşim çalışması bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi B'dir.
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)
Oktreotid tedavisi boyunca çocuk doğurma potansiyeli olan kadın hastalar için uygun ve etkili kontrasepsiyon kullanılması tavsiye edilmelidir.
Gebelik dönemi
Gebe kadınlarda oktreotid kullanımında veriler kısıtlıdır (<300 gebelik sonucu) ve vakaların üçte birinde gebelik sonuçları bilinmemektedir. Raporların çoğu pazarlama sonrası oktreotid kullanımından sonra alınmış olup, maruz kalan gebeliklerin %50'sinden fazlası akromegali hastalarında bildirilmiştir. Çoğu kadın oktreotide gebeliğin ilk trimestresi sırasında 100-1200 mikrogram/gün SANDOSTATİN Subkutan veya 10-40 mg/ay SANDOSTATİN LAR arasında değişen dozlarda maruz kalmıştır. Gebelik vakalarının yaklaşık %4'ünde konjenital anomaliler bildirilmiş olup, sonuçları bilinmemektedir. Bu vakalar için oktreotid ile nedensel bir ilişkiden şüphe edilmemektedir.
Hayvan çalışmaları üreme toksisitesi açısından doğrudan veya dolaylı zararlı etkiler
göstermemektedir (bkz. Bölüm 5.3).
Bir önlem olarak gebelik sırasında SANDOSTATİN LAR kullanımından kaçınılması
tercih edilir (bkz. Bölüm 4.4).
Laktasyon dönemi
Oktreotidinin insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar, oktreotidinin sütle atıldığını göstermektedir. SANDOSTATİN LAR tedavisi sırasında emzirme yapılmamalıdır.
Üreme yeteneği / Fertilite:
Oktreotidin insan fertilitesi üzerinde bir etkiye sahip olup olmadığı bilinmemektedir. Gebelik ve laktasyon sırasında tedavi edilen dişilerin erkek yavrularında testislerin geç indiği tespit edilmiştir. Bununla birlikte oktreotid günde 1 mg/kg vücut ağırlığına kadar olan dozlarda erkek ve dişi sıçanlarda fertiliteyi bozmamıştır (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
SANDOSTATİN LAR'ın araç ve makine kullanma becerisi üzerinde etkisi yoktur veya ihmal edilebilir düzeyde etkiye sahiptir. Hastalara SANDOSTATİN LAR ile tedavi sırasında baş dönmesi, bitkinlik/yorgunluk veya baş ağrısı yaşamaları durumunda araç veya makine kullanırken dikkatli olmaları tavsiye edilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Oktreotid tedavisi boyunca rapor edilen en sık yan etkiler gastrointestinal hastalıklar, sinir sistemi hastalıkları, hepato-bilier hastalıklar ve metabolizma ve beslenme hastalıkları içermektedir.
Oktreotid uygulamaları ile klinik uygulamada rapor edilen çok yaygın yan etkiler diyare, karın ağrısı, bulantı, baş ağrısı, barsakta aşırı gaz, safra kesesi taşı, hiperglisemi ve kabızlık. Diğer yaygın rapor edilen yan etkiler baş dönmesi, lokal enjeksiyon bölgesi ağrısı, safra çamuru, tiroid disfonksiyonu (tiroid stimule eden hormonun (TSH), Total T4 ve serbest T4'ün azalması vs), gevşek dışkı, glukoz toleransının bozulması, asteni, kusma ve hipoglisemidir.
Aşağıdaki yan etkiler, oktreotidle yapılan klinik çalışmalardan toplanmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek ≥.1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her sıklık grubu içinde advers reaksiyonlar azalan ciddiyet sırasıyla dizilmiştir.
Endokrin hastalıkları
Yaygın: Hipotiroidizm, tiroid bozukluğu (tiroid stimule eden hormonun (TSH), Total T4 ve serbest T4'ün azalması gibi)
Metabolizma ve beslenme hastalıkları
Çok yaygın: Hiperglisemi
Yaygın: Hipoglisemi, glukoz tolerans bozukluğu, anoreksia Yaygın olmayan: Dehidratasyon
Sinir sistemi hastalıkları Çok yaygın: Baş ağrısı Yaygın: Baş dönmesi Kardiyak hastalıkları Yaygın: Bradikardi
Yaygın olmayan: Taşikardi
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Yaygın: Dispne
Gastrointestinal hastalıkları
Çok yaygın: Diyare, karın ağrısı, bulantı, kabızlık, flatulans
Yaygın: Dispepsi, kusma, karında şişkinlik, steatore, dışkı kıvamında azalma, feçeste renk değişikliği
Hepato-bilier hastalıkları
Çok yaygın: Kolelitiyazis
Yaygın: Kolesistit, safra çamuru, hiperbilirubinemi
Deri ve deri altı doku hastalıkları
Yaygın: Kaşıntı, döküntü, alopesi
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Çok yaygın: Enjeksiyon bölgesi reaksiyonları Yaygın: Asteni
Araştırmalar
Yaygın: Transaminaz seviyelerinde artış Pazarlama sonrası deneyim:
Spontan oluşmuş yan etkiler gönüllü olarak rapor edilmiştir, sıklık veya ilaç etkileşimi ile ilişkisini güvenle yayınlamak her zaman mümkün değildir.
Kan ve lenf sistemi hastalıkları
Trombositopeni
Bağışıklık sistemi hastalıkları
Anafilaksi, alerji/aşırı hassasiyet reaksiyonları
Kardiyak hastalıkları
Aritmi
Hepato-bilier hastalıkları
Akut pankreatit, kolestazın eşlik etmediği akut hepatit, kolestatik hepatit, kolestaz, sarılık, kolestatik sarılık.
Deri ve deri altı doku hastalıkları
Ürtiker
Araştırmalar
Alkalin fosfataz seviyesinde artış, gama glutamil transferaz seviyesinde artış. Seçili advers reaksiyonların tanımı
Safra kesesi ve ilişkili reaksiyonlar
Somatostatin analoglarının safra kesesinin kontraktilitesini inhibe edip safra salgısını azalttığı ve bu durumun safra kesesinde anormalliklere veya çamura neden olabileceği kanıtlanmıştır. Uzun süreli S.C. SANDOSTATİN kullanıcılarının %15-30'unda safra kesesi taşı oluştuğu bildirilmiştir. Genel popülasyondaki (40-60 yaş arası) insidans yaklaşık %5-20'dir. Akromegali veya gastro-entero pankreatik tümörleri olan hastalarda uzun süreli SANDOSTATİN LAR maruziyeti, SANDOSTATİN LAR tedavisinin S.C. tedaviye kıyasla safra kesesi taşı oluşma insidansını artırmadığını göstermektedir. Safra kesesi taşları oluşursa bunlar genellikle asemptomatik olmaktadır; semptomatik taşlar safra asitleriyle eritme tedavisi uygulanarak veya cerrahiyle tedavi edilmelidir.
Gastrointestinal hastalıklar
Nadir durumlarda, gastrointestinal yan etkiler, progresif karın şişliği, şiddetli epigastrik ağrı, abdominal hassasiyet ve sakınmanın eşlik ettiği akut bağırsak tıkanıklığını andırabilir.
Gastrointestinal advers olayların sıklığının kesintisiz tedavi ile zaman içerisinde azaldığı
bilinmektedir.
Aşırı duyarlılık reaksiyonları ve anafilaktik reaksiyonlar
Pazarlama sonrasında aşırı duyarlılık reaksiyonları ve alerjik reaksiyonlar bildirilmiştir. Bu reaksiyonlar meydana geldiği zaman çoğunlukla deriyi, nadiren ağzı ve solunum yollarını etkilemektedir. İzole anafilaktik şok vakaları bildirilmiştir.
Enjeksiyon bölgesi reaksiyonları
Ağrı, kızarıklık, hemoraji, kaşıntı, şişlik veya endürasyon dahil enjeksiyon bölgesi ile ilişkili reaksiyonlar SANDOSTATİN LAR kullanan hastalarda yaygın olarak bildirilmiştir; bununla birlikte, bu olaylar vakaların çoğunda hiçbir klinik girişim gerektirmemiştir.
Metabolizma ve beslenme hastalıkları
Ölçülen fekal yağ atılımı artabilse de, bugüne kadar oktreotid ile uzun vadeli tedavinin malabsorpsiyon nedeniyle nütrisyonel eksikliğe yol açtığına dair bir kanıta rastlanmamıştır.
Pankreatik enzimler
Çok nadir durumlarda, SANDOSTATİN S.C. tedavisinin ilk birkaç saati veya günü içinde akut pankreatit bildirilmiş ve ilacın kesilmesi ile düzelmiştir. Ayrıca, uzun vadeli SANDOSTATİN S.C. tedavisi gören hastalar için kolelityaz ile indüklenen pankreatit bildirilmiştir.
Kardiyak hastalıklar
Bradikardi, somatostatin analogları kullanımı esnasında yaygın görülen bir advers reaksiyondur. Hem akromegali hem de karsinoid sendrom hastalarında, QT uzaması, eksen kaymaları, erken repolarizasyon, düşük voltaj, R/S geçiş, erken R dalgası progresyonu ve spesifik olmayan ST-T dalgası değişiklikleri gibi EKG değişiklikleri gözlenmiştir. Bu olayların oktreotid asetat ile ilişkisi, bu hastaların çoğu altta yatan kardiyak hastalıklara sahip olduğundan belirlenmemiştir (bkz. Bölüm 4.4).
Trombositopeni
Trombositopeni pazarlama sonrası deneyimde karaciğer sirozu olan hastalarda özellikle SANDOSTATİN (İ.V.) tedavisi esnasında ve SANDOSTATİN LAR tedavisi esnasında bildirilmiştir. Tedavi bırakıldıktan sonra düzelmektedir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35
99)
4.9. Doz aşımı ve tedavisi
Sınırlı sayıda SANDOSTATİN LAR'ın kazara alınan aşırı dozları rapor edilmiştir. Dozlar ayda 100 mg ila 163 mg SANDOSTATİN LAR arasında değişmektedir. Rapor edilen tek yan etki sıcak basmasıdır.
Kanser hastalarının ayda 60 mg ve 2 haftada 90 mg'a kadar kullandığı SANDOSTATİN LAR dozları bildirilmiştir. Genelde dozlar iyi tolare edildiyse de aşağıdaki yan etkiler rapor edilmiştir: sık idrara çıkma, yorgunluk, depresyon, anksiyete, konsantrasyon eksikliği.
Doz aşımında semptomatik tedavi uygulanmalıdır.
Adım
Bu aşamada hastayı enjeksiyon için hazırlayın.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Somatostatin ve analogları ATC kodu: H01CB02.Oktreotid, doğal somatostatinin, benzer farmakolojik etkilere sahip olan, ancak etki süresi çok daha uzun, sentetik bir oktapeptit türevidir. Patolojik olarak artmış bulunan GH ve gastro-entero-pankreatik (GEP) endokrin sistemdeki serotonin ve peptit salgılanmasını inhibe eder.
Hayvanlarda, oktreotid, somatostatine göre daha güçlü bir GH, glukagon ve insülin salımı inhibitörüdür ve GH ve glukagon supresyonu açısından daha yüksek bir seçiciliğe sahiptir.
Sağlıklı insanlarda oktreotidin, aynen somatostatin gibi aşağıdaki inhibitör etkilere sahip olduğu gösterilmiştir:
arjinin, efor ve insüline bağlı hipoglisemi etkisiyle uyarılan büyüme hormonu salgılanmasını
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim:
Bir tek intramüsküler SANDOSTATİN LAR enjeksiyonundan sonra serum oktreotid konsantrasyonu, sonraki 1 saat içinde geçici olarak maksimal değerlere yükselir ve bunu, oktreotid düzeylerinin 24 saat içerisinde ölçülemeyen değerlere indiği bir dönem izler. Birinci gündeki bu maksimal düzeyden sonraki 7 gün boyunca hemen bütün hastalardaki oktreotid düzeyleri subterapötik değerlerde kalır ve daha sonra tekrar yükselerek 14. gün dolayında bir plato çizmeye başlar ve sonraki 3-4 hafta boyunca nispeten sabit kalır. 1. gün elde edilen maksimal düzey, plato fazındakinden daha düşüktür ve ilk gün total dozun en çok %0,5'i salıverilir. Yaklaşık 42. günden sonra oktreotid konsantrasyonları yavaş
yavaş azalır ve bu, dozaj formundaki polimer matriksin terminal parçalanma fazına eşlik
eder.
Akromegali vakalarında 10, 20 ve 30 miligramlık tek doz SANDOSTATİN LAR uygulamalarından sonraki ortalama oktreotid plato düzeyleri, sırasıyla litrede 358, 926 ve 1710 nanogram olarak ölçülmüştür. 4 hafta arayla yapılan 3 enjeksiyondan sonra elde edilen kararlı serum düzeyleri, bu değerlerden yaklaşık 1,6-1,8 kat daha yüksek olup 20 ve 30 miligramlık çoklu SANDOSTATİN LAR enjeksiyonlarından sonra litrede sırasıyla 1557 ve 2384 nanogram olarak ölçülmüştür.
Karsinoid tümör vakalarında 4 hafta arayla uygulanan 10, 20 ve 30 miligramlık çoklu SANDOSTATİN LAR enjeksiyonlarından sonra serumdaki ortalama (ve medyan) kararlı oktreotid düzeyleri de yine doz arttıkça yükselmiş ve sırasıyla litrede 1231 (894), 2620 (2270) ve 3928 (3010) nanogram bulunmuştur.
Dağılım:
28 aya kadar SANDOSTATİN LAR enjeksiyonunu kapsayan bir süre boyunca ortaya çıkan örtüşen serbest bırakma profillerine dayanarak, beklenenin üzerinde bir oktreotid birikimi meydana gelmemiştir.
SANDOSTATİN LAR enjeksiyonunu izleyen farmakokinetik oktreotid profili, polimer matriksten gerçekleşen salıverilmeyi ve bu matriksin biyodegradasyonunu yanısıtır. Sistemik dolaşıma salıverildiğinde, oktreotid, subkutan uygulama için tarif edilen, bilinen farmakokinetik özelliklerine göre dağılır. Oktreotidin kararlı durumda dağılım hacmi 0.27 L/kg ve toplam vücut klirensi 160 mL/dakika'dır. Plazma protein bağlama oranı %65'tir ve kan hücrelerine neredeyse hiç ilaç bağlanmaz.
7-17 yaş arası, ayda bir SANDOSTATİN LAR 40 mg almakta olan, hipotalamik obeziteli pediatrik hastalardan alınan sınırlı kan örnekleriyle elde edilen farmakokinetik veriler, ilk enjeksiyondan sonra 1,395 ng/L ve kararlı durumda 2,973 ng/L düzeyinde ortalama oktreotid çukur plazma konsatrasyonları gözlendiğini göstermektedir. Gönüllüler arasında yüksek bir değişkenlik gözlenmektedir.
Kararlı durumdaki çukur oktreotid konsantrasyonlarının yaş ve VKİ (Vücut kitle indeksi) ile korelasyon göstermediği ancak vücut ağırlığıyla (52,3 – 133 kg) orta dereceli bir korelasyon gösterdiği belirlenmiş olup, erkek ve kadın hastalar arasında anlamlı derecede farklı olduğu, yani kadın hastalarda yaklaşık %17 oranında daha yüksek olduğu görülmüştür.
Biyotransformasyon:
Biyotransformasyon ile ilgili ek bir veri yoktur.
Eliminasyon:
Total vücut klerensi 160 ml/dakikadır. Doğrusallık/Doğrusal Olmayan Durum:
28 aya kadar uzayabilen süreler boyunca 4 haftada bir yapılan SANDOSTATİN LAR uygulamalarından sonra vücutta oktreotid, salıverme profillerinin üstüste gelmesiyle beklenenden daha fazla birikmemiştir.
Hastalardaki karakteristik özellikler
Bu bölüme ait bilgi bulunmamaktadır.
5.3. Klinik öncesi güvenlilik verileri
Hayvanlarda yürütülen akut ve tekrarlanan doz toksikolojisi, genotoksisite, karsinojenisite ve üreme toksikolojisi çalışmaları insanlar için spesifik güvenlilik problemi ortaya koymamıştır.
Hayvanlarda yürütülen üreme çalışmaları 1 mg/kg/güne varan parental dozlarda oktreotide bağlı teratojenik, embriyo/fötal veya diğer üreme etkilerine dair bir kanıt ortaya koymamıştır. Sıçan yavrularında aşırı farmakodinamik aktivitenin neden olduğu GH inhibisyonuna bağlı ve geçici özellikte bir miktar fiziksel büyüme geriliği not edilmiştir (bkz. Bölüm 4.6).
Jüvenil sıçanlarda spesifik çalışmalar yürütülmemiştir. Pre- ve post-natal gelişim çalışmalarında, tüm gebelik ve laktasyon periyodu boyunca oktreotid verilen dişilerin F1 döllerinde azalmış büyüme ve olgunlaşma gözlenmiştir. Erkek F1 döller için geç testis inmesi gözlenmekle birlikte etkilenmiş F1 erkek yavruların fertilitesi normal kalmıştır. Bu nedenle yukarıda bahsedilen gözlemler geçici olup, GH inhibisyonundan kaynaklandıkları düşünülmektedir.
Adım
Doyurma aşamasından sonra, pistonu sonuna kadar enjektöre doğru bastırdığınızdan emin olun.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Toz (Flakon):
Poli (DL-laktit-ko-glikolit) Steril mannitol
Çözücü içeren şırınga (parenteral kullanım):
Sodium karboksimetil selüloz Mannitol
Poloksamer 188 Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimlilik çalışmaları bulunmadığından, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
36 ay
Sulandırıldıktan sonra saklanmamalıdır, derhal kullanılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
2ï‚°-8ï‚° C arasında buzdolabında saklayınız. Dondurmayınız. Işıktan korumak için flakonu kutunun içinde saklayınız.
SANDOSTATİN LAR, enjeksiyon günü 25°C'nin altındaki oda sıcaklığında kalabilir. Ancak süspansiyon intramüsküler enjeksiyondan hemen önce hazırlanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Mikroküreler floroelastomer kaplı bir lastik tıpası olan, 6 ml'lik, koyu mavi renkli alüminyum bir geçme kapak ile yalıtılarak kapatılmış bir cam flakon içindedir.
Taşıyıcı çözelti iki lastik tıpa ile kapatılmış olan (bir ön ve bir piston tıpası) kullanıma hazır dolu bir cam enjektör içinde paketlenmiştir.
Flakon adaptörü.
Bir güvenlik enjeksiyon iğnesi [40 mm (1,5 inç), 19 gauge].
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
İLACIN UYGULANMASI İLE İLGİLİ BİLGİLER
Ürünün uygulanması ile ilgili daha detaylı bilgi için Bölüm 4.2'ye bakınız. SANDOSTATİN LAR İ.M. kullanma talimatı
YALNIZCA DERİN İNTRAMÜSKÜLER ENJEKSİYON İÇİNDİR.
İçerik
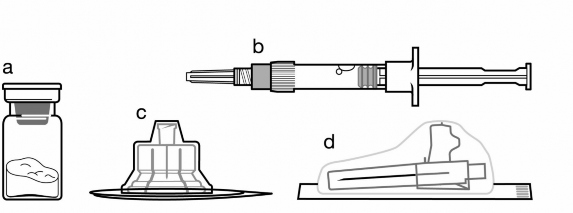
a | SANDOSTATİN LAR toz içeren bir flakon |
b | Bitmiş ürünü süspansiyon haline getirmek için taşıyıcı çözeltisini içeren bir kullanıma hazır dolu enjektör (2 ml) |
c | Bitmiş ürünü süspansiyon haline getirmek hazırlamak için bir flakon adaptörü |
d | Bir adet 19G x 1,5†güvenlik enjeksiyon iğnesi |
Derin intragluteal (intramüsküler) enjeksiyondan önce SANDOSTATİN LAR'ın uygun
biçimde hazırlanmasını sağlamak için aşağıdaki talimatları dikkatle izleyiniz.
SANDOSTATİN LAR'ın sulandırılarak hazırlanmasında 3 kritik adım bulunmaktadır.
Bunların takip edilmemesi ilacın uygun şekilde uygulanamamasına yol açabilir.
Enjeksiyon kiti oda sıcaklığına gelmelidir. Enjeksiyon kitini buzdolabından çıkarın ve sulandırarak hazırlamadan önce en az 30 dakika oda sıcaklığında bekletiniz; fakat 24 saati geçirmeyiniz.
Adım
Enjeksiyon bölgesini alkollü bir bezle temizleyin.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A06962 |
| Satış Fiyatı | 4346.46 TL [ 7 Apr 2025 ] |
| Önceki Satış Fiyatı | 4346.46 TL [ 24 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504770018 |
| Etkin Madde | Oktreotid |
| ATC Kodu | H01CB02 |
| Birim Miktar | 10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Endokrin Sistem > GONADOTROP SERBESTLEYİCİ HORMON > Oktreotid |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |