SARCLISA 100 mg / 5 ml infüzyonluk çözelti hazırlamak için konsantre Farmakolojik Özellikler
{ Isatuksimab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar ATC kodu: L01FC02
Etki mekanizması
İsatuksimab, CD38 reseptörünün spesifik bir hücre dışı epitopuna bağlanan bir IgG1 türevi monoklonal antikordur. CD38, multipl miyelom hücreleri üzerinde yüksek düzeyde eksprese edilen bir transmembran glikoproteindir.
In vitro ortamda isatuximab; antikor bağımlı hücre aracılı sitotoksisite (ADCC), antikor bağımlı hücresel fagositoz (ADCP) ve kompleman bağımlı sitotoksisite (CDC) dahil olmak üzere IgG Fc-bağımlı mekanizmalar yoluyla etki göstermektedir. İsatuksimab ayrıca Fc bağımsız bir mekanizma yoluyla apoptoz indüksiyonuyla da tümör hücrelerinin ölümünü tetikleyebilmektedir.
In vitro ortamda, isatuximab kalsiyum mobilize edici bir ajan olan siklik ADP-ribozun (cADPR) sentezi ve hidrolizini katalize eden CD38'in enzimatik aktivitesini bloke etmektedir. İsatuksimab multipl miyelom hücrelerinde hücre dışı nikotinamid adenin dinükleotidden (NAD) cADPR üretimini inhibisyona uğratmaktadır.
In vitro ortamda, isatuximab CD38 pozitif hedef tümör hücrelerinin yokluğunda NK hücreleri aktive edebilmektedir.
In vivo ortamda, isatuximab monoterapisiyle tedavi edilen hastaların periferik kanında toplam CD16 ve CD56 NK hücreleri, CD19 B hücreleri, CD4 T hücreleri ve T(CD3, CD4, CD25, CD127) mutlak sayımında bir düşüş gözlemlenmiştir.
Multipl miyelom hastalarında, SARCLISA monoterapisi T hücre reseptör repertuvarında klonal genişleme indüklemiştir; bu da adaptif bir immün yanıtı olduğuna işaret etmektedir.
In vitro ortamda isatuximab ve pomalidomid kombinasyonu, tek başına isatuximabla karşılaştırıldığında efektör hücreler (ADCC) tarafından veya doğrudan tümör hücrelerini öldürerek CD38 eksprese eden multipl miyelom hücrelerinin hücre lizisini arttırmaktadır. Farelerde insan multipl miyelom ksenogreft modeli kullanılan in vivo hayvan deneylerinde, isatuximab ve pomalidomid kombinasyonunun tek başına isatuximab veya pomalidomidle karşılaştırıldığında anti-tümör aktivitede artışla sonuçlandığını göstermiştir.
Klinik etkililik ve güvenlilik ICARIA-MM (EFC 14335)
SARCLISA'nın pomalidomid ve düşük doz deksametazonla birlikte etkililiği ve güvenliliği, relaps ve refrakter multipl miyelom hastalarında yapılan çok merkezli, çok uluslu, randomize, açık etiketli, 2 kollu bir Faz 3 çalışması olan ICARIA-MM (EFC14335) çalışmasında incelenmiştir. Hastalar daha önce lenalidomid ve bir proteazom inhibitörü dahil olmak üzere en az iki tedavi görmüş ve önceki tedavi sırasında veya tedavinin sona ermesinden sonraki 60 gün içinde hastalık progresyonu göstermiştir. Primer refrakter hastalığı olan hastalar çalışmaya dahil edilmemiştir.
Toplam 307 hasta 1:1 oranında pomalidomid ve düşük deksametazonla kombinasyon halinde SARCLISA (isatuximab rejimi, 154 hasta) veya pomalidomid ve düşük doz deksametazon (kontrol rejimi, 153 hasta) tedavisine randomize edilmiştir. Tedavi iki grupta da 28 günlük sikluslarda, hastalık ilerlemesi veya kabul edilemez toksisite meydana gelene kadar uygulanmıştır. SARCLISA 10 mg/kg, ilk siklusta haftada bir ve sonraki sikluslarda her iki haftada bir IV infüzyon olarak uygulanmıştır.
Pomalidomid 4 mg, her 28 günlük siklusun 1. gününden 21. gününe kadar günde bir kez oral yoldan alınmıştır. 28 günlük siklusun 1., 8., 15. ve 22. günlerinde düşük doz deksametazon (oral/intravenöz) 40 mg (75 yaş ve üzerindeki hastalarda 20 mg) verilmiştir.
Genel olarak, başlangıçta demografik ve hastalık karakteristikleri iki tedavi grubu arasında benzerdir ve bazı minör dengesizlikler bulunmaktadır. Medyan hasta yaşı 67'dir (aralık 36-86) ve hastaların %19,9'u 75 yaş ve üzerindedir. ECOG PS isatuximab kolundaki hastaların
%35,7'sinde ve kontrol kolundaki hastaların %45,1'inde 0; isatuximab kolundaki hastaların
%53,9'u ve kontrol kolundaki hastaların %44,4'ünde 1; isatuximab kolundaki hastaların
%10,4'ü ve kontrol kolundaki hastaların %10,5'inde 2'dir. İsatuximab kolundaki hastaların
%10,4'üne karşı kontrol kolundaki hastaların %10,5'i çalışmaya KOAH veya astım öyküsüyle girmiştir ve isatuximab ve kontrol kolunda hastaların sırasıyla %38,6'sı ve %33,3'ü böbrek yetmezliği (kreatinin klirensi <60 mL/dk./1,73 m) vardır. Çalışmanın başındaki Uluslararası Evreleme Sistemi (ISS) evresi hastaların %37,5'inde I (isatuximab kolunda %41,6, kontrol kolunda %33,3), %35,5'inde II (isatuximab kolunda %34,4, kontrol kolunda %36,6) ve
kolunda %9,1, kontrol kolunda %15,0), %8,5'inde (isatuximab kolunda %7,8, kontrol kolunda
%9,2) ve %1,6'sında (isatuximab kolunda %0,6, kontrol kolunda %2,6) sırasıyla del(17p), t(4;14) ve t(14;16) bulunmaktadır.
Geçmişteki medyan tedavi basamağı sayısı 3'tür (aralık 2-11). Tüm hastalar geçmişte bir proteazom inhibitörü almıştır, tüm hastalar geçmişte lenalidomid almıştır ve hastaların
%56,4'ü geçmişte kök hücre nakli almıştır. Hastaların büyük bölümü (%92,5) lenalidomide,
%75,9'u bir proteazom inhibitöründe, %72,6'sı hem bir immünomodülatöre ve bir proteazom inhibitörüne ve refrakterdir ve hastaların %59'u son tedavi basamağı olarak lenalidomide refrakterdir.
Medyan tedavi süresi isatuximab rejimi grubunda 41 haftaya kıyasla kontrol rejim grubunda 24 haftadır.
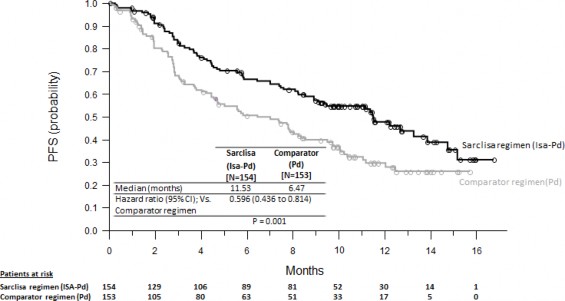
ICARIA-MM çalışmasındaki primer etkililik sonlanım noktaları progresyonsuz sağkalımdır (PFS). PFS'deki iyileşme isatuximab rejimiyle tedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde %40,4 düşüş temsil etmektedir.
Etkililik sonuçları Tablo 5'te sunulmaktadır ve PFS ve Genel Sağkalım için Kaplan-Meier eğrileri Şekil 1 ve 2'de verilmiştir:
Tablo 5: Multipl miyelom tedavisinde pomalidomid ve düşük doz deksametazonla kombinasyon halinde SARCLISA'ya karşı pomalidomid ve düşük doz deksametazonun etkililiği (tedavi amaçlı analiz)
Bitiş noktası | SARCLISA + pomalidomid + düşük doz deksametazon N = 154 | Pomalidomid + düşük doz deksametazon N = 153 |
Progresyonsuz sağkalım |
|
|
Medyan (ay) | 11,53 | 6,47 |
[%95 GA] | [8,936-13,897] | [4,468-8,279] |
Tehlike oranı [%95 GA] | 0,596 [0,436-0,814] | |
p değeri (tabakalaştırılmış log- sıra testi) | 0,0010 | |
Toplam Yanıt Oranı | 93 (60,4) | 54 (35,3) |
Yanıt verenler | [0,5220-0,6817] | [0,2775-0,4342] |
(sCR+CR+VGPR+PR) n(%) |
|
|
[%95 GA] |
|
|
Olasılık oranı vs. kontrol [%95 tam GA] | 2,795 [1,715-4,562] | |
p değeri (tabakalaştırılmış Cochran-Mantel-Haenszel) | <0,0001 | |
Katı Tam Yanıt (sCR) + Tam Yanıt (CR) n(%) | 7 (4,5) | 3 (2,0) |
Çok İyi Kısmi Yanıt (VGPR) n(%) | 42 (27,3) | 10 (6,5) |
Kısmi Yanıt (PR) n(%) | 44 (28,6) | 41 (26,8) |
VGPR veya daha iyi n(%) | 49 (31,8) | 13 (8,5) |
[%95GA] | [0,2455-0,3980] | [0,0460-0,1409] |
Tehlike oranı vs. kontrol [%95 | 3k0YnUyZW56 | |
Bitiş noktası | SARCLISA + pomalidomid + düşük doz deksametazon N = 154 | Pomalidomid + düşük doz deksametazon N = 153 |
tam GA] |
| |
p değeri (tabakalaştırılmış Cochran-Mantel-Haenszel) | <0,0001 | |
Yanıt Süresi Medyan ay [%95 GA] |
13,27 [10,612-NR] |
11,07 [8,542-NR] |
NR = Ulaşılmamıştır.
Yüksek riskli sitogenetiğe sahip hastalarda (merkezi laboratuvar değerlendirmesi), medyan PFS isatuximab rejimi kolunda 7,49 (%95 GA: 2,628 ile NC), kontrol rejim grubunda 3,745'tir (%95 GA: 2,793 ile 7,885) (HR=0,655; %95 GA: 0,334 ile 1,283). 75 yaş ve
üzerindeki hastalarda da isatuximab rejimi grubunda PFS iyileşmeleri görülmüştür (HR=0,479; %95 GA: 0,242 ile 0,946) ve geçmişte lenalidomid (HR=0,593; %95 GA: 0,431
ile 0,816) veya proteazom inhibitörü (HR=0,578; %95 GA: 0,405 ile 0,824) tedavisine refrakter hastalarda ve çalışma girişinden önce son basamakta lenalidomide refrakter (HR= 0,601; %95 GA: 0,436 ile 0,828) hastalarda çalışma girişindeki ISS evresi III (HR=0,635;
%95 GA: 0,363 ile 1,110), başlangıç kreatinin klirensi <60 ml/dk./1,73 m (HR=0,502; %95
GA: 0,297 ile 0,847), geçmişte >3 basamak tedavi (HR=0,590; %95 GA: 0,356 ile 0,977) vardır.
Daha önce daratumumabla tedavi edilen hastalarda (isatuximab kolunda 1 hasta, kontrol kolunda 0 hasta) isatuximab rejiminin etkililiğiyle ilgili bir sonuca varmak için yeterli veri bulunmamaktadır.
Yanıt veren hastalarda ilk yanıta kadar geçen medyan süre isatuximab grubunda 35 güne karşı kontrol grubunda 58 gündür. Medyan izlem süresi isatuximab grubunda 11,56 ay ve kontrol grubunda 11,73 aydır, medyan toplam sağkalıma iki tedavi grubunda da ulaşılmamıştır. Genel sağkalım için tehlike oranı 0,687'dir (%95 GA: 0,461-1,023, p değeri=0,0631).
Şekil 1: PFS için Kaplan-Meier Eğrileri - ITT Popülasyonu - ICARIA-MM (IRC değerlendirmesine göre)
Şekil 2: Genel Sağkalım için Kaplan-Meier Eğrileri - ITT Popülasyonu - ICARIA-MM
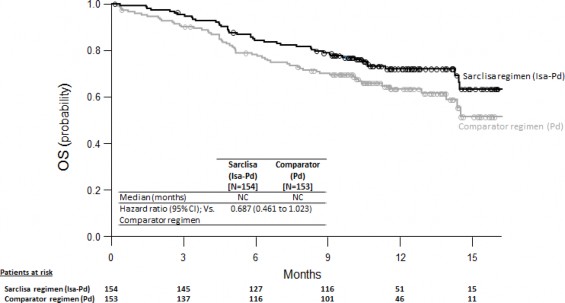
Veri sona erme tarihi = 11 Ekim 2018
ICARIA-MM (EFC14335) çalışmasında, isatuximab infüzyonu için ağırlığa dayalı bir hacim kullanılmıştır. Bölüm 4.2'de açıklanan sabit hacim infüzyonu, TCD14079 çalışmasının B
Kısmında değerlendirilmiştir ve farmakokinetik simülasyonlar hasta ağırlığına göre hacim ve
250 mL sabit hacim uygulanan enjeksiyondan sonra farmakokinetikler arasında minimal fark olduğunu teyit etmiştir (bkz. Bölüm 5.2). TCD114079 çalışmasının B kısmında, ICARIA- MM çalışmasıyla karşılaştırıldığında etkililikte hiçbir yeni güvenlilik sinyali veya etkililik farkı yoktur.
Pediyatrik popülasyon
Avrupa İlaç Ajansı (EMA) hematopoetik ve lenfoid dokulardaki malignite neoplazmların tedavisinde pediyatrik popülasyonun bir veya daha fazla alt grubunda SARCLISA ile yapılan çalışmaların sonuçlarının sunulması gerekliliğini ertelemiştir. Pediyatrik kullanımla ilgili bilgi için bkz. Bölüm 4.2.
5.2. Farmakokinetik özellikler
Genel özelliklerİsatuksimabın farmakokinetiği, tek ajan olarak veya pomalidomid ve deksametazonla kombinasyon halinde intravenöz isatuximab infüzyonuyla tedavi edilen 476 multipl miyelom hastasında, haftada bir kez, 2 haftada bir veya 8 hafta boyunca 2 haftada bir ve ardından 4 haftada bir veya 4 hafta boyunca haftada bir ve ardından 2 haftada bir olmak üzere 1 ila 20 mg/kg doz aralığında değerlendirilmiştir.
İsatuksimab maruziyeti (doz aralığında plazma konsantrasyonu-zaman eğrisi altındaki alan EAA) her 2 haftada bir programı takiben 1 mg/kg'dan 20 mg/kg'a dozla orantılı bir şekilde daha hızla artmaktayken, 4 hafta boyunca haftada bir ve ardından 2 haftada bir programı takiben 5 ve 20 mg/kg arasında doza orantılılığa sapma gözlemlenmemiştir. Bunun nedeni, 5 mg/kg'ın altındaki dozlarda doğrusal olmayan hedef aracılı klirensin toplam klirense yüksek katkısıdır ve bu katkı daha yüksek dozlarda ihmal edilebilir düzeye düşmektedir. 4 hafta boyunca haftada bir ve ardından 2 haftada bir isatuximab 10 mg/kg uygulamasından sonra, kararlı duruma ulaşana kadar geçen medyan süre 8 haftadır ve 3,1 kat birikim olmaktadır. Kararlı durumdaki ortalama (%CV) öngörülen maksimum plazma konsantrasyonu Cve EAA sırasıyla 351 mcg/mL (%36,0) ve 72.600 mcg.saat/mL'dir (%51,7). İsatuksimab infüzyonu için ağırlık bazlı bir hacim uygulama yönteminden sabit hacim infüzyonu yöntemine yapılan değişiklik, t'ta değişiklikle sonuçlanmıştır ve bu değişiklik maruziyet farmakokinetikleri üzerinde sınırlı etki göstermiştir; medyan ağırlığa (76 kg) sahip bir hasta için simülasyonu yapılan kararlı durum C(283 mcg/mL'ye 284 mcg/mL) ve 4 haftalık C(119 mcg/mL'ye 119 mcg/mL) benzerdir. Diğer hasta ağırlığı grupları için, Cve Cbenzerdir.
İsatuksimab ve pomalidomidin farmakokinetiği birlikte uygulamadan etkilenmemiştir. Emilim:
SARCLISA intravenöz olarak uygulandığı için bu bölüm geçerli değildir.
Dağılım:
İsatuksimabın tahmini toplam dağılım hacmi 8,75 L'dir.
Biyotransformasyon:
Büyük bir protein olan isatuximabın, doymayan proteolitik katabolizma prosesleriyle metabolize edilmesi beklenmektedir.
Eliminasyon:
olmayan lineer yolak. Terapötik plazma konsantrasyonları aralığında, lineer yolak baskındır ve zaman içinde %50 oranında azalarak 9,55 mL/h (0,229 L/gün) kararlı durum değerine düşmektedir. Bu değer 28 günlük bir terminal yarı ömürle ilişkilendirilmiştir.
Doğrusallık/doğrusal olmayan durum:
İsatuksimab, CD38 reseptörlerine bağlandığı için hedef aracılı ilaç eğilimiyle birlikte doğrusal olmayan farmakokinetik sergilemektedir. İsatuximab EAA'sı 2 haftada bir, 1 mg/kg ila 20 mg/kg doz aralığında (onaylanan önerilen dozun 0,1 ila 2 katı) doza orantılıdan daha fazla artmaktadır. İsatuksimab EAA'sı 4 hafta boyunca haftada bir ve ardından 2 haftada bir 5 mg/kg ila 20 mg/kg doz aralığında (onaylanan önerilen dozun 0,5 ila 2 katı) orantılı olarak artmaktadır.
Hastalardaki karakteristik özellikler
Yaş:
36 ila 85 yaşındaki 476 hastada yapılan popülasyon FK analizlerinde, <75 yaşındaki (n=406) ve ≥75 yaşındaki (n=70) hastalarda isatuximaba benzer maruziyet görülmüştür.
Cinsiyet:
207 kadın (%43,5) ve 269 erkek (%56,5) hastayla yapılan popülasyon farmakokinetik analizinde cinsiyetin isatuximabın farmakokinetiği üzerinde klinik açıdan anlamlı bir etkisi görülmemiştir.
Irk:
377 Beyaz (%79), 25 Asyalı (%5), 18 Siyah (%4) ve 33 diğer ırk (%7) hastayla yapılan popülasyon farmakokinetiği analizinde, ırkın isatuximabın farmakokinetiği üzerinde klinik açıdan anlamlı hiçbir etkisi görülmemiştir.
Ağırlık:
Kararlı durumdaki isatuximab maruziyeti (EAA) artan vücut ağırlığıyla azalmıştır.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda isatuximabla herhangi bir resmi çalışma yapılmamıştır. Popülasyon farmakokinetik analizindeki 476 hastadan 65'inde hafif karaciğer yetmezliği [toplam bilirubin normalin üst limitinin (ULN) 1 ila 1,5 katı veya aspartat amino transferaz (AST) > ULN] ve 1 hastada orta dereceli karaciğer yetmezliği (toplam bilirubin ULN'nin >1,5 ila 3 katı ve tüm AST) vardır. Hafif karaciğer yetmezliğinin isatuximabın farmakokinetiği üzerinde klinik açıdan anlamlı bir etkisi olmamıştır. Orta dereceli (toplam bilirubin ULN'nin
>1,5 ila 3 katı ve tüm AST) ve şiddetli karaciğer yetmezliğinin (toplam bilirubin ULN'nin >3 katı ve tüm AST) isatuximab farmakokinetiği üzerindeki etkisi bilinmemektedir. Ancak, isatuximab bir monoklonal antikor olduğu için, hepatik enzim aracılı metabolizma yoluyla temizlenmesi beklenmemektedir ve bu yüzden, karaciğer işlevindeki farklılıkların isatuximabın eliminasyonunu etkilemesi beklenmemektedir (bkz. Bölüm 4.2).
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda isatuximabla herhangi bir resmi çalışma yapılmamıştır. Popülasyon farmakokinetik analizindeki 476 hasta arasında, hafif böbrek yetmezliği (60 mL/dk./1,73 m ≤ tahmini glomerüler filtrasyon oranı (eGFR) <90 mL/dk./1,73 m) olan 192 hasta, orta dereceli böbrek yetmezliği olan 163 hasta (30 mL/dk./1,73 m≤ e-GFR < 60 mL/dk./1,73 m) ve şiddetli böbrekyetmezliği o lan12hasta (e-GFR <30 mL/dk./1,73 m)
bulunmaktadır. Analizler, normal böbrek işleviyle karşılaştırıldığında hafif ila orta dereceli böbrek yetmezliğinin isatuximabın farmakokinetiği üzerinde klinik açıdan anlamlı bir etkisi olduğunu göstermemektedir.
Pediyatrik popülasyon:
İsatuksimab 18 yaşından küçük hastalarda değerlendirilmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler, tekrarlanan konvansiyonel doz toksisitesi çalışmalarına göre insanlarda özel bir tehlike ortaya koymamıştır ancak seçilen türler farmakolojik açıdan duyarlı değildir ve bu nedenle insanlardaki önemi bilinmemektedir. Genotoksisite, karsinojenik potansiyel ve üreme ve gelişim toksisite çalışmaları yapılmamıştır.
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Sanofi Sağlık Ürünleri Ltd.Şti
| Satış Fiyatı | 11303.89 TL [ 25 Apr 2025 ] |
| Önceki Satış Fiyatı | 11303.89 TL [ 18 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699809779266 |
| Etkin Madde | Isatuksimab |
| ATC Kodu | L01FC02 |
| Birim Miktar | 100/5 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |