SELOVITA-K1 10 mg/ml enjeksiyonluk çözelti (5 adet) Kısa Ürün Bilgisi
{ Vitamin K1 }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
Selovita-K1 10 mg/mL Enjeksiyonluk Çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir SELOVİTA-K1 ampul 1 mL'de 10 mg Kvitamini (fitomenadion) içerir.
10 mg/mL'lik ampuller safra asidi/lesitin mikst misel çözeltisi şeklindedir. Bir amber cam ampul, 10 mg Kvitamini (dolum hacmi 1,15 mL) bulunan 1 mL'lik berrak sarı renkli mikst misel çözeltisi içerir.
Yardımcı maddeler
Sodyum hidroksit: 4,588 mg Lesitin: 75,6 mg
Yardımcı maddeler için bkz. Bölüm 6.1.
3. FARMASÖTİK FORMU
Steril ampul IV
Berrak sarı renkli mikst misel çözelti
Her bir amber cam ampul 1 mL'de 10 mg fitomenadion içerir. Ampul çözeltisi berrak veya az miktarda opelesan ve açık sarı renginde olup glikokolik asit ve lesitinin mikst misel karışımında etkin madde içerir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Kumarin tipi antikoagülanlarla doz aşımı, bunların fenilbutazon ile kombinasyonu ve diğer K hipovitaminoz formları (örn. obstrüktif sarılık ve ayrıca karaciğer ve bağırsak bozuklukları ve antibiyotikler, sülfonamidler veya salisilatlar ile uzun süreli tedavi) gibi çeşitli etiyolojilerin oluşturduğu ciddi âhipoprotrombinemiâ (örn. Pıhtılaşma faktörleri II, VII, IX ve X'un eksikliği) sonucunda hemoraji veya hemoraji riski.
4.2. Pozoloji ve uygulama şekli
SELOVİTA-K1 ampulleri IV enjeksiyon içindir. Ampul solüsyonu seyreltilmemeli veya enjekte edilen diğer maddelerle karıştırılmamalıdır ancak uygun olduğunda, %0,9'luk sodyum klorür veya %5'lik dekstrozun sürekli enfüzyonu sırasında, enfüzyon setinin alt kısmına enjekte edilebilir.
Standart doz:
Şiddetli veya hayatı tehdit edici hemoraji, örn. antikoagülan tedavi sırasında:
Kumarin antikoagülan kesilmeli ve SELOVİTA-K1 IV enjeksiyonu yavaşça (en az 30 saniye içerisinde), 5-10 mg'lık dozda, taze dondurulmuş plazma (FFP) veya protrombin kompleks konsantresi (PCC) ile birlikte verilmelidir. Kvitamin dozu gerekli oldukça tekrarlanabilir.
Hafif hemoraji ile birlikte veya olmadan, asemptomatik yüksek Uluslararası Normalleştirilmiş Oranı (INR) olan hastalarda Kvitamini tedavisi için doz tavsiyeleri:
Antikoagülan | INR | İntravenöz Kvitamini |
Varfarin | 5-9 | 0,5 ila 1,0 mg 0,5 ila 1,0 mg |
>9 | 1,0 mg | |
Asenokumarol | 5-8 | 1,0 ila 2,0 mg |
>8 | 1,0 ila 2,0 mg | |
Fenprokumon | 5-9 | 2,0 ila 5,0 mg |
>9 | 2,0 ila 5,0 mg | |
>10 | Kişiye bağlı olarak ayarlanan dozlar |
Büyük ve hayatı tehdit edici kanaması bulunan hastalarda Kvitamini tedavisi için doz tavsiyeleri:
Antikoagülan | Koşul | İntravenöz Kvitamini | Eşlik eden tedavi |
Varfarin | Büyük kanama | 5,0 ila 10,0 mg | FFP veya PCC |
Hayatı tehdit edici kanama | 10,0 mg | FFP, PCC veya rekombinant faktör VIIa | |
Asenokumarol | Büyük kanama | 5,0 mg | FFP, PCC veya protrombin konsantreleri ve faktör VII |
Fenprokumon | INR<5,0 ile birlikte büyük kanama | 5,0 mg | PCC |
INR>5,0 ile birlikte büyük kanama | 10,0 mg | PCC |
FFP: taze dondurulmuş plazma
PCC: protrombin kompleks konsantresi
Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği: Bilgi verilmemiştir.
Karaciğer yetmezliği: Karaciğer fonksiyonlarında şiddetli bozukluk olan hastalarda
SELOVİTA-K1 uygulamasından sonra INR'nin yakın takibi gerekmektedir.
Pediyatrik popülasyon:
1 yaşın üzerindeki çocuklar: SELOVİTA-K1'in 1 yaşın üzerindeki çocuklarda kullanımına ilişkin çok az veri bulunmaktadır. Kanamalı çocuklarda herhangi bir doz araştırması yapılmamıştır. Bu nedenle en uygun doz, tedavi eden hekim tarafından endikasyona ve hastanın ağırlığına göre belirlenmelidir. Kvitaminin IV erişkin dozunun onda birinin tek dozunun, asemptomatik yüksek (>8) INR'yi klinik olarak sağlıklı çocuklarda tersine çevirmede etkili olduğu bildirilmiştir. Hastanın INR değeri 2-6 saat sonra ölçülmelidir ve yanıt yeterli değilse doz tekrarlanabilir. Bu hastalarda vitamin K'ya bağımlı pıhtılaşma faktörlerinin sıklıkla izlenmesi şarttır.
Yenidoğanlar ve bebekler: Bu hastalarda endikasyon ve pozolojiye uygun olarak
SELOVİTA-K1 2 mg/0,2 mL Pediatrik Çözelti kullanılmalıdır.
Geriyatrik popülasyon:
Yaşlı hastalar, SELOVİTA-K1 ile antikoagülasyonun durdurulmasına daha duyarlıdırlar. Bu nedenle bu hasta grubu için doz, tavsiye edilen aralıkların alt sınırında olmalıdır. IV Kvitamininin 0,5 ila 1,0 mg arasındaki düşük dozlarının, INR'yi 24 saat içerisinde etkili bir şekilde <5,0'e düşürdüğü gösterilmiştir (Bkz. Farmakokinetik özellikler).
4.3. Kontrendikasyonlar
SELOVİTA-K1, fitomenadion (Kvitamini) veya ilacın içerdiği diğer yardımcı maddelerden herhangi birine karşı aşırı duyarlı olduğu bilinen hastalarda kontrendikedir.
SELOVİTA-K1 ampulleri intramusküler yolla uygulanmamalıdır çünkü IM yol depo karakteristiği gösterir ve Kvitamininin sürekli salınması antikoagülasyon tedavisinin yeniden oluşturulmasını zorlaştırır. Ayrıca antikoagülasyon yapılmış kişilere uygulanan IM enjeksiyonlar hematom oluşma riski doğurur.
4.4. Özel kullanım uyarıları ve önlemleri
Karaciğer fonksiyonlarında şiddetli bozukluk olan hastalar tedavi edilirken bir Selovita-K1 10 mg/mL Ampul'ün 54,6 mg glikokolik asit içerdiği ve bunun bilirubin yer değiştirici etkisi olduğu göz önünde bulundurulmalıdır. Karaciğer fonksiyonlarında şiddetli bozukluk olan hastalarda SELOVİTA-K1 uygulamasından sonra INR'nin yakın takibi gerekmektedir.
Kullanım sırasında ampul bileşenleri berrak olmalıdır. Uygun olmayan saklama sonrası solüsyon bulanıklaşabilir veya faz ayrımı meydana gelebilir. Bu tip durumlarda, ampul kullanılmamalıdır.
Kumarin antikoagülanlarının doz aşımına bağlı olarak potansiyel öldürücü veya şiddetli kanamada SELOVİTA-K1'in intravenöz enjeksiyonları yavaşça uygulanmalı ve 24 saatlik bir periyot süresince 40 mg'den fazla olmamalıdır.
SELOVİTA-K1 tedavisi tam kan veya kan pıhtılaşma faktörlerinin transfüzyonu gibi daha çabuk ve etkili bir tedavi ile birlikte yapılmalıdır. Protez kalp kapakçıkları olan hastalara ciddi veya potansiyel öldürücü kanama tedavisi için transfüzyon uygulandığında yeni donmuş plazma kullanılmalıdır. Mekanik kalp kapakçığı olan hastalarda, majör kanama olmadığı müddetçe, Kvitamininin kullanımı genellikle tercih edilmez.
SELOVİTA-K1'in yüksek dozları (günde 40 mg'den fazla olmamak üzere) eğer antikoagülan tedavi ile devam edilecekse tercih edilmemelidir çünkü 40 mg'den fazla dozlar için deneyim bulunmamaktadır ve daha yüksek dozlar beklenmeyen advers reaksiyonlara yol açabilir. Klinik çalışmalar, önerilen doz için INR'de anlamlı bir düşüş olduğunu göstermiştir. Kanama ciddi ise, Kvitamininin etkisi beklenirken, taze tam kan transfüzyonu gerekli olabilir.
Kvitamini heparinin bir antidotu değildir.
Enjeksiyon esnasında veya hemen sonrasında ciddi anaflaksi/hipersensitivite
gelişebileceğinden gerekli önlemlerin alınması gerekmektedir.
SELOVİTA-K1, 1 mmol'den (1 mL'de 2,64 mg) az sodyum içerdiğinden sodyum içermediği kabul edilir.
SELOVİTA-K1 soya yağı ihtiva eder. Eğer fıstık ya da soyaya alerjiniz varsa bu tıbbi ürünü kullanmayınız.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Kumarin antikoagülanlarının antagonizminden farklı olarak anlamlı bir etkileşim bilinmemektedir.
Özel popülasyonlara ilişkin ek bilgiler Pediatrik popülasyon:
Etkileşim bilinmemektedir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): SELOVİTA-K1'in çocuk doğurma potansiyeli olan kadınlar ve doğum kontrolü üzerine herhangi bir etkisi bilinmemektedir.
Gebelik dönemi:
Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/embriyonal/fetal gelişim/ve- veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. (bkz. Bölüm 5.3) İnsanlara yönelik potansiyel risk bilinmemektedir.SELOVİTA-K1 gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Yine de tüm ilaçlarda olduğu gibi, SELOVİTA-K1 yalnızca ilacın anneye sağlayacağı yararın, fetus üzerindeki riskten daha önemli olduğu durumlarda kullanılmalıdır.
Laktasyon dönemi:
SELOVİTA-K1'in, yenidoğanlarda K vitamini eksikliğinden kaynaklanan kanamaların profilaksisi olarak gebe kadınlarda kullanımı önerilmemektedir.
Üreme yeteneği/Fertilite:
İnsanlara yönelik potansiyel risk bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı üzerine herhangi bir etkisi bilinmemektedir.
4.8. İstenmeyen etkiler
Advers olaylar, sistem organ sınıfına ve sıklığına göre aşağıda listelenmiştir. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (≥1/10); yaygın (≥1/100 ila ≤1/10); yaygın olmayan (≥1/1.000 ila ≤1/100); seyrek (≥1/10.000 ila ≤1/1.000); izole olgular dâhil çok seyrek (≤1/10.000).
Bağışıklık sistemi hastalıkları:
Çok seyrek: SELOVİTA-K1'in intravenöz uygulamasından sonra anafilaktoid reaksiyonlar
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:
Çok seyrek: SELOVİTA-K1'in intravenöz uygulanmasıyla ilişkili olarak venöz iritasyon veya flebit
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks:0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Kvitamini hipervitaminozuna bağlı, bilinen bir klinik sendrom bulunmamaktadır. Anti- koagülasyonun yeniden oluşması etkilenebilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antihemorajik, vitamin K ATC kodu: B02BA01
SELOVİTA-K1'in etken maddesi olan Kvitamini (fitomenadion), prokoagülan bir faktördür. Kvitamini, karaciğerdeki karboksilaz sisteminin bir bileşeni olarak, pıhtılaşma faktörü II (protrombin), VII, IX ve X ve pıhtılaşma inhibitörleri olan protein C ve protein S'nin geçiş-sonrası karboksilasyonunda rol oynar. Kumarinler, Kvitamininin (kinon formundan) Kvitamini hidrokinon formuna indirgenmesini inhibe eder ve ayrıca karboksilasyondan sonra oluşan Kvitamini epoksidinin, kinon formuna indirgenmesini önler.
Kvitamini kumarin tipi antikoagülanların (örn. fenprokumon) bir antagonistidir. Ancak heparinin aktivitesini nötrleştirmez; protamin heparinin antagonistidir.
Kvitamini kalıtsal hipoprotrombinemide veya ağır karaciğer yetmezliğine bağlı hipoprotrombinemide etkisizdir.
Ampüllerde Kvitamini, vücut içinde de bulunan bir taşıma ortamı olan, safra asidi lesitin misellerinin oluşturduğu fizyolojik kollodial sistem aracılığı ile çözülür.
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim:
SELOVİTA-K1 ampulün etkisi intravenöz uygulamadan yaklaşık 1-3 saat sonra başlamaktadır.
Dağılım:
Başlıca dağılım kompartmanı plazma hacmine karşılık gelir. Kan plazmasında Kvitamininin
%90'ı lipoproteinlere bağlanır (VLDL fraksiyonu). Kvitamininin plazmadaki normal konsantrasyonları 0,4-1,2 ng/mL arasında değişir. 10 mg Kvitamininin, intravenöz uygulanmasından bir saat sonraki plazma düzeyi yaklaşık 500 ng/mL ve 12 saatte yaklaşık 50 ng/mL'dir. Kvitamini plasentadan kolayca geçemez ve anne sütüne çok az geçer.
Biyotransformasyon:
Kvitamini, Kvitamini 2,3-epoksid gibi daha polar metabolitlere hızla dönüşür. Bu metabolitin bir kısmı yeniden K1 vitaminine dönüşmektedir.
Eliminasyon:
Metabolik degradasyonu takiben, Kvitamini glukuronid ve sülfat konjügatları şeklinde, safra ve idrar yoluyla atılır. Erişkinlerdeki terminal yarı-ömür intravenöz uygulamadan sonra 14±6 saat arasında değişmektedir. Uygulanan dozun %10'undan azı idrarla değişmeden atılır.
Doğrusallık / Doğrusal olmayan durum:
Geçerli değil.
Özel popülasyonlara ilişkin ek bilgiler:
Diğer:
Kvitamininin barsaktaki emilimi, malabsorpsiyon sendromları, ince barsak sendromu, biliyer atrezi ve pankreas yetmezliği gibi çeşitli durumlarda bozulur. Bu hasta grubu için doz, önerilen aralığın en alt kısmında olmalıdır (Bkz. Pozoloji ve uygulama şekli).
5.3. Klinik öncesi güvenlilik verileri
Geçerli değil.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Glikokolik asit Sodyum hidroksit Lesitin Hidroklorik asit Enjeksiyonluk su
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklayınız. Işıktan koruyunuz.
Stabilite göz önüne alınarak, açık ampullerin kullanılmamış olan içerikleri kullanılamaz ve atılmalıdır.
6.5. Ambalajın niteliği ve içeriği
SELOVİTA-K1, 1 mL içerisinde, 10 mg Kvitamini (fitomenadion) içeren, 5 ampullük ambalajlarda sunulmaktadır.
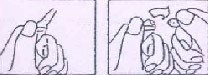
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Ampulün baş kısmı ok yönünde aşağıya çekilir. Testere kullanılmasına gerek yoktur.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve
âAmbalaj Atıklarının Kontrolü Yönetmeliğiâlerine uygun olarak imha edilmelidir.
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| SELOVITA-K1 | 8680400771537 | 220.56TL |
| Diğer Eşdeğer İlaçlar |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Haver Pharma İlaç A.Ş.
| Satış Fiyatı | 220.56 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 220.56 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680400771537 |
| Etkin Madde | Vitamin K1 |
| ATC Kodu | B02BA01 |
| Birim Miktar | 10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 5 |
| Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > Vitamin k1 |
| Yerli ve Beşeri bir ilaçdır. |