SERONDIR 10 MG+20 MG+30 mg film kaplı tablet tedaviYE BASLAMA paketi Farmakolojik Özellikler
{ Apremilast }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Selektif immünosüpresantlar ATC kodu: L04AA32
Etki Mekanizması
Bir oral küçük moleküllü fosfodiesteraz 4 (PDE4) inhibitörü olan apremilast bir pro- inflamatuar ve anti-inflamatuar mediyatör ağını düzenlemek üzere intraselüler olarak iş görür. PDE4, siklik adenozin monofosfata (cAMP) özgü bir PDE'dir ve inflamatuar hücrelerdeki baskın olan PDE'dir. PDE4 inhibisyonu intraselüler cAMP düzeylerini artırır, bu da TNF-âº, IL-23, IL-17 ve diğer inflamatuar sitokinlerin ortaya çıkmasını düzenleyerek inflamatuar yanıtı azaltır. Siklik AMP aynı zamanda IL-10 gibi anti-inflamatuar sitokinlerin düzeylerini de düzenler. Bu pro-inflamatuar ve anti-inflamatuar mediyatörlerin psöriatik artrit ve psöriaziste işe karıştıkları gösterilmiştir.
Farmakodinamik Etkiler
Psöriatik artritli hastalarda yürütülen klinik çalışmalarda, apremilast IL-1âº, IL-6, IL-8, MCP- 1, MIP-1Ã, MMP-3 ve TNF-âº'nın plazma protein düzeylerini tamamen inhibe etmemekle birlikte önemli ölçüde düzenlemiştir. Apremilast ile 40 haftalık tedaviden sonra IL-17 ve IL- 23'ün plazma protein düzeylerinde bir azalma ve IL-10'da bir artış görülmüştür. Psöriazisli hastalarda yürütülen klinik çalışmalarda apremilast lezyonlu deri epidermal kalınlığı, inflamatuar hücre infiltrasyonu ve indüklenebilir nitrik oksit sentaz (iNOS), IL-12/IL-23p40, IL-17A, IL-22 ve IL-8 için olanlar dahil pro-inflamatuar genlerin ekspresyonunu azaltmıştır.
50 mg BID'e varan dozlarda uygulanan apremilast sağlıklı gönüllülerde QT aralığını uzatmamıştır.
Klinik çalışmalar Psöriatik Artrit
Apremilastın güvenliliği ve etkililiği, küçük moleküllü veya biyolojik DMARD'larla önceki tedaviye rağmen aktif psöriatik artritli (≥3 şiş eklem ve ≥3 hassas eklem) yetişkin hastalarda benzer tasarıma sahip 3 çok merkezli, randomize, çift kör, plasebo kontrollü çalışmada (PALACE 1, PALACE 2 ve PALACE 3 Çalışmaları) değerlendirilmiştir. Toplamda 1493 hasta randomize edilmiş ve plasebo, apremilast 20 mg ya da apremilast 30 mg ile günde iki kez oral yolla tedavi edilmiştir.
Bu çalışmalardaki hastalar en az 6 aylık psöriatik artrit tanısına sahipti. PALACE 3'te ayrıca niteleyici bir psöriazis deri lezyonu da (en az 2 cm çapında) gerekliydi. Apremilast küçük moleküllü DMARD'ların stabil dozları ile kombinasyon halinde (%65.2) veya monoterapi (%34.8) olarak kullanılmıştır. Hastalar şunların biri veya daha fazlası ile kombinasyon halinde apremilast almıştır: metotreksat (MTX, ≤ 25 mg/hafta, %54.5), sülfasalazin (SSZ, ≤ 2 g/gün, %9.0) ve leflunomid (LEF; ≤ 20 mg/gün, %7.4). TNF blokerleri dahil olmak üzere biyolojik DMARD'larla eşzamanlı tedaviye izin verilmemiştir. Simetrik poliartrit (%62.0), asimetrik oligoartrit (%26.9), distal interfalangeal (DIP) eklem artriti (%6.2), artritis mutilans (%2.7) ve baskın olarak spondilit (%2.1) dahil her bir psöriatik artrit alt tipindeki hastalar bu 3 çalışmaya kaydedilmiştir. Önceden mevcut entezopati (%63) veya daktilit (%42) görülen hastalar kaydedilmiştir. Hastalarıntoplamda%7Saklamaya yönelik özel tedbirler tedbirler'üdahaönce sadece küçük moleküllü
DMARD'larla tedavi edilirken, hastaların %22.4'ü daha önce biyolojik DMARD'larla tedavi edilmişti (bunların %7.8'inde önceki biyolojik DMARD ile terapötik başarısızlık vardı). Medyan psöriatik artrit hastalık süresi 5 yıldı.
Çalışma tasarımına dayalı olarak, hassas ve şiş eklem sayımları 16. haftada en az %20 iyileşme göstermemiş hastalar yanıt vermeyenler olarak kabul edilmiştir. Yanıt vermeyenler olarak kabul edilen plasebo hastaları 1:1 oranında körlenmiş bir şekilde ya günde iki kez apremilast 20 mg ya da günde iki kez 30 mg'a yeniden randomize edilmiştir. 24. Haftada, tüm geri kalan plasebo ile tedavi edilen hastalar ya apremilast 20 ya da 30 mg BID'ye geçirilmiştir. 52 haftalık tedaviden sonra hastalar PALACE 1, PALACE 2 ve PALACE 3 çalışmalarının uzun vadeli uzatılması kapsamında açık etiketli apremilast 20 mg veya 30 mg'a 5 yıla varan toplam tedavi süresince (260 hafta) devam edebilmiştir.
Birincil sonlanım noktası 16. haftada Amerikan Romatoloji Derneği (ACR) 20 yanıtını elde eden hastaların yüzdesiydi.
Apremilast ile tedavi 16. haftada plaseboya kıyasla ACR 20 yanıt kriterleri ile değerlendirilen psöriatik artrit bulgu ve semptomlarında anlamlı iyileşmelerle sonuçlanmıştır. 16. Haftada günde iki kez 30 mg apremilast için ACR 20/50/70 elde eden hastaların oranı (PALACE 1, PALACE 2 ve PALACE 3 Çalışmalarındaki yanıtlar ve PALACE 1, PALACE 2 ve PALACE 3 çalışmaları için birleştirilmiş veriler) Tablo 3'te gösterilmektedir. ACR 20/50/70 yanıtları
24. haftada devam etmiştir.
Başlangıçta günde iki kez 30 mg apremilast tedavisine randomize edilmiş hastalar arasında ACR 20/50/70 yanıt oranları birleştirilmiş PALACE 1, PALACE 2 ve PALACE 3 Çalışmalarında 52. haftaya kadar korunmuştur (Şekil 1).
Tablo 3. 16. Haftada PALACE 1, PALACE 2 ve PALACE 3 çalışmaları ve birleştirilmiş çalışmalarda ACR yanıtlarına sahip hastaların oranı
| PALACE 1 | PALACE 2 | PALACE 3 | BİRLEŞTİRİLMİŞ | ||||
N | Plasebo | Apremilast | Plasebo | Apremilast | Plasebo | Apremilast | Plasebo | Apremilast |
| ± | 30 mg BID | ± | 30 mg BID | ± | 30 mg BID | ± | 30 mg BID |
| DMARD | ± | DMARD | ± | DMARD | ± | DMARD | ± |
| N=168 | DMARD | N=159 | DMARD | N=169 | DMARD | N=496 | DMARD |
|
| N=168 |
| N=162 |
| N=167 |
| N=497 |
ACR 20 |
|
|
|
|
|
|
|
|
16. Hafta | %19.0 | %38.1** | %18.9 | %32.1* | %18.3 | %40.7** | %18.8 | %37.0** |
ACR 50 |
|
|
|
|
|
|
|
|
16. Hafta | %6.0 | %16.1* | %5.0 | %10.5 | %8.3 | %15.0 | %6.5 | %13.9** |
ACR 70 |
|
|
|
|
|
|
|
|
16. Hafta | %1.2 | %4.2 | %0.6 | %1.2 | %2.4 | %3.6 | %1.4 | %3.0 |
* Plaseboya karşı apremilast için p≤0.01
** Plaseboya karşı apremilast için p≤0.001
Şekil 1 PALACE 1, PALACE 2 ve PALACE 3 çalışmalarının birleştirilmiş analizinde
52. Haftaya kadar ACR 20/50/70 yanıtı verenlerin oranı (NRI*)
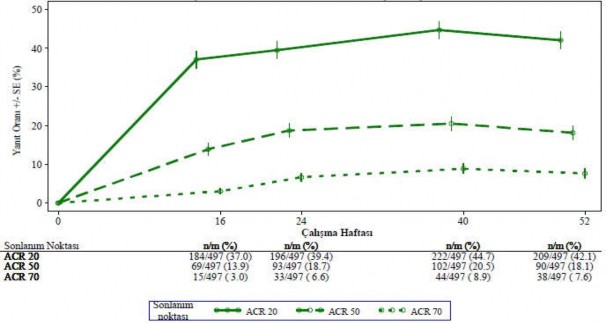
*NRI: Yanıt vermeyen. Zaman noktasından önce ayrılan ve zaman noktasında yanıt durumunun kesin bir şekilde belirlenmesi için yeterli veriye sahip olmayan denekler yanıt vermeyenler olarak sayılmaktadır.
Başlangıçta günde iki kez 30 mg apremilasta randomize edilmiş 497 hasta içerisinden 375 hasta (%75) 52. haftada halen bu tedaviye devam etmekteydi. Bu hastalarda 52. haftadaki ACR 20/50/70 yanıtları sırasıyla %57, %25 ve %11'di. Başlangıçta günde iki kez 30 mg apremilasta randomize edilen 497 hasta arasında 375 hasta (%75) uzun vadeli uzatma çalışmalarına girmiş olup, bunlardan 221 hasta (%59) 260. haftada halen bu tedaviyi almaktaydı. ACR yanıtları uzun vadeli açık etiketli uzatma çalışmalarında 5 yıla kadar korunmuştur.
Apremilast ile tedavi edilen grupta gözlenen yanıtlar MTX dahil eşzamanlı DMARD kullanan ve kullanmayan hastalarda benzerdi. Daha önce DMARD'lar veya biyolojiklerle tedavi edilmiş apremilast alan hastalar 16. haftada plasebo alan hastalardan daha yüksek ACR 20 yanıtı elde etmiştir.
DIP dahil farklı psöriatik artrit alt tiplerinin görüldüğü hastalarda benzer ACR yanıtları gözlenmiştir. Artritis mutilans ve baskın spondilit alt tipleri görülen hastaların sayısı anlamlı değerlendirilebilmek için çok küçüktü.
PALACE 1, PALACE 2 ve PALACE 3'te Hastalık Aktivitesi Ölçeği (DAS) 28 C-reaktif protein (CRP) ve modifiye psöriatik artrit yanıt kriterlerine (PsARC) elde eden hastaların oranındaki iyileşmeler 16. haftada plaseboya kıyasla apremilast grubunda daha yüksekti (nominal p-değeri sırasıyla p≤0.0017, p≤0.0004). Bu iyileşmeler 24. haftada devam etmiştir. Çalışmanın başlangıcında randomize edildikleri apremilast tedavisini sürdüren hastalar arasında DAS28(CRP) skoru ve PsARC yanıtı 52. haftaya kadar korunmuştur.
16 ve 24. haftalarda apremilast ile tedavi edilen hastalarda psöriazis artritin periferik aktivite özelliğine ilişkin parametrelerde (örn., şiş eklem sayısı, ağrılı/hassas eklem sayısı, daktilit ve entezit) ve psöriazisin deri bulgularında iyileşmeler görülmüştür. Çalışmanın başlangıcında randomize edildikleri apremilast tedavisini sürdüren hastalarda bu iyileşmeler 52. haftaya kadar korunmuştur.
Açık etiketli uzatma çalışmalarında 5 yıla varan tedavi boyunca psöriazisin deri bulgularında ve aynı periferik aktivite parametrelerindeki klinik yanıtlar korunmuştur.
Fiziksel fonksiyon ve sağlıklailişkiliyaşamkalitesi
birleştirilmiş çalışmalarda 16. haftada plaseboya kıyasla sağlık değerlendirme anketinin engellilik indeksinde (HAQ-DI) başlangıca göre değişiklik değerlendirildiğinde fiziksel fonksiyonda istatistiksel olarak anlamlı bir iyileşme göstermiştir. HAQ-DI skorlarındaki iyileşme 24. haftada devam etmiştir.
Başlangıçta günde iki kez 30 mg apremilast tedavisine randomize edilmiş hastalar arasında, PALACE 1, PALACE 2 ve PALACE 3 çalışmalarının açık etiketli fazının birleştirilmiş analizinde 52. haftadaki HAQ-DI skorunda başlangıca göre değişiklik günde iki kez 30 mg apremilast grubunda -0.333 idi.
PALACE 1, PALACE 2 ve PALACE 3 çalışmalarında, 16 ve 24. haftalarda plaseboya kıyasla apremilast ile tedavi edilen hastalarda Kısa Form Sağlık Anketi versiyon 2'nin (SF-36v2) fiziksel işlevsellik (PF) domeninde ve Fonksiyonel Kronik Hastalık Tedavisi Değerlendirmesi â Yorgunluk (FACIT-yorgunluk) skorlarında başlangıca göre değişiklikte sağlıkla ilişkili yaşam kalitesinde anlamlı iyileşmeler gösterilmiştir. Çalışmanın başlangıcında randomize edildikleri apremilast tedavisini sürdüren hastalar arasında fiziksel fonksiyon ve FACIT- yorgunluktaki iyileşme 52. haftaya kadar korunmuştur.
HAQ-DI ve SF36v2PF domeni ve FACIT-yorgunluk skorları ile değerlendirildiğinde iyileşmiş fiziksel fonksiyon açık etiketli uzatma çalışmalarında 5 yıllık tedavi boyunca korunmuştur.
Psöriazis
Apremilastın güvenliliği ve etkililiği, orta şiddette ila şiddetli plak psöriazisli, (≥ %10 vücut yüzey alanı (BSA) tutulumu görülen, Psöriazis Alan ve Ciddiyet İndeks (PASI) skoru ≥ 12 olan, statik Hekim Genel Değerlendirmesi (sPGA) ≥ 3 (orta şiddette veya şiddetli) ve fototerapi ya da sistemik tedaviye aday, toplamda 1257 hastanın kaydedildiği iki çok merkezli, randomize, çift kör, plasebo kontrollü çalışmada (ESTEEM 1 ve ESTEEM 2 Çalışmaları) değerlendirilmiştir.
Bu çalışmalar 32. haftaya kadar benzer tasarıma sahiptir. Her iki çalışmada da hastalar 2:1 oranında 16 hafta boyunca apremilast 30 mg BID veya plaseboya (plasebo kontrollü faz) randomize edilmiş ve 16-32. haftalar arası tüm hastalar apremilast 30 mg BID (idame fazı) almıştır. Randomize Tedavinin Geri Çekilme Fazı sırasında (32-52. haftalar) orijinal olarak apremilasta randomize edilmiş, PASI skorlarında %75 azalma (PASI-75) (ESTEEM 1) veya
PASI skorlarında %50 azalma (PASI-50) (ESTEEM 2) elde etmiş hastalar 32. haftada yeniden plasebo veya apremilast 30 mg BID'ye randomize edilmiştir. Plaseboya yeniden randomize edilmiş ve 32. haftada PASI-75 yanıtını (ESTEEM 1) kaybetmiş veya PASI iyileşmesinin
%50'sini kaybetmiş hastalar (ESTEEM 2) apremilast 30 mg BID ile yeniden tedavi edilmiştir.
32. Haftaya kadar belirlenen PASI yanıtına ulaşmamış veya başlangıçta plaseboya randomize edilmiş hastalar, 52. haftaya kadar apremilast tedavisinde kalmıştır. Çalışmalarda yüz, koltukaltı ve kasıkta düşük potensli topikal kortikosteroid, katranlı şampuan ve/veya salisilik asit saç derisi preparatlarının kullanılmasına izin verilmiştir. Buna ilaveten, 32. haftada, ESTEEM 1'de PASI-75 yanıtı veya ESTEEM 2'de PASI-50 yanıtı elde etmemiş deneklerin apremilast 30 mg BID tedavisine ek olarak topikal psöriazis tedavileri ve/veya fototerapi kullanmalarına izin verilmiştir.
52 haftalık tedaviden sonra, hastalar ESTEEM 1 ve ESTEEM 2 çalışmalarının uzun vadeli uzatma çalışmalarıyla 5 yıla kadar toplam tedavi süresi boyunca (260 hafta) açık etiketli apremilast 30mg kullanmaya devam edebilmiştir.
Her iki çalışmada da birincil sonlanım noktası 16. haftada PASI-75 elde eden hastaların oranıdır. Majör ikincil sonlanım noktası 16. haftada temiz (0) ya da neredeyse temiz (1) sPGA skoru elde etmiş hastaların oranıdır.
Ortalama başlangıç PASI skoru 19.07 (medyan 16.80) olup, başlangıçta sPGA skoru 3 (orta şiddette) ve 4 (şiddetli) olan hastaların oranı %25.19'luk ortalama BYA tutulumu (medyan
%21.0) ile sırasıyla %70.0 ve%29.8idi.Tümhastalarınyaklaşık %30'u psöriazis tedavisi için
daha önce fototerapi ve %54'ü daha önce konvansiyonel sistemik ve/veya biyolojik tedavi görmüş olup (tedavi başarısızlıkları dahil), %37'si daha önce konvansiyonel sistemik tedavi ve
%30'u daha önce biyolojik tedavi görmüştü. Hastaların yaklaşık üçte biri daha önce fototerapi, konvansiyonel sistemik veya biyolojik tedavi görmemişti. Hastaların toplamda %18'i psöriatik artrit öyküsüne sahipti.
PASI-50, -75 ve -90 yanıtları elde eden ve sPGA skoru temiz (0) veya neredeyse temiz (1) olan hastaların oranı aşağıdaki Tablo 4'te sunulmaktadır. Apremilast ile tedavi plaseboya kıyasla 16. haftada PASI-75 yanıtına sahip hastaların oranı ile gösterildiği üzere orta şiddette ila şiddetli plak tipi psöriaziste anlamlı iyileşme ile sonuçlanmıştır. 16. Haftada sPGA, PASI- 50 ve PASI- 90 yanıtları ile ölçülen klinik iyileşme gösterilmiştir. Buna ilaveten apremilast kaşıntı, tırnak hastalığı, saç derisi tutulumu ve yaşam kalitesi ölçümleri dahil olmak üzere çeşitli psöriazis bulgularında tedavi faydası göstermiştir.
Tablo 4. ESTEEM 1 ve ESTEEM 2 çalışmalarında 16. haftadaki klinik yanıt (FAS a, LOCFb)
| ESTEEM 1 | ESTEEM 2 | ||
| Plasebo | 30 mg BID APR* | Plasebo | 30 mg BID APR* |
N | 282 | 562 | 137 | 274 |
PASI, n (%) | 15 (5.3) | 186 (33.1) | 8 (5.8) | 79 (28.8) |
sPGA Temiz veya Neredeyse Temiz, n (%) | 11 (3.9) | 122 (21.7) | 6 (4.4) | 56 (20.4) |
PASI 50, n (%) | 48 (17.0) | 330 (58.7) | 27 (19.7) | 152 (55.5) |
PASI 90, n (%) | 1 (0.4) | 55 (9.8) | 2 (1.5) | 24 (8.8) |
Yüzde Değişiklik BYA (%) ortalama ± SD | -6.9 ±38.95 | -47.8 ±38.48 | -6.1 ±47.57 | -48.4 ±40.78 |
Kaşıntı VAS'ında değişiklik (mm), ortalama±SD | -7.3 ±27.08 | -31.5 ±32.43 | -12.2 ±30.94 | -33.5 ±35.46 |
DLQI'da değişiklik, ortalama±SD | -2.1 ±5.69 | -6.6 ±6.66 | -2.8 ±7.22 | -6.7 ±6.95 |
SF-36 MCS'de değişiklik, ortalama±SD | -1.02 ±9.161 | 2.39 ±9.504 | 0.00 ±10.498 | 2.58 ±10.129 |
Apremilastın klinik faydası başlangıç demografikleri ve başlangıç klinik hastalık özellikleri ile tanımlanan (psöriazis hastalığı süresi ve psöriatik artrit öyküsü olan hastalar dahil) çok sayıda alt grup arasında gösterilmiştir. Apremilastın klinik faydası aynı zamanda önceki psöriazis ilacı kullanımı ve önceki psöriazis tedavilerine verilen yanıta bakılmaksızın gösterilmiştir. Tüm kilo aralıklarında benzer yanıt oranları gözlenmiştir.
Apremilasta yanıt, 2. hafta itibariyle plaseboya kıyasla PASI, deride rahatsızlık/ağrı ve kaşıntı
Genelde PASI yanıtları 16. hafta itibariyle elde edilmiş ve 32. haftaya kadar devam etmiştir. Her iki çalışmada da PASI'da başlangıca göre ortalama yüzde iyileşme 32. Haftada apremilasta yeniden randomize edilmiş hastalar için Randomize Tedaviden Çekilme Fazı sırasında stabil kalmıştır (Tablo 5).
Tablo 5. 0. Haftada APR 30 BID'ye randomize edilmiş ve 32. hafta ila 52. haftada APR 30 BID'ye yeniden randomize edilmiş deneklerdeki etkinin kalıcılığı
| Zaman Noktası | ESTEEM 1 | ESTEEM 2 |
32. Haftada PASI-75 elde eden hastalar | 32. Haftada PASI-50 elde eden hastalar | ||
PASI'da başlangıca göre Yüzde Değişiklik (%) ± SD | 16. Hafta | -77.7±20.30 | -69.7±24.23 |
32. Hafta | -88±8.30 | -76.7±13.42 | |
52. Hafta | -80.5±12.60 | -7.8±Saklamaya yönelik özel tedbirler tedbirler1 | |
DLQI'da başlangıca göre değişiklik, ortalama±SD | 16. Hafta | -8.3±6.26 | -74.4±18.91 |
32. Hafta | -8.9±6.68 | -7.8±Saklamaya yönelik özel tedbirler tedbirler1 | |
52. Hafta | -7.8±5.75 | -7.7±5.92 | |
Saç Derisi Psöriazisi PGA'sı (ScPGA) 0 veya 1 olan gönüllülerin oranı, n/N (%) | 16. Hafta | 40/48 (83.3) | 21/37 (56.8) |
32. Hafta | 39/48 (81.3) | 27/37 (73.0) | |
52. Hafta | 35/48 (72.9) | 20/37 (54.1) |
ESTEEM 1 Çalışmasında, 32. haftada apremilasta yeniden randomize edilmiş hastaların yaklaşık %61'i 52. haftada PASI-75 yanıtına sahipti. Randomize Tedaviden Geri Çekilme Fazı sırasında 32. haftada plaseboya yeniden randomize edilmiş en azından PASI-75 yanıtına sahip hastalardan %11.7'si 52. haftada PASI-75 yanıtı veren hastalardı. Plaseboya yeniden randomize edilmiş hastalar arasında PASI-75 yanıtı kaybına kadar geçen medyan süre 5.1 haftaydı.
ESTEEM 2 Çalışmasında, 32. haftada apremilasta yeniden randomize edilmiş hastaların yaklaşık %80.3'ü 52. haftada PASI-50 yanıtına sahipti. 32. Haftada plaseboya yeniden randomize edilmiş en az PASI-50 yanıtına sahip hastalardan %24.2'si 52. haftada PASI-50 yanıtı veren hastalardı. 32. Hafta PASI iyileşmelerinde %50 kayba kadar geçen medyan süre
12.4 haftaydı.
32. Haftada randomize tedaviden geri çekilme sonrasında, ESTEEM 1 Çalışmasındaki hastaların yaklaşık %70'i ve ESTEEM 2 Çalışmasındaki hastaların %65.6'sı apremilast tedavisinin yeniden başlatılmasından sonra PASI-75 (ESTEM 1) veya PASI-50 (ESTEEM 2) yanıtlarını yeniden kazanmıştır. Çalışma tasarımından dolayı yeniden tedavinin süresi değişken olup, 2.6 ile 22.1 hafta arasında değişmiştir.
ESTEEM 1 Çalışmasında, çalışmanın başlangıcında apremilasta randomize edilmiş 32. haftada PASI-75 yanıtı elde etmemiş hastaların, 32 ve 52. haftalar arasında eşzamanlı topikal tedaviler ve/veya UVB fototerapisi kullanmalarına izin verilmiştir. Bu hastalardan %12'si 52. haftada apremilast artı topikal tedavi ve/veya fototerapi ile PASI-75 yanıtı elde etmiştir.
ESTEEM 1 ve ESTEEM 2 Çalışmalarında, 16. haftada plasebo ile tedavi edilen hastalara kıyasla apremilast alan hastalarda Tırnak Psöriazis Şiddet İndeksinde (NAPSI) başlangıca göre ortalama değişiklik yüzdesi ile ölçüldüğüüzeretırnakpsöriazisindeanlamlı iyileşmeler (azalmalar)
hastalarda 32. haftada tırnak psöriazisinde ilave iyileşmeler gözlenmiştir.
ESTEEM 1 ve ESTEEM 2 Çalışmalarında plasebo ile tedavi edilen hastalara kıyasla apremilast alan hastalarda 16. haftada Saç Derisi Psöriazisi Hekimin Genel Değerlendirmesi (ScPGA) temiz (0) ya da minimum (1) skoru elde etmiş hastaların oranı ile ölçüldüğü üzere en az orta şiddette (≥3) saç derisi psöriazisinde anlamlı iyileşmeler gözlenmiştir. İyileşmeler Apremilasta yeniden randomize edilmiş deneklerde 32. haftadan 52. haftaya genellikle korunmuştur (Tablo 5).
ESTEEM 1 ve ESTEEM 2 Çalışmalarında, plasebo ile tedavi edilen hastalara kıyasla apremilast alan hastalarda Dermatoloji Yaşam Kalitesi İndeksi (DLQI) ve SF-36v2MCS ile ölçülen yaşam kalitesinde anlamlı iyileşmeler görülmüştür (Tablo 4). DLQI'daki iyileşmeler32. haftada apremilasta yeniden randomize edilmiş deneklerde 52. haftaya kadar korunmuştur (Tablo 5). Buna ilaveten, ESTEEM 1 Çalışmasında, plaseboya kıyasla apremilast alan hastalarda İş Kısıtlamaları Anketinde (WLQ-25) anlamlı iyileşme elde edilmiştir.
Başlangıçta günde iki kez 30 mg apremilasta randomize edilmiş 832 hasta arasında 443 hasta (%53) ESTEEM 1 ve ESTEEM 2'nin açık etiketli uzatma çalışmalarına girmiş olup, bunlardan
115 hasta (%26) 260. haftada halen tedavi görmekteydi. ESTEEM 1 ve ESTEEM 2 çalışmalarının açık etiketli uzatmasında apremilasta devam eden hastalar için PASI skoru, etkilenmiş BSA, kaşıntı, tırnak ve yaşam kalitesi ölçümlerinde iyileşmeler genellikle 5 yıla kadar korunmuştur.
Psöriatik artrit ve psöriazis görülen hastalarda günde iki kez 30 mg apremilastın uzun dönem güvenliliği 5 yıla varan toplam tedavi süresince değerlendirilmiştir. Apremilast ile açık etiketli uzatma çalışmalarında uzun dönemli deneyim genellikle 52 haftalık çalışmalardakine benzer olmuştur.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Apremilast yaklaşık 2.5 saatlik medyan sürede (tmaks) meydana gelen pik plazma konsantrasyonları (Cmaks) eşliğinde yaklaşık %73 mutlak oral biyoyararlanım ile iyi düzeyde emilmektedir. Apremilast farmakokinetiği doğrusal olup, günlük 10 ile 100 mg doz aralığında sistemik maruziyette dozla orantılı bir artış söz konusudur. Birikim apremilast günde bir kez uygulandığında minimum ve günde iki kez uygulandığında sağlıklı gönüllülerde yaklaşık
%53 ve psöriazisli gönüllülerde %68'dir. Gıdalarla birlikte uygulama biyoyararlanımı değiştirmediğinden apremilast aç veya tok karnına uygulanabilir.
Dağılım
Apremilastın insan plazma proteinine bağlanması yaklaşık %68'dir. Ortalama görünür dağılım hacmi (Vd) 87L olup, ekstravasküler dağılıma işaret eder.
Biyotransformasyon
Apremilast oksidasyon, hidroliz ve konjugasyon dahil yaygın olarak hem CYP aracılı hem de CYP dışı yolaklarla metabolize edilir, bu da tek bir klirens yolağının inhibisyonunun belirgin ilaç-ilaç etkileşimine neden olmasının muhtemel olmadığını düşündürür. Apremilastın oksidatif metabolizmasına başlıca CYP3A4 aracılık ederken CYP1A2 ve CYP2A6'dan minör katkılar söz konusudur. Apremilast oral uygulamayı takiben dolaşımdaki majör bileşendir. Apremilast, uygulanan ana bileşiğin sırasıyla sadece % 3 ve % 7'sinin idrar ve dışkıda geri kazanılmasıyla yoğun bir metabolizmaya maruz kalır. Dolaşımdaki majör inaktif metabolit O- demetile apremilastın glukuronid konjugatıdır(M12). Apremilastınbir CYP3A4 substratı olması ile
eşzamanlı uygulandığında azalır.
İn vitro apremilast sitokrom P450 enzimlerinin inhibitörü ya da indükleyicisi değildir. Bu nedenle CYP enzimlerinin substratları ile birlikte uygulanan apremilastın CYP enzimleri ile metabolize edilen etkin maddelerin klirensini ve maruziyetini etkilemesi olası değildir.
İn vitro apremilast bir P-glikoprotein substratı ve zayıf inhibitörüdür (IC50>50µM), bununla birlikte P-gp aracılığıyla klinik açıdan ilgili ilaç etkileşimlerinin meydana gelmesi beklenmemektedir.
İn vitro apremilast Organik Anyon Taşıyıcısı (OAT)1 ve OAT3, Organik Katyon Taşıyıcısı (OKT)2, Organik Anyon Taşıyıcısı Polipeptid (OATP)1B1 ve OATP1B3 veya meme kanseri direnç proteini (BCRP) üzerinde inhibe edici etkiye sahip değildir veya çok az etki söz konusudur ve bu taşıyıcılar için bir substrat değildir. Bu nedenle apremilast bu taşıyıcıların substratları veya inhibitörleri ile birlikte uygulandığında klinik açıdan ilgili ilaç-ilaç etkileşimleri olası değildir.
Eliminasyon
Apremilastın plazma klirensi yaklaşık 9 saatlik bir terminal eliminasyon yarılanma ömrü ile sağlıklı kişilerde ortalama yaklaşık 10 L/saattir. Radyo-etiketli apremilastın oral yolla uygulanmasını takiben radyoaktivitenin yaklaşık %58 ve %39'u sırasıyla idrar ve feçeste geri kazanılırken, radyoaktif dozun sırasıyla %3'ü ve %7'si idrar ve feçeste apremilast olarak geri kazanılmıştır.
Özel popülasyonlar:
Geriyatrik popülasyon:
Apremilast genç ve yaşlı sağlıklı gönüllülerde araştırılmıştır. Yaşlı gönüllülerde (65 ila 85 yaş) maruziyet genç gönüllülere (18 ila 55 yaş) kıyasla apremilast için EAA'da yaklaşık %13 daha yüksek ve C'ta yaklaşık %6 daha yüksektir. Klinik çalışmalarda 75 yaş üzerindeki gönüllülerde farmakokinetik veriler sınırlıdır. Yaşlı hastalar için herhangi bir doz ayarlaması gerekli değildir.
Böbrek yetmezliği:
Hafif veya orta şiddette böbrek yetmezliği olan gönüllüler ve eşleştirilmiş sağlıklı gönüllüler arasında apremilastın FK'sında anlamlı bir fark yoktur (her biri N=8). Bulgular hafif ve orta şiddette böbrek yetmezliği olan hastalarda doz ayarlaması gerekmediğini desteklemektedir. Şiddetli böbrek yetmezliği (eGFR <30 mL/dakika/1.73 m2 veya CLcr < 30 mL/dakika) olan hastalarda apremilast dozu günde bir kez 30 mg'a azaltılır. 30 mg'lık tek doz apremilast uygulanan şiddetli böbrek yetmezliği olan 8 gönüllüde apremilastın EAA ve Cmaks değerleri sırasıyla yaklaşık %89 ve %42 artmıştır.
Karaciğer yetmezliği:
Apremilast ve majör metaboliti M12'nin farmakokinetiği orta şiddette veya şiddetli karaciğer yetmezliğinden etkilenmez. Karaciğer yetmezliği olan hastalar için herhangi bir doz ayarlaması gerekli değildir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler konvansiyonel güvenlilik farmakolojisi ve tekrarlanan doz toksisitesi çalışmaları temelinde insanlar için özel bir tehlikeyi ortaya koymamıştır. İmmünotoksik potansiyel, dermal irritasyon veya fototoksik potansiyel için kanıt yoktur.
![]()
Fertilite ve erken embriyonikgelişim
fertilitesi üzerinde bir etkiye yol açmamıştır; erkek fertilitesi için advers etki gözlenmeyen düzey (NOAEL) 50 mg/kg/günden fazladır (klinik maruziyetin 3 katı).
10, 20 ,40 ve 80 mg/kg/günlük oral dozajlarla birleştirilmiş bir dişi fare fertilitesi ve embriyo- fetal gelişimsel toksisite çalışmasında 20 mg/kg/gün ve üzerinde östrus sikluslarda uzama ve çiftleşmeye kadar geçen sürede artış gözlenmiştir; buna rağmen farelerin tümü çiftleşmiş ve gebelik oranları etkilenmemiştir. Dişi fertilitesi için advers etki gözlenmeyen düzey (NOEL) 10 mg/kg/gündür (klinik maruziyetin 1.0 katı).
Embriyo-fetal gelişim
10, 20, 40 ve 80 mg/kg/günlük oral dozajlarla birleştirilmiş bir dişi fare fertilitesi ve embriyo- fetal gelişimsel toksisite çalışmasında maternal hayvanların mutlak ve/veya nispi kalp ağırlıkları 20, 40 ve 80 mg/kg/günde artmıştır. Artmış erken rezorpsiyon sayısı ve azalmış kemikleşmiş tarsal sayısı 20, 40 ve 80 mg/kg/günde gözlenmiştir. 40 ve 80 mg/kg/günde supraoksipital kafatası kemiğinin osifikasyonunda gecikme ve azalmış fetal ağırlıklar gözlenmiştir. Farede maternal ve gelişimsel NOEL 10 mg/kg/gündür (klinik maruziyetin 1.3 katı).
Bir maymun embriyo-fetal gelişimsel toksisite çalışmasında 20, 50, 200 ve 1000 mg/kg/günlük oral dozajlar 50 mg/kg/gün ve üzerindeki dozajlarda prenatal kayıpta (düşük) dozla ilişkili bir artışla sonuçlanmıştır; 20 mg/kg/günde (klinik maruziyetin 1.4 katı) prenatal kayıpta test maddesi ile ilişkili bir etki gözlenmemiştir.
Pre-natal ve post-natal gelişim
Bir pre-natal ve post-natal çalışmada apremilast gebe dişi farelere 10, 80 ve 300 mg/kg/gün dozajlarında 6. gestasyon gününden (GG) laktasyonun 20. gününe kadar oral yolla uygulanmıştır. 300 mg/kg/günde maternal vücut ağırlığı ve kilo artışında azalmalar ve yavruların doğurulmasında güçlükle ilişkili bir ölüm gözlenmiştir. Yavruların doğumu ile ilişkili maternal toksisitenin fiziksel belirtileri aynı zamanda 80 ve 300 mg/kg/günün her birinde bir farede gözlenmiştir. ≥80 mg/kg/günde (klinik maruziyetin ≥4.0 katı) artmış pre- natal ve postnatal yavru ölümleri ve laktasyonun ilk haftası sırasında azalmış yavru vücut ağırlıkları gözlenmiştir. Gebelik süresi, gestasyon periyodunun sonunda gebe farelerin sayısı, yavru doğuran farelerin sayısı üzerinde apremilast ile ilişkili etkiler veya doğum sonrası 7. gün ötesinde yavrularda herhangi bir gelişimsel etkiler söz konusu değildir. Postnatal periyodun ilk haftası sırasında gözlenen yavru gelişimsel etkileri muhtemelen apremilast ile ilişkili yavru toksisitesi (azalmış yavru kilosu ve canlılığı) ve/veya maternal bakım eksikliği (yavruların midesinde süt olmaması açısından daha yüksek insidans) ile ilişkilidir. Tüm gelişimsel etkiler postnatal periyodun ilk haftası sırasında gözlenmiştir; sütten kesme öncesi ve sonrası periyotların geri kalanında cinsel olgunlaşma, davranış, çiftleşme, fertilite ve uterin parametreleri dahil olmak üzere apremilastla ilişkili hiçbir etki görülmemiştir. Maternal toksisite ve F1 jenerasyonu için faredeki NOEL 10 mg/kg/gündür (klinik EAA'nın 1.3 katı).
Karsinojenisite çalışmaları
Fareler ve sıçanlarda karsinojenisite çalışmaları apremilast tedavisi ile ilişkili karsinojenisite kanıtı göstermemiştir.
Genotoksisite çalışmaları
Apremilast genotoksik değildir. Apremilast Ames analizinde mutasyonları veya metabolik aktivasyon varlığında veya yokluğunda kültürlenmiş insan periferik kan lenfositlerinde kromozom anomalilerini indüklememiştir. Apremilast 2000 mg/kg/güne varan dozlarda in vivo fare mikronukleus analizinde klastojenik bulunmamıştır.
Diğer çalışmalar
İmmünotoksik, dermal iritasyonveyafototoksikpotansiyeledair kanıta rastlanmamıştır.
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ GENEL BİLGİLERİ
Pharmer Danışmanlık Sağlık Ve Kozmetik Ürünleri Ltd.Şti
| Satış Fiyatı | 3027.86 TL [ 28 Jun 2024 ] |
| Önceki Satış Fiyatı | 3027.86 TL [ 14 Jun 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8680972609139 |
| Etkin Madde | Apremilast |
| ATC Kodu | L04AA32 |
| Birim Miktar | 10+20+30 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 4+4+19 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |