SERONDIR 30 mg film kaplı tablet (56 tablet) Kısa Ürün Bilgisi
{ Apremilast }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SERONDİR 30 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her film kaplı tablet 30 mg Apremilast içerir.
Yardımcı maddeler
Her film kaplı tablet, 171 mg laktoz monohidrat (sığır kaynaklı) içerir. Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Bej renkli, elmas şekilli, bir yüzünde â30â yazılı film kaplı tabletler.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Psöriatik artrit
Apremilast, tek başına veya Hastalığı Modifiye Edici Antiromatizmal İlaçlarla (DMARD'lar) kombinasyon halinde önceki DMARD tedavisine yetersiz yanıt veren veya tolere edemeyen yetişkin hastalarda aktif psöriatik artritin (PsA) tedavisinde endikedir (bölüm 5.1'e bakınız).
Psöriazis
Apremilast siklosporin, metotreksat veya psoralen ve ultraviyole-A ışığı (PUVA) dahil olmak üzere diğer sistemik tedavilere yanıt vermeyen, söz konusu tedavilere karşı kontrendikasyonu veya intoleransı bulunan yetişkin hastalarda orta ve şiddetli kronik plak tipi psöriazisin tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Tedavi, psöriazis veya psöriatik artrit tanı ve tedavisinde deneyimli bir hekim tarafından başlatılmalı ve kontrol edilmelidir.
Apremilastın önerilen dozu yemek kısıtlaması olmaksızın yaklaşık 12 saat arayla sabah ve akşam olmak üzere günde iki kez oral yoldan alınan 30 mg'dır. Aşağıdaki Tablo 1'de gösterildiği şekilde bir başlangıç titrasyon programı gerekmektedir. Başlangıç titrasyonundan sonra başka bir titrasyon gerekli değildir.
Tablo 1: Doz titrasyonu programı
1. Gün | 2. Gün | 3. Gün | 4. Gün | 5. Gün | 6. Gün ve sonrası | |||||
Sabah | Sabah | Akşam | Sabah | Akşam | Sabah | Akşam | Sabah | Akşam | Sabah | Akşam |
10 mg | 10 mg | 10 mg | 10 mg | 20 mg | 20 mg | 20 mg | 20 mg | 30 mg | 30 mg | 30 mg |
Hastalar bir dozu atlarsa, bir sonraki doz mümkün olan en kısa zamanda alınmalıdır. Bir sonraki dozları için zaman yaklaşmışsa atlanan doz alınmamalı ve sonraki doz normal zamanında alınmalıdır.
Pivotal çalışmalar sırasında en fazla iyileşme tedavinin ilk 24 haftası içinde gözlenmiştir. Bir hasta 24 haftadan sonra terapötik fayda kanıtı göstermezse tedavi yeniden değerlendirilmelidir. Hastanın tedaviye yanıtı düzenli olarak değerlendirilmelidir.
Uygulama şekli:
SERONDİR ağızdan kullanım içindir.
SERONDİR film kaplı tabletler aç veya tok karnına bütün olarak yutulmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Hafif ve orta şiddette böbrek yetmezliği olan hastalarda herhangi bir doz ayarlamasına gerek yoktur. Apremilast dozu ciddi böbrek yetmezliği (Cockcroft-Gault denklemi ile hesaplanan dakikada 30 mL'den az kreatinin klirensi) olan hastalarda günde bir kez 30 mg'a azaltılmalıdır. Bu grup hastalarda başlangıç doz titrasyonu için apremilastın sadece Tablo 1'de listelenen SABAH programı kullanılarak titre edilmesi ve AKŞAM dozlarının atlanması önerilir (bölüm 5.2'ye bakınız).
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalar için herhangi bir doz ayarlamasına gerek yoktur (bölüm 5.2'ye bakınız).
Pediyatrik popülasyon:
0-18 yaş arasındaki çocuklarda apremilastın güvenliliği ve etkililiği belirlenmemiştir. Herhangi bir veri mevcut değildir.
Geriyatrik popülasyon:
Bu hasta popülasyonu için herhangi bir doz ayarlamasına gerek yoktur (bölüm 4.8 ve 5.2'ye bakınız).
4.3. Kontrendikasyonlar
Etkin madde
Gebelikte (bölüm 4.6'ya bakınız) kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
İshal, Bulantı ve KusmaPazarlama sonrası apremilast kullanımı ile ilişkili şiddetli ishal, bulantı ve kusma raporları alınmıştır. Çoğu olay tedavinin ilk birkaç haftası içinde meydana gelmiştir. Bazı durumlarda hastalar hastaneye yatırılmıştır. 65 yaş veya üzerindeki hastalar komplikasyonlar açısından daha yüksek risk taşıyabilir. Hastalarda şiddetli ishal, bulantı veya kusma gelişirse apremilast
ile tedavinin kesilmesi gerekebilir.
Psikiyatrik bozukluklar
Apremilast kullanımı, uykusuzluk ve depresyon gibi psikiyatrik bozuklukların artma riski ile ilişkilidir. Depresyon öyküsü olan veya olmayan hastalarda intihar da dahil olmak üzere intihar düşüncesi ve davranışı gözlemlenmiştir (bölüm 4.8'e bakınız). Hastalar öncesine ait veya mevcut psikiyatrik semptomlar bildirirlerse ya da psikiyatrik olaylara neden olması olası diğer tıbbi ürünlerle eşzamanlı tedavi yapılması planlanıyorsa apremilast ile tedaviye başlamanın veya devam etmenin riskleri ve faydaları dikkatli bir şekilde değerlendirilmelidir. Hastalara ve bakıcılarına davranış veya ruh halinde herhangi bir değişikliği veya herhangi bir intihar düşüncesini reçete yazan hekimlerine bildirmeleri söylenmelidir. Hastaların yeni veya kötüleşen psikiyatrik semptomlardan muzdarip olması veya intihar düşüncesi ya da intihar girişimi tespit edildiği durumlarda apremilast ile tedavinin bırakılması önerilir.
Şiddetli böbrek yetmezliği
Apremilast dozu, şiddetli böbrek yetmezliği olan hastalarda günde bir kez 30 mg'a düşürülmelidir (bölüm 4.2 ve 5.2'ye bakınız).
Zayıf hastalar
Tedavinin başlangıcında olması gerekenden zayıf hastaların vücut ağırlıkları düzenli olarak izlenmelidir. Açıklanmayan ve klinik anlamlı kilo kaybı durumunda bu hastalar bir hekim tarafından değerlendirilmeli ve tedavinin kesilmesi düşünülmelidir.
Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Güçlü sitokrom P450 3A4 (CYP3A4) enzim indükleyicisi rifampisinin eşzamanlı uygulanması apremilastın sistemik maruziyetinde bir azalma ile sonuçlanmıştır, bu da apremilast etkinliğinin kaybıyla sonuçlanabilir. Bu nedenle güçlü CYP3A4 enzim indükleyicilerinin (örn., rifampisin, fenobarbital, karbamazepin, fenitoin ve sarı kantaron) apremilast ile kullanımı önerilmemektedir. Apremilastın birden fazla rifampisin dozu ile eşzamanlı uygulanması apremilastın konsantrasyon zaman eğrisi altındaki alan (EAA) ve maksimum serum konsantrasyonu (Cmaks) değerlerinde sırasıyla yaklaşık %72 ve %43 azalma ile sonuçlanmıştır. Apremilast maruziyeti güçlü CYP3A4 indükleyicileri (örn., rifampisin) ile eşzamanlı uygulandığında azalır ve azalmış klinik yanıtla sonuçlanabilir.
Klinik çalışmalarda, apremilast topikal tedavi (kortikosteroidler, katranlı şampuan ve salisilik asit kafa derisi preparatları dahil) ve UVB fototerapisi ile eşzamanlı olarak uygulanmıştır. Ketokonazol ve apremilast arasında klinik olarak anlamlı bir ilaç-ilaç etkileşimi olmamıştır. Apremilast ketokonazol gibi potent bir CYP3A4 inhibitörü ile birlikte uygulanabilir.
Psöriatik artrit hastalarında apremilast ve metotreksat arasında farmakokinetik ilaç-ilaç etkileşimi yoktur. Apremilast metotreksat ile birlikte uygulanabilir.
Apremilast ve etinil östradiol ve norgestimat içeren oral kontraseptifler arasında farmakokinetik ilaç-ilaç etkileşimi olmamıştır. Apremilast oral kontraseptiflerle birlikte uygulanabilir.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
Çocuklarda herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Tedaviye başlamadan önce hastanın gebe olup olmadığı mutlaka kontrol edilmelidir. Çocuk doğurma potansiyeli olan kadınlar tedavi sırasında gebeliği önlemek için etkili bir doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi
Gebe kadınlarda apremilast kullanımı ile ilgili veriler sınırlıdır.
Apremilast gebelik sırasında kontrendikedir. Apremilastın gebelik üzerindeki etkileri halihazırda önerilen en yüksek insan dozundan daha yüksek dozlarda fareler ve maymunlarda embriyofetal kaybı ve farelerde azalmış fetüs ağırlığı ve gecikmiş kemikleşmeyi içermiştir. Klinik maruziyetin 1.3 katı maruziyetle hayvanlarda bu tip etkiler gözlenmemiştir (bölüm 5.3'e bakınız).
Laktasyon dönemi
Apremilast laktasyondaki farelerin sütünde tespit edilmiştir (bölüm 5.3'e bakınız). Apremilastın ya da metabolitlerinin insanlarda anne sütüne geçip geçmediği bilinmemektedir. Emzirilen bebekler için risk dışlanamaz, bu nedenle apremilast emziren annelerde kullanılmamalıdır.
Üreme yeteneği/Fertilite
İnsanlarda fertilite verisi yoktur. Farelerde yürütülen hayvan çalışmalarında klinik maruziyetin 3 katı maruziyet düzeylerinde erkeklerde ve klinik maruziyetin 1 katı maruziyet düzeylerinde dişilerde hiçbir advers etki gözlenmemiştir. Klinik öncesi fertilite verileri için bölüm 5.3'e bakınız.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Apremilastın araç ve makine kullanma becerisi üzerinde bir etkisi yoktur ya da ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özetiPsA ve PSOR'da apremilastın en yaygın bildirilen yan etkileri, ishal (%15.7) ve mide bulantısı (%13.9) dahil olmak üzere gastrointestinal (GI) bozukluklardır. En sık bildirilen diğer yan etkiler arasında üst solunum yolu enfeksiyonları (%8.4), baş ağrısı (%7.9) ve gerilim tipi baş ağrısı (%7.2) yer alır ve çoğunlukla hafif ila orta şiddettedir.
Gastrointestinal yan etkiler genellikle tedavinin ilk 2 haftasında meydana gelir ve genellikle 4 hafta içinde düzelir.
Aşırı duyarlılık reaksiyonları apremilast klinik çalışmalarında nadiren gözlenmiştir (bölüm 4.3'e bakınız).
Apremilast ile tedavi edilen hastalarda ortaya çıkan istenmeyen etkiler Tablo 2'de MedDRA organ sistemine göre sıralanmıştır.
Advers ilaç reaksiyonları apremilast klinik geliştirme programından veriler temelinde belirlenmiştir. Advers ilaç reaksiyonlarının sıklıkları psöriatik artritte yürütülen dört Faz III çalışmanın (n=1945) veya psöriaziste yürütülen iki Faz III çalışmanın (n=1184) ) apremilast kollarında bildirilenlerdir (Tablo 2'de her iki veri havuzuna ait en yüksek sıklık gösterilmektedir).
Advers ilaç reaksiyonları aşağıda tanımlanan sıklığa göre listelenmiştir:
Çok yaygın (ï³1/10); yaygın (ï³1/100 ila <1/10); yaygın olmayan (ï³1/1.000 ila <1/100); seyrek (ï³1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) olarak sınıflandırılır.
Tablo 2. Psöriatik artrit ve/veya psöriazisteki advers reaksiyonların özeti
Sistem Organ Sınıfı | Sıklık | Advers reaksiyon |
Enfeksiyonlar ve enfestasyonlar | Çok yaygın | Üst solunum yolu enfeksiyonu |
Yaygın | Bronşit | |
Nazofarenjit* | ||
Bağışıklık sistemi hastalıkları | Yaygın olmayan | Aşırı duyarlılık |
Metabolizma ve beslenme hastalıkları | Yaygın | İştah azalması * |
Psikiyatrik hastalıklar | Yaygın | Uykusuzluk Depresyon |
Yaygın olmayan | İntihar düşüncesi ve davranışı# | |
Sinir sistemi hastalıkları | Çok yaygın | Baş ağrısı* |
Yaygın | Gerilim tipi baş ağrısı* | |
Migren* | ||
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | Yaygın | Öksürük |
Gastrointestinal hastalıklar | Çok Yaygın | İshal* Bulantı* |
Yaygın | Kusma* Dispepsi Sık bağırsak hareketleri Üst karın ağrısı* Gastrointestinal reflü hastalığı | |
Yaygın olmayan | Gastrointestinal hemoraji | |
Deri ve deri altı doku hastalıkları | Yaygın olmayan | Döküntü Ürtiker |
Bilinmiyor | Anjiyoödem | |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | Yaygın | Sırt ağrısı* |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Yaygın | Yorgunluk |
Araştırmalar | Yaygın olmayan | Kilo kaybı |
*Bu advers reaksiyonlardan en az biri ciddi olarak bildirilmiştir.
Seçili advers reaksiyonların tanımı Psikolojik bozukluklar
#Klinik çalışmalarda ve pazarlama sonrası deneyimde, yaygın olmayan intihar düşüncesi ve davranışı vakaları bildirilirken, pazarlama sonrasında gerçekleştirilmiş intihar bildirilmiştir. Hastalara ve bakıcılarına herhangi bir intihar düşüncesini hekimlerine bildirmeleri söylenmelidir (bölüm 4.4'e bakınız).
Kilo kaybı
Hasta kilosu klinik çalışmalarda rutin olarak ölçülmüştür. Apremilast ile 52 haftaya kadar tedavi edilen hastalarda ortalama gözlenen kilo kaybı 1.99 kg'dır. Apremilast alan hastaların toplamda %14.3'ünde %5-10 arası kilo kaybı gözlenirken, %5.7'sinde %10'dan fazla kilo kaybı gözlenmiştir. Bu hastaların hiçbirinde kilo kaybına bağlı aşikar klinik sonuçlar gelişmemiştir. Apremilast ile tedavi edilen hastaların toplamda %0.1'i azalmış kilo advers reaksiyonu nedeniyle ilacı bırakmıştır.
Tedavinin başlangıcında zayıf olan hastalar için bölüm 4.4'teki ilave uyarıya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Geriyatrik popülasyon:
Pazarlama sonrası deneyime göre 65 yaş ve üstündeki hastalar şiddetli ishal, bulantı ve kusma komplikasyonları açısından daha yüksek risk taşıyabilir.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan psöriatik artritli veya psöriazisli hastalarda apremilastın güvenliliği değerlendirilmemiştir.
Böbrek yetmezliği:
Psöriatik artrit veya psöriazis klinik çalışmalarında, hafif böbrek yetersizliği olan hastalarda gözlenen güvenlilik profili normal böbrek fonksiyonuna sahip hastalardakine benzerdir.
Klinik çalışmalarda orta şiddette veya şiddetli böbrek yetersizliği olan psöriatik artritli veya psöriazisli hastalarda apremilastın güvenliliği değerlendirilmemiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Apremilast sağlıklı gönüllülerde 4.5 gün boyunca 100 mg'lık (50 mg BID olarak verilen) maksimum toplam günlük dozda doz kısıtlayıcı toksisite kanıtı görülmeksizin araştırılmıştır. Bir doz aşımı durumunda hastanın advers etki bulgu ve belirtileri açısından izlenmesi ve uygun semptomatik tedavinin başlatılması önerilir. Doz aşımı durumunda semptomatik ve destekleyici bakım tavsiye edilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
ATC kodu: L04AA32
Etki Mekanizması
Bir oral küçük moleküllü fosfodiesteraz 4 (PDE4) inhibitörü olan apremilast bir pro- inflamatuar ve anti-inflamatuar mediyatör ağını düzenlemek üzere intraselüler olarak iş görür. PDE4, siklik adenozin monofosfata (cAMP) özgü bir PDE'dir ve inflamatuar hücrelerdeki baskın olan PDE'dir. PDE4 inhibisyonu intraselüler cAMP düzeylerini artırır, bu da TNF-âº, IL-23, IL-17 ve diğer inflamatuar sitokinlerin ortaya çıkmasını düzenleyerek inflamatuar yanıtı azaltır. Siklik AMP aynı zamanda IL-10 gibi anti-inflamatuar sitokinlerin düzeylerini de düzenler. Bu pro-inflamatuar ve anti-inflamatuar mediyatörlerin psöriatik artrit ve psöriaziste işe karıştıkları gösterilmiştir.
Farmakodinamik Etkiler
Psöriatik artritli hastalarda yürütülen klinik çalışmalarda, apremilast IL-1âº, IL-6, IL-8, MCP- 1, MIP-1Ã, MMP-3 ve TNF-âº'nın plazma protein düzeylerini tamamen inhibe etmemekle birlikte önemli ölçüde düzenlemiştir. Apremilast ile 40 haftalık tedaviden sonra IL-17 ve IL- 23'ün plazma protein düzeylerinde bir azalma ve IL-10'da bir artış görülmüştür. Psöriazisli hastalarda yürütülen klinik çalışmalarda apremilast lezyonlu deri epidermal kalınlığı, inflamatuar hücre infiltrasyonu ve indüklenebilir nitrik oksit sentaz (iNOS), IL-12/IL-23p40, IL-17A, IL-22 ve IL-8 için olanlar dahil pro-inflamatuar genlerin ekspresyonunu azaltmıştır.
50 mg BID'e varan dozlarda uygulanan apremilast sağlıklı gönüllülerde QT aralığını uzatmamıştır.
Klinik çalışmalar Psöriatik Artrit
Apremilastın güvenliliği ve etkililiği, küçük moleküllü veya biyolojik DMARD'larla önceki tedaviye rağmen aktif psöriatik artritli (≥3 şiş eklem ve ≥3 hassas eklem) yetişkin hastalarda benzer tasarıma sahip 3 çok merkezli, randomize, çift kör, plasebo kontrollü çalışmada (PALACE 1, PALACE 2 ve PALACE 3 Çalışmaları) değerlendirilmiştir. Toplamda 1493 hasta randomize edilmiş ve plasebo, apremilast 20 mg ya da apremilast 30 mg ile günde iki kez oral yolla tedavi edilmiştir.
Bu çalışmalardaki hastalar en az 6 aylık psöriatik artrit tanısına sahipti. PALACE 3'te ayrıca niteleyici bir psöriazis deri lezyonu da (en az 2 cm çapında) gerekliydi. Apremilast küçük moleküllü DMARD'ların stabil dozları ile kombinasyon halinde (%65.2) veya monoterapi (%34.8) olarak kullanılmıştır. Hastalar şunların biri veya daha fazlası ile kombinasyon halinde apremilast almıştır: metotreksat (MTX, ≤ 25 mg/hafta, %54.5), sülfasalazin (SSZ, ≤ 2 g/gün, %9.0) ve leflunomid (LEF; ≤ 20 mg/gün, %7.4). TNF blokerleri dahil olmak üzere biyolojik DMARD'larla eşzamanlı tedaviye izin verilmemiştir. Simetrik poliartrit (%62.0), asimetrik oligoartrit (%26.9), distal interfalangeal (DIP) eklem artriti (%6.2), artritis mutilans (%2.7) ve baskın olarak spondilit (%2.1) dahil her bir psöriatik artrit alt tipindeki hastalar bu 3 çalışmaya kaydedilmiştir. Önceden mevcut entezopati (%63) veya daktilit (%42) görülen hastalar kaydedilmiştir. Hastaların toplamda %7Saklamaya yönelik özel tedbirler tedbirler'ü daha önce sadece küçük moleküllü DMARD'larla tedavi edilirken, hastaların %22.4'ü daha önce biyolojik DMARD'larla tedavi edilmişti (bunların %7.8'inde önceki biyolojik DMARD ile terapötik başarısızlık vardı). Medyan psöriatik artrit hastalık süresi 5 yıldı.
Çalışma tasarımına dayalı olarak, hassas ve şiş eklem sayımları 16. haftada en az %20 iyileşme göstermemiş hastalar yanıt vermeyenler olarak kabul edilmiştir. Yanıt vermeyenler olarak kabul edilen plasebo hastaları 1:1 oranında körlenmiş bir şekilde ya günde iki kez apremilast 20 mg ya da günde iki kez 30 mg'a yeniden randomize edilmiştir. 24. Haftada, tüm
geri kalan plasebo ile tedavi edilen hastalar ya apremilast 20 ya da 30 mg BID'ye geçirilmiştir. 52 haftalık tedaviden sonra hastalar PALACE 1, PALACE 2 ve PALACE 3 çalışmalarının uzun vadeli uzatılması kapsamında açık etiketli apremilast 20 mg veya 30 mg'a 5 yıla varan toplam tedavi süresince (260 hafta) devam edebilmiştir.
Birincil sonlanım noktası 16. haftada Amerikan Romatoloji Derneği (ACR) 20 yanıtını elde eden hastaların yüzdesiydi.
Apremilast ile tedavi 16. haftada plaseboya kıyasla ACR 20 yanıt kriterleri ile değerlendirilen psöriatik artrit bulgu ve semptomlarında anlamlı iyileşmelerle sonuçlanmıştır. 16. Haftada günde iki kez 30 mg apremilast için ACR 20/50/70 elde eden hastaların oranı (PALACE 1, PALACE 2 ve PALACE 3 Çalışmalarındaki yanıtlar ve PALACE 1, PALACE 2 ve PALACE 3 çalışmaları için birleştirilmiş veriler) Tablo 3'te gösterilmektedir. ACR 20/50/70 yanıtları
24. haftada devam etmiştir.
Başlangıçta günde iki kez 30 mg apremilast tedavisine randomize edilmiş hastalar arasında ACR 20/50/70 yanıt oranları birleştirilmiş PALACE 1, PALACE 2 ve PALACE 3 Çalışmalarında 52. haftaya kadar korunmuştur (Şekil 1).
Tablo 3. 16. Haftada PALACE 1, PALACE 2 ve PALACE 3 çalışmaları ve birleştirilmiş çalışmalarda ACR yanıtlarına sahip hastaların oranı
| PALACE 1 | PALACE 2 | PALACE 3 | BİRLEŞTİRİLMİŞ | ||||
N | Plasebo | Apremilast | Plasebo | Apremilast | Plasebo | Apremilast | Plasebo | Apremilast |
| ± | 30 mg BID | ± | 30 mg BID | ± | 30 mg BID | ± | 30 mg BID |
| DMARD | ± | DMARD | ± | DMARD | ± | DMARD | ± |
| N=168 | DMARD | N=159 | DMARD | N=169 | DMARD | N=496 | DMARD |
|
| N=168 |
| N=162 |
| N=167 |
| N=497 |
ACR 20 |
|
|
|
|
|
|
|
|
16. Hafta | %19.0 | %38.1** | %18.9 | %32.1* | %18.3 | %40.7** | %18.8 | %37.0** |
ACR 50 |
|
|
|
|
|
|
|
|
16. Hafta | %6.0 | %16.1* | %5.0 | %10.5 | %8.3 | %15.0 | %6.5 | %13.9** |
ACR 70 |
|
|
|
|
|
|
|
|
16. Hafta | %1.2 | %4.2 | %0.6 | %1.2 | %2.4 | %3.6 | %1.4 | %3.0 |
* Plaseboya karşı apremilast için p≤0.01
** Plaseboya karşı apremilast için p≤0.001
Şekil 1 PALACE 1, PALACE 2 ve PALACE 3 çalışmalarının birleştirilmiş analizinde
52. Haftaya kadar ACR 20/50/70 yanıtı verenlerin oranı (NRI*)
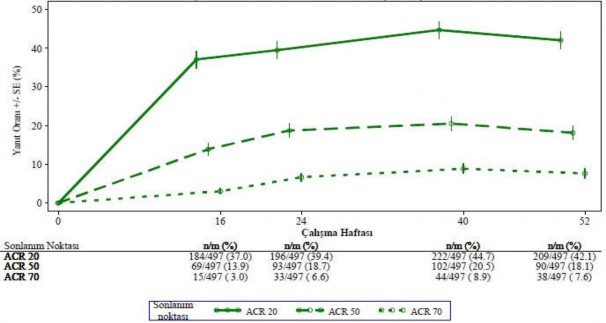
*NRI: Yanıt vermeyen. Zaman noktasından önce ayrılan ve zaman noktasında yanıt durumunun kesin bir şekilde belirlenmesi için yeterli veriye sahip olmayan denekler yanıt vermeyenler olarak sayılmaktadır.
Başlangıçta günde iki kez 30 mg apremilasta randomize edilmiş 497 hasta içerisinden 375 hasta (%75) 52. haftada halen bu tedaviye devam etmekteydi. Bu hastalarda 52. haftadaki ACR 20/50/70 yanıtları sırasıyla %57, %25 ve %11'di. Başlangıçta günde iki kez 30 mg apremilasta randomize edilen 497 hasta arasında 375 hasta (%75) uzun vadeli uzatma çalışmalarına girmiş olup, bunlardan 221 hasta (%59) 260. haftada halen bu tedaviyi almaktaydı. ACR yanıtları uzun vadeli açık etiketli uzatma çalışmalarında 5 yıla kadar korunmuştur.
Apremilast ile tedavi edilen grupta gözlenen yanıtlar MTX dahil eşzamanlı DMARD kullanan ve kullanmayan hastalarda benzerdi. Daha önce DMARD'lar veya biyolojiklerle tedavi edilmiş apremilast alan hastalar 16. haftada plasebo alan hastalardan daha yüksek ACR 20 yanıtı elde etmiştir.
DIP dahil farklı psöriatik artrit alt tiplerinin görüldüğü hastalarda benzer ACR yanıtları gözlenmiştir. Artritis mutilans ve baskın spondilit alt tipleri görülen hastaların sayısı anlamlı değerlendirilebilmek için çok küçüktü.
PALACE 1, PALACE 2 ve PALACE 3'te Hastalık Aktivitesi Ölçeği (DAS) 28 C-reaktif protein (CRP) ve modifiye psöriatik artrit yanıt kriterlerine (PsARC) elde eden hastaların oranındaki iyileşmeler 16. haftada plaseboya kıyasla apremilast grubunda daha yüksekti (nominal p-değeri sırasıyla p≤0.0017, p≤0.0004). Bu iyileşmeler 24. haftada devam etmiştir. Çalışmanın başlangıcında randomize edildikleri apremilast tedavisini sürdüren hastalar arasında DAS28(CRP) skoru ve PsARC yanıtı 52. haftaya kadar korunmuştur.
16 ve 24. haftalarda apremilast ile tedavi edilen hastalarda psöriazis artritin periferik aktivite özelliğine ilişkin parametrelerde (örn., şiş eklem sayısı, ağrılı/hassas eklem sayısı, daktilit ve entezit) ve psöriazisin deri bulgularında iyileşmeler görülmüştür. Çalışmanın başlangıcında randomize edildikleri apremilast tedavisini sürdüren hastalarda bu iyileşmeler 52. haftaya kadar korunmuştur.
Açık etiketli uzatma çalışmalarında 5 yıla varan tedavi boyunca psöriazisin deri bulgularında ve aynı periferik aktivite parametrelerindeki klinik yanıtlar korunmuştur.
Fiziksel fonksiyon ve sağlıkla ilişkili yaşam kalitesi
Apremilast ile tedavi edilen hastalar PALACE 1, PALACE 2 ve PALACE 3 çalışmalarında ve birleştirilmiş çalışmalarda 16. haftada plaseboya kıyasla sağlık değerlendirme anketinin engellilik indeksinde (HAQ-DI) başlangıca göre değişiklik değerlendirildiğinde fiziksel fonksiyonda istatistiksel olarak anlamlı bir iyileşme göstermiştir. HAQ-DI skorlarındaki iyileşme 24. haftada devam etmiştir.
Başlangıçta günde iki kez 30 mg apremilast tedavisine randomize edilmiş hastalar arasında, PALACE 1, PALACE 2 ve PALACE 3 çalışmalarının açık etiketli fazının birleştirilmiş analizinde 52. haftadaki HAQ-DI skorunda başlangıca göre değişiklik günde iki kez 30 mg apremilast grubunda -0.333 idi.
PALACE 1, PALACE 2 ve PALACE 3 çalışmalarında, 16 ve 24. haftalarda plaseboya kıyasla apremilast ile tedavi edilen hastalarda Kısa Form Sağlık Anketi versiyon 2'nin (SF-36v2) fiziksel işlevsellik (PF) domeninde ve Fonksiyonel Kronik Hastalık Tedavisi Değerlendirmesi â Yorgunluk (FACIT-yorgunluk) skorlarında başlangıca göre değişiklikte sağlıkla ilişkili yaşam kalitesinde anlamlı iyileşmeler gösterilmiştir. Çalışmanın başlangıcında randomize edildikleri apremilast tedavisini sürdüren hastalar arasında fiziksel fonksiyon ve FACIT- yorgunluktaki iyileşme 52. haftaya kadar korunmuştur.
HAQ-DI ve SF36v2PF domeni ve FACIT-yorgunluk skorları ile değerlendirildiğinde iyileşmiş fiziksel fonksiyon açık etiketli uzatma çalışmalarında 5 yıllık tedavi boyunca korunmuştur.
Psöriazis
Apremilastın güvenliliği ve etkililiği, orta şiddette ila şiddetli plak psöriazisli, (≥ %10 vücut yüzey alanı (BSA) tutulumu görülen, Psöriazis Alan ve Ciddiyet İndeks (PASI) skoru ≥ 12 olan, statik Hekim Genel Değerlendirmesi (sPGA) ≥ 3 (orta şiddette veya şiddetli) ve fototerapi ya da sistemik tedaviye aday, toplamda 1257 hastanın kaydedildiği iki çok merkezli, randomize, çift kör, plasebo kontrollü çalışmada (ESTEEM 1 ve ESTEEM 2 Çalışmaları) değerlendirilmiştir.
Bu çalışmalar 32. haftaya kadar benzer tasarıma sahiptir. Her iki çalışmada da hastalar 2:1 oranında 16 hafta boyunca apremilast 30 mg BID veya plaseboya (plasebo kontrollü faz) randomize edilmiş ve 16-32. haftalar arası tüm hastalar apremilast 30 mg BID (idame fazı) almıştır. Randomize Tedavinin Geri Çekilme Fazı sırasında (32-52. haftalar) orijinal olarak apremilasta randomize edilmiş, PASI skorlarında %75 azalma (PASI-75) (ESTEEM 1) veya
PASI skorlarında %50 azalma (PASI-50) (ESTEEM 2) elde etmiş hastalar 32. haftada yeniden plasebo veya apremilast 30 mg BID'ye randomize edilmiştir. Plaseboya yeniden randomize edilmiş ve 32. haftada PASI-75 yanıtını (ESTEEM 1) kaybetmiş veya PASI iyileşmesinin
%50'sini kaybetmiş hastalar (ESTEEM 2) apremilast 30 mg BID ile yeniden tedavi edilmiştir.
32. Haftaya kadar belirlenen PASI yanıtına ulaşmamış veya başlangıçta plaseboya randomize edilmiş hastalar, 52. haftaya kadar apremilast tedavisinde kalmıştır. Çalışmalarda yüz, koltukaltı ve kasıkta düşük potensli topikal kortikosteroid, katranlı şampuan ve/veya salisilik asit saç derisi preparatlarının kullanılmasına izin verilmiştir. Buna ilaveten, 32. haftada, ESTEEM 1'de PASI-75 yanıtı veya ESTEEM 2'de PASI-50 yanıtı elde etmemiş deneklerin apremilast 30 mg BID tedavisine ek olarak topikal psöriazis tedavileri ve/veya fototerapi kullanmalarına izin verilmiştir.
52 haftalık tedaviden sonra, hastalar ESTEEM 1 ve ESTEEM 2 çalışmalarının uzun vadeli uzatma çalışmalarıyla 5 yıla kadar toplam tedavi süresi boyunca (260 hafta) açık etiketli apremilast 30mg kullanmaya devam edebilmiştir.
Her iki çalışmada da birincil sonlanım noktası 16. haftada PASI-75 elde eden hastaların oranıdır. Majör ikincil sonlanım noktası 16. haftada temiz (0) ya da neredeyse temiz (1) sPGA
skoru elde etmiş hastaların oranıdır.
Ortalama başlangıç PASI skoru 19.07 (medyan 16.80) olup, başlangıçta sPGA skoru 3 (orta şiddette) ve 4 (şiddetli) olan hastaların oranı %25.19'luk ortalama BYA tutulumu (medyan
%21.0) ile sırasıyla %70.0 ve %29.8 idi. Tüm hastaların yaklaşık %30'u psöriazis tedavisi için daha önce fototerapi ve %54'ü daha önce konvansiyonel sistemik ve/veya biyolojik tedavi görmüş olup (tedavi başarısızlıkları dahil), %37'si daha önce konvansiyonel sistemik tedavi ve %30'u daha önce biyolojik tedavi görmüştü. Hastaların yaklaşık üçte biri daha önce fototerapi, konvansiyonel sistemik veya biyolojik tedavi görmemişti. Hastaların toplamda
%18'i psöriatik artrit öyküsüne sahipti.
PASI-50, -75 ve -90 yanıtları elde eden ve sPGA skoru temiz (0) veya neredeyse temiz (1) olan hastaların oranı aşağıdaki Tablo 4'te sunulmaktadır. Apremilast ile tedavi plaseboya kıyasla 16. haftada PASI-75 yanıtına sahip hastaların oranı ile gösterildiği üzere orta şiddette ila şiddetli plak tipi psöriaziste anlamlı iyileşme ile sonuçlanmıştır. 16. Haftada sPGA, PASI- 50 ve PASI-90 yanıtları ile ölçülen klinik iyileşme gösterilmiştir. Buna ilaveten apremilast kaşıntı, tırnak hastalığı, saç derisi tutulumu ve yaşam kalitesi ölçümleri dahil olmak üzere çeşitli psöriazis bulgularında tedavi faydası göstermiştir.
Tablo 4. ESTEEM 1 ve ESTEEM 2 çalışmalarında 16. haftadaki klinik yanıt (FAS a, LOCFb)
| ESTEEM 1 | ESTEEM 2 | ||
| Plasebo | 30 mg BID APR* | Plasebo | 30 mg BID APR* |
N | 282 | 562 | 137 | 274 |
PASI, n (%) | 15 (5.3) | 186 (33.1) | 8 (5.8) | 79 (28.8) |
sPGA Temiz veya Neredeyse Temiz, n (%) | 11 (3.9) | 122 (21.7) | 6 (4.4) | 56 (20.4) |
PASI 50, n (%) | 48 (17.0) | 330 (58.7) | 27 (19.7) | 152 (55.5) |
PASI 90, n (%) | 1 (0.4) | 55 (9.8) | 2 (1.5) | 24 (8.8) |
Yüzde Değişiklik BYA (%) ortalama ± SD | -6.9 ±38.95 | -47.8 ±38.48 | -6.1 ±47.57 | -48.4 ±40.78 |
Kaşıntı VAS'ında değişiklik (mm), ortalama±SD | -7.3 ±27.08 | -31.5 ±32.43 | -12.2 ±30.94 | -33.5 ±35.46 |
DLQI'da değişiklik, ortalama±SD | -2.1 ±5.69 | -6.6 ±6.66 | -2.8 ±7.22 | -6.7 ±6.95 |
SF-36 MCS'de değişiklik, ortalama±SD | -1.02 ±9.161 | 2.39 ±9.504 | 0.00 ±10.498 | 2.58 ±10.129 |
Apremilastın klinik faydası başlangıç demografikleri ve başlangıç klinik hastalık özellikleri ile tanımlanan (psöriazis hastalığı süresi ve psöriatik artrit öyküsü olan hastalar dahil) çok sayıda alt grup arasında gösterilmiştir.Apremilastınklinikfaydasıay nı zamanda önceki psöriazis ilacı
kullanımı ve önceki psöriazis tedavilerine verilen yanıta bakılmaksızın gösterilmiştir. Tüm kilo aralıklarında benzer yanıt oranları gözlenmiştir.
Apremilasta yanıt, 2. hafta itibariyle plaseboya kıyasla PASI, deride rahatsızlık/ağrı ve kaşıntı dahil psöriazis bulgu ve semptomlarında anlamlı olarak daha fazla iyileşmelerle hızlıydı. Genelde PASI yanıtları 16. hafta itibariyle elde edilmiş ve 32. haftaya kadar devam etmiştir.
Her iki çalışmada da PASI'da başlangıca göre ortalama yüzde iyileşme 32. Haftada apremilasta yeniden randomize edilmiş hastalar için Randomize Tedaviden Çekilme Fazı sırasında stabil kalmıştır (Tablo 5).
Tablo 5. 0. Haftada APR 30 BID'ye randomize edilmiş ve 32. hafta ila 52. haftada APR 30 BID'ye yeniden randomize edilmiş deneklerdeki etkinin kalıcılığı
| Zaman Noktası | ESTEEM 1 | ESTEEM 2 |
32. Haftada PASI-75 elde eden hastalar | 32. Haftada PASI-50 elde eden hastalar | ||
PASI'da başlangıca göre Yüzde Değişiklik (%) ± SD | 16. Hafta | -77.7±20.30 | -69.7±24.23 |
32. Hafta | -88±8.30 | -76.7±13.42 | |
52. Hafta | -80.5±12.60 | -7.8±Saklamaya yönelik özel tedbirler tedbirler1 | |
DLQI'da başlangıca göre değişiklik, ortalama±SD | 16. Hafta | -8.3±6.26 | -74.4±18.91 |
32. Hafta | -8.9±6.68 | -7.8±Saklamaya yönelik özel tedbirler tedbirler1 | |
52. Hafta | -7.8±5.75 | -7.7±5.92 | |
Saç Derisi Psöriazisi PGA'sı (ScPGA) 0 veya 1 olan gönüllülerin oranı, n/N (%) | 16. Hafta | 40/48 (83.3) | 21/37 (56.8) |
32. Hafta | 39/48 (81.3) | 27/37 (73.0) | |
52. Hafta | 35/48 (72.9) | 20/37 (54.1) |
ESTEEM 1 Çalışmasında, 32. haftada apremilasta yeniden randomize edilmiş hastaların yaklaşık %61'i 52. haftada PASI-75 yanıtına sahipti. Randomize Tedaviden Geri Çekilme Fazı sırasında 32. haftada plaseboya yeniden randomize edilmiş en azından PASI-75 yanıtına sahip hastalardan %11.7'si 52. haftada PASI-75 yanıtı veren hastalardı. Plaseboya yeniden randomize edilmiş hastalar arasında PASI-75 yanıtı kaybına kadar geçen medyan süre 5.1 haftaydı.
ESTEEM 2 Çalışmasında, 32. haftada apremilasta yeniden randomize edilmiş hastaların yaklaşık %80.3'ü 52. haftada PASI-50 yanıtına sahipti. 32. Haftada plaseboya yeniden randomize edilmiş en az PASI-50 yanıtına sahip hastalardan %24.2'si 52. haftada PASI-50 yanıtı veren hastalardı. 32. Hafta PASI iyileşmelerinde %50 kayba kadar geçen medyan süre
12.4 haftaydı.
32. Haftada randomize tedaviden geri çekilme sonrasında, ESTEEM 1 Çalışmasındaki hastaların yaklaşık %70'i ve ESTEEM 2 Çalışmasındaki hastaların %65.6'sı apremilast tedavisinin yeniden başlatılmasından sonra PASI-75 (ESTEM 1) veya PASI-50 (ESTEEM 2) yanıtlarını yeniden kazanmıştır. Çalışma tasarımından dolayı yeniden tedavinin süresi değişken olup, 2.6 ile 22.1 hafta arasında değişmiştir.
ESTEEM 1 Çalışmasında, çalışmanın başlangıcında apremilasta randomize edilmiş 32. haftada PASI-75 yanıtı elde etmemiş hastaların, 32 ve 52. haftalar arasında eşzamanlı topikal tedaviler ve/veya UVB fototerapisikullanmalarınaizinverilmiştir. Bu hastalardan %12'si 52.
haftada apremilast artı topikal tedavi ve/veya fototerapi ile PASI-75 yanıtı elde etmiştir. ESTEEM 1 ve ESTEEM 2 Çalışmalarında, 16. haftada plasebo ile tedavi edilen hastalara kıyasla apremilast alan hastalarda Tırnak Psöriazis Şiddet İndeksinde (NAPSI) başlangıca göre ortalama değişiklik yüzdesi ile ölçüldüğü üzere tırnak psöriazisinde anlamlı iyileşmeler (azalmalar) gözlenmiştir (sırasıyla p<0.0001 ve p=0.0052). Apremilast ile tedavi edilmeye devam eden hastalarda 32. haftada tırnak psöriazisinde ilave iyileşmeler gözlenmiştir.
ESTEEM 1 ve ESTEEM 2 Çalışmalarında plasebo ile tedavi edilen hastalara kıyasla apremilast alan hastalarda 16. haftada Saç Derisi Psöriazisi Hekimin Genel Değerlendirmesi (ScPGA) temiz (0) ya da minimum (1) skoru elde etmiş hastaların oranı ile ölçüldüğü üzere en az orta şiddette (≥3) saç derisi psöriazisinde anlamlı iyileşmeler gözlenmiştir. İyileşmeler Apremilasta yeniden randomize edilmiş deneklerde 32. haftadan 52. haftaya genellikle korunmuştur (Tablo 5).
ESTEEM 1 ve ESTEEM 2 Çalışmalarında, plasebo ile tedavi edilen hastalara kıyasla apremilast alan hastalarda Dermatoloji Yaşam Kalitesi İndeksi (DLQI) ve SF-36v2MCS ile ölçülen yaşam kalitesinde anlamlı iyileşmeler görülmüştür (Tablo 4). DLQI'daki iyileşmeler32. haftada apremilasta yeniden randomize edilmiş deneklerde 52. haftaya kadar korunmuştur (Tablo 5). Buna ilaveten, ESTEEM 1 Çalışmasında, plaseboya kıyasla apremilast alan hastalarda İş Kısıtlamaları Anketinde (WLQ-25) anlamlı iyileşme elde edilmiştir.
Başlangıçta günde iki kez 30 mg apremilasta randomize edilmiş 832 hasta arasında 443 hasta (%53) ESTEEM 1 ve ESTEEM 2'nin açık etiketli uzatma çalışmalarına girmiş olup, bunlardan 115 hasta (%26) 260. haftada halen tedavi görmekteydi. ESTEEM 1 ve ESTEEM 2 çalışmalarının açık etiketli uzatmasında apremilasta devam eden hastalar için PASI skoru, etkilenmiş BSA, kaşıntı, tırnak ve yaşam kalitesi ölçümlerinde iyileşmeler genellikle 5 yıla kadar korunmuştur.
Psöriatik artrit ve psöriazis görülen hastalarda günde iki kez 30 mg apremilastın uzun dönem güvenliliği 5 yıla varan toplam tedavi süresince değerlendirilmiştir. Apremilast ile açık etiketli uzatma çalışmalarında uzun dönemli deneyim genellikle 52 haftalık çalışmalardakine benzer olmuştur.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Apremilast yaklaşık 2.5 saatlik medyan sürede (tmaks) meydana gelen pik plazma konsantrasyonları (Cmaks) eşliğinde yaklaşık %73 mutlak oral biyoyararlanım ile iyi düzeyde emilmektedir. Apremilast farmakokinetiği doğrusal olup, günlük 10 ile 100 mg doz aralığında sistemik maruziyette dozla orantılı bir artış söz konusudur. Birikim apremilast günde bir kez uygulandığında minimum ve günde iki kez uygulandığında sağlıklı gönüllülerde yaklaşık
%53 ve psöriazisli gönüllülerde %68'dir. Gıdalarla birlikte uygulama biyoyararlanımı değiştirmediğinden apremilast aç veya tok karnına uygulanabilir.
Dağılım
Apremilastın insan plazma proteinine bağlanması yaklaşık %68'dir. Ortalama görünür dağılım hacmi (Vd) 87L olup, ekstravasküler dağılıma işaret eder.
Biyotransformasyon
Apremilast oksidasyon, hidroliz ve konjugasyon dahil yaygın olarak hem CYP aracılı hem de CYP dışı yolaklarla metabolizeedilir,budatekbirklirensyolağının inhibisyonunun belirgin
ilaç-ilaç etkileşimine neden olmasının muhtemel olmadığını düşündürür. Apremilastın oksidatif metabolizmasına başlıca CYP3A4 aracılık ederken CYP1A2 ve CYP2A6'dan minör katkılar söz konusudur. Apremilast oral uygulamayı takiben dolaşımdaki majör bileşendir. Apremilast, uygulanan ana bileşiğin sırasıyla sadece % 3 ve % 7'sinin idrar ve dışkıda geri kazanılmasıyla yoğun bir metabolizmaya maruz kalır. Dolaşımdaki majör inaktif metabolit O- demetile apremilastın glukuronid konjugatıdır (M12). Apremilastın bir CYP3A4 substratı olması ile tutarlı olarak apremilast maruziyeti güçlü bir CYP3A4 indükleyicisi olan rifampisin ile eşzamanlı uygulandığında azalır.
İn vitro apremilast sitokrom P450 enzimlerinin inhibitörü ya da indükleyicisi değildir. Bu nedenle CYP enzimlerinin substratları ile birlikte uygulanan apremilastın CYP enzimleri ile metabolize edilen etkin maddelerin klirensini ve maruziyetini etkilemesi olası değildir.
İn vitro apremilast bir P-glikoprotein substratı ve zayıf inhibitörüdür (IC50>50µM), bununla birlikte P-gp aracılığıyla klinik açıdan ilgili ilaç etkileşimlerinin meydana gelmesi beklenmemektedir.
İn vitro apremilast Organik Anyon Taşıyıcısı (OAT)1 ve OAT3, Organik Katyon Taşıyıcısı (OKT)2, Organik Anyon Taşıyıcısı Polipeptid (OATP)1B1 ve OATP1B3 veya meme kanseri direnç proteini (BCRP) üzerinde inhibe edici etkiye sahip değildir veya çok az etki söz konusudur ve bu taşıyıcılar için bir substrat değildir. Bu nedenle apremilast bu taşıyıcıların substratları veya inhibitörleri ile birlikte uygulandığında klinik açıdan ilgili ilaç-ilaç etkileşimleri olası değildir.
Eliminasyon
Apremilastın plazma klirensi yaklaşık 9 saatlik bir terminal eliminasyon yarılanma ömrü ile sağlıklı kişilerde ortalama yaklaşık 10 L/saattir. Radyo-etiketli apremilastın oral yolla uygulanmasını takiben radyoaktivitenin yaklaşık %58 ve %39'u sırasıyla idrar ve feçeste geri kazanılırken, radyoaktif dozun sırasıyla %3'ü ve %7'si idrar ve feçeste apremilast olarak geri kazanılmıştır.
Özel popülasyonlar:
Geriyatrik popülasyon:
Apremilast genç ve yaşlı sağlıklı gönüllülerde araştırılmıştır. Yaşlı gönüllülerde (65 ila 85 yaş) maruziyet genç gönüllülere (18 ila 55 yaş) kıyasla apremilast için EAA'da yaklaşık %13 daha yüksek ve C'ta yaklaşık %6 daha yüksektir. Klinik çalışmalarda 75 yaş üzerindeki gönüllülerde farmakokinetik veriler sınırlıdır. Yaşlı hastalar için herhangi bir doz ayarlaması gerekli değildir.
Böbrek yetmezliği:
Hafif veya orta şiddette böbrek yetmezliği olan gönüllüler ve eşleştirilmiş sağlıklı gönüllüler arasında apremilastın FK'sında anlamlı bir fark yoktur (her biri N=8). Bulgular hafif ve orta şiddette böbrek yetmezliği olan hastalarda doz ayarlaması gerekmediğini desteklemektedir. Şiddetli böbrek yetmezliği (eGFR <30 mL/dakika/1.73 m2 veya CLcr < 30 mL/dakika) olan hastalarda apremilast dozu günde bir kez 30 mg'a azaltılır. 30 mg'lık tek doz apremilast uygulanan şiddetli böbrek yetmezliği olan 8 gönüllüde apremilastın EAA ve Cmaks değerleri sırasıyla yaklaşık %89 ve %42 artmıştır.
Karaciğer yetmezliği:
Apremilast ve majör metaboliti M12'nin farmakokinetiği orta şiddette veya şiddetli karaciğer yetmezliğinden etkilenmez. Karaciğer yetmezliği olan hastalar için herhangi bir doz ayarlaması gerekli değildir.
5.3. Klinik öncesi güvenlilik verileri
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet çekirdeğiMikrokristalin selüloz
Laktoz monohidrat (sığır kaynaklı)
Kroskarmelloz sodyum Silikon dioksit Magnezyum stearat
Film kaplama maddesi Hipromelloz
Titanyum dioksit (E171) Makrogol 3350
Demir oksit kırmızı (E172) Demir oksit sarı (E172) Demir oksit siyah (E172)
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Kutuda, 56 film kaplı tablet şeffaf PVC/PE/PVdC - alüminyum folyo blister ambalajlarda kullanma talimatı ile birlikte sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| LEDEZLA | 8699511099041 | 3,743.91TL |
| OPRELAST | 8699586096068 | 3,923.41TL |
| SERONDIR | 8680972609139 | 3,027.86TL |
| Diğer Eşdeğer İlaçlar |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Pharmer Danışmanlık Sağlık Ve Kozmetik Ürünleri Ltd.Şti
| Satış Fiyatı | 6188.08 TL [ 28 Jun 2024 ] |
| Önceki Satış Fiyatı | 6188.08 TL [ 14 Jun 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8680972609115 |
| Etkin Madde | Apremilast |
| ATC Kodu | L04AA32 |
| Birim Miktar | 30 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| Yerli ve Beşeri bir ilaçdır. |