SKYRIZI 150 mg/ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör Kısa Ürün Bilgisi
{ Risankizumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SKYRIZI 150 mg/mL enjeksiyonluk çözelti içeren kullanıma hazır kalem
Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her tek kullanımlık kalem 1 mL çözelti içerisinde 150 mg risankizumab içerir.
Risankizumab, rekombinant DNA teknolojisi kullanılarak Çin hamsteri over hücrelerinde üretilen, interlökin (IL)-23 proteinine karşı seçici bir hümanize immünoglobülin G1 (IgG1) monoklonal antikordur.
Yardımcı maddeler
Sodyum asetat trihidrat 1.24 mg
Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti.
Renksiz ila sarı renkli, berrak ila hafif opalesan çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Plak psöriyazis
SKYRIZI, sistemik tedavilere aday olan ve konvansiyonel sistemik tedavilere (örneğin siklosporin, metotreksat veya fototerapi) yanıt vermeyen, bunların kontrendike olduğu veya bu tedavileri tolere edemeyen erişkin hastalarda orta ile şiddetli plak tip psöriyazis tedavisinde endikedir.
Psöriyatik artrit
SKYRIZI, tek başına veya metotreksat (MTX) ile kombinasyon halinde, bir veya daha fazla hastalık modifiye edici anti-romatizmal ilaç (DMARD) tedavisine yeterli yanıt vermeyen veya bu tedavileri tolere edemeyen erişkin hastalarda aktif psöriyatik artritin tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
SKYRIZI, endike olduğu durumların teşhisi ve tedavisinde uzman bir doktorun gözetimi ve rehberliği altında kullanıma yöneliktir.
Pozoloji/uygulama sıklığı ve süresi:
Önerilen doz, 0. haftada, 4. haftada ve ardından 12 haftada bir subkütan enjeksiyonla uygulanan 150 mg'dır (bir adet 150 mg kullanıma hazır enjektör ya da kullanıma hazır kalem).
16 haftalık tedavinin ardından, tedaviye yanıt vermeyen hastalarda tedavinin kesilmesine yönelik değerlendirme yapılmalıdır. Başlangıçta kısmi yanıt veren bazı plak psöriyazis hastalarında 16 haftayı aşan devamlı tedavinin ardından düzelme görülebilir.
Unutulan doz
Bir dozun unutulması durumunda, doz en kısa sürede uygulanmalıdır. Ardından, doz uygulamasına planlanan şekilde devam edilmelidir.
Uygulama şekli:
SKYRIZI subkütan enjeksiyonla uygulanır. Enjeksiyonlar uyluk ya da karına uygulanmalıdır. Hastalar cildin hassas, morarmış, eritemli, sertleşmiş veya psöriyazisten etkilenmiş bölgelerine enjekte etmemelidir.
Hastalar subkütan enjeksiyon tekniğine ilişkin eğitim aldıktan sonra SKYRIZI'yi kendi kendilerine enjekte edebilirler. Hastalar uygulama öncesinde Kullanma Talimatı'nı okumaları konusunda bilgilendirilmelidir.
SKYRIZI üst kolun dış kısmına sadece bir sağlık çalışanı tarafından uygulanmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek veya karaciğer yetmezliğinin risankizumab farmakokinetiği üzerindeki etkisini değerlendirmek amaçlı özel bir çalışma yürütülmemiştir. Genel olarak, bu rahatsızlıkların monoklonal antikorların farmakokinetiği üzerinde anlamlı bir etkisi olması beklenmemektedir ve bir doz ayarlaması gerekli görülmemektedir (bkz. Bölüm 5.2).
Pediyatrik popülasyon:
5-18 yaş arası hastalarda risankizumabın güvenliliği ve etkililiği belirlenmemiştir. Herhangi bir veri bulunmamaktadır.
Risankizumabın 6 yaşından küçük çocuklarda orta veya şiddetli plak psöriyazis endikasyonu için ya da 5 yaşından küçük çocuklarda psöriyatik artrit endikasyonu için uygun bir kullanımı bulunmamaktadır.
Geriyatrik popülasyon:
Doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).
Aşırı kilolu hastalar:
Doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
SKYRIZI aşağıdaki durumlarda kontrendikedir:
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
İzlenebilirlik
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için, uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
Enfeksiyonlar
Risankizumab enfeksiyon riskini artırabilir.
Kronik enfeksiyonu veya nükseden enfeksiyon hikayesi olan veya enfeksiyon için bilinen risk faktörleri olan hastalarda risankizumab dikkatli kullanılmalıdır. Klinik olarak anlamlı aktif enfeksiyonu olan hastalarda, enfeksiyon iyileşene veya uygun şekilde tedavi edilinceye kadar risankizumab tedavisi başlatılmamalıdır.
Risankizumab ile tedavi edilen hastalar, klinik olarak anlamlı kronik veya akut enfeksiyon belirtileri veya semptomları ortaya çıkarsa tıbbi yardım almaları konusunda bilgilendirilmelidir. Hastada bu tür bir enfeksiyon ortaya çıkması veya hastanın standart enfeksiyon tedavisine yanıt vermemesi durumunda, hasta yakından izlenmelidir ve enfeksiyon geçene kadar risankizumab uygulanmamalıdır.
Tüberküloz
Risankizumab tedavisine başlamadan önce, hastalar tüberküloz (TB) enfeksiyonu için değerlendirilmelidir. Risankizumab alan hastalar, aktif TB belirtileri ve semptomları açısından izlenmelidir. Yeterli tedavi seyrinin doğrulanamadığı, geçmişte latent ya da aktif TB öyküsü olan hastalarda, risankizumaba başlamadan önce anti-TB tedavisi düşünülmelidir.
Aşılamalar
Risankizumab tedavisine başlamadan önce, güncel bağışıklama programına uygun olarak tüm aşıların tamamlanması düşünülmelidir. Bir hastaya canlı aşı yapıldıysa (viral veya bakteriyel), risankizumab ile tedaviye başlamadan önce en az 4 hafta beklemesi önerilir. Risankizumab ile tedavi edilen hastalara tedavi sırasında ve tedaviden sonra en az 21 hafta boyunca canlı aşılar uygulanmamalıdır (bkz. Bölüm 5.2).
Aşırı duyarlılık
Ciddi bir aşırı duyarlılık reaksiyonu oluşursa, risankizumab uygulaması hemen durdurulmalı ve uygun tedavi başlatılmalıdır.
Yardımcı maddeler
Bu tıbbi ürün 150 mg doz başına 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında
“sodyum içermezâ€.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Risankizumabın karaciğer enzimleriyle metabolizasyona veya böbrek eliminasyonuna uğraması beklenmemektedir. Risankizumab ile tıbbi ürün metabolize edici enzim inhibitörleri, indükleyicileri ya da sübstratları arasında etkileşim beklenmemektedir ve doz ayarlaması gerekmemektedir (bkz. Bölüm 5.2).
Eşzamanlı immunosüpresif tedavi veya fototerapi
Biyolojikler veya fototerapi dahil olmak üzere immunosüpresantlarla kombine risankizumabın etkililiği ve güvenliliği araştırılmamıştır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Risankizumabın karaciğer enzimleriyle metabolizasyona veya böbrek eliminasyonuna uğraması beklenmemektedir.
Geriyatrik popülasyon:
65 yaş ve üstü hastalar ile ilgili sınırlı güvenlilik bilgisi bulunmaktadır.
Pediyatrik popülasyon:
5-18 yaş arası hastalarda SKYRIZI'nin güvenliliği ve etkililiği henüz belirlenmemiştir. Herhangi bir veri bulunmamaktadır.
SKYRIZI'nin 6 yaşından küçük çocuklarda orta veya şiddetli plak psöriyazis endikasyonu için uygun bir kullanımı bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar, tedavi süresince ve tedaviden sonra en az 21 hafta boyunca etkili bir doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi
Hamile kadınlarda risankizumab kullanımına dair sınırlı sayıda veri (300'den az hamilelik sonucu) mevcuttur ya da veri bulunmamaktadır.
Gebelikte maruz kalma olgularından gelen veriler, risankizumabın gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli bir epidemiyolojik veri elde edilmemiştir. Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal / fetal gelişim / doğum ya da doğum sonrası gelişim
ile ilgili olarak doğrudan yadado laylızararlıetkilerolduğunu göstermemektedir (bkz. Bölüm
5.3). Önlem amaçlı olarak hamile kadınlarda risankizumab kullanımından kaçınılması tercih
edilebilir.
Laktasyon dönemi
Risankizumabın anne sütüne geçip geçmediği bilinmemektedir. İnsan IgG'nin doğumdan sonraki ilk günlerde anne sütüne geçtiği bilinmekte olup, hemen ardından düşük konsantrasyonlara düşer. Bu sebeple bu kısa dönem sırasında anne sütüyle beslenen bebeklere yönelik risk göz ardı edilemez. Emzirmenin çocuğa yararı ve risankizumab tedavisinin kadına yararı göz önünde bulundurularak risankizumab tedavisinin kesilip kesilmeyeceğine/tedavisinden uzak durulup durulmayacağına karar verilmelidir.
Üreme yeteneği/Fertilite
Risankizumabın insan fertilitesi üzerindeki etkisi değerlendirilmemiştir. Hayvan çalışmaları fertilite açısından doğrudan ya da dolaylı zararlı bir etki göstermemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
SKYRIZI araç ve makine kullanımı üzerinde herhangi bir etkiye sahip değildir ya da etkisi
ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
En sık bildirilen advers reaksiyonlar üst solunum yolu enfeksiyonlarıdır. SKYRIZI ile ilişkili advers etkiler aşağıda Tablo 1'de sunulmaktadır.
Advers reaksiyonların sıklığı, aşağıdaki sınıflandırma kullanılarak tanımlanır.
Psöriyazis ve psöriyatik artrit ile ilgili risankizumaba ilişkin klinik çalışmalardan elde edilen, advers reaksiyonlar (Tablo 1), MedDRA sistem organ sınıfına göre listelenmiştir ve şu düzene dayanmaktadır: çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1.000 ila < 1/100); seyrek (≥ 1/10.000 ila < 1/1.000) ve çok seyrek (< 1/10.000).
Sistem Organ Sınıfı | Sıklık | Advers Reaksiyon |
Enfeksiyonlar ve enfestasyonlar | Çok yaygın | Üst solunum yolu enfeksiyonları |
Yaygın | Tinea enfeksiyonları | |
Yaygın olmayan | Follikülit | |
Sinir sistemi hastalıkları | Yaygın | Baş ağrısı |
Deri ve deri altı doku hastalıkları | Yaygın | Kaşıntı |
Döküntü | ||
Yaygın olmayan | Ürtiker | |
Genel hastalıklar ve uygulama bölgesine ilişkin hastalıklar | Yaygın | Yorgunluk Enjeksiyon yeri reaksiyonları |
(akut dahil), rinit, nazofarenjit, farenjit (viral dahil), tonsilit, larenjit, trakeit Şunları içerir: ayak mantarı,kasıkmantarı, vücuttakitinea,tinea versikolor, tinea manuum, | ||
Tablo 1: Advers reaksiyonların listesi
Seçilmiş advers reaksiyonların tanımlanması
Enfeksiyonlar
Enfeksiyon oranı, uzun süre risankizumaba maruz kalma dahil, psöriyazis klinik çalışmalarında 100 hasta yılında 75,5 olay ve psöriyatik artrit klinik çalışmalarında 100 hasta yılında 43 olay olmuştur. Vakaların çoğu ciddi değildir ve şiddeti hafif ve orta derecededir ve risankizumabın kesilmesine yol açmamıştır. Ciddi enfeksiyon oranı psöriyaz çalışmalarında her 100 hasta yılında 1,7 ve psöriyatik artrit çalışmalarında her 100 hasta yılında 2,6'dır (bkz. Bölüm 4.4).
Psöriyatik artrit
Genel olarak, risankizumab ile tedavi gören psöriyatik artritli hastalarda gözlemlenen güvenlilik profili, plak psöriyazisli hastalarda gözlemlenen güvenlilik profili ile tutarlı olmuştur.
İmmünojenisite
Diğer terapötik proteinler ile olduğu gibi, risankizumab ile immünojenisite gelişme potansiyeli mevcuttur. Antikor oluşumunun saptanması büyük ölçüde testin hassasiyetine ve özgüllüğüne bağlıdır.
Psöriyazis klinik çalışmalarında, önerilen klinik dozda risankizumab ile 52 haftaya kadar tedavi edilen hastalarda, tedavi ile ortaya çıkan anti-ilaç antikorları ve nötralizan antikorlar, değerlendirilen hastaların sırasıyla %24'ünde (263/1.079) ve %14'ünde (150/1.079) tespit edilmiştir.
Birçok psöriyazis hastasında, nötralizan antikorlar da dahil olmak üzere, risankizumaba karşı antikorlar, klinik cevap veya güvenlilikteki değişikliklerle ilişkilendirilmemiştir. Yüksek antikor titrelerine (>128) sahip az sayıdaki (yaklaşık % 1; 16. haftada 7/1.000 ve 52. haftada 6/598) hastalar arasında klinik yanıtın azaldığı görülmüştür. Enjeksiyon yeri reaksiyonlarının görülme sıklığı, kısa süreli (16 hafta: %2,7 - %1,3) ve daha uzun süreli (>52 hafta: %5 - %3,3) tedavi boyunca anti–ilaç antikor-negatif gruba kıyasla anti-ilaç antikor-pozitif grupta sayısal olarak daha yüksektir. Enjeksiyon bölgesi reaksiyonları, hafif ila orta şiddetli derecededir, hiçbiri ciddi değildir ve hiçbiri risankizumabın kesilmesine yol açmamıştır.
Psöriyatik artrit klinik çalışmalarında 28 haftaya kadar önerilen klinik dozda risankizumab ile tedavi gören hastalarda, değerlendirilen hastaların sırasıyla %12,1 (79/652) ve %0'ında (0/652) tedavi sırasında meydana gelen anti-ilaç antikorları ve nötralizan antikorlar tespit edilmiştir. Risankizumaba karşı antikorlar, psöriyatik artrit için güvenlilik ya da klinik yanıttaki değişikliklerle ilişkilendirilmemiştir.
Özel popülasyonlara ilişkin ek bilgiler:
Geriyatrik popülasyon:
65 yaş ve üstü hastalar ile ilgili sınırlı güvenlilik bilgisi bulunmaktadır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Doz aşımı durumunda, hastanın advers reaksiyonlara ilişkin belirti ve semptomlara karşı izlenmesi ve uygun semptomatik tedavinin derhal uygulanması tavsiye edilmektedir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosüpresanlar, interlökin inhibitörleri
ATC kodu: L04AC18
Etki mekanizması
Risankizumab, IL-12'ye bağlanmadan insan interlökin 23 (IL-23) sitokininin p19 alt birimine yüksek afiniteyle seçici olarak bağlanan ve IL-23 reseptör kompleksiyle etkileşimini inhibe eden bir hümanize immünoglobulin G1 (IgG1) monoklonal antikorudur. IL-23 enflamatuvar ve immün yanıtlara katılan bir sitokindir. Risankizumab, IL-23'ün reseptörüne bağlanmasını bloke ederek IL-23 bağımlı hücre sinyalini ve pro-enflamatuvar sitokinlerin salınmasını inhibe eder.
Farmakodinamik etkiler
Psöriyazisi olan hastaları içeren bir çalışmada, IL-23/IL-17 ekseni ile ilişkili genlerin ekspresyonu, tek doz risankizumabın ardından deride azalmıştır. Ayrıca psöriyatik lezyonlarda epidermal kalınlıkta, enflamatuvar hücrelerin infiltrasyonunda ve psöriyatik hastalık belirteçlerinin ekspresyonunda azalma gözlemlenmiştir.
Psöriyatrik artritli hastaları içeren bir çalışmada, 0. hafta, 4. hafta ve sonrasında 12 haftada bir subkütan olarak 150 mg risankizumab ile tedavinin ardından, serum IL-17A, IL-17F ve IL-22 dahil olmak üzere IL-23 ve IL-17 ile ilişkili biyobelirteçlerde 24. haftada başlangıca göre istatistiksel ve klinik açıdan anlamlı bir azalma gözlemlenmiştir.
Klinik etkililik ve güvenlilik
Plak psöriyazis
Risankizumabın etkililiği ve güvenliliği çok merkezli, randomize, çift kör dört çalışmada (ULTIMMA-1, ULTIMMA-2, IMMHANCE ve IMMVENT) orta veya şiddetli plak psöriyazisi olan 2.109 hastada değerlendirilmiştir. Kaydedilen hastalar 18 yaş ve üzerinde, plak psöriyazisi olan, vücut yüzey alanı (VYA) tutulumları ≥%10 olan, genel değerlendirmede (plak kalınlığı/sertliği, eritem ve pullanma) psöriyazis için 0 ila 4 şiddet skalasındaki, statik Doktor Global Değerlendirme (static Physician Global Assessment, sPGA) skoru ≥3 olan ve Psöriyazis Alan ve Şiddet Endeksi (Psoriasis Area and Severity Index, PASI) skoru ≥12 olan ve sistemik tedavi veya fototerapi için aday olan hastalardır.
| ULTIMMA-1 | ULTIMMA-2 | ||||
| Risankizumab (N=304) n (%) | Ustekinumab (N=100) n (%) | Plasebo (N=102) n (%) | Risankizumab (N=294) n (%) | Ustekinumab (N=99) n (%) | Plasebo (N=98) n (%) |
sPGA temiz veya neredeyse temiz (0 veya 1) | ||||||
16. hafta | 267 (87,8) | 63 (63,0) | 8 (7,8) | 246 (83,7) | 61 (61,6) | 5 (5,1) |
52. hafta | 262 (86,2) | 54 (54,0) | -- | 245 (83,3) | 54 (54,5) | -- |
sPGA temiz (0) | ||||||
16. hafta | 112 (36,8) | 14 (14,0) | 2 (2,0) | 150 (51,0) | 25 (25,3) | 3 (3,1) |
52. hafta | 175 (57,6) | 21 (21,0) | -- | 175 (59,5) | 30 (30,3) | -- |
PASI 75 | ||||||
12. hafta | 264 (86,8) | 70 (70,0) | 10 (9,8) | 261 (88,8) | 69 (69,7) | 8 (8,2) |
52. hafta | 279 (91,8) | 70 (70,0) | -- | 269 (91,5) | 76 (76,8) | -- |
PASI 90 | ||||||
16. hafta | 229 (75,3) | 42 (42,0) | 5 (4,9) | 220 (74,8) | 47 (47,5) | 2 (2,0) |
52. hafta | 249 (81,9) | 44 (44,0) | -- | 237 (80,6) | 50 (50,5) | -- |
PASI 100 | ||||||
16. hafta | 109 (35,9) | 12 (12,0) | 0 (0,0) | 149 (50,7) | 24 (24,2) | 2 (2,0) |
-- | ||||||
Genel olarak, hastaların medyan başlangıç PASI skoru 17,8'dir ve medyan VYA değeri
%20'dir ve medyan başlangıç Dermatoloji Yaşam Kalite İndeksi (Dermatology Life Quality Index, DLQI) değeri 13'tür. Başlangıç sPGA skoru hastaların %19,3'ünde şiddetli ve % 80,7'sinde orta derecelidir. Çalışma hastalarının toplam %9,8'inde tanı konmuş psöriyatik artrit hikayesi vardır.
Tüm çalışmalar boyunca psöriyazis tedavisi için hastaların %30,9'u hiçbir sistemik (biyolojik olmayan ve biyolojik dahil) tedavi görmemiştir, %38,1'i daha önce fototerapi ya da fotokemoterapi almıştır, %48,3'ü daha önce biyolojik olmayan sistemik tedavi almıştır, %42,1'i daha önce biyolojik tedavi almıştır ve %23,7'si en az bir anti-TNF alfa ajanı almıştır.
ULTIMMA-1 ve ULTIMMA-2
ULTIMMA-1 ve ULTIMMA-2 çalışmalarına 997 hasta kaydedilmiştir (598'i risankizumab 150 mg, 199'u ustekinumab 45 mg veya 90 mg [başlangıç ağırlığına göre] ve 200'ü plasebo almak üzere randomize edilmiştir). Hastalar 0. haftada, 4. haftada ve ardından 12 haftada bir tedavi almıştır. ULTIMMA-1 ve ULTIMMA-2 için iki ko-primer sonlanım noktası, 1) PASI 90 cevabına ve 2) plaseboya karşı 16. haftada temiz ya da neredeyse temiz sPGA skoruna (sPGA 0 ya da 1) ulaşan hasta oranıdır. Ko-primer ve diğer sonlanım noktaları için sonuçlar Tablo 2'de ve Şekil 1'de gösterilmektedir.
Tablo 2: ULTIMMA-1 ve ULTIMMA-2 çalışmalarında plak psöriyazisi olan yetişkinlerdeki etkililik ve yaşam kalitesi sonuçları
DLQI 0 ya da 1 | ||||||
16. hafta | 200 (65,8) | 43 (43,0) | 8 (7,8) | 196 (66,7) | 46 (46,5) | 4 (4,1) |
52. hafta | 229 (75,3) | 47 (47,0) | -- | 208 (70,7) | 44 (44,4) | -- |
PSS 0 (semptomsuz) | ||||||
16. hafta | 89 (29,3) | 15 (15,0) | 2 (2,0) | 92 (31,3) | 15 (15,2) | 0 (0,0) |
52. hafta | 173 (56,9) | 30 (30,0) | -- | 160 (54,4) | 30 (30,3) | -- |
Risankizumabın ustekinumab ve plasebo ile bütün karşılaştırmalarında, ULTIMMA-2 çalışmasının 52. haftasında p=0,001 değerinin elde edildiği PASI 75 hariç olmak üzere, p<0,001 değeri elde edilmiştir. | ||||||
Şekil 1: ULTIMMA-1 ve ULTIMMA-2'de PASI başlangıcına göre ortalama yüzde değişim süreci
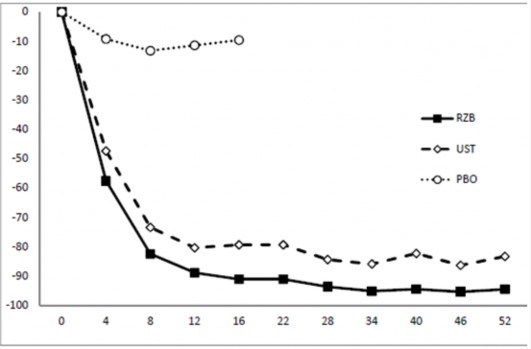
PASI Başlangıca Göre Yüzde Değişim
RZB = risankizumab UST = ustekinumab PBO = plasebo
her bir zaman noktasında p<0,001
Hafta
Yaş, cinsiyet, ırk, vücut ağırlığı ≤130 kg, başlangıç PASI skoru, eşzamanlı psöriyatik artrit, geçmişteki bir biyolojik olmayan sistemik tedavi, geçmişteki bir biyolojik tedavi ve geçmişteki bir biyolojik tedavi başarısızlığına ilişkin incelemede, bu alt gruplarda risankizumaba karşı verilen cevap açısından herhangi bir fark tespit edilmemiştir.
Risankizumab ile tedavi edilen hastalarda, 16. haftada ve 52. haftada kafa derisi, tırnaklar, avuç içi ve ayak tabanını içeren psöriyazisde iyileşmeler gözlemlenmiştir.
Tablo 3: NAPSI, PPASI ve PSSI'de başlangıçtan ortalama değişiklikler
| ULTIMMA-1 | ULTIMMA-2 | IMMHANCE | |||
| Risankizumab | Plasebo | Risankizumab | Plasebo | Risankizumab | Plasebo |
NAPSI: 16.haftadaki değişiklikler (SE) |
N=178; -9,0 (1,17) |
N=56; 2,1 (1,86) *** |
N=177; -7,5 (1,03) |
N=49; 3,0 (1,76) *** |
N=235; -7,5 (0,89) |
N=58; 2,5 (1,70) *** |
PPASI: |
|
|
|
|
|
|
16.haftadaki |
| N=34; |
| N=23; |
| N=26; |
değişiklikler | N=95; | -3,17 | N=86; | -3,74 | N=113; | -0,27 |
(SE) | -5,93 (0,324) | (0,445) | -7,24 (0,558) | (1,025) | -7,39 (0,654) | (1,339) |
|
| *** |
| ** |
| *** |
PSSI: |
|
|
|
|
|
|
16.haftadaki |
| N=92; |
| N=83; |
| N=88; |
değişiklikler | N=267; | -2,9 | N=252; | -4,6 | N=357; | -5,5 |
(SE) | -17,6 (0,47) | (0,69) | -18,4 (0,52) | (0,82) | -20,1 (0,40) | (0,77) |
|
| *** |
| *** |
| *** |
NAPSI: |
|
|
|
|
|
|
52.haftadaki değişiklikler (SE) |
N=178; -15,7 (0,94) |
- |
N=183; -16.7 (0,85) |
- |
- |
- |
PPASI: |
|
|
|
|
|
|
52.haftadaki değişiklikler (SE) | N=95; -6,16 (0,296) |
- | N=89; -8,35 (0,274) |
- |
- |
- |
PSSI: |
|
|
|
|
|
|
52.haftadaki |
|
|
|
|
|
|
değişiklikler (SE) | N=269; -17,9 (0,34) |
- | N=259; -18,8 (0,24) |
- |
- |
- |
Tırnak Psöriyazis Şiddet İndeksi (NAPSI), Palmoplantar Psöriyazis Şiddet İndeksi (PPASI), Kafa Derisi Psöriyazisi Şiddet İndeksi (PSSI), and Standart Hata (SE)
** p < 0,01 risankizumab ile karşılaştırıldığında *** p < 0,001 risankizumab ile karşılaştırıldığında | ||||||
Hastane Anksiyete ve Depresyon Skalası (HADS) ile ölçülen anksiyete ve depresyon, risankizumab grubunda 16. haftada plasebo grubuna göre düzelmiştir.
Yanıtın korunması
ULTIMMA-1 ve ULTIMMA-2 çalışmalarında risankizumab alan hastaların entegre analizinde,
16. haftada PASI 100 cevabı verenler için, risankizumaba devam eden hastaların %79,8'i (206/258) 52. haftaya kadar cevap vermeyi sürdürmüştür. 16. haftada PASI 90 cevabı verenler için hastaların %88,4'ü (398/450) 52. haftaya kadar cevap vermeyi sürdürmüştür.
Risankizumaba 77 haftaya kadar maruz kalındığında güvenlilik profili, 16 haftaya kadar gözlemlenen profille tutarlı olmuştur.
IMMHANCE
IMMHANCE çalışmasına 507 hasta kaydedilmiştir (407 hasta risankizumab 150 mg almak üzere ve 100 hasta plasebo almak üzere randomize edilmiştir). Hastalar 0. haftada, 4. haftada ve ardından 12 haftada bir tedavi almıştır. Başlangıçtan itibaren risankizumab almakta olan ve
28. haftada sPGA yanıtı temiz ila neredeyse temiz olan hastalar 88. haftaya kadar 12 haftada bir risankizumab almak üzere yeniden randomize edilmiştir (son risankizumab dozundan itibaren 16 haftaya kadar takip edilmiştir) veya tedaviden ayrılmıştır.
16. haftada, risankizumab sPGA skoru temiz ila neredeyse temiz (risankizumab ile %83,5'e karşı plasebo ile %7) ve PASI 90 (risankizumab ile %73,2'ye karşı plasebo ile %2) ko-primer sonlanım noktalarında plasebodan üstündür.
IMMHANCE çalışmasında yer alan ve latent tüberkülozlu (TB) olduğu belirlenip çalışma boyunca profilaksi almayan 31 hastanın hiçbirinde, risankizumab ile 55 haftalık ortalama takip süresince aktif TB gelişmemiştir.
IMMHANCE'de 28. haftada temiz veya neredeyse temiz sPGA'ya sahip hastalar arasında, risankizumab ile tedaviye devam etmek için yeniden randomize edilen hastaların % 81,1'i (90/111), risankizumab tedavisi kesilmek üzere yeniden randomize edilen %7,1'e (16/225) kıyasla bu yanıtı 104. haftada sürdürdü. Bu hastalardan, risankizumab ile tedaviye devam etmesi için yeniden randomize edilen hastaların % 63,1'i (70/111), risankizumab tedavisi kesilmek üzere yeniden randomize edilen %2,2'ye (5/225) kıyasla 104. haftada temiz bir sPGA yanıtına ulaşmıştır.
hafta sonunda sPGA skoru temiz veya neredeyse temiz olan, ancak tedavileri kesildikten sonra orta ve şiddetli sPGA yanıtlarına nüks eden hastaların %83,7'si (128/153), tedaviye yeniden başladıklarında, sPGA skorunda temiz ve neredeyse temiz değerini 16. haftada geri kazanmıştır. Temiz ve neredeyse temiz sPGA yanıtlarının kaybı, ilk doz atlandıktan 12 hafta sonra gözlemlenmiştir. Tedavisi kesilen gruba randomize edilen hastaların %80,9'unda (182/225) nüks gözlemlenirken, nüks görülmesine kadar geçen ortalama süre 295 gün olmuştur. Bireysel olarak hasta seviyesinde tekrar yanıt alma ihtimalinin ya da yanıt kaybı süresinin öngörülebilmesi için herhangi bir karakteristik özellik tanımlanmamıştır.
IMMVENT
ardından 15. haftaya kadar iki haftada bir 40 mg tedavi almıştır. 16. haftadan itibaren, adalimumab almakta olan hastalar yanıta bağlı olarak tedaviye devam etmiştir veya başka tedaviye geçiş yapmıştır:
<PASI 50 yanıtlı hastalar risankizumab tedavisine geçmiştir
PASI 50 ila <PASI 90 yanıtı olan hastalar adalimumab tedavisine devam etmek veya risankizumab tedavisine geçiş yapmak üzere yeniden randomize edilmiştir.
PASI 90 yanıtını sağlayan hastalar adalimumab tedavisi ile devam etmiştir.
5.2. Farmakokinetik özellikler
Risankizumabın farmakokinetiği, plak psöriyazisi olan hastalar ve psöriyatik artriti olan hastalar arasında benzerdir.
Genel özellikler
Emilim:
Risankizumab, subkütan olarak uygulanan 18 ila 300 mg ve 0,25 ila 1 mg/kg ve ayrıca intravenöz olarak uygulanan 200 ila 1.200 mg ve 0,01 ila 5 mg/kg doz aralıklarındaki maruziyette, doz orantılı artışla birlikte doğrusal farmakokinetik sergilemiştir.
Risankizumabın subkütan dozlamasının ardından, tahmini %89 mutlak biyoyararlanımla birlikte dozlamadan sonra 3 ila 14 gün arasında tepe plazma konsantrasyonlarına ulaşılmıştır.
0. haftada, 4. haftada ve bunun ardından 12 haftada bir 150 mg şeklindeki dozlama rejiminde tahmini kararlı durum tepe konsantrasyonu ve tahmini çukur plazma konsantrasyonları sırasıyla 12 ve 2 mikrogram/mL'dir.
Dağılım:
Faz 3 çalışmalarında psöriyazisi olan hastalarda risankizumabın ortalama (±standart sapma) kararlı durum dağılım hacmi (V) 11,4 (±2,7) L olup, risankizumabın dağılımının öncelikli olarak vasküler ve interstisyel boşluklarla sınırlı olduğunu göstermektedir.
Biyotransformasyon:
Terapötik IgG monoklonal antikorlar tipik olarak, endojen IgG'ler ile aynı şekildeki katabolik yollarla küçük peptitler ve amino asitlere bozunur. Risankizumabın sitokrom P450 enzimleri tarafından metabolize edilmesi beklenmemektedir.
Eliminasyon:
Faz 3 çalışmalarında psöriyazisi olan hastalarda risankizumabın ortalama (±standart sapma) sistemik klerensi (CL) 0,3 (±0,1) L/gündür ve risankizumabın ortalama terminal eliminasyon yarılanma ömrü, Faz 3 çalışmalarında psöriyazisi olan hastalarda 28-29 gün aralığındadır.
Bir IgG1 monoklonal antikoru olarak risankizumabın böbreklerde glomerüler filtrasyonla süzülmesi veya değişmemiş molekül olarak idrarla atılması beklenmemektedir.
Doğrusallık/doğrusal olmayan durum:
Risankizumab, sağlıklı hastalarda veya psöriyazisi olan hastalarda subkütan olarak uygulanan 18 ila 300 mg ya da 0,25 ila 1 mg/kg doz aralığı değerlendirmelerinde sistematik maruziyette (Cve EAA) yaklaşık olarak doz orantılı artışla birlikte doğrusal farmakokinetik sergilemiştir.
Etkileşimler
Plak psöriyazisi olan hastalarda, risankizumabın tekrarlanan uygulamasının sitokrom P450 (CYP) duyarlı prob substratlarının farmakokinetiği üzerindeki etkisini değerlendirmek için bir etkileşim çalışması yürütülmüştür. Risankizumab tedavisinin ardından kafein (CYP1A2 substratı), varfarin (CYP2C9 substratı), omeprazol (CYP2C19 substratı), metoprolol (CYP2D6 substratı) ve midazolam (CYP3A substratı) maruziyeti, risankizumab tedavisi öncesideki maruziyetleriyle karşılaştırılabilir ölçüde idi, bu da bu enzimlerle klinik olarak anlamlı etkileşim olmadığını belirtmektedir.
Popülasyon farmakokinetik analizleri risankizumab maruziyetinin, klinik çalışmalar sırasında plak psöriyazisi olan ya da psöriyatik artriti olan hastalar tarafından kullanılan eşzamanlı tedaviler tarafından etkilenmediğini göstermektedir.
Hastalardaki karekteristik özellikler
Pediyatrik popülasyon:
Risankizumabın pediyatrik hastalardaki farmakokinetiği belirlenmemiştir.
Yaşlı popülasyon:
Risankizumabı kullanan plak psöriyazisli 2.234 hasta arasından 243'ü 65 yaş veya üstü olup, 24 hasta ise 75 yaş veya üstüdür. Risankizumabı kullanan psöriyatrik artritli 1.542 hastanın 246'sı 65 yaş veya üstü, 34'ü ise 75 yaş veya üstüdür. Risankizumab alan yaşlı ve genç hastalar arasında risankizumab maruziyetinde genel bir farklılık gözlemlenmemiştir.
Karaciğer / böbrek yetmezliği:
Karaciğer ya da böbrek yetmezliğinin risankizumabın farmakokinetiği üzerindeki etkisini değerlendirmek amaçlı özel bir çalışma yürütülmemiştir. Popülasyon farmakokinetik analizlerine dayanarak, serum kreatinin seviyeleri, kreatinin klerensi veya karaciğer fonksiyon belirteçleri (ALT/AST/bilirubin), plak psöriyazisli ya da psöriyatik artritli hastalarda risankizumabın klerensi üzerinde anlamlı bir etki göstermemiştir.
IgG1 monoklonal antikoru olarak, risankizumab temelde hücre içi katabolizmayla elimine edilir ve karaciğer P450 sitokrom enzimleri ya da böbrek eliminasyonuyla metabolizmaya uğraması beklenmemektedir.
Vücut ağırlığı:
Risankizumab klerensi ve dağılım hacmi vücut ağırlığı ile birlikte artar, bu da vücut ağırlığının yüksek olduğu (> 130 kg) hastalarda etkililiği azaltabilir. Ancak, bu gözlem sınırlı sayıda hastayı temel almaktadır. Halen vücut ağırlığına göre doz ayarlaması önerilmemektedir.
Cinsiyet veya ırk:
Risankizumabın klerensi plak psöriyazisi olan ya da psöriyatik artriti olan yetişkin hastalarda cinsiyet veya ırktan anlamlı ölçüde etkilenmemiştir. Bir klinik farmakokinetik çalışmasında, beyaz ırk hastalarına kıyasla, Çinli veya Japon hastalarda risankizumab maruziyeti bakımından klinik olarak anlamlı farklılıklar gözlemlenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler, güvenlilik farmakolojisi değerlendirmeleri dahil tekrar-doz toksisitesi çalışmalarına ve sinomolgus maymunlarında 50 mg/kg/hafta'ya kadar dozlarda (maksimum önerilen insan dozundaki (MRHD) klinik maruziyetin yaklaşık 70 katı düzeyinde maruziyet üreten) gerçekleştirilen bir üreme toksisitesi ve gelişimsel toksisite çalışmasına dayanarak, insanlar için özel bir tehlike ortaya koymamıştır.
Risankizumab ile mutajenisite ve karsinojenisite çalışmaları gerçekleştirilmemiştir. Sinomolgus maymunlarında 50 mg/kg/hafta'ya kadar dozlarda (MRHD'de klinik maruziyetin yaklaşık 70 katı) gerçekleştirilen 26 haftalık bir kronik toksikoloji çalışmasında pre-neoplastik veya neoplastik lezyonlar gözlemlenmemiştir ve advers immunotoksisite ya da advers kardiyovasküler etkiler kaydedilmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum asetat trihidrat (E262) Asetik asit (E260)
Trehaloz dihidrat Polisorbat 20 Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimlilik çalışmaları mevcut olmadığından, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
2ºC-8ºC arasında buzdolabında saklanmalıdır. Dondurulmamalıdır.
Kullanıma hazır kalem, ışıktan korunmak için, kullanım anına kadar orijinal ambalaj kutusunda saklanmalıdır.
Skyrizi 150 mg kullanıma hazır kalem, ışıktan korumak için orijinal ambalaj kutusunda, buzdolabının dışında (maksimum 25°C'ye kadar) 24 saate kadar saklanabilir.
6.5. Ambalajın niteliği ve içeriği
SKYRIZI otomatik iğne kılıfına sahip kullanıma hazır kaleme yerleştirilmiş kullanıma hazır cam enjektör içerisinde bulunmaktadır.
Her bir ambalaj, 1 adet kullanıma hazır kalem içermektedir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Enjeksiyondan önce kutu buzdolabından çıkarılır ve kutudan çıkartmadan kullanıma hazır kalemlerin, doğrudan güneş ışığı almayacak şekilde (30 ila 90 dakika süreyle) oda sıcaklığına gelmesi beklenmelidir.
Çözelti, renksiz ila sarı renkli ve berrak ila hafif opalesan olmalıdır.
Genel özel önlemler
Kullanım öncesinde, kullanıma hazır kalemlerin her birinin gözle kontrol edilmesi tavsiye edilmektedir. Çözelti ürün ile ilgili birkaç yarısaydam veya beyaz renkte partikül içerebilir. Çözeltinin bulanık olması veya renginde değişiklik olması veya büyük parçacıkları içermesi durumunda SKYRIZI kullanılmamalıdır.
Kullanma Talimatı'nda ürünün kullanımına dair kapsamlı bilgi sunulmuştur. Her kullanıma hazır kalem yalnızca tek kullanımlıktır.
Tüm kullanılmayan ürün veya atık maddeler “Tıbbi Atıkların Kontrolü†ve “Ambalaj Atıklarının Kontrolü†yönetmeliklerine uygun olarak imha edilmelidir.
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
AbbVie Tibbi İlaçlar San. Tic. Ltd. Şti.
| Satış Fiyatı | 60935.83 TL [ 25 Apr 2025 ] |
| Önceki Satış Fiyatı | 60935.83 TL [ 18 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8680656080599 |
| Etkin Madde | Risankizumab |
| ATC Kodu | L04AC18 |
| Birim Miktar | 150 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |