SKYRIZI 75 mg/0.83 ml enjeksiyonluk çözelti içeren kullanımahazır enjektör (2 adet) Farmakolojik Özellikler
{ Risankizumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosüpresanlar, interlökin inhibitörleri
ATC kodu: L04AC18
Etki mekanizması
Risankizumab, IL-12'ye bağlanmadan insan interlökin 23 (IL-23) sitokininin p19 alt birimine yüksek afiniteyle seçici olarak bağlanan ve IL-23 reseptör kompleksiyle etkileşimini inhibe eden bir hümanize immünoglobulin G1 (IgG1) monoklonal antikorudur. IL-23 enflamatuvar ve immün yanıtlara katılan bir sitokindir. Risankizumab, IL-23'ün reseptörüne bağlanmasını bloke ederek IL-23 bağımlı hücre sinyalini ve pro-enflamatuvar sitokinlerin salınmasını inhibe eder.
Farmakodinamik etkiler
Psöriyazisi olan hastaları içeren bir çalışmada, IL-23/IL-17 ekseni ile ilişkili genlerin ekspresyonu, tek doz risankizumabın ardından deride azalmıştır. Ayrıca psöriyatik lezyonlarda epidermal kalınlıkta, enflamatuvar hücrelerin infiltrasyonunda ve psöriyatik hastalık belirteçlerinin ekspresyonunda azalma gözlemlenmiştir.
Klinik etkililik ve güvenlilik
Plak psöriyazis
Risankizumabın etkililiği ve güvenliliği çok merkezli, randomize, çift kör dört çalışmada (ULTIMMA-1, ULTIMMA-2, IMMHANCE ve IMMVENT) orta veya şiddetli plak psöriyazisi olan 2.109 hastada değerlendirilmiştir. Kaydedilen hastalar 18 yaş ve üzerinde, plak psöriyazisi olan, vücut yüzey alanı (VYA) tutulumları ≥%10 olan, genel değerlendirmede (plak kalınlığı/sertliği, eritem ve pullanma) psöriyazis için 0 ila 4 şiddet skalasındaki, statik Doktor Global Değerlendirme (static Physician Global Assessment, sPGA) skoru ≥3 olan ve Psöriyazis Alan ve Şiddet Endeksi (Psoriasis Area and Severity Index, PASI) skoru ≥12 olan ve sistemik tedavi veya fototerapi için aday olan hastalardır.
Genel olarak, hastaların medyan başlangıç PASI skoru 17,8'dir ve medyan VYA değeri
%20'dir ve medyan başlangıç Dermatoloji Yaşam Kalite İndeksi (Dermatology Life Quality Index, DLQI) değeri 13'tür. Başlangıç sPGA skoru hastaların %19,3'ünde şiddetli ve % 80,7'sinde orta derecelidir. Çalışma hastalarının toplam %9,8'inde tanı konmuş psöriyatik artrit hikayesi vardır.
Tüm çalışmalar boyunca psöriyazis tedavisi için hastaların %30,9'u hiçbir sistemik (biyolojik olmayan ve biyolojik dahil) tedavi görmemiştir, %38,1'i daha önce fototerapi ya da fotokemoterapi almıştır, %48,3'ü daha önce biyolojik olmayan sistemik tedavi almıştır, %42,1'i daha önce biyolojik tedavi almıştır ve %23,7'si en az bir anti-TNF alfa ajanı almıştır.
ULTIMMA-1 ve ULTIMMA-2
ULTIMMA-1 ve ULTIMMA-2 çalışmalarına 997 hasta kaydedilmiştir (598'i risankizumab 150 mg, 199'u ustekinumab 45 mg veya 90 mg [başlangıç ağırlığına göre] ve 200'ü plasebo almak üzere randomize edilmiştir). Hastalar 0. haftada, 4. haftada ve ardından 12 haftada bir tedavi almıştır. ULTIMMA-1 ve ULTIMMA-2 için iki ko-primer sonlanım noktası, 1) PASI 90 cevabına ve 2) plaseboya karşı 16. haftada temiz ya da neredeyse temiz sPGA skoruna (sPGA 0 ya da 1) ulaşan hasta oranıdır. Ko-primer ve diğer sonlanım noktaları için sonuçlar Tablo 2'de ve Şekil 1'de gösterilmektedir.
| ULTIMMA-1 | ULTIMMA-2 | |||||
| Risankizuma b (N=304) n (%) | Ustekinum ab (N=100) n (%) | Plasebo (N=102) n (%) | Risankizuma b (N=294) n (%) | Ustekinum ab (N=99) n (%) | Plasebo (N=98) n (%) | |
sPGA temiz veya neredeyse temiz (0 veya 1) | |||||||
16. hafta | 267 (87,8) | 63 (63,0) | 8 (7,8) | 246 (83,7) | 61 (61,6) | 5 (5,1) | |
52. hafta | 262 (86,2) | 54 (54,0) | -- | 245 (83,3) | 54 (54,5) | -- | |
sPGA temiz (0) | |||||||
16. | 112 (36,8) | 25 (25,3) | 3 (3,1) | ||||
Tablo 2: ULTIMMA-1 ve ULTIMMA-2 çalışmalarında plak psöriyazisi olan yetişkinlerdeki etkililik ve yaşam kalitesi sonuçları
52. hafta | 175 (57,6) | 21 (21,0) | -- | 175 (59,5) | 30 (30,3) | -- | |
PASI 75 | |||||||
12. hafta | 264 (86,8) | 70 (70,0) | 10 (9,8) | 261 (88,8) | 69 (69,7) | 8 (8,2) | |
52. hafta | 279 (91,8) | 70 (70,0) | -- | 269 (91,5) | 76 (76,8) | -- | |
PASI 90 | |||||||
16. hafta | 229 (75,3) | 42 (42,0) | 5 (4,9) | 220 (74,8) | 47 (47,5) | 2 (2,0) | |
52. hafta | 249 (81,9) | 44 (44,0) | -- | 237 (80,6) | 50 (50,5) | -- | |
PASI 100 | |||||||
16. hafta | 109 (35,9) | 12 (12,0) | 0 (0,0) | 149 (50,7) | 24 (24,2) | 2 (2,0) | |
52. hafta | 171 (56,3) | 21 (21,0) | -- | 175 (59,5) | 30 (30,3) | -- | |
DLQI 0 ya da 1 | |||||||
16. hafta | 200 (65,8) | 43 (43,0) | 8 (7,8) | 196 (66,7) | 46 (46,5) | 4 (4,1) | |
52. hafta | 229 (75,3) | 47 (47,0) | -- | 208 (70,7) | 44 (44,4) | -- | |
PSS 0 (semptomsuz) | |||||||
16. hafta | 89 (29,3) | 15 (15,0) | 2 (2,0) | 92 (31,3) | 15 (15,2) | 0 (0,0) | |
52. hafta | 173 (56,9) | 30 (30,0) | -- | 160 (54,4) | 30 (30,3) | -- | |
Risankizumabın ustekinumab ve plasebo ile bütün karşılaştırmalarında, ULTIMMA-2 çalışmasının 52. haftasında p=0,001 değerinin elde edildiği PASI 75 hariç olmak üzere, p<0,001 değeri elde edilmiştir. | |||||||
Şekil 1: ULTIMMA-1 ve ULTIMMA-2'de PASI başlangıcına göre ortalama yüzde değişim süreci
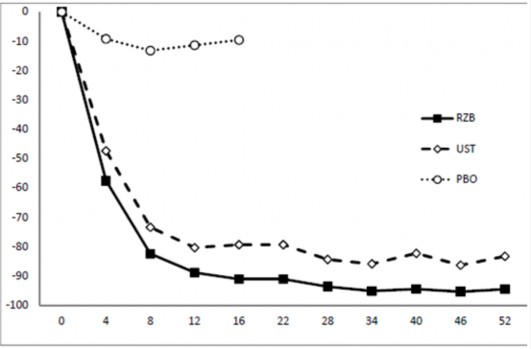
PASI Başlangıca Göre Yüzde Değişim
RZB = risankizumab UST = ustekinumab PBO = plasebo
her bir zaman noktasında p<0,001
Hafta
Yaş, cinsiyet, ırk, vücut ağırlığı ≤130 kg, başlangıç PASI skoru, eşzamanlı psöriyatik artrit, geçmişteki bir biyolojik olmayan sistemik tedavi, geçmişteki bir biyolojik tedavi ve geçmişteki bir biyolojik tedavi başarısızlığına ilişkin incelemede, bu alt gruplarda risankizumaba karşı verilen cevap açısından herhangi bir fark tespit edilmemiştir.
Risankizumab ile tedavi edilen hastalarda, 16. haftada ve 52. haftada kafa derisi, tırnaklar, avuç içi ve ayak tabanını içeren psöriyazisde iyileşmeler gözlemlenmiştir.
Tablo 3: NAPSI, PPASI ve PSSI'de başlangıçtan ortalama değişiklikler
| ULTIMMA-1 | ULTIMMA-2 | IMMHANCE | |||
| Risankizumab | Plasebo | Risankizumab | Plasebo | Risankizumab | Plasebo |
NAPSI: 16.haftadaki değişiklikler (SE) |
N=178; -9,0 (1,17) |
N=56; 2,1 (1,86) *** |
N=177; -7,5 (1,03) |
N=49; 3,0 (1,76) *** |
N=235; -7,5 (0,89) |
N=58; 2,5 (1,70) *** |
PPASI: |
|
|
|
|
|
|
16.haftadaki |
| N=34; |
| N=23; |
| N=26; |
değişiklikler | N=95; | -3,17 | N=86; | -3,74 | N=113; | -0,27 |
(SE) | -5,93 (0,324) | (0,445) | -7,24 (0,558) | (1,025) | -7,39 (0,654) | (1,339) |
|
| *** |
| ** |
| *** |
PSSI: |
|
|
|
|
|
|
16.haftadaki |
| N=92; |
| N=83; |
| N=88; |
değişiklikler | N=267; | -2,9 | N=252; | -4,6 | N=357; | -5,5 |
(SE) | -17,6 (0,47) | (0,69) | -18,4 (0,52) | (0,82) | -20,1 (0,40) | (0,77) |
|
| *** |
| *** |
| *** |
NAPSI: |
|
|
|
|
|
|
52.haftadaki değişiklikler (SE) | N=178; -15,7 (0,94) |
- | N=183; -16.7 (0,85) |
- |
- |
- |
PPASI: |
|
|
|
|
|
|
52.haftadaki değişiklikler (SE) | N=95; -6,16 (0,296) |
- | N=89; -8,35 (0,274) |
- |
- |
- |
PSSI: |
|
|
|
|
|
|
52.haftadaki |
|
|
|
|
|
|
değişiklikler (SE) | N=269; -17,9 (0,34) |
- | N=259; -18,8 (0,24) |
- |
- |
- |
Tırnak Psöriyazis Şiddet İndeksi (NAPSI), Palmoplantar Psöriyazis Şiddet İndeksi (PPASI), Kafa Derisi Psöriyazisi Şiddet İndeksi (PSSI), and Standart Hata (SE)
** p < 0,01 risankizumab ile karşılaştırıldığında *** p < 0,001 risankizumab ile karşılaştırıldığında | ||||||
Hastane Anksiyete ve Depresyon Skalası (HADS) ile ölçülen anksiyete ve depresyon, risankizumab grubunda 16. haftada plasebo grubuna göre düzelmiştir.
Yanıtın korunması
ULTIMMA-1 ve ULTIMMA-2 çalışmalarında risankizumab alan hastaların entegre analizinde,
16. haftada PASI 100 cevabı verenler için, risankizumaba devam eden hastaların %79,8'i (206/258) 52. haftaya kadar cevap vermeyi sürdürmüştür. 16. haftada PASI 90 cevabı verenler için hastaların %88,4'ü (398/450) 52. haftaya kadar cevap vermeyi sürdürmüştür.
Risankizumaba 77 haftaya kadar maruz kalındığında güvenlilik profili, 16 haftaya kadar gözlemlenen profille benzer bulunmuştur.
IMMHANCE
IMMHANCE çalışmasına 507 hasta kaydedilmiştir (407 hasta risankizumab 150 mg almak üzere ve 100 hasta plasebo almak üzere randomize edilmiştir). Hastalar 0. haftada, 4. haftada ve ardından 12 haftada bir tedavi almıştır. Başlangıçtan itibaren risankizumab almakta olan ve
28. haftada sPGA yanıtı temiz ila neredeyse temiz olan hastalar 88. haftaya kadar 12 haftada bir risankizumab almak üzere yeniden randomize edilmiştir (son risankizumab dozundan itibaren 16 haftaya kadar takip edilmiştir) veya tedaviden ayrılmıştır.
16. haftada, risankizumab sPGA skoru temiz ila neredeyse temiz (risankizumab ile %83,5'e karşı plasebo ile %7) ve PASI 90 (risankizumab ile %73,2'ye karşı plasebo ile %2) ko-primer sonlanım noktalarında plasebodan üstündür.
IMMHANCE çalışmasında yer alan ve latent tüberkülozlu (TB) olduğu belirlenip çalışma boyunca profilaksi almayan 31 hastanın hiçbirinde, risankizumab ile 55 haftalık ortalama takip süresince aktif TB gelişmemiştir.
IMMHANCE'de 28. haftada temiz veya neredeyse temiz sPGA'ya sahip hastalar arasında, risankizumab ile tedaviye devam etmek için yeniden randomize edilen hastaların % 81,1'i (90/111), risankizumab tedavisi kesilmek üzere yeniden randomize edilen %7,1'e (16/225) kıyasla bu yanıtı 104. haftada sürdürdü. Bu hastalardan, risankizumab ile tedaviye devam etmesi için yeniden randomize edilen hastaların % 63,1'i (70/111), risankizumab tedavisi kesilmek üzere yeniden randomize edilen %2,2'ye (5/225) kıyasla 104. haftada temiz bir sPGA yanıtına ulaşmıştır.
hafta sonunda sPGA skoru temiz veya neredeyse temiz olan, ancak tedavileri kesildikten sonra orta ve şiddetli sPGA yanıtlarına nüks eden hastaların %83,7'si (128/153), tedaviye yeniden başladıklarında, sPGA skorunda temiz ve neredeyse temiz değerini 16. haftada geri kazanmıştır. Temiz ve neredeyse temiz sPGA yanıtlarının kaybı, ilk doz atlandıktan 12 hafta sonra gözlemlenmiştir. Tedavisi kesilen gruba randomize edilen hastaların %80,9'unda (182/225) nüks gözlemlenirken, nüks görülmesine kadar geçen ortalama süre 295 gün olmuştur. Bireysel olarak hasta seviyesinde tekrar yanıt alma ihtimalinin ya da yanıt kaybı süresinin öngörülebilmesi için herhangi bir karakteristik özellik tanımlanmamıştır.
IMMVENT
IMMVENT çalışmasına 605 hasta kaydedilmiştir (301 hasta risankizumab almak üzere ve 304 hasta adalimumab almak üzere randomize edilmiştir). Risankizumab almak üzere randomize edilen hastalar 0. haftada, 4. haftada ve ardından 12 haftada bir 150 mg tedavi almıştır. Adalimumab almak üzere randomize edilen hastalar 0. haftada 80 mg, 1. haftada 40 mg ve ardından 15. haftaya kadar iki haftada bir 40 mg tedavi almıştır. 16. haftadan itibaren, adalimumab almakta olan hastalar yanıta bağlı olarak tedaviye devam etmiştir veya başka tedaviye geçiş yapmıştır:
<PASI 50 yanıtlı hastalar risankizumab tedavisine geçmiştir
PASI 50 ila <PASI 90 yanıtı olan hastalar adalimumab tedavisine devam etmek veya risankizumab tedavisine geçiş yapmak üzere yeniden randomize edilmiştir.
PASI 90 yanıtını sağlayan hastalar adalimumab tedavisi ile devam etmiştir.
5.2. Farmakokinetik özellikler
Risankizumabın farmakokinetiği, plak psöriyazisi olan hastalar ve psöriyatik artriti olan hastalar arasında benzerdir.
Genel özellikler
Emilim:
Risankizumab, subkütan olarak uygulanan 18 ila 300 mg ve 0,25 ila 1 mg/kg ve ayrıca intravenöz olarak uygulanan 200 ila 1.200 mg ve 0,01 ila 5 mg/kg doz aralıklarındaki maruziyette, doz orantılı artışla birlikte doğrusal farmakokinetik sergilemiştir.
Risankizumabın subkütan dozlamasının ardından, tahmini %89 mutlak biyoyararlanımla birlikte dozlamadan sonra 3 ila 14 gün arasında tepe plazma konsantrasyonlarına ulaşılmıştır.
0. haftada, 4. haftada ve bunun ardından 12 haftada bir 150 mg şeklindeki dozlama rejiminde tahmini kararlı durum tepe konsantrasyonu ve tahmini çukur plazma konsantrasyonları sırasıyla 12 ve 2 mikrogram/mL'dir.
Dağılım:
Faz 3 çalışmalarında psöriyazisi olan hastalarda risankizumabın ortalama (±standart sapma) kararlı durum dağılım hacmi (V) 11,4 (±2,7) L olup, risankizumabın dağılımının öncelikli olarak vasküler ve interstisyel boşluklarla sınırlı olduğunu göstermektedir.
Biyotransformasyon:
Terapötik IgG monoklonal antikorlar tipik olarak, endojen IgG'ler ile aynı şekildeki katabolik yollarla küçük peptitler ve amino asitlere bozunur. Risankizumabın sitokrom P450 enzimleri tarafından metabolize edilmesi beklenmemektedir.
Eliminasyon:
Faz 3 çalışmalarında psöriyazisi olan hastalarda risankizumabın ortalama (±standart sapma) sistemik klerensi (CL) 0,3 (±0,1) L/gündür ve risankizumabın ortalama terminal eliminasyon yarılanma ömrü, Faz 3 çalışmalarında psöriyazisi olan hastalarda 28-29 gün aralığındadır.
Bir IgG1 monoklonal antikoru olarak risankizumabın böbreklerde glomerüler filtrasyonla süzülmesi veya değişmemiş molekül olarak idrarla atılması beklenmemektedir.
Doğrusallık/doğrusal olmayan durum:
Risankizumab, sağlıklı hastalarda veya psöriyazisi olan hastalarda subkütan olarak uygulanan 18 ila 300 mg ya da 0,25 ila 1 mg/kg doz aralığı değerlendirmelerinde sistematik maruziyette (Cve EAA) yaklaşık olarak doz orantılı artışla birlikte doğrusal farmakokinetik sergilemiştir.
Etkileşimler
Plak psöriyazisi olan hastalarda, risankizumabın tekrarlanan uygulamasının sitokrom P450 (CYP) duyarlı prob substratlarının farmakokinetiği üzerindeki etkisini değerlendirmek için bir etkileşim çalışması yürütülmüştür. Risankizumab tedavisinin ardından kafein (CYP1A2 substratı), varfarin (CYP2C9 substratı), omeprazol (CYP2C19 substratı), metoprolol (CYP2D6 substratı) ve midazolam (CYP3A substratı) maruziyeti, risankizumab tedavisi öncesideki maruziyetleriyle karşılaştırılabilir ölçüde idi, bu da bu enzimlerle klinik olarak anlamlı etkileşim olmadığını belirtmektedir.
Popülasyon farmakokinetik analizleri risankizumab maruziyetinin, klinik çalışmalar sırasında plak psöriyazisi olan ya da psöriyatik artriti olan hastalar tarafından kullanılan eşzamanlı tedaviler tarafından etkilenmediğini göstermektedir.
Hastalardaki karekteristik özellikler
Pediyatrik popülasyon:
Risankizumabın pediyatrik hastalardaki farmakokinetiği belirlenmemiştir.
Yaşlı popülasyon:
Risankizumabı kullanan plak psöriyazisli 2.234 hasta arasından 243'ü 65 yaş veya üstü olup, 24 hasta ise 75 yaş veya üstüdür. Risankizumabı kullanan psöriyatrik artritli 1.542 hastanın 246'sı 65 yaş veya üstü, 34'ü ise 75 yaş veya üstüdür. Risankizumab alan yaşlı ve genç hastalar arasında risankizumab maruziyetinde genel bir farklılık gözlemlenmemiştir.
Karaciğer / böbrek yetmezliği:
Karaciğer ya da böbrek yetmezliğinin risankizumabın farmakokinetiği üzerindeki etkisini değerlendirmek amaçlı özel bir çalışma yürütülmemiştir. Popülasyon farmakokinetik analizlerine dayanarak, serum kreatinin seviyeleri, kreatinin klerensi veya karaciğer fonksiyon belirteçleri (ALT/AST/bilirubin), plak psöriyazisli ya da psöriyatik artritli hastalarda risankizumabın klerensi üzerinde anlamlı bir etki göstermemiştir.
IgG1 monoklonal antikoru olarak, risankizumab temelde hücre içi katabolizmayla elimine edilir ve karaciğer P450 sitokrom enzimleri ya da böbrek eliminasyonuyla metabolizmaya uğraması beklenmemektedir.
Vücut ağırlığı:
Risankizumab klerensi ve dağılım hacmi vücut ağırlığı ile birlikte artar, bu da vücut ağırlığının yüksek olduğu (> 130 kg) hastalarda etkililiği azaltabilir. Ancak, bu gözlem sınırlı sayıda hastayı temel almaktadır. Halen vücut ağırlığına göre doz ayarlaması önerilmemektedir.
Cinsiyet veya ırk:
Risankizumabın klerensi plak psöriyazisi olan ya da psöriyatik artriti olan yetişkin hastalarda cinsiyet veya ırktan anlamlı ölçüde etkilenmemiştir. Bir klinik farmakokinetik çalışmasında, beyaz ırk hastalarına kıyasla, Çinli veya Japon hastalarda risankizumab maruziyeti bakımından klinik olarak anlamlı farklılıklar gözlemlenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler, güvenlilik farmakolojisi değerlendirmeleri dahil tekrar-doz toksisitesi çalışmalarına ve sinomolgus maymunlarında 50 mg/kg/hafta'ya kadar dozlarda (maksimum önerilen insan dozundaki (MRHD) klinik maruziyetin yaklaşık 70 katı düzeyinde maruziyet üreten) gerçekleştirilen bir üreme toksisitesi ve gelişimsel toksisite çalışmasına dayanarak, insanlar için özel bir tehlike ortaya koymamıştır.
Risankizumab ile mutajenisite ve karsinojenisite çalışmaları gerçekleştirilmemiştir. Sinomolgus maymunlarında 50 mg/kg/hafta'ya kadar dozlarda (MRHD'de klinik maruziyetin yaklaşık 70 katı) gerçekleştirilen 26 haftalık bir kronik toksikoloji çalışmasında pre-neoplastik veya neoplastik lezyonlar gözlemlenmemiştir ve advers immunotoksisite ya da advers kardiyovasküler etkiler kaydedilmemiştir.
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
İLAÇ GENEL BİLGİLERİ
AbbVie Tibbi İlaçlar San. Tic. Ltd. Şti.
| Satış Fiyatı | 60935.83 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 60935.83 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8680656080520 |
| Etkin Madde | Risankizumab |
| ATC Kodu | L04AC18 |
| Birim Miktar | 75/0,83 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 2 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |