SOFEXAN 200 mg film kaplı tablet Farmakolojik Özellikler
{ Sorafenib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ilaçlar, protein kinaz inhibitörü ATC kodu: L01EX02
Sorafenib, in vitro ve in vivo anti-proliferatif ve anti-anjiyojenik özellikler sergileyen bir multikinaz inhibitörüdür.
Etki mekanizması ve farmakodinamik etkiler
Sorafenib, in vitro koşullarda tümör hücresi proliferasyonunu azaltan bir multikinaz inhibitörüdür. Sorafenib, atimik farelerde tümör anjiyogenezinde azalma ile birlikte, insan tümörü ksenograftlarının geniş bir spektrumunda tümör büyümesini inhibe etmektedir. Sorafenib tümör hücresinde (CRAF, BRAF, V600E BRAF, c-KIT ve FLT-3) ve tümör vaskülatüründe (CRAF, VEGFR-2, VEGFR-3 ve PDGFR-Ã) bulunan hedeflerin aktivitesini inhibe etmektedir. Serin/treonin kinazlar RAF kinazları iken c-KIT, FLT-3, VEGFR-2, VEGFR-3 ve PDGFR-Ã reseptör tirozin kinazlarıdır.
Klinik etkililik ve güvenlilik
Sorafenibin klinik etkililiği ve güvenliliği hepatoselüler karsinomalı (HSK), metastatik renal hücreli karsinomalı (RHK) ve diferansiye tiroid karsinomalı (DTK) hastalarda çalışılmıştır.
Hepatoselüler karsinoma
Çalışma 3 (çalışma 100554), 602 hepatosellüler karsinom hastasıyla yapılan uluslararası, çok merkezli, randomize, çift körlü, plasebo kontrollü bir Faz III çalışmadır. Sorafenib ve plasebo grubunda ECOG skoru açısından demografik ve başlangıçtaki hastalık özellikleri benzerdir (skor 0: %54'e karşı %54; skor 1: %38'e karşı %39; skor 2: %8'e karşı %7), TNM evresi (evre I: <%1'e karşı <%1; evre II: %10,4'e karşı %8,3; evre III: %37,8'e karşı %43,6; evre IV: %50,8'e karşı %46,9) ve BCLC evresi (evre B: %18,1'e karşı %16,8; evre C: %81,6'ya karşı %83,2; evre D: <%1'e karşı %0).
Çalışma, planlanan ara OS analizi önceden belirlenen etkililik sınırını geçtikten sonra durdurulmuştur. Bu OS analizi, sorafenibin OS açısından plaseboya göre istatistiksel olarak anlamlı ölçüde avantajlı olduğunu göstermiştir (HR: 0,69, p = 0,00058, bkz. Tablo 5).
Bu çalışmada Child Pugh B karaciğer yetmezliği olan hastalara ilişkin veriler sınırlıdır ve Child Pugh C olan yalnızca bir hasta çalışmaya dahil edilmiştir.
Tablo 5: Hepatosellüler Karsinomda Çalışma 3 (Çalışma 100554) Etkililik Sonuçları
Etkililik Parametresi | Sorafenib (n=299) | Plasebo (n=303) | P değeri | HR (%95 GA) |
Genel Sağkalım (OS) [medyan, hafta (%95 GA)] | 46,3
(40,9; 57,9) | 34,4
(29,4; 39,4) | 0,00058* | 0,69
(0,55; 0,87) |
İlerlemeye Kadar Geçen Zaman (TTP) [medyan, hafta (%95 GA)]** | 24
(18; 30) | 12,3
(11,7; 17,1) |
0,000007 | 0,58
(0,45; 0,74) |
GA=Güven aralığı, HR=Tehlike oranı (plaseboya göre Sorafenib)
*p değeri, önceden belirlenen O'Brien Fleming durma sınırı olan 0,0077'in altında olduğundan istatistiksel olarak anlamlı
**Bağımsız radyolojik inceleme
İkinci Faz III, uluslararası, çok merkezli, randomize, çift körlü, plasebo kontrollü çalışmada (Çalışma 4, 11849) ilerlemiş hepatosellüler karsinomu olan 226 hastada sorafenibin klinik faydası değerlendirilmiştir. Çin, Kore ve Tayvan'da yürütülen bu çalışma, sorafenibin olumlu fayda-risk profili açısından Çalışma 3'ün bulgularını doğrulamıştır (HR (OS): 0,68, p = 0,01414).
Çalışma 3 ve 4'te önceden belirlenen katmanlandırma faktörlerinde (ECOG skoru, makroskopik vasküler invazyon ve/veya ekstrahepatik tümör yayılması varlığı veya yokluğu) tehlike oranı tutarlı bir şekilde plaseboya göre sorafenib lehine olmuştur. Araştırma amaçlı alt grup analizleri, başlangıçta uzak metastazları olan hastalarda tedavi etkisinin daha az belirgin olduğunu göstermiştir.
Renal hücreli karsinoma
Sorafenibin ilerlemiş renal hücreli karsinoma (RHK) tedavisindeki güvenliliği ve etkililiği 2 klinik çalışmada incelenmiştir:
Çalışma 1 (çalışma 11213), 903 hastayla yapılan çok merkezli, randomize, çift körlü, plasebo kontrollü bir Faz III çalışmadır. Yalnızca berrak hücreli renal karsinomu ve düşük ve orta MSKCC (Memorial Sloan Kettering Kanser Merkezi) riski olan hastalar çalışmaya dahil edilmiştir. Primer sonlanım noktaları genel sağkalım ve progresyonsuz sağkalım (PFS) olmuştur.
Hastaların yaklaşık yarısında ECOG performans skoru 0'dır ve hastaların yarısı düşük risk MSKCC prognostik grubundadır.
PFS, RECIST kriterleri kullanılarak körleştirilmiş bağımsız radyolojik inceleme ile değerlendirilmiştir. PFS analizi 769 hastada 342 olayla yürütülmüştür. Medyan PFS, sorafenibe randomize edilen hastalarda 167 gün olarak bulunurken, plasebo hastalarında 84 gün olmuştur (HR=0,44; %95 GA: 0,35-0,55; p<0,000001). Yaş, MSKCC prognostik grubu, ECOG PS ve önceki tedavi, tedavinin etki boyutunu etkilememiştir.
Genel sağkalıma yönelik ara analiz (ikinci ara analiz) 903 hastada 367 ölümle yapılmıştır. Bu analiz için nominal alfa değeri 0,0094'tür. Medyan sağkalım, sorafenibe randomize edilen hastalarda 19,3 ay olarak bulunurken, plasebo hastalarında 15,9 ay olmuştur (HR= 0,77; %95 GA: 0,63, 0,95; p = 0,015). Bu analiz sırasında yaklaşık 200 hasta plasebo grubundan
sorafenib grubuna geçmiştir.
Çalışma 2, RHK'yı da içeren metastatik maligniteleri olan hastalarla yapılan bir Faz II, kesme çalışmasıdır. Sorafenib tedavisinde hastalığı stabil olan hastalar plaseboya randomize edilmiş veya sorafenib tedavisine devam etmiştir. RHK'sı olan hastalarda progresyonsuz sağkalım (PFS), sorafenib grubunda (163 gün) plasebo grubuna (41 gün) göre anlamlı ölçüde daha uzun olmuştur (p= 0,0001, HR= 0,29).
Diferansiye tiroid karsinoma
Çalışma 5 (çalışma 14295), radyoaktif iyoda dirençli lokal olarak ilerlemiş veya metastatik diferansiye tiroid kanserli 417 hasta üzerinde yürütülen, uluslararası, çok-merkezli, randomize, çift-kör, plasebo-kontrollü bir Faz III araştırmadır.
Körlenmiş bir bağımsız radyolojik inceleme ile RECIST kriterleri kullanılarak değerlendirilen PFS, çalışmanın birincil sonlanım noktasıdır. Sekonder sonlanım noktaları arasında genel sağkalım (OS), tümör yanıt oranı ve yanıt süresi yer almıştır. Progresyon sonrasında, hastaların açık etiketli sorafenib kullanmalarına izin verilmiştir.
Kayıttan önce 14 ay içinde hastalarda progresyon görüldüyse ve Radyoaktif iyota (RAİ) dirençli DTK varsa hastalar çalışmaya dahil edilmiştir. RAİ'ye dirençli DTK RAİ taramasında iyot tutulumu olmayan bir lezyonu olan veya kümülatif RAİ>600 mCi alan veya kayıttan önceki 16 ay içinde bir RAİ tedavisi ya da 16 aylık süre içinde yapılmış iki RAİ tedavisinden sonra progresyon gösteren olarak tanımlanmıştır.
Başlangıç dönemi demografik özellikleri ve hasta özellikleri her iki tedavi grubu arasında iyi bir dengelenme göstermiştir. Hastaların %86'sında akciğerlerde, %51'inde lenf nodunda ve
%27'sinde kemikte metastaz vardır. Hastaların hemen hemen tamamına tiroidektomi (%99,5) uygulanmış ve ortanca yaklaşık 400 mCi kümülatif radyoaktif aktivite almıştır. Hastaların çoğunda papiller karsinomayı (%56,8) takiben foliküler (%25,4) ve daha az diferansiye karsinoma (%9,6) vardır.
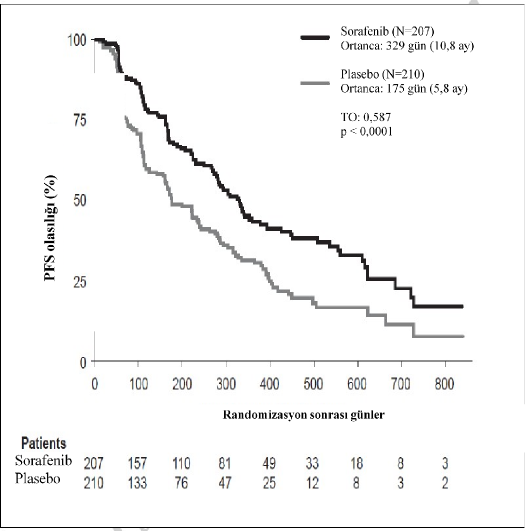
Tüm analiz kümesinde, 207 hasta günde iki kez 400 mg sorafenibe ve 210 hasta plaseboya randomize edilmiştir. PFS, körlemeli bağımsız radyolojik inceleme yoluyla, RECIST kriterleri kullanılarak değerlendirilmiştir.
Ortanca PFS süresi, sorafenib grubunda 329 gün (10,8 ay) ve plasebo grubunda 175 gündür (5,8 ay). PFS için bağıl risk (hastalık progresyonu veya ölüm), sorafenib ile tedavi edilen hastalarda, plasebo ile tedavi edilen bireyler ile karşılaştırıldığında tehlike oranıyla yaklaşık
%41 azalmıştır (Tehlike Oranı (TO): 0,587; %95 GA: 0,454; 0,758; tek yönlü p<0,0001)
(Tablo 6, Şekil 2).
Sorafenibin PFS üzerindeki etkisi coğrafik bölge, 60 yaş üzeri veya altı yaş, cinsiyet, histolojik alt tip, tümör yükü ve kemik metastazının varlığı veya yokluğu dahil tüm alt kümelerde tutarlıdır.
Genel sağkalımda (OS) tedavi grupları arasında istatistiksel bir fark bulunmamaktadır (TO: 0,802; %95 GA: 0,539; 1,194, tek yönlü p değeri 0,138, Tablo 6). Ortanca OS'ye her iki kolda da erişilmemiştir. Plasebo koluna randomize edilen 150 (%71,4) ve sorafenib koluna randomize edilen 55 (%26,6) hasta açık etiketli olarak sorafenib aldılar.
RECIST'e göre tam yanıt (CR) gözlenmemiştir. Bağımsız radyolojik değerlendirmeye göre
genel yanıt oranı (CR + parsiyel yanıt (PR)) sorafenib grubunda (24 hasta, %11,6), plasebo grubuna (1 hasta, %0,5) kıyasla daha yüksektir (tek yönlü p<0,0001). PR veren, sorafenib ile tedavi edilen hastalarda ortalama yanıt süresi 309 gündür (%95 GA: 226, 505 gün).
Tablo 6: Çalışma 5: Diferansiye Tiroid Karsinomada Etkililik Sonuçları
Etkinlik Parametresi | Sorafenib (n=207) Olay (ölüm) ile deneklerin (%) oranı | Plasebo (n=210) Olay (ölüm) ile deneklerin (%) oranı | Sorafenib (n=207) [ortanca, gün (%95 GA)]* | Plasebo (n=210) [ortanca, gün (%95 GA)] | p-değeri | TO (%95 GA) |
Progresyonsuz Sağkalım (PFS) (12.08.2012) | 113 (%54,6) | 137 (%65,2) | 329 (278; 393) | 175 (160; 238) | <0,0001 | 0,587 (0,454-0,758) |
Genel Sağkalım (OS) (31.05.2013) | 66 (%31,9) | 72 (%34,3) | Erişilmemiştir | 1.110 (26-1.110) | 0,2359 | 0,884 (0,663; 1,236) |
GA=Güven aralığı, TO=Tehlike oranı (plaseboya karşı sorafenib)
* Bağımsız radyolojik inceleme
Riskli hastalar
Şekil 1: Çalışma 5: Tiroid Karsinomada Progresyonsuz Sağkalımın (PFS) Kaplan-Meier eğrisi (tüm analiz kümesi)
QT aralığının uzaması
Bir klinik farmakoloji çalışmasında, 31 hastada başlangıçta (tedavi öncesi) ve tedavi sonrası QT/QTc ölçümleri kaydedilmiştir. 28 günlük tek bir tedavi küründen sonra, maksimum sorafenib konsantrasyonunun izlendiği zaman noktasında, plasebo tedavisinin başlangıç değerleriyle karşılaştırıldığında QTcB 4±19 msn, QTcF ise 9±18 msn uzamıştır. Tedavi sonrası EKG izlemi sırasında hiçbir hastada QTcB veya QTcF>500 msn izlenmemiştir (bkz. Bölüm 4.4).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Sorafenib tablet uygulamasından sonra, oral çözeltiye kıyasla ortalama bağıl biyoyararlanım
%38-49'dur. Oral uygulamayı izleyerek, sorafenib doruk plazma düzeylerine yaklaşık 3 saatte ulaşır. Orta dereceli yağ içeren bir yemek ile verildiğinde, biyoyararlanımı aç karına olduğu gibidir. Yağdan zengin bir yemek ile verildiğinde, sorafenib biyoyararlanımı aç karına uygulamaya kıyasla %30 azalmaktadır. Yedi gün süreyle çoklu sorafenib dozlarının uygulanması, tek doz uygulamaya kıyasla 2,5 ile 7 katlık bir birikim ile sonuçlanır. Kararlı durum plazma sorafenib konsantrasyonları 7 gün içinde elde edilir ve ortalama konsantrasyonların tepe-vadi oranı 2'den düşüktür. Günde iki kez 400 mg sorafenib uygulamasının kararlı durum farmakokinetiği, tiroid karsinoma, RHK ve HSK hastalarında değerlendirilmiştir. Tüm tümör tipleri için maruz kalmadaki değişkenlik yüksek olmasına rağmen, en yüksek ortalama maruziyet tiroid kanserli hastalarda görülmüştür. Tiroid kanserli hastalarda EAA'daki artışın klinik anlamı bilinmemektedir.
Dağılım:
Sorafenibin insan plazma proteinlerine in vitro bağlanması %99,5 düzeyindedir.
Biyotransformasyon:
Sorafenib esas olarak karaciğerde metabolize olur, CYP3A4'ün aracılık ettiği oksidatif metabolizmaya girerken, aynı zamanda UGT1A9 aracılığıyla glukuronidasyona uğrar. Sorafenib konjugatları gastrointestinal kanalda bakteriyel glukuronidaz aktivitesi tarafından parçalanabilirler, bu da konjuge olmayan ilacın tekrar emilimini sağlar. Eş zamanlı neomisin uygulaması bu süreci engelleyerek sorafenibin ortalama biyoyararlanımını %54 oranında düşürür.
Sorafenib kararlı durumda, plazmada dolaşan metabolitlerin yaklaşık %70-85'ini oluşturur. Sorafenibin sekiz metaboliti tanımlanmıştır, bunlardan beşi plazmada saptanmıştır. Sorafenibin plazmada dolaşan esas metaboliti, piridin N-oksit, sorafenibe benzer bir in vitro potens gösterir. Bu metabolit kararlı durumda dolaşımdaki metabolitlerin yaklaşık %9-16'sını oluşturur.
Eliminasyon:
Çözelti şeklinde bir sorafenib formülasyonu oral yoldan 100 mg dozda uygulandıktan sonra dozun %96'sı 14 gün içinde atılmıştır, bu miktarın %77'si feçes ile, %19'u idrarda glukuronize metabolitler şeklinde atılmıştır. Dozun %51'ini oluşturan değişmemiş haldeki sorafenib, feçeste bulunmakta, ama idrarda bulunmamaktadır. Bu da, değişmemiş haldeki ilacın eliminasyonuna safra ile atılımın katkıda bulunduğunu göstermektedir.
Sorafenibin eliminasyon yarı-ömrü 25-48 saat civarındadır.
Doğrusallık/Doğrusal olmayan durum:
Sorafenib doğrusal farmakokinetik özellik gösterir.
Hastalardaki karakteristik özellikler
Irk:
Beyaz ırk ile Asya ırkına mensup gönüllülerde farmakokinetik özellikler bakımından klinik olarak anlamlı farklılıklar bulunmamaktadır.
Cinsiyet:
Demografik verilerin analizleri, cinsiyete göre farmakokinetik açısından fark olmadığını göstermektedir.
Karaciğer yetmezliği:
Sorafenib esas olarak karaciğer tarafından elimine edilmektedir.
Hafif (Child-Pugh A) ya da orta derecede (Child-Pugh B) karaciğer yetmezliği olan hepatoselüler karsinomu hastalarda sistemik maruz kalma düzeyleri, karaciğer bozukluğu olmayan hastalarda gözlenen aralık içindedir. Child-Pugh A ve Child-Pugh B olup hepatoselüler karsinomu olmayan hastalarda sorafenibin farmakokinetiği, sağlıklı gönüllülerin farmakokinetiği ile benzerdir.
Sorafenib farmakokinetiği şiddetli karaciğer yetmezliği (Child-Pugh C) olan hastalarda incelenmemiştir (bkz. Özel kullanım uyarıları ve önlemleri ve Pozoloji ve uygulama şekli). Başlıca karaciğer aracılığıyla atıldığından bu hasta popülasyonunda maruziyet artabilir.
Böbrek yetmezliği:
Bir klinik farmakoloji çalışmasında sorafenibin farmakokinetiği, böbrek fonksiyonları normal olan olgulara ve hafif (CrCl 50-80 mL/dk), orta dereceli (CrCl 30 ile <50 mL/dk) ya da diyaliz gerektirmeyen şiddetli böbrek yetmezliği (CrCl <30 mL/dk) olan olgulara tek doz 400 mg uygulamasından sonra değerlendirilmiştir. Sistemik sorafenibe maruz kalma ve renal fonksiyon arasında ilişki gözlenmemiştir. Hafif, orta dereceli ya da diyaliz gerektirmeyen şiddetli böbrek yetmezliği nedeniyle doz ayarlaması gerekli değildir (bkz. Pozoloji ve uygulama şekli). Diyaliz gereken hastalardaki durum incelenmemiştir.
Yaşlılar (65 yaş üzeri):
Demografik verilerin analizleri, yaşa göre doz ayarlaması yapılmasının gerekli olmadığını göstermektedir.
Pediyatrik hastalar:
Pediyatrik hastalara ilişkin farmakokinetik veri bulunmamaktadır.
5.3. Klinik öncesi güvenlilik verileri
Karsinojenez, Mutajenez, Fertilite bozukluğu
Sorafenibin klinik öncesi güvenlilik profili fareler, sıçanlar, köpekler ve tavşanlarda değerlendirilmiştir.
Tekrarlı doz toksisitesi çalışmalarında, öngörülen klinik maruziyetin altındaki maruziyetlerde (EAA karşılaştırmaları doğrultusunda) çeşitli organlarda değişiklikler (dejenerasyon ve rejenerasyon) görülmüştür.
Genç ve büyümekte olan köpeklere tekrarlı doz uygulamasından sonra, kemik ve dişler üzerinde etkiler gözlenmiştir. Bu değişiklikler, günlük 600 mg/m vücut yüzey alanı sorafenib dozunda (vücut yüzey alanı temelinde önerilen klinik doz olan 500 mg/m'nin 1,2 katına eşdeğer) femoral büyüme plağında düzensiz kalınlaşmalar, 200 mg/m/gün düzeyinde değişen büyüme plağına komşu kemik iliğinde hiposelülarite ve 600 mg/m/gün düzeyinde dentin bileşiminde değişikliklerden oluşmaktaydı. Erişkin köpeklerde benzeri etkiler indüklenmemiştir.
Bir in vitro memeli hücresi çalışmasında (Çin hamsteri overleri), metabolik aktivasyon varlığında klastojenisite (kromozomal aberrasyonlar) için pozitif genotoksik etkiler elde edilmiştir. Üretim prosesi sırasında oluşan ve aynı zamanda bitmiş ilaç hammaddesinde de bulunan (<%0,15) bir ara madde, bir in vitro bakteriyel hücre incelemesinde (Ames testi) mutajenez açısından pozitiftir. Sorafenib, Ames testinde (%0,34 düzeyinde ara madde) ve bir in vivo koşullarda fare mikronukleus incelemesinde genotoksik bulunmamıştır.
Sorafenib ile karsinogenesite çalışmaları yürütülmemiştir.
Sorafenib ile hayvanlarda fertilite üzerindeki etkiyi değerlendirme amaçlı spesifik çalışmalar yapılmamıştır. Ancak erkek ve dişi fertilitesi üzerinde bir advers etki beklenebilir, çünkü hayvanlarda yürütülen tekrarlı doz çalışmaları, erkek ve dişi üreme organlarında değişimler olduğunu göstermiştir. Tipik değişimler, sıçanların testis, epididim, prostat ve seminal veziküllerinde dejenerasyon ve retardasyon bulgularından oluşmaktadır ve bu etkiler günlük 150 mg/m vücut yüzey alanı sorafenib dozunda açık bir şekilde belirmiştir (vücut yüzey alanı temelinde önerilen 500 mg/m'lik klinik dozun yaklaşık üçte biri). Dişi sıçanlarda korpus luteumda santral nekroz ve overlerde foliküler gelişim duraklaması görülmüştür ve gözlenen en düşük etki düzeyi 30 mg/m/gün olmuştur. Köpeklerde 600 mg/m/gün dozunda testislerde tübüler dejenerasyon ve 1200 mg/m/gün dozunda oligospermi görülmüştür.
Sorafenibin sıçanlar ve tavşanlara uygulandığında embriyotoksik ve teratojen olduğu gösterilmiştir. Gözlenen etkiler maternal ve fetal vücut ağırlığında azalma, fetal rezorpsiyon sayısında artış ve eksternal ve viseral malformasyon sayısında artıştan oluşmaktadır. Sıçanlarda oral 6 mg/m/gün dozunda ve tavşanlarda 36 mg/m/gün dozunda advers fetal sonlanımlar gözlenmiştir (bkz. Bölüm 4.4, Bölüm 4.6).
Çevresel Risk değerlendirme çalışmaları, sorafenib tosilatın çevre açısından persistan, biyoakümülatif ve toksik olma potansiyeli olduğunu göstermiştir.
 Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ GENEL BİLGİLERİ
Nobel İlaç Sanayii ve Tic. Anomim Şirketi
| Satış Fiyatı | 31286.88 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 31286.88 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699540033658 |
| Etkin Madde | Sorafenib |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |