SOLIQUA SOLOSTAR 100 U/ml ve 33 mcg/ml SC enjeksiyonluk çöz. içeren kullanıma hazır enj. kalemI (3 kalem) Farmakolojik Özellikler
{ Insulin Glarjin + Liksisenatid }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diyabette kullanılan ilaçlar, enjeksiyon için insülinler ve analogları, uzun etkili
ATC Kodu: A10AE54
Etki mekanizması
SOLIQUA glisemik kontrolü iyileştirmek için tamamlayıcı etki mekanizmalarına sahip iki etkin maddeyi birleştirmektedir: bir bazal insülin analogu olan insülin glarjin (başlıca açlık plazma glukozunu hedef alır) ve GLP-1 reseptör agonisti olan liksisenatid (başlıca tokluk plazma glukozunu hedef alır).
İnsülin glarjin
İnsülin glarjin dahil olmak üzere insülinin primer aktivitesi, glukoz metabolizmasının düzenlenmesidir. İnsülin ve analogları, özellikle iskelet kası ve yağ dokusunda olmak üzere periferik glukoz alımını uyararak ve karaciğerde glukoz üretimini baskılayarak kan glukoz düzeyini düşürür. İnsülin yağ hücresindeki lipolizi baskılar, proteolizi baskılar ve protein sentezini artırır.
Liksisenatid
Liksisenatid GLP-1 reseptör agonistidir. GLP-1 reseptörü, pankreasta beta hücrelerinden glukoza bağımlı insülin salgılanmasını artıran ve pankreasta alfa hücrelerinden glukagon salgılanmasını baskılayan endojen inkretin hormonu olan doğal GLP-1 için hedeftir.
Liksisenatid, kan glukozu yükseldiğinde ama normoglisemi düzeyinde olmadığında glukoza bağımlı insülin salgısını stimule eder ve bu hipoglisemi riskini sınırlandırır. Paralel olarak glukagon salgılanması baskılanır. Hipoglisemi durumunda, glukagon salgılama kurtarma mekanizması korunmaktadır. Liksisenatid prandiyal enjeksiyonu sonrası, gastrik boşalmayı yavaşlatarak, yemeklerle alınan glukozun emilme ve dolaşıma katılma hızını düşürür.
Farmakodinamik etkiler
İnsülin glarjin ve liksisenatid kombinasyonunun insülin glarjinin farmakodinamikleri üzerinde bir etkisi bulunmamaktadır. İnsülin glarjin ve liksisenatid kombinasyonunun liksisenatidin farmakodinamikleri üzerindeki etkisi faz 1 çalışmalarında incelenmemiştir.
Tek başına uygulandığında belirgin pik olmadan insülin glarjinin 24 saatlik nispeten sabit konsantrasyon/zaman profili ile tutarlı olarak, insülin glarjin/liksisenatid kombinasyonunda verildiğinde belirgin pik olmadan glukoz kullanım oranı/zaman profili benzerdi.
SOLIQUA dahil olmak üzere insülinlerin etki süreleri, bireyler arasında ve aynı bireyde farklılık gösterebilir.
İnsülin glarjin
İnsülin glarjinle (100 ünite/mL) yürütülen klinik çalışmalarda, intravenöz insülin glarjinin molar bazda (örn; aynı dozlarda verildiğinde) glukoz düşürücü etkisi insan insülini ile yaklaşık olarak aynıdır.
Liksisenatid
Tip 2 diyabet hastalarında yürütülen 28 günlük plasebo kontrollü bir çalışmada,5 ile 20 mikrogram liksisenatid kahvaltı, öğle yemeği ve akşam yemeği sonrasında tokluk kan glukozunda istatistiki olarak anlamlı düşüşler sağlamıştır.
Gastrik boşalma
Standart etiketli bir test öğünü sonrasında, yukarıda atfedilen çalışmada, liksisenatidin gastrik boşalmayı yavaşlatarak tokluk glukoz absorpsiyon oranını düşürdüğü doğrulanmıştır. Tek başına liksisenatidle 28 günlük tedavi sonrasında, yavaşlayan gastrik boşalma etkisi, çalışmanın sonunda korunmuştur.
Klinik etkililik ve güvenlilik
SOLIQUA'nın glisemik kontrol üzerindeki güvenlilik ve etkililiği, tip 2 diabetes mellitus hastalarında üç randomize klinik çalışmada değerlendirilmiştir:
Metformine ekleme [İnsülin Kullanmamış]
Bazal insülinden geçiş
GLP-1 reseptör agonistinden geçiş
Her bir aktif kontrollü çalışmada SOLIQUA tedavisi, hemoglobin A1c'de (HbA1c) klinik ve istatistiki olarak anlamlı iyileşmeler sağlamıştır.
Tek başına insülin glarjinle karşılaştırıldığında kombinasyon tedavisi hipoglisemi oranlarını artırmadan daha düşük HbA1c düzeylerine ulaştırmış ve daha yüksek HbA1c azalması sağlamıştır.(bkz. bölüm 4.8).
Metformine ekleme klinik çalışmasında tedavi 10 doz adımında başlatıldı (10 ünite insülin glarjin ve 5 mcg liksisenatid). Bazal insülinden geçiş klinik çalışmasında, önceki insülin dozuna bağlı olarak (bkz. bölüm 4.2) başlangıç dozu 20 doz adımı (20 ünite insülin glarjin ve 10 mcg liksisenatid) veya 30 doz adımı (30 ünite insülin glarjin ve 10 mcg liksisenatid) idi. Her iki çalışmada da doz, kendi kendine ölçülen açlık plazma glukoz değerlerine göre hafta bir kez titre edilmiştir.
Metformine ekleme [insülin kullanmamış]
OAD ile kontrol altında olmayan Tip 2 diyabet hastalarındaki klinik çalışma
İnsülin glarjin (100 ünite/mL) ve liksisenatid (20 mcg) olarak ayrı bileşenleri ile karşılaştırıldığında, SOLIQUA'nın etkililik ve güvenliliğini değerlendirmeye yönelik açık etiketli, 30 haftalık, aktif kontrolü bir çalışmada tip 2 diyabeti olan toplam 1170 hasta randomize edilmiştir.
Tek başına metforminle veya metformin ve ikinci bir OAD tedavisi sülfonilüre veya glinid veya sodyum glukoz ko-transporter-2 (SGLT2-) inhibitörü veya dipeptidil peptidaz-4 (DPP-4) inhibitörü ile tedavi edilen ve bu tedavi ile yeterli şekilde kontrol edilemeyen tip 2 diyabet hastaları (HbA1c aralığı önceden tek başına metformin ile tedavi edilen hastalar için %7,5 ile
%10 ve önceden metformin ve ikinci bir oral anti-diyabetik tedavi ile tedavi edilen hastalar için
%7,0 ile %9) 4 hafta boyunca başlatma dönemine girmiştir. Bu tedavisiz süre boyunca metformin tedavisi optimize edilmiş ve diğer OAD'ler kesilmiştir. Tedavisiz süre sonunda, kontrol altına alınamayan hastalar (HbA1c %7 ile %10 arasında), SOLIQUA'ya, insülin glarjin veya liksisenatid'e randomize edilmiştir. Tedavisiz süreye başlayan 1479 hastanın 1170'i
randomize edilmiştir. Randomize faza dahil olmamalarının ana nedenleri, tedavisiz süre sonunda APG değerlerinin >13,9 mmol/L ve HbA1c değerlerinin <%7 veya >%10 olmasıydı.
Randomize Tip 2 diyabet popülasyonu aşağıdaki özelliklere sahiptir: Çoğunlukla (%57,1) 50 ile 64 yaş arası olmak üzere, ortalama yaş 58,4'tü ve %50,6'sı erkekti. Başlangıçtaki vücut kitle indeksi (BMI) hastaların %63,4'ü BMI ≥30 kg/molmak üzere ortalama 31,7 kg/m'ydi. Diyabetin ortalama süresi yaklaşık 9 yıldı. Metformin zorunlu arka plan tedavisi idi ve hastaların %58'i tarama sırasında ikinci bir OAD alıyordu ve bunların %54'ü de sülfonilüre idi.
30. haftada SOLIQUA, ayrı bileşenlerle karşılaştırıldığında HbA1c'de istatistiki olarak anlamlı düşüş sağlamıştır (p-değeri <0,0001). Bu primer sonlanım noktasının önceden belirlenen analizinde, gözlemlenen farklılıklar başlangıç HbA1c (<%8 veya ≥%8) veya başlangıç OAD kullanımı (tek başına metformin veya metformin ile birlikte ikinci OAD) ile ilgili olarak tutarlıydı.
Çalışmadaki diğer sonlanım noktaları için aşağıdaki şekil 1'e ve tablo 4'e bakınız.
Tablo 4 - 30. haftadaki sonuçlar - Metformine ekleme klinik çalışması (mITT popülasyonu)
| SOLIQUA | İnsülin glarjin | Liksisenatid |
Gönüllü sayısı (mITT) | 468 | 466 | 233 |
HbA1c (%) |
|
|
|
Başlangıç (ortalama; tedavisiz faz sonrası) | 8,1 | 8,1 | 8,1 |
Çalışma sonu (ortalama) | 6,5 | 6,8 | 7,3 |
Başlangıçtan LS değişikliği (ortalama) | -1,6 | -1,3 | -0,9 |
İnsülin glarjine karşı fark [%95 güven aralığı] (p-değeri) |
| -0,3 [-0,4, -0,2] (<0,0001) |
|
Liksisenatide karşı fark [%95 güven aralığı] (p-değeri) |
|
| -0,8 [-0,9 -0,7] (<0,0001) |
30. haftada <%7 HbA1c'ye ulaşan Hasta Sayısı (%)* | 345 (%74) | 277 (%59) | 77 (%33) |
Açlık plazma glukozu (mmol/L) |
|
|
|
Başlangıç (ortalama) | 9,88 | 9,75 | 9,79 |
Çalışma sonu (ortalama) | 6,32 | 6,53 | 8,27 |
Başlangıçtan LS değişikliği (ortalama) | -3,46 | -3,27 | -1,50 |
Glarjine karşı LS farkı (ortalama) [%95 güven aralığı] (p-değeri) |
| -0,19 [-0,420 ile 0,038] (0,1017) |
|
Liksisenatide karşı LS farkı (ortalama) [%95 güven aralığı] (p-değeri) |
|
| -1,96 [-2,246 ile -1,682] (<0,0001) |
2 saatlik PPG (mmol/L)** |
|
|
|
Başlangıç (ortalama) | 15,19 | 14,61 | 14,72 |
Çalışma sonu (ortalama) | 9,15 | 11,35 | 9,99 |
Başlangıçtan LS değişikliği (ortalama) | -5,68 | -3,31 | -4,58 |
Glargine karşı LS farkı (ortalama) [%95 güven aralığı] |
| -2,38 (-2,79 ile -1,96) |
|
Liksisenatide karşı LS farkı (ortalama) [%95 güven aralığı] |
|
| -1,10 (-1,63 ile -0,57) |
Başlangıçtan 30 haftaya LS değişikliği (ortalama) | -5,68 [-2,31] | -3,31 [-0,18] | -4,58 [-3,23] |
Ortalama vücut ağırlığı (kg) |
|
|
|
Başlangıç (ortalama) | 89,4 | 89,8 | 90,8 |
Başlangıçtan LS değişikliği (ortalama) | -0,3 | 1,1 | -2,3 |
İnsülin glarjine karşı karşılaştırma [%95 güven aralığı] (p-değeri) |
| -1,4 [-1,9 ile -0,9] (<0,0001) |
|
Liksisenatide karşı karşılaştırma [%95 güven aralığı]* |
|
| 2,01 [1,4 ile 2,6] |
30. haftada vücut ağırlığı artışı olmadan < %7,0 HbA1c'ye ulaşan hasta sayısı (%) | 202 (%43,2) | 117 (%25,1) | 65 (%27,9) |
İnsülin glarjine karşı oran farkı [%95 güven aralığı] (p-değeri) |
| 18,1 [12,2 ile 24,0] (<0,0001) |
|
Liksisenatide karşı oran farkı [%95 güven aralığı]* |
|
| 15,2 [8,1 ile 22,4] |
İnsülin glarjin günlük dozu |
|
|
|
30. haftada LS insülin dozu (ortalama) | 39,8 | 40,5 | NA |
* Daha önceden belirlenmiş azaltma test prosedürü dahil değildir
**2 saatlik PPG eksi yemek öncesi glukoz değeri
Şekil 1: 30 haftalık randomize tedavi periyodu boyunca ziyarette ortalama HbA1c (%) - mITT popülasyonu
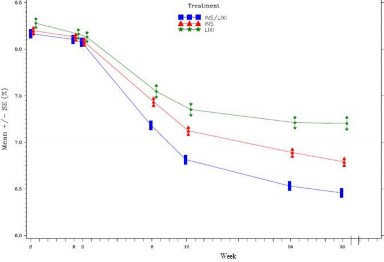
İnsülin glarjin grubundaki hastalarla (-2,66 mmol/L; fark -0,69 mmol/L) ve liksisenatid grubundaki hastalarla (-1,95 mmol/L; fark -1,40 mmol/L) karşılaştırıldığında, SOLIQUA grubundaki hastalar, başlangıçtan 30. Haftaya kadar ortalama 7 noktalı plazma glukoz ( (SMPG) profilinde istatistiki açıdan anlamlı daha büyük bir düşüş (-3,35 mmol/L) rapor etmiştir (her iki karşılaştırma için p<0,0001). Tüm zaman noktalarında 30 haftalık ortalama plazma glukoz değerleri, insülin glarjin grubu ve liksisenatid grubu ile karşılaştırıldığında SOLIQUA grubunda daha düşük olup, SOLIQUA grubu ve insülin glarjin grubu arasında benzer olan kahvaltı öncesi değer tek istisnadır.
Bazal insülinden geçiş
Bazal insülin ile yeterli şekilde kontrol edilemeyen Tip 2 diyabet hastalarındaki klinik çalışma Tip 2 diyabetli toplam 736 hasta, insülin glarjin (100 ünite/mL) ile karşılaştırılan SOLIQUA'nın etkililik ve güvenliliğini değerlendirmek için randomize, 30 haftalık, aktif kontrollü, açık etiketli, 2 tedavi kollu, paralel gruplu çok merkezli bir çalışmaya katılmıştır.
Tip 2 diyabeti olan izlenen hastalar, en az 6 ay boyunca tek başına veya 1 veya 2 OAD (metformin veya sülfonilüre veya glinid veya SGLT-2 inhibitörü veya DPP-4 inhibitörü) ile birlikte 15 ile 40 U arasında stabil günlük doz alarak bazal insülinle tedavi edilmiş ve anti- diyabetik önceki tedaviye bağlı olarak %7,5 ile %10 (taramada % 8,5'luk ortalama HbA1c) değerinde HbA1c'ye ve 10,0 mmol/L (180 mg/dL) veya 11,1 mmol/L (200 mg/dL)'ye eşit veya bu değerlerden düşük APG'ye sahipti.
İzleme sonrasında uygun hastalardan (n=1018), insülin glarjin alanlar tedavilerine devam etti, başka bir bazal insülin alanlar ise insülin glarjine geçerek, metformine devam ederken insülin dozlarının sabitlendiği/titre edildiği 6 haftalık tedavisiz döneme girdi. Diğer OAD'ler kesilmiştir.
Tedavisiz sürenin sonunda %7 ile %10 HbA1c ve APG≤ 7,77 mmol/L'e (140 mg/dL) sahip olan ve 20 ile 50 ünite günlük insülin glarjin dozu alan hastalar SOLIQUA (n=367) veya insülin glarjine (n=369) randomize edilmiştir.
Bu tip 2 diyabet popülasyonu aşağıdaki özelliklere sahiptir: çoğunlukla (%56,3) 50 ile 64 yaş arası olmak üzere, ortalama yaş 60,0'dı ve yüzde 53,3'ü kadındı. Başlangıçtaki ortalama vücut kitle indeksi (BMI) hastaların %57,3'ü BMI ≥30 kg/molmak üzere 31,1 kg/m'ydi. Diyabetin ortalama süresi yaklaşık 12 yıldı ve bir önceki bazal insülin tedavisinin ortalama süresi 3 yıldı. Taramada hastaların %64,4'ü bazal insülin olarak insülin glarjin alıyordu ve %95'i beraberinde en az 2 OAD kullanıyordu.
30. haftada SOLIQUA, insülin glarjinle karşılaştırıldığında HbA1c'de istatistiki olarak anlamlı gelişme sağlamıştır (p-değeri <0,0001).
Çalışmadaki diğer sonlanım noktaları için aşağıdaki şekil 2'ye ve tablo 5'e bakınız.
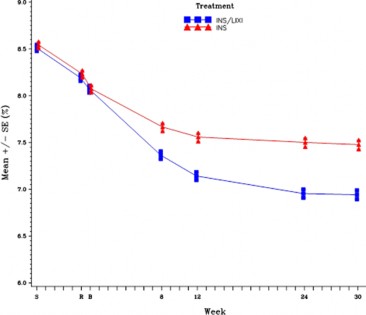
Tablo 5 -30. haftadaki sonuçlar - Bazal İnsülin mITT popülasyonunda kontrolsüz Tip 2 Diyabet Çalışması
| SOLIQUA | İnsülin glarjin |
Gönüllü sayısı (mITT) | 366 | 365 |
HbA1c (%) |
|
|
Başlangıç (ortalama; tedavisiz faz sonrası) | 8,1 | 8,1 |
Tedavi sonu (ortalama) | 6,9 | 7,5 |
Başlangıçtan LS değişikliği (ortalama) | -1,1 | -0,6 |
İnsülin glarjine karşı fark [%95 güven aralığı] (p-değeri) | -0,5 [-0,6, -0,4] (<0,0001) | |
30. haftada HbA1c <7'ye ulaşan hasta [n (%)] | 201 (%54,9) | 108 (%29,6) |
Açlık plazma glukozu (mmol/L) |
|
|
Başlangıç (ortalama) | 7,33 | 7,32 |
Çalışma sonu (ortalama) | 6,78 | 6,69 |
Başlangıçtan LS değişikliği (ortalama) | -0,35 | -0,46 |
İnsülin glarjine karşı fark [%95 güven aralığı] | 0,11 (-0,21 ile 0,43) | |
2 saatlik PPG (mmol/L)** |
|
|
Başlangıç (ortalama) | 14,85 | 14,97 |
Çalışma sonu (ortalama) | 9,91 | 13,41 |
Başlangıçtan LS değişikliği (ortalama) | -4,72 | -1,39 |
Glarjine karşı LS farkı [%95 güven aralığı] | -3,33 (-3,89 ile -2,77) | |
Ortalama vücut ağırlığı (kg) |
|
|
Başlangıç (ortalama) | 87,8 | 87,1 |
Başlangıçtan LS değişikliği (ortalama) | -0,7 | 0,7 |
İnsülin glarjine karşı karşılaştırma [%95 güven aralığı] (p-değeri) | 1,4 [-1,8 ile -0,9] (<0,0001) | |
30. haftada vücut ağırlığı artışı olmadan < %7,0 HbA1c'ye ulaşan hasta sayısı (%) | 125 (%34,2) | 49 (%13,4) |
İnsülin glarjine karşı oran farkı [%95 güven aralığı] (p-değeri) | 20,8 [15,0 ile 26,7] (<0,0001) | |
İnsülin glarjin günlük dozu |
|
|
Başlangıç (ortalama) | 35,0 | 35,2 |
Sonlanım noktası (ortalama) | 46,7 | 46,7 |
30. haftada LS insülin dozu değişikliği (ortalama) | 10,6 | 10,9 |
* Daha önceden belirlenmiş azaltma test prosedürü dahil değildir
** 2 saatlik PPG eksi öğün öncesi glukoz değeri
Şekil 2 - 30 haftalık randomize tedavi periyodu boyunca ziyarette ortalama HbA1c (%) - mITT popülasyonu
GLP-1 reseptör agonistinden SOLIQUA tedavisine geçiş
GLP-1 reseptör agonisti ile yeterli düzeyde kontrol edilemeyen Tip 2 diyabetli hastalarda yapılmış klinik çalışma
Çalışma öncesinde kullanılan ve çalışmada değiştirilmemiş GLP-1 reseptör agonist tedavisine kıyasla SOLIQUA'nın etkililiği ve güvenliliği 26 haftalık, randomize, açık etiketli bir çalışmada incelenmiştir. Çalışmaya, maksimum tolere edilen dozlarda liraglutid veya eksenatid
ile en az 4 ay veya dulaglutid, albiglutid veya uzatılmış salımlı eksenatid ile en az 6 ay, ve tek başına metformin ya da metforminin pioglitazon ile veya bir SGLT-2 inhibitörü ile kombinasyon halinde veya metforminin her ikisiyle beraber kombinasyonuyla tedavi görürken yeterli şekilde kontrol altına alınamayan tip 2 diabetes mellitus (HbA1c seviyesi % 7 ila % 9 (her iki rakam da dahil) izlenen 514 hasta dahil edilmiştir. Uygun hastalar, önceki oral anti- diyabetik tedavilerine ek olarak SOLIQUA almak veya önceki GLP-1 reseptör agonisti tedavisine devam etmek üzere randomize edilmiştir.
Taramada, gönüllülerin % 59,7'si günde bir veya iki kez kullanılan GLP-1 reseptör agonisti ve
% 40,3'ü haftada bir kez kullanılan GLP-1 reseptör agonisti kullanmaktadır. Taramada, gönüllülerin % 6,6'sı pioglitazon ve % 10,1'i metformin ile kombinasyon halinde bir SGLT-2 inhibitörü kullanmaktadır. Çalışma popülasyonunun özellikleri şu şekilde olmuştur: ortalama yaş 59,6, bireylerin % 52,5'i erkek idi. Ortalama diyabet süresi 11 yıl, önceki GLP-1 reseptör agonisti tedavisinin ortalama süresi 1,9 yıl, ortalama VKİ yaklaşık 32,9 kg / m, ortalama eGFR 87,3 ml / dak / 1,73 m ve hastaların % 90,7'sinde eGFR ≥60 ml / dakika olmuştur.
26. haftada SOLIQUA HbA1c değerinde istatistiksel olarak anlamlı bir iyileşme sağlamıştır (p
<0,0001). Taramada kullanılan GLP-1 reseptör agonisti alt tipi (günde bir / iki kez veya haftalık formülasyon) ile önceden belirlenmiş bir analiz, 26. haftadaki HbA1c değişikliğinin her alt grup için benzer olduğunu ve tüm popülasyon için primer analizle tutarlılık gösterdiğini ortaya koymuştur. 26. haftadaki ortalama günlük SOLIQUA dozu 43,5 doz adımıdır.
Çalışmanın diğer sonlanım noktaları için aşağıdaki şekil 3 ve tablo 6'ya bakınız.
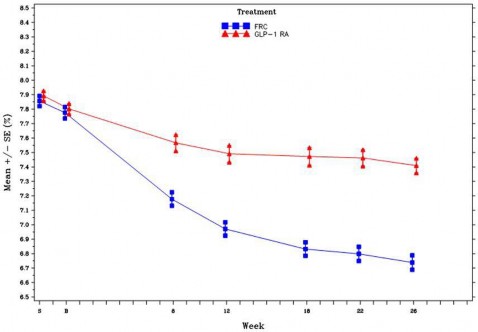
Tablo 6 - 26. haftadaki sonuçlar – GLP-1 reseptör agonisti ile kontrol edilemeyen Tip 2 Diyabetli mITT popülasyonunda Çalışma
| SOLIQUA | GLP-1 reseptör agonisti |
Gönüllü sayısı (mITT) | 252 | 253 |
HbA1c (%) |
|
|
Başlangıç (ortalama; hazırlık fazı sonrası) | 7,8 | 7,8 |
Tedavi sonu (ortalama) | 6,7 | 7,4 |
Başlangıçtan LS değişikliği (ortalama) | -1,0 | -0,4 |
GLP-1 reseptör agonistine karşı fark [%95 güven aralığı] (p-değeri) | -0,6 [-0,8, -0,5] (<0,0001) | |
26. haftada HbA1c <7'ye ulaşan hasta [n (%)] | 156 (%61,9) | 65 (%25,7) |
GLP-1 reseptör agonistine karşı fark yüzdesi [%95 güven aralığı] | %36,1 (%28,1 ila %44,0) | |
(p-değeri) | <0,0001 | |
Açlık plazma glukozu (mmol/L) |
|
|
Başlangıç (ortalama) | 9,06 | 9,45 |
Çalışma sonu (ortalama) | 6,86 | 8,66 |
Başlangıçtan LS değişikliği (ortalama) | -2,28 | -0,60 |
GLP-1 reseptör agonistine karşı fark [%95 güven aralığı] (p-değeri) | 1,67 (-2,00 ila 1,34) (<0,0001) | |
2 saatlik PPG (mmol/L)* |
|
|
Başlangıç (ortalama) | 13,60 | 13,78 |
Çalışma sonu (ortalama) | 9,68 | 12,59 |
Başlangıçtan LS değişikliği (ortalama) | -4,0 | -1,11 |
GLP-1 reseptör agonistine karşı LS farkı (ortalama) | -2,9 | |
[%95 güven aralığı] (p-değeri) | [-3,42 ila -2,28] (<0,0001) | |
Ortalama vücut ağırlığı |
|
|
Başlangıç (ortalama) | 93,01 | 95,49 |
Başlangıçtan LS değişikliği (ortalama) | 1,89 | 1,14 |
GLP-1 reseptör agonistine karşı karşılaştırma [%95 güven aralığı] (p-değeri) | -3,03 (2,417 ila 3,643) (<0,0001) | |
* 2. saat PPG eksi öğün öncesi glukoz değeri
Şekil 3 - 26 haftalık randomize tedavi süresi boyunca ziyarette ortalama HbA1c (%) - mITT popülasyonu
SOLIQUA'nın SGLT-2 inhibitörleri (SGLT2i) ile birlikte kullanımı
SOLIQUA ile SLGT2i'nin birlikte kullanımı 3 Faz 3 randomize klinik çalışmaya ait bir alt grup analizi ile desteklenmiştir (insülin glarjin/liksisenatid sabit oran kombinasyonu kullanan ve aynı zamanda SGLT2i alan 119 hasta).
Avrupa ve Kuzey Amerika'da gerçekleştirilen bir çalışma insülin glarjin/liksisenatid sabit oran kombinasyonu, metformin ve bir SGLT2i'yi birlikte kullanan 26 (%10.1) hastadan elde edilen verileri içermektedir. Oral antidiyabetiklerle yeterli glisemik kontrole ulaşamayan hastalarda gerçekleştirilen, Japon klinik geliştirme programına ait iki ilave Faz 3 çalışması, SGLT2i ve insülin glarjin/liksisenatid sabit oran kombinasyonunu beraber kullanan sırasıyla 59 (%22,7) ve 34 (%21,1) hasta için veri sağlamıştır.
Bu 3 çalışmadan elde edilen veriler, SGLT2i içeren bir tedavi ile yeterli kontrol sağlanamayan hastalarda SOLIQUA tedavisine başlanmasının, karşılaştırılanlara oranla HbA1c değerinde iyileşme sağladığını göstermiştir. Hipoglisemi riskinde bir artış olmamış ve SGLT2i kullananlarda, kullanmayanlara kıyasla, genel güvenlilik profilinde ilgili bir değişiklik gözlemlenmemiştir.
Kardiyovasküler sonuç çalışmaları
İnsülin glarjin ve liksisenatidin kardiyovasküler güvenliliği, sırasıyla ORIGIN ve ELIXA klinik çalışmalarında belirlenmiştir. SOLIQUA ile özel kardiyovasküler sonuç çalışması gerçekleştirilmemiştir.
İnsülin glarjin
Başlangıç Glarjin Müdahalesi ile Sonuç Azaltma çalışması (ORIGIN), LANTUS'u, majör advers kardiyovasküler olayın (MACE) ilk meydana gelmesine kadar geçen sürede standart bakımla karşılaştıran açık etiketli, randomize, 12.537 hastadan oluşan bir çalışmadır. MACE, kardiyovasküler ölüm, ölümcül olmayan miyokardiyal enfarktüs ve ölümcül olmayan inme kompoziti olarak tanımlanmıştır. Çalışma takibinin ortalama süresi 6,2 yıldı. LANTUS ve ORIGIN'deki standart bakım arasındaki MACE insidansı benzerdi [MACE için Tehlike Oranı (%95 CI); 1,02 (0,94, 1,11)].
Liksisenatid
ELIXA çalışması, yakın tarihte meydana gelen Akut Koroner Sendrom sonrasında tip 2 diyabetli hastalarda (n=6068) liksisenatid tedavisi sırasındaki kardiyovasküler (CV) sonuçları değerlendiren randomize, çift kör, plasebo kontrollü, çok uluslu bir çalışmaydı. Primer kompozit etkililik sonlanım noktası, aşağıdaki olaylardan herhangi birinin ilk meydana gelmesine kadar geçen süredir: Kardiyovasküler ölüm, ölümcül olmayan miyokardiyal enfarktüs, ölümcül olmayan inme veya unstabil anjin için hastaneye yatırılma. Çalışma takibinin medyan süresi, liksisenatid grubu veya plasebo grubunda sırasıyla 25,8 ve 25,7 aydı.
Primer sonlanım noktası insidansı, liksisenatid (%13,4) ve plasebo gruplarında (%13,2) benzerdi: plaseboya karşı liksisenatide yönelik tehlike oranı (HR), 0,886 ile 1,168 değerinde bağlantılı 2 yönlü %95 güven aralığı ile 1,017'ydi.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
İnsülin glarjin/liksisenatid oranı, SOLIQUA'daki insülin glarjin ve liksisenatidin PK değeri üzerinde bir etkiye sahip değildir.
İnsülin glarjin/liksisenatid kombinasyonlarının tip 1 diyabeti olan hastalara subkütan olarak uygulanmasından sonra insülin glarjin belirgin pik göstermemiştir. İnsülin glarjin/liksisenatid kombinasyonu uygulamasını takiben insülin glarjine maruziyet, ayrı olarak eş zamanlı insülin glarjin ve liksisenatid uygulaması ile karşılaştırıldığında %86-88 aralığındaydı. Bu fark klinik olarak anlamlı değildir.
İnsülin glarjin/liksisenatid kombinasyonlarının tip 1 diyabeti olan hastalara subkütan olarak uygulanmasından sonra, liksisenatidin medyan tdeğeri 2,5 ile 3,0 saat aralığındaydı. EAA benzer iken insülin glarjin ve liksisenatidin ayrı olarak eş zamanlı uygulaması ile karşılaştırıldığında liksisenatidin Cdeğerinde %22-34 oranında küçük bir düşüş olmuş olup, bu klinik olarak anlamlı değildi.
Liksisenatid tek başına subkütan olarak karın, kol veya uyluğa uygulandığında emilim oranında klinik olarak anlamlı fark yoktur.
Dağılım:
Liksisenatid, insan proteinlerine düşük düzeyde (%55) bağlanmaktadır. İnsülin glarjin/liksisenatid kombinasyonunun subkütan olarak uygulanmasından sonra liksisenatid dağılımının görünür hacmi (Vz/F) yaklaşık 100 L'dir. İnsülin glarjin/liksisenatid kombinasyonunun subkütan olarak uygulanmasından sonra insülin glarjin dağılımının görünür hacmi (Vss/F) yaklaşık 1700 L'dir.
Biyotransformasyon:
Tek başına insülin glarjin alan diyabetik hastalarda yürütülen metabolizma çalışması, insülin glarjinin iki aktif metabolitini, M1 (21-Gly- insülin) ve M2'ye (21-Gly-des-30-Thr-insülin), oluşturmak için B zincirinin karboksil terminusunda hızla metabolize olduğunu göstermiştir. Plazmada, dolaşımda olan ana bileşik metabolit M1'dir. Farmakokinetik ve farmakodinamik bulgular insülin glarjin ile subkütan enjeksiyonun etkisinin esas olarak M1'e maruziyete dayandığını göstermektedir.
Eliminasyon:
Bir peptit olarak liksisenatid, glomerüler filtrasyon, ardından tübüler reabsorpsiyon ve sonrasında metabolik bozunma ile elimine edilir, protein metabolizmasına tekrar giren daha küçük peptitler ve amino asitler oluşur. Tip 2 diyabetli hastalarda çoklu-doz uygulaması sonrası, ortalama terminal yarı-ömür yaklaşık 3 saatti ve ortalama görünür klerens (CL/F) 35 L/sa'ya yakındı.
Doğrusallık/doğrusal olmayan durum:
Veri bulunmamaktadır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Hafif (Cockcroft-Gault formülü ile hesaplanmış kreatinin klerensi 60-90 mL/dak), orta (kreatinin klerensi 30-60 mL/dak) ve şiddetli (kreatinin klerensi 15-30 mL/dak) böbrek yetmezliği olan olgularda liksisenatid EEA değeri sırasıyla %46, %51 ve %87 artmıştır.
İnsülin glarjin böbrek yetmezliği bulunan hastalarda çalışılmamıştır. Diğer yandan, böbrek yetmezliği olan hastalarda insülin gereksinimleri, azalmış insülin metabolizması nedeniyle azalabilir.
Karaciğer yetmezliği:
Liksisenatid başlıca böbreklerle atıldığından, akut veya kronik karaciğer yetmezliği olan hastalarda farmakokinetik çalışma yapılmamıştır. Karaciğer fonksiyon bozukluğunun, liksisenatidin farmakokinetiklerini etkilemesi beklenmemektedir.
İnsülin glarjin karaciğer yetmezliği bulunan hastalarda çalışılmamıştır. Karaciğer yetmezliği olan hastalarda insülin gereksinimleri, azalmış glukoneojenez kapasitesi ve azalmış insülin metabolizması nedeniyle azalabilir.
Yaş, ırk, cinsiyet ve vücut ağırlığı:
İnsülin glarjin
Yaş, ırk ve cinsiyetin insülin glarjinin farmakokinetikleri üzerindeki etkisi değerlendirilmemiştir. İnsülin glarjinle (100 ünite/mL) yetişkinlerde yürütülen kontrollü klinik çalışmalarda, yaş, ırk ve cinsiyete dayanan alt grup analizleri, güvenlilik ve etkililikte farklılık göstermemiştir.
Liksisenatid
Yaşın liksisenatid farmakokinetiği üzerinde klinik olarak ilgili etkisi bulunmamaktadır. Diyabetik olmayan yaşlılarda yürütülen bir farmakokinetik çalışmada, 20 mcg liksisenatid uygulaması yaşlı popülasyonda (11 olgu 65 ile 74 yaş arası ve 7 olgu ≥75 yaşında) 18 ile 45 yaş arası 18 olgu ile karşılaştırıldığında liksisenatid EAA değerinde ortalama %29'luk bir artışla sonuçlanmış olup, bunun daha yaşlı hasta grubunda azalmış böbrek fonksiyonları ile ilişkili olması muhtemeldir.
Cinsiyetin liksisenatid farmakokinetiği üzerinde klinik olarak ilgili etkisi bulunmamaktadır. Vücut ağırlığı liksisentaid EAA değeri üzerinde klinik olarak ilgili etkisi bulunmamaktadır.
İmmünojenisite:
Anti-liksisenatid antikorları varlığında, liksisenatid maruziyeti ve maruziyette değişkenlik doz seviyesinden bağımsız olarak belirgin şekilde artar.
Pediatrik popülasyon:
Çocuklarda ve 18 yaşın altındaki ergenlerde SOLIQUA ile herhangi bir çalışma yapılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Tekrarlayan doz toksisitesi, karsinojenez, genotoksisite veya üreme toksisitesini değerlendirmek için insülin glarjin ve liksisenatid kombinasyonuyla hayvan çalışmaları gerçekleştirilmemiştir.
İnsülin glarjin
İnsülin glarjine yönelik klinik dışı veriler, güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite, karsinojenik potansiyel, üreme toksisitesine ilişkin konvansiyonel çalışmalara dayanarak insanlara yönelik özel bir tehlike olmadığını ortaya koymuştur.
Liksisenatid
2 yıllık subkütan karsinojenisite çalışmalarında, sıçanlarda ve farelerde ölümcül olmayan C- hücreli tiroit tümörleri görülmüş ve özellikle kemirgenlerin duyarlı olduğu genotoksik olmayan GLP-1 reseptör aracılı mekanizmanın neden olduğu görülmektedir. C-hücre hiperplazisi ve adenoma, sıçanlarda tüm dozlarda görülmüştür ve herhangi bir advers etki gözlenmeyen düzey (NOAEL) tanımlanamamıştır. Farelerde bu etkiler, terapötik dozdaki insan maruziyeti ile karşılaştırıldığında 9,3 katından fazla bir maruz kalım oranında meydana gelmiştir. Farelerde C-hücreli karsinom gözlenmemiş ve sıçanlarda C-hücreli karsinom, sıçanlarda insan terapötik dozunun yaklaşık 900 katına maruz kalındığında meydana gelmiştir.
Farelerde yürütülen 2 yıllık subkütan karsinojenite çalışmasında, maruziyet oranı 97-kata eşdeğer istatistiksel olarak anlamlı artış olan orta doz grubunda 3 endometriyum adenokarsinomu vakası görülmüştür. Tedavi ilişkili etki gösterilmemiştir.
Hayvan çalışmaları, sıçanlarda erkek ve dişi fertilitesiyle ilgili olarak doğrudan zararlı etki göstermemiştir Liksisenatidle tedavi edilen köpeklerde reversibl testiküler ve epididimal lezyonlar görülmüştür. Sağlıklı erkeklerde spermatojenez üzerinde ilgili etki olmadığı görülmüştür.
Embriyo-fetal gelişim çalışmalarında, sıçanlarda liksisenatidin tüm dozlarında (insan maruz kalması ile karşılaştırıldığında 5 kat maruz kalma oranı) ve tavşanlarda liksisenatidin yüksek dozlarında (insan maruz kalması ile karşılaştırıldığında 32 kat maruz kalma oranı) sakatlıklar,
büyüme geriliği, kemikleşme geriliği ve iskeletle ilgili etkiler gözlenmiştir. Her iki türde de, düşük gıda tüketimi ve düşük vücut ağırlığından oluşan hafif maternal toksisite söz konusuydu. Yenidoğan büyümesi, gözlemlenen hafif artmış yavru mortalitesi ile geç gebelik ve emzirme sırasında liksisenatidin yüksek dozlarına maruz kalan erkek sıçanlarda azalmıştır.
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
İLAÇ GENEL BİLGİLERİ
Sanofi Sağlık Ürünleri Ltd.Şti
| Satış Fiyatı | 1888.04 TL [ 2 May 2025 ] |
| Önceki Satış Fiyatı | 1888.04 TL [ 25 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699809951105 |
| Etkin Madde | Insulin Glarjin + Liksisenatid |
| ATC Kodu | A10AE54 |
| Birim Miktar | 100U+33MCG |
| Birim Cinsi | U/ML+MCG/M |
| Ambalaj Miktarı | 3 |
| Sindirim Sistemi ve Metabolizma > İnsülinler ve Analogları |
| İthal ( ref. ülke : Slovenya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |