SOMAVERT 15 mg 30 flakon Kısa Ürün Bilgisi
{ Pegvisomant }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SOMAVERT® 15 mg enjeksiyonluk çözelti için toz içeren flakon ve çözücü Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Pegvisomant 15 mg
Sulandırıldıktan sonra 1 ml çözelti 15 mg pegvisomant içerir.
(Pegvisomant, rekombinant DNA teknolojisiyle Escherichia coli kullanılarak üretilmiş bir
proteindir).
Yardımcı maddeler
Sodyum Fosfat Dibazik, Susuz 1,04 mg Sodyum Fosfat, Monobazik (Monohidrat) 0,36 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
SOMAVERT, enjeksiyonluk çözelti için toz içeren flakon ve çözücü içerir.
Toz, beyaz ile hafif kırık beyaz arası bir renktedir. Ürünün çözücüsü olan enjeksiyonluk su berrak ve renksizdir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
SOMAVERT, cerrahi ve/veya radyasyon terapisi ve/veya diğer tıbbi tedavilere yetersiz yanıt veren veya bu tedavilerin etkili veya uygun olmadığı hastalarda akromegalinin tedavisi için endikedir. Tedavinin amacı, serum IGF-I seviyelerini normale çevirmektir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresiTedavi, akromegali tedavisinde uzmanlaşmış bir doktor denetiminde başlatılmalıdır.
Doktor gözetiminde 80 mg SOMAVERT yükleme dozu subkutan olarak uygulanmalıdır. Bunu takiben 10 mg SOMAVERT 1 ml çözücü içinde seyreltilerek subkutan enjeksiyonlar halinde günlük olarak uygulanmalıdır.
Doz ayarlamalarında serum IGF-I değerleri baz alınmalıdır. Serum IGF-I konsantrasyonları
her dört veya altı haftadabirölçülmelidirve serumIGF-I konsantrasyonunun yaşa göre
ayarlanmış normal aralık içerisindeki seviyesini ve optimal terapötik yanıtı korumak için
uygun doz ayarlamaları 5 mg/gün'lük artışlar ile yapılmalıdır.
SOMAVERT'e başlamadan önce karaciğer enzimlerinin başlangıç seviyelerinin
değerlendirilmesi
SOMAVERT'e başlamadan önce hastalar karaciğer testlerinin (LT) [serum alanin aminotransferaz (ALT), aspartat aminotransferaz (AST), serum toplam bilirubin (TBIL) ve alkalin fosfataz (ALP)] başlangıç seviyeleri açısından değerlendirme geçirmelidirler. Başlangıç LT değerlerine ve SOMAVERT tedavisi sırasında gözlemlenen LT değerleri baz alınarak SOMAVERT tedavisi ile ilgili öneriler için bölüm 4.4 özel kullanım uyarılar ve önlemleri bölümündeki Tablo A'ya bakınız.
Maksimum doz 30 mg/gündür.
Farklı dozaj rejimleri için aşağıdaki formlar mevcuttur:
SOMAVERT 10mg, 15mg ve 20mg.
Uygulama şekli
SOMAVERT subkutan enjeksiyon olarak uygulanmalıdır.
Her seferinde farklı enjeksiyon yeri seçilerek lipohipertrofi önlenebilir.
Ürünün uygulama öncesi sulandırılması ile ilgili talimatlar için 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Karaciğer/böbrek yetmezliği:
SOMAVERT'in böbrek veya karaciğer yetmezliği olan hastalardaki güvenliliği ve etkililiği belirlenmemiştir.
Pediyatrik popülasyon:
SOMAVERT'in 0 yaşından 17 yaşa kadar olan çocuklarda güvenliliği ve etkililiği belirlenmemiştir. Veri mevcut değildir.
Geriyatrik popülasyon:
Herhangi bir doz ayarlaması gerekmemektedir.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Büyüme hormonu salgılayan tümorler
Serum IGF-1 izlenmesi
SOMAVERT büyüme hormonunun potent bir antagonistidir. Serum büyüme hormonu değerleri artmış olmasına rağmen bu ilacın uygulaması sonucunda büyüme hormonu eksikliği durumu ortaya çıkabilir. Serum IGF-I konsantrasyonları takip edilmeli ve SOMAVERT dozunun ayarlanmasıyla yaşa göre ayarlanmış normal aralıkta tutulmalıdır.
AST/ALT yükselmesi
SOMAVERT'e başlamadan önce hastalar karaciğer testlerinin (LT) [serum alanin aminotransferaz (ALT), aspartat aminotransferaz (AST), serum toplam bilirubin (TBIL) ve alkalin fosfataz (ALP)] başlangıç seviyeleri açısından değerlendirme geçirmelidirler.
Daha önce somatostatin analoğu ile tedavi öyküsü veya ALT ve AST yükselmesi olan hastalarda obstrüktif safra yolu hastalığına dair kanıtlar ekarte edilmelidir. Karaciğer hastalığının bulguları devam ederse SOMAVERT uygulaması sonlandırılmalıdır.
Başlangıç LT değerleri baz alınarak SOMAVERT tedavisine başlanması ve SOMAVERT tedavisi sırasındaki karaciğer testlerinin izlenmesi ile ilgili öneriler için Tablo A'ya bakınız.
Tablo A: Başlangıç LT değerleri baz alınarak SOMAVERT tedavisine başlanması ve SOMAVERT tedavisi sırasındaki karaciğer testlerinin periyodik izlenmesi ile ilgili öneriler
Başlangıç LT Değerleri | Öneriler |
Normal | |
Artmış, fakat ≤ 3x ULN | |
> 3 xULN |
SOMAVERT ile tedavi edilebilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Herhangi bir etkileşim çalışması yapılmamıştır. Somatostatin analoglarıyla tedaviye devam edilip edilmeyeceği düşünülmelidir. Akromegali tedavisinde diğer ürünlerle kombine halde SOMAVERT kullanımı kapsamlı olarak araştırılmamıştır.
SOMAVERT'in insülin duyarlılığı üzerindeki etkilerinden ötürü insülin veya oral hipoglisemik tıbbi ürünleri alan hastalarda bu etkin maddelerin dozunun azaltılması gerekebilir (bkz. bölüm 4.4.).
SOMAVERT'in büyüme hormonu ile belirgin yapısal benzerliğe sahip olması, mevcut ticari
büyüme hormonu tayinlerinde çapraz reaksiyon vermesine neden olur.
Terapötik olarak etkili dozlarda SOMAVERT'in serum konsantrasyonlarının, akromegali hastalarında gözlenen gerçek serum büyüme hormonu seviyelerinden genellikle 100 ila 1000 kat daha yüksek olmasından dolayı, ticari olarak mevcut büyüme hormonu tayinleri, gerçek büyüme hormonu seviyelerini olduğundan fazla gösterecektir. Bu nedenle, SOMAVERT tedavisi, bu ölçümlerden elde edilen serum büyüme hormonu konsantrasyonlarına dayanarak izlenmemelidir veya ayarlanmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Veri mevcut değildir.
Karaciğer/böbrek yetmezliği:
Veri mevcut değildir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Hastalara gerektiği takdirde uygun doğum kontrol yöntemi kullanmaları önerilmelidir (bkz. bölüm 4.4).
Gebelik dönemi
SOMAVERT'in gebe kadınlarda kullanımı ile ilgili sınırlı sayıda veri mevcuttur.
Hayvanlar üzerinde yapılan çalışmalar, gebelik/ ve-veya/ embriyonal/fetal gelişim/ve-veya/ doğum/ ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. bölüm 5.3.). İnsanlara yönelik potansiyel risk bilinmemektedir.
SOMAVERT'in gebelik döneminde ve doğum kontrol yöntemi kullanmayan çocuk doğurma potansiyeli olan kadınlarda kullan ımıönerilmemektedir.
Hamilelik sırasında SOMAVERT kullanılmışsa IGF-I düzeyleri (özellikle ilk 3 aylık dönemde) yakından takip edilmelidir. Hamilelik döneminde doz ayarlaması yapılması gerekebilir (bkz. bölüm 4.4).
Laktasyon dönemi
SOMAVERT'in anne sütüne geçişi hayvanlar üzerinde incelenmemiştir. SOMAVERT'in insan sütüne geçişi konusunda fikir vermek açısından klinik veriler çok kısıtlıdır (bildirilen bir vaka). Bundan dolayı emziren kadınlarda SOMAVERT kullanılmamalıdır. Ancak SOMAVERT kesilirse emzirmeye devam edilebilir. Bu karar, SOMAVERT tedavisinin anneye faydası ve anne sütünün çocuğa faydası göz önünde bulundurularak verilmelidir.
Üreme yeteneği / Fertilite
SOMAVERT için fertilite ile ilgili klinik veri bulunmamaktadır.
Hastanın klinik durumunun iyiye gitmesi ile sonuçlanan IGF-I konsantrasyonundaki düşüşün terapötik faydaları potansiyel olarak kadın hastaların fertilitesinde de iyileşme sağlayabilir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanım becerisi ile ilgili çalışma yapılmamıştır.
4.8. İstenmeyen etkiler
Aşağıdaki liste SOMAVERT klinik çalışmalarında görülen istenmeyen reaksiyonları
içermektedir.
Klinik çalışmalarda SOMAVERT ile tedavi edilen hastalarda (n=550), advers reaksiyonların
çoğu hafif ila orta şiddettedir, süreleri kısıtlıdır ve tedavinin kesilmesini gerektirmemişlerdir.
Klinik çalışmalarda SOMAVERT ile tedavi edilen akromegali hastalarının yüzde ≥10 kadarında ortaya çıkan, en çok bildirilen advers reaksiyonlar baş ağrısı (%25), artralji (%16) ve diyaredir (%13).
Advers reaksiyonlar aşağıdaki kategorilere göre sıralanmaktadır:
Aşağıdaki liste klinik çalışmalarda görülen ve spontan olarak bildirilen istenmeyen etkileri içermekte olup sistem organ sınıfına ve sıklığına göre sınıflandırılmıştır (çok yaygın (≥ 1/10), yaygın (≥ 1/100 ila < 1/10), yaygın olmayan (≥ 1/1.000 ila < 1/100), seyrek (≥ 1/10.000 ila
<1/1.000) çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)).
Kan ve lenf sistemi hastalıkları
Yaygın olmayan : Trombositopeni, lökopeni, lökositoz, kanama eğilimi
Bağışıklık sistemi hastalıkları
Yaygın olmayan : Hipersensitivite reaksiyonlarıb
Bilinmiyor : Anafilaktik reaksiyonb, anafilaktoid reaksiyonb
Metabolizma ve beslenme hastalıkları
Yaygın : Hiperkolesterolemi, hiperglisemi, hipoglisemi, kilo alma
Yaygın olmayan : Hipertrigliseridemi
Psikiyatrik hastalıklar
Yaygın : Normal olmayan rüyalar
![]()
Yaygın olmayan :Panik atak, kısa dönemli hafıza kaybı, apati, konfüzyon, uyku
bozukluğu, libido artışı
Bilinmiyor : Asabiyet
Sinir sistemi hastalıkları
Çok yaygın : Baş ağrısı
Yaygın : Somnolans, tremor, baş dönmesi, hipoestezi Yaygın olmayan : Narkolepsi, migren, disguzi
Göz hastalıkları
Yaygın : Gözde ağrı
Yaygın olmayan : Astenopi
Kulak ve iç kulak hastalıkları
Yaygın olmayan : Meniere hastalığı
Kardiyak hastalıklar
Yaygın : Periferik ödem
Vasküler hastalıklar
Yaygın : Hipertansiyon
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın : Dispne
Bilinmiyor : Laringospazmb
Gastrointestinal hastalıklar
Çok yaygın : Diyare
Yaygın : Kusma, konstipasyon, bulantı, abdominal distansiyon, dispepsi, gaz
Yaygın olmayan :Hemoroid, aşırı tükürük sekresyonu, ağız kuruluğu, diş hastalığı
Hepato-biliyer hastalıklar
Yaygın :Normal olmayan karaciğer fonksiyon test sonuçları (örneğin transaminaz yüksekliği) (ayrıca Bölüm 4.4' e bakınız)
Deri ve derialtı doku hastalıkları
Yaygın : Aşırı terleme, kontüzyon, pirüritb, döküntüb
Yaygın olmayan :Yüzde ödem, ciltte kuruluk, morarma eğiliminde artma, gece terlemeleri, eritemb, ürtikerb
Bilinmiyor : Anjiyoödemb
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Çok yaygın : Artralji
Yaygın : Miyalji, artrit
Böbrek ve idrar yolu hastalıkları
Yaygın : Hematüri
Yaygın olmayan : Proteinüri, poliüri, renal fonksiyon bozukluğu
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın :Enjeksiyon bölgesi reaksiyonu, (enjeksiyon bölgesi aşırı duyarlılığı dahil), enjeksiyon yerinde morarma ya da kanama, enjeksiyon bölgesi hipertrofisi, (örneğin lipohipertrofi)a, grip benzeri rahatsızlık, yorgunluk, asteni, pireksi
Yaygın olmayan : İyi hissetmeme, iyileşmede bozukluk, açlık
a Aşağıda yer alan ilave bilgilere bakınız.
b Hipersensitivite reaksiyonu ile ilişkili istenmeyen etkiler
Seçilen yan etkilerın tanımı
Enjeksiyon bölgesi reaksiyonlarının çoğu lokalize eritem ve sızı ile karakterizedir ve SOMAVERT tedavisine devam edilirken lokal semptomatik tedavi ile kendiliğinden geçmektedir. Lipohipertrofi dahil enjeksiyon bölgesinde hipertrofi oluşumu gözlenmiştir.
SOMAVERT ile tedavi edilen hastaların %16,9'unda düşük titreli izole anti-büyüme hormonu
antikorları gelişmiştir. Bu antikorların klinik anlamlılığı bilinmemektedir.
Anafilaktik/anafilaktoid reaksiyonları da içeren sistemik hipersensitivite reaksiyonları, laringospazm, anjiyoödem, genel cilt reaksiyonları (döküntü, eritem, prurit, ürtiker) pazarlama sonrası kullanımda raporlanmıştır. Bazı hastaların hastaneye yatırılması gerekmiştir. Tekrar uygulamada semptomlar tüm hastalarda tekrar oluşmamıştır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
SOMAVERT doz aşımı ile ilgili deneyimler kısıtlıdır. Rapor edilen bir akut doz aşımı vakasında, 80 mg/gün 7 gün boyunca uygulanmıştır ve hastanın halsizlik ve ağız kuruluğu biraz artmıştır. Tedavinin kesilmesini takip eden haftada şu advers reaksiyonlar gözlenmiştir: insomnia, halsizlik artışı, periferal ödem, tremor ve kilo alma. Tedavinin kesilmesinden 2 hafta sonra lökositoz ve enjeksiyon yerinde ve ven ponksiyon bölgelerinde orta dereceli kanama gözlenmiştir ve bu etkilerin muhtemelen SOMAVERT ile ilişkili olduğu düşünülmüştür.
Aşırı doz olgularında, SOMAVERT uygulaması kesilmeli ve IGF-I seviyeleri normal aralığa
veya bu seviyenin üzerine gelene dek tedaviye yeniden başlanmamalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer ön hipofiz lobu hormonları ve analogları ATC kodu: H01AX01
Etki mekanizması
Pegvisomant genetik olarak büyüme hormonu reseptör antagonistine modifiye edilen insan büyüme hormonu analoğudur. Pegvisomant, hücre yüzeylerinde büyüme hormonu reseptörlerine bağlanır ve buralarda büyüme hormonunun bağlanmasını engeller ve böylece hücre içi büyüme hormonu sinyal iletimini bozar. Pegvisomant, GH reseptörü için oldukça seçicidir ve prolaktin dahil diğer sitokin reseptörleriyle, çapraz reaksiyon vermez.
Farmakodinamik etkiler
Pegvisomant ile büyüme hormonunun etkisinin inhibisyonu, insülin benzeri büyüme faktörü-I (IGF-I)' in, ayrıca büyüme hormonuna duyarlı serbest IGF-I, IGF bağlayan protein-3 (IGFBP- 3) ve aside dayanıksız IGF-I alt-ünitesi (ALS) gibi diğer serum proteinlerinin konsantrasyonlarında azalma ile sonuçlanır.
Klinik etkililik ve güvenlilik
Akromegalik hastalar (n=112) plasebo ve pegvisomantın karşılaştırıldığı 12 haftalık, randomize, çift kör, çok merkezli bir çalışmada tedavi edilmişlerdir. SOMAVERT tedavisi uygulanan grupta ortalama IGF-I (p<0,0001), serbest IGF-I (p<0,05), IGFBP-3 (p<0,05) ve ALS'de (p<0,05) başlangıçtan sonraki tüm vizitlerde doz bağımlı bir şekilde, istatistiksel olarak anlamlı düşüşler görülmüştür. Çalışma sonunda (12. hafta) plasebo, 10 mg/gün, 15 mg/gün ya da 20 mg/gün SOMAVERT ile tedavi edilen deneklerin sırasıyla %9,7, %38,5,
%75 ve %82 kadarında serum IGF-I normalleşmiştir.
Plasebo ile karşılaştırılan tüm doz gruplarında toplam bulgu ve belirti skorlarındaki iyileşme açısından plasebodan (p<0,05) istatistiksel olarak anlamlı farklılıklar gözlemlenmiştir.
38 akromegalik denekten oluşan bir grup, her gün pegvisomant dozunun uygulandığı en az 12 ay (ortalama=55 hafta) boyunca uzun dönemli, açık etiketli, doz titrasyonlu bir kohort çalışmada izlenmiştir. Bu kohorttaki ortalama IGF-I konsantrasyonu pegvisomant ile 917 ng/mL'den 299 ng/mL'ye düşerken %92 kadarında normal (yaşa uygun) IGF-I konsantrasyonu sağlanmıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Derialtına uygulamayı takiben pegvisomant emilimi uzun ve yavaştır, doruk serum pegvisomant konsantrasyonlarına, genellikle uygulamadan 33 ila 77 saat sonrasına kadar ulaşılamaz. Derialtına uygulanan dozun ortalama emilimi intravenöz uygulanan doza göre
%57'dir.
Dağılım:
Pegvisomantın görünür dağılımhacmigöreceliolarakküçüktü r (7-12 L).
Biyotransformasyon:
Pegvisomant metabolizması çalışılmamıştır.
Eliminasyon:
Çoklu dozları takiben pegvisomantın ortalama toplam vücut sistemik klirensinin, 10 ila 20 mg/gün arasında değişen subkutan dozlar için 28 ml / saat olduğu tahmin edilmektedir. Pegvisomatın renal klirensi göz ardı edilebilir ve toplam vücut kliresinin %1'inden az olarak hesaplanmıştır. Pegvisomant tekli ya da çoklu dozların ardından genel olarak tahmini 74-172 saat aralığındaki ortalama yarılanma ömrü ile, serumdan yavaşça elimine edilebilir.
Doğrusallık/Doğrusal Olmayan Durum:
Derialtına tek doz pegvisomant uygulamasından sonra 10, 15, 20 mg'lık artan dozlarda doğrusallık gözlenmemiştir. Popülasyon farmakokinetiği çalışmalarında kararlı halde yaklaşık olarak lineer farmakokinetik gözlemlenmiştir. İki uzun dönemli çalışmada 10-15-20 mg günlük doz alan 145 hastadan elde edilen verilere göre ortalama pegvisomant serum konsantrasyonları (±SD) sırasıyla 8.800 ± 6.300ng/mL, 13.200 ± 8.000 ng/mL, 15.600 ±
10.300 ng/mL olarak saptanmıştır.
Pegvisomant farmakokinetiği normal sağlıklı gönüllüler ve akromegali hastalarında benzerdir ancak zayıf kişilere nazaran daha ağır olan kişilerde pegvisomantın toplam vücut klirensi daha yüksek olmaya meyillidir; dolayısıyla daha yüksek dozda pegvisomant gerekebilir.
5.3. Klinik öncesi güvenlilik verileri
Sıçan ve maymunlarda tekrarlanan doz toksisitesi çalışmalarına dayanılarak klinik dışı veriler insanlar için herhangi bir özel risk göstermemiştir. Bununla birlikte, maymunlardaki belirgin farmakolojik yanıttan ötürü, terapötik dozlar alan hastalarda erişilenden daha yüksek sistemik maruziyetler çalışılmamıştır. Tavşanlardaki bir segment II testi (deney hayvanları üzerinde yapılan bir teratojenite testidir) dışında başka herhangi bir üreme toksisite çalışması gerçekleştirilmemiştir.
Günlük 30 mg doz uygulanan iki uzun dönemli çalışmadaki, ortalama plazma konsantrasyonlarına dayanarak insan maruziyetinin üç katına eşit maruziyet düzeylerinde yapılan sıçan karsinojenite çalışmalarında, erkeklerde enjeksiyon bölgelerinde fibrozis ve histiositik inflamasyon ile ilişkili malign fibröz histiositoma gözlemlenmiştir. İnsanlar için bu yanıtın önemi şu an için bilinmemektedir. Enjeksiyon bölgesi tümörlerinin insidansındaki artış büyük olasılıkla irritasyon ve sıçanın tekrarlayan subkutan enjeksiyona karşı geliştirdiği aşırı duyarlılıktan dolayı görülmüştür.
Hamile tavşanlarda 1,3 ve 10 mg/kg/gün SOMAVERT dozları subkutan uygulanarak erken embryonik gelişim ve embryo- fetal gelişim çalışmaları gerçekleştirilmiştir. Organogenez sırasında SOMAVERT uygulaması ile ilişkili teratojenik etkilere dair herhangi bir kanıtına rastlanmamıştır. 10 mg/kg/gün dozunda (vücut yüzey alanı baz alınarak hesaplandığında insana uygulanan maksimum terapötik dozun 6 katı) her iki çalışmada da implantasyon sonrası kayıp insidansında artış görülmüştür. Herhangi bir fertilite çalışması yapılmamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Toz:Glisin (E640) Mannitol (E421)
Sodyum fosfat dibazik susuz (E339)
Sodyum fosfat monobazik monohidrat (E339)
Çözücü:
Enjeksiyonluk su
6.2. Geçimsizlikler
Bu tıbbi ürün bölüm 6.6'da belirtilenler dışındaki hiçbir tıbbi ürünle karıştırılmamalıdır.
6.3. Raf ömrü
36 ay
Sulandırıldıktan sonra hemen kullanılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında (2°C – 8°C) saklayınız. Dondurucuya koymayınız. Işıktan korumak için için
flakon(lar)ı ve çözücü içeren kullanıma hazır enjektör(ler)i ambalajında saklayınız. Sulandırıldıktan sonra hemen kullanılmalıdır.
Enjeksiyonluk su içeren kullanıma hazır şırıngayı 30°C altında veya buzdolabında (2°C –
8°C) saklayınız. Dondurmayınız.
6.5. Ambalajın niteliği ve içeriği
15 mg pegvisomant içeren 30 adet tıpalı (klorobutil kauçuk) Tip I cam flakon ve 1 ml çözücü (enjeksiyonluk su) içeren 30 adet piston tıpalı (bromobutil kauçuk) ve ucu kapaklı (bromobutil kauçuk) kullanıma hazır enjektör (Tip 1 borosilikat cam) ve 30 adet güvenlik iğnesi
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Enjeksiyonu uygulamak için kullanılan enjektör ve güvenlik iğnesi ürün ile birlikte sağlanır.
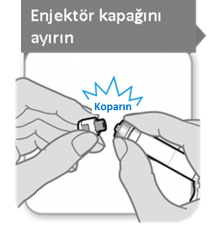
Güvenlik iğnesini yerleştirmeden önce enjektör kapağı kullanıma hazır enjektörden ayrılmalıdır. Bu işlem koparılarak yapılır. Enjektör sızıntıyı önlemek için dik tutulmalıdır ve enjektörün ucunun herhangi bir şeyle temasına izin verilmemelidir.
Toz, 1 mL çözücü kullanılarak sulandırılmalıdır. Enjektörden çözücü eklenirken flakon ve
enjektör aşağıdaki diagramda gösterilen bir açı ile tutulmalıdır.
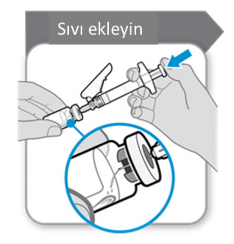
Çözücüyü toz flakonuna ekleyiniz. Köpük oluşumu olasılığını engellemek için çözücü flakonun içine yavaşça boşaltılmalıdır. Köpük oluşursa ürün kullanılamaz hale gelir. Yavaş, dairesel bir hareketle tozu nazikçe eritin. Hızla çalkalamayınız, çünkü çalkalama etkin maddenin denatürasyonuna neden olabilir.
Sulandırıldıktan sonra, sulandırılmış çözelti dış partiküller (veya herhangi bir yabancı partikül) veya fiziksel görünümde herhangi bir değişiklik açısından görsel olarak uygulamadan önce incelenmelidir. Bunlardan birinin gözlenmesi durumunda, ürün atılmalıdır.
Çözülmüş SOMAVERT'i çekmeden önce enjektör flakona yerleştirilmiş şekildeyken flakonu ters çeviriniz ve aşağıdaki diagramda gösterildiği gibi tıpadaki boşluğun görülebildiğinden emin olunuz.
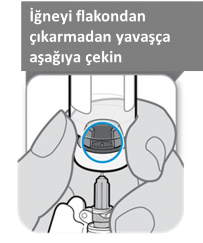
İğnenin ucu sıvı içinde en alt seviyede olacak şekilde iğneyi aşağı çekiniz. Ürünü flakondan çekmek için yavaşça enjektördeki pistonu geri çekiniz. Enjektörde hava görülürse, baloncukları üste çıkarmak için enjektörün gövdesine hafifçe vurun ve sonrasında nazikçe baloncukları enjektörün dışına itiniz.
Enjektör ve iğneyi atmadan önce iğne koruyucusunu iğnenin üzerinde yerleştirin ve yerine oturduğundan emin olunuz. Enjektör ve iğne bir daha asla kullanılmamalıdır.
Tek kullanım içindir. Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikâ€'lerine uygun olarak imha edilmelidir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Geri Ödeme Kodu | A10538 |
| Satış Fiyatı | 71632.99 TL [ 2 May 2025 ] |
| Önceki Satış Fiyatı | 71632.99 TL [ 25 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308278753 |
| Etkin Madde | Pegvisomant |
| ATC Kodu | H01AX01 |
| Birim Miktar | 15 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Endokrin Sistem > Ön Hipofiz Hormonları ve Analogları > Pegvisomant |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |