SPASMEX 30 mg 50 tablet Kısa Ürün Bilgisi
{ Trospiyum Klorür }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SPASMEX® 30 mg film tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
30 mg trospiyum klorürYardımcı maddeler
Laktoz 100 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film tablet.
Beyaz-beyazımsı, kokusuz, yuvarlak ve bir yüzü çentikli, bikonveks film tabletler.
Bir yüzünde tabletlerin yarıya bölünmesine imkan veren kırılma çentiği (SNAP-TAB) bulunmaktadır. Tablet iki eşit doza bölünebilir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
-Aşağıdaki durumlarda görülen idrara çıkma sıklığında artış (pollaküri)'nin semptomatik tedavisinde endikedir.
Non-hormonal ve non-organik vejetatif mesane fonksiyon bozuklukları (semptomatik irritable mesane, duyusal urge inkontinans).
4.2. Pozoloji ve uygulama şekli
Pozoloji/ uygulama sıklığı ve süresi:Dozaj hastalığın şiddetine ve hastanın tedaviye verdiği cevaba göre değişir.
Trospiyum Klorür'ün önerilen günlük dozu 45 mg'dır. Hastanın ilaca bireysel cevabı ve tolerabilitesi göz önünde bulundurulduktan sonra günlük doz hekim tarafından 30 mg'a azaltılabilir. O zaman doz aşağıdaki tabloya göre düzenlenmelidir.
Günlük doz | Doz/ Gün | Eşdeğer doz miktarı |
45 mg
(önerilen günlük doz) | Günde 3 defa ½ film-kaplı tablet veya Sabahları 1 film-kaplı tablet ve Akşamları ½ film-kaplı tablet | 15 mg trospiyum klorür
30 mg trospiyum klorür 15 mg trospiyum klorür |
30 mg | Günde 2 defa ½ film-kaplı tablet | 15 mg trospiyum klorür |
Uygulama şekli:
Önerilen günlük doz, her iki günde bir 1 x 15 mg (½ tablete karşılık gelir) veya 1 â 2 x 15 mg'dır (1 â 2 x ½ tablete karşılık gelir). Her bir dozaj, bireysel etkililik ve tolere edilebilirlik ölçülerek tanımlanmalıdır. 30 mg film kaplı tabletler, aşağıdaki resimde gösterildiği gibi her biri 15 mg içeren iki eşit parçaya bölünebilir.
45 mg standart günlük dozu yarıya indirmek için alternatif olarak 15 mg trospiyum klorür içeren bölünebilir tabletlerin reçete edilmesi düşünülmelidir.
Tedaviye devam edilmesi gerekliliği 3-6 aylık düzenli aralıklarla izlenmelidir.
Şekilde gösterildiği gibi tabletler iki eşit parçaya bölünebilir. Bunu yapmak için, tablet sert bir yüzeye konulur ve tableti eşit büyüklükte iki parçaya bölmek için başparmak ile (kısa, güçlü baskı uygulanır) kırma çentiğine bastırılır.
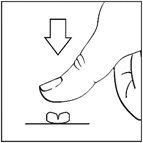
Film kaplı tabletler veya her parçası, yemeklerden önce aç karnına yeterli miktarda sıvı ile çiğnenmeden yutulmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği: Orta veya ciddi böbrek yetmezliği olan hastalarda (kreatinin klirensi 10 ile 50 mL/dk/1.73 m2) böbrek yetmezliğinin şiddetine göre başlangıç dozu azaltılmalıdır. Şiddetli böbrek yetmezliği olan hastalar ilacı yemekle birlikte almalıdır.
Karaciğer yetmezliği:
Karaciğer fonksiyonunda hafif ila orta derecede bozukluğu olan hastalarda doz ayarlaması gerekli görülmemektedir.(Child-Pugh 5-6 veya 7-9) (bkz. bölüm Farmakokinetik özellikler).
Şiddetli karaciğer fonksiyon bozukluğu (Child-Pugh > 10; sınıf C) olan hastalar için çalışmalar yapılmamıştır, yani bu vakalarda tedavi önerilemez.
Pediyatrik popülasyon: SPASMEX 12 yaşın altındaki çocuklarda yeterli veri olmadığından önerilmemektedir.
Geriyatrik popülasyon: Yaşlılarda özel bir doz ayarlamasına gerek yoktur.
4.3. Kontrendikasyonlar
Etkin madde
30 mg trospiyum klorür4.4. Özel kullanım uyarıları ve önlemleri
Trospiyum klorür aşağıdaki rahatsızlıkları olan hastalarda dikkatli şekilde kullanılmalıdır:
Gastrointestinal yolda tıkanıklık (ör. pilorik stenoz),
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Aşağıdaki etkileşimler görülebilir:
Amantadin, trisiklik antidepresanlar, kinidin, antihistaminler ve disopiramidinin antikolinerjik etkisi ve β- sempatomimetiklerin taşikardik etkisi artabilir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda trospiyum klorür kullanımıyla ilgili herhangi bir veri yoktur.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik/ ve-veya/ embriyonal/fetal gelişim/ ve-veya / doğum/ ve-veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
SPASMEX gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Hayvan çalışmalarında, trospiyum klorürün gebelik, embriyonik/fetal gelişme, doğum veya postnatal gelişme üzerinde direkt veya indirekt zararlı etkisinin olduğu hakkında hiçbir kanıt bulunmamıştır (bkz. bölüm 5.3). Yine de, SPASMEX insanlarda gebelik sırasında kullanımı konusunda hiçbir bir tecrübenin bulunmaması nedeniyle ancak endikasyonun yakından incelenmesinden sonra kullanılmalıdır.
Laktasyon dönemi
Bu ilacın insanlarda laktasyon sırasında kullanımı konusunda hiçbir tecrübenin bulunmaması nedeniyle ancak endikasyonun yakından incelenmesinden sonra kullanılmalıdır.
Üreme yeteneği /Fertilite
SPASMEX icin, üreme yeteneği/fertiliteye iliskin klinik veri mevcut değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Görme bozukluğuna bağlı olarak araç ve makine kullanım yeteneğini azaltabilir.
4.8. İstenmeyen etkiler
Yan etkilerin değerlendirilmesi sırasında, aşağıdaki sıklıklar tanımlanmıştır: Çok yaygın (≥1/10)
Yaygın (â¥1/100 ila <1/10)
Yaygın olmayan (â¥1/1 000 ila <1/100) Seyrek (â¥1/10.000 ila <1/1.000)
Çok seyrek (<1/10 000)
Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
SPASMEX ile tedavi sırasında gözlenen yan etkiler esas olarak ağız kuruluğu, dispepsi veya kabızlık gibi tipik antikolinerjik etkilerden kaynaklanır.
30 mg trospiyum klorürün kullanıldığı kontrollü bir klinik çalışmada, en az bir olası nedensel bağlantı ile ⥠%1 sıklıkta şu yan etkiler gözlenmiştir: ağız kuruluğu (%4.1), mide ağrısı (%2.4), kabızlık (%2.1), mide bulantısı (%1.2), baş dönmesi (%1.2) ve baş ağrısı (%1.1).
Trospiyum klorür içeren ilaçların piyasaya sürülmesinden sonra, gösterilen sıklıklara ve sistem organ sınıflarına göre aşağıdaki tabloda yer alan yan etkiler gözlemlenmiştir:
Sistem organ sınıfı | Çok yaygın (â¥1/10) | Yaygın (â¥1/100 to <1/10) | Yaygın olmayan (â¥1/1,000 to <1/100) | Seyrek (â¥1/10,000 to <1/1,000) | Bilinmiyor (mevcut verilerden tahmin edilemez) |
Bağışıklık sistemi hastalıkları |
|
|
| Anaflaksi | Stevens- Johnson- Syndromu (SJS), Toksik epidermal nekroliz (TEN). |
Göz hastalıkları |
|
| Akomodasyon bozuklukları (özellikle hiperop ve yeterince düzeltilmemiş |
|
|
Sistem organ sınıfı | Çok yaygın (â¥1/10) | Yaygın (â¥1/100 to <1/10) | Yaygın olmayan (â¥1/1,000 to <1/100) | Seyrek (â¥1/10,000 to <1/1,000) | Bilinmiyor (mevcut verilerden tahmin edilemez) |
Kardiyak hastalıkları |
|
| Taşikardi | Taşiaritmi |
|
Solunum göğüs bozuklukları ve mediastinal hastalıkları |
|
|
| Dispne |
|
Gastrointestinal hastalıkları | Ağız kuruluğu | Dispne, kabızlık, karın ağrısı, mide bulantısı | İshal, şişkinlik |
|
|
Deri ve deri altı doku hastalıkları |
|
| Deri döküntüleri | Anjiyoödem, |
|
Böbrek ve idrar yolu hastalıkları |
|
| İdrar yapmada rahatsızlık (örn. artık idrar oluşumu) | İdrar retansiyonu |
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar |
|
| Zayıflık, göğüs ağrıları |
|
|
Araştırmalar |
|
|
| Transaminazlarda hafif ila orta derecede artış |
|
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
İnsanlara oral yoldan verilen trospiyum klorürün en yüksek tekli dozu 360 mg'dır. Ağız kuruluğu, taşikardi ve idrara çıkma bozuklukları gözlenmiştir. Trospiyum klorürle ciddi doz aşımı veya intoksikasyon bugüne kadar bildirilmemiştir.
Doz aşımının beklenen belirtileri görmede bulanıklık, taşikardi, ağız kuruluğu ve deride kızarma gibi artan antikolinerjik semptomlardır.
Doz aşımının görülme şekline göre, aşağıdaki önlemler alınmalıdır:
Gastrik lavaj ve rezorpsiyonun azaltılması (örn. aktif kömür)
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İdrar sıklığı ve inkontinans için ilaçlar, ürolojik ilaç. ATC kodu: G04BD09
Trospiyum klorür, parasempatolitik bileşiklerden biri olan nortropanolden geliştirilen bir kuaterner amonyum türevidir. Konsantrasyonuna göre, ilaç, post sinaptik bağlanma bölgelerinde (antikolinerjik) endojen transmiter asetil kolin ile rekabet eder. İlacın, M1 ve M3- reseptörlerine afinitesi yüksek, M2- reseptörlerine afinitesi daha düşüktür ve ihmal edilebilir düşük oranda nikotinik respetörlere bağlanır.
Trospiyum klorürün doku ve organların düz adaleleri üzerindeki gevşetici etkisi (muskarinik reseptörlerle iletilenler) bulunmaktadır. Trospiyum klorür, mide- barsak ve idrar yollarında düz adale tonusunu azaltır.
Bronş, salya ve ter salgısını inhibe eder ve akomodasyonu bozar. Bugüne kadar merkezi sinir sistemi üzerine etkisi görülmemiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerDağılım:
Oral yoldan alındıktan 4 - 6 saat sonra, trospiyum klorür maksimum kan seviyelerine ulaşır. Plazma protein bağlama oranı %50-80'dir.
Biyotransformasyon:
Sistemik olarak mevcut olan trospiyum klorürün büyük kısmı böbrek sistemi aracılığıyla değişmeden atılmaktadır. Küçük bir kısmı esterin hidroliziyle oluşan bir metabolit olan spiro- alkol (yaklaşık %10) şeklinde atılmaktadır.
Eliminasyon:
Eliminasyon yarı ömrü çok değişkendir ve oral uygulamadan sonra 5 ile 18 saat arasında değişmektedir. Birikme olmamaktadır. Büyük oranda idrarla değişmeden atılır. Küçük bir bölümü (%10) spiro-alkol metaboliti olarak atılmaktadır.
Doğrusallık/Doğrusal olmayan:
Tekli doz olarak 20 ile 60 mg doz aralığında plazma seviyeleri uygulanan doza lineerdir. Hastalardaki Karakteristik Özellikler
Farmakokinetik veriler yaşlı hastalarda veya cinsiyetler arasında herhangi bir büyük farklılık olduğunu ortaya koymamıştır.
Şiddetli renal bozukluğu olan hastaları kapsayan bir çalışmada (Kreatinin klirensi 8-32 mL/ dak) ortalama AUC'nin 4 kat ve C'ın 2 kat arttığı bulunmuştur. Yarılanma ömrü sağlıklı kişilere oranla iki kat artmıştır. Hafif derecede böbrek yetmezliği olan hastalarda yapılan herhangi bir çalışma bulunmamaktadır.
Karaciğer fonksiyonunda hafif ila orta derecede bozukluğu olan hastalarda yapılan bir farmakokinetik çalışmanın sonuçları, bu hasta grubunda doz ayarlaması gerekliliğini ortaya koymamıştır.
5.3. Klinik öncesi güvenlilik verileri
Mutajenik ve karsinojenik potansiyel:
Trospiyum klorüre bağlı in-vitro ve in-vivo çalışmalarda hiçbir mutajenik etki görülmemiştir. Sıçan ve fareleri kapsayan uzun süreli karsinojenik çalışmalarda karsinojenik potansiyele dair bir bulgu bulunmamaktadır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz
Mikrokristalin selüloz Mısır nişastası
Sodyum nişasta glikolat Stearik asit
Kolloidal anhidr silika Povidon (K25) Hipromelloz Titanyum dioksit
6.2. Geçimsizlikler
Bilinen bir geçimsizliği yoktur.
6.3. Raf ömrü
60 ay.
6.4. Saklamaya yönelik özel tedbirler
Son kullanma tarihi geçtikten sonra kullanılmaz. 25 C'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Blister ambalaj:
Termoform folyo: 0.25 mm PVC folyo ( Genotherm ZA 52), beyaz Üst folyo: 0.02 mm aluminyum folyo ısıyla kapatılabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliği' ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| VOLTERRA | 8699293094821 | 434.14TL |
| Diğer Eşdeğer İlaçlar |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Er-Kim İlaç Sanayi ve Tic. A.Ş.
| Geri Ödeme Kodu | A07394 |
| Satış Fiyatı | 434.14 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 434.14 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699538094548 |
| Etkin Madde | Trospiyum Klorür |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |