SPINRAZA 12 mg/5 ml intratekal enjeksiyonluk çözelti Kısa Ürün Bilgisi
{ Nusinersen }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SPİNRAZA 12 mg/5 ml intratekal enjeksiyonluk çözelti
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her 5 ml flakon, 12 mg nusinersene eşdeğer nusinersen sodyum içerir. Her ml 2,4 mg nusinersen içerir.
Yardımcı maddeler
Her bir flakon sodyum dihidrojen fosfat dihidrat, disodyum fosfat, sodyum klorür, potasyum klorür ve pH ayarlayıcı olarak sodyum hidroksit içermektedir.
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti.
pH değeri yaklaşık 7.2 olan berrak ve renksiz çözelti.
Uygulamadan önce, flakon buzdolabından çıkarılmalı ve harici ısı kaynakları kullanılmaksızın oda sıcaklığına (25°C) gelmesi sağlanmalıdır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
SPİNRAZA, 5q Spinal Musküler Atrofi tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
SPİNRAZA tedavisi sadece spinal müsküler atrofi (SMA) tedavisinin yönetiminde tecrübeli bir
doktor tarafından başlatılmalıdır.
Tedavi kararı, SPİNRAZA ile tedavinin potansiyel risklerine karşılık tedavinin birey için beklenen faydalarının bir uzman tarafından bireye özgü değerlendirmesine dayanmalıdır. SPİNRAZA'nın çalışılmadığı doğumda şiddetli hipotonisi ve solunum yetmezliği olan hastalar, ciddi SMN protein eksikliği nedeniyle klinik olarak anlamlı bir fayda sağlamayabilir.
Pozoloji:
SPİNRAZA, lomber ponksiyon ile intratekal kullanım içindir. Önerilen doz her uygulama için 12 mg (5 ml)'dır.
SPİNRAZA tedavisi, teşhisten sonra mümkün olan en erken sürede 0, 14, 28 ve 63. günlerdeki
4 yükleme dozuyla başlatılmalıdır. Bunun sonrasında, her 4 ayda bir idame dozu uygulanmalıdır.
Tedavinin süresi
Bu tıbbi ürünün uzun süreli etkililiği ile ilgili bilgi mevcut değildir. Tedavinin sürdürülmesi ihtiyacı düzenli olarak gözden geçirilmeli ve hastanın klinik durumuna ve tedaviye yanıtına bağlı olarak bireysel olarak değerlendirilmelidir.
Kaçırılan ve geciken dozlar
Eğer bir yükleme dozu kaçırıldı veya geciktiyse; SPİNRAZA, dozlar arasında en az 14 gün olacak şekilde mümkün olan en kısa sürede uygulanmalı ve reçete edilen sıklıkta dozlamaya devam edilmelidir. Eğer bir idame dozu kaçırıldı veya geciktiyse; SPİNRAZA, mümkün olan en kısa sürede uygulanmalı ve her 4 ayda bir dozlamaya devam edilmelidir.
Uygulama şekli:
Tedavi, lomber ponksiyon uygulamalarında deneyimli sağlık meslek mensupları tarafından uygulanmalıdır.
SPİNRAZA, spinal anestezi iğnesi kullanılarak 1 ila 3 dakika boyunca intratekal bolus enjeksiyon ile uygulanır. Enjeksiyon, cildin enfeksiyon veya inflamasyon belirtileri olan bölgelerine yapılmamalıdır. SPİNRAZA uygulamasından önce enjekte edilecek SPİNRAZA hacmine eşdeğer hacimde boyun omurilik sıvısının (BOS) alınması önerilmektedir.
SPİNRAZA uygulaması için hastanın klinik durumuna göre sedasyon gerekebilir. Özellikle daha küçük hastalarda ve skolyozlu hastalarda ultrason (veya diğer görüntüleme teknikleri) rehberliğinde, SPİNRAZA'nın intratekal uygulaması düşünülebilir. SPİNRAZA'nın hazırlanmasında ve uygulanmasında aseptik teknikler kullanılmalıdır; kullanım talimatları için bkz. bölüm 6.6.
Özel popülasyonlara ilişkin bilgiler:
Böbrek yetmezliği:
SPİNRAZA, böbrek yetmezliği olan hastalarda çalışılmamıştır. Böbrek yetmezliği olan hastalarda güvenlilik ve etkililiği saptanmamıştır ve bu hastalar yakından takip edilmelidir.
Karaciğer yetmezliği:
SPİNRAZA, karaciğer yetmezliği olan hastalarda çalışılmamıştır. SPİNRAZA, karaciğerde sitokrom P450 enzim sistemi ile metabolize edilmez, bu nedenle karaciğer yetmezliği olan hastalarda doz ayarlaması yapılması gerekli değildir (bkz. bölüm 4.5 ve 5.2).
Pediyatrik popülasyon:
Çocuklar için ayrı bir doz ayarlaması yoktur.
Geriyatrik popülasyon:
65 yaş üstündeki hastalarda veri bulunmamaktadır.
4.3. Kontrendikasyonlar
Etkin madde
Her 5 ml flakon, 12 mg nusinersene eşdeğer nusinersen sodyum içerir. Her ml 2,4 mg nusinersen içerir.
4.4. Özel kullanım uyarıları ve önlemleri
Lomber ponksiyon prosedürü
Lomber ponksiyon prosedürünün bir parçası olarak advers reaksiyonların ortaya çıkma riski vardır (örneğin; baş ağrısı, sırt ağrısı, kusma. bkz. bölüm 4.8). Bu uygulama yönteminin potansiyel zorlukları çok küçük hastalarda ve skolyozu olanlarda görülmektedir. SPİNRAZA'nın intratekal uygulamasına yardımcı olmak için ultrason veya diğer görüntüleme tekniklerinin kullanımı doktorun takdirine bağlı olarak düşünülebilir.
Trombositopeni ve koagülasyon anomalileri
Subkütan veya intravenöz olarak uygulanan diğer antisens oligonükleotidlerin uygulanmasından sonra akut ciddi trombositopeni dahil trombositopeni ve koagülasyon anomalileri gözlenmiştir. Eğer klinik olarak gerekliyse, SPİNRAZA uygulamasından önce platelet ve koagülasyon laboratuvar testlerinin yapılması önerilmektedir.
Renal toksisite
Subkütan ve intravenöz uygulanan diğer antisens oligonükleotidlerin uygulanmasından sonra
renal toksisite gözlenmiştir. Eğer klinik olarak gerekliyse, idrar protein testlerinin (tercihen sabah ilk idrar örneği kullanılarak) yapılması önerilmektedir. İdrar proteinin inatçı artışı için
ileri değerlendirmeler düşünülmelidir.
Hidrosefali:
Pazarlama sonrası raporlarda menenjit veya nusinersen ile tedavi edilen hastalarda kanama ile ilişkili olmayan komunikan hidrosefali bildirilmiştir. Bazı hastalar ventriküloperitoneal şant ile implante edildi. Bilinç kaybı olan hastalarda, hidrosefali için bir değerlendirme düşünülmelidir. Ventriküloperitoneal şantı olan hastalarda nusinersen tedavisinin yararları ve riskleri halen bilinmemektedir ve tedavinin sürdürülmesi dikkatle değerlendirilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Hiçbir etkileşim çalışması yapılmamıştır. İn vitro çalışmalar, nusinersenin CYP450 aracılı metabolizmanın indükleyicisi ya da inhibitörü olmadığını göstermiştir. İn vitro çalışmalar, plazma proteinlerine bağlanmak için yarışma ya da taşıyıcılarla yarışma veya inhibisyonu nedeniyle nusinersen ile etkileşme olasılığının düşük olduğunu göstermiştir.
Özel popülasyonlara ilişkin ek bilgiler Herhangi bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:
Herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Genel tavsiyeGebelik kategorisi: B
Hayvanlardaki toksisite çalışmalarında; üreme organları, erkek veya dişi fertilitesi veya embriyo-fetal gelişim üzerine hiçbir etki gözlenmemiştir.
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon):
SPİNRAZA için, gebeliklerde maruz kalmaya iliskin klinik veri mevcut değildir.
Hayvanlar üzerinde yapılan çalısmalar, gebelik / embriyonal / fetal gelisim / doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. kısım 5.3).
Gebe kadınlara verilirken tedbirli olunmalıdır.
Gebelik dönemi:
SPİNRAZA'nın gebe kadınlarda kullanımına ilişkin yetersiz/sınırlı veri mevcuttur.
Hayvanlar üzerinde yapılan çalışmalar, üreme toksisitesi ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir. (bkz. bölüm 5.3).
Tedbir amaçlı olarak, gebelik süresince SPİNRAZA kullanımından kaçınılması daha uygundur.
Laktasyon dönemi:
Nusinersen veya metabolitlerin'in insan sütüyle atılıp atılmadığı bilinmemektedir. Yenidoğan/ infant açısından bir risk olduğu göz ardı edilemez. Emzirmenin durdurulup durdurulmayacağına ya da SPİNRAZA tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişki karar verilirken, emzirmenin çocuk açısından faydası ve SPİNRAZA tedavisinin emziren anne açısından faydası dikkate alınmalıdır.
Üreme yeteneği / Fertilite:
Hayvanlardaki toksisite çalışmalarında, erkek ya da dişi fertilitesi üzerine herhangi bir etki gözlenmemiştir (bkz. bölüm 5.3). İnsan fertilitesi üzerine potansiyel etkileri hakkında veri yoktur.
4.7. Araç ve makine kullanımı üzerindeki etkiler
SPİNRAZA'nın araç ve makine kullanımı üzerine etkisi yoktur ya da önemsizdir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
SPİNRAZA'nın güvenlilik değerlendirmesi, SMA'lı yenidoğanlarda ve çocuklarda (CS7) bir Faz 2 çalışmasına ve SMA genetik tanısı almış pre-semptomatik yenidoğanlar (CS5) ve SMA'lı yenidoğanlarda ve çocuklarda dahil açık etiketli çalışmalar ile birlikte SMA'lı yenidoğan (CS3B) ve çocuklarla (CS4) yapılan iki Faz 3 klinik çalışmaya dayanmaktadır. CS11 çalışması, infantilleri ve CS3B, CS4 ve CS12 çalışmalarını tamamlamış olanlar da dahil olmak üzere geç başlangıçlı hastaları kaydetmiştir. En fazla 5 yıla kadar SPİNRAZA alan 346 hastanın 258 tanesi en az 1 yıl tedavi görmüştür.
Advers reaksiyonların tablolaştırılmış listesi
İstenmeyen etkiler, Tablo 2'de MedDRA Sistem Organ Sınıfı ve sıklık kategorilerine göre listelenmiştir. Sıklıklar tüm dereceleri temel almaktadır ve istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir:
Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1.000 ila < 1/100);
seyrek (≥ 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000); bilinmeyen (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 1: CS4 (geç başlangıçlı SMA) çalışmasında, SPİNRAZA ile tedavi edilen hastalarda sham kontrol grubuna göre %5 daha yüksek olan lomber ponksiyon prosedürü ile ilişkili advers reaksiyon insidans oranları
MedDRA Sistem Organ Sınıfı | MedDRA tercih edilen terim | SPİNRAZA Sıklık Kategorisi, n=84 |
Sinir sistemi hastalıkları | Baş ağrısı* | Çok yaygın |
Gastrointestinal hastalıklar | Kusma* | Çok yaygın |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | Sırt Ağrısı* | Çok yaygın |
Pazarlama sonrası deneyim
Spinraza'nın onay sonrası kullanımı sırasında advers reaksiyonlar tespit edilmiştir. Lomber ponksiyon prosedürü ile Spinraza uygulanan hastalar arasında, menenjit gibi ciddi enfeksiyonlar gözlenmiştir. Komunikan hidrosefali, aseptik menenjit ve aşırı duyarlılık (örneğin anjiyoödem, ürtiker ve döküntü) da rapor edilmiştir. Bu reaksiyonların sıklığı, reaksiyonlar pazarlama sonrası verilerden raporlandığı için bilinmemektedir.
Seçilmiş advers reaksiyonların tanımlanması
Lomber ponksiyon ile SPİNRAZA uygulamasıyla ilişkili advers reaksiyonlar gözlenmiştir. Bunların büyük bir kısmı prosedürden sonraki 72 saat içinde rapor edilmiştir. Bu olayların insidansı ve şiddeti, lomber ponksiyon ile meydana gelmesi beklenen olaylarla uyumluydu. SPİNRAZA'nın klinik çalışmalarında, ciddi enfeksiyonlar gibi lomber ponksiyonun hiçbir ciddi komplikasyonu gözlenmemiştir.
SPİNRAZA'ya maruz kalan yenidoğan popülasyonunda, lomber ponksiyonla yaygın bir şekilde ilişkili olan bazı advers olaylar (örn., baş ağrısı ve sırt ağrısı) bu yaş grubunun sınırlı sözlü iletişimi nedeniyle değerlendirilememiştir.
İmmunojenesite
Nusinersene immunojenik yanıtı, anti-ilaç antikorları (ADA) için başlangıç plazma örnekleri ve başlangıç sonrası plazma örnekleri bulunan 346 hastada belirlenmiştir. Genel olarak, 4 tanesi geçici, 5 tanesi kalıcı ve 6 hastada ise veri kesilmesi sırasında geçici veya kalıcı olarak sınıflandırılamamış şekilde 15 hasta (%4) genelde ADA pozitif olarak sınıflandırılarak ADA insidansı düşüktür. ADA'lı hstaların sayısı düşük olduğu için immunojenesitenin güvenlik üzerindeki etkisi resmi olarak analiz edilememiştir. Oysaki, tedavi ile ortaya çıkan ADA-pozitif durumlar için tekil veriler gözden geçirilmiştir ve ilgilenilen hiçbir AE tanımlanmamıştır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Klinik çalışmalarda, advers reaksiyonlar ile ilişkili hiçbir doz aşımı bildirilmemiştir.
Doz aşımı durumunda, bir sağlık profesyoneline danışılması ve hastanın klinik durumunun yakından izlenmesini kapsayan destekleyici tıbbi bakım sağlanmalıdır.
Eğer flakon açılmamışsa ve çözelti kullanılmamışsa, tekrar buzdolabına koyulmalıdır (bkz. BölümSaklamaya yönelik özel tedbirler tedbirler)
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Kas-iskelet sistemi bozukluklarında kullanılan diğer ilaçlar, ATC kodu: M09AX07
Etki Mekanizması
Nusinersen, SMN2 pre-messenger ribonükleik asidinin (pre-mRNA) intron 7'de bulunan intronik splice silencing bölgesine (ISS-N1) bağlanarak survival motor nöron 2 (SMN2) messenger ribonükleik asit (mRNA) transkriptlerinde ekson 7 inklüzyonunun oranını arttıran bir antisens oligonükleotiddir (ASO). Bu bağlanma ile ASO, normalde splicingi baskılayan splicing faktörlerin yerine geçer. Bu faktörlerin yer değişimi, SMN2 mRNA'sında ekson 7'nin tutulmasına neden olur ve dolayısıyla SMN2 mRNA üretildiğinde, tam uzunlukta fonksiyonel SMN proteinine çevrilebilir.
SMA, kromozom 5q üzerindeki SMN1 genindeki mutasyondan kaynaklanan ilerleyici bir nöromüsküler hastalıktır. SMN1 geninin yanında yer alan ve ikinci bir gen olan SMN2, az miktarda SMN proteini üretiminden sorumludur. SMA, SMN2 gen kopyasının az sayıda olmasıyla bağlantılı olarak hastalık şiddetinin ve semptomların ortaya çıkış yaşının değiştiği klinik bir hastalık yelpazesidir.
Klinik etkililik ve güvenlilik
Semptomatik hastalar
İnfantil başlangıç
Çalışma CS3B (ENDEAR), SMA tanısı alan (semptom başlangıçları 6 aydan önce olan), ≤7 ay olan 121 semptomatik infant ile yapılan Faz 3, randomize, çift kör, sham-prosedür kontrollü bir çalışmadır. CS3B, SPİNRAZA'nın motor fonksiyon ve sağkalım üzerine etkisini değerlendirmek üzere tasarlanmıştır. Hastalar, ya SPİNRAZA (onaylanan doz rejimine göre) ya da sham kontrol grubuna 2:1 oranında 6 ila 442 gün arasında değişen bir tedavi rejimine randomize edilmiştir.
SMA klinik belirtilerinin ve semptomlarının ortaya çıktığı medyan yaş, SPİNRAZA ile tedavi edilenler ve sham-kontrol gruplarında sırasıyla 6,5 hafta ve 8 haftaydı, hastaların %99'u SMN2 geninin 2 kopyasını taşımaktaydı ve bu nedenle muhtemel Tip I SMA kabul edilmiştir. Hastaların ilk dozu aldığı medyan yaş, tedavi alan hastalarda 164,5 gün ve sham-kontrol hastalarında 205 gündü. Başlangıç hastalık karakteristikleri, Sham-kontrol hastalarına kıyasla SPİNRAZA tedavisi alan hastalarda daha yüksek oranda görünen paradoksal solunum (%66'ya karşı %89), pnömoni ve solunum semptomları (%22'ye karşı %35), yutma ve beslenme güçlükleri (%29'a karşı %51) ve solunum desteği gereksinimi (%15'e karşı %26) haricinde büyük ölçüde benzerdi.
Son analizde, sham-kontrol grubuna (%0) (p<0,0001) göre SPİNRAZA grubunda (%51), hastaların istatistiksel olarak anlamlı büyük bir yüzdesi “motor kilometre taşları yanıtlı†tanımına ulaşmışlardır. Ölüme veya kalıcı ventilasyona (akut reversible bir olay ya da trakeostomi olmaksızın >21 gün boyunca ≥16 saat ventilasyon/gün) kadar geçen zaman primer sonlanım noktası olarak değerlendirilmiştir. Olaysız sağkalım, genel sağkalım, bir motor kilometre taşı yanıtlı hasta tanımına ulaşılması ve başlangıçtan itibaren Children's Hospital of Philadelphia Infant Test for Neuromuscular Disease (CHOP INTEND) skorunda en az 4 puan iyileşme gösteren hastaların yüzdesinde Sham-kontrol grubuna kıyasla SPİNRAZA grubunda, istatistiksel olarak anlamlı etkiler görülmüştür (Tablo 2).
Etkililik setinde, SPİNRAZA grubunda 18 hastada (%25) ve sham-kontrol grubunda 12 hastada (%32) kalıcı ventilasyon gerekmiştir. Bu hastalardan, protokolde tanımlanan motor kilometre taşı yanıt kriterini karşılayanların sayısı SPİNRAZA grubunda 6 (%33) ve sham-kontrol grubunda 0'dır (%0).
Tablo 2: Son analizde primer ve sekonder sonlanım noktaları - Çalışma CS3B
Etkililik Parametresi | SPİNRAZA ile tedavi edilen hastalar | Sham-kontrol hastaları |
Sağkalım | ||
Olaysız sağkalım Ölen veya kalıcı ventilasyona geçen hastaların sayısı Tehlike Oranı (%95 GA) p-değeri |
31 (%39) |
28 (%68) |
0,53 (0,32 – 0,89) p = 0,0046 | ||
Genel sağkalım Ölen hastaların sayısı Tehlike Oranı (%95 GA) p-değeri |
13 (%16) |
%16 (39) |
0,37 (0,18 – 0,77) p=0,0041 | ||
Motor fonksiyon | ||
Motor kilometre taşları Ön tanımlı motor kilometre taşı yanıt kriterlerine ulaşanların oranı (HINE bölüm 2) 183. gündeki oran 302. gündeki oran |
37 (%51) p<0,0001
%41 %45 |
0 (%0)
%5 %0 |
394. gündeki oran | %54 | %0 |
toplam motor kilometre taşı skorundaki iyileşme ile orantısı | 49 (%67) | 5 (%14) |
toplam motor kilometre skorundaki kötüleşme ile orantısı | 1 (%1) | 8 (%22) |
CHOP INTEND |
|
|
4 puan iyileşme olanların oranı | 52 (%71) p<0,0001 | 1 (%3) |
4 puan kötüleşme olanların oranı | 2 (%3) | 17 (%46) |
Herhangi bir iyileşme olanların oranı | 53 (%73) | 1 (%3) |
Herhangi bir kötüleşme olanların oranı | 5 (%7) | 18 (%49) |
CHOP INTEND'deki iyileşmenin boyutu Şekil 1'de gösterilmiştir (her hasta için başlangıçtan itibaren skordaki değişim).
Şekil 1: Başlangıçtan 183. Gün, 302. Gün ve 394. gün sonrası çalışma vizitlerinde CHOP INTEND değişimi - Endear Çalışması/CS3B (Etkililik Seti, ES)
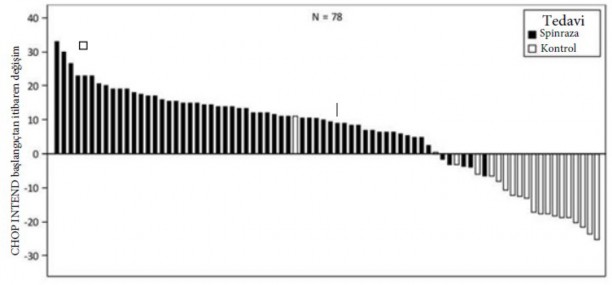
Not 1: 0. Satırdaki en kısa çubuklar hiçbir değeri göstermez.
Not 2: Etkililik setindeki 110 hastanın 29'u öldü (SPİNRAZA grubundan 13(%18), kontrol grubundan 16 (%43)), 3'ü ölüm dışında nedenlerle ayrıldı (SPİNRAZA grubundan 2(%3), kontrol grubundan 1(%3)) ve bu nedenle ES'nin bu analizine dahil edilmedi.
Bu hastaların uzun süreli takibini sağlamak için, CS3B çalışmasının sonunda, 89 hasta (Spinraza: n= 65; Sham kontrol: n= 24) CS11 çalışmasına (SHINE) kaydolmuştur. CS11 çalışması, daha önce diğer Spinraza klinik çalışmalarına katılan SMA hastaları için açık uçlu uzatılmış bir çalışmadır. CS11 çalışmasında, 655 günden 592 güne kadar uzayan tedavi boyunca (medyan 289 gün) ara analiz sırasında tüm hastalar Spinraza almışlardır. CS11 çalışmasına en büyük faydanın gözlendiği erken tedaviye başlayan hastalar yanında CS3B'de SPINRAZA tedavisine devam edenler ve CS11 çalışmasında SPİNRAZA tedavisi başlanan hastalarda fayda görmüşlerdir (Şekil 3). CS11 çalışmasının başlangıcında ve ara analizinde sürekli ventilasyon uygulanmayan hastalar çoğunlukla hayatta kalmıştır.
CSB3 çalışmasındaki Spinraza'ya randomize edilen hastalar ve CS11 çalışma deneyimlerinde, ölüm veya sürekli ventilasyon medyan zamanı 73 haftadır. CS11 çalışması ara analizinde 65 hastanın 61'i (94) hayatta kalmıştır. CS3B çalışmasında sürekli ventilasyon tanımı kapsamına girmeyen 45 hastanın 38'i (%84), CS11 çalışmasının ara analizde sürekli ventilasyon olmadan hayatta kalmıştır. Ortalama motor kilometre taşında artış (HINE-Section 2) (2,1; SD 4,36; n=22) ve CHOP INTEND (4,68; SD 3,993, n=22) skorları CS11 çalışmasının başlangıcından
304. çalışma gününe kadar gözlenmiştir.
CS11 çalışmasında ilk Spinraza uygulaması başlatılan hastalarda (n=24; CS3B çalışmasındaki sham-kontrol) medyan yaş 17,8 ay ( 10-23 ay aralığı) ve CS11 çalışma başlangıcında ortalama CHOP İNTEND skoru 17.25 (2,0-46,0) idi. Ara analizde 24 hastanın 22'si (92%) hayatta kalmıştır. CS3B çalışmasında sürekli ventilasyon tanımını karşılamayan 12 hastanın (%50) 7'si (%58) CS11 çalışmasında sürekli ventilasyon gereksinimi olmadan hayatta kalmıştır. CS11 çalışmasında Spinraza uygulamasının başlatılmasından sonra ölüm veya sürekli ventilasyon
medyan zamanı 50.9 hafta olmuştur. Ortalama motor kilometre taşında artış (HINE-Section 2) (1.2; SD 1,8; n=12) ve CHOP INTEND (3,58; SD 7,051 n=12) skorları CS11 çalışmasının başlangıcından 304. çalışma gününe kadar gözlenmiştir.
Bu sonuçlar, SMA tanısı alan semptomatik hastalarda açık etiketli bir faz 2 çalışma (CS3A) ile desteklenmiştir. Klinik belirtilerin ve semptomların ortaya çıktığı medyan yaş 56 gündü ve hastalar ya 2 SMN2 gen kopyası (n=17) ya da 3 SMN2 gen kopyası (n=2) taşımaktaydı (SMN2 gen kopya sayısı bilinmeyen 1 hasta). Bu çalışmadaki hastalar muhtemel Tip 1 SMA olarak düşünülmektedir. İlk dozun alındığı medyan yaş 162 gündür.
Primer sonlanım noktası, motor kilometre taşlarında bir veya daha fazla kategoride iyileşme olan hastaların oranıydı (HINE bölüm 2'ye göre: tekme kabiliyeti ya da gönüllü kavramada ≥2 puan artış [ya da azami skorda], YA DA başın kontrolü, yuvarlanma, oturma, emekleme, ayakta durma ve yürüme motor kilometre taşlarında ≥1 puan artış). Zamanla 20 hastanın 12'si (%60), zaman içinde ortalama motor kilometre taşı ulaşımında sürekli iyileşme ile primer sonlanım noktasını karşılamıştır. Başlangıçtan 1072. güne kadar ortalama CHOP INTEND skorunda sürekli bir iyileşme gözlendi (ortalama değişim 21,30). Genel olarak, 20 hastanın 11'i (%55) veri kesiminden önceki son çalışma vizitlerinde toplam CHOP INTEND skorunda ≥4 puan artış ile sonlanım noktasını karşılamıştı. Kayıtlı 20 hastanın 11'i (%55) hayatta kalmıştır ve son ziyarette sürekli ventilasyondan muaf tutulmuştur. 4 hasta kalıcı ventilasyon tanımını karşılamış ve 5 hasta ise çalışma süresince kaybedilmiştir.
Geç başlangıç
Çalışma CS4 (CHERISH), geç başlangıçlı SMA'sı olan (semptomların 6 aydan sonra başladığı) 126 semptomatik hastada yürütülen randomize, çift kör, sham-prosedür kontrollü bir faz 3 çalışmasıdır. Hastalar, 2:1 oranında ya SPİNRAZA (3 yükleme dozu ve sonrasında her 6 ayda bir idame dozu ile dozlanan) veya sham-kontrol gruplarında 324. günden 482. güne değişen uzunluktaki tedavilerine 2:1 oranında randomize edilmiştir.
Taramadaki medyan yaş 3 yıl ve SMA'nın klinik belirti ve semptomlarının başladığı medyan yaş 11 aydı. Hastaların çoğunluğu (%88) 3 SMN2 gen kopyası (%8'i 2 kopya, %2'si 4 kopya ve %2'si bilinmeyen sayıda kopya) taşımaktaydı. Başlangıçta, hastaların ortalama Hammersmith Fonksiyonel Motor Skalası Genişletme (HFMSE) skoru 21,6, ortalama revize üst ekstremite modülü (RULM) 19,1 idi, hepsi bağımsız bir şekilde oturmuştu ve hiçbir hasta bağımsız yürümemişti. Bu çalışmadaki hastalar muhtemel Tip II ya da III SMA hastası olarak kabul edildiler. Başlangıç hastalık özellikleri, desteksiz ayakta durma kabiliyetini halen kaybetmemiş hastaların (SPİNRAZA grubunda hastaların %13'ü ve sham-kontrol grubunda hastaların %29'u) veya destekle yürüyen hastaların (SPİNRAZA grubunda hastaların %24'ü ve sham-kontrol grubunda hastaların %33'ü) oranındaki bir dengesizlik dışında genel olarak benzerdi.
Son analizde, SPİNRAZA ile tedavi edilen hastalarda, sham-kontrol hastalarına kıyasla HFMSE skorunda başlangıçtan itibaren 15. aya kadar istatistiksel olarak anlamlı bir iyileşme gözlendi (Tablo 3, Şekil 2). Analiz ITT (tedavi amacına yönelik) popülasyonda (SPİNRAZA:
n=84; sham-kontrol: n=42) gerçekleştirildi ve çoklu imputasyon yöntemi kullanılarak 15. ay ziyareti olmayan hastalar için başlangıç sonrası HFMSE verileri tamamlandı. 15. ayda gözlenen değerlere sahipolan ITT popülasyonundaki hastaların alt kümesinin bir analizinin tutarlı, istatistiksel olarak anlamlı sonuçlar verdiği kanıtlandı. 15. Ay'da gözlenen değerlere sahip olanlardan, Spinraza ile tedavi edilen deneklerin daha yüksek bir oranının iyileşme gösterdiği (sırasıyla %41'e karşı %73) ve daha düşük bir oranda Spinraza ile tedavi edilen deneklerin toplam HFMSE skorunda sham-kontrolüne kıyasla kötüleşme olduğu (sırasıyla %44'e karşı
%23) görülmüştür. Fonksiyonel önlemleri ve WHO motor kilometre taşı başarısını içeren ikincil sonlanım noktaları resmen istatistiksel olarak test edilmiş ve Tablo 3'te açıklanmıştır.
Semptomların başlangıcından hemen sonra tedavinin başlatılması, gecikmiş tedavi başlangıcı olanlara kıyasla motor fonksiyonlarda daha erken ve daha büyük iyileşme kaydedilmesini sağlamıştır, bununla beraber sham-kontrol grubuna nazaran her iki grup da fayda görmüştür.
Tablo 3: Son analizde primer ve sekonder sonlanım noktaları - Çalışma CS4
| SPİNRAZA ile tedavi edilen hastalar | Sham-kontrol hastaları |
HFMSE score |
|
|
15. ayda toplam HFMSE skorunda başlangıçtan itibaren olan değişim | 3,9 (%95 CI: 3,0, 4,9) p=0,0000001 | -1,0 (%95 CI: -2,5, 0,5) |
Başlangıçtan itibaren 15. Aya kadar en az 3 puan iyileşme olan hastaların oranı | 56,8% (%95 CI:45,6, 68,1) P=0,0006 | 26,3% (%95 CI: 12,4, 40,2) |
RULM |
4,2 (%95 CI: 3,4, 5,0) p=0,0000001 |
0,5 (%95 CI: -0,6, 1,6) |
Toplam RULM skorunda başlangıçtan 15. aya kadar olan ortalama değişim | ||
WHO motor kilometre taşları |
%19,7 (%95 CI: 10,9, 31,3) p=0,0811 |
%5,9 (%95 CI: 0,7, 19,7) |
15. ayda yeni bir kilometre taşına ulaşan hastaların oranı |
Şekil 2: HFMSE skorunun başlangıcından zaman içindeki son analizde (ITT) ortalama değişim - Çalışma CS4
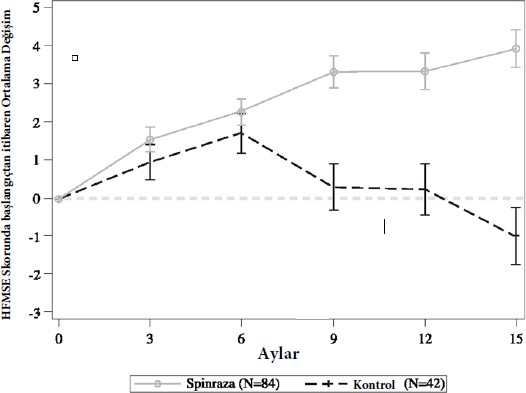
1Çoklu imputasyon yöntemi kullanılarak 15. ay ziyareti olmayan hastalar için veriler
CS4 (CHERISH) çalışması tamamladıktan hemen sonra 125 hasta, tüm hastaların Spinraza aldığı CS11'e (SHINE) çalışmasına kaydedildi. Ara analiz zamanında tedavi süresinin uzunluğu 74 günden 474 güne kadar değişmekteydi (medyan 250 gün). Spinraza ile tedavi edilen hastaların çoğu motor fonksiyonlarda stabilizasyon veya iyileşme gösterirlerken, en büyük iyileşme erken tedavi başlangıcında gözlenmiştir.
Çalışma CS4'te Spinraza tedavisi başlatılan hastalarda (n= 39), stabilizasyon veya ortalama HFMSE (0,2; SD 3,06) ve RULM (0,7; SD 2,69) skorlarında ek iyileşmeler başlangıçtan CS11 çalışmasının 265. gününe kadar gözlenmiştir.
Bu sonuçlar, 2 açık etiketli çalışma ile (CS2 ve CS12 çalışmaları) ile desteklenmiştir. İlk dozlarını Çalışma CS2'de alan 28 hasta analize dahil edildi ve sonrasında uzatma fazı olan Çalışma CS12'ye transfer edildi. Bu çalışmalara ilk dozlarını 2 ila 15 yaşları arasında alan hastalar kayıt edilmiştir. 28 hastadan 3 tanesi, son çalışma vizitlerinde en az 18 yaşındalardı. 28 hastadan 1'i 2 SMN2 gen kopyasına, 21 tanesi 3 gen kopyasına ve 6 tanesi 4 gen kopyasına sahipti.
Hastalar 3 yıldan fazla süren bir tedavi periyodunda değerlendirilmiştir. Tip II SMA hastalarında başlangıç HFMSE skorlarında 253'üncü günde ortalama 5,1 (SD 4,05, n=11) ve 1050'nci günde
ortalama 9,1 (SS 6,61, n=9) kalıcı iyileşme gözlenmiştir. Plato olmaksızın, 253 gün sonrasında ortalama skor 26,4 (SD 11,91) ve 1050 gün sonrasında ortalama skor 31,3 (SD 13,02) idi. Tip III SMA hastalarında, başlangıçtan itibaren HFMSE skorunda 253 gün sonrasında ortalama 1,3 (SD 1,87, n=16) ve 1050 gün sonrasında ortalama 1,2 (SD 4,64, n=11) toplam skorda iyileşme görülmüştür. Ortalama toplam skor 253 gün sonrasında 49,8 (SD 12,46) ve 1050 gün sonrasında 52,6 (SD 12,78) idi.
Tip II SMA'lı hastalarda Üst Ekstremite Modülü testi, 253 gün sonrasında ortalama 1,9 (SD 2,68, n= 11) ve 1050 gün sonrasında ortalama 3,5 (SD 3,32, n= 9) ortalama iyileşme ile
yürütülmüştür. Ortalama toplam skor 253 gün sonrasında 13,8 (SD 3,09) ve 1050 gün sonrasında 15,7'dir (SD 1,92).
6MWT (6 dakika yürüme testi) sadece ambulatuvar hastalarda yapılmıştır. Bu hastalarda, ortalama iyileşme 253 gün sonrasında 28,6 metre (SD 47,22, n=12) ve 1050 gün sonrasında 86,5 metre (SD 40,58, n=8) olarak gözlendi. Ortalama 6 MWT uzunluğu, 253 gün sonrasında 278,5 metre (SD 206,46) ve 1050 gün sonrasında 333,6 metre (SD 176,47) dir. Daha önceden bağımlı ambulatuvar olan 2 (Tip III) hasta ve ambulatuvar olmayan bir (Tip II) hasta bağımsız yürümeyi başarmışlardır.
Tarama yaşı veya SMN2 kopya numarası çalışma CS4 veya CS3B'ye uygun olmayan hastalar için ek bir klinik çalışma olan CS7 (EMBRACE) açılmıştır. CS7, infantil başlangıçlı SMA (≤6 ay) veya geç başlangıçlı SMA (>6 ay) ve uzun süreli açık etiketli uzatma çalışması fazını (2. bölüm) takip eden 2 veya 3 SMN2 kopyası (1. bölüm) teşhisi konan hastalarda randomize, çift kör, sham-prosedür kontrollü bir faz 2 çalışmasıdır. Çalışmanın 1. bölümünde, hastalar medyan 302 gün takip edildiler.
Spinraza alan tüm hastalar Bölüm 1'in erken sonlanması itibariyle hayatta kalmıştır, ancak kontrol kolundaki bir hasta 289. çalışma gününde hayatını kaybetmiştir. Ek olarak, Spinraza veya sham-kontrol grubundaki hiçbir hastada sürekli ventilasyon kullanımına gerek olmamıştır. İnfantil-başlangıçlı SMA'lı 13 hastada, Spinraza grubundaki 9 hastanın 7'si (%78; %95 CI:
45,94) ve sham grubundaki 4 hastanın 0'ı (%0; %95 CI: 0,60) motor kilometre taşı cevabı için gerekli kriteri karşılamıştır (Hammersmith Infant Neurological Examination (HINE) bölüm 2'ye göre: tekme kabiliyeti (ya da azami skorda) ≥2 puan artış, YA DA başın kontrolü, yuvarlanma, oturma, emekleme, ayakta durma ve yürüme motor kilometre taşlarında ≥1 puan artış, VE motor kilometre taşlarında kötüleşme olandan daha fazla kategoride iyileşme olması). Geç-başlangıçlı SMA'lı 8 hastanın, Spinraza grubundaki 5 hastanın 4'ü (% 80; % 95 CI: 38,96) ve sham-kontrol grubundaki 3 hastanın 2'si (% 67; % 95 CI: 21,94) bu cevabın tanımını karşılamıştır.
Pre-semptomatik yenidoğanlar
Çalışma CS5 (NURTURE) genetik olarak tanı almış SMA'lı pre-semptomatik 6 haftalık ve daha küçük infantlarla yapılan açık etiketli bir çalışmadır. Bu çalışmadaki hastalar, muhtemel Tip I ve ya II SMA hastası kabul edilmektedir. İlk doz alındığındaki medyan yaş 22 gündür.
Hastalar çalışmanın medyan 27.1. ayında (15,1-35,5 ay) ve son vizitte medyan 26 aylık (14,0- 34,3 ay) yaşta iken bir ara analiz yapıldı. Ara analizde 25 hastanın hepsi (2 SMN2 gen kopya sayılı, n=15, 3 SMN2 gen kopya sayılı, n=10) kalıcı ventilasyon ihtiyacı göstermeden hayattaydı. Birincil son nokta, ölüm zamanı veya solunum yolu ile müdahale (ardışık ≥ 7gün boyunca ≥ 6 saat/gün sürekli invaziv ya da non-invaziv ventilasyon VEYA trakeostomi olarak tanımlanmıştır) çok az vaka olduğu için tahmin edilememiştir. Bir akut geri dönüşlü (reversible) hastalık sırasında ventilatör desteği başlatılan dört hasta (2 SMN2 kopyası) ardışık ≥ 7gün boyunca > 6 saat/gün sürekli solunum yolu ile müdahaleye ihtiyaç duymuştur.
Hastalar, normal gelişime daha uygun olan ve Tip I ve II SMA için beklenmeyen kilometre taşlarını başarmıştır. Ara analizde, 25 hastanın tümü (% 100) WHO (Dünya Sağlık Örgütü) motor kilometre taşlarında desteksiz oturmayı, 22 hasta (%88) destekli yürümeyi başarmıştır. Daha yaşlı hastalar arasında WHO'nun beklenen başarı yaşı için tanımlanmış penceresinden (yüzde 95), 22'sinin 17'si yalnız yürümeyi başarmıştır. Son değerlendirmedeki ortalama CHOP INTEND puanı 2 SMN2 kopyaya sahip hastalar arasında 61,0 (46 - 64) ve 3 SMN2 kopyaya sahip hastalar arasında 62,6 (58 - 64) idi. Son değerlendirmede HINE bölüm 1'deki azami skoru tutturan 22 (% 88) infantlarla birlikte tüm hastalar emme ve yutma yeteneğine sahipti.
Ara analizde 700. güne erişen hastalar arasında klinik olarak ortaya çıkan SMA gelişen hastaların oranı değerlendirildi (n=16). Klinik olarak belirgin SMA'nın protokolde tanımlanmış kriterleri yaşa göre ayarlanmış ağırlığın WHO 5. persentilinin altında olması, 2 ya da daha fazla temel ağırlık gelişim eğrisi persentili düşüş, perkütanöz gastrik tüp yerleştirilmesi, ve/veya yaşa uygun WHO kilometre taşlarını başaramama (bağımsız oturma, yardımla ayakta durma, el ve dizler üstünde emekleme, destekle yürüme, yalnız ayakta durma ve yalnız yürüme). 700'üncü günde, 2 SMN2 gen kopyası olan 11 hastadan 7'si (% 64) ve 3 SMN2 kopyası olan 5 hastanın 0'ı (% 0) klinik olarak ortaya konulan SMA'nın protokol tanımlı kriterlerini karşıladı, ancak bu hastalar kilo alıyordu ve Tip IA SMA ile uyumlu olmayan WHO kilometre taşlarına erişiyordu.
Semptomatik yenidoğan başlangıçlı SMA ve pre-semptomatik SMA hastaları arasında motor kilometre taşları başarısının karşılaştırılması Şekil 3'de gösterilmiştir.
Şekil 3: Çalışma CS3B (tedavi ve sham-kontrol), CS3A ve CS5 için HINE motor kilometre taşları ve çalışma günlerinin değişimi
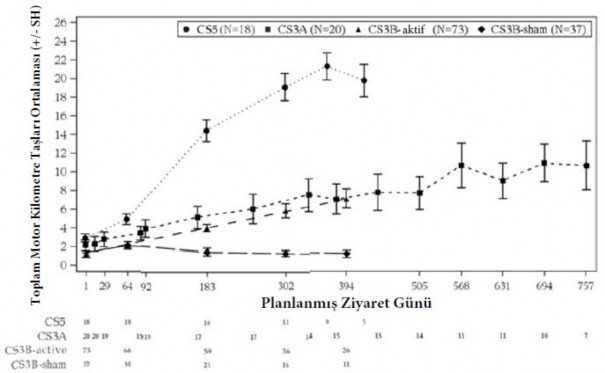
Şekilde kullanılan popülasyon: CS5 – geçici etkinlik seti, CS3A – tüm dozlananlar, CS3B etkinlik seti Her bir çalışma için, n<5 olan ziyaretler çizilmemiştir
5.2. Farmakokinetik özellikler
Genel özellikler:İntratekal enjeksiyon ile ygulanan nusinersenin tek ve çoklu doz farmakokinetiği (FK), SMA tanısı alan pediatrik hastalarda incelenmiştir.
Emilim:
Nusinersenin BOS'a intratekal enjeksiyonu, nusinersenin BOS'dan hedef merkezi sinir sistemi (MSS) dokularına tamamen dağılımını mümkün kılar. Nusinersenin ortalama en düşük BOS konsantrasyonları, çoklu yükleme ve idame dozlarının ardından yaklaşık 1,4 ila 3 kat biriktive yaklaşık 24 ay içinde kararlı duruma ulaşmıştır. İntratekal uygulamanın ardından nusinersenin en düşük plazma konsantrasyonları, en düşük BOS konsantrasyonuna göre nispeten düşüktür. Medyan plazma Tdeğeri 1,7'den 6,0 saate değişmektedir. Ortalama plazma Cve EAA değerleri, takriben doz artışı ile orantılı olarak artmıştır. Çoklu dozlardan sonra plazma maruziyet ölçümlerinde (Cve EAA) hiçbir birikim olmamıştır.
Dağılım:
Hastalardan elde edilen otopsi verileri (n=3) intratekal uygulanan nusinersenin BOS içinde
yaygın bir şekilde dağılarak hedef omurilik dokularında terapötik seviyelere ulaştığını göstermektedir. Nusinersenin varlığı, beyin ve omurilikteki nöronlarda ve diğer hücre tiplerinin yanında iskelet kasları, karaciğer ve böbrek gibi periferal dokularda da gösterilmiştir.
Biyotransformasyon:
Nusinersen yavaşça ve ağırlıklı olarak ekzonükleaz (3'- ve 5') aracılı hidroliz yoluyla metabolize olmaktadır ve CYP450 enziminin substratı, inhibitörü ya da indükleyicisi değildir.
Eliminasyon:
BOS'ta ortalama terminal eliminasyon yarı ömrü 135 ila 177 gün olarak tahmin edilmektedir. Başlıca eliminasyon yolunun, nusinersen ve metabolitlerinin idrarla atılımı olduğu düşünülmektedir.
Etkileşimler:
İn vitro çalışmalar, nusinersenin CYP450- aracılı oksidatif metabolizmanın bir indükleyicisi ya da inhibitörü olmadığını göstermiştir. Bu nedenle, bu metabolik yolaklar için diğer tıbbi ürünlerle karışmamalıdır. Nusinersen, insan BCRP, P-gp, OAT1, OAT3, OCT1, OCT2, OATP1B1, OATP1B3 ya da BSEP taşıyıcılarının substratı ya da inhibitörü değildir.
Hastalardaki karakteristik özellikler
Böbrek ve karaciğer yetmezliği:
Böbrek ve karaciğer yetmezliği olan hastalarda nusinersenin farmakokinetiğine ilişkin çalışma yapılmamıştır. FK modelinin sunulduğu popülasyonda klinik olarak ilişkili karaciğer ve böbrek yetmezliği görülen hastaların nadir bulunması nedeniyle eş değişkenleri olarak hepatik ve renal yetmezliğin etkileri detaylı olarak incelenememiştir. Popülasyon FK analizleri, hepatik ve renal klinik kimya belirteçleri ve hastalar arası değişkenlik arasında belirgin bir korelasyon olmadığını ortaya koymuştur.
Irk:
Hastaların büyük kısmı beyaz ırktandı. Popülasyon FK analizleri, ırkın nursinersenin farmakokinetiğini etkilemesinin olası olmadığını ortaya koymuştur.
5.3. Klinik öncesi güvenlilik verileri
Karsinogenez
Nursinersenin karsinojenik potansiyelini değerlendirmek için uzun süreli hayvan çalışmaları yapılmamıştır.
Mutagenez
Nusinersenin genotoksisitesine ilişkin hiçbir kanıt yoktur. Üreme toksisitesi
Üreme toksikolojisi çalışmaları, fare ve tavşanlarda nursinersenin subkütan uygulaması kullanılarak yürütülmüştür. Erkek ya da dişi fertilitesine veya embriyo-fetal gelişime ya da pre/post-natal gelişime hiçbir etkisi gözlenmemiştir.
Toksikoloji
Yavru cynomolgus maymunlarına intratekal uygulamanın tekrarlı doz toksisite çalışmalarında (14 hafta ve 53 hafta) nursinersen iyi tolere edilmiştir. İstisnası, her çalışmada en yüksek doz düzeylerinde (doz başına 3 ya da 4 mg; hastada her intratekal doz başına 30 ya da 40 mg'a eşdeğerdir) alt spinal reflekslerde ortaya çıkan akut, geçici bir kayıptır. Bu etkiler dozdan sonraki birkaç saat içinde gözlemlenmiş ve genellikle 48 saat içinde çözülmüştür.
Cynomolgus maymunlarındaki 53 haftalık intratekal doz çalışmasında, önerilen yıllık klinik idame dozunun 14 katı kadar seviyelerde toksik etki görülmemiştir.
Uygulamadan hemen önce, plastik kapağı çıkarın ve şırınga iğnesini üst contanın ortasından flakon içine sokarak uygun hacimde sıvıyı çekin. SPİNRAZA seyreltilmemelidir. Harici filtrelerin kullanımına gerek yoktur.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum dihidrojen fosfat dihidrat Disodyum fosfat
Sodyum klorür Potasyum klorür Kalsiyum klorür dihidrat
Magnezyum klorür hekzahidrat Sodyum hidroksit (pH ayarlaması için) Hidroklorik asit (pH ayarlaması için) Enjeksiyonluk su
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
2°C - 8°C arasında buzdolabında saklayınız. Dondurmayınız.
Flakonları ışıktan korumak için kutusunda saklayınız.
Eğer soğutucu mevcut değilse, SPİNRAZA kendi orijinal kutusunda, 30°C ve altındaki sıcaklıklarda ışıktan korunarak 14 güne kadar saklanabilir.
Uygulama öncesinde, açılmamış SPİNRAZA flakonları gerekirse buzdolabından alınabilir veya geri buzdolabına konulabilir. Eğer, orijinal ambalajından çıkarıldıysa, buzdolabının dışında kaldığı toplam süre 30 saati geçmemeli ve sıcaklık 25°C'yi aşmamalıdır.
6.5. Ambalajın niteliği ve içeriği
Bromobütil kauçuk tıpalı, alüminyum üst contalı ve plastik kapaklı 5 ml'lik Tip I cam flakon. Her bir kutu 1 adet flakon içermektedir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tek kullanımlıktır.
Uygulamadan önce tıbbi ürünün hazırlanması için talimatlar
Uygulama öncesinde SPİNRAZA flakonu partiküller bakımından kontrol edilmelidir. Eğer partikül gözlenirse ve/veya flakon içindeki sıvı berrak ve renksiz değilse, flakon kullanılmamalıdır.
Enjektöre çekilen çözelti 6 saat içinde kullanılmazsa atılmalıdır.
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Gen İlaç Ve Sağlık Ürünleri San. Ve Tic. Ltd. Sti.
| Satış Fiyatı | 932972.32 TL [ 15 May 2023 ] |
| Önceki Satış Fiyatı | 932972.32 TL [ 8 May 2023 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699783770389 |
| Etkin Madde | Nusinersen |
| ATC Kodu | M09AX07 |
| Birim Miktar | 12 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Kas İskelet Sistemi > Kas İskelet İlaçları |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |