SPIRIVA 18 mcg 30 inhilasyon kapsülU Klinik Özellikler
{ Tiotropium Bromur Monohidrat }
4.1. Terapötik endikasyonlar
4.2. Pozoloji ve uygulama şekli
Pozoloji ve uygulama sıklığı:
SPIRIVA®nın önerilen dozu, günde bir kez bir kapsül içeriğinin inhale edilmesidir.
Uygulama şekli:
İnhalasyon her gün, günün aynı saatinde, HandiHaler® inhalasyon cihazı kullanılarak yapılmalıdır.
SPIRIVA® kapsül yutulmamalıdır.
SPIRIVA®yı kullanırken, doktorunuzun talimatlarını dikkatle izlemeyi unutmayınız. HandiHaler® cihazı, SPIRIVA® kapsüllerinin inhalasyonu için özel olarak tasarlanmış bir inhalasyon cihazıdır. Başka hiçbir ilacı almak için kullanılmamalıdır.
1. Toz başlığı


2. Ağızlık parçası
3. Hazne tabanı
4. Delme düğmesi (yeşil renkte)
5. Merkezi hazne
1. Toz başlığını serbestlemek için, delme düğmesini iyice bastırıp bırakınız.

2. Toz başlığını yukarı doğru çekerek tamamen açınız.
Daha sonra ağızlık parçasını yukarıya doğru çekerek açınız.

3. Blister ambalajından bir SPIRIVA® kapsül çıkarınız (kullanımdan hemen önce çıkarılmalıdır; bkz. Blisterin kullanımı) ve şekilde (5) gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.
4. Ağızlık parçasını bir "klik" sesi duyuncaya değin sıkıca kapatınız. Toz başlığını açık bırakınız.
5. HandiHaler® cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve delme düğmesini sadece tek bir hareketle iyice bastırarak bırakınız.
Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır.



6. Nefesinizi tam olarak veriniz.
Önemli: Lütfen hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz.
7. HandiHaler® cihazını ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini duyacak ya da hissedecek şekilde ayarlayınız.

Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada HandiHaler® cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.
Basamak 6 ve 7yi bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır.

8. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız.
Ağızlık parçasını ve toz başlığını kapatınız ve HandiHaler® cihazınızı yerine kaldırınız.
A. Blister şeritlerini, perfore (delikli) çizgi üzerinden kopararak ayırınız.
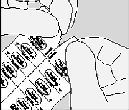
B. Kullanımdan hemen önce, blisterin alt tarafındaki folyoyu, işaretli yerinden tutunuz ve kapsülün tamamı görününceye, yani DUR işaretine kadar açınız.

Eğer yanlışlıkla ikinci bir kapsül hava ile temas ederse, bu kapsülün atılması gerekir.
C. Kapsülü çıkarınız.
Kapsüller aşırı sıcaklıklara maruz bırakılmamalıdır.
SPIRIVA® kapsülleri az miktarda toz içermektedir, bu nedenle kapsüller yalnızca kısmen doludur.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği: Böbrekleri bozuk olan hastalar SPIRIVA®yı önerilen dozlarda kullanabilirler. Ancak, esas olarak böbrekler yoluyla atılan bütün ilaçlarda olduğu gibi, orta ile şiddetli böbrek yetmezliği olan hastalarda SPIRIVA® kullanımı yakından izlenmelidir (Özel kullanım uyarıları ve önlemleri ve Farmakokinetik özellikler bölümlerine bakınız).
Karaciğer yetmezliği:
Karaciğerleri bozuk olan hastalar SPIRIVA®yı önerilen dozlarda kullanabilirler.
Pediyatrik popülasyon:
Bebeklerde ve çocuklarda SPIRIVA® kullanımına ilişkin deneyim bulunmamaktadır; bu nedenle bu yaş grubunda kullanılmamalıdır.
Geriyatrik popülasyon:
4.3. Kontrendikasyonlar
SPIRIVA® atropin veya türevlerine, örn. ipratropium ya da oksitropium veya bu ilacın bileşenlerinden herhangi birisine karşı aşırı duyarlılık öyküsü olan hastalarda kontrendikedir (bkz. Bölüm 2 ve Bölüm 6.1; Yardımcı maddeler).
4.4. Özel kullanım uyarıları ve önlemleri
SPIRIVA®, günde bir kez kullanılan bir idame tedavisi bronkodilatörü olarak, akut bronkospazm episodlarının başlangıç tedavisinde, yani kurtarma tedavisi şeklinde kullanılmamalıdır.
SPIRIVA® uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir.
Diğer antikolinerjik ilaçlarla olduğu gibi, SPIRIVA® dar-açılı glokomu kötüleştirebileceği, prostat hiperplazisi ya da mesane boynu obstrüksiyonu bulunan hastalarda idrar güçlüğü oluşturabileceğinden bu hastalarda dikkatle kullanılmalıdır.
İnhalasyon yoluyla alınan ilaçlar, inhalasyonun indüklediği bronkospazma neden olabilirler.
Esas olarak böbrekler yoluyla atılan bütün ilaçlarda olduğu gibi, orta ile şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi < 50 mL/dk) SPIRIVA® kullanımı yakından izlenmelidir.
Hastalara, SPIRIVA®nın doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Hastalara tozun göze kaçmaması için dikkatli olmaları öğütlenmelidir. Konjonktivada konjesyon veya korneada ödem sonucunda gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomlar herhangi bir kombinasyon şeklinde gelişirse, hemen bir uzman hekimin görüşü alınmalıdır. Miyotik göz damlalarının, etkili bir tedavi sağlamadıkları kabul edilmektedir.
SPIRIVA® günde bir defadan daha sık kullanılmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Düzenli ilaç etkileşimi çalışmaları yürütülmemiş olmakla birlikte, tiotropium bromür, KOAH tedavisinde yaygın olarak kullanılan diğer ilaçlar ile beraber, ilaç etkileşimine yönelik klinik bulgular görülmeksizin kullanılmıştır; sempatomimetik bronkodilatatörler, metilksantinler, oral ve inhale steroidler, bu ilaçlar arasındadır.
İki klinik araştırmadan, SPIRIVA®nın diğer antikolinerjik ilaçlar ile birlikte uygulanmasına yönelik sınırlı bilgiler elde edilmiştir. KOAH hastaları (n=64) ve sağlıklı gönüllülerde (n=35) kronik SPIRIVA® uygulamasıyla birlikte akut tek doz ipratropium bromür uygulaması, advers
olaylarda artış, vital bulgular ya da elektrokardiyografik bulgularda değişiklik ile ilişkili değildi.
Ancak, diğer antikolinerjik ilaçların SPIRIVA® ile birlikte kronik olarak uygulanması henüz incelenmemiştir ve bu nedenle önerilmemektedir.
Özel popülasyonlara ilişkin ek bilgiler:
Özel veri bulunmamaktadır.
Pediyatrik popülasyon:
4.6. Gebelik ve laktasyon
Genel tavsiye: Gebelik kategorisi Cdir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğum kontrol yöntemleri kullanmalıdır.
Gebelik dönemi: SPIRIVA® kapsül ile ilgili olarak, gebelik sırasında ilaç temasına yönelik herhangi bir veri bulunmamaktadır. Preklinik çalışmalarda, gebelik, embriyonal / fetal gelişim, doğum ya da doğum sonrası gelişmeye yönelik direkt ya da dolaylı herhangi bir zararlı etki gösterilmemiştir.
Laktasyon dönemi: Bebeklerini emziren annelerde, tiotropium temasına yönelik klinik veri bulunmamaktadır. Laktasyondaki kemirgenlerde yapılan çalışmalarda, az miktarda tiotropiumun süte geçtiği belirlenmiştir.
Bu nedenle SPIRIVA®, gebe ya da emziren kadınlarda beklenen yararları, henüz doğmamış fetus ya da bebek üzerindeki herhangi bir olası riske karşı ağır basmadığı sürece kullanılmamalıdır.
Üreme yeteneği/Fertilite: Tavşanlar ve sıçanlardaki üreme çalışmalarında gebelik,
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
Listelenmiş olan istenmeyen etkilerin çoğu, SPIRIVA®nın antikolinerjik özelliklerine bağlanabilir.
Advers ilaç reaksiyonları, klinik araştırmalardan ve ilacın onay sonrası kullanımı sırasında yapılan spontan bildirimlerden elde edilen verilerden belirlenmiştir. Klinik araştırma veritabanı, dört hafta ile dört yıl arasında değişen tedavi dönemlerini kapsayan 26 plasebo kontrollü klinik
araştırmada yer alan 9,149 tiotropium hastası ve bunlara ilişkin 11,958 kişi yılı tiotropium temasından oluşmaktadır.
Aşağıdaki listede belirtilen istenmeyen etkilerin sıklık oranları şu şekildedir:
> 1/10 > 1/100 ilâ < 1/10 > 1/1,000 ilâ < 1/100 > 1/10,000 ilâ < 1/1,000
Çok yaygın Yaygın
Yaygın olmayan
Seyrek
Çok seyrek
< 1/10,000, Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Metabolizma ve beslenme hastalıkları
Bilinmiyor: Dehidratasyon
Sinir sistemi hastalıkları
Yaygın olmayan: Baş dönmesi, baş ağrısı, tat alma bozuklukları
Seyrek: Uykusuzluk
Göz hastalıkları
Yaygın olmayan: Bulanık görme
Seyrek: Glokom, göz içi basıncında artış
Kardiyak hastalıklar
Yaygın olmayan: Atriyal fibrilasyon
Seyrek: Supraventriküler taşikardi, taşikardi, palpitasyonlar
Solunum, göğüs bozuklukları ve mediyastinal hastalıklar
Yaygın olmayan: Farenjit, disfoni, öksürük
Seyrek: Bronkospazm, burun kanaması, larenjit, sinüzit
Gastro-intestinal hastalıklar
Yaygın: Ağız kuruluğu
Yaygın olmayan: Stomatit, gastroözofajiyal reflü hastalığı, konstipasyon, bulantı
Seyrek: İntestinal obstrüksiyon (paralitik ileus dahil), gingivit, glossit, orofarenjiyal
kandidiyazis, disfaji Bilinmiyor: Diş çürümesi
Deri ve derialtı dokusu hastalıkları -
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Döküntü
Seyrek: Aşırı duyarlılık reaksiyonları (ani reaksiyonlar dahil), ürtiker, kaşıntı
Bilinmiyor: Anjiyonörotik ödem, deri infeksiyonu ve deri ülseri, deride kuruluk
Kas-iskelet, bağ dokusu ve kemik hastalıkları
Bilinmiyor: Eklemlerde şişme
Böbrek ve idrar hastalıkları
Yaygın olmayan: İdrar retansiyonu, idrar yapmada güçlük
4.9. Doz aşımı ve tedavisi
Yüksek dozlarda SPIRIVA®, antikolinerjik bulgu ve semptomlara yol açabilir.
Ancak, sağlıklı gönüllülerde 282 mikrogram tiotropium dozuna kadar inhale edilen tek doz sonrasında, hiçbir sistemik antikolinerjik istenmeyen etki görülmemiştir.
Sağlıklı gönüllülerde, günde bir kez 141 mg dozunda tekrarlı inhalasyonları izleyerek, ağız kuruluğu ile birlikte bilateral konjonktivit görülmüş ve bu durum tedavi halen sürmekte iken ortadan kaybolmuştur. KOAHı olan kişilerde dört hafta süreyle, günlük maksimum 36 mikrogram tiotropium dozları ile uygulanan çok-dozlu bir çalışmada gözlenen tiotropiuma bağlanabilecek tek istenmeyen olay, ağız kuruluğu olmuştur.
Tiotropium kapsüllerinin oral yoldan alınması ile akut intoksikasyon pek olası değildir, çünkü oral yoldan biyoyararlanımı düşüktür.
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | A07412 |
| Satış Fiyatı | 529.93 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 529.93 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693550019 |
| Etkin Madde | Tiotropium Bromur Monohidrat |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |