SPRYCEL 20 mg 60 film kaplı tablet Kısa Ürün Bilgisi
{ Dasatinib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SPRYCEL 20 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Dasatinib (monohidrat) 20 mg
Yardımcı maddeler
Laktoz monohidrat (inek sütü kaynaklı) 27 mg
Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Bir tarafında “BMS†ve diğer tarafında da “527†basılı olan beyaz-beyazımsı, bikonveks, yuvarlak tablet.
Sitopeni nüksederse, kemik iliği aspiratı/biyopsisi tekrarlanır ve tedavi azaltılmış doz ile tekrar başlatılır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
SPRYCEL aşağıdaki koşullara sahip yetişkin hastaların tedavisinde endikedir:
Yeni tanı konmuş Philadelphia kromozumu pozitif kronik evre kronik miyeloid lösemi (KML),
4.2. Pozoloji ve uygulama şekli
Lösemi tanı ve tedavisinde uzmanlaşmış hekim tarafından tedavi başlatılmalıdır.
Pozoloji:
Yetişkin hastalar
SPRYCEL'in kronik faz KML'de önerilen başlangıç dozajı sabah veya akşam olmak üzere günde bir defa oral yoldan uygulanan 100 mg'dır. Önerilen dozaja ulaşmak için SPRYCEL 20 mg, 50 mg ve 70 mg'lık film kaplı tabletler halinde satışa sunulmuştur (Bkz. Bölüm 4.4, 4.8 ve 5.1). Kronik faz KML hastalarında bir Faz III doz optimizasyon çalışmasında plevral efüzyon, konjestif kalp yetmezliği/kardiyak fonksiyon bozukluğu ve miyelosupresyon insidansı günde bir kere 100 mg SPRYCEL ile tedavi edilen hastalarda daha düşük bulunduğu için bu hasta grubunda başlangıç dozu günde 1 kere 100 mg'dır.
Tabletler düzenli olarak sabah ya da akşamları alınmalıdır.
SPRYCEL'in akselere, myeloid ya da lenfoid blastik faz (ileri faz) KML ya da Ph+ ALL'de başlangıç dozajı sabah bir tablet ve akşam bir tablet olmak üzere oral yoldan uygulanan günde iki defa 70 mg'dır. (Bkz. Bölüm 4.8 ve 5.1).
Hastanın yanıtına ve toleransına göre doz arttırılabilir ya da azaltılabilir.
Uygulama sıklığı ve süresi:
Ph+ kronik faz KML, hızlanmış, miyeloid veya lenfoid blastik evredeki (ileri faz) KML veya Ph+ ALL'li yetişkin hastalarda ve Ph+ kronik faz KML'li pediyatrik hastalarda yapılan klinik çalışmalarda, SPRYCEL tedavisi hastalığın progresyonuna veya hasta tolere edemeyene kadar devam etmiştir. Sitogenetik veya moleküler yanıt [tam sitogenetik yanıt (CCyR), majör moleküler yanıt (MMR) ve MR4.5 gibi] alındıktan sonra tedaviyi kesmenin uzun vadede hastalığın sonucu üzerindeki etkisi araştırılmamıştır.
Klinik çalışmalarda, Ph+ ALL'li pediyatrik hastalarda SPRYCEL tedavisi sürekli olarak uygulanmış ve maksimum iki yıl süreyle asıl ardışık kemoterapi bloklarına eklenmiştir. Daha sonra kök hücre transplantasyonu yapılan hastalarda, SPRYCEL transplantasyondan sonra ilave bir yıl süreyle uygulanabilir.
Önerilen dozu elde etmek amacıyla, SPRYCEL 20 mg, 50 mg, 70 mg, 100 mg film kaplı tabletler halinde bulunmaktadır. Hastanın yanıtı ve tolerabilitesine göre dozun azaltılması veya arttırılması önerilir.
Uygulama şekli:
Oral yoldan uygulanır. Derinin ilaca maruz kalma riskini azaltmak için tabletler ezilmemeli ya da kesilmemeli, bütün olarak yutulmalıdır. SPRYCEL yemekle birlikte ya da aç karnına alınabilir. Kronik faz KML'de günlük doz düzenli olarak sabah ya da akşam alınmalıdır. İleri faz KML'de ise günlük doz sabah ve akşam olmak üzere günde iki kerede alınmalıdır. Tabletleri bütün olarak alan hastalara kıyasla eritilmiş tablet alan hastalarda maruziyet daha düşük olduğundan film kaplı tabletler eritilmemelidir.
SPRYCEL aç veya tok karnına alınabilir ve düzenli olarak sabah veya akşam alınmalıdır.
SPRYCEL greyfurt veya greyfurt suyu ile birlikte alınmamalıdır (Bkz. bölüm 4.5).
Doz artırımı:
Yetişkin kronik faz KML ve Ph+ ALL hastalarında yapılan klinik çalışmalarda önerilen başlangıç dozajında hematolojik veya sitogenetik yanıt vermeyen hastalarda dozun günde bir kere 140 mg'a (kronik faz KML) veya günde bir kere 180 mg'a (ileri faz KML veya Ph+ ALL) artırımına izin verilmiştir.
Güncel tedavi kılavuzlarına göre önerilen dönemde hematolojik, sitogenetik ve moleküler yanıt vermeyen ve tedaviyi tolere eden Ph+ kronik faz KML'li pediyatrik hastalarda aşağıda Tablo1'de belirtilen doz artışları tavsiye edilmektedir.
Tablo 1: Ph+ Kronik faz KML'li pediyatrik hastalarda doz artışı | ||
Doz (günlük maksimum doz) | ||
| Başlangıç dozu | Yükseltme |
Tablet | 40 mg | 50 mg |
| 60 mg | 70 mg |
| 70 mg | 90 mg |
| 100 mg | 120 mg |
Ph+ ALL'li pediyatrik hastalarda SPRYCEL kemoterapi ile birlikte uygulandığından bu hastalarda dozun artırılması önerilmez.
İstenmeyen etkilerde dozun ayarlanması:
Miyelosupresyon:
Klinik çalışmalarda miyelosupresyon doza ara verilerek, doz azaltılarak ya da çalışma tedavisi kesilerek tedavi edilmiştir. Gereken durumlarda trombosit transfüzyonu ve kırmızı hücre transfüzyonu yapılmıştır. Dirençli miyelosupresyonu olan hastalarda hematopoetik büyüme faktörü kullanılmıştır.
Yetişkinlerde doz değişiklik kılavuzları Tablo 2'de ve Ph+ kronik faz KML'li pediyatrik hastalarda Tablo3'te özetlenmektedir. Kemoterapi ile kombinasyon tedavisi uygulanan Ph+ ALL'li pediyatrik hastalara yönelik kılavuzlar tabloların arkasından ayrı bir paragrafta açıklanmaktadır.
Tablo 2 Yetişkinlerde nötropeni ve trombositopenide doz ayarlamaları | ||
Yetişkin Kronik Faz KML (başlangıç dozu: günde bir kere 100 mg |
MNS < 0,5 x 10/l ve/veya Trombositler < 50 x 10/l | 1 MNS ≥ 1,0 x 10/l ve trombositler ≥ 50 x 10/l olana kadar tedavi kesilir
2 Orijinal başlangıç dozu ile tedaviye kaldığı yerden devam edilir.
3 Eğer 7 günden daha uzun bir süre trombositler < 25 x 10/l olur ve/veya < 0,5 x 10/l MNS reküransı görülürse, 1. aşama tekrarlanır ve tedavi günde bir kere 80 mg olarak düşük bir dozla yeniden başlatılır (ikinci episod için) üçüncü episod için doz günde bir kere 50 mg'a düşürülür (yeni tanı almış hastalar için) ya da tedavi kesilir (imatinib dahil önceki tedaviye karşı dirençli ya da intoleran hastalar için). |
Yetişkin Akselere ve Blastik Faz KML ve Ph+ ALL (başlangıç dozu: günde iki kere 70 mg) |
MNS < 0,5 x 10/l ve/veya Trombositler < 10 x 10/l |
|
Sitopeninin lösemiye bağlı olup olmadığı kontrol edilir (ilik aspirasyonu veya biyopsi).
4.3. Kontrendikasyonlar
Dasatinib monohidrata veya diğer bileşenlerine karşı aşırı duyarlılığı olanlarda kontrendikedir. (bkz. Bölüm 6.1)
4.4. Özel kullanım uyarıları ve önlemleri
Klinik önemi olan etkileşmeler:
Dasatinib sitokrom P450 (CYP)3A4'ün bir substratı ve inhibitörüdür. Dolayısıyla, primer olarak CYP3A4 tarafından metabolize edilen veya onun aktivitesini düzenleyen tıbbi ürünlerin eşzamanlı uygulanmasında etkileşme potansiyeli vardır (Bkz Bölüm 4.5).
Dasatinibin CYP3A4'ü kuvvetle inhibe eden tıbbi ürünler veya maddeler (örn., ketokonazol, itrakonazol, eritromisin, klaritromisin, ritonavir, telitromisin, greyfurt suyu) ile eşzamanlı kullanımı dasatinib etkinliğini arttırabilir. Bu yüzden, SPRYCEL alan hastalarda güçlü bir CYP3A4 inhibitörünün eşzamanlı uygulaması önerilmez (Bkz Bölüm 4.5).
Dasatinibin CYP3A4'ü indükleyen tıbbi ürünler (örn., deksametazon, fenitoin, karbamazepin, rifampisin, fenobarbital ya da St. John's Wort diye de bilinen Hypericum perforatum içeren bitkisel preparatlar) ile eşzamanlı kullanımı dasatinib alımını kayda değer oranda azaltıp terapötik başarısızlık riskini potansiyel olarak arttırabilir. Bundan dolayı, SPRYCEL alan hastalara CYP3A4 indüksiyon potansiyeli daha az olan alternatif tıbbi ürünlerin eşzamanlı uygulaması seçilmelidir (Bkz Bölüm 4.5).
Dasatinib ile bir CYP3A4 substratının eşzamanlı kullanımı CYP3A4 substratı düzeyini arttırabilir. Dolayısıyla, SPRYCEL'in örneğin astemizol, terfenadin, sisaprid, pimozid, kinidin, bepridil ya da ergot alkaloidleri (ergotamin, dihidroergotamin) gibi terapötik indeksi dar olan CYP3A4 substratları ile eşzamanlı uygulaması dikkat gerektirir (Bkz Bölüm 4.5).
Dasatinib ile bir histamin-2(H) blokörün (örn., famotidin), bir proton pompası inhibitörünün (örn., omeprazol) ya da alüminyum hidroksitin ve magnezyum hidroksitin eşzamanlı kullanımı dasatinib düzeyini azaltabilir. Dolayısıyla Hblokörleri ile proton pompası inhibitörleri önerilmez. Alüminyum hidroksit/magnezyum hidroksit ürünleri ise dasatinibden 2 saat önce veya 2 saat sonra uygulanmalıdır (Bkz Bölüm 4.5).
Özel popülasyonlar
Tek doz farmakokinetik çalışma bulgularına dayanarak, hafif, orta veya şiddetli karaciğer yetmezliği olan hastalar önerilen başlangıç dozunu alabilir (Bkz. bölüm 5.2). Bu klinik çalışmanın sınırlamalarından dolayı, karaciğer yetmezliği olan hastalara dasatinib uygulanırken dikkatli olunması önerilir.
Önemli istenmeyen ilaç reaksiyonları
Myelosupresyon: SPRYCEL tedavisi anemi, nötropeni ve trombositopeni ile ilişkilidir. Bu belirtiler, ileri faz KML veya Ph+ ALL hastalarında kronik faz KML hastalarında olduğundan daha erken ve daha sık görülür. İlk iki ay her hafta tam kan sayımı yapılmalı, daha sonra aylık olarak veya klinik olarak endike olması halinde daha sık aralıklarla devam edilmelidir. Kronik faz KML hastalarında, 12 hafta boyunca her 2 haftada bir ve bundan sonra her 3 ayda bir veya klinik olarak endike olduğu hallerde tam kan sayımı yapılmalıdır.
Myelosupresyon genellikle geri dönüşümlü olmuş ve SPRYCEL geçici olarak kesilerek ya da dozu azaltılarak tedavi edilmiştir. Kemoterapi ile kombinasyon halinde dasatinib alan Ph+ ALL'li pediyatrik hastalarda, her bir kemoterapi bloğunun başlangıcından önce ve klinik olarak endike olan şekilde tam kan sayımı gerçekleştirilmelidir. Kemoterapi bloklarının
konsolidasyonu sırasında, iyileşme gözlenene kadar 2 günde bir tam kan sayımı yapılmalıdır (Bkz. bölüm 4.2 ve 4.8).
Kanama: Kronik faz KML hastalarındaki (n=548) dasatinib alan 5 hasta (%1) grade 3 veya 4 kanama geliştirmiştir. SPRYCEL'in önerilen dozunu almakta olan ileri faz KML hastaları (n=304) ile yapılan klinik çalışmalarda hastaların %1'inde ciddi merkezi sinir sistemi (MSS) kanaması görülmüştür. Bir vaka fatal olmuş ve CTC (Common Toxicity Criteria) grade 4 trombositopeni ile ilişkilendirilmiştir. İleri faz KML hastalarının % 6'sında grade 3 veya 4 gastrointestinal kanama görülmüş ve genellikle ilacın kesilmesi ve transfüzyon gerekmiştir. İleri faz KML hastalarının %2'sinde başka grade 3 veya 4 kanamalar ortaya çıkmıştır. Bu hastalarda kanamaya bağlı olayların çoğu tipik olarak grade 3 veya 4 trombositopeni ile ilişkilidir (Bkz Bölüm 4.8). Buna ek olarak, in vitro ve in vivo platelet tayinleri SPRYCEL tedavisinin platelet aktivasyonunu reversibl olarak etkilediğini önermektedir.
Hastaların trombosit fonksiyonlarını inhibe eden tıbbi ürünler ya da antikoagülanlar alması gereken durumlarda dikkatli olmak gerekir.
Sıvı retansiyonu: SPRYCEL sıvı retansiyonu ile ilişkilidir. Yeni tanı almış kronik faz KML hastalarında yapılan Faz III klinik çalışmada, minimum 60 aylık bir takip sonucunda dasatinib tedavi grubundaki 13 hastada (%5) ve imatinib tedavi grubundaki 2 hastada (%1) grade 3 veya 4 sıvı retansiyonu bildirilmiştir (Bkz Bölüm 4.8). Önerilen dozda SPRYCEL almakta olan kronik faz KML hastalarından (n=548) 32 hastada (%6) ciddi sıvı retansiyonu görülmüştür. Önerilen dozda SPRYCEL almakta olan ileri faz KML hastalarında (n=304) yapılan klinik çalışmalarda sırası ile hastaların % 7'sinde ve %1'inde bildirilen grade 3 veya 4 plevral ve perikardiyal efüzyon dahil, hastaların % 8'inde grade 3 veya 4 sıvı retansiyonu bildirilmiştir. Bu hastalarda grade 3 veya 4 pulmoner ödem ve pulmoner hipertansiyon her biri %1 oranında bildirilmiştir.
Dispne ya da kuru öksürük gibi plevral efüzyonu düşündüren semptomlar geliştiren hastalar göğüs röntgeni ile değerlendirilmelidir. Grade 3 veya 4 plevral efüzyon torasentez ve oksijen tedavisi gerektirebilir. Sıvı retansiyonu olayları tipik olarak diüretik ve kısa steroid kürleri dahil destekleyici tedavi önlemleri ile iyileştirilmiştir. 65 yaş ve üstü hastalarda plevral efüzyon, dispne, öksürük, perikardiyal efüzyon ve konjestif kalp yetmezliği görülme olasılığı genç hastalardan daha yüksek olduğundan, bu hastalar yakından izlenmelidir. Plevral efüzyon ile başvuran hastalarda da şilotoraks vakaları bildirilmiştir. (Bkz. bölüm 4.8)
Pulmoner arter hipertansiyonu (PAH):
Dasatinib tedavisi ile bağlantılı olarak sağ kalp kateterizasyonu ile konfirme edilen pre-kapiler pulmoner arter hipertansiyonu (PAH) bildirilmiştir (Bkz Bölüm 4.8). Bu vakalarda PAH dasatinib tedavisine başlandıktan sonra bildirilmiştir ve bir yıldan daha uzun süren tedavileri de içermektedir.
Dasatinib tedavisine başlamadan önce hastalar altta yatan kardiyopulmoner hastalık bulgu ve semptomları açısından değerlendirilmelidir. Kardiyak hastalık semptomları ile gelen her hastaya tedavi başlangıcında ekokardiyografi yapılmalı ve kardiyak ya da pulmoner hastalık risk faktörleri bulunan hastalarda yapılması düşünülmelidir. Dasatinibe başlandıktan sonra dispne ve bitkinlik geliştiren hastalar plevral efüzyon, pulmoner ödem, anemi, akciğer infiltrasyonu dahil yaygın etiyolojiler açısından değerlendirilmelidir. Hemotoloji – dışı adversreaksiyonların tedavisi önerilerine göre (Bkz Bölüm 4.2) bu değerlendirme yapılırken dasatinib dozu azaltılmalı ya da tedaviye ara verilmelidir. Doz azaltılarak veya ara verilerek bir iyileşme sağlanamıyorsa ya da hiçbir açıklama getirilemiyorsa, PAH teşhisi düşünülmelidir. Tanı koymak için standart uygulama rehberine göre hareket etmelidir. Eğer
PAH konfirme edilirse, dasatinib tamamen kesilmelidir. Standart uygulama rehberine göre takip edilmelidir. Dasatinib tedavisi kesildikten sonra dasatinib ile PAH geliştiren hastaların hemodinamik ve klinik parametrelerinde düzelme gözlenmiştir.
QT Uzaması: İn vitro veriler dasatinibin kardiyak ventriküler repolarizasyonu (QT aralığı) uzatma potansiyeli olduğunu göstermektedir (Bkz Bölüm 5.3). Yeni tanı almış kronik faz KML hastalarında yapılan Faz III çalışmada, minimum 60 aylık takip sonrasında, dasatinib ile tedavi edilen 258 hastadan ve imatinib ile tedavi edilen 258 hastadan oluşan her iki tedavi grubundaki 1'er hastada (<%1) QTc uzaması advers reaksiyon olarak bildirilmiştir. Başlangıca göre QTcF'teki medyan değişiklikler dasatinib ile tedavi edilen hastalarda 3,0 milisaniye, buna karşın imatinib ile tedavi edilen hastalarda 8,2 milisaniye idi. Her iki tedavi grubundaki 1'er hastada (< %1) >500 milisaniye QTcF bildirilmiştir. SPRYCEL ile tedavi edilen 865 lösemi hastasında yapılan Faz II klinik çalışmalarda QTc aralığında başlangıçtan olan ortalama değişiklik, Fridericia metodu (QTcF) ile, 4 – 6 milisaniyeydi; başlangıçtan itibaren bütün ortalama değişikliklerin üst %95 güven aralıkları < 7 milisaniye olmuştur (Bkz Bölüm 4.8).
Önceki imatinib tedavisine dirençli veya intoleranslı hastalarda yapılan klinik çalışmalarda
SPRYCEL alan 2182 hastadan 15'inde (%1) advers olay olarak QTc uzaması bildirilmiştir. Yirmibir hastada (%1) > 500 milisaniye QTcF bildirilmiştir.
QTc uzaması olan veya bunu geliştirebilecek durumdaki hastalarda SPRYCEL dikkatli uygulanmalıdır. Hipokalemi veya hipomagnezemili, konjenital uzun QT sendromlu, anti- aritmik ilaçlar alan veya QT uzamasına yol açan başka tıbbi ürünler alan ya da kümülatif yüksek doz antrasiklin tedavisi gören hastalar buna dahildir. SPRYCEL uygulamadan önce hipokalemi veya hipomagnezemi düzeltilmelidir.
Kardiyak advers reaksiyonlar: Dasatinib, aralarında daha önce kardiyak hastalık hikayesi olan hastaların da bulunduğu 519 yeni tanı almış kronik faz KML hastası ile yapılan randomize bir çalışmada incelenmiştir. Konjestif kalp yetmezliği/ kardiyak fonksiyon bozukluğu, perikardiyal efüzyon, aritmi, çarpıntı, QT uzaması ve miyokard infarktüsü (fatal dahil) gibi kardiyak advers reaksiyonlar dasatinib tedavisi alan hastalarda rapor edilmiştir. Kardiyak advers olaylar, kardiyak hastalıklar ilgili hikayesi veya risk faktorü olan hastalarda daha yaygındır. Kardiyak hastalık risk faktörü (ör. hipertansiyon, hiperlipidemi, diyabet) veya hikayesi (ör. Geçmişte perkütan koroner girişim, belgelendirilmiş koroner arter hastalığı olan hastalar göğüs ağrısı, nefes darlığı ve aşırı terleme gibi kardiyak disfonksiyon bulgu ve semptomları açısından dikkatlice izlenmeli ve uygun şekilde değerlendilmeli ve tedavi edilmelidir.
Eğer bu klinik belirti ve semptomlar gelişirse hekimlerin dasatinib uygulamasına ara vermeleri ve alternatif KML'ye özgü tedavi ihtiyacını göz önünde bulundurmaları önerilmektedir. Düzelme sonrasında, dasatinib ile tedaviye devam edilmeden önce işlevsel bir değerlendirme yapılmalıdır. Hafif/orta şiddetli olaylarda (Grade ≤ 2) dasatinibe başlangıç dozunda devam edilebilir ve şiddetli olaylarda (Grade ≥ 3) doz düzeyi azaltılarak (Bkz. Bölüm 4.2) devam edilebilir. Tedaviye devam eden hastalar periyodik olarak izlenmelidir.
Kontrol edilemeyen ya da anlamlı kardiyovasküler hastalığı olan hastalar klinik çalışmalara alınmamıştır.
Trombotik mikroanjiyopati (TMA)
BCR-ABL tirozin kinaz inhibitörleri, SPRYCEL için bireysel olgu raporları dahil olmak üzere trombotik mikroanjiyopati (TMA) ile ilişkilendirilmiştir (Bkz. bölüm 4.8). SPRYCEL alan bir hastada TMA ile ilişkili bir laboratuvar bulgusu veya klinik bulgu gelişirse, SPRYCEL
tedavisi sonlandırılmalı ve ADAMTS13 aktivitesi ve anti-ADAMTS13-antikor tespiti dahil olmak üzere TMA için kapsamlı bir değerlendirme tamamlanmalıdır. Düşük ADAMTS13 aktivitesi ile bağlantılı olarak anti-ADAMTS13-antikoru yükselirse, SPRYCEL tedavisi tekrar başlatılmamalıdır.
Hepatit B reaktivasyonu
Hepatit B virüsü (HBV) kronik taşıyıcısı olan hastalarda, BCR-ABL tirozin kinaz inhibitörleri ile tedavi sonrası, Hepatit B reaktivasyonu ortaya çıkmıştır. Bazı vakalar, karaciğer nakli veya ölüme sebep olan akut karaciğer yetmezliği veya fulminan hepatit ile sonuçlanmıştır. SPRYCEL tedavisine başlanmadan önce, hastalar HBV enfeksiyonu açısından test edilmelidir. Pozitif HBV serolojisine sahip (aktif hastalığı olanlar dahil) ve tedavi sırasında HBV enfeksiyonu için pozitif test sonucu veren hastalarda, tedavi başlatılmadan önce karaciğer hastalığı ve HBV tedavisi konusunda uzman hekimlere danışılmalıdır. SPRYCEL ile tedaviye ihtiyaç duyan HBV taşıyıcıları, tedavi boyunca ve tedavi sonlandırıldıktan sonra birkaç ay boyunca aktif HBV enfeksiyonu bulgu ve belirtileri için yakından izlenmelidir (Bkz. Bölüm 4.8).
Pediyatrik hastalarda büyüme ve gelişim üzerinde etkiler
İmatinibe dirençli/tolere edemeyen Ph+ kronik faz KML'li pediyatrik hastalarda ve tedavi almamış Ph+ kronik faz KML'li pediyatrik hastalarda SPRYCEL ile yapılan pediyatrik çalışmalarda en az 2 yıllık tedaviden sonra, biri yüksek şiddette olmak üzere 6 hastada (%4,6) tedavi ile ilişkili kemik büyümesi ve gelişimle ilgili advers olaylar bildirilmiştir (Grade 3 Büyüme Geriliği). Bu 6 vaka epifiz füzyonunda gecikme, osteopeni, büyüme geriliği ve jinekomasti vakalarını içermiştir (Bkz. bölüm 5.1). Bu bulguların KML gibi kronik hastalık bağlamında yorumlanması zordur ve uzun dönem takibi gerekmektedir.
Yeni tanı konan Ph+ ALL'li pediyatrik hastalarda kemoterapi ile kombinasyon halinde SPRYCEL'in incelendiği çalışmalarda en az 2 yıllık tedaviden sonra, 1 hastada (%0,6) tedavi ile ilişkili kemik büyümesi ve gelişimle ilgili advers olaylar bildirilmiştir. Bu olgu bir Grade 1 osteopeniydi.
Klinik çalışmalarda SPRYCEL ile tedavi edilen pediyatrik hastalarda büyüme geriliği gözlenmiştir (bkz. bölüm 4.8). Pediyatrik hastalarda kemik büyümesinin ve gelişiminin izlenmesi önerilir.
Laktoz: Bu tıbbi ürünün 100 mg'lık günlük dozu 135 mg ve 140 mg'lık günlük dozu 189 mg laktoz monohidrat içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Dasatinibin plazma konsantrasyonlarını arttırabilen aktif maddeler:
In vitro çalışmalar dasatinibin bir CYP3A4 substratı olduğunu göstermektedir. Dasatinib ile CYP3A4'ü kuvvetle inhibe eden tıbbî ürünlerin veya maddelerin (örn., ketokonazol, itrakonazol, eritromisin, klaritromisin, ritonavir, telitromisin, greyfurt suyu) eşzamanlı kullanımı dasatinib kan düzeyini arttırabilir. Dolayısıyla, SPRYCEL alan hastalarda kuvvetli bir CYP3A4 inhibitörünün sistemik uygulaması önerilmez.
In vitro deneylere göre, dasatinib; klinik olarak önemli konsantrasyonlarda, plazma proteinlerine yaklaşık %96 oranında bağlanır. Dasatinibin proteinlere bağlanan diğer tıbbî ürünler ile olan etkileşimini değerlendirmek için herhangi bir çalışma yapılmamıştır. Yer değiştirme (displacement) potansiyeli ve klinik önemi bilinmemektedir.
Dasatinibin plazma konsantrasyonlarını düşürebilen aktif maddeler:
Güçlü bir CYP3A4 indükleyicisi olan rifampisinin 8 akşam üstüste 600 mg olarak uygulanmasından sonra dasatinib uygulandığı zaman, dasatinibin EAA'ı %82 azalmıştır. Keza CYP3A4 aktivitesini indükleyen başka tıbbi ürünler de (örn., deksametazon, fenitoin, karbamazepin, fenobarbital veya St. John's Wort olarak da bilinen Hypericum perforatum içeren bitkisel preparatlar) metabolizmayı hızlandırarak dasatinibin plazma konsantrasyonlarını düşürebilirler. Dolayısıyla, güçlü CYP3A4 indükleyicileri ile SPRYCEL'in eşzamanlı kullanımı tavsiye edilmez. Rifampisinin ya da başka CYP3A4 indükleyicisinin endike olduğu hastalarda, enzim indüksiyonu daha az olan tıbbi ürünler kullanılmalıdır. Zayıf bir CYP3A4 indükleyicisi olan deksametazonun dasatinib ile eşzamanlı kullanımına izin verilmektedir; dasatinib EAA'sının deksametazonla birlikte kullanıldığında yaklaşık %25 azalması beklenmektedir ve bu düşüşün klinik olarak anlamlı olması olası değildir.
Histamin-2 antagonistleri ve proton pompası inhibitörleri:
Gastrik asit sekresyonunun Hantagonistleri ya da proton pompası inhibitörleri (örn., famotidin ve omeprazol) ile uzun süreli supresyonunun dasatinib alımını azaltma olasılığı vardır. Sağlıklı gönüllülerde yapılan bir tek doz çalışmasında tek doz SPRYCEL'den 10 saat önce famotidin uygulandığı zaman dasatinib alımı %61 azalmıştır. 14 sağlıklı gönüllü üzerinde gerçekleştirilen bir çalışmada denge durumunda 4 günlük 40 mg omeprazol dozunun ardından tek bir 100 mg'lik SPRYCEL dozunun uygulanması dasatinibin EAA'sını %43, C değerini ise %42 azaltmıştır. SPRYCEL tedavisi alan hastalarda Hantagonistleri ya da proton pompası inhibitörleri yerine antasit kullanımı düşünülmelidir (Bkz Bölüm 4.4).
Antasitler:
Nonklinik veriler dasatinibin solubilitesinin pH'a bağlı olduğunu kanıtlamaktadır. Sağlıklı gönüllülerde alüminyum/magnezyum hidroksidin SPRYCEL ile eşzamanlı kullanımı sonucu tek doz SPRYCEL'in EAA'ı %55 ve C'ı %58 azalmıştır. Ancak antasitler tek doz SPRYCEL'den 2 saat önce uygulandığı zaman SPRYCEL'in konsantrasyonunda ya da alımında önemli bir değişiklik gözlenmemiştir. Bu durumda, antiasitler SPRYCEL'den en erken 2 saat önce veya 2 saat sonra uygulanabilir (Bkz Bölüm 4.4).
SPRYCEL'in plazma konsantrasyonlarını değiştirebileceği aktif maddeler:
Dasatinibin ve bir CYP3A4 substratının eş zamanlı kullanımı CYP3A4 substratı kan düzeyini arttırabilir. Sağlıklı gönüllülerde yapılan bir çalışmada 100 mg'lık tek bir SPRYCEL dozu bir CYP3A4 substratı olduğu bilinen simvastatinin EAA ve Calımını sırasıyla %20 ve %37 arttırmıştır. Bu etkinin multipl dasatinib dozlarından sonra daha fazla olduğu görülmüştür. Dolayısıyla, terapötik indekslerinin dar olduğu bilinen CYP3A4 substratları (örn., astemizol, terfenadin, sisaprid, pimozid, kinidin, bepridil veya ergot alkaloidleri (ergotamin, dihidroergotamin) SPRYCEL alan hastalarda dikkatli uygulanmalıdır (Bkz Bölüm 4.4).
In vitro veriler örneğin glitazonlar gibi CYP2C8 substratları ile potansiyel etkileşme riski olduğunu göstermektedir.
Özel popülasyonlara ek bilgiler Pediyatrik popülasyon
Etkileşim çalışmaları yalnızca yetişkinlerle gerçekleştirilmiştir.
4.6. Gebelik ve laktasyon
:Gebelik kategorisi D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):
Çocuk doğurma potansiyeli olan cinsel olarak aktif erkek ya da kadın hastalar SPRYCEL ile tedavi görürken yeterli kontrasepsiyon kullanmalıdır.
Gebelik dönemi:
İnsan deneyimlerine dayanarak, dasatinibin hamilelik esnasında kullanıldığında nöral tüp defektleri ve fetüs üzerinde zararlı farmakolojik etkileride dahil olmak üzere konjenital malformasyonlara sebep olabileceği beklenmektedir. Hayvanlarda yapılan çalışmalar üreme toksisitesi göstermiştir (Bkz Bölüm 5.3). Kadının klinik durumu dasatinib ile tedavisini gerektirmedikçe SPRYCEL, gebelik döneminde kullanılmamalıdır. Eğer SPRYCEL gebelikte kullanılacak ise fetüsün karşı karşıya bulunduğu potansiyel risk hastaya bildirilmelidir.
Dasatinib hamile bir kadına uygulandığında fetüse zarar verebilir. Hamilelikleri sırasında SPRYCEL almış olan kadınlarda pazarlama sonrası spontan düşük ve yanı sıra fetüs ve bebekte anomali bildirimleri yapılmıştır.
Laktasyon dönemi:
Dasatinib monohidratın insan ya da hayvan sütü ile atıldığına ilişkin yetersiz/sınırlı bilgi mevcuttur. Bu nedenle memedeki çocuk açısından bir risk olduğu göz ardı edilemez.
SPRYCEL ile tedavi sırasında emzirme durdurulmalıdır.
Üreme yeteneği / Fertilite:
Hayvanlarla yapılan çalışmalarda, erkek ve dişi sıçanların fertilitesi dasatinib tedavisinden etkilenmemiştir (Bkz. bölüm 5.3). Doktorlar ve diğer sağlık uzmanları uygun yaştaki erkek hastalara spermlerin saklanması hakkında tavsiyeyi de içeren, SPRYCEL'in fertilite üzerindeki olası etkileri hakkında bilgi vermelidir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
SPRYCEL'in araç ve makine kullanma becerisi üzerinde çok düşük etkisi vardır. Dasatinib sersemlik ya da görme bulanıklığına sebep olabileceğinden, hastalar araç ve makine kullanırken dikkatli olmaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Aşağıda açıklanan veriler klinik çalışmalarda, 324 yeni tanı almış kronik faz KML, 2388 imatinibe dirençli veya tolere edemeyen kronik veya ileri faz KML veya Ph+ ALL hastasını ve
188 pediyatrik hastayı içeren hastaların (N=2900) tek ajanlı tedavi olarak SPRYCEL'e
maruziyetini yansıtmaktadır.
Kronik faz KML, ileri faz KML veya Ph+ ALL hastalarını içeren 2712 hastada medyan tedavi süresi 19,2 ay (0-93,2 ay aralığında) olmuştur. Yeni tanı almış kronik faz KML hastalarında yapılan randomize çalışmada, medyan tedavi süresi yaklaşık 60 ay olmuştur. 1618 yetişkin kronik faz KML hastasının medyan tedavi süresi 29 ay (0-92,9 ay aralığında) olmuştur. 1094 yetişkin ileri faz KML veya Ph+ ALL hastasında, hastaların medyan tedavi süresi 6,2 ay (0- 93,2 ay aralığında) idi. Pediyatrik çalışmalardaki 188 hastada tedavi süresi 26,3 ay olmuştur (0 ila 99,6 ay aralığında). SPRYCEL ile tedavi edilen 130 kronik faz pediyatrik KML hastasını içeren alt grupta medyan tedavi süresi 42,3 ay (0,1-99,6 ay aralığında) olmuştur.
SPRYCEL ile tedavi edilen hastaların çoğunluğu bazen advers reaksiyon yaşamıştır. SPRYCEL ile tedavi edilen 2712 hastadan oluşan genel popülasyonda, 520 (%19) hasta advers reaksiyon yaşamış ve bunun sonucunda tedavileri kesilmiştir.
Pediyatrik Ph+ kronik faz KML popülasyonunda SPRYCEL'in genel güvenlilik profili, formülasyondan bağımsız şekilde yetişkin popülasyonda gözlenene benzer olmuştur; sadece pediyatrik popülasyonda perikardiyal efüzyon, plevral efüzyon, pulmoner ödem veya pulmoner hipertansiyon bildirilmemiştir. SPRYCEL ile tedavi edilen kronik faz KML'li 130 pediyatrik hastanın 2'sinde (%1,5) tedavinin kesilmesine yol açan advers reaksiyonlar görülmüştür.
4.9. Doz aşımı ve tedavisi
SPRYCEL doz aşımı deneyimi klinik çalışmalardaki izole vakalar ile sınırlıdır. Bir hafta boyunca günde 280 mg'lık bir doz aşımı iki hastada bildirilmiştir ve her iki hastanın da trombosit sayılarında belirgin bir azalma olmuştur. SPRYCEL grade 3 veya 4 myelosupresyon ile bağlantılı bulunduğundan (Bkz Bölüm 4.4), önerilen dozajdan fazlasını almış olan hastalar myelosupresyon açısından yakından gözlemlenmeli ve uygun destekleyici tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, Protein kinaz inhibitörü ATC kodu: L01EA02
Farmakodinami
Dasatinib c-KIT, efrin (EPH) reseptör kinazlar ve PDGFβ reseptörü dahil bir takım başka seçilmiş onkojen kinazlar ile birlikte BCR-ABL kinaz ile SRC ailesi kinazlarının aktivitesini inhibe eder. Dasatinib potensini 0,6-0,8 nM'de gösteren güçlü bir subnanomolar BCR-ABL kinaz inhibitörüdür. BCR-ABL enziminin hem inaktif hem de aktif konformasyonuna bağlanır.
Etki mekanizması
İmatinibe duyarlı ve dirençli hastalık değişkenleri olan lösemi hücresi serilerinde dasatinib in vitro olarak aktiftir. Bu klinik olmayan çalışmalar dasatinibin aşırı BCR-ABL ekspresyonundan, BCR-ABL kinaz parça mutasyonlarından, SRC ailesi kinazları (LYN, HCK) içeren alternatif sinyal yolaklarının aktivasyonundan ve çoklu ilaç direnç (MDR) geninin aşırı ekspresyonundan kaynaklanan imatinib direncini yenebileceğini göstermektedir. Bundan başka, dasatinib SRC ailesi kinazlarını subnanomolar konsantrasyonda inhibe eder.
In vivo, fare veya sıçan KML modellerinin kullanıldığı ayrı deneylerde dasatinib kronik KML'nin blastik faza progresyonunu engellemiş ve merkezi sinir sistemi dahil farklı yerlerde büyüyen, hastalardan elde edilmiş KML hücresi serilerini taşıyan farelerde sağkalımı uzatmıştır.
Klinik etkililik ve güvenlilik
Faz I çalışmada, tedavi edilen ve 27 ay takip edilen ilk 84 hastada KML'nin tüm fazlarında ve Ph+ ALL'de hematolojik ve sitogenetik yanıtlar gözlenmiştir. Yanıtlar KML ve Ph+ ALL'nin tüm fazlarında sürekli olmuştur.
İmatinibe dirençli olan veya tolere edemeyen kronik, hızlanmış veya miyeloid blastik evredeki KML'li hastalarda dasatinibin güvenlilik ve etkililiğini değerlendirmek üzere dört tek kollu, kontrolsüz, açık Faz II klinik çalışma gerçekleştirilmiştir. Başlangıçta 400 veya 600 mg imatinib tedavisi başarısız olan kronik fazdaki hastalarda bir randomize, karşılaştırmalı olmayan çalışma yürütülmüştür. Başlangıç dozu günde iki kez 70 mg dasatinib idi. Etkinliğin iyileştirilmesi veya toksisitelerin yönetimi için doz değişikliklerine izin verilmiştir (Bkz. Bölüm 4.2).
Günde iki kez uygulanan dasatinibe kıyasla günde bir kez uygulanan dasatinibin etkililiğini değerlendirmek üzere iki randomize, açık etiketli Faz III çalışma yürütülmüştür. Buna ek
olarak, yeni kronik faz KML tanısı konmuş yetişkin hastalarda bir açık etiketli, randomize, karşılaştırmalı Faz III çalışma yapılmıştır.
Dasatinibin etkililiği, hematolojik ve sitogenetik yanıt oranlarına dayalıdır.
Yanıt sürekliliği ve tahmini sağkalım oranları, dasatinibin klinik yararı açısından ilave kanıt
sağlamaktadır.
Klinik çalışmalarda toplam 2712 hasta değerlendirilmiş olup, bunların %23'ü ≥ 65 yaş ve
%5'i ≥75 yaşındaydı.
Kronik faz KML – Yeni tanı konmuş
Yeni kronik faz KML tanısı konmuş yetişkin hastalarda bir uluslararası, açık etiketli, çok merkezli, randomize, karşılaştırmalı Faz III çalışma yapılmıştır. Hastalar günde bir kez SPRYCEL 100 mg veya günde bir kez imatinib 400 mg almak üzere randomize edilmiştir. Primer sonlanma noktası 12 ay içindeki doğrulanmış tam sitogenetik yanıt oranı (cCCyR) idi. Sekonder sonlanma noktaları cCCyR'de geçen süre (yanıt sürekliliğinin ölçümü), cCCyR'ye kadar geçen süre, majör moleküler yanıt (MMR) oranı, MMR'ye kadar geçen süre, progresyonsuz sağkalım (PFS) ve genel sağkalımdı (OS). Diğer ilişkili etkililik sonuçları CCyR ve tam moleküler yanıt (CMR) oranlarını içermiştir. Çalışma devam etmektedir.
Toplam 519 hasta bir tedavi grubuna randomize edilmiştir: 259'u SPRYCEL ve 260'ı imatinib grubuna. Başlangıç özellikleri yaş (medyan yaş SPRYCEL grubunda 46 ve imatinib grubunda 49 olup hastaların sırasıyla %10 ve %11'i 65 yaş veya üzerindeydi), cinsiyet (sırasıyla %44 ve
%37'si kadın) ve ırk (sırasıyla Beyaz %51 ve %55; Asyalı %42 ve %37) açısından iki tedavi grubu arasında iyi şekilde dengelenmiştir. Başlangıçta, Hasford Skorlarının dağılımı SPRYCEL ve imatinib tedavi gruplarında benzerdi (sırasıyla düşük risk: %33 ve %34; orta risk %48 ve %47; yüksek risk: %19 ve %19).
En az 12 aylık takiple, SPRYCEL grubuna randomize olan hastaların %85'i ve imatinib grubuna randomize olan hastaların %81'i halen birinci basamak tedavi almaktaydı. Hastalık progresyonundan dolayı 12 ay içinde tedaviyi kesme oranı SPRYCEL grubunda %3 ve imatinib grubunda %5 idi.
En az 60 aylık takiple, SPRYCEL grubuna randomize olan hastaların %60'ı ve imatinib grubuna randomize olan hastaların %63'ü halen birinci basamak tedavi almaktaydı. Hastalık progresyonundan dolayı 60 ay içinde tedaviyi kesme oranı SPRYCEL grubunda %11 ve imatinib grubunda %14 idi.
Etkililik sonuçları Tablo 8'de sunulmuştur. Tedavinin ilk 12 ayında imatinib grubuna kıyasla SPRYCEL grubundaki hastaların istatistiksel olarak anlamlı şekilde daha yüksek bir bölümünde cCCyR elde edilmiştir. SPRYCEL'in etkililiği, yaş, cinsiyet ve başlangıç Hasford skorları dahil farklı alt gruplarda tutarlı şekilde gösterilmiştir.
Tablo 8 :Yeni Tanı Konmuş Kronik Faz KML Hastalarında Yapılan bir Faz 3 Çalışmadan Alınan Etkililik Sonuçları
| SPRYCEL n=259 | İmatinib n=260 | p-değeri |
Yanıt oranı (%95 GA) | |||
Sitogenetik Yanıt 12 Ayda |
|
|
|
cCCyR | %76,8 (71,2-81,8) | %66,2 (60,1-71,9) | p<0,007* |
CCyR | %85,3 (80,4-89,4) | %73,5 (67,7-78,7) | - |
24 Ayda |
|
|
|
cCCyR | % 80,3 | %74,2 | - |
CCyR | % 87,3 | % 82,3 | - |
36 Ayda |
|
|
|
cCCyR | % 82,6 | %77,3 | - |
CCyR | % 88 | %83,5 | - |
48 Ayda |
|
|
|
cCCyR | % 82,6 | % 78,5 | - |
CCyR | % 87,6 | % 83,8 | - |
60 Ayda |
|
|
|
cCCyR | %83 | %78.5 |  |
CCyR | %88 | %83.8 |  |
Majör Moleküler Yanıt |
|
|
|
12 aylık | % 52,1(45,9-58,3) | %33,8 (28,1-39,9) | p<0,00003* |
24 aylık | % 64,5(58,3-70,3) | %50(43,8-56,2) | - |
36 aylık | %69,1(63,1-74,7) | %56,2(49,9-62,3) | - |
48 aylık | %75,7(70–80,8) | %62,7(56,5-68,6) | - |
60 aylık | %76.4 (70.8-81.5) | %64.2% (58.1-70.1) | p=0.0021 |
Risk Oranı (% 99,99GA)(12 aylık) | |||
cCCyR'a kadar geçen süre | 1,55 (1-2,3) |
| p<0,0001* |
MMR'a kadar geçen süre | 2,01 (1,2-3,4) |
| p<0,0001* |
cCCyR süresi | 0,7 (0,4-1,4) |
| p<0,035* |
Risk Oranı (%95 GA)(24 aylık) | |||
cCCyR'a kadar geçen süre | 1,49 (1,22-1,82) |
| - |
MMR'a kadar geçen süre | 1,69 (1,34-2,12) |
| - |
cCCyR süresi | 0,77 (0,55-1,1) |
| - |
Risk Oranı (%95 GA)(36 aylık) | |||
cCCyR'a kadar geçen süre | 1,48 (1,22-1,8) |
| - |
MMR'a kadar geçen süre | 1,59 (1,28-1,99) |
| - |
cCCyR süresi | 0,77 (0,53-1,11) | - |
Risk Oranı (%95 GA)(48 aylık) | ||
cCCyR'a kadar geçen süre | 1,45 (1,2-1,77) | - |
MMR'a kadar geçen süre | 1,55 (1,26-1,91) | - |
cCCyR süresi | 0,81 (0,56-1,17) | - |
Risk Oranı (%95 GA)(60 aylık) | ||
cCCyR'a kadar geçen süre | 1.46 (1.2-1.77) | p=0.0001 |
MMR'a kadar geçen süre | 1.54 (1.25-1.89) | p<0.0001 |
cCCyR süresi | 0.79 (0.55-1.13) | p=0.1983 |
60 aylık takipten sonra, doğrulanmış CCyR ile cCCyR'ye ulaşmak için gereken medyan süre SPRYCEL grubunda 3,1 ay ve imatinib grubunda 5,8 ay olmuştur. 60 aylık takipten sonra, bir MMR olan hastalarda MMR'ye ulaşmak için gereken medyan süre SPRYCEL grubunda
9,3 ay ve imatinib gubunda 15,0 ay olmuştur. Bu sonuçlar 12, 24 ve 36. aylarda gözlenen sonuçlarla uyumludur.
MMR'ye kadar geçen süre Şekil 1'de grafik olarak gösterilmektedir. MMR'ye kadar geçen süre dasatinib ile tedavi edilen hastalarda, imatinib ile tedavi edilen hastalara kıyasla tutarlı şekilde daha kısa olmuştur.
Şekil 1. Majör moleküler yanıta (MMR) kadar geçen sürenin Kaplan-Meier kestirimi
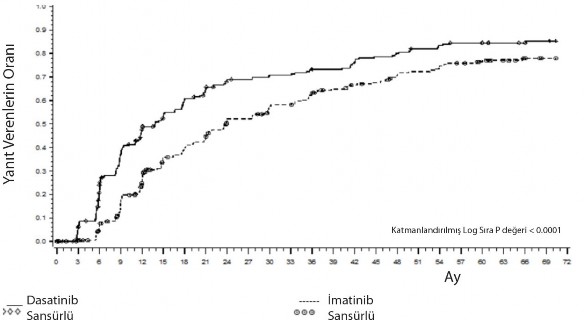
GRUP | # YANIT VERENLER / # RANDOMİZE EDİLENLER | RİSK ORANI (%95 GA) |
Dasatinib | 198/259 |
|
İmatinib | 167/260 |
|
İmatinib karşısında dasatinib |
| 1,54 (1,25 – 1,89) |
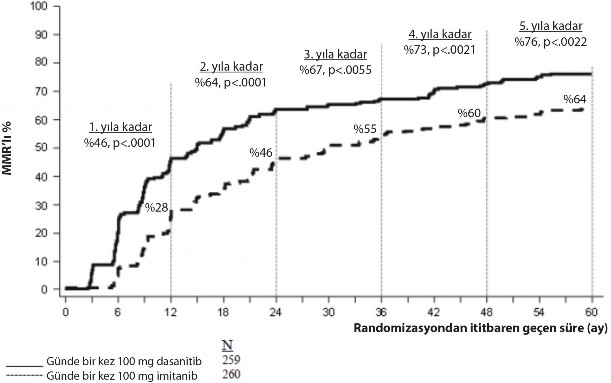
SPRYCEL ve imatinib tedavi gruplarında sırasıyla 3 ay (%54 ve %30), 6 ay (%70 ve %56), 9
ay (%75 ve %63), 24 ay (%80 ve %74), 36 ay (%83 ve %77), 48 ay (%83 ve %79) ve 60 ay (%83 ve %79) içindeki cCCyR oranları primer sonlanma noktası ile uyumluydu. SPRYCEL ve imatinib tedavi gruplarında sırasıyla 3 ay (%8 ve %0,4), 6 ay (%27 ve %8), 9 ay (%39 ve
%18), 12 ay (%46 ve %28), 24 ay (%64 ve %46), 36 ay (%67 ve %55), 48 ay (%73 ve %60)
ve 60 ay (%76 ve %64) içindeki MMR oranları da primer sonlanma noktası ile uyumluydu.
Spesifik zaman noktalarındaki MMR oranları Şekil 2'de grafik olarak gösterilmektedir. MMR oranları dasatinib ile tedavi edilen hastalarda, imatinib ile tedavi edilen hastalara kıyasla tutarlı şekilde daha yüksek olmuştur.
Şekil 2. Zaman içindeki MMR oranları – yeni kronik faz KML tanısı konmuş hastalarda yapılan faz 3 çalışmaya randomize edilen tüm hastalar
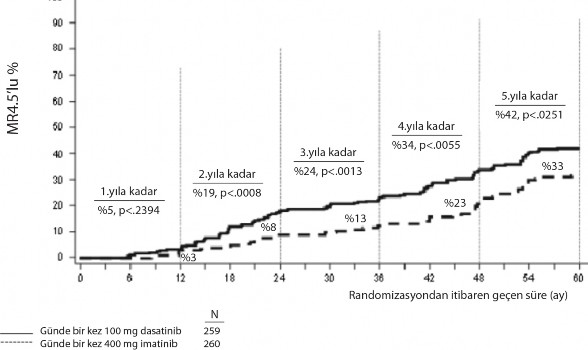
Herhangi bir zamanda BCR-ABL oranı ≤ %0,01 (4-log azalma) olan hastaların oranı SPRYCEL grubunda, imatinib grubuna kıyasla daha yüksekti (%54,1 karşısında %45). Herhangi bir zamanda BCR-ABL oranı ≤%0,0032 (4,5-log azalma) olan hastaların oranı SPRYCEL grubunda, imatinib grubuna kıyasla daha yüksekti (%44 karşısında %34).
Zaman içindeki MR 4.5 oranları Şekil 3'te grafik olarak gösterilmektedir. MR 4.5 oranları dasatinib ile tedavi edilen hastalarda, imatinib ile tedavi edilen hastalara kıyasla tutarlı şekilde daha yüksek olmuştur.
Şekil 3. Zaman içindeki MR 4,5 oranları–yeni kronik faz KML tanısı konmuş hastalarda yapılan faz 3 çalışmaya randomize edilen tüm hastalar
Hasford skoru ile belirlenen her bir risk grubunda herhangi bir zamandaki MMR oranı imatinib grubuna kıyasla SPRYCEL grubunda daha yüksekti (sırasıyla düşük risk: %90 ve
%69; orta risk: %71 ve %65; yüksek risk: %67 ve %54)
Bir ek araştırma analizinde imatinib tedavisi uygulanan hastalarla karşılaştırıldığında (%64) dasatinible tedavi uygulanan daha fazla sayıda hastada (%84) erken moleküler yanıt (3 aylık BCR-ABL seviyelerinin ï‚£ %10 olması şeklinde tanımlanmıştır) elde edildiği görülmüştür. Tablo 9'da görüldüğü gibi, erken moleküler yanıt elde edilen hastalarda transformasyon riski daha düşük, progresyonsuz sağ kalım (PFS) oranı ile genel sağ kalım (OS) oranı daha yüksekti.
Tablo 9: 3 Aylık BCR-ABL düzeyleri ï‚£%10 ve >%10 olan Dasatinib Hastaları | ||
Dasatinib N = 235 |
3 Aylık BCR-ABL Seviyeleri ≤%10 Olan Hastalar | 3 Aylık BCR-ABL Seviyeleri ABL > %10 Olan Hastalar |
Hasta Sayısı (%) | 198 (84,3) | 37 (15,7) |
60. Ayda transformasyon, n/N (%) | 6/198 (3) | 5/37 (13,5) |
60. Ayda PFS Oranı (%95 GA) | %92 (89,6, 95.2) | %73.8 (52, 86.8) |
60. Ayda OS Oranı (%95 GA) | %93.8 (89.3, 96.4%) | %80.6 (63.5, 90.2) |
Spesifik zaman noktasıyla OS oranı Şekil 4'te grafikle gösterilmektedir. Dasatinible tedavi uygulanan ve 3 ayda ≤ %10 şeklinde bir BCR-ABL düzeyine ulaşan hastalarda OS oranının ulaşmayanlara kıyasla tutarlı şekilde daha yüksek olduğu görülmüştür.
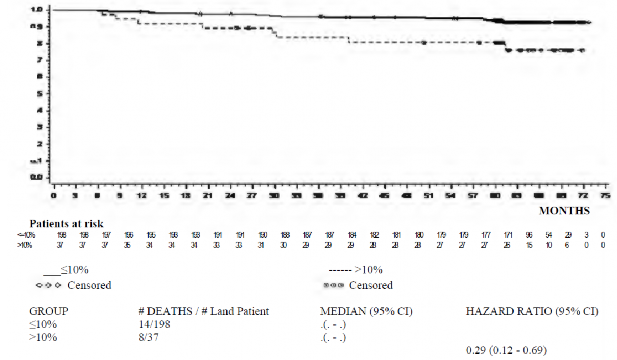
Şekil 4. Yeni kronik KML tanısı konmuş olan hastalarda yapılan bir faz 3 çalışmada 3. ayda BCR-ABL düzeyine göre (≤ %10 veya > %10) genel sağkalım için sınır noktası grafiği
Hastalık ilerlemesi uygun terapötik idareye karşın akyuvar hücrelerinde artış, CHR, kısmi CyR veya CCyR kaybı, hızlanmış evreye veya blast evresine ilerleme ya da ölüm şeklinde tanımlanmıştır. Tahmin edilen 60 aylık PFS oranı dasatinib ve imatinib tedavi grubunun her ikisi içinde % 88,9'dur (GA: %84 - %92,4). 60 ayda, akselere ya da blast faza geçiş dasatinib (n = 8; %3) ile tedavi edilen hastalarda imatinib ile tedavi edilen hastalardan (n = 15; %5.8) daha seyrek olarak gerçekleşmiştir. Dasatinib ve imatinib ile tedavi edilen vakalardaki tahminî 60 aylık sağkalım oranları sırasıyla %90,9 (GA: %86,6 - %93,8) ve %89,6 (GA: %85,2 -
%92,8) olmuştur. Dasatinib and imatinib arasında OS (Risk Oranı 1.01, %95 GA: 0.58-1.73,
p= 0.9800) ve PFS (Risk Oranı 1.00, %95 GA: 0.58-1.72, p = 0.9998) açısından herhangi bir fark tespit edilmemiştir.
Yeni kronik faz KML tanısı konmuş hastalarla yürütülen faz III çalışmasında, dasatinib veya imatinib tedavileri kesilen hastalardan alınan kan örneklerinde BCR-ABL sekansı yapılmıştır. Dasatinib alan hastalarda T315I, F317I/L ve V299L mutasyonları saptanmıştır. İmatinib grubunda farklı bir mutasyon spektrumu saptanmamıştır. In vitro verilere göre, dasatinib, T315I mutasyonuna karşı aktif görünmemektedir.
Kronik faz KML – Önceki İmatinib Tedavisine Direnç ya da İntolerans
İmatinibe dirençli ya da intoleransı olan hastalarda iki klinik çalışma yürütülmüştür; bu çalışmalardaki primer etkinlik sonlandırma kriteri Majör Sitogenetik Yanıttı (MCyR):
Çalışma 1
400 ya da 600 mg imatinib ile başlangıç tedavileri başarısız olan hastalarda açık etiketli, randomize, karşılaştırmalı olmayan çok merkezli bir çalışma yürütülmüştür. Hastalara randomize olarak (2:1) ya dasatinib (günde iki kere 70 mg) ya da imatinib (günde iki kere 400 mg) verilmiştir. Hastada doz değişikliği ile kontrol altına alınmayan hastalık progresyonu veya
intoleransa dair bir bulgu olması durumunda, alternatif tedavi koluna geçiş yapılmasına izin verilmiştir. Primer sonlanma noktası 12. haftada MCyR idi. Sonuçlar 150 hasta için mevcuttur:
101 hasta dasatinib ve 49 hasta imatinib koluna randomize edilmiştir (tümü imatinibe dirençli). Teşhisten randomizasyona kadar geçen medyan süre dasatinib grubunda 64 ay ve imatinib grubunda 52 ay olmuştur. Tüm hastalar önceden yoğun tedavi görmüştür. Genel hasta popülasyonunun %93'ü önceden imatinibe tam hematolojik yanıt (CHR) vermiştir. Sırasıyla dasatinib ve imatinib kollarındaki hastalarının %28'inde ve %29'unda önceden imatinibe MCyR görülmüştür.
Medyan tedavi süresi dasatinib için 23 ay (hastaların %44'ü günümüze dek > 24 ay tedavi edilmiştir) ve imatinib için 3 ay (hastaların %10'u günümüze dek > 24 ay tedavi edilmiştir) olmuştur.
Çapraz geçişten önce dasatinib kolundaki hastaların %93'ü ve imatinib kolundaki hastaların
%82'sinde bir CHR elde edilmiştir.
3 aylık takipte dasatinib kolunda (%36) imatinib kolundakinden (%29) daha sık MCyR görülmüştür. Dasatinib kolundaki hastaların %22'sinde tam sitogenetik yanıt (CCyR) rapor edilmiş ancak imatinib kolunda bu oran yalnızca %8 olarak bildirilmiştir. Daha uzun süreli tedavi ve takiple (medyan 24 ay), çaprazlama öncesi SPRYCEL ile tedavi edilen hastaların
%53'ü (%44'ünde CCyR), imatinib ile tedavi edilenlerin %33'ünde (%18'inde CCyR) McyR'ye ulaşılmıştır. Çalışmaya girmeden önce 400 mg imatinib almış olan hastalar arasında SPRYCEL kolunda hastaların %61'inde, imatinib kolunda hastaların %50'sinde MCyR'ye ulaşılmıştır.
Kaplan-Meier'in tahminlerine dayanarak, 1 yıl MCyR devam ettiren hastaların oranı SPRYCEL (CCyR %97, % 95 GA: [%92-%100]) için %92 (%95 GA: [%85-%100]) ve
imatinib (CCyR %100) için %74 olmuştur (95% GA: [%49-%100]). MCyR'yi 18 ay boyunca
devam ettiren hastaların oranı SPRYCEL (CCyR %94, %95 GA: [%87-%100]) için %90 (%95
GA: [%82-%98]) ve imatinib (CCyR 100%) için %74'tü (%95 GA: [%49-%100]).
Kaplan-Meier'in tahminlerine dayanarak, 1 yıl boyunca ilerleme olmadan hayatta kalan [progression-free survival (PFS)] hastaların oranı SPRYCEL için %91 (%95 GA: [%85-%97]) ve imatinib için %73 olmuştur (%95 GA: [%54-%91]). İkinci yılda PFS'ye sahip hastaların oranı SPRYCEL için %86 (%95 GA: [%78-%93]) ve imatinib için %65 (%95 GA: [%43-
%87]) olmuştur.
Dasatinib kolundaki hastaların toplam %43'ünün ve imatinib kolundakilerin %82'sinin tedavileri başarısız olmuştur; yani; ya hastalıkları ilerlemiştir ya da diğer tedaviye çapraz geçiş yapmışlardır (yanıt alınmadığı, çalışma ilacı tolere edilmediği için vs.)
Çapraz geçiş öncesi majör moleküler yanıt oranları (periferik kan örneklerinde BCR- ABL/kontrol transkriplerinin RQ-PCR ile <% 0,1 olması ile tanımlanır) dasatinib için %29 ve imatinib için %12 olmuştur.
Çalışma 2
İmatinibe intolerans veya direnç geliştiren (yani, imatinib tedavisi sırasında tedaviye devam etmeyi olanaksız hale getiren önemli toksisite geliştiren hastalar) hastalarda açık etiketli, tek kollu, çok merkezli bir çalışma yürütülmüştür.
Toplam 387 hasta (288'i direnç, 99'u intolerans) günde iki kere 70 mg dasatinib almıştır. Teşhisten tedavinin başlangıcına kadar medyan süre 61 ay idi. Hastaların çoğunluğu (% 53) 3 yıldan fazla bir süre önce imatinib tedavisi gördü. Direnç geliştiren hastaların çoğu (%72)
>600 mg imatinib almıştı. Imatinibe ilaveten, hastaların %35'i daha önce sitotoksik kemoterapi görmüştü, % 65'i daha önce interferon almıştı ve % 10'una önceden kök hücre transplantasyonu yapılmıştı. Başlangıçta hastaların % 38'inin imatinib direncini oluşturan mutasyonları vardı. SPRYCEL tedavisinin medyan süresi 24 ay olmuş, hastaların %51'i bugüne kadar > 24 ay tedavi edilmiştir. Majör sitogenetik yanıt (MCyR) imatinibe dirençli hastaların %55'inde, imatinib intolerans hastaların %82'sinde gelişmiştir.
Minimum 24 ay takip süresinde önceden MCyR gösteren 240 hastanın 21'inde ilerleme olmuş ve medyan MCyR süresine ulaşılmamıştır.
Kaplan-Meier'in tahminlerine dayanarak, hastaların %95'i (%95 GA: [%92-%98]) MCyR'yi 1 yıl boyunca ve %88'i (%95 GA: [%83-%93]) 2 yıl boyunca sürdürmüşlerdir. CCyR'yi 1 yıl boyunca sürdüren hastaların oranı %97 (%95 GA: [%94-%99]) ve 2 yıl sürdüren hastaların
%90 (%95 GA: [%86-%95]) olmuştur. Daha önce imatinibe karşı hiç MCyR'ye sahip olmayan imatinib dirençli hastaların (n= 188) % 42'si dasatinib ile MCyR'ye ulaşmıştır.
Bu çalışmaya kaydedilen hastaların %38'inde 45 farklı BCR-ABL mutasyonu mevcuttu. T315I hariç olmak üzere imatinib direnci ile ilişkili çeşitli BCR-ABL mutasyonları bulunan hastalarda tam hematolojik yanıt veya MCyR elde edilmiştir. İkinci yılda MCyR oranları, hastalara başlangıç BCR-ABL mutasyonu, P-loop mutasyonu olmasına veya herhangi bir mutasyon bulunmamasına bağlı olmaksızın benzerdi (sırasıyla %63, %61 ve %62).
İmatinibe dirençli hastalar arasında tahmin edilen PFS oranı 1 yılda %88 (%95 GA: [%84-
%92]) ve 2 yılda %75'ti (%95 GA: [%69-%81]). İmatinibi tolere edemeyen hastalar arasında
tahmin edilen PFS oranı 1 yılda %98 (%95 GA: [%95-%100]) ve 2 yılda %94 (%95 GA:
[%88-%99]) olmuştur.
24. ayda majör moleküler yanıt oranı %45 idi (imatinibe dirençli hastalar için %35 ve imatinibi tolere edemeyen hastalar için %74).
Akselere Faz KML
İmatinibe dirençli veya intoleran olan hastalarda açık etiketli, tek kollu, çok merkezli bir çalışma yapılmıştır. Toplam 174 hasta (imatinib dirençli: 161, intoleranslı: 13) günde iki kere
70 mg dasatinib almıştır. Teşhisten tedavi başlangıcına kadar geçen medyan süre 82 ay olmuştur. SPRYCEL tedavisinin medyan süresi 14 ay olmuş, hastaların %31'i bugüne kadar > 24 ay tedavi edilmiştir. 24 ayda majör moleküler yanıt oranı %46'dır (Tam sitogenetik yanıtı (CCyR) olan 41 hastada değerlendirilmiştir).
Myeloid Blastik Faz KML
İmatinibe intoleransı veya direnci olan hastalarda açık etiketli, tek kollu, çok merkezli bir çalışma yapılmıştır. Toplam 109 hasta (imatinib direnci: 99, intoleransı: 10) günde iki kere 70 mg dasatinib almıştır. Teşhisten tedavi başlangıcına kadar geçen medyan süre 48 ay olmuştur. SPRYCEL tedavisinin medyan süresi 3,5 ay olmuş, hastaların %12'ü bugüne kadar > 24 ay tedavi edilmiştir. 24 ayda majör moleküler yanıt oranı %68'dir (Tam sitogenetik yanıtı (CCyR) olan 19 hastada değerlendirilmiştir. İlave etkililik bulguları Tablo 10'da bildirilmiştir.
Lenfoid Blastik Faz KML ve Ph+ ALL
Daha önceki imatinib tedavisine direnç veya intolerans geliştiren lenfoid blastik faz KML veya Ph+ ALL hastalarında açık etiketli, tek kollu, çok merkezli bir çalışma yapılmıştır. Toplam 48 lenfoid blastik KML hastası (imatinib dirençli: 42, intoleranslı: 6) günde iki kere
70 mg dasatinib almıştır. Teşhisten tedavi başlangıcına kadar medyan 28 ay geçmiştir.
SPRYCEL tedavisinin medyan süresi 3 ay olmuş, bugüne kadar tedavisi > 24 ay süren hasta oranı %2 olmuştur. 24 ayda majör moleküler yanıt oranı %50'dir (Tam sitogenetik yanıtı (CCyR) olan 22 hastada). Ayrıca 46 Ph+ ALL hastası da günde iki kere 70 mg dasatinib almıştır (imatinibe dirençli: 44, intoleranslı: 2). Teşhisten tedavi başlangıcına kadar medyan 18 ay geçmiştir. SPRYCEL tedavisinin medyan süresi 3 ay olup bugüne kadar > 24 ay tedavi edilen hasta oranı %7 olmuştur. 24 ayda majör moleküler yanıt oranı %52'dir (Tam sitogenik yanıtı (CCyR) olan 25 hastada). Majör hematolojik yanıtların (MaHR) çabuk elde edilmiş olması dikkate değerdir (lenfoid blastik KML hastalarında ilk dasatinib uygulamasından itibaren 35 gün, Ph+ ALL hastalarında ise 55 gün içinde).
Tablo 10: Faz II SPRYCEL tek kollu klinik çalışmalarında etkililik
| |||||
|
|
|
|
| |
SPRYCEL'den sonra kemik iliği transplantı yapılan hastaların sonuçları tam olarak değerlendirilmemiştir.
İmatinibe dirençli veya intoleran olan kronik, akselere ya da myeloid blast faz KML ve Ph+ALL hastalarında Faz III Klinik Çalışmalar
Günde bir kere uygulanan SPRYCEL ile günde iki kere uygulanan SPRYCEL'in etkinliğini değerlendirmek üzere randomize, açık-etiketli iki çalışma yürütülmüştür: Aşağıdaki sonuçlar dasatinib tedavisine başladıktan sonra minimum 2 yıllık ve 7 yıllık takiplere dayanmaktadır.
Çalışma 1
Kronik faz KML çalışmasında, primer sonlandırma kriteri imatinibe dirençli hastalarda MCyR'tır. Başlıca sekonder sonlandırma kriteri imatinibe dirençli hastalarda toplam günlük dozda MCyR'tır. Diğer ikincil son noktalar, MCyR, PFS ve genel hayatta kalma süresini içermiştir. 497'i imatinibe dirençli olan toplam 670 hasta günde bir kere 100 mg, günde bir
kere 140 mg, günde iki kere 50 mg ya da günde iki kere 70 mg SPRYCEL grubuna randomize edilmiştir. En az 5 yıllık takip süresi olan (n=205) halen tedavi görmekte olan tüm hastalar için medyan tedavi süresi 59 aydı (28 – 66 ay aralığında). Tüm hastalar için 7 yıllık takipte medyan tedavi süresi 29,8 ay olmuştur (aralık <1-92.9 ay).
Tüm SPRYCEL tedavi gruplarında etkinlik elde edilmiştir ve primer sonlanım noktasında günde tek doz uygulaması günde iki kere uygulamaya göre (MCyR farkı %1,9; %95 güven aralığı [-%6,8 - %10,6]) kıyaslanabilir bir etkinlik (daha az olmayan) göstermiştir. Ancak, günde bir kez 100 mg'lık rejimde güvenlilik ve tolerabilitede artış gözlenmiştir. Etkililik sonuçları Tablo 11 ve 12'de açıklanmaktadır.
Tablo 11: Faz III Doz Optimizasyon Çalışmasında SPRYCEL'in Etkinliği: İmatinibe Dirençli veya İntolerant Kronik Faz KML (2 yıllık sonuçlar)
Tüm Hastalar |
n=167 |
| |
Imitanibe dirençli hastalar | n=124 |
Hematolojik Yanıt Oranı (%95 GA) |
|
CHR | %92 (86-95) |
Sitogenetik Yanıt (%) (%95 GA) |
|
MCyR |
|
Tüm hastalar | %63 (56-71) |
Imatinibe Dirençli Hastalar | %59 (50-68) |
CCyR |
|
Bütün hastalar | %50 (42-58) |
Imatinibe Dirençli Hastalar | %44 (35-53) |
CCyR Elde Edilen Hastalarda Majör Moleküler Yanıt (%) (%95 GA)
![]()
Bütün Hastalar %69 (58-79)
İmatinibe Dirençli Hastalar %72 (58-83)
![]()
c
Tablo 12: SPRYCEL'in Faz III Doz Optimizasyonu Çalışmasındaki Uzun Dönemli Etkinliği: İmatinibe Dirençli veya İntolerant Kronik Faz KML Hastaları | ||||
Minimum Takip Süresi | ||||
| 1 yıl | 2 yıl | 5 yıl | 7 yıl |
Majör Moleküler Yanıt |
|
|
|
|
Tüm hastalar | Geçerli değil | % 37 (57/154) | % 44 (71/160) | % 46 (73/160) |
Imatinibe dirençli hastalar | Geçerli değil | % 35 (41/117) | % 42 (50/120) | % 43 (51/120) |
Imatinibe intoleran hastalar | Geçerli değil | % 43 (16/37) | % 53 (21/40) | % 55 (22/40) |
Progresyonsuz Sağkalım (PFS) | ||||
Tüm hastalar | % 90 (86, 95) | % 80 (73, 87) | % 51 (41, 60) | % 42 (33, 51) |
Imatinibe dirençli hastalar | % 88 (82, 94) | % 77 (68, 85) | % 49 (39, 59) | % 39 (29, 49) |
Imatinibe intoleran hastalar | % 97 (92, 100) | % 87 (76, 99) | % 56 (37, 76) | % 51(32, 67) |
Genel Sağkalım |
|
|
|
|
Tüm hastalar | % 96 (93, 99) | % 91 (86, 96) | % 78 (72, 85) | % 65 (56, 72) |
Imatinibe dirençli hastalar | % 94 (90, 98) | % 89 (84, 95) | % 77 (69, 85) | % 63 (53, 71) |
Imatinibe intoleran hastalar | % 100 (100, 100) | % 95 (88, 100) | % 82 (70, 94) | %70 (52, 82) |
Kaplan-Meier tahminlerine dayanarak, günde bir defa dasatinib 100 mg ile tedavi edilen ve 18 ay süreyle MCyR yanıtını koruyan hastaların oranı %93 idi (%95 GA: [88%-98%]).
İmatinibi tolere edemeyen hastalarda etkililik de değerlendirilmiştir. Günde bir defa 100 mg dozu alan bu hasta popülasyonunda, MCyR elde edilen hasta oranı %77 ve CCyR oranı %67 olmuştur.
Çalışma 2
İleri faz KML ve Ph+ ALL çalışmasının primer sonlandırma kriteri MaHR'tı. Toplam 611 hasta ya günde bir kere 140 mg ya da günde iki kere 70 mg SPRYCEL grubuna randomize edilmişti. Medyan tedavi süresi yaklaşık 6 aydı (aralık 0,03-31 ay).
Primer etkinlik sonlanım kriterine göre, günde bir kere uygulaması, günde iki kere uygulaması ile karşılaştırılabilir (daha az olmayan) bir etkinlik göstermiştir (MaHR farkı %0,8; %95 güven aralığı [-%7,1-%8,7]), ancak, günde bir kez 140 mg rejimi iyileşmiş güvenlilik ve tolerabilite göstermiştir. Yanıt oranları Tablo 13'te belirtilmektedir.
Tablo 13:SPRYCEL'in Faz III Doz Optimizasyonu Çalışmasındaki Etkinliği: İleri Faz KML ve
Ph+ ALL (2 yıllık sonuçlar)
| Akselere (n= 158) | Miyeloid Blast (n= 75) | Lenfoid Blast (n= 33) | Ph+ALL (n= 40) |
MaHY (%95 GA) | %66 (59-74) | %28 (18-40) | %42 (26-61) | %38 (23-54) |
THY (%95 GA) | %47 (40-56) | %17 (10-28) | %21 (9-39) | %33 (19-49) |
NEL (%95 GA) | %19 (13-26) | %11 (5-20) | %21 (9-39) | %5 (1-17) |
MSY (%95 GA) | %39 (31-47) | %28 (18-40) | %52 (34-69) | %70 (54-83) |
TSY (%95 GA) | %32 (25-40) | %17 (10-28) | %39 (23-58) | %50 (34-66) |
Günde bir defa 140 mg rejimi ile tedavi uygulanan hızlanmış faz CML hastalarında medyan MaHR süresi ve medyan genel sağkalıma ulaşılmamıştır ve medyan PFS'nin 25 ay olduğu tespit edilmiştir.
Günde bir defa 140 mg rejimi ile tedavi uygulanan miyeloid blast fazı CML hastalarında medyan MaHR süresinin 8 ay, medyan PFS'nin 4 ay, medyan genel sağkalımın ise 8 ay olduğu tespit edilmiştir. Günde bir defa 140 mg rejimi ile tedavi uygulanan lenfoid blast fazı CML hastalarında medyan MaHR süresinin 5 ay, medyan PFS'nin 5 ay, medyan genel sağkalımın ise 11 ay olduğu tespit edilmiştir.
Günde bir defa 140 mg rejimi ile tedavi uygulanan Ph+ ALL hastalarında medyan MaHR süresinin 5 ay, medyan PFS'nin 4 ay, medyan genel sağkalımın ise 7 ay olduğu tespit edilmiştir.
Pediyatrik popülasyon
Pediyatrik KML hastaları
İki pediyatrik çalışmada tedavi edilen kronik faz KML'li 130 pediyatrik hastada (biri Faz I, açık etiketli, randomize olmayan doz aralığı bulma çalışması ve diğeri Faz II, açık etiketli, randomize olmayan çalışma), 84 hasta (sadece Faz II çalışmadan kaydedilen) yeni tanı konan kronik faz KML ve 46 hasta (17 hasta Faz I çalışmadan ve 29 hasta Faz II çalışmadan kaydedilmiştir) imatinib ile önceki tedaviye dirençliydi veya bu tedaviyi tolere edememiştir. Kronik faz KML'li 130 pediyatrik hastanın 97'si günde bir kez SPRYCEL tablet 60 mg/mile tedavi edilmemiştir (yüksek BSA'lı hastalar için günde bir defa 100 mg'lık maksimum doz). Hastalar hastalık progresyonuna veya kabul edilemez toksisiteye kadar tedavi edilmiştir.
Kilit etkililik sonlanma noktaları şöyleydi: tam sitogenetik yanıt (CCyR), majör sitogenetik yanıt (MCyR) ve majör moleküler yanıt (MMR). Sonuçlar Tablo 14'te gösterilmektedir.
Tablo 14: SPRYCEL'in kronik faz KML'li pediyatrik hastalarda etkililiği – Minimum
takip döneminde zaman içinde kümülatif yanıt
| 3 ay | 6 ay | 12 ay | 24 ay |
CCyR (%95 GA) |
|
|
|
|
Yeni tanı konan (N = 51) | %43,1, (29,3, 57,8) | %66,7 (52,1, 79,2) | %96,1 (86,5, 99,5) | %96,1 (86,5, 99,5) |
Önceki imatinib (N = 46) | %45,7 (30,9, 61) | %71,7 (56,5, 84) | % 78,3 (63,6, 89,1) | %82,6 (68,6, 92,2) |
MCyR (%95 GA) |
|
|
|
|
Yeni tanı konan (N = 51) | %60,8 (46,1, 74,2) | %90,2 (78,6, 96,7) | %98 (89,6, 100) | %98 (89,6, 100) |
Önceki imatinib (N = 46) | %60,9 (45,4, 74,9) | %82,6 (68,6, 92,2) | %89,1 (76,4, 96,4) | %89,1 (76,4, 96,4) |
MMR (%95 GA) |
|
|
|
|
Yeni tanı konan (N = 51) | %7,8 (2,2, 18,9) | %31,4 (19,1, 45,9) | %56,9 (42,2, 70,7) | %74,5 (60,4, 85,7) |
Önceki imatinib (N = 46) | %15,2 (6,3, 28,9) | %26,1 (14,3, 41,1) | %39,1 (25,1, 54,6) | %52,2 (36,9, 67,1) |
Faz I pediyatrik çalışmada, imatinibe dirençli veya tolere edemeyen kronik faz KML'li hastalar arasında en az 7 yıllık takipten sonra, medyan PFS süresi 53,6 ay ve OS oranı %82,4 idi.
Faz II pediyatrik çalışmada, tablet formülasyonu alan hastalarda yeni tanı alan kronik faz KML'li 51 hasta arasında tahmini 24 aylık PFS oranı %94 iken (82,6, 98) imatinibe
dirençli/tolere edemeyen kronik faz KML'li 29 hastada bu oranı %81,7 (61,4, 92) bulunmuştur. 24 aylık takipten sonra, yeni tanı konan hastalarda OS %100 ve imatinibe dirençli/tolere edemeyen hastalara %96,6 idi.
Faz II pediyatrik çalışmada, yeni tanı konan 1 hastada ve imatinibe dirençli/tolere edemeyen 2 hastada hastalık blastik faz KML'ye ilerlemiştir.
SPRYCEL oral süspansiyon hazırlamaya yönelik toz formülasyonu alan (72 mg/m dozunda) 33 yeni tanı konmuş kronik faz KML'li pediyatrik hasta mevcuttu. Bu doz önerilen doza kıyasla %30 daha düşük maruziyeti temsil etmektedir. Bu hastalarda, CCyR ve MMR 12. ayda CCyR: %87,9 [%95 GA: (71,8-96,6)] ve MMR: %45,5 [%95 GA: (28,1-63,6)] olarak
bulunmuştur.
Daha önce imatinib almış olan dasatinib ile tedavi edilen kronik faz KML hastaları arasında, tedavi sonunda şu mutasyonlar tespit edilmiştir: T315A, E255K ve F317L. Ancak, tedaviden
önce E255K ve F317L de tespit edilmiştir. Tedavi sonunda yeni tanı konan kronik faz KML hastalarında herhangi bir mutasyon tespit edilmemiştir.
ALL'li pediyatrik hastalar
SPRYCEL'in kemoterapi ile kombinasyon halinde etkililiği, yeni tanı konan Ph+ ALL'li bir yaşın üzerindeki hastalarda yapılan bir pivot çalışmada değerlendirilmiştir.
Bu çok merkezli, tarihsel olarak kontrollü, standart kemoterapiye eklenen dasatinib ile yapılan Faz II çalışmada, 104'ü doğrulamış Ph+ ALL'ye sahip yeni tanı konmuş Ph+ ALL'li 106 pediyatrik hasta, kemoterapi ile kombinasyon halinde 24 aya varan sürekli doz rejimi ile günlük 60 mg/m'lik doz almıştır. Hastaların 82'si sadece dasatinib tablet alırken 24 hasta en az bir kez dasatinib oral süspansiyon hazırlamak için toz formülasyonunu almıştır (bunların 8'i sadece dasatinib oral süspansiyon hazırlamak için toz formülasyonunu almıştır). Arka plandaki kemoterapi rejimi AIEOP-BFM ALL 2000 çalışmasında kullanılanla aynıydı (kemoterapötik standart çok ajanlı kemoterapi protokolü). Primer etkililik sonlanma noktası 3 yıllık olaysız sağkalım olup (EFS), %65,5 olarak bulunmuştur (55,5, 73,7).
Ig/TCR tekrar düzenlemesi ile değerlendirilen minimum rezidüel hastalık (MRD) negativite oranı, konsolidasyon sonunda tedavi edilen tüm hastalarda %71,7 idi. Bu oran değerlendirilebilir Ig/TCR değerlendirmeleri olan 85 hastaya dayandırıldığında, oran %89,4 idi. İndüksiyon ve konsolidasyon sonunda akış sitometrisi ile ölçülen şekilde MRD negativite oranları sırasıyla %66 ve %84 idi.
5.2. Farmakokinetik özellikler
Genel ÖzelliklerDasatinibin farmakokinetiği 229 yetişkin sağlıklı gönüllülerde ve 84 hastada değerlendirilmiştir.
Emilim:
Oral uygulamayı takiben hastalar dasatinibi hızla absorbe ederler, pik konsantrasyonlar 0,5-3 saatte görülür. Oral uygulamayı takiben, ortalama maruziyette ki artış (EAA) günde iki kere 25 mg - 120 mg aralığındaki dozlarda doz artışıyla yaklaşık olarak orantılıdır. Dasatinibin genel ortalama terminal yarılanma ömrü hastalarda yaklaşık 5-6 saattir.
Çok yağlı bir yemekten 30 dakika sonra 100 mg'lık tek bir dasatinib dozu uygulanan sağlıklı gönüllülerde alınan veriler dasatinibin ortalama EAA'ında %14 artış göstermiştir.
Dasatinibden 30 dakika önce yenilen az yağlı bir yemek dasatinibin ortalama EAA'ını %21 arttırmıştır. Gıdaların gözlenen etkileri ilaç alımında klinik açıdan önem taşıyan değişikliklere yol açmamıştır. Dasatinib maruziyetinde görülen değişkenlik, az yağlı (%39 CV) ve çok yağlı yemeğe (%32 CV) kıyasla açlık koşullarında daha yüksektir (%47 CV).
Hasta popülasyonu FK analizine göre, dasatinib maruziyetinde görülen değişkenliğin temelde durumlar arası biyoyararlanım değişkenliğinden (%44 CV) ve daha düşük ölçüde bireyler arası biyoyararlanım değişkenliğinden ve bireyler arası klirens değişkenliklerinden (sırasıyla, %30 ve %32) kaynaklandığı tahmin edilmiştir. Maruziyetteki durumlar arası rastgele değişkenliğin kümülatif maruziyeti ve etkililik veya güvenliliği etkilemesi beklenmemektedir.
Dağılım:
Hastalarda dasatinibin görünür dağılım hacmi yüksek olup (2,505 L), varyasyon katsayısı (%CV %93) tıbbi ürünün ekstravasküler yerde yaygın olarak dağıldığını gösterir. In vitro
deneyimlere göre, dasatinib klinik olarak önemli konsantrasyonlarda plazma proteinlerine yaklaşık %96 oranında bağlanmaktadır.
Biyotransformasyon:
Dasatinib insanlarda, metabolitlerin oluşumunda görev alan multipl enzimler ile yaygın olarak metabolize edilir. 100 mg [C] işaretli dasatinib uygulanan sağlıklı gönüllülerde plazmada dolaşan radyoaktivitenin %29'u değişmemiş dasatinib olarak bulunmuştur. Plazma konsantrasyonu ve ölçülen in vitro aktivite dasatinibin metabolitlerinin ürünün gözlenen farmakolojisinde majör bir rol oynama olasılıklarının düşük olduğunu göstermektedir. CYP3A4 dasatinibin metabolizmasından sorumlu majör enzimdir.
Eliminasyon:
Dasatinib'in ortalama terminal yarı ömrü 3 ila 5 saattir. Ortalama belirgin oral klirens 363,8
L/saattir (%CV %81,3).
Eliminasyon başlıca feçeste, çoğunlukla metabolitler halinde gerçekleşir. Tek doz [C] işaretli dasatinib verilmesini takiben, dozun yaklaşık %89'u 10 gün içinde atılmış, radyoaktivitenin
%4'ü idrarda ve %85'i feçeste bulunmuştur. İdrardaki ve feçesteki değişmemiş dasatinib oranları sırasıyla dozun %0,1'i ve %19'u olmuş, dozun kalanı ise metabolit olmuştur.
Doğrusallık/Doğrusal olmayan durumlar:
Yeterli veri mevcut değildir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği: SPRYCEL ile böbrek fonksiyonları azalmış olan hastalarda herhangi bir klinik çalışma yapılmamıştır (serum kreatinin konsantrasyonu normal aralığın üst sınırının >1,5 katı olan hastalar çalışmalara alınmamıştır). Dasatinibin ve metabolitlerinin böbrek klerensi < %4 olduğu için, böbrek yetmezliği olan hastalarda total vücut klerensinde bir azalma beklenmez.
Dasatinib ve metabolitleri böbreklerden minimal düzeyde atılmaktadır.
Karaciğer yetmezliği:
Karaciğer yetmezliğinin dasatinibin tek-doz farmakokinetiği üzerine etkileri, 50 mg uygulanan orta düzeyde karaciğer yetmezliği olan 8 hastada ve 20 mg uygulanan şiddetli karaciğer yetmezliği olan 5 hastada, 70 mg uygulanan eşleştirilmiş sağlıklı gönüllülerle
karşılaştırılarak değerlendirilmişir. Orta düzeyde karaciğer yetmezliği olan hastalar normal karaciğer fonksiyonu olanlarla karşılaştırıldığında dasatinibin 70 mg doza göre ayarlanmış ortalama Cve EAA değerleri sırasıyla %47 ve %8 oranında azalmıştır. Şiddetli karaciğer yetmezliği olan hastalar normal karaciğer fonksiyonu olan gönüllüler ile karşılaştırıldığında dasatinibin 70 mg doza göre ayarlanmış ortalama Cve EAA değerleri sırasıyla %43 ve
%28 oranında azalmıştır. (Bkz Bölüm 4.2 ve 4.4)
Pediyatrik popülasyon
Dasatinib farmakokinetiği lösemi veya solid tümörleri olan 104 pediyatrik hastada değerlendirilmiştir (tablet formülasyonu alan 72 ve oral süspansiyon hazırlamak için toz formülasyonu alan 32).
Yapılan bir pediyatrik farmakokinetik çalışmada, doza göre normalize edilen dasatinib maruziyeti (C, Cve C) kronik faz KML'li 21 hasta ve Ph+ ALL'li 16 hasta arasında benzer olmuştur.
Dasatinib tablet formülasyonunun farmakokinetiği, tekrarlayan veya dirençli lösemili veya solid tümörleri olan 72 pediyatrik hastada günde bir defa 60 ila 120 mg/m ve günde iki defa 50 ila 110 mg/m arasında değişen oral dozlarda değerlendirilmiştir. Veriler iki çalışmada birleştirilmiştir ve dasatinib'in hızla emildiğini göstermiştir. Ortalama T0,5 ve 6 saat arasında gözlenirken ortalama yarı ömür tüm doz ve yaş gruplarında 2 ila 5 saat arasında bulunmuştur. Dasatinibin FK profili, pediyatrik hastalarda maruziyette dozla ilişkili artışla birlikte dozla orantılı olmuştur. Çocuklar ve adölesanlar arasında dasatinib FK profili açısından anlamlı bir fark görülmemiştir. Doza göre normalleştirilmiş dasatinib C, EAA (0-T) ve EAA (INF) parametrelerine ait geometrik ortalamaların farklı doz düzeylerinde çocuklar ve adölesanlar arasında benzer olduğu bulunmuştur. Bir PFK modele dayalı simülasyon, bölüm 4.2'de tablet için önerilen vücut ağırlığına dayalı dozlamın, 60 mg/m tablet formülasyonu ile benzer bir maruziyet sağlayacağını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Dasatinibin klinik olmayan güvenlilik profili bir dizi ve farelerde, sıçanlarda, maymunlarda ve tavşanlarda yapılan in vivo ve in vitro çalışmada değerlendirilmiştir.
Primer toksisiteler gastrointestinal, hematopoietik ve lenfoid sistemlerde ortaya çıkmıştır. Bağırsak daima hedeflenen bir organ olduğu için, sıçanlarda ve maymunlarda gastrointestinal toksisite dozu sınırlamıştır. Sıçanlarda eritrosit parametrelerindeki minimal ve hafif düşüşlere kemik iliğindeki değişiklikler eşlik etmiştir; maymunlarda benzer değişiklikler daha düşük bir insidans ile görülmüştür. Sıçanlarda lenfoid toksisite lenf nodüllerinde, dalakta ve timusta lenfoid azalması ve lenfoid organların ağırlıklarında düşüşler ile kendini göstermiştir. Tedavinin kesilmesini takiben gastrointestinal, hematopoetik ve lenfoid sistemlerdeki değişiklikler geri dönüşümlü olmuştur.
9 aya kadar tedavi edilen maymunlarda arka plan böbrek mineralizasyonunda artış ile sınırlı böbrek değişiklikleri gözlenmiştir. Maymunlarda ≥ 15 mg/kg akut tek dozun uygulandığı bir oral çalışmada kütanöz hemoraji gözlenmiş, fakat ne maymunlarda ne de sıçanlarda tekrarlanan dozların uygulandığı çalışmalarda görülmemiştir. Sıçanlarda dasatinib trombosit agregasyonunu in vitro olarak inhibe etmiş ve tırnak eti kanamasını in vivo olarak uzatmıştır. Ancak spontan kanama görülmemiştir.
hERG ve Purkinje lif tayinleri; in vitro dasatinib aktivitesinin kardiyak ventriküler repolarizasyonu (QT aralığı) uzatma potansiyeli olabileceğini göstermiştir. Ancak bilinci açık maymunlarda ölçümlenen bir in vivo tek doz çalışmasında QT aralığında veya EKG dalgası formunda bir değişiklik görülmemiştir.
Dasatinib in vitro bakteri hücresi tayinlerinde (Ames testi) mutajenik ve bir in vivo sıçan mikronükleus çalışmasında genotoksik bulunmamıştır. Bölünmekte olan Çin hamsteri over hücrelerinde in vitro klastojenik etki göstermiştir.
Sıçan fertilitesi ve erken embriyonik gelişimle ilgili konvansiyonel bir çalışmada dasatinib erkek veya dişilerin fertilitesini etkilememiştir ancak insanlardaki klinikte kullanılan doz seviyelerinde embriyoletaliteyi indüklemiştir. Embriyofetal gelişim çalışmalarında dasatinib benzer şekilde, sıçanlarda yavruların boylarındaki düşüş ve hem sıçanlarda hem de tavşanlarda fetüsün iskeletinde farklılıklar ile birlikte olan embriyoletaliteyi indüklemiştir. Bu etkiler maternel toksisiteye yol açmayan dozlarda ortaya çıkmıştır; bu da dasatinibin implantasyondan organojenezin tamamlanmasına kadar geçen sürede selektif reprodüktif toksik madde olduğunu göstermektedir.
Farelerde dasatinib doza bağlı olan ve doz azaltılarak ve/veya dozaj planı değiştirilerek etkinlikle tedavi edilen immunosupresyonu indüklemiştir. Dasatinib fare fibroblastlarında yürütülen bir in vitro nötral kırmızı uptake fototoksisite tayininde fototoksik potansiyel göstermiştir. Dasatinibin dişi tüysüz farelere tek dozluk oral uygulama sonrası önerilen standard terapötik doz ile insan maruziyetinin 3 katına kadarki maruziyette (EAA'ya göre) in vivo olarak non-fototoksik olarak değerlendirilmiştir.
İki yıllık bir karsinojenisite çalışmasında, sıçanlara günlük 0,3, 1 ve 3 mg/kg dozlarında oral dasatinib uygulanmıştır. En yüksek doz genellikle günlük 100 mg ila 140 mg arasında değişen önerilen başlangıç dozunda insanlarda gözlenen maruziyetle eşdeğer bir plazma maruziyet (EAA) düzeyi ile sonuçlanmıştır. Yüksek doz uygulanan dişilerde uterus ve rahimde skuamöz hücreli karsinomalar ve papillomaların birleşik insidansında ve düşük doz uygulanan erkeklerde prostat adenomalarının insidansında istatistiksel olarak anlamlı bir artış kaydedilmiştir. Sıçanlarda karsinojenisite çalışmalarından elde edilen bu bulguların insanlar için önemi bilinmemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet çekirdeği:
Laktoz monohidrat (inek sütü kaynaklı) Mikrokristalin selüloz
Kroskarmelos sodyum Hidroksipropil sellüloz Magnezyum stearat
Film kaplama:
Hipromelloz Titanyum dioksit Makrogol 400
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30C'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
60 film kaplı tablet içeren çocukların açamayacağı polipropilen kapaklı yüksek dansiteli polietilen (HDPE) şişe.
Her kartonda bir şişe vardır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
SPRYCEL tablet sağlık profesyonellerinin aktif ilaç maddesine maruz kalmalarını engelleyecek bir film kaplama ile çevrili bir çekirdek tabletten oluşur. Ancak, eğer tabletler ezilir veya kırılırsa, sağlık profesyonelleri tek kullanımlık kemoterapi eldivenleri giymelidirler.
Kullanılmamış olan ürünler ya da atık materyaller ‘Tıbbi Atıkların Kontrol Yönetmeliği' ve ‘Ambalaj Atıklarının Kontrolü Yönetmelik'lerine uygun olarak imha edilmelidir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| DASAVEC | 8699828091516 | 18,118.01TL |
| DASIKAM | 8699638095780 | 28,119.61TL |
| MYLORGE | 8699514012757 | 28,119.61TL |
| SPRYCEL | 8699726094404 | 36,113.92TL |
| SPRYTINIB | 8699769090173 | 28,119.61TL |
| Diğer Eşdeğer İlaçlar |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |