SULGEN 30000 TU/ml DILALTI sprey çözelti (AKARLAR) Kısa Ürün Bilgisi
{ Dermatophagoides Pteronyssinus (avrupa Ev Tozu Akari) / Dermatophagoides Farinae (amerika Ev Tozu Akari) }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SULGEN® 30000 TU/ml dilaltı sprey, çözelti (Betula)
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir 9 mL'lik çözelti içeren şişe:
Betula verrucosa (Avrupa beyaz huş ağacı) polenlerinden elde edilen yüksek oranda saflaştırılmış sulu alerjen ekstraktı içerir. Tam içerik hakkında bilgi edinmek için şişelerin ve paketin üzerindeki etikete bakınız.
Standardizasyon TU/mL (TU=Terapötik Ünite/Birim) birimindedir. 1 mL 30000 TU içermektedir. Tek püskürtme 0,1 mL 3000 TU içerir. Seriden seriye üniform biyolojik aktivite, üretim prosesi tarafından garanti edilmiştir.
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Dilaltı sprey, çözelti.
SULGEN® renksiz çözelti şeklindedir. Alerjen ekstraktlarının doğal renkleri sebebiyle çözelti rengi bir miktar değişebilir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
SULGEN®, eşlik eden astım olmadan veya güncel GINA (Global Initiative for Asthma-Astım için Küresel Girişim) kılavuzuna göre kontrollü bronşiyal astımla beraber görülebilen alerjik rinit (saman nezlesi) ve gözün konjonktiva tabakasının alerji kaynaklı inflamasyonu (alerjik konjonktivit) gibi önlenemeyen alerjenler tarafından tetiklenen IgE aracılı alerjik hastalıkları tedavi etmek için kullanılır.
SULGEN® ile spesifik immünoterapiye başlamadan önce detaylı bir alergolojik anamnez ve tanı önerilir.
4.2. Pozoloji ve uygulama şekli
Aşağıda belirtilen doz örneği bir referans bilgidir ve kişiye özel tedavi seyrine uyarlanmak zorundadır.
Hastanın duyarlılık derecesi, hastanın tıbbi öyküsü ve test reaksiyonlarının sonucuna göre belirlenir.
Maksimum doz 2 püskürtmedir. Hastanın tolere edebileceği bireysel maksimum doz çok daha düşük olabilir.
SULGEN® ile tedavi birinci gün maksimum 2 püskürtme ile başlar ve her gün maksimum 2 püskürtme ile devam ettirilir.
Tedavi kalıcı olarak başlatılabilir, alerjen varlığında, mevsim öncesinde ve mevsiminde başlanabilir.
Çocuklar ve adolesanlarda kullanım:
2 ila 18 yaş arasındaki çocuklar ve ergenler için doz ayarlaması gerekli değildir.
SULGEN® 0 ila 2 yaş arası çocuklarda kontrendikedir (bkz. Bölüm 4.3).
Uygulama şekli:
SULGEN® dilaltına uygulanmalıdır.
Dilin altında yaklaşık 2 dakika tutulmalı ve ardından yutulmalıdır.
Uygulama tercihen sabahları ilk öğünden 15 dakika önce (açken) ve diş temizliği ile en az 15 dakika arayla gerçekleştirilmelidir.
Uygulama için püskürtme cihazını yana çevirin (bkz. Şekil 1) ve püskürtme düğmesine basarak çözeltiyi dilaltına püskürtün (bkz. Şekil 2). Alerjen çözeltisini en uygun şekilde dağıtmak için püskürtme cihazının mukoza ile doğrudan temasından kaçınılmalıdır.
Püskürtme cihazını hazırlama talimatları için Bölüm 6.6' ya bakınız.
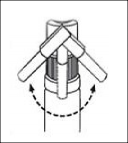
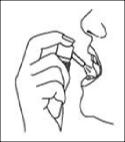
Şekil 1 Şekil 2
Özel tedbirler
Eğer iki farklı alerjen çözeltisi reçete edilirse, bir alerjen çözeltisi sabah kahvaltıdan önce, diğer alerjen çözeltisi de akşam yemeğinden önce kullanılmalıdır.
Hasta bir dozu unuttuğu zaman, uygulama 12 saat içinde, iki alerjen solüsyonu reçete edilmişse 6 saat içinde telafi edilebilir. Bu durumda bir sonraki uygulama ertesi gün bilinen saatinde gerçekleştirilir. Asla çift doz uygulanmamalıdır.
Tedaviye ara verildikten sonra tedavi günlük maksimum 2 püskürtme ile yeniden başlatılabilir. Tedavinin sonucu ulaşılan bireysel maksimum doza bağlıdır, ancak bu sınır aşılmamalıdır.
Tedavinin genel olarak 3 ila 5 yıl sürdürülmelidir. En azından, belirgin bir iyileşme görüldükten veya semptomlar ortadan kalktıktan sonra 1 yıl devam ettirilmelidir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Veri yoktur.
Pediyatrik popülasyon:
2 yaşın altındaki çocuklarda kullanılmamalıdır.
Geriyatrik popülasyon:
Veri yoktur.
4.3. Kontrendikasyonlar
Oral kavitede (ağız boşluğunda) akut ağır enfeksiyonlar veya kronik hastalıklar
Güncel GINA kılavuzlarına göre kontrolsüz veya kısmen kontrollü bronşiyal astım
Solunum sisteminde geri dönüşümsüz hasarlar (amfizem, bronşektazi vb.)
Malign tümör hastalıkları
Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı bilinen aşırı duyarlılık
İmmün bozukluklar (otoimmün hastalıkları, immün kompleks sebepli immünpatiler, diğer immün yetmezlikler)
Bağışıklık sistemini baskılayıcı tedavi
Geçmişte spesifik immün tedavisinde görülen ağır sistemik reaksiyonlar
2 yaş altı çocuklar
Tedaviye başlamadan önce gebelik söz konusu olduğunda
4.4. Özel kullanım uyarıları ve önlemleri
Özellikle dikkat edilmesi gereken hususlar:
Oral kavitedeki enfeksiyonlar, iltihaplar veya lezyonlar
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Etkileşimler hakkında bilgi toplamak amacıyla herhangi bir çalışma bulunmamaktadır.
Semptomatik antialerjik ilaçlarla eşzamanlı tedavi (örn. antihistaminikler, kortikosteroidler, mast hücre stabilizatörleri) ve eşlik eden antihistaminik etkili tıbbi ürünler hastanın tolerans sınırını etkileyebilir. Bu ilaçların kullanımının bırakılması durumunda alerjik yan etkileri önlemek için SULGEN® dozunun azaltılması gerekebilir.
Herhangi bir aşı yaptırmadan en az 3 gün önce SULGEN®'in kullanımı kesilmelidir. Aşıdan kaynaklanan reaksiyonlar geçtikten sonra, aşıdan en az 3 gün sonra olmak şartıyla SULGEN® kullanımına devam edilebilir.
Hasta, SULGEN® kullanmadan önce ve sonra en az 15 dakika yiyecek veya içecek tüketmemelidir.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
Pediyatrik popülasyon için herhangi bir ilaç etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar /Doğum kontrolü (Kontrasepsiyon)
SULGEN®'in çocuk doğurma potansiyeli ve doğum kontrol yöntemleri üzerindeki etkilerine ilişkin veri bulunmamaktadır.
Gebelik dönemi
SULGEN®'in gebe kadınlarda kullanımına ilişkin yeterli klinik veri yer almamaktadır. Üreme toksisitesi ile ilgili çalışma yapılmamıştır.
SULGEN® ile tedaviye gebelik sırasında başlanmamalıdır. Daha önce başlatılmış bir tedavi gebelik sırasında, tedavi eden doktor ile görüşülerek ve fayda-risk değerlendirmesi yapılarak devam ettirilmelidir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/embriyonal/fetal gelişim/ve- veya/doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir.
SULGEN®, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
SULGEN®'in insan sütüyle atılıp atılmadığı bilinmemektedir. Emzirilen bebek için muhtemelen bir risk olmamasına rağmen, emzirme döneminde fayda risk değerlendirmesi gereklidir, çünkü emziren kadınların kullanımı konusunda yeterli veri mevcut değildir.
Üreme yeteneği / Fertilite
SULGEN®'in üreme yeteneği/fertiliteyi etkilemesi beklenmemektedir ancak bu konuda herhangi bir veri mevcut değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
SULGEN®'in araç ve makine kullanma yeteneği üzerine göz ardı edilebilir derecede bir etkisi bulunmakta veya hiç etkisi bulunmamaktadır.
4.8. İstenmeyen etkiler
MedDRA sistem organ sınıfına göre istenmeyen etkiler sıklıklarına göre sınıflandırılmıştır. Sıklıklar şu şekilde tanımlanmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Dozaja tam uyulduğu takdirde (ayrıca bkz. Bölüm 4.2) alerjik yan etkiler seyrek görülür.
Bununla birlikte, özellikle doz aşımında veya hassas kişilerde tedaviye başlandıktan sonraki ilk bir ila üç hafta içerisinde aşağıdaki reaksiyonlar hafif düzeyde görülebilir (ayrıca bkz. Bölüm 5.1):
Sistem Organ Sınıfı | Görülme Sıklığı | Yan Etkiler |
Bağışıklık sistemi hastalıkları |
Bilinmiyor | Sistemik alerjik reaksiyonlar (anafilaktik şok da dahil) |
Sinir sistemi hastalıkları | Bilinmiyor | Baş ağrısı, baş dönmesi, parestezi |
Göz hastalıkları | Bilinmiyor | Göz kapağı ödemi, göz kaşıntısı |
Kulak ve iç kulak hastalıkları | Bilinmiyor | Vertigo |
Kardiyak hastalıklar | Bilinmiyor | Taşikardi, palpitasyon |
Vasküler hastalıklar | Bilinmiyor | Hipotansiyon, solgunluk, kızarma |
Solunum, göğüs bozuklukları ve mediastinal hastalıkları |
Bilinmiyor | Boğazda sıkışma, hırıltı, öksürük, dispne, astım, boğaz tahrişi, burun tıkanıklığı, burun akıntısı, burunda kaşıntı |
Gastrointestinal hastalıklar | Bilinmiyor | Disfaji, diyare, kusma, bulantı, karın ağrısı |
Deri ve deri altı doku hastalıkları | Bilinmiyor | Ürtiker, kaşıntı, döküntü, eritem, anjiyoödem, şişmiş yüz |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | Bilinmiyor | Artralji, eklem şişmesi |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar |
Bilinmiyor | Dilde, dudaklarda ve/veya oral kavitede (ağız boşluğu) kaşınma, tahriş olma veya şişme, ürtiker, renk değişikliği, nodül, ağrı, granülom, hematom, eritem, kaşıntı, hipertrikoz, sıcaklık hissi, yabancı cisim hissi, periferik şişlik, göğüs rahatsızlığı, yorgunluk, halsizlik |
Bu istenmeyen etkilerin çoğu kısa sürer ve tedavisi kolaydır. Mevcut bir atopik dermatit bazı durumlarda kötüleşebilir.
Tedavi kesinlikle alerjik yan etkilerin seyrine ve şiddetine uygun olarak devam ettirilmelidir. Gerekirse, alerjik yan etkilerin seyrine ve ciddiyet derecesine göre, doz bir sonraki uygulamada 1 püskürtmeye düşürülebilir.
Anafilaktik reaksiyonlar (şok dahil, ayrıca bkz. Bölüm 4.9) alerjen enjeksiyonundan birkaç saniye ila birkaç dakika sonra, genellikle de lokal bir reaksiyon gelişmeden önce ortaya çıkabilir.
Tipik alarm semptomları:
Avuç içlerinde, ayak tabanlarında ve genital bölgede kaşıntı ve yanma
4.9. Doz aşımı ve tedavisi
Doz aşımı olması durumunda ciddi yan etkiler görülebilir (ayrıca bkz. Bölüm 4.8).
Anafilaktik reaksiyonların tedavisi için daima bir ilk yardım kiti hazır bulundurulmalıdır!
Gerekli ilk yardım tedbirleri açısından güncel akut tedavi ve anafilaksi yönetimi basamakları izlenmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Alerjen ekstraktları ATC Kodu: V01AAAlerjiye yol açan maddeler verilerek tedavi edilen hastada bu alerjenlere karşı bir tolerans geliştirilmesi amaçlanmaktadır, bunlar alerjene özgü IgG antikorların oluşmasıyla ve değişen mediyatörlerin açığa çıkmasıyla kendini göstermektedir.
5.2. Farmakokinetik özellikler
Genel özelliklerAlerjenler, yüksek molekül ağırlıklı maddelerin kompleks karışımlarıdır. İçerisindeki alerjenler proteinler ve glikoproteinlerdir.
Emilim:
Uygulanabilir değildir. Dağılım: Uygulanabilir değildir. Biyotransformasyon Uygulanabilir değildir.
Eliminasyon:
Uygulanabilir değildir.
Doğrusallık / doğrusal olmayan durum:
Uygulanabilir değildir.
5.3. Klinik öncesi güvenlilik verileri
Alerjen ekstraktlarının ve başlangıç maddelerinin toksik özellikleri bilinmemektedir.
Doğal alerjen ekstraktları uzun yıllardan beri spesifik immünoterapi için kullanılmaktadır. Ayrıca alerjen ekstraktları yaygın olarak bulunan doğal kaynaklardan üretilmektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Gliserol Sodyum klorür
Disodyum fosfat dihidrat (pH ayarı için)
Sodyum dihidrojen fosfat monohidrat (pH ayarı için) Ananas aroması
Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimlilik araştırmaları bulunmadığından bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
18 ay.
SULGEN®, etiket üzerinde belirtilen son kullanma tarihinden sonra kullanılmamalıdır. Son kullanma tarihi belirtilen ayın son günüdür.
Her şişe açıldıktan sonra buzdolabında (2°C-8°C) en fazla 4 ay veya oda sıcaklığını aşmayan sıcaklıklarda (2°C-25°C) en fazla 2 ay boyunca muhafaza edilebilir; fakat saklama süresi etiketin üstünde yer alan son kullanma tarihini geçmemelidir.
6.4. Saklamaya yönelik özel tedbirler
SULGEN® buzdolabında (2°C-8°C arasında), ışıktan korunarak saklanmalıdır. Dondurulmamalıdır. Yanlışlıkla dondurulmuş ilaçlar çözülüp kullanılmamalıdır.
6.5. Ambalajın niteliği ve içeriği
PP boru, pompa silindiri, mavi LDPE kauçuk conta ve yana doğru döndürülebilir uzatma borusu olan, beyaz püskürtme başlığı bulunan vidalı pompa sistemli kahverengi cam şişe (Tip III, Av. Farm.).
SULGEN® aşağıdaki ambalaj şeklinde sunulmaktadır:
- Her biri 9,0 mL çözelti içeren 2 şişe
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Özel bir imha yöntemi yoktur. Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
Kullanım ile ilgili bilgiler:
Her yeni şişeyi ilk kez kullanmadan önce, sprey pompasına çözelti gelmesini sağlamak için 1 ila 2 kez test püskürtmesi yapılmalıdır.
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
ROXALL Medicine İlaç İthalat İhracat Sanayi ve Ticaret Ltd. Şti.
| Satış Fiyatı | 19755.37 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 19755.37 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8683190185430 |
| Etkin Madde | Dermatophagoides Pteronyssinus (avrupa Ev Tozu Akari) / Dermatophagoides Farinae (amerika Ev Tozu Akari) |
| İthal ( ref. ülke : Turkiye ) ve Beşeri bir ilaçdır. |