SYNJARDY 5mg/1000 mg film kaplı tablet (60 adet) Farmakolojik Özellikler
{ Empagliflozin + Metformin Hidroklorür }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diyabette kullanılan ilaçlar, kan glikozunu düşürücü oral ilaçların kombinasyonu
ATC kodu : A10BD20
Etki mekanizması
SYNJARDY, tip 2 diyabet hastalarında glisemik kontrolün iyileştirilmesi için etki gösteren ve birbirini tamamlayan etki mekanizmalarına sahip iki antihiperglisemik ilacın kombinasyonudur: Empagliflozin, sodyum-glikoz ko-taşıyıcı 2 (SGLT-2) inhibitörüdür, metformin hidroklorür ise, biguanid sınıfının bir üyesidir.
Empagliflozin
Empagliflozin, geri dönüşümlü, yüksek ölçüde potent (IC1,3 nmol) ve selektif bir SGLT-2 kompetitif inhibitörüdür. Empagliflozin, periferik dokulara glikoz taşınması için önemli olan diğer glikoz taşıyıcılarını inhibe etmez ve SGLT-2 için SGLT-1 (bağırsakta glikoz absorpsiyonundan sorumlu majör taşıyıcı) ile karşılaştırıldığında 5.000 kat daha selektiftir. SGLT-2 böbreklerde yüksek oranda eksprese edilir, buna karşılık diğer dokularda ekspresyonu ya yoktur ya da çok düşüktür. SGLT-2, asıl taşıyıcı olarak, glikozun glomerüler filtrattan tekrar dolaşıma absorpsiyonundan sorumludur. Tip 2 diyabeti ve hiperglisemisi olan hastalarda daha yüksek miktarlarda glikoz süzülür ve yeniden absorbe edilir.
Empagliflozin, Tip 2 diyabetli hastalarda renal glikozun tekrar absorbsiyonunu azaltarak glisemik kontrolü iyileştirir. Böbreklerden bu gluküretik mekanizma ile uzaklaştırılan glikoz miktarı, kan glikozu konsantrasyonuna ve glomerüler filtrasyon hızına bağlıdır. Tip 2 diyabeti ve hiperglisemisi olan hastalarda SGLT-2 inhibisyonu, idrarla aşırı glikoz atılımına neden olur. Ek olarak, empagliflozin kullanımına başlanması, sodyum atılımını arttırır ve bu durum da osmotik diürez ve intravasküler hacmin azalması ile sonuçlanır.
Tip 2 diyabet hastalarında idrarla glikoz atılımı, empagliflozinin ilk dozunu takiben hemen artar ve 24 saatlik doz aralıkları boyunca devam eder. İdrarla glikoz atılımındaki artış 4 haftalık tedavi döneminin sonunda sağlanır ve empagliflozin 25 mg ile ortalama yaklaşık 78 g/gündür. İdrarla glikoz atılımının artması, tip 2 diyabet hastalarında plazma glikoz düzeylerinin hızla azalmasına yol açar.
Empagliflozin, hem açlık ve hem de tokluk plazma glikoz düzeylerinde iyileşme yapar. Empagliflozinin etki mekanizması, beta hücre fonksiyonundan ve insülin yolağından bağımsızdır ve bu durum hipoglisemi riskinin düşük olmasına katkıda bulunur. Homeostaz Model Değerlendirmesi-ï¢ (HOMA-ï¢) dahil, beta hücre fonksiyonunun yerini tutucu (surrogate) göstergelerde iyileşme kaydedilmiştir. Ek olarak, idrarla glikoz atılımı kalori kaybını tetikler, vücutta yağ kaybı ve vücut ağırlığında düşme ile ilişkilidir. Empagliflozin ile gözlenen glikozüri, hafif diürez ile birliktedir ve bu durum kan basıncının sürekli ve orta derecedeki düşmesine katkıda bulunabilir. Empagliflozin ile gözlemlenen glikozüri, natriürez ve osmotik diürez, kardiyovasküler sonlanımların iyileşmesine katkıda bulunabilir.
Metformin
Metformin, antihiperglisemik etkileri olan bir biguaniddir. Hem bazal hem de postprandiyal plazma glikoz düzeylerini düşürür. İnsülin sekresyonunu stimüle etmez ve bu nedenle hipoglisemi oluşturmaz.
Metformin 3 mekanizma aracılığı ile etki gösterebilir:
Glikoneojenezi ve glikojenolizi inhibe ederek hepatik glikoz üretimini azaltır
Kaslarda, insülin duyarlılığını arttırarak periferik glikoz alımını ve kullanımını arttırır
İntestinal glikoz absorpsiyonunu geciktirir
Metformin, glikojen sentazı etkileyerek intraselüler glikojen sentezini stimüle eder. Metformin,
bugüne kadar bilinen tüm membran glikoz taşıyıcılarının (GLUT) taşıma kapasitesini arttırır.
İnsanlarda, metforminin, glisemi üstündeki etkilerinden bağımsız olarak, lipid metabolizması üzerinde olumlu etkileri vardır. Bu durum, kontrollü, orta veya uzun süreli klinik çalışmalarda terapötik dozlarda gösterilmiştir: Metformin total kolesterolü, LDL kolesterolü ve trigliserit düzeylerini düşürür.
Klinik etkililik ve güvenlilik
Glisemik kontrolün iyileştirilmesi ve kardiyovasküler morbidite ve mortalitenin düşürülmesi Tip 2 diyabet tedavisinin ayrılmaz parçasıdır.
Glisemik etkililik ve kardiyovasküler sonuçlar, Tip 2 diyabeti olan toplam 10.366 hasta, 9 çift kör, plasebo veya aktif kontrollü klinik çalışmada, en az 24 hafta süre ile tedavi edilmiştir. 2.950 hasta metformine ekleme tedavisi olarak empagliflozin 10 mg ve 3.701 hasta da metformine ekleme tedavisi olarak empagliflozin 25 mg kullanmıştır. Bu hastalardan 266'sı metformin + insülin tedavisine ekleme tedavisi olarak empagliflozin 10 mg ve 264'ü empagliflozin 25 mg almıştır.
Metforminle kombine empagliflozin tedavisi, diğer antidiyabetik ilaçlarla (pioglitazon, sülfonilüre, DPP-4 inhibitörleri ve insülin) birlikte veya bu ilaçlar kullanılmadan, HbA1c'de, açlık plazma glikozunda, vücut ağırlığında, sistolik ve diyastolik kan basıncında klinik olarak anlamlı iyileşmeler sağlamıştır. Empagliflozin 25 mg uygulanması, HbA1c düzeyinin %7'nin altına inmesi hedefine ulaşan hastaların oranında daha büyük bir artışla sonuçlanmış ve empagliflozin 10 mg ve plasebo uygulamalarına göre daha az hasta glisemik kurtarmaya ihtiyaç duymuştur. 75 yaşında ve daha yaşlı hastalarda, empagliflozin tedavisi ile HbA1c düzeyinde sayısal olarak daha düşük düşmeler gözlenmiştir. Başlangıç HbA1c düzeylerinin daha yüksek olması, HbA1c düzeylerinde daha fazla düşme ile ilişkilidir. Ek olarak, empagliflozinin standart tedaviye eklenmesi, belirlenmiş kardiyovasküler hastalığı ve Tip 2 diyabeti olan hastalarda, kardiyovasküler mortaliteyi azaltmıştır.
Metformine, sülfonilüreye, pioglitazona ekleme tedavisi olarak empagliflozin
Metformin, metformin ve bir sülfonilüre veya pioglitazon ve metformine ekleme tedavisi olarak empagliflozin uygulanması, plasebo ile karşılaştırıldığında, HbA1c düzeylerinde ve vücut ağırlığında istatistiksel olarak anlamlı (p<0,0001) azalmalarla sonuçlanmıştır (Tablo 3). Ayrıca, açlık plazma glikozunda, sistolik ve diyastolik kan basıncında da plaseboyla karşılaştırıldığında, klinik olarak anlamlı düşmelerle sonuçlanmıştır.
Bu çalışmaların çift kör, plasebo kontrollü uzatmalarında, HbA1c, vücut ağırlığı ve kan
basıncındaki düşme, 76. haftaya kadar devam etmiştir.
Metformine ekleme tedavisi | |||
| Plasebo | Empagliflozin | |
10 mg | 25 mg | ||
N | 207 | 217 | 213 |
HbA1c (%) | |||
Başlangıç (ortalama) | 7,9 | 7,94 | 7,86 |
Başlangıçtan olan değişiklik | -0,13 | -0,7 | -0,77 |
Plasebodan olan farklılık (% 97,5 GA) |
| -0,57* (-0,72, -0,42) | -0,64* (-0,79, -0,48) |
N | 184 | 199 | 191 |
Başlangıç HbA1c düzeyi ≥% 7 olan ve HbA1c düzeyi <% 7 hedefine ulaşan hastalar (%) |
12,5 |
37,7 |
38,7 |
N | 207 | 217 | 213 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 79,73 | 81,59 | 82,21 |
Başlangıca göre değişiklik | -0,45 | -2,08 | -2,46 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,63* (-2,17, -1,08) | -2,01* (-2,56, -1,46) |
N | 207 | 217 | 213 |
Sistolik kan basıncı (mmHg) | |||
Başlangıç (ortalama) | 128,6 | 129,6 | 130 |
Başlangıca göre değişiklik | -0,4 | -4,5 | -5,2 |
Plaseboya göre farklılık (% 95 GA) |
| -4,1* (-6,2, -2,1) | -4,8* (-6,9, -2,7) |
Metformin ve bir sülfonilüreye ekleme tedavisi | |||
|
Plasebo | Empagliflozin | |
10 mg | 25 mg | ||
N | 225 | 225 | 216 |
HbA1c (%) | |||
Başlangıç (ortalama) | 8,15 | 8,07 | 8,1 |
Başlangıca göre değişiklik | -0,17 | -0,82 | -0,77 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,64* (-0,79, -0,49) | -0,59* (-0,74, -0,44) |
N | 216 | 209 | 202 |
Başlangıç HbA1c düzeyi ≥% 7 olan ve HbA1c düzeyi <% 7 hedefine ulaşan hastalar (%) |
9,3 |
26,3 |
32,2 |
N | 225 | 225 | 216 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 76,23 | 77,08 | 77,5 |
Başlangıca göre değişiklik | -0,39 | -2,16 | -2,39 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,76* (-2,25, -1,28) | -1,99* (-2,48, -1,5) |
N | 225 | 225 | 216 |
Sistolik kan basıncı (mmHg) | |||
Başlangıç (ortalama) | 128,8 | 128,7 | 129,3 |
Tablo 3: 24 hafta süreli plasebo kontrollü çalışmaların etkililik sonuçları
Plaseboya göre farklılık (% 95 GA) |
| -2,7 (-4,6, -0,8) | -2,1 (-4, -0,2) |
Pioglitazon + metformine ekleme tedavisi | |||
| Plasebo | Empagliflozin | |
10 mg | 25 mg | ||
N | 124 | 125 | 127 |
HbA1c (%) | |||
Başlangıç (ortalama) | 8,15 | 8,07 | 8,1 |
Başlangıca göre değişiklik | -0,11 | -0,55 | -0,7 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,45* (-0,69, -0,21) | -0,6* (-0,83, -0,36) |
N | 118 | 116 | 123 |
Başlangıç HbA1c düzeyi ≥% 7 olan ve HbA1c düzeyi <% 7 hedefine ulaşan hastalar (%) | 8,5 | 22,4 | 28,5 |
N | 124 | 125 | 127 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 79,45 | 79,44 | 80,98 |
Başlangıca göre değişiklik | 0,4 | -1,74 | -1,59 |
Plaseboya göre farklılık (% 97,5 GA) |
| -2,14* (-2,93, -1,35) | -2* (-2,78, -1,21) |
N | 124 | 125 | 127 |
Sistolik kan basıncı (mmHg) | |||
Başlangıç (ortalama) | 125,5 | 126,3 | 126,3 |
Başlangıca göre değişiklik | 0,8 | -3,5 | -3,3 |
Plaseboya göre farklılık (% 95 GA) |
| -4,2** (-6,94, -1,53) | -4,1** (-6,76, -1,37) |
* p değeri<0,0001
** p değeri <0,01 GA: Güven aralığı
Daha önce ilaç tedavisi görmemiş hastalarda empagliflozinin metformin ile kombinasyonu Daha önce ilaç tedavisi görmemiş hastalarda empagliflozinin etkililiği ve güvenliliğini değerlendirmek üzere, 24 haftalık faktöriyel tasarımlı bir klinik çalışma yürütülmüştür. Empagliflozin ve metformin kombinasyonu (günde 2 kez verilen 5 mg ve 500 mg; 5 mg ve 1000 mg; 12,5 mg ve 500 mg; 12,5 mg ve 1000 mg), HbA1c değerlerinde istatistiksel olarak anlamlı iyileşme (Tablo 4), açlık plazma glikoz değerinde daha fazla azalma (her bir bileşenle karşılaştırıldığında) ve vücut ağırlığında daha fazla düşme sağlamıştır (metformine göre).
Tablo 4: Empagliflozinin metforminle kombinasyonunu bireysel bileşenlerle karşılaştıran 24. haftadaki etkililik sonuçları
| Empagliflozin 10 mg | Empagliflozin 25 mg | Metformin | |||||
| + Met 1000 mg | + Met 2000 mg | Met yok | + Met 1000 mg | + Met 2000 mg | Met yok | 1000 mg | 2000 mg |
N | 161 | 167 | 169 | 165 | 169 | 163 | 167 | 162 |
HbA1c (%) | ||||||||
Başlangıç (ortalama) | 8,68 | 8,65 | 8,62 | 8,84 | 8,66 | 8,86 | 8,69 | 8,55 |
Başlangıçtan | -1,98 | -1,36 | -1,18 | -1,75 | ||||
Empa ile karşılaştırma (%95 GA) | -0,63* (-0,86, - 0,4) | -0,72* (-0,96,- 0,49) |
| -0,57* (-0,81,-0,34) | -0,72* (-0,95,- 0,48) |
|
|
|
Met ile karşılaştırma (%95 GA) | -0,79* (-1,03,- 0,56) | -0,33* (-0,56,- 0,09) |
| -0,75* (-0,98- 0,51) | -0,33* (-0,56,-0,1) |
|
|
|
Met= Metformin; empa= Empagliflozin
Metformin ve linagliptin ile yeterli kontrolün sağlanamadığı hastalarda empagliflozin Metformin ve linagliptin 5 mg ile yeterli kontrolün sağlanamadığı hastalarda, empagliflozinin gerek 10 mg ve gerekse 25 mg dozları ile tedavi, HbA1c değerleri ve vücut ağırlığında plaseboya göre, istatistiksel olarak anlamlı (p<0,0001) düşüşler sağlamıştır (Tablo 5). Ayrıca, plasebo ile karşılaştırıldığında, açlık plazma glikozu, sistolik ve diyastolik kan basıncında da klinik olarak önemli azalmalar ortaya çıkmıştır.
Tablo 5: Metformin ve linagliptin 5 mg ile yeterli kontrol sağlanamayan hastalarda plasebo kontrollü çalışmanın 24 haftalık etkililik sonuçları
Metformin ve linagliptin 5 mg tedavisine ekleme | |||
| Plasebo | Empagliflozin | |
|
| 10 mg | 25 mg |
N | 106 | 109 | 110 |
HbA1c (%) | |||
Başlangıç (ortalama) | 7,96 | 7,97 | 7,97 |
Başlangıçtan değişiklik | 0,14 | -0,65 | -0,56 |
Plaseboya göre farklılık (%95 GA) |
| -0,79* (-1,02, -0,55) | -0,7* (-0,93, -0,46) |
N | 100 | 100 | 107 |
Başlangıçta HbA1c ≥7% olan ve HbA1c <7% değerini sağlayan hastalar (%) |
17 |
37 |
32,7 |
N | 106 | 109 | 110 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 82,3 | 88,4 | 84,4 |
Başlangıçtan değişiklik | -0,3 | -3,1 | -2,5 |
Plaseboya göre farklılık (%95 GA) |
| -2,8* (-3,5, -2,1) | -2,2* (-2,9, -1,5) |
N | 106 | 109 | 110 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 130,1 | 130,4 | 131 |
Başlangıçtan değişiklik | -1,7 | -3 | -4,3 |
Plaseboya göre farklılık (%95 GA) |
| -1,3 (-4,2, 1,7) | -2,6 (-5,5, 0,4) |
TAS (OC) MMRM modeli, başlangıçHbA1c,başlangıçeGFR(MDRD), coğrafi bölge, vizit, tedavi
* p-değeri <0,0001
GA: Güven aralığı
Başlangıç HbA1c değerleri ≥ % 8,5 olan önceden tanımlanmış bir hasta alt grubunda, başlangıç HbA1c değerlerindeki 24. haftadaki düşme, plasebo ile kıyaslandığında, empagliflozin 10 mg veya empagliflozin 25 mg ile %-1,3 olmuştur (p<0,0001).
Metformine eklenen empagliflozin tedavisi ile glimepirid tedavisinin karşılaştırılması- Empagliflozin 24 aylık veri
Tek başına metformin ile yeterli glisemik kontrolün sağlanamadığı hastalarda, empagliflozin
25 mg'ın etkililik ve güvenliliğini glimepirid ile (günde 4 mg'a kadar) karşılaştıran bir çalışmada, günlük empagliflozin tedavisi, glimepiride göre, HbA1c düzeyinde üstün şekilde azalma ile sonuçlanmış (Tablo 6) ve açlık plazma glikozu değerlerinde klinik olarak anlamlı bir düşme sağlamıştır. Günlük empagliflozin tedavisi, glimepirid ile karşılaştırıldığında, vücut ağırlığında, sistolik ve diyastolik kan basıncında istatistiksel olarak anlamlı azalmalar sağlamış ve istatistiksel olarak anlamlı şekilde daha düşük oranda hasta hipoglisemik olay yaşamıştır (empagliflozin için % 2,5, glimepirid için % 24,2, p<0,0001).
Tablo 6: Metformine ekleme tedavisi olarak empagliflozin ve glimepiridi karşılaştıran aktif kontrollü bir çalışmada 104. hafta etkililik sonuçları
| Empagliflozin 25 mg | Glimepirid |
N | 765 | 780 |
HbA1c (%) | ||
Başlangıç (ortalama) | 7,92 | 7,92 |
Başlangıca göre değişiklik | -0,66 | -0,55 |
Glimepiride göre farklılık (% 97,5 GA) | -0,11* (-0,2, -0,01) |
|
N | 690 | 715 |
Başlangıç HbA1c düzeyi ≥% 7 olan ve HbA1c düzeyi <% 7 hedefine ulaşan hastalar (%) | 33,6 | 30,9 |
N | 765 | 780 |
Vücut ağırlığı (kg) | ||
Başlangıç (ortalama) | 82,52 | 83,03 |
Başlangıca göre değişiklik | -3,12 | 1,34 |
Glimepiride göre farklılık (% 97,5 GA) | -4,46** (-4,87,-4,05) |
|
N | 765 | 780 |
Sistolik kan basıncı (mmHg) | ||
Başlangıç (ortalama) | 133,4 | 133,5 |
Başlangıca göre değişiklik | -3,1 | 2,5 |
Glimepiride göre farklılık (% 97,5 GA) | -5,6** (-7, -4,2) |
|
tam seti (TAS)
* âDaha aşağı olmamaâ için p değeri<0,0001; üstünlük için p değeri=0,0153
** p değeri<0,0001 GA: Güven aralığı
İnsülin tedavisine ekleme
Çoklu günlük insülin tedavisine ekleme tedavisi olarak empagliflozin
Metforminle birlikte uygulanan çoklu günlük insüline eklenen empagliflozinin etkililiği ve güvenliliği, 52 hafta süreli, çift kör, plasebo kontrollü bir çalışmada değerlendirilmiştir. Başlangıçtaki ilk 18 hafta ve son 12 hafta boyunca insülin dozu stabil tutulmuş, ancak,19-40 haftaları arasında preprandiyal glikoz düzeyleri <100 mg/dl [5,5 mmol/L] ve postprandiyal glikoz düzeyleri <140 mg/dl [7,8 mmol/L] olacak şekilde ayarlanmıştır.
18. haftada, empagliflozin, plasebo ile karşılaştırıldığında, HbA1c düzeylerinde istatistiksel olarak anlamlı iyileşmeler sağlamıştır (Tablo 7).
52. haftada empagliflozin ile tedavi, plasebo ile karşılaştırıldığında, HbA1c düzeyinde ve insülin kullanımında istatistiksel olarak anlamlı azalmalar sağlamış ve vücut ağırlığını düşürmüştür.
Tablo 7: Plasebo kontrollü bir çalışmada metforminle birlikte uygulanan çoklu günlük dozlarda
insüline eklenen empagliflozin tedavisi için 18. ve 52. haftalardaki etkililik sonuçları
| Plasebo | Empagliflozin | |
10 mg | 25 mg | ||
N | 135 | 128 | 137 |
18. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 8,29 | 8,42 | 8,29 |
Başlangıca göre değişiklik | -0,58 | -0,99 | -1,03 |
Plaseboya göre farklılık |
| -0,41* | -0,45* |
(% 97,5 GA) | (-0,61, -0,21) | (-0,65, -0,25) | |
N | 86 | 84 | 87 |
52. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 8,26 | 8,43 | 8,38 |
Başlangıca göre değişiklik | -0,86 | -1,23 | -1,31 |
Plaseboya göre farklılık |
| -0,37** | -0,45* |
(% 97,5 GA) | (-0,67, -0,08) | (-0,74, -0,16) | |
N | 84 | 84 | 87 |
Başlangıç HbA1c düzeyi ≥% 7 olan ve 52. haftada HbA1c düzeyi <% 7 hedefine ulaşan hastalar (%) |
27,4 |
41,7 |
48,3 |
N | 86 | 83 | 86 |
52. haftada insülin dozu (IU/gün) | |||
Başlangıç (ortalama) | 91,01 | 91,77 | 90,22 |
Başlangıca göre değişiklik | 12,84 | 0,22 | -2,25 |
-15,09** | |||
N | 86 | 84 | 87 |
52. haftada vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 97,78 | 98,86 | 94,93 |
Başlangıca göre değişiklik | 0,42 | -2,47 | -1,94 |
Plaseboya göre farklılık(% 97,5 GA) |
| -2,89* (-4,29, -1,49) | -2,37* (-3,75, -0,98) |
<140 mg/dl (7,8 mmol/L) sağlayacak insülin doz ayarlaması, hedefe yönelik tedavi rejimi
*p değeri ≤ 0,0005
** p değeri < 0,005
GA: Güven aralığı
Bazal insüline ekleme tedavisi olarak empagliflozin
Metforminle uygulanan bazal insülin tedavisine eklenen empagliflozin tedavisinin etkililiği ve güvenliliği, 78 hafta süreli, çift kör, plasebo kontrollü bir çalışmada değerlendirilmiştir. İlk 18 hafta süresince insülin dozu stabil tutulmuş, ancak, takip eden 60 hafta boyunca açlık plazma glikoz düzeyi <110 mg/dl olarak sağlanacak şekilde ayarlanmıştır.
Empagliflozin, 18. haftada, HbA1c düzeyinde istatistiksel olarak anlamlı iyileşme sağlamıştır. Plasebo ile karşılaştırıldığında, empagliflozin ile tedavi edilen ve başlangıç HbA1c düzeyi
≥% 7 olan hastaların daha büyük bir oranı <% 7 HbA1c hedefine ulaşmıştır (Tablo 8).
78. haftada, empagliflozinin HbA1c düzeyini düşürücü ve insülin kullanımını azaltıcı etkisi sürmüştür. Ayrıca, empagliflozin, açlık plazma glikozu, vücut ağırlığı ve kan basıncında da düşme oluşturmuştur.
Tablo 8: Plasebo kontrollü bir çalışmanın 18 ve 78. haftasında metforminle uygulanan bazal insülin tedavisine eklenen empagliflozin tedavisinin etkililik sonuçları
| Plasebo | Empagliflozin 10 mg | Empagliflozin 25 m |
N | 96 | 107 | 99 |
18. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 8,02 | 8,21 | 8,35 |
Başlangıca göre değişiklik | -0,09 | -0,62 | -0,72 |
Plaseboya göre farklılık (% 97,5 GA) |
| 0,54* (-0,77, -0,3) | -0,63* (-0,88, -0,39) |
N | 89 | 105 | 94 |
78. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 8,03 | 8,24 | 8,29 |
Başlangıca göre değişiklik | -0,08 | -0,42 | -0,71 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,34**(-0,64, -0,05) | -0,63* (-0,93, -0,33) |
N | 89 | 105 | 94 |
78. haftada bazal insülin dozu (IU/gün) |
|
|
|
Başlangıç (ortalama) | 49,61 | 47,25 | 49,37 |
Başlangıca göre değişiklik | -0,28 | ||
GA) |
| 0,61) |
|
kurtarma tedavisinden önce ileri taşınan son gözlem (İTSG) kullanılarak tamamlayanlar
*p değeri<0,0001
** p değeri ≤0,025
Metformine ekleme tedavisi olarak empagliflozin ve linagliptin
Yeterli glisemik kontrol sağlanamayan hastalarda yürütülen bir çift-kör çalışmada, metformine eklenen empagliflozinin her iki dozu + linagliptin tedavisi, HbA1c değerlerinde istatistiksel olarak anlamlı (p<0,0001) düşme (başlangıca göre değişiklik: empagliflozin 10 mg + linagliptin 5 mg için % -1,08, empagliflozin 25 mg + linagliptin 5 mg için % -1,19, linagliptin 5 mg için
% -0,7) sağlamıştır. Linagliptin 5 mg ile karşılaştırıldığında, her iki empagliflozin dozu + linagliptin 5 mg, açlık plazma glikozunda ve kan basıncında istatistiksel olarak anlamlı azalmalar sağlamıştır. Her iki doz da, vücut ağırlığında kg ve % değişiklik olarak belirtilen, istatistiksel olarak anlamlı, benzer düşmeler göstermiştir. Linagliptin 5 mg ile kıyaslandığında, başlangıç HbA1c düzeyi ≥% 7 olan ve empagliflozin + linagliptin ile tedavi edilen hastaların daha büyük bir oranı <% 7 HbA1c hedefine ulaşmıştır. HbA1c düzeyinde klinik olarak anlamlı düşmeler, 52 hafta boyunca devam etmiştir.
Metformine ekleme tedavisi olarak günde bir kez empagliflozin uygulamasına karşı günde iki kez empagliflozin uygulaması
Metformin monoterapisi ile yeterli glisemik kontrol sağlanamayan hastalarda, ekleme tedavisi olarak günde iki kez uygulanan empagliflozine karşı günde bir kez empagliflozin uygulamasının (günlük 10 mg ve 25 mg dozları) etkililiği ve güvenliliği, 16 hafta süreli bir çift kör, plasebo kontrollü çalışmada değerlendirilmiştir. 16 hafta süreli tedaviden sonra, plaseboyla karşılaştırıldığında, tüm empagliflozin tedavileri HbA1c düzeylerinde başlangıca göre anlamlı düşmeler (toplam ortalama % 7,8) sağlamıştır. Metformin arka plan tedavisine eklenen empagliflozinin günde bir kez doz rejimine karşı, günde iki kez doz rejimi HbA1c düzeylerinde karşılaştırılabilir düşmelere yol açmıştır. HbA1c düzeylerindeki tedavi farklılığı, başlangıçtan
16. haftaya kadar; günde iki kez empagliflozin 5 mg dozuna karşı günde bir kez 10 mg dozu için % -0,02 (% 95 GA -0,16, 0,13) ve günde iki kez empagliflozin 12,5 mg dozuna karşı günde bir kez 25 mg dozu için de %-0,11 (% 95 GA -0,26, 0,03) olmuştur.
Kardiyovasküler sonuçlar
Çift kör, plasebo kontrollü EMPA-REG OUTCOME çalışmasında, tip 2 diyabeti ve belirlenmiş kardiyovasküler hastalığı olan hastalarda, standart tedaviye ek olarak empagliflozin 10 mg ve 25 mg havuzlanmış dozları plasebo ile karşılaştırılmıştır. Toplam 7.020 hasta tedavi edilmiş (empagliflozin 10 mg: 2.345, empagliflozin 25 mg: 2.342, plasebo: 2.333) ve medyan 3,1 yıl süreyle takip edilmiştir. Ortalama yaş 63, ortalama HbA1c % 8,1'dir ve hastaların % 71,5'i erkektir. Başlangıçta, hastaların % 74'ü metformin, % 48'i insulin, % 43'ü bir sülfonilüre ile tedavi edilmekteydi. Hastaların yaklaşık yarısında (% 52,2) eGFR 60-90 ml/dk/1,73 m, % 17,8'inde 45-60 ml/dk/1,73 m, % 7,7'sinde 30-45 ml/dk/1,73 m idi.
12. haftada başlangıç düzeyi ile kıyaslandığında HbA1c'de uyarlanmış ortalama (SE) iyileşme plasebo grubunda % 0,11 (0,02), empagliflozin 10 ve 25 mg gruplarında sırasıyla % 0,65 (0,02) ve % 0,71 (0,02) olarak gözlemlenmiştir. İlk 12 haftadan sonra glisemik kontrol araştırılan tedaviden bağımsız olarak optimize edilmiştir. Bu nedenle 94. haftada etki azalarak, uyarlanmış ortalama (SE) HbA1c değerindeki iyileşme, plasebo grubunda % 0,08 (0,02); empagliflozin 10 ve 25 mg gruplarında, sırasıyla,%0,5(0,02)ve%0,55(0,02)olarak saptanmıştır.
Empagliflozin, primer kombine sonlanım noktası olan kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmenin önlenmesinde, plaseboya göre üstün bulunmuştur. Tedavi etkisi, kardiyovasküler ölümde anlamlı bir azalma ile sağlanmış, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede anlamlı bir değişiklik olmamıştır. Kardiyovasküler ölümdeki azalma empagliflozin 10 mg ve empagliflozin 25 mg için karşılaştırılabilir bulunmuştur (Şekil 1) ve genel sağ kalım süresindeki iyileşme ile de doğrulanmıştır (Tablo 9). EMPA-REG OUTCOME çalışmasında empagliflozinin kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede primer birleşik sonlanım noktası üzerindeki etkisi, glisemik kontrolden veya renal fonksiyonundan (eGFR) büyük ölçüde bağımsız olmuştur ve genel olarak 30 ml/dakika/1,73m eGFR değerine kadar inen eGFR kategorileri arasında tutarlı olmuştur.
Kardiyovasküler mortaliteyi önlemedeki etkililiği, DPP-4 inhibitörü ile birlikte empagliflozin kullanan hastalarda veya siyah ırktan olanlarda tam olarak belirlenmemiştir, çünkü bu grupların EMPA-REG OUTCOME çalışmasındaki temsilleri sınırlıdır.
Tablo 9: Primer kompozit sonlanım noktası için tedavi etkisi, bileşenleri ve mortalite
| Plasebo | Empagliflozin |
N | 2.333 | 4.687 |
İlk KV ölüm, fatal olmayan MI veya fatal olmayan inme olayına kadar geçen süre N(%) | 282 (12,1) | 490 (10,5) |
Tehlike oranı, plaseboya karşı (% 95,02 GA) |
| 0,86 (0,74, 0,99) |
Üstünlük için p değeri |
| 0,0382 |
KV ölüm N (%) | 137 (5,9) | 172 (3,7) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,62 (0,49, 0,77) |
p değeri |
| <0,0001 |
Fatal olmayan MI N (%) | 121 (5,2) | 213 (4,5) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,87 (0,7, 1,09) |
p değeri |
| 0,2189 |
Fatal olmayan inme N (%) | 60 (2,6) | 150 (3,2) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 1,24 (0,92, 1,67) |
p değeri |
| 0,1638 |
Tüm nedenlere bağlı mortalite N (%) | 194 (8,3) | 269 (5,7) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,68 (0,57, 0,82) |
p değeri |
| <0,0001 |
KV olmayan mortalite N (%) | 57 (2,4) | 97 (2,1) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,84 (0,6, 1,16) |
KV: Kardiyovasküler, MI: Miyokard enfarktüsü
*Çalışmadan elde edilen veriler bir ara analize dahil edildiğinden, anlamlılık için 0,0498'den düşük bir p değerine karşılık gelen bir iki yanlı % 95,02 güven aralığı uygulanmıştır.
Şekil 1 EMPA-REG OUTCOME çalışmasında ilk kardiyovasküler ölüme kadar geçen zaman
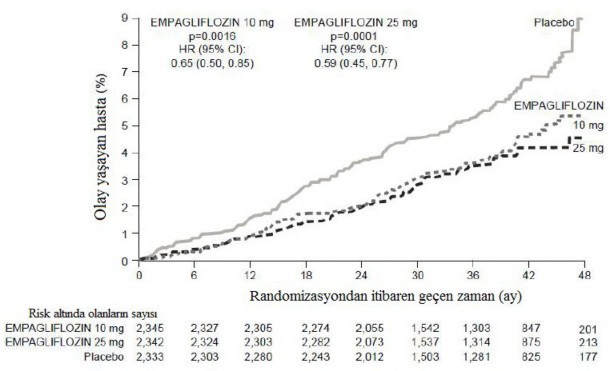
Her bir empagliflozin dozuna karşılık plasebo
Hastanede yatmayı gerektiren kalp yetmezliği
Hastanede yatmayı gerektiren kalp yetmezliği
EMPA-REG OUTCOME çalışmasında, empagliflozin, plaseboya kıyaslandığında, hastanede yatmayı gerektiren kalp yetmezliği riskini azaltmıştır (empagliflozin % 2,7; plasebo % 4,1; Tehlike Oranı 0,65, % 95 GA 0,5, 0,85).
Nefropati
UEMPA-REG OUTCOME çalışmasında, ilk nefropati olayına kadar geçen süre açısından, empagliflozine (% 12,7) karşı plasebo (% 18,8) için Tehlike Oranı, 0,61 (% 95 GA 0,53, 0,7) bulunmuştur.
Buna ek olarak, empagliflozin, başlangıçta makro-albuminürisi bulunan hastalarda, plaseboya (% 28,8), kıyasla, daha yüksek (Tehlike Oranı % 1,82, % 95 GA 1,4, 2,37) uzun süreli normo- albuminüri veya mikroalbuminüri (% 49,7)görülmüştür.
2 saatlik postprandiyal glikoz
Metformin veya metformin + sülfonilüre tedavisine eklenen empagliflozin ile yapılan tedavi,
24. haftadaki 2 saatlik postprandiyal glikoz değerinde (yemek tolerans testi) klinik olarak anlamlı iyileşme ile sonuçlanmıştır (metformine ekleme tedavisi, plasebo: +5,9 mg/dl, empagliflozin 10mg: -46mg/dl, empagliflozin 25 mg: -44,6 mg/dl; metformin + sülfonilüreye ekleme tedavisi, plasebo: -2,3 mg/dl, empagliflozin 10 mg: - 35,7 mg/dl, empagliflozin 25 mg:
-36,6 mg/dl).
Başlangıç HbA1c düzeyleri ≥% 9 olan hastalar
Başlangıç HbA1c düzeyleri ≥% 9 olan hastaların önceden tanımlanmış analizinde, metformine eklenen empagliflozin 10 mgveya25mg,24. haftadaHbA1cdüzeylerinde istatistiksel olarak
anlamlı azalmalarla sonuçlanmıştır (başlangıca göre uyarlanmış ortalama değişiklik, empagliflozin 25 mg için: % -1,49, empagliflozin 10 mg için: % -1,4 ve plasebo için: % -0,44).
Vücut ağırlığı
4 plasebo kontrollü çalışmanın önceden tanımlanmış havuz analizinde, empagliflozin tedavisi (hastaların % 68'i arka plan tedavisi olarak metformin almaktaydı) 24. haftada, plasebo ile karşılaştırıldığında, vücut ağırlığında azalma ile sonuçlanmış (empagliflozin 10 mg için
-2,04 kg, empagliflozin 25 mg için -2,26 kg ve plasebo için -0,24 kg) ve bu etki 52 haftaya kadar sürmüştür (empagliflozin 10 mg için -1,96 kg, empagliflozin 25 mg için -2,25 kg ve plasebo için -0,16 kg).
Kan basıncı
Tip 2 diyabetli ve yüksek kan basıncına sahip, farklı antidiyabetik ve 2 taneye kadar antihipertansif tedavi almakta olan hastalarda yürütülen, 12 hafta süreli bir çift kör, plasebo kontrollü çalışmada, empagliflozinin etkililiği ve güvenliliği değerlendirilmiştir. Günde bir kez empagliflozin tedavisi, HbA1c düzeylerinde ve 24 saatlik ortalama sistolik ve diyastolik kan basıncında (ambulatuvar kan basıncı izlemi ile tayin edilmiştir) istatistiksel olarak anlamlı iyileşmelerle sonuçlanmıştır (Tablo 10). Empagliflozin tedavisi oturma pozisyonundaki sistolik ve diyastolik kan basıncında düşme sağlamıştır.
Tablo 10: Tip 2 diyabeti olan ve kan basıncı kontrol edilemeyen hastalarda empagliflozinin 12 hafta süreli, plasebo kontrollü bir çalışmadaki etkililik sonuçları
| Plasebo | Empagliflozin | |
| 10 mg | 25 mg | |
N | 271 | 276 | 276 |
12. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 7,9 | 7,87 | 7,92 |
Başlangıca göre değişiklik | 0,03 | -0,59 | -0,62 |
Plaseboya göre farklılık (% 95 GA) |
| -0,62* (-0,72, -0,52) | -0,65* (-0,75, -0,55) |
12. haftada 24 saatlik sistolik kan basıncı | |||
Başlangıç (ortalama) | 131,72 | 131,34 | 131,18 |
Başlangıca göre değişiklik | 0,48 | -2,95 | -3,68 |
Plaseboya göre farklılık (% 95 GA) |
| -3,44* (-4,78, -2,09) | -4,16* (-5,5, -2,83) |
12. haftada 24 saatlik diyastolik kan basıncı | |||
Başlangıç (ortalama) | 75,16 | 75,13 | 74,64 |
Başlangıca göre değişiklik | 0,32 | -1,04 | -1,4 |
Plaseboya göre farklılık (% 95 GA) |
| -1,36** (-2,15,-0,56) | -1,72* (-2,51, -0,93) |
Başlangıç sistolik kan basıncı, başlangıç HbA1c, başlangıç eGFR, coğrafi bölge ve antihipertansif ilaç sayısına göre uyarlanmış ortalama
ilaç sayısına göre uyarlanmış ortalama
* p değeri<0,0001
** p değeri < 0,001 GA: Güven aralığı
4 plasebo kontrollü çalışmanın önceden belirlenmiş, havuzlanmış analizinde, 24. haftada, plasebo (-0,5 mmHg) ile karşılaştırıldığında, empagliflozin tedavisi (hastaların % 68'i arka planda metformin tedavisi almaktadır), sistolik (empagliflozin 10 mg için -3,9 mmHg, empagliflozin 25 mg için -4,3 mmHg) ve diyastolik kan basıncını (empagliflozin 10 mg için
-1,8 mmHg, empagliflozin 25 mg için -2 mmHg) düşürmüştür, bu etki 52. haftaya kadar sürmüştür.
Metformin
Prospektif randomize (UKPDS) çalışma, tip 2 diyabette sıkı kan glikozu kontrolünün uzun dönemdeki yararlarını ortaya koymuştur. Fazla kilolu olan ve tek başına diyetle başarısız olduktan sonra metformin ile tedavi edilen kişilerde elde edilen sonuçların analizleri şunları göstermiştir:
Diyabetle ilişkili herhangi bir komplikasyon açısından mutlak riskte anlamlı bir azalma, metformin grubunda 29,8 olay/1.000 hasta yılı iken, tek başına diyet grubunda 43,3 olay/1.000 hasta yılı, (p=0,0023) ve sülfonilüre ile insülin monoterapisi gruplarının kombinasyonu ile 40,1 olay/1.000 hasta yılı; (p=0,0034),
Diyabetle ilişkili herhangi bir mortalite açısından mutlak riskte anlamlı bir azalma: metformin 7,5 olay/1.000 hasta yılı, tek başına diyet 12,7 olay/1.000 hasta yılı, p=0,017
Genel mortalite açısından mutlak riskte anlamlı bir azalma: Metformin 13,5 olay/1.000 hasta yılı iken, tek başına diyet ile: 20,6 olay/1.000 hasta yılı, (p=0,011) ve sülfonilüre ile insülin monoterapi gruplarının kombinasyonu ile 18,9 olay/1.000 hasta yılı, (p=0,021),
Miyokard enfarktüsü açısından mutlak riskte anlamlı bir azalma: Metformin 11 olay/1.000 hasta yılı, tek başına diyet: 18 olay/1.000 hasta yılı, (p=0,01).
Pediyatrik popülasyon
Avrupa İlaç Ajansı, tip 2 diyabette pediyatrik popülasyonun tüm alt tiplerinde SYNJARDY ile yapılan çalışmaların sonuçlarını sağlama zorunluluğunu kaldırmıştır (pediyatrik kullanım ile ilgili bilgi için Bölüm 4.2'ye bakınız).
5.2. Farmakokinetik özellikler
SYNJARDY
Sağlıklı kişilerde yapılan biyoeşdeğerlik çalışmalarının sonuçları SYNJARDY (empagliflozin/metformin hidroklorür) 5 mg/850 mg, 5 mg/1.000 mg, 12,5 mg/850 mg ve 12,5 mg/1.000 mg kombine tabletlerin, ayrı ayrı tabletler şeklinde alınan empagliflozin ve metforminin karşılık gelen dozlarda eş zamanlı uygulanması ile biyoeşdeğer olduğunu göstermiştir.
Empagliflozin/metformin 12,5 mg/1.000 mg dozunun tokluk koşullarında uygulanması, açlık koşulları ile karşılaştırıldığında, empagliflozinin EAA değerinde % 9 ve Cdeğerinde % 28 azalma oluşturmuştur. Açlık koşullarıyla karşılaştırıldığında, metformin için, EAA değeri % 12 ve Cdeğeri % 26 azalmıştır. Yiyeceklerin empagliflozin ve metformin üzerindeki gözlenen
etkisi, klinik olarak anlamlı kabul edilmemiştir. Bununla birlikte, metformin yiyeceklerle birlikte önerildiği için, SYNJARDY de yiyeceklerle birlikte önerilmiştir.
İzleyen ifadeler SYNJARDY formülündeki her bir aktif maddenin farmakokinetik özelliklerini yansıtır.
Genel özellikler
Empagliflozin
Emilim:
Empagliflozinin farmakokinetiği, sağlıklı gönüllülerde ve tip 2 diyabetli hastalarda ayrıntılı olarak incelenmiştir. Empagliflozin, oral uygulamadan sonra hızla absorbe edilir, pik plazma konsantrasyonlarına ulaşma zamanı, dozun verilmesinden sonra, medyan t1,5 saattir. Sonrasında, hızlı bir dağılım fazı ile plazma konsantrasyonları bifazik tarzda azalır, terminal faz görece olarak yavaştır. Kararlı durum ortalama plazma EAA ve Cdeğerleri, günde bir kez empagliflozin 10 mg için sırası ile 1.870 nmol.sa/L ve 259 nmol/L ve günde bir kez empagliflozin 25 mg için 4.740 nmol.sa/L ve 687 nmol/L'dir. Sistemik empagliflozin maruziyeti dozla orantılı bir şekilde artmıştır. Empagliflozinin tek doz ve kararlı durum farmakokinetik parametreleri zamana göre lineer farmakokinetiği düşündürecek şekilde benzerdir. Sağlıklı gönüllülerle tip 2 diyabeti olan hastalar arasında, empagliflozinin farmakokinetiği açısından, klinik olarak anlamlı bir farklılık yoktur.
Günde iki kez 5 mg ve günde bir kez 10 mg empagliflozinin farmakokinetiği, sağlıklı gönüllülerde karşılaştırılmıştır. Empagliflozinin 24 saat boyunca genel maruziyeti (EAA), günde iki kez 5 mg ve günde bir kez 10 mg empagliflozin uygulamaları arasında benzerdir. Beklendiği gibi, günde iki kez 5 mg uygulama, günde bir kez 10 mg empagliflozin uygulaması ile karşılaştırıldığında, daha düşük bir Cve daha yüksek bir çukur plazma empagliflozin konsantrasyonu (C) ile sonuçlanmıştır.
Empagliflozin 25 mg'ın yüksek oranda yağlı ve yüksek kalorili bir yemekten sonra verilmesi maruziyette hafif bir azalma ile sonuçlanmıştır: Açlık koşulları ile karşılaştırıldığında, EAA yaklaşık % 16 ve Cyaklaşık % 37 oranında azalmıştır. Yiyeceklerin empagliflozin farmakokinetiğine gözlenen etkisi, klinik olarak anlamlı kabul edilmemiştir ve empagliflozin yiyeceklerle birlikte veya ayrı olarak kullanılabilir. SYNJARDY (empagliflozin/metformin) kombine tabletler de yüksek oranda yağlı ve yüksek kalorili bir yemekle birlikte verildiğinde benzer sonuçlar elde edilmiştir.
Dağılım:
Popülasyon farmakokinetiği analizlerine dayanarak, dağılımın görünür kararlı durum hacmi 73,8 L olarak tahmin edilmiştir. Oral [C]-empagliflozin çözeltisinin sağlıklı gönüllülere uygulanmasından sonra, eritrosit partitisyonu yaklaşık % 37 ve plazma proteinlerine bağlanma oranı % 86 olmuştur.
Biyotransformasyon:
İnsan plazmasında empagliflozinin, ilaçla ilişkili toplam materyalin en az % 10'u şeklinde tanımlanan herhangi bir majör metaboliti tespit edilmemiştir ve en fazla bulunan metabolitler, üç glukuronid konjügatıdır (2-, 3- ve 6-O-glukuronid). In vitro çalışmalar, insanlarda empagliflozinin primer metabolizma yolunun, üridin 5'-difosfo-glukuronosiltransferazlar olan UGT2B7, UGT1A3, UGT1A8ve UGT 1A9ileglukuronidasyon olduğunu düşündürmüştür.
Eliminasyon:
Popülasyon farmakokinetik analizlerine dayanarak, empagliflozinin görünür terminal eliminasyon yarılanma ömrünün 12,4 saat ve görünür oral klirensin 10,6 L/sa olduğu tahmin edilmiştir. Empagliflozinin oral klirensi için kişiler-arası ve rezidüel değişkenlikler, sırası ile % 39,1 ve % 35,8'dir. Günde bir doz uygulama ile, empagliflozinin kararlı durum plazma konsantrasyonuna 5. dozda ulaşılır. Yarılanma ömrü ile tutarlı şekilde, kararlı durumda plazma EAA açısından % 22'e kadar birikim görülür. Oral [C]-empagliflozin çözeltisinin sağlıklı gönüllülere uygulanmasından sonra, ilaçla ilgili radyoaktivitenin yaklaşık % 96'sı feçesle (% 41) veya idrarla (% 54) elimine edilir. Feçese geçen ilaçla ilgili radyoaktivitenin büyük kısmı ve idrara geçen ilaçla ilgili radyoaktivitenin yaklaşık yarısı değişmemiş ana ilaçtır.
Doğrusallık/ doğrusal olmayan durum
Empagliflozin doğrusal farmakokinetik profil gösterir. Metformin doğrusal olmayan farmakokinetik profil gösterir.
Hastalardaki karakteristik özellikler
Böbrek Yetmezliği:
Hafif, orta veya şiddetli böbrek yetmezliği olan hastalarda (kreatinin klirensi <30-<90 ml/dk) ve böbrek yetmezliği/son dönem böbrek yetmezliği olan hastalarda, böbrek fonksiyonları normal olan gönüllülerle karşılaştırıldığında, empagliflozinin EAA değerleri, sırası ile, yaklaşık olarak % 18, % 20, % 66 ve % 48 artmıştır. Empagliflozinin pik plazma düzeyleri, böbrek fonksiyonları normal olan gönüllülerle karşılaştırıldığında, orta derecede böbrek yetmezliği olan hastalarla, böbrek yetmezliği/son dönem böbrek yetmezliği olan hastalarda benzerdir. Empagliflozinin pik plazma düzeyleri, böbrek fonksiyonları normal olan gönüllülerle karşılaştırıldığında, hafif ve şiddetli böbrek yetmezliği olan hastalarda kabaca % 20 oranında daha yüksektir. Popülasyon farmakokinetik analizleri, empagliflozinin görünür oral klirensinin, düşen kreatinin klirensi ile birlikte düştüğünü ve bunun sonucu olarak ilaç maruziyetinin arttığını göstermiştir.
Karaciğer Yetmezliği:
Child-Pugh sınıflandırmasına göre hafif, orta ve şiddetli karaciğer yetmezliği olan hastalarda, karaciğer fonksiyonları normal olan gönüllülerle karşılaştırıldığında, empagliflozinin EAA değerleri, sırası ile, yaklaşık % 23, % 47 ve % 75 ve Cdeğerleri, sırası ile, yaklaşık % 4,
% 23 ve % 48 oranında artmıştır.
Vücut kitle indeksi:
Popülasyon farmakokinetik analizlerine dayanarak, vücut kitle indeksinin empagliflozinin farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi yoktur. Bu analizde, vücut kitle indeksi 25 kg/m olan gönüllülerle karşılaştırıldığında, vücut kitle indeksleri 30, 35 ve 45 kg/m olan gönüllülerde, EAA sırası ile % 5,82, % 10,4 ve % 17,3 oranında daha düşük tahmin edilmiştir.
Cinsiyet:
Popülasyon farmakokinetik analizlerine dayanarak, cinsiyetin empagliflozin farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi yoktur.
Irk:
Popülasyon farmakokinetik analizlerinde EAA, vücut kitle indeksi 25 kg/m olan Asyalılarda, vücut kitle indeksi 25 kg/m olan Asyalı olmayanlara göre, % 13,5 oranında daha yüksek tahmin edilmiştir.
Geriyatrik popülasyon:
Popülasyon farmakokinetik analizlerine dayanarak, yaşın empagliflozinin farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi yoktur.
Pediyatrik popülasyon:
Pediyatrik bir Faz I çalışması empagliflozinin (5mg, 10mg ve 25mg) Tip 2 diabetes mellitusu olan çocuklar ve adölesanlardaki (≥10 - <18 yaş) farmakokinetiğini ve farmakodinamiğini incelemiştir. Gözlenen farmakokinetik ve farmakodinamik yanıtlar erişkin gönüllülerde bulunan yanıtlarla tutarlıdır.
Metformin
Emilim
Metforminin oral doz uygulamasından sonra, tdeğerine 2,5 saatte ulaşılır. 500 mg veya 850 mg metformin hidroklorür tabletin mutlak biyoyararlanımı, sağlıklı gönüllülerde yaklaşık
% 50-60'tır. Oral bir dozdan sonra, feçeste elde edilen absorbe edilmemiş fraksiyonun oranı
% 20-30'dur. Oral uygulama sonrasında metforminin absorbsiyonu tam değildir ve doyurulabilir. Metformin absorbsiyonunun farmakokinetiğinin non-lineer olduğu varsayılır. Önerilen metformin dozlarında ve dozlama programında, kararlı durum plazma konsantrasyonlarına 24-48 saat içinde ulaşılır ve genellikle 1 mikrogram/ml'den düşüktür. Kontrollü klinik çalışmalarda, metforminin maksimum plazma düzeyleri (C), maksimum dozlarda bile, 5 mikrogram/ml'yi aşmamıştır.
Yiyecekler, metformin absorbsiyonunun miktarını azaltır ve hafif oranda geciktirir. 850 mg metformin HCl uygulanmasından sonra, % 40 oranında daha düşük pik plazma konsantrasyonu, EAA'da % 25 azalma ve pik plazma konsantrasyonuna kadar geçen zamanda 35 dakikalık bir uzama gözlenmiştir. Bu azalmaların klinik anlamı bilinmemektedir.
Dağılım
Plazma proteinlerine bağlanma ihmal edilebilir oranlardadır. Metformin eritrositlere partisyon gösterir. Kan piki plazma pikinden daha düşüktür ve yaklaşık olarak aynı zamanda oluşur. Büyük olasılıkla eritrositler ikincil bir dağılım kompartmanını temsil eder. Ortalama dağılım hacmi (Vd) 63-276 L arasındadır.
Biyotransformasyon
Metformin değişmeden idrarla atılır. İnsanlarda metaboliti tanımlanmamıştır.
Eliminasyon
Metforminin renal klirensi >400 ml/dk'dır, metforminin glomerüler filtrasyon ve tübüler sekresyon ile elimine edildiğini gösterir. Oral dozu takiben, görünür terminal eliminasyon yarılanma ömrü yaklaşık 6,5 saattir.
Hastalardaki karakteristik özellikler
Pediyatrik popülasyon:
Tek doz çalışması: Metformin hidroklorür 500 mg tek dozundan sonra, pediyatrik hastalarda, erişkin sağlıklı gönüllülerde gözlenen farmakokinetik profilin benzeri görülmüştür.
Çoklu doz çalışması: Pediyatrik hastalarda 7 gün süre ile, günde iki kez 500 mg tekrarlı doz uygulanmasından sonra, diyabetik erişkinlerde 14 gün süre ile günde iki kez 500 mg tekrarlı doz uygulaması ile karşılaştırıldığında, pik plazma konsantrasyonu (C) ve sistemik maruziyet (EAA), sırası ile, yaklaşık olarak % 33 ve % 40 oranında düşmüştür. Doz, bireysel glisemik kontrole göre ayarlandığında bu durumun klinik önemi sınırlıdır.
5.3. Klinik öncesi güvenlilik verileri
Empagliflozin ve metformin
Genel toksisite çalışmaları, empagliflozin ve metformin kombinasyonu ile sıçanlarda, 13 haftaya kadar süreyle yapılmış ve tek başına empagliflozin ve metformin için belirlenmiş olanlara ek hiçbir hedef organ saptanmamıştır. Renal fizyoloji, elektrolit dengesi ve asit/baz durumu üzerine etkiler gibi bazı cevaplar kombinasyon tedavisi ile artmıştır. Ancak, sadece hipokloremi, empagliflozin ve metforminin önerilen maksimum dozlarıyla oluşan klinik EAA maruziyetinin, sırasıyla, yaklaşık 9 ve 3 katı maruziyette advers olarak kabul edilmiştir.
Gebe sıçanlarda yapılan bir embriyofetal gelişim çalışması, birlikte kullanılan empagliflozin ve metformine bağlanabilecek herhangi bir teratojenik etkiyi göstermemiştir. Bu çalışmadaki maruziyet düzeyleri, empagliflozinin en yüksek dozu için geçerli klinik EAA maruziyetinin yaklaşık 14 katı ve metforminin 2000 mg dozu için geçerli klinik EAA maruziyetinin 4 katıdır.
Empagliflozin
Konvansiyonel güvenlilik farmakolojisi, genotoksisite, fertilite ve erken embriyonik gelişim çalışmalarına dayanan klinik dışı veriler, insanlara özgü bir tehlikeyi göstermemiştir.
Kemirgenlerde ve köpeklerde yapılan uzun dönem toksisite çalışmalarında, empagliflozinin klinik dozunun 10 katı ve daha üstündeki dozlarda toksisite belirtileri gözlenmiştir. Toksisitenin büyük kısmı, idrarla glikoz kaybı ve elektrolit dengesizlikleriyle ilişkili sekonder farmakoloji ile tutarlıdır ve şunları da içerir: Vücut ağırlığında ve vücut yağında azalma, yiyecek tüketiminin artması, diyare, dehidratasyon, serum glikozunda düşme, protein metabolizması ve glikoneojenezin arttığını gösteren diğer serum parametrelerinde artışlar, poliüri ve glikozüri gibi idrarla ilgili değişikler, böbrekler ile bazı yumuşak ve vasküler dokuların mineralizasyonu dahil mikroskopik değişiklikler. Bazı türlerde böbreklerde gözlenen abartılı farmakolojik etkilerin mikroskobik kanıtları arasında tübüler dilatasyon ve tübüler ve pelvik mineralizasyon bulunur ve empagliflozinin klinik EAA maruziyetinin yaklaşık 4 katı maruziyet düzeylerinde ve 25 mg dozla ortaya çıkmıştır.
Empagliflozin genotoksik değildir.
2 yıl süreli bir karsinojenite çalışmasında empagliflozin, dişi sıçanlarda, en yüksek doz olan 700 mg/kg/gün dozlara kadar tümör insidansını arttırmamıştır. Bu doz, empagliflozinin maksimum klinik EAA maruziyetinin yaklaşık 72 katına karşılık gelmektedir. Erkek sıçanlarda, en yüksek dozda, mezenterik lenf düğümlerinin selim vasküler proliferatif lezyonları (hemanjiyomlar) gözlenmiştir.Ancakempagliflozininmaksimum klinik maruziyetinin
yaklaşık 26 katına karşılık gelen 300 mg/kg/gün dozlarında böyle bir etki gözlenmemiştir. Testislerdeki interstisyel hücre tümörleri, sıçanlarda, 300 mg/kg/gün ve daha üstündeki dozlarda daha yüksek insidanslarda gözlenmiştir, ancak, empagliflozinin maksimum klinik maruziyetinin yaklaşık 18 katına karşılık gelen 100 mg/kg/gün dozlarında görülmemiştir. Her iki tümör tipi de sıçanlarda yaygındır ve insanlarla ilişkili olması beklenmez.
Dişi farelerde, empagliflozin, maksimum klinik maruziyetinin yaklaşık 62 katına karşılık gelen
1.000 mg/kg/gün dozlara kadar tümör insidansını arttırmamıştır. Empagliflozin, erkek farelerde
1.000 mg/kg/gün dozda renal tümörleri indüklemiştir, ancak empagliflozinin maksimum klinik maruziyetinin yaklaşık 11 katına karşılık gelen 300 mg/kg/gün dozda bu etki gözlenmemiştir. Bu tümörlerin oluşum mekanizması, erkek farede böbrek patolojisine bağlı doğal predispozisyonuna ve metabolik yolağa bağlıdır ve insanlardaki durumu yansıtmaz. Erkek fare böbrek tümörlerinin insanlarla ilişkili olmadığı düşünülmüştür.
İnsanlarda terapötik dozlardan sonra meydana gelen maruziyet miktarına uygun maruziyetlerde, empagliflozinin fertilite veya erken embriyonik gelişim üzerinde advers bir etki ortaya çıkmamıştır. Organogenezis sırasında uygulanan empagliflozin teratojenik değildir. Empagliflozin sıçanlarda, sadece maternal toksik dozlarda, kaburga kemiklerinde eğriliğe ve tavşanlarda embriyofetal kayıplarda artışa neden olmuştur.
Sıçanlarda, prenatal ve postnatal toksisite çalışmalarında, empagliflozinin maksimum klinik maruziyetinin yaklaşık 4 katına karşılık gelen maternal maruziyetlerde, yavruların kilo almasında azalma gözlenmiştir. Empagliflozinin maksimum klinik maruziyetine eşdeğer olan sistemik maruziyetlerde böyle bir etki gözlenmemiştir. Bu bulguların insanlarla ilişkisi belli değildir.
Genç sıçanlarda yürütülen bir toksisite çalışmasında, empagliflozin doğumdan sonraki 21. günden 90. güne kadar uygulandığında, advers olmayan, minimal-hafif renal tübüler ve pelvik dilatasyon, sadece 100 mg/kg/gün dozda (maksimum klinik doz olan 25 mg'ın yaklaşık 11 katı) görülmüştür. Bu bulgular, 13 haftalık ilaç uygulanmayan kendine gelme periyodundan sonra yok olmuştur.
Metformin
Konvansiyonel güvenlilik farmakolojisi, doz toksisitesi, genotoksisite, karsinojenik potansiyel veya üreme toksisitesi çalışmalarında elde edilen preklinik veriler, insanlara özel bir tehlikeyi göstermemiştir. Wistar Hannover sıçanlarına verilen, 500 mg/kg/gün doz seviyelerinde (bu doz metforminin insanlar için önerilen maksimum metformin dozunun 7 katına tekabül eder) metformin ile, iskelet malformasyonlarının sayısında artışla ortaya çıkan teratojenite gözlenmiştir.
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Satış Fiyatı | 857.04 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 857.04 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693090164 |
| Etkin Madde | Empagliflozin + Metformin Hidroklorür |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |