TAFINLAR 75 mg 120 kapsül { Novartis } Kısa Ürün Bilgisi
{ Dabrafenib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
TAFİNLAR 75 mg kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir kapsül 75 mg dabrafenibe eşdeğer 88,88 mg dabrafenib mesilat içerir.Yardımcı maddeler
Yardımcı maddeler için 6.1.'e bakınız.
3. FARMASÖTİK FORMU
Sert kapsül (kapsül).
Üzeri “GS LHF ve “75 mg†baskılı opak, koyu pembe renkli kapsüller.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
TAFİNLAR, daha önce herhangi bir RAF yolağı inhibitörü kullanmamış, ECOG performans skoru 0-1 olan, lokal tedaviler sonrası nüks eden ve tekrar lokal tedavilerin kullanılmadığı relaps veya metastatik BRAF V600 mutasyonu pozitif olan malign melanom hastaların tedavisinde tek ajan olarak veya trametinib ile kombinasyon halinde progresyona kadar kullanımda endikedir.
TAFİNLAR, trametinib ile kombinasyon halinde BRAF V600 E mutasyonlu Evre III melanomu olan yetişkin hastaların, tam rezeksiyonu takiben adjuvan tedavisi için en fazla 12 ay süreyle kullanılır. Bu süre içerisinde progresyon gelişen hastalarda tedavi kesilir. Tafinlar, tek başına kullanılamaz.
BRAF V600 E mutasyonu akredite laboratuvarda saptanmış olup EGFR veya ALK mutasyonu olmayan veya bilinmeyen, ECOG performans durumu 0-1, kemik iliği rezervi yeterli olan (nötrofil sayısı 1500, trombosit sayısı 100000 üzerinde olan), karaciğer ve renal fonksiyonları yeterli olan (ALT, AST, bilirubin ve serum kreatinin normalin en fazla 1,5 katı olan) lokal ileri veya metastatik akciğer adenokanserli hastaların sol ventrikül ejeksiyon fraksiyonu normal sınırlarda olması durumunda trametinib ile birlikte progresyona kadar kullanımında endikedir. Tafinlar, tek başına kullanılamaz.
4.2. Pozoloji ve uygulama şekli
TAFİNLAR tedavisine konusunda uzman ve antikanser tıbbi ürünlerin kullanımında deneyimli bir hekim tarafından başlanmalı ve yakından takip edilmelidir.
TAFİNLAR'ı kullanmadan önce malign melanom hastalarının BRAF V600 ve küçük hücreli dışı akciğer kanseri (KHDAK) hastalarının BRAF V600 E mutasyonuna sahip oldukları geçerliliği kanıtlanmış bir test kullanılarak doğrulanmalıdır.
TAFİNLAR'ın etkililik ve güvenliliği yabanıl tip (wild-type) BRAF melanomu veya yabanıl tip BRAF KHDAK'si olan hastalarda gösterilmemiştir, bu nedenle TAFİNLAR yabanıl tip BRAF melanom hastalarında ya da yabanıl tip BRAF KHDAK hastalarında kullanılmamalıdır (bkz. Bölüm 4.4 ve 5.1).
Pozoloji:
İster monoterapi olarak ister trametinib ile kombinasyon halinde uygulansın, önerilen TAFİNLAR dozu günde iki kez 150 mg'dır (günde iki kez 75 mg'lık iki kapsül; 300 mg toplam
günlük dozuna karşılık gelir). TAFİNLAR ile kombinasyon halinde uygulandığında önerilen trametinib dozu günde bir kez (QD) 2 mg'dır.
Uygulama sıklığı ve süresi:
Tedavi hasta daha fazla fayda görmeyene veya kabul edilemez toksisite gelişinceye kadar devam ettirilmelidir (bkz. Tablo 2). Adjuvan melanom durumunda, hastalar hastalık nüksü veya kabul edilemez toksisite görülmediği müddetçe 12 aylık bir süre boyunca tedavi edilmelidir.
Atlanan dozlar
Eğer bir TAFİNLAR dozu alınmamışsa ve diğer doza 6 saatten daha az bir süre kaldıysa, unutulan doz alınmamalıdır.
Eğer TAFİNLAR trametinib ile kombinasyon halinde uygulanırken, bir doz trametinib alınmamışsa; unutulan trametinib dozu sadece diğer trametinib dozuna 12 saatten daha fazla bir süre varsa alınmalıdır.
Doz modifikasyonu
Doz modifikasyonu gereksinimlerini etkili bir şekilde yönetmek için 50 mg ve 75 mg'lık iki TAFİNLAR kapsül formu bulunmaktadır.
Advers reaksiyonların yönetimi, tedaviye ara verilmesini, doz azaltılmasını veya tedavinin bırakılmasını gerektirebilir (bkz. Tablolar 1 ve 2).
Kutanöz skuamöz hücreli karsinom (cuSCC) veya yeni primer melanom advers reaksiyonlarında doz modifikasyonları veya doza ara vermeler önerilmez (bkz. Bölüm 4.4).
Oküler enflamasyon etkili lokal tedavilerle kontrol altına alınabildiği sürece üveit için doz modifikasyonu gerekmemektedir. Üveit lokal oküler tedaviye yanıt vermezse, oküler enflamasyon iyileşene kadar TAFİNLAR kesilir ve daha sonra bir doz düzeyi düşürülerek TAFİNLAR tekrar başlanır (bkz. Bölüm 4.4).
Önerilen doz seviyesi azaltmaları ve önerilen doz modifikasyonları sırasıyla Tablo 1 ve Tablo 2'de verilmiştir.
Tablo 1 Önerilen doz seviyesi azaltımları
Doz Seviyesi | TAFİNLAR dozu Monoterapi veya trametinib ile kombinasyon halinde kullanılırken | Trametinib dozu * Sadece TAFİNLAR ile kombinasyon halinde kullanılırken |
Başlangıç dozu | Günde iki kez 150 mg | Günde bir kez 2 mg |
Birinci doz azaltımı | Günde iki kez 100 mg | Günde bir kez 1,5 mg |
İkinci doz azaltımı | Günde iki kez 75 mg | Günde bir kez 1 mg |
Üçüncü doz azaltımı | Günde iki kez 50 mg | Günde bir kez 1 mg |
Monoterapi olarak veya trametinible kombinasyon halinde uygulanan günde iki kez 50 mg altındaki TAFİNLAR için doz ayarlaması önerilmemektedir. Dabrafenible kombinasyon halinde kullanıldığı zaman günde bir kez 1 mg altındaki trametinib için doz ayarlaması önerilmemektedir. | ||
* Trametinib monoterapisine yönelik doz uygulama talimatları için bkz. Trametinib KÜB, Pozoloji ve uygulama şekli.
Tablo 2 Herhangi bir Advers Olay (AO) derecesine göre TAFİNLAR doz modifikasyon şeması (pireksi hariç)
Derece CTC-AO* | Önerilen TAFİNLAR doz modifikasyonu |
| Monoterapi veya trametinib ile kombinasyon halinde kullanılırken |
Derece 1 veya Derece 2 (Tolere edilebilir) |
Tedaviye devam ediniz ve klinik olarak izleyiniz. |
Derece2 (Tolere edilemez) veya Derece 3 | Toksisite derece 1-0 olana kadar tedaviye ara veriniz ve tedaviye başlarken dozu bir seviye düşürünüz. |
Derece 4 | Kalıcı olarak tedaviyi kesiniz veya derece 1-0 olana kadar tedaviye ara veriniz ve tedaviye başlarken dozu bir seviye düşürünüz. |
* Klinik advers olayların şiddeti Advers Olaylar için Ortak Terminoloji Kriteri (CTC-AO) v4.0 ile derecelendirilmiştir.
Hastanın advers reaksiyonlarının etkili şekilde yönetildiği durumda, doz düşürülmesinde izlenen adımlar doz yükseltilmesinde de göz önünde bulundurulabilir. TAFİNLAR dozu günde 2 kez 150 mg'ı geçmemelidir.
Pireksi
Hastanın ateşi ≥38ºC ise tedaviye ara verilmelidir (monoterapi olarak kullanıldığında dabrafenib ve kombinasyon halinde kullanıldığında hem dabrafenib hem de trametinib). Nüks durumunda, pireksinin ilk belirtisinde de tedavi kesilebilir. İbuprofen veya asetaminofen/parasetamol gibi ateş düşürücü ilaçlarla tedaviye başlanmalıdır. Ateş düşürücü ilaçların yetersiz kaldığı durumlarda oral kortikosteroid kullanımı düşünülmelidir. Hastalar enfeksiyon belirti ve semptomları açısından değerlendirilmeli ve gerekirse yerel uygulamalara göre tedavi edilmelidir (bkz. Bölüm 4.4). Eğer hasta en az 24 saat süreyle semptomsuzsa (1) aynı doz seviyesinde veya
(2) ateş tekrarlıyorsa ve/veya dehidratasyon, hipotansiyon veya böbrek yetmezliği gibi başka semptomlar eşlik ediyorsa, dabrafenib veya kombinasyon halinde kullanıldığında hem dabrafenib hem de trametinib bir doz seviyesinde azaltılarak yeniden başlatılmalıdır.
TAFİNLAR, trametinib ile kombinasyon halinde kullanıldığında tedavi ile ilişkili toksisiteler ortaya çıkarsa, eşzamanlı olarak iki tedavide de doz azaltımı yapılmalı, tedavilere ara verilmeli ya da tedaviler kesilmelidir. İki tedaviden sadece birinde doz modifikasyonların gerekli olduğu istisnai durumlar üveit, RAS mutasyonu pozitif kutanöz olmayan maligniteler (temelde TAFİNLAR ile ilişkili), sol ventriküler ejeksiyon fraksiyonu (LVEF) azalması, retinal ven tıkanıklığı (RVO), retinal pigment epitel dekolmanı (RPED) ve interstisyel akciğer hastalığı (ILD)/pnömoni (temelde trametinib ile ilişkili) için aşağıda detaylı tarif edilmektedir.
Belirli advers reaksiyonlarda doz modifikasyonu için istisnai durumlar (iki tedaviden sadece birinde dozun azaltıldığı durumlar)
Üveit
Oküler enflamasyon, etkili lokal tedaviler ile kontrol edebildiği sürece üveit için herhangi bir doz modifikasyonu gerekmez. Eğer üveit lokal oküler tedaviye yanıt vermezse, oküler enflamasyon iyileşene kadar TAFİNLAR durdurulmalıdır ve ardından bir doz düzeyi azaltılarak TAFİNLAR yeniden başlatılmalıdır. TAFİNLAR ile kombinasyon halinde alındığında trametinib için doz modifikasyonu gerekli değildir (bkz. Bölüm 4.4).
RAS mutasyonu pozitif kutanöz dışı maligniteler
RAS mutasyonu pozitif kutanöz dışı maligniteleri olan hastalarda TAFİNLAR tedavisine devam etmeden önce faydaları ve riskleri göz önünde bulundurulmalıdır. TAFİNLAR ile kombinasyon halinde alındığında trametinib için doz modifikasyonu gerekli değildir.
Sol ventrikül ejeksiyon fraksiyonu (LVEF) azalması/Sol ventrikül fonksiyon bozukluğu
Eğer TAFİNLAR, trametinib ile kombinasyon halinde kullanılıyorsa ve LVEF değerinde başlangıca göre >%10 mutlak düşüş varsa ve ejeksiyon fraksiyonu kurumsal normalin alt
sınırından (LLN) daha düşükse, trametinib doz modifikasyonları talimatları için lütfen trametinib KÜB'üne başvurunuz (bkz. Bölüm 4.2). Trametinib ile kombinasyon halinde alındığında TAFİNLAR için doz modifikasyonu gerekli değildir.
Retinal ven tıkanması (RVO) ve retinal pigment epitelyum dekolmanı (RPED)
Eğer hastalar TAFİNLAR ile trametinib kombinasyon tedavisi sırasında herhangi bir zamanda azalmış santral görüş, bulanık görüş ya da görüş kaybı gibi yeni görsel bozukluklar bildirirse, trametinib doz modifikasyonları talimatları için lütfen trametinib KÜB'üne başvurunuz (bkz. Bölüm 4.2). Doğrulanmış RVO veya RPED olgularında trametinib ile kombinasyon halinde alındığında TAFİNLAR için doz modifikasyonu gerekli değildir.
İnterstisyel akciğer hastalığı (ILD)/Pnömoni
Yeni veya progresif pulmoner semptomlar ve öksürük, dispne, hipoksi, plevral efüzyon veya infiltratı da içeren bulguları olan hastalar dahil ILD veya pnömoni şüphesi olan hastalarda, klinik tetkiklerin sonuçları gelene kadar trametinib doz modifikasyonları talimatları için lütfen trametinib KÜB'üne başvurunuz (bkz. Bölüm 4.2). ILD veya pnömoni olgularında trametinib ile kombinasyon halinde alındığında TAFİNLAR için doz modifikasyonu gerekli değildir.
Uygulama şekli:
TAFİNLAR oral yolla kullanım içindir. TAFİNLAR kapsüller su ile bütün olarak yutulmalıdır. Kapsüller çiğnenmemeli veya açılmamalı ve TAFİNLAR'ın kimyasal instabilitesi nedeni ile yiyecek veya içecek ile karıştırılmamalıdır.
TAFİNLAR dozunun her gün benzer saatlerde, dozlar arasında yaklaşık 12 saatlik bir süre bırakılarak alınması önerilir. TAFİNLAR ve trametinib kombinasyon halinde alındığında, trametinibin günlük tek tozu her gün aynı saatte, TAFİNLAR'ın ya sabah dozuyla ya da akşam dozuyla birlikte alınmalıdır.
TAFİNLAR bir öğünden en az bir saat önce veya en az 2 saat sonra alınmalıdır.
Eğer hasta TAFİNLAR aldıktan sonra kusarsa hasta dozu tekrar almamalı ve bir sonraki programlı dozu almalıdır.
Trametinibin TAFİNLAR ile kombinasyon halinde verildiğinde uygulama yöntemi için lütfen trametinib KÜB'üne başvurunuz.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Hafif veya orta dereceli renal bozukluğu olan hastalarda doz ayarlamasına gerek yoktur. Ağır renal bozukluğu olan hastalarda klinik veri yoktur ve doz ayarlaması için potansiyel ihtiyaç tespit edilememiştir (bkz. Bölüm 5.2). TAFİNLAR, monoterapi olarak ya da trametinib ile kombinasyon halinde, ağır renal bozukluğu olan hastalarda dikkatli kullanılmalıdır.
Karaciğer yetmezliği:
Hafif hepatik bozukluğu olan hastalarda doz ayarlamasına gerek yoktur. Orta-ağır hepatik bozukluğu olan hastalarda klinik veriler yoktur ve doz ayarlaması için potansiyel ihtiyaç tespit edilememiştir (bkz. Bölüm 5.2). TAFİNLAR ve metabolitleri için primer eliminasyon yolu hepatik metabolizma ve biliyer sekresyondur ve orta-ağır hepatik bozukluğu olan hastalarda maruziyet artabilir. TAFİNLAR, monoterapi olarak ya da trametinib ile kombinasyon halinde, orta veya ağır hepatik bozukluğu olan hastalarda dikkatli kullanılmalıdır.
Pediyatrik popülasyon:
TAFİNLAR'ın çocuklarda ve adolesanlarda güvenliliği ve etkililiği henüz belirlenmemiştir (<18 yaş). Klinik veri bulunmamaktadır. Yavru hayvanlardaki çalışmalar, TAFİNLAR'ın erişkin hayvanlarda gözlenmemiş olan advers etkilerini göstermiştir (bkz. Bölüm 5.3).
Geriyatrik popülasyon:
>65 yaş hastalarda başlangıç dozunda herhangi bir ayarlama gerekli değildir.
Beyaz ırka mensup olmayan hastalar:
Beyaz ırka mensup olmayan hastalarda TAFİNLAR hakkında sınırlı güvenlilik ve etkililik verileri toplanmıştır. Popülasyon farmakokinetiği analizi Asyalı ve Beyaz hastalar arasında TAFİNLAR farmakokinetiği bakımından anlamlı farklılıklar göstermemiştir. Asyalı hastalarda TAFİNLAR doz ayarlaması gerekmemektedir.
4.3. Kontrendikasyonlar
TAFİNLAR'ın etkin maddesine veya içerisinde bulunan ve Bölüm 6.1'de belirtilen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
TAFİNLAR, trametinib ile kombinasyon halinde verildiğinde, kombinasyon tedavisine başlanmadan önce trametinib KÜB'üne başvurulmalıdır. Trametinib tedavisi ile ilişkili uyarılar ve önlemlere dair ek bilgi için lütfen trametinib KÜB'üne başvurunuz.
BRAF V600 testi
TAFİNLAR'ın etkililiği ve güvenliliği yabanıl tip BRAF melanomu olan hastalarda ya da yabanıl tip BRAF ileri evre KHDAK hastalarında gösterilmemiştir ve bu nedenle yabanıl tip BRAF melanomlu ya da yabanıl tip BRAF KHDAK'li hastalarda TAFİNLAR kullanılmamalıdır (bkz. Bölüm 4.2 ve 5.1).
Bir BRAF inhibitörü ile tedavi sırasında progrese olan melanom hastalarında trametinib ile kombinasyon halinde TAFİNLAR
Önceki BRAF inhibitörü tedavisinde progrese olan, TAFİNLAR + trametinib kombinasyonu kullanmakta olan hastalarda sınırlı veri mevcuttur. Veriler, bu kombinasyonun etkililiğinin bu hastalarda daha düşük olacağını göstermektedir (bkz. Bölüm 5.1). Dolayısıyla, önceden BRAF inhibitörü tedavisi görmüş olan bu popülasyonda söz konusu kombinasyon ile tedaviye başlanmadan önce diğer tedavi seçenekleri göz önünde bulundurulmalıdır. Bir BRAF inhibitör tedavisi sırasında progresyon sonrasında tedavilerin ardışık kullanımı belirlenmemiştir.
Yeni maligniteler
Monoterapi olarak veya trametinib ile kombinasyon halinde TAFİNLAR uygulandığında kutanöz ve kutanöz dışı yeni maligniteler görülebilir.
Kutanöz maligniteler
Kutanöz Skuamöz Hücre Karsinomu (cuSCC)
Tek başına veya trametinib ile kombinasyon halinde dabrafenib ile tedavi edilen hastalarda cuSCC (keratoakantoma dahil) vakaları bildirilmiştir (bkz. Bölüm 4.8). Rezeke edilemeyen veya metastatik melanomlu hastalarda yürütülen Faz III klinik çalışmalar MEK115306 ve MEK116513'te, monoterapi olarak TAFİNLAR alan hastaların %10'unda (22/211) ve monoterapi olarak vemurafenib alan hastaların %18'inde (63/349) cuSCC meydana gelmiştir. Melanomlu ve ileri evre KHDAK'li hastalardan oluşan entegre güvenlilik popülasyonunda cuSCC trametinib ile kombinasyon halinde TAFİNLAR alan hastaların %2'sinde (19/1076) meydana gelmiştir. MEK115306 çalışmasında ilk cuSCC oluşumunun tanısına kadar geçen medyan süre, kombinasyon tedavisi kolunda 223 gün (aralık: 56 ila 510 gün) ve dabrafenib (TAFİNLAR) monoterapi kolunda 60 gün (aralık: 9 ila 653 gün) bulunmuştur.
Adjuvan melanom tedavisi ile yürütülen Faz III çalışma BRF115532'de (COMBI-AD) plasebo alan hastaların %1'ine (5/432) kıyasla trametinib ile kombinasyon halinde TAFİNLAR alan hastaların %1'inde (6/435) cuSCC gelişmiştir. Adjuvan tedavi çalışmasının kombinasyon kolunda ilk cuSCC olayının başlangıcına kadar geçen medyan süre yaklaşık 18 hafta ve plasebo
kolunda 33 haftadır.
TAFİNLAR ile tedaviye başlanmadan önce ve tedavi süresince aylık olarak ve tedaviden sonra altı aya kadar cuSCC açısından deri muayenesi yapılması önerilir. TAFİNLAR ile tedavi bırakıldıktan sonra 6 aya kadar ya da başka bir anti-neoplastik tedaviye başlanana kadar izleme devam edilmelidir.
CuSCC vakaları dermatolojik eksizyon ile tedavi edilmelidir ve TAFİNLAR tedavisine ya da eğer kombinasyon halinde alınıyorsa TAFİNLAR ve trametinib tedavisine doz ayarlaması yapılmadan devam edilmelidir. Hastalar yeni lezyon gelişirse hekimlerine bildirmeleri konusunda bilgilendirilmelidir.
Yeni primer melanom
Klinik çalışmalarda TAFİNLAR ile tedavi gören hastalarda yeni primer melanomlar bildirilmiştir. Rezeke edilemeyen veya metastatik melanomlu klinik çalışmalarda bu vakalar, monoterapi olarak TAFİNLAR ile tedavinin ilk 5 ayında tespit edilmiştir. Yeni primer melanom vakaları eksizyon ile tedavi edilmiştir ve tedavi modifikasyonuna gereksinim olmamıştır. Deri lezyonlarının izlemi cuSCC için tarif edildiği şekilde yapılmalıdır.
Non-kutanöz maligniteler
Yapılan in vitro deneyler RAS mutasyon içeren BRAF yabanıl tip hücrelerde BRAF inhibitörlerine maruziyette mitojenle aktive edilen protein kinaz (MAP kinaz) sinyal iletiminde paradoksal aktivasyon oluştuğunu göstermiştir. Bu durum RAS mutasyonları mevcut olduğunda TAFİNLAR maruziyetiyle kutanöz-olmayan malignitelerin riskinde artışa neden olabilir (bkz. Bölüm 4.8). Klinik çalışmalarda, TAFİNLAR ile gerek başka bir BRAF inhibitörü (kronik miyelomonositik lösemi ve kutanöz-olmayan baş ve boyun SCC'si) gerekse monoterapi olarak TAFİNLAR (pankreatik adenokarsinom, safra kanalı adenokarsinom) ve mitojenle aktive edilen protein kinaz (MEK) inhibitörü trametinib (kolorektal kanser, pankreatik kanser) ile birlikte TAFİNLAR uygulandığında RAS'la bağlantılı malignite olguları bildirilmiştir.
Tedavinin başlatılmasından önce hastalarda en azından gözle oral mukoza muayenesi ve lenf nodülü palpasyonuyla birlikte bir baş ve boyun muayenesinin yanısıra göğüs/abdomen Bilgisayarlı Tomografi (BT) taraması yapılmalıdır. Tedavi sırasında hastalar klinik olarak gerektiğinde izlenmelidir, buna her 3 ayda bir baş ve boyun mauyenesi ile her 6 ayda bir yapılan göğüs/abdomen BT taraması dahil edilebilir. Tedaviye başlamadan önce ve tedavi bittikten sonra ya da klinik açıdan gerekli olduğu düşünüldüğünde anal muayene ve pelvik muayene yapılması önerilir. Klinik olarak uygun görüldüğünde tam kan sayımı ve kanda biyokimya testi yapılmalıdır.
Öncesinde veya eşzamanlı olarak RAS mutasyonu ile ilişkili kanseri olan hastalarda TAFİNLAR tedavisinin fayda ve riskleri değerlendirilmelidir. TAFİNLAR ile kombinasyon halinde alındığında trametinib dozunda modifikasyon gerekli değildir.
TAFİNLAR kullanımı kesildikten sonra kutanöz-olmayan ikincil/tekrarlayan malignite takipleri 6 aya kadar veya başka bir anti-neoplastik terapi başlangıcına kadar devam etmelidir. Anormal bulgular klinik uygulamalara göre tedavi edilmelidir.
Kanama
Trametinib ile kombinasyon halinde TAFİNLAR kullanan hastalarda majör hemorajik olaylar ve ölümle sonuçlanan hemorajik olaylar dahil hemorajik olaylar meydana gelmiştir (bkz. Bölüm 4.8). Ek bilgi için lütfen trametinib KÜB'üne başvurunuz (bkz. Bölüm 4.4).
Görüş bozukluğu
Klinik çalışmalarda monoterapi olarak ve trametinib ile kombinasyon halinde TAFİNLAR kullanan hastalarda üveit, iridosiklit ve irit dahil olmak üzere oftalmolojik reaksiyonlar bildirilmiştir. Hastalar tedavi süresince görme ile ilgili bulgu ve belirtiler (örn., görme değişiklikleri, fotofobi ve göz ağrısı) açısından rutin olarak izlenmelidir.
Oküler enflamasyon, etkili lokal tedaviler ile kontrol edebildiği sürece herhangi bir doz modifikasyonu gerekli değildir. Eğer üveit lokal oküler tedaviye yanıt vermezse, oküler enflamasyon iyileşene kadar TAFİNLAR durdurulmalıdır ve ardından bir doz düzeyi azaltılarak TAFİNLAR yeniden başlatılmalıdır. Üveti tanısından sonra, TAFİNLAR ile kombinasyon halinde alınan trametinib için doz modifikasyonu gerekli değildir.
Trametinib ile kombinasyon halinde TAFİNLAR ile Retinal Pigment Epitelyum Dekolmanı (RPED) ve Retinal Ven Tıkanması (RVO) gelişebilir. Lütfen trametinib KÜB'üne başvurunuz (bkz. Bölüm 4.4). RVO veya RPED tanısından sonra, TAFİNLAR ile kombinasyon halinde alınan trametinib için doz modifikasyonu gerekli değildir.
Pireksi
Monoterapi olarak ve TAFİNLAR ile kombinasyon halinde trametinib ile yürütülen klinik çalışmalarda ateş bildirilmiştir (bkz. Bölüm 4.8). TAFİNLAR monoterapisi ile klinik çalışmalarda hastaların %1'inde ciddi enfeksiyon dışı febril olaylar ateş ile tanımlanmış olup başlangıçta böbrek fonksiyonu normal olan hastalarda buna şiddetli rigor, dehidratasyon, hipotansiyon ve/veya akut renal yetmezlik de eşlik etmiştir (bkz. Bölüm 4.8). Bu ciddi enfeksiyon dışı febril olayların başlangıcı tipik olarak TAFİNLAR ile monoterapi tedavisinin ilk ayı içerisinde olmuştur. Ciddi enfeksiyon dışı febril olayları olan hastalar doza ara verilmesine ve/veya dozun azaltılmasına ve destekleyici bakıma iyi yanıt verir.
Pireksinin insidansı ve şiddeti kombinasyon tedavisi ile daha yüksek olmuştur. Rezeke edilemeyen ve metastatik melanomlu hastalar ile gerçekleştirilen MEK115306 çalışmasının kombinasyon tedavisi kolunda pireksi hastaların %57'sinde (119/209) bildirilmiş ve bunların
%7'si Derece 3 olmuş, diğer yandan TAFİNLAR monoterapi kolunda %2'si Derece 3 olmak üzere hastaların %33'ünde (69/211) pireksi bildirilmiştir. İleri evre KHDAK'li hastalar ile gerçekleştirilen Faz II BRF113928 çalışmasında, TAFİNLAR monoterapisi (%39, %2'si Derece 3) ile karşılaştırıldığında TAFİNLAR'ın trametinib ile kombinasyon halinde kullanıldığı hastalarda pireksinin insidansı ve şiddetinde hafif artış olmuştur (%48, %3'ü Derece 3). Adjuvan melanom tedavisi ile yürütülen Faz III çalışma BRF115532'de, pireksinin insidansı ve şiddeti plasebo koluna kıyasla (%15; <%1 Derece 3) trametinib ile kombinasyon halinde TAFİNLAR kolunda (%67; %6 Derece 3/4) daha yüksektir.
TAFİNLAR'ı trametinib ile kombinasyon halinde alan ve pireksi geliştiren rezeke edilemeyen veya metastatik melanomlu hastalarda, ateşin ilk ortaya çıkış olaylarının yaklaşık yarısı tedavinin ilk bir ayında olmuştur ve hastaların üçte birinde 3 veya daha fazla olay söz konusu olmuştur.
Hastanın ateşi ≥ 38ºC ise tedavi (monoterapi olarak kullanıldığında dabrafenib ve kombinasyon halinde kullanıldığında hem dabrafenib hem de trametinib) kesilmelidir (bkz. Bölüm 5.1). Nüks durumunda, pireksinin ilk belirtisinde de tedavi kesilebilir. İbuprofen veya asetaminofen/parasetamol gibi ateş düşürücü ilaçlarla tedaviye başlanmalıdır. Ateş düşürücü ilaçların yetersiz kaldığı durumlarda oral kortikosteroid kullanımı düşünülmelidir. Hastalar enfeksiyon işaret ve belirtileri açılarından değerlendirilmelidir. Ateş düzeldiğinde tedavi yeniden başlatılabilir. Eğer ateş başka şiddetli işaret ve belirtiler ile ilişkili ise ateş düzeldiğinde tedaviye azaltılmış dozdan ve klinik durumuna uygun şekilde yeniden başlanmalıdır (bkz. Bölüm 4.2).
LVEF azalması/Sol ventrikül fonksiyon bozukluğu
TAFİNLAR ile kombinasyon halindeki trametinibin LVEF'i düşürdüğü bildirilmiştir (bkz. Bölüm 4.8). Ek bilgi için lütfen trametinib KÜB'üne başvurunuz (bkz. Bölüm 4.4). Trametinib ile kombinasyon halinde alındığında TAFİNLAR için doz modifikasyonu gerekli değildir.
Böbrek yetmezliği
Tek başına TAFİNLAR ile tedavi edilen hastaların < %1'inde ve trametinib ile kombinasyon halinde TAFİNLAR ile tedavi edilen hastaların ≤ %1'inde böbrek yetmezliği tanımlanmıştır.
Gözlenen olgular genellikle ateş ve dehidrasyonla bağlantılı olmuştur ve doza ara verilmesine ve genel destekleyici önlemlere iyi yanıt vermiştir. Granülomatoz nefrit bildirilmiştir (bkz. Bölüm 4.8). Hastalarda tedavi sırasında rutin olarak serum kreatinin değerleri takip edilmelidir. Kreatininde artış olursa, klinik olarak uygun görüldüğünde TAFİNLAR'a ara verilmesi gerekebilir. TAFİNLAR böbrek yetmezliği (kreatinin > 1,5 x ULN şeklinde tanımlanmıştır) bulunan hastalarda çalışılmamıştır, bu nedenle bu ortamda dikkatli şekilde kullanılması gerekir (bkz. Bölüm 5.2).
Hepatik olaylar
Trametinib ile kombinasyon halinde TAFİNLAR ile yürütülen klinik çalışmalarda hepatik advers olaylar bildirilmiştir (bkz. Bölüm 4.8). Trametinib ile kombinasyon halinde TAFİNLAR tedavisi gören hastalarda karaciğer fonksiyonunun, trametinib ile tedaviye başlandıktan sonra 6 ay süreyle her dört haftada bir izlenmesi önerilir. Sonrasında klinik durumunun gerektirdiği şekilde karaciğer izlemine devam edilebilir. Ek bilgi için lütfen trametinib KÜB'üne başvurunuz.
Hipertansiyon
Önceden hipertansiyonu olan ya da olmayan hastalarda, trametinib ile kombinasyon halinde uygulanan TAFİNLAR ile bağlantılı olarak kan basıncında yükselmeler bildirilmiştir (bkz. Bölüm 4.8). Ek bilgi için lütfen trametinib KÜB'üne başvurunuz.
İnterstisyel akciğer hastalığı (ILD)/Pnömoni
Trametinib ile kombinasyon halinde TAFİNLAR ile yürütülen klinik çalışmalarda pnömoni veya ILD olguları bildirilmiştir. Ek bilgi için lütfen trametinib KÜB'ü Bölüm 4.4'e başvurunuz. Eğer TAFİNLAR trametinib ile birlikte alınıyorsa, daha sonra TAFİNLAR ile tedaviye aynı dozdan devam edilebilir.
Döküntü
TAFİNLAR, trametinib ile kombinasyon halinde uygulandığında, klinik çalışmalarda hastaların yaklaşık %24'ünde döküntü gözlenmiştir (bkz. Bölüm 4.8). Bu vakaların çoğu Derece 1 veya 2 olup, doza ara verme ya da azaltma gerektirmemiştir. Ek bilgi için lütfen trametinib KÜB'ü Bölüm 4.4'e başvurunuz.
Rabdomiyoliz
Trametinib ile kombinasyon halinde TAFİNLAR kullanan hastalarda rabdomiyoliz bildirilmiştir (bkz. Bölüm 4.8). Ek bilgi için lütfen trametinib KÜB'ü Bölüm 4.4'e başvurunuz.
Pankreatit
Pankreatit, rezeke edilemeyen veya metastatik melanom klinik çalışmalarında TAFİNLAR ile monoterapi olarak ve trametinib ile kombinasyon halinde tedavi edilen hastaların <%1'inde ve KHDAK klinik çalışmasında trametinib ile kombinasyon halinde TAFİNLAR ile tedavi edilen hastaların yaklaşık %4'ünde bildirilmiştir. Bu olaylardan biri, bir metastatik melanom hastasında TAFİNLAR dozunun uygulandığı ilk gün meydana gelmiş ve daha düşük bir dozda doz uygulamalarına yeniden başlanması ile tekrar görülmüştür. Adjuvan melanom tedavisi çalışmasında trametinib ile kombinasyon halinde TAFİNLAR alan hastaların <%1'inde (1/435) pankreatit bildirilirken, plasebo alan hastalarda bildirilmemiştir. Açıklanamayan abdominal ağrının serum amilaz ve lipaz ölçümü dahil olacak şekilde hemen araştırılması gerekir. Hastalar pankreatit nöbeti sonrasında yeniden TAFİNLAR'a başlarken yakından izlenmelidir.
Derin ven trombozu/Pulmoner embolizm
TAFİNLAR trametinib ile kombinasyon halinde kullanıldığında derin ven trombozu veya pulmoner embolizm meydana gelebilir. Hastalarda nefes darlığı, göğüs ağrısı veya kol ya da bacakta şişme gibi pulmoner embolizm veya derin ven trombozu semptomları gelişirse hasta derhal tıbbi yardım almalıdır.
Yaşamı tehdit edici pulmoner embolizm durumunda trametinib ve TAFİNLAR bir daha başlanmamak üzere kesilir.
Şiddetli kutanöz advers reaksiyonlar
TAFİNLAR/trametinib kombinasyon tedavisi sırasında, Stevens-Johnson sendromu dahil olmak üzere şiddetli kutanöz advers reaksiyon (SCAR'lar) vakaları ve yaşamı tehdit edebilen ya da ölümcül olabilen eozinofili ve sistemik semptomlar ile birlikte ilaç reaksiyonu (DRESS) bildirilmiştir. Tedavi başlatılmadan önce, hastalar cilt reaksiyonlarının işaret ve semptomları konusunda bilgilendirilmeli ve bu reaksiyonlar açısından yakından takip edilmelidir. Eğer SCAR'ları düşündüren işaret ve semptomlar ortaya çıkarsa, TAFİNLAR ve trametinib geri çekilmelidir.
Gastrointestinal hastalıklar
Trametinib ile kombinasyon halinde TAFİNLAR alan hastalarda ölümcül sonuç da dahil kolit ve gastrointestinal perforasyon bildirilmiştir (bkz. Bölüm 4.8.). Daha fazla bilgi için lütfen trametinib KÜB'ünü inceleyiniz (bkz. Bölüm 4.4).
Sarkoidoz
Trametinib ile kombinasyon halinde TAFİNLAR ile tedavi edilen hastalarda, çoğunluklu deri, akciğer, göz ve lenf nodlarını tutan sarkoidoz vakaları bildirilmiştir. Vakaların çoğunda TAFİNLAR ve trametinib ile tedaviye devam edilmiştir. Sarkoidoz tanısı durumunda ilgili tedavi düşünülmelidir. Sarkoidozun hastalık progresyonu olarak yanlış yorumlanmaması önemlidir.
Hemofagositik lenfohistiyositoz
Pazarlama sonrası deneyimde, trametinib ile kombinasyon halinde dabrafenib ile tedavi edilen hastalarda hemofagositik lenfohistiyositoz (HLH) gözlenmiştir. Dabrafenib, trametinib ile kombinasyon halinde uygulandığında dikkatli olunmalıdır. HLH'nin doğrulanması halinde, dabrafenib ve trametinib uygulaması kesilmeli ve HLH tedavisi başlatılmalıdır.
Diğer maddelerin TAFİNLAR üzerindeki etkileri
TAFİNLAR bir CYP2C8 ve CYP3A4 substratıdır. Bu enzimlerin güçlü indükleyicileri TAFİNLAR'ın etkililiğini azaltabileceğinden bunlardan mümkün olduğunca kaçınılması gerekir (bkz. Bölüm 4.5).
TAFİNLAR'ın diğer maddeler üzerindeki etkisi
TAFİNLAR yaygın olarak kullanılan birçok tıbbi ürünün etkinliğinin kaybına yol açabilecek metabolize edici enzimlerin indükleyicisidir (örnekler için Bölüm 4.5'e bakınız). Bu nedenle, TAFİNLAR tedavisine başlarken bir ilaç kullanımı incelemesi yapılması şarttır. Etkinlik izlemesi ve doz ayarı mümkün değilse genellikle TAFİNLAR'ın bazı metabolize edici enzim veya taşıyıcıların duyarlı substratları olan tıbbi ürünlerle (bkz. Bölüm 4.5) eşzamanlı kullanımından kaçınılmalıdır.
TAFİNLAR'ın varfarinle eşzamanlı kullanımı varfarine maruziyetin azalmasıyla sonuçlanabilir. TAFİNLAR varfarinle eşzamanlı kullanıldığında ve TAFİNLAR tedavisi kesildiğinde dikkat edilmelidir ve ilave olarak Uluslararası Normalleştirilmiş Oran'ın (INR) takip edilmesi önerilir (bkz. Bölüm 4.5).
TAFİNLAR'ın digoksin ile eşzamanlı uygulanması digoksin maruziyetinin azalmasına neden olabilir. Digoksin (bir taşıyıcı substratı) TAFİNLAR ile eşzamanlı kullanıldığında ve TAFİNLAR tedavisi kesildiğinde dikkat edilmesi ve ek olarak digoksinin izlenmesi önerilir (bkz. Bölüm 4.5).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer tıbbi ürünlerin TAFİNLAR üzerine etkisi
TAFİNLAR metabolizma enzimleri CYP2C8 ve CYP3A4 için bir substrat iken, aktif metabolitler hidroksi-dabrafenib ve desmetil-dabrafenib CYP3A4 substratlarıdır. Bu nedenle güçlü CYP2C8 veya CYP3A4 inhibitörleri ya da indükleyicileri olan ilaç ürünlerinin TAFİNLAR konsantrasyonlarını sırasıyla artırması ya da azaltması ihtimali mevcuttur. Mümkün olduğunda TAFİNLAR uygulaması sırasında alternatif ajanlar kullanılmalıdır. Güçlü inhibitörler (örn., ketokonazol, gemfibrozil, nefazodon, klaritromisin, ritonavir, sakinavir, telitromisin, itrakonazol, vorikonazol, posakonazol, atazanavir) TAFİNLAR ile eşzamanlı uygulanırsa dikkat gösterilmelidir. TAFİNLAR ile eş zamanlı olarak CYP2C8 veya CYP3A4'ün potent indükleyicilerinin (örn., rifampisin, fenitoin, karbamazapin, fenobarbital veya sarı kantaron (Hypericum perforatum St. John's Wort)) kullanılmasından kaçınılmalıdır.
Günde bir kez 400 mg ketokonazolün (bir CYP3A4 inhibitörü) günde iki kez 75 mg TAFİNLAR ile birlikte uygulanması, günde iki kez 75 mg TAFİNLAR'ın tek başına uygulanmasına kıyasla TAFİNLAR'ın EAA'sında %71 artış ve TAFİNLAR'ın Cdeğerinde
%33 artış ile sonuçlanmıştır. Eşzamanlı uygulama hidroksi- ve desmetil-dabrafenib EAA'sında artışlarla sonuçlanmıştır (sırasıyla %82 ve %68 artış). Karboksi-dabrafenib için EAA'da
%16'lık bir azalma not edilmiştir.
Günde iki kez 600 mg gemfibrozilin (bir CYP2C8 inhibitörü) günde iki kez TAFİNLAR ile birlikte uygulanması, günde iki kez 75 mg TAFİNLAR'ın tek başına uygulanmasına kıyasla TAFİNLAR EAA'sında %47 artış ile sonuçlanmakla birlikte TAFİNLAR Cdeğeri değişmemiştir. Gemfibrozil'in TAFİNLAR metabolitlerine sistemik olarak maruziyeti klinik olarak anlamlı bir etkiye sahip değildir (≤%13).
Günde bir kez 600 mg rifampinin (bir CYP3A4/CYP2C8 indükleyicisi) günde iki kez 150 mg TAFİNLAR ile birlikte uygulanması, tekrarlanan doz TAFİNLAR C(%27) ve EAA (%34) değerlerinde bir azalma ile sonuçlanmıştır. Hidroksi-dabrafenib için EAA'da ilgili bir değişiklik not edilmemiştir. Karboksi-dabrafenib için EAA'da %73 artış ve desmetil-dabrafenib için EAA'da %30 azalma görülmüştür.
Günde iki kez 150 mg TAFİNLAR ve günde bir kez pH artırıcı ajan rabeprazol 40 mg'ın tekrarlanan dozlarının birlikte uygulanması EAA'da %3 artış ve TAFİNLAR Cdeğerinde
%12 azalma ile sonuçlanmıştır. TAFİNLAR EAA ve Cdeğerlerindeki bu değişiklikler klinik açıdan anlamlı bulunmamaktadır. Üst gastrointestinal (GI) sistemin pH'sını değiştiren tıbbi ürünlerin (örn., proton pompası inhibitörleri, H-reseptörü antagonistleri, antasitler) TAFİNLAR'ın biyoyararlanımını azaltması beklenmemektedir.
TAFİNLAR'ın diğer tıbbi ürünler üzerine etkisi
TAFİNLAR bir enzim indükleyicisidir ve CYP3A4, CYP2Cs ve CYP2B6 dahil ilaç metabolize edici enzimlerin sentezini artırır ve ayrıca taşıyıcıların sentezini de artırabilir. Bunun sonucunda bu enzimler tarafından metabolize olan tıbbi ürünlerin plazma seviyeleri düşer ve taşınan bazı tıbbi ürünler etkilenebilir. Plazma konsantrasyonlarındaki azalma bu tıbbi ürünlerin etkililiğinde kayba ya da azalmaya neden olabilir. Ayrıca bu tıbbi ürünlerin aktif metabolitlerinin daha fazla oluşma riski de söz konusudur. İndüklenebilecek enzimler arasında karaciğer ve bağırsakta CYP3A ve CYP2B6, CYP2C8, CYP2C9, CYP2C19 ve UGT'ler (glukuronid konjüge edici enzimler) yer alır. Taşıyıcı protein Pgp ve ayrıca MRP-2 gibi başka taşıyıcılar da indüklenebilir. OATP1B1/1B3 ve BCRP'nin indüksiyonu, rosuvastatin ile yürütülen bir klinik çalışma gözlemlerine göre olası değildir.
İn vitro ortamda TAFİNLAR CYP2B6 ve CYP3A4'te doza bağlı artışlara neden olmuştur. Bir klinik ilaç etkileşimi çalışmasında oral midazolamın (bir CYP3A4 substratı) Cve EAA değerleri, eş zamanlı uygulanan tekrarlı TAFİNLAR dozu ile sırasıyla %47 ve %65 azalmıştır.
Günde iki kez 150 mg TAFİNLAR ve varfarinin birlikte uygulanması, varfarinin tek başına uygulanmasına kıyasla S- ve R-varfarinin EAA'sında sırasıyla %37 ve %33 azalma ile sonuçlanmıştır. S- ve R-varfarinin Cdeğeri %18 ve %19 artmıştır.
Metabolizma veya aktif taşınma ile elimine edilen çeşitli ilaç ürünleri ile etkileşimler beklenmektedir. Terapötik etkileri hasta için büyük öneme sahipse ve dozda ayarlama etkililik ya da plazma konsantrasyonlarının takibi temelinde kolaylıkla yapılamıyorsa, bu ilaç ürünlerinden kaçınılmalı veya kullanımlarında dikkat gösterilmelidir. Parasetamol uygulamasını takiben karaciğer hasarı riskinin enzim indükleyicileri ile eşzamanlı olarak tedavi edilen hastalarda daha yüksek olduğundan şüphe edilmektedir.
Etkileşimin şiddeti değişkenlik gösterse de etkilenen tıbbi ürün sayısının yüksek olduğu düşünülmektedir. Etkinebilecek tıbbi ürünler, belirtilenlerle sınırlı olmamakla birlikte, aşağıda listelenmiştir:
Analjezikler (örneğin fentanil, metadon)
4.6. Gebelik ve laktasyon
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip kadınlar TAFİNLAR ile tedavi sırasında ve tedaviden sonra 2 hafta boyunca, trametinib TAFİNLAR ile kombinasyon halinde kullanılırken ise trametinib'in son dozundan sonra 16 hafta boyunca etkin kontrasepsiyon yöntemlerini kullanmalıdırlar.
TAFİNLAR oral ya da herhangi bir sistemik hormonal kontraseptifin etkinliğini azaltabilir ve kontrasepsiyon için etkili bir alternatif yöntem kullanılması gerekir (bkz. Bölüm 4.5).
Gebelik dönemi
TAFİNLAR'ın gebe kadınlarda kullanımı ile ilişkili hiçbir veri yoktur. Hayvan çalışmaları reprodüktif toksisite ve teratojenik etkiler dahil embriyo-fetal gelişim toksisitelerini göstermiştir (bkz. Bölüm 5.3). Eğer hasta TAFİNLAR alırken hamile kalırsa, ilacın fetüse olası tehlikesi konusunda hasta bilgilendirilmelidir. Trametinib ile birlikte kullanırken, lütfen trametinib KÜB'üne (bkz. Bölüm 4.6) bakınız.
Dabrafenib'in gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır.
TAFİNLAR, anne için potansiyel fayda fetüs için muhtemel riskten daha ağır basmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
TAFİNLAR'ın insan sütüne geçip geçmediği bilinmemektedir. Birçok tıbbi ürün insan sütüne geçtiği için emen çocuk için risk göz ardı edilmemelidir. Emzirme veya TAFİNLAR'ın kesilmesi konusunda çocuğun emzirilmesinin yararı ile TAFİNLAR tedavisinin anneye yararı değerlendirilerek bir karar verilmelidir.
Üreme yeteneği/Fertilite
TAFİNLAR monoterapi olarak ya da trametinib ile kombinasyon halinde kullanılırken insanlara ilişkin veri bulunmamaktadır. Hayvanlarda erkek ve dişi üreme organlarında advers etkiler gözlenmiş olduğundan TAFİNLAR erkek ve kadın fertilitesini olumsuz yönde etkileyebilir (bkz. Bölüm 5.3). TAFİNLAR'ı tek başına ya da trametinib ile kombinasyon halinde kullanan erkek hastalar geri dönüşsüz spermatogenez bozukluğu riski konusunda bilgilendirilmelidir. Trametinib ile birlikte kullanırken, lütfen trametinib KÜB'üne (bkz. Bölüm 4.6) bakınız.
4.7. Araç ve makine kullanımı üzerindeki etkiler
TAFİNLAR'ın araç ve makine kullanımı üzerinde minimal etkisi bulunmaktadır. Hastanın değerlendirme, motor veya kognitif yeteneklerini gerektiren işlerdeki yeteneği düşünülürken hastanın klinik durumu ve TAFİNLAR'ın advers olay profili göz önünde bulundurulmalıdır. Hastalar bu tür aktiviteleri etkileyebilecek halsizlik ve göz problemleri açısından bilgilendirilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti:
TAFİNLAR monoterapisinin güvenliliği, günde iki kez TAFİNLAR 150 mg ile tedavi edilen BRAF V600 mutant rezeke edilemeyen ya da metastatik melanomlu 578 hastayı içeren beş klinik çalışma olan BRF113683 (BREAK-3), BRF113929 (BREAK-MB), BRF113710
(BREAK-2), BRF113220 ve BRF112680'in birleştirilmiş güvenlilik popülasyonuna dayanmaktadır. TAFİNLAR ile en sık bildirilmiş olan advers reaksiyonlar (ADR) (insidans ≥
%15) hiperkeratoz, baş ağrısı, pireksi, artralji, halsizlik, bulantı, papillom, alopesi, döküntü ve kusmadır.
Trametinib ile kombinasyon halindeki TAFİNLAR'ın güvenliliği, günde bir kez 2 mg trametinib ve günde iki kez 150 mg dabrafenib ile tedavi edilen BRAF V600 mutasyonlu rezeke edilemeyen ya da metastatik melanomlu, tam rezeksiyonu takiben evre III BRAF V600 mutasyonlu melanomlu (adjuvan tedavi) ve ileri evre KHDAK'si olan 1076 hastadan oluşan birleştirilmiş güvenlilik popülasyonunda değerlendirilmiştir. Bu hastaların 559'u MEK115306 (COMBI-d) ve MEK116513 (COMBI-v) olmak üzere iki randomize Faz III klinik çalışmada BRAF V600 mutasyonlu melanom için kombinasyonla tedavi edilirken, 435'i randomize Faz III çalışma BRF115532'de (COMBI-AD) tam rezeksiyon sonrasında evre III BRAF V600 mutasyonlu melanomun adjuvan tedavisinde kombinasyon ile tedavi edilmiş ve 82'si çok kohortlu, randomize olmayan Faz II çalışma BRF113928'de BRAF V600 mutasyonlu KHDAK için kombinasyonla tedavi edilmiştir (bkz. Bölüm 5.1)
TAFİNLAR ve trametinib kombinasyon tedavisi için en sık advers reaksiyonlar (insidans
 %20) ateş, yorgunluk, bulantı, üşüme hissi, baş ağrısı, ishal, kusma, eklem ağrısı ve döküntüyü içermiştir.
Bildirilmiş olan ADR'ler aşağıda MedDRA vücut sistemi organ sınıflaması ve sıklıklarıyla listelenmiştir. Sıklık tanımlaması: çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir sıklık sınıflandırmasında ADR'ler azalan ciddiyet sırasına göre sunulmuştur
TAFİNLAR:
Klinik çalışmalardan ve pazarlama sonrası gözetimden elde edilen, dabrafenib ve trametinib ile kombinasyonu ile ilişkili advers reaksiyonlar aşağıda listelenmiştir.
Dabrafenib monoterapisi ile advers reaksiyonlar:
İyi huylu, kötü huylu ve tanımlanmamış neoplazmalar (Kistler ve polipler dahil olmak üzere)
Çok yaygın: Papillom
Yaygın: Kutanöz skuamöz hücreli karsinom, seboreik keratoz, akrokordon (deri etiketleri), bazal hücre karsinomu
Yaygın olmayan: Yeni primer melanoma
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Hipersensitivite
Metabolizma ve beslenme hastalıkları
Çok yaygın: İştah azalması
Yaygın: Hipofosfatemi, hiperglisemi
Sinir sistemi hastalıkları Çok yaygın: Baş ağrısı Göz hastalıkları
Yaygın olmayan: Üveit
Solunum, göğüs hastalıkları ve mediastinal hastalıklar
Çok yaygın: Öksürük Gastrointestinal hastalıklar Çok yaygın: Bulantı, kusma, ishal Yaygın: Kabızlık
Yaygın olmayan: Pankreatit
Deri ve deri altı doku hastalıkları
Çok yaygın: Hiperkeratoz, alopesi, döküntü, palmar-plantar eritrodisestezi sendromu Yaygın: Deride kuruluk, pruritus, aktinik keratoz, deri lezyonu, eritem, fotosensitivite Yaygın olmayan: Pannikulitis
Kas-iskelet ve bağ doku bozuklukları
Çok yaygın: Artralji, miyalji, ekstremite ağrısı
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Renal yetmezlik, akut renal yetmezlik, nefrit Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Çok yaygın: Pireksi, halsizlik, titreme, asteni
Yaygın: İnflüenza benzeri hastalık
Trametinib ve kombinasyon halinde dabrafenib ile advers reaksiyonlar:
Enfeksiyonlar ve enfestasyonlar
Çok yaygın: Nazofarenjit
Yaygın: İdrar yolu enfeksiyonu, selülit, folikülit, paronişya, püstüler döküntü
İyi huylu, kötü huylu ve tanımlanmamış neoplazmalar (Kistler ve polipler dahil olmak üzere)
Yaygın: Kutanöz skuamöz hücreli karsinom, papillom, seboreik keratoz, Yaygın olmayan: Yeni primer melanom, akrokordon (deri etiketleri) Kan ve lenf sistem hastalıkları
Yaygın: Nötropeni, anemi, trombositopeni, lökopeni
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Hipersensitivite (İlaç aşırı duyarlılığı), sarkoidoz Seyrek: Hemofagositik lenfohistiyositoz
Metabolizma ve beslenme hastalıkları
Çok yaygın: İştah azalması
Yaygın: Dehidratasyon, hiponatremi, hipofosfatemi, hiperglisemi
Sinir sistemi hastalıkları
Çok yaygın: Baş ağrısı, sersemlik
Göz hastalıkları
Yaygın: Bulanık görme, görme bozukluğu, üveit
Yaygın olmayan: Koryoretinopati, retina dekolmanı, periorbital ödem
Kardiyak hastalıklar
Yaygın: Azalmış ejeksiyon fraksiyonu Yaygın olmayan: Bradikardi Bilinmiyor: Miyokardit
Vasküler hastalıklar
Çok yaygın: Hipertansiyon, hemoraji Yaygın: Hipotansiyon, lenfödem
Solunum, göğüs hastalıkları ve mediastinal hastalıklar
Çok yaygın: Öksürük Yaygın: Dispne
Yaygın olmayan: Pnömoni
Gastrointestinal hastalıklar
Çok yaygın: Karın ağrısı, kabızlık, ishal, bulantı, kusma Yaygın: Ağız kuruluğu, ağız iltihabı
Yaygın olmayan: Pankreas iltihabı, kolit Seyrek: Gastrointestinal perforasyon Deri ve deri altı doku hastalıkları
Çok yaygın: Cilt kuruluğu, kaşıntı, döküntü, eritem
Yaygın: Dermatit akneiform, aktinik keratoz, gece terlemeleri, hiperkeratoz, saç dökülmesi, palmar-plantar eritrodizestesi sendromu, deri lezyonu, hiperhidroz, panikülit, deri çatlakları, fotosensitivite
Bilinmiyor: Stevens-Johnson sendromu, eozinofili ve sistemik semptomlar ile birlikte ilaç reaksiyonu, jeneralize eksfolyatif dermatit
Kas-iskelet ve bağ doku bozuklukları
Çok yaygın: Eklem ağrısı, kas ağrısı, uzuvlarda ağrı, kas spazmları
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Böbrek yetmezliği, nefrit
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Yorgunluk, üşüme, asteni, periferik ödem, ateş, grip benzeri hastalık Yaygın: Mukoza enflamasyonu, yüz ödemi
Araştırmalar
Çok yaygın: Alanin aminotransferaz düzeyinde artış, aspartat aminotransferaz düzeyinde artış
Yaygın: Kan alkalen fosfataz düzeyinde artış, gamma-glutamiltransferaz düzeyinde artış, kan kreatin fosfokinaz düzeyinde artış
Seçili advers reaksiyonlarla ilgili açıklamalar:
Kutanöz skuamöz hücreli karsinom (cuSCC)
MEK115306 çalışmasında TAFİNLAR monoterapisi için kutanöz skuamöz hücreli karsinom (keratoakantoma ya da karma keratoakantoma alt tipi olarak sınıflandırılanlar dahil) hastaların
%10'unda görülmüştür ve olayların yaklaşık %70'i, 8 haftalık başlangıca kadar geçen medyan süre ile tedavinin ilk 12 haftasında meydana gelmiştir. Trametinib ile kombinasyon halindeki TAFİNLAR'ın birleştirilmiş güvenlilik popülasyonunda hastaların %2'si cuSCC geliştirmiştir ve bu olaylar, 18-31 haftalık başlangıca kadar geçen medyan süreyle TAFİNLAR monoterapisinden daha geç görülmüştür. Monoterapi olarak ya da trametinib ile kombinasyon halinde TAFİNLAR alan ve cuSCC gelişen bütün hastalar doz modifikasyonları yapılmadan tedaviye devam etmiştir.
Yeni primer melanom
TAFİNLAR monoterapisi ve trametinib ile kombinasyonu ile yapılan melanom klinik çalışmalarda yeni primer melanomlar bildirilmiştir. Olgular eksizyon yoluyla tedavi edilmiş ve tedavi modifikasyonu gerekmemiştir (bkz. Bölüm 4.4). Faz II KHDAK çalışmasından (BRF113928) herhangi bir yeni primer melanom vakası bildirilmemiştir.
Non-kutanöz malignansi
BRAF inhibitörlerine maruz kalan BRAF yabanıl tip hücrelerde MAP-kinaz sinyal iletiminin aktivasyonu RAS mutasyonları da dahil olmak üzere kutanöz dışı malignitelerin riskinin artmasına yol açabilir (bkz. Bölüm 4.4). Kutanöz dışı maligniteler, TAFİNLAR'ın monoterapi olarak incelendiği birleştirilmiş güvenlilik popülasyonunda hastaların %1'i (6/586) ve TAFİNLAR'ın trametinib ile kombinasyon halinde ele alındığı birleştirilmiş güvenlilik popülasyonunda hastaların <%1'i (8/1076) için bildirilmiştir. Monoterapi şeklinde ya da trametinib ile kombinasyon halinde TAFİNLAR ile RAS kökenli malignite olgularına rastlanmıştır. Hastalar klinik açıdan uygun şekilde izlenmelidir.
Kanama
Trametinib ile kombinasyon halinde TAFİNLAR kullanan hastalarda majör hemorajik olaylar ve ölümle sonuçlar hemorajik olaylar dahil kanama olayları meydana gelmiştir. Lütfen trametinib KÜB'üne başvurunuz.
LVEF azalması/Sol ventrikül fonksiyon bozukluğu
Trametinib ile kombinasyon halindeki TAFİNLAR'ın birleştirilmiş güvenlilik popülasyonunda hastaların %6'sında (65/1076) LVEF düzeyinde azalma bildirilmiştir. Çoğu vaka asemptomatik ve geri dönüşlü olmuştur. LVEF değeri kurumsal normalin alt sınırının altında olan hastalar TAFİNLAR ile gerçekleştirilen klinik çalışmalara dahil edilmemiştir. Trametinib ile
kombinasyon halindeki TAFİNLAR, sol ventrikül fonksiyonunu bozabilecek durumların söz konusu olduğu hastalarda dikkatle kullanılmalıdır. Lütfen trametinib KÜB'üne başvurunuz.
Pireksi
Monoterapi olarak ve trametinib ile kombinasyon halinde TAFİNLAR ile yürütülen klinik çalışmalarda ateş bildirilmiştir; ateşin insidansı ve şiddeti kombinasyon tedavisi ile artmıştır (bkz. Bölüm 4.4). Trametinib ile kombinasyon halinde TAFİNLAR alan ve ateş geliştiren hastalar arasında, ateşin ilk ortaya çıkış olaylarının yaklaşık yarısı tedavinin ilk bir ayında olmuştur ve hastaların üçte birinde 3 veya daha fazla olay söz konusu olmuştur. Klinik çalışmalarda birleştirilmiş güvenlilik popülasyonunda monoterapi olarak TAFİNLAR alan hastaların %1'inde ciddi, enfeksiyöz olmayan febril olaylar ateş ile tanımlanmış olup başlangıçta böbrek fonksiyonu normal olan hastalarda buna şiddetli rigor, dehidratasyon, hipotansiyon ve/veya akut renal yetmezlik veya prerenal orjin de eşlik etmiştir. Bu ciddi enfeksiyon dışı febril olayların başlangıcı tipik olarak tedavinin ilk ayı içerisinde olmuştur. Ciddi enfeksiyon dışı febril olayları olan hastalar doza ara verilmesine ve/veya dozun azaltılmasına ve destekleyici bakıma iyi yanıt vermiştir (bkz. Bölüm 4.2 ve 4.4)
Hepatik olaylar
Trametinib ile kombinasyon halinde TAFİNLAR ile yürütülen klinik çalışmalarda hepatik advers olaylar bildirilmiştir. Lütfen trametinib KÜB'üne başvurunuz.
Hipertansiyon
Önceden mevcut hipertansiyonu olan ya da olmayan hastalarda trametinib ile kombinasyon halinde TAFİNLAR ile ilişkili olarak kan basıncında yükselmeler bildirilmiştir. Kan basıncı, trametinib ile tedavi başlangıcında ölçülmeli ve tedavi süresince izlenmeli, gerektiğinde hipertansiyon standart tedavi ile kontrol altına alınmalıdır.
Artralji
Artralji, TAFİNLAR monoterapisi (%25) ve trametinib ile kombinasyon halindeki TAFİNLAR'ın (%25) birleştirilmiş güvenlilik popülasyonunda çok yaygın sıklıkla bildirilmiştir ancak, bunlar çoğunlukla Derece 1 ve 2 şiddette olmuştur, Derece 3 yaygın olmamıştır (< %1), Derece 4 hiç bildirilmemiştir.
Hipofosfatemi
TAFİNLAR monoterapisi (%7) ve trametinib ile kombinasyon halinde TAFİNLAR (%4) ile yürütülen klinik çalışmaların birleştirilmiş güvenlilik popülasyonunda hipofosfatemi yaygın olarak bildirilmiştir. Ancak bu olayların TAFİNLAR monoterapisi ile yaklaşık yarısının (%4) ve trametinib ile kombinasyon halinde TAFİNLAR ile %1'inin Derece 3 şiddette olduğuna dikkat edilmesi gerekir.
Pankreatit
TAFİNLAR monoterapisi ve trametinib ile kombinasyon halinde TAFİNLAR tedavisinde pankreatit bildirilmiştir. Açıklanamayan abdominal ağrının serum amilaz ve lipaz ölçümü de yapılacak şekilde hemen araştırılması gerekir. Pankreatit nöbeti sonrasında yeniden TAFİNLAR'a başlarken hastaların yakından izlenmesi gerekir (bkz. Bölüm 4.4).
Böbrek yetmezliği
Pireksiye bağlı prerenal azotemi veya granülomatöz nefrit nedeniyle böbrek yetmezliği yaygın olmamıştır; ancak TAFİNLAR böbrek yetmezliği (kreatinin > 1,5 x ULN olarak tanımlanmıştır) bulunan hastalarda çalışılmamıştır. Bu ortamda dikkatli bir şekilde kullanılmalıdır (bkz. Bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler: Geriyatrik popülasyon:
TAFİNLAR monoterapisinin birleştirilmiş güvenlilik popülasyonunda toplam hasta sayısı (N = 578), 65 yaş ve üzeri için %22 ve 75 yaş ve üzeri için %6'dır. Daha genç hastalarla (< 65) karşılaştırıldığında, ≥ 65 yaşındaki hastaların daha fazlasında çalışma ilacında doz azaltımı (%22'ye karşı %12) veya ilaca ara vermeye (%39'a karşı %27) yol açan advers olaylar yaşanmıştır. Ek olarak, yaşlı hastalar genç hastalarla karşılaştırıldığında daha ciddi advers olaylar yaşamıştır (%41'e karşı %22). Etkililikte bu hastalar ile genç hastalar arasında genel farklılıklar gözlenmemiştir.
Trametinib ile kombinasyon halindeki TAFİNLAR'ın birleştirilmiş güvenlilik popülasyonunda (n=1076), 265 hasta (%25) ≥65 yaşında, 62 hasta (%6) ≥75 yaşındadır. AO'lar yaşayan hasta oranı tüm klinik çalışmalarda <65 yaş ve ≥65 yaş hastalar arasında benzer olmuştur. ≥65 yaş hastaların CAO'lar (ciddi advers olaylar) ve tıbbi ürünün kalıcı olarak kesilmesine, dozun azaltılmasına ve dozlara ara verilmesine yol açan AO'lar yaşama olasılığının, <65 yaş hastalara göre daha yüksek olduğu belirlenmiştir.
Beyin metastazları olan hastalarda trametinib ile kombinasyon halinde TAFİNLAR
Trametinib ve TAFİNLAR kombinasyonunun güvenliliği ve etkililiği, beyin metastazları bulunan BRAF V600 mutant melanomlu hastalarla yapılan çok kohortlu, açık etiketli bir Faz II çalışmada değerlendirilmiştir. Bu hastalarda gözlenmiş güvenlilik profili, kombinasyonun birleştirilmiş güvenlilik profili ile tutarlı gibi görünmektedir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
TAFİNLAR doz aşımı için spesifik bir tedavi yoktur. Eğer doz aşımı görülürse, hasta gerekli uygun izlem ile desteklenerek tedavi edilmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri, B-Raf serin-treonin kinaz (BRAF) inhibitörleri.
ATC kodu: L01EC02
Etki mekanizması
TAFİNLAR, RAF kinazlarının inhibitörüdür. BRAF'deki onkojenik mutasyonlar RAS/RAF/MEK/ERK yolağının yapısal aktivasyonuna yol açar. BRAF mutasyonları, melanomda yaklaşık %50 olmak üzere spesifik kanserlerde de yüksek frekansta tespit edilmiştir. En sık gözlenen BRAF mutasyonu, melanomda görülen BRAF mutasyonlarının yaklaşık
%90'ını oluşturan V600E'dir.
Biyokimyasal testlerden elde edilen preklinik veriler, TAFİNLAR'ın kodon 600 mutasyonlarını aktive ederek BRAF kinazları inhibe ettiğini göstermiştir (Tablo 3).
Tablo 3 TAFİNLAR'ın RAF kinazlara karşı kinaz inhibe edici etkinliği
Kinaz | İnhibe edici konsantrasyon 50 (IC50 nM) |
BRAF V600E | 0,65 |
BRAF V600K | 0,50 |
BRAF V600D | 1,8 |
BRAF WT | 3,2 |
CRAF WT | 5,0 |
İn vitro ve hayvan modellerinde, TAFİNLAR BRAF V600 mutant melanom hücre dizilerinde hücre büyümesini engellemiş ve farmakodinamik bir biyolojik aşağı akım belirtecinin (fosforile ERK) baskılanmasını göstermiştir. BRAF V600 mutasyon pozitif melanomu olan hastalarda TAFİNLAR verilmesi başlangıca göre tümör fosforile ERK'nin inhibisyonuna yol açmıştır.
Trametinib ile kombinasyon
Trametinib mitojen-tarafından aktive edilen ekstrasellüler sinyalle regüle edilen kinaz 1 (MEK1) ve MEK2 aktivasyonunun ve kinaz aktivitesinin geri dönüşlü, yüksek düzeyde seçici, allosterik bir inhibitörüdür. MEK proteinleri, ekstrasellüler sinyalle-ilişkili kinaz (ERK) yolağının bileşenleridir. Bu şekilde trametinib ve TAFİNLAR bu yolakta iki kinazı (MEK ve RAF) inhibe eder ve dolayısıyla kombinasyon, yolakta eşzamanlı inhibisyon sağlar. TAFİNLAR+trametinib kombinasyonunun in vitro ortamda BRAF V600 mutasyonu pozitif melanom hücre dizilerinde anti-tümör aktiviteye sahip olduğu ve in vivo ortamda BRAF V600 mutasyonu pozitif melanom ksenograftlarında direnç gelişimini geciktirdiği gösterilmiştir.
BRAF mutasyon durumunun tespiti
TAFİNLAR veya trametinib ile kombinasyon olarak alınmasından önce geçerliliği kanıtlanmış bir test ile hastaların BRAF V600 mutasyon pozitif tümör durumu doğrulanmalıdır. Faz II ve III klinik çalışmalarda uygunluk taraması için, en son tümör örneğinde BRAF mutasyon değerlendirme testi kullanılarak merkezi BRAF V600 mutasyonunun değerlendirmesi gereklidir. Primer tümör veya metastatik bir alandan tümör sadece araştırma amaçlı geliştirilmiş (IUO) bir test ile değerlendirilmiştir. IUO, formalin ile fikse edilmiş parafine batırılmış (FFPE) tümör dokudan elde edilmiş DNA'ya uygulanmış allele özgü polimeraz zincir reaksiyonu (PCR) testidir. Test özellikle V600E ve V600K mutasyonları arasında ayırım yapmak üzere özel olarak geliştirilmiştir. Sadece BRAF V600E veya V600K mutasyonu pozitif tümörleri olan hastalar bu çalışmaya katılmak üzere uygun bulunmuştur.
Sonrasında tüm hasta örnekleri CE işareti taşıyan geçerliliği oluşturulmuş bioMerieux (bMx) THxID BRAF testi kullanılarak yeniden test edilmiştir. bMx THxID BRAF testi, FFPE tümör dokusundan alınan DNA üzerinde uygulanan alele özgün bir PCR'dır. Test BRAF V600E ve V600K mutasyonlarını yüksek bir duyarlılıkla tespit edecek şekilde tasarlanmıştır (FFPE dokusundan alınan DNA kullanılarak yabanıl tip sıralamasından oluşan bir tabanda %5 V600E ve V600K sekansına inerek). Geriye dönük iki-yönlü Sanger sıralama analizleriyle yapılan klinik-dışı ve klinik çalışmalar testin daha az yaygın BRAF V600D mutasyonunu ve V600E/K601E mutasyonunu da daha düşük bir duyarlılıkla tespit ettiğini göstermiştir. Klinik- dışı ve klinik çalışmalarda THxID BRAF testiyle mutasyon pozitif çıkan, ardından referans yöntem kullanılarak sıralaması yapılan örneklerde (n=876) testin özgünlüğünün %94 olduğu saptanmıştır.
Klinik etkililik ve güvenlilik
Rezeke edilemeyen veya metastatik melanom Trametinib ile kombinasyon halinde TAFİNLAR
Önceden tedavi görmemiş hastalar
BRAF V600 mutasyonlu rezeke edilemeyen veya metastatik melanomlu yetişkin hastaların tedavisinde TAFİNLAR (günde iki kez 150 mg) ile kombinasyon halinde trametinib (günde bir kez 2 mg) için önerilen dozun etkililiği ve güvenliliği iki Faz III çalışmada ve bir destekleyici Faz I/II çalışmada çalışılmıştır.
MEK115306 (COMBI-d)
MEK115306 rezeke edilemeyen (Evre IIIC) veya metastatik (Evre IV) BRAF V600E/K mutasyonu pozitif kutanöz melanomu olan gönüllüler için birinci basamak tedavi olarak TAFİNLAR ve trametinib kombinasyonunun TAFİNLAR ve plasebo ile karşılaştırıldığı bir Faz III, randomize, çift kör çalışmadır. Çalışmanın birincil sonlanım noktası progresyonsuz sağkalım (PFS) ve kritik ikincil sonlanım noktası Genel Sağkalım (OS) olmuştur. Gönüllüler laktat dehidrogenaz (LDH) düzeyi (≤ normalin üst sınırına (ULN) karşı > ULN) ve BRAF mutasyonuna (V600K'ya karşı V600E) göre sınıflandırılmıştır.
Toplam 423 gönüllü kombinasyon tedavisi (N=211) ya da TAFİNLAR (N=212) almak üzere 1:1 oranında randomize edilmiştir. Hastaların çoğu Beyaz (>%99) ve erkek (%53) olup medyan yaş 56'dır (%28'i ≥65 yaşındadır). Hastaların büyük çoğunluğu Evre IV M1c hastalığa (%67) sahiptir. Çoğu hastada başlangıçta LDH ≤ ULN (%65), ECOG performans durumu 0'dır (%72) ve bir viseral hastalık vardır (%73). Hastaların büyük çoğunlunda BRAF V600E mutasyonu söz konusudur (%85). Beyin metastazları olan gönüllüler çalışmaya dahil edilmemiştir.
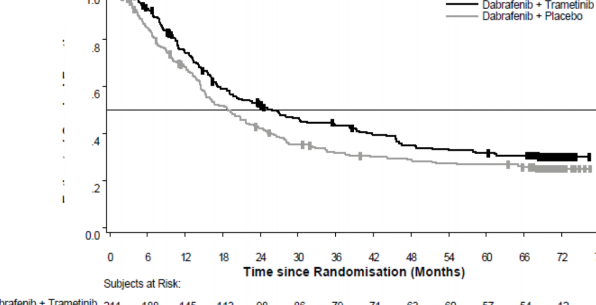
Medyan OS ve tahmini 1 yıllık, 2 yıllık, 3 yıllık, 4 yıllık ve 5 yıllık sağkalım oranları Tablo 4'te sunulmaktadır. 5 yılda gerçekleştirilen bir OS analizinde, kombinasyon kolu için medyan OS, TAFİNLAR monoterapisine kıyasla yaklaşık 7 ay daha uzun olmuş (18,7 aya karşı 25,8 ay), 5 yıllık sağkalım oranları TAFİNLAR monoterapisi için %27'ye karşılık kombinasyon için %32 bulunmuştur (Tablo 4, Şekil 1). Kaplan-Meier OS eğrisinin 3 ila 5 yıl arasında stabilize olduğu görülmektedir (bkz. Şekil 1). Beş yıllık genel sağkalım oranı, tedavi başlangıcında laktat dehidrojenaz düzeyleri normal olan hastalar için kombinasyon kolunda %40 (%95 GA: 31,2; 48,4) iken, TAFİNLAR monoterapi kolunda %33 (%95 GA: 25,0; 41,0) olmuştur; başlangıç laktat dehidrojenaz düzeyleri yüksek olan hastalar için ise TAFİNLAR monoterapi kolunda
%14'e (%95 GA: 6,8; 23,1) karşı kombinasyon kolunda %16 (%95 GA: 8,4; 26,0) bulunmuştur.
Tablo 4 Çalışma MEK115306 (COMBI-d) için Genel Sağkalım sonuçları
OS analizi (veri kesme tarihi: 12 Ocak 2015) | 5 yıllık OS analizi (veri kesme tarihi: 10 Aralık 2018) | |||
| TAFİNLAR + trametinib (n=211) | TAFİNLAR + Plasebo (n=212) | TAFİNLAR + trametinib (n=211) | TAFİNLAR + Plasebo (n=212) |
Hasta sayısı |
|
|
|
|
Ölen (olay), n (%) | 99 (47) | 123 (58) | 135 (64) | 151 (71) |
OS tahminleri (ay) | ||||
Medyan (%95 GA) | 25,1 (19,2; NR) | 18,7 (15,2; 23,7) | 25,8 (19,2; 38,2) | 18,7 (15,2; 23,1) |
Tehlike oranı (%95 GA) | 0,71 (0,55; 0,92) | 0,80 (0,63; 1,01) | ||
p değeri | 0,011 | NA |
| |
Genel sağkalım tahmini, % (%95 GA) | TAFİNLAR + trametinib (n=211) | TAFİNLAR + Plasebo (n=212) | ||
1 yılda | 74 (66,8; 79,0) | 68 (60,8; 73,5) | ||
2 yılda | 52 (44,7; 58,6) | 42 (35,4; 48,9) | ||
3 yılda | 43 (36,2; 50,1) | 31 (25,1; 37,9) | ||
4 yılda | 35 (28,2; 41,8) | 29 (22,7; 35,2) | ||
5 yılda | 32 (25,1; 38,3) | 27 (20,7; 33,0) | ||
NR = Ulaşılmadı, NA = Geçerli değil |
| |||
Randomizasyondan İtibaren Geçen Süre (Ay)
Riskteki gönüllüler:
Tahmini Sağkalım Fonksiyonu
Şekil 1 Çalışma MEK115306 için Kaplan-Meier genel sağkalım eğrileri (ITT Popülasyonu)
Birincil sonlanım noktası PFS'de sağlanan iyileşmeler, TAFİNLAR monoterapisine kıyasla, kombinasyon kolunda 5 yıllık bir zaman dilimi içinde sürdürülmüştür. Genel yanıt oranı (ORR) için de iyileşmeler gözlenmiştir ve kombinasyon kolunda TAFİNLAR monoterapisine kıyasla daha uzun bir yanıt süresi (DoR) izlenmiştir (Tablo 5).
Tablo 5 MEK115306 (COMBI-d) çalışmasının etkililik sonuçları
| Birincil analiz (veri kesme tarihi: 26 Ağustos 2013) | Güncellenmiş analiz (veri kesme tarihi: 12 Ocak 2015) | 5 yıllık analiz (veri kesme tarihi: 10 Aralık 2018) | |||
Sonlanım noktası | TAFİNLAR + Trametinib (n=211) | TAFİNLAR + Plasebo (n=212) | TAFİNLAR + Trametinib (n=211) | TAFİNLAR + Plasebo (n=212) | TAFİNLAR + Trametinib (n=211) | TAFİNLAR + Plasebo (n=212) |
PFS |
|
| ||||
Progresif hastalık veya ölüm, n (%) | 102 (48) | 109 (51) | 139 (66) | 162 (76) | 160 (76) | 166 (78) |
Medyan PFS (ay) (%95 GA) | 9,3 (7,7; 11,1) | 8,8 (5,9; 10,9) | 11,0 (8,0; 13,9) | 8,8 (5,9; 9,3) | 10,2 (8,1; 12,8) | 8,8 (5,9; 9,3) |
Tehlike oranı (%95 GA) | 0,75 (0,57; 0,99) | 0,67 (0,53; 0,84) | 0,73 (0,59; 0,91) | |||
P değeri | 0,035 | <0,001 | NA | |||
ORR % (%95 GA) | 67 (59,9; 73,0) | 51 (44,5; 58,4) | 69 (61,8; 74,8) | 53 (46,3; 60,2) | 69 (62,5; 75,4) | 54 (46,8; 60,6) |
ORR farkı (%95 GA) | 15 (5,9; 24,5) | 15 (6,0; 24,5) | NA | |||
P değeri | 0,0015 | 0,0014 | NA | |||
DoR (ay) Medyan (%95 GA) |
9,2 (7,4; NR) |
10,2 (7,5; NR) |
12,9 (9,4; 19,5) |
10,6 (9,1; 13,8) |
12,9 (9,3; 18,4) |
10,2 (8,3; 13,8) |
a - Progresyonsuz Sağkalım (araştırıcı tarafından değerlendirilen)
b - Genel Yanıt Oranı = Tam Yanıt + Kısmi Yanıt
c - Yanıt Süresi
d - Bildirim zamanında araştırıcı tarafından değerlendirilen yanıtların çoğu (≥ %59) halen devam etmektedir
e - Yuvarlanmamış ORR bulgusu temelinde hesaplanmış ORR farkı
f - Güncellenmiş analiz önceden planlı değildir ve p değeri çoklu test için düzeltilmemiştir NR = Ulaşılmamıştır
NA = Geçerli değildir
MEK116513 (COMBI-v)
MEK116513 çalışması, BRAF V600 mutasyonu pozitif rezeke edilemeyen veya metastatik melanomda TAFİNLAR ve trametinib kombinasyon tedavisini vemurafenib monoterapisi ile karşılaştıran 2 kollu, randomize, açık etiketli bir Faz III çalışmadır. Çalışmanın birincil sonlanım noktası genel sağkalım olup kritik ikincil sonlanım noktası PFS'dir. Gönüllüler laktat dehidrogenaz (LDH) düzeyi (≤ normalin üst sınırına (ULN) karşı >ULN) ve BRAF mutasyonuna (V600K'ya karşı V600E) göre sınıflandırılmıştır.
Toplam 704 gönüllü kombinasyon ya da vemurafenib almak üzere 1:1 oranında randomize edilmiştir. Hastaların çoğu Beyaz (>%96) ve erkek (%55) olup medyan yaş 55'tir (%24'ü ≥ 65 yaşındadır). Hastaların büyük çoğunluğu Evre IV M1c hastalığa (%61 genel) sahiptir. Çoğu hastada başlangıçta LDH ≤ ULN (%67), ECOG performans durumu 0'dır (%70) ve bir viseral hastalık vardır (%78). Genel olarak gönüllülerin %54'ünde çalışma başlangıcında < 3 hastalık bölgesi vardır. Hastaların büyük çoğunlunda BRAF V600E mutasyonu pozitif melanom söz konusudur (%89). Beyin metastazları olan gönüllüler çalışmaya dahil edilmemiştir.
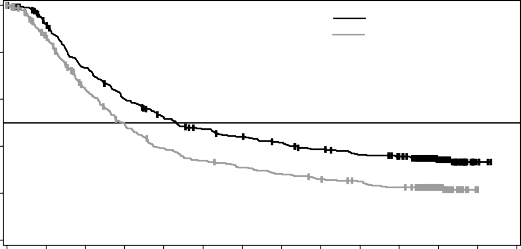
Medyan OS ve tahmini 1 yıllık, 2 yıllık, 3 yıllık, 4 yıllık ve 5 yıllık sağkalım oranları Tablo 6'da sunulmaktadır. 5 yılda gerçekleştirilen bir OS analizinde, kombinasyon kolu için ortalama OS, vemurafenib monoterapisine göre yaklaşık 8 ay daha uzun olmuş (17,8 aya karşı 26,0 ay), 5 yıllık sağkalım oranları vemurafenib monoterapisi için %23'e karşılık kombinasyon için %36 bulunmuştur (Tablo 6, Şekil 2). Kaplan-Meier OS eğrisinin 3 ila 5 yıl arasında stabilize olduğu görülmektedir (bkz. Şekil 2). Beş yıllık genel sağkalım oranı, tedavi başlangıcında laktat
dehidrojenaz düzeyleri normal olan hastalar için kombinasyon kolunda %46 (%95 GA: 38,8; 52,0) iken, vemurafenib monoterapi kolunda %28 (%95 GA: 22,5; 34,6) olmuştur; başlangıç laktat dehidrojenaz düzeyleri yüksek olan hastalar için ise vemurafenib monoterapi kolunda
%10'a (%95 GA: 5,1; 17,4) karşı kombinasyon kolunda %16 (%95 GA: 9,3; 23,3) bulunmuştur.
Tablo 6 Çalışma MEK116513 (COMBI-v) için Genel Sağkalım sonuçları
OS analizi (veri kesme tarihi: 13 Mart 2015) | 5 yıllık OS analizi (veri kesme tarihi: 08 Ekim 2018) | |||
| TAFİNLAR + Trametinib (n=352) | Vemurafenib (n=352) | TAFİNLAR + Trametinib (n=352) | Vemurafenib (n=352) |
Hasta sayısı |
|
|
|
|
Ölen (olay), n (%) | 155 (44) | 194 (55) | 216 (61) | 246 (70) |
OS tahminleri (ay | ) |
|
|
|
Medyan (%95 GA) | 25,6 (22,6; NR) | 18,0 (15,6; 20,7) | 26,0 (22,1; 33,8) | 17,8 (15,6; 20,7) |
Düzeltilmiş tehlike oranı (%95 GA) | 0,66 (0,53; 0,81) | 0,70 (0,58; 0,84) | ||
p değeri | <0,001 |
| NA |
|
Genel sağkalım tahmini, % (%95 GA) | TAFİNLAR + Trametinib (n=352) | Vemurafenib (n=352) | ||
1 yılda | 72 (67; 77) | 65 (59; 70) | ||
2 yılda | 53 (47,1; 57,8) | 39 (33,8; 44,5) | ||
3 yılda | 44 (38,8; 49,4) | 31 (25,9; 36,2) | ||
4 yılda | 39 (33,4; 44,0) | 26 (21,3; 31,0) | ||
5 yılda | 36 (30,5; 40,9) | 23 (18,1; 27,4) | ||
NR = Ulaşılmamıştır, NA = Geçerli değildir |
| |||
Şekil 2 MEK116513 çalışması için güncel OS analizinin Kaplan-Meier eğrileri
Estimated Survival Function
![]()
Tahmini Sağkalım Fonksiyonu
Time since Randomisation (Months)
![]()
Randomizasyondan İtibaren Geçen Süre (Ay)
İkincil sonlanım noktası PFS'de sağlanan iyileşmeler, vemurafenib monoterapisine kıyasla, kombinasyon kolunda 5 yıllık bir zaman dilimi içinde sürdürülmüştür. Genel yanıt oranı (ORR) için de iyileşmeler gözlenmiştir ve kombinasyon kolunda vemurafenib monoterapisine kıyasla daha uzun bir DoR izlenmiştir (Tablo 7).
Tablo 7 MEK116513 (COMBI-v) çalışması için etkililik sonuçları
| Birincil analiz (Veri kesme tarihi: 17 Nisan 2014) | 5 yıllık analiz (Veri kesme tarihi: 08 Ekim 2018) | ||
Sonlanım noktası | TAFİNLAR + Trametinib (n=352) | Vemurafenib (n=352) | TAFİNLAR + Trametinib (n=352) | Vemurafenib (n=352) |
PFS |
|
| ||
Progresif hastalık veya ölüm, n (%) | 166 (47) | 217 (62) | 257 (73) | 259 (74) |
Medyan PFS (ay) (%95 GA) | 11,4 (9,9; 14,9) | 7,3 (5,8; 7,8) | 12,1 (9,7; 14,7) | 7,3 (6,0; 8,1) |
Tehlike oranı (%95 GA) | 0,56 (0,46; 0,69) | 0,62 (0,52; 0,74) | ||
P değeri | <0,001 | NA | ||
| Birincil analiz (Veri kesme tarihi: 17 Nisan 2014) | 5 yıllık analiz (Veri kesme tarihi: 08 Ekim 2018) | ||
Sonlanım noktası | TAFİNLAR + Trametinib (n=352) | Vemurafenib (n=352) | TAFİNLAR + Trametinib (n=352) | Vemurafenib (n=352) |
ORR % (%95 GA) | 64 (59,1; 69,4) | 51 (46,1; 56,8) | 67 (62,2; 72,2) | 53 (47,2; 57,9) |
ORR farkı (%95 GA) | 13 (5,7; 20,2) | NA | ||
p değeri | 0,0005 | NA | ||
DoR (ay) Medyan (%95 GA) |
13,8 (11,0; NR) |
7,5 (7,3; 9,3) |
13,8 (11,3; 18,6) |
8,5 (7,4; 9,3) |
a – Progresyonsuz sağkalım (araştırmacı tarafından değerlendirilen) b – Genel Yanıt Oranı = Tam Yanıt + Kısmi Yanıt c – Yanıt süresi d – Raporlama sırasında, araştırmacı tarafından değerlendirilen yanıtların çoğunluğu (TAFİNLAR+trametinib %59 ve vemurafenib %42) halen devam etmektedir NR = Ulaşılmamıştır NA = Geçerli değildir | ||||
Önceki BRAF inhibitör tedavisi
Önceki BRAF inhibitör tedavisinde progrese olmuş hastalarda TAFİNLAR+trametinib kombinasyonu ile sınırlı veri mevcuttur.
BRF113220 çalışması Bölüm B, bir BRAF inhibitör tedavisinde progrese olmuş 26 hastadan oluşan bir grubu içermiştir. Trametinib 2 mg QD ve TAFİNLAR 150 mg BID kombinasyonu, bir BRAF inhibitörü tedavisinde progrese olan hastalarda sınırlı klinik aktivite göstermiştir. Araştırmacı tarafından değerlendirilen doğrulanmış yanıt oranı %15 (%95 GA: 4,4, 34,9) ve medyan PFS 3,6 ay (%95 GA: 1,9, 5,2) bulunmuştur. Bu çalışmanın C Bölümünde TAFİNLAR monoterapisinden trametinib 2 mg QD+TAFİNLAR 150 mg BID kombinasyonuna geçiş yapan 45 hastada da benzer sonuçlar görülmüştür. Bu hastalarda 3,6 ay (%95 GA: 2, 4) medyan PFS ile %13'lük (%95 GA: 5,0, 27,0) bir doğrulanmış yanıt oranı gözlenmiştir.
Beyin metastazları olan hastalar:
Beyne metastaz yapmış BRAF V600 mutant-pozitif melanomu olan hastalarda trametinib ile kombinasyon halinde TAFİNLAR'ın etkililik ve güvenliliği, randomize olmayan, açık etiketli, çok merkezli bir Faz II çalışmada (COMBI-MB çalışması) incelenmiştir. Toplam 125 hasta dört kohorta kaydedilmiştir:
Kohort A: Daha önce beyin hedefli lokal tedavinin yapılmadığı, asemptomatik beyin metastazları ile birlikte BRAFV600E mutant melanomun olduğu, ECOG performans durumu 0 ya da 1 olan hastalar.
5.2. Farmakokinetik özellikler
Genel ÖzelliklerEmilim:
TAFİNLAR oral olarak emilir. Dozdan 2 saat sonra pik plazma konsantrasyonuna ulaşır. Oral TAFİNLAR'ın ortalama mutlak biyoyararlanımı %95'dir (%90 GA: %81, %110). TAFİNLAR maruziyeti (Cve EAA) doz ile orantılı olarak 12 ve 300 mg tek doz olarak verilmesinden sonra artmıştır, fakat bu artış günde 2 kez tekrarlanan doz alımından sonraki artıştan daha azdır. Tekrarlanan dozlar ile maruziyette bir azalma gözlemlenmiştir; bu da kendi metabolizmasının indüklenmesine bağlı olabilir. Ortalama birikim EAA Gün 18/Gün 1 oranları 0,73'dür. Günde 2 kez 150 mg verilmesinden sonra, geometrik ortalama C, EAA(0-Ï„) ve predoz konsantrasyonu (CÏ„) sırasıyla 1478 ng/ml, 4341 ng*sa/ml ve 26 ng/ml'dir.
TAFİNLAR'ın yiyecekler ile birlikte verilmesi biyoyararlanımı (Cve EAA sırasıyla %51 ve %31 düşer) azaltmıştır ve açlık durumu ile karşılaştırıldığında TAFİNLAR kapsüllerinin absorpsiyonunu geciktirmiştir.
Dağılım:
TAFİNLAR birincil olarak insan plazma proteinine bağlanır (%99,7 bağlı). İntravenöz mikrodoz verilmesinden sonra dağılımın sabit durum hacmi 46 L'dir.
Biyotransformasyon:
TAFİNLAR metabolizması birincil olarak CYP2C8 ve CYP3A4 aracılığıyla hidroksi- dabrafenib oluşturmaktadır; bu ise daha sonra CYP3A4 aracılığıyla karboksi dabrafenib oluşturmak üzere oksitlenir. Karboksi-dabrafenib enzimatik olmayan bir işlem ile desmetil dabrafenib oluşturmak üzere dekarboksillenir. Karboksi-dabrafenib safra ve idrarda atılır. Desmetil-dabrafenib bağırsaklarda oluşur ve tekrar emilir.
Desmetil-dabrafenib CYP3A4 aracılığıyla oksidatif metabolitlerine metabolize olur. Hidroksi- dabrafenib terminal yarılanma ömrü ana ürünün yarılanma ömrü olan 10 saate paralel iken karboksi- ve desmetil- metabolitleri daha uzun yarılanma ömrüne sahiptir (21-22 saat). Tekrarlanan doz alımlarından sonra hidroksi, karboksi ve desmetil defabrenibin ortalama metabolit/ ana ürün EAA oranları sırasıyla 0,9; 11 ve 0,7'dir. Maruziyet, rölatif güç ve farmakokinetik özelliklere göre hidroksi- ve desmetil-dabrafenibin her ikisi de TAFİNLAR'ın klinik aktivitesine katkıda bulunmakta iken karboksi-dabrafenibin aktivitesi anlamlı değildir.
İlaç-ilaç etkileşim potansiyelinin in vitro değerlendirmesi:
TAFİNLAR in vitro ortamda insan P-glikoproteini (Pgp) ve insan BCRP substratıdır. Ancak bu taşıyıcıların TAFİNLAR'ın oral biyoyararlanımı ve atılımı üzerindeki etkileri minimaldir ve Pgp ya da BCRP inhibitörleri ile klinik olarak anlamlı ilaç etkileşimi gösterme riski
3
düşüktür. TAFİNLAR ya da 3 ana metabolitinin Pgp inhibitörü oldukları in vitro koşullarda gösterilmemiştir.
TAFİNLAR ve metabolitleri hidroksi-dabrafenib, karboksi-dabrafenib ve desmetil-dabrafenib in vitro ortamda insan organik anyon taşıyıcısı (OAT) 1 ve OAT3'ün inhibitörleri ve de, TAFİNLAR ve desmetil metabolit in vitro ortamda organik katyon taşıyıcıları 2'nin (OCT2) inhibitörü olsa dahi, bu taşıyıcılarda ilaç-ilaç etkileşimi riski TAFİNLAR ve metabolitlerinin klinik maruziyeti baz alındığında minimaldir.
Eliminasyon:
Tek intravenöz mikro-dozdan sonra TAFİNLAR'ın terminal yarılanma ömrü 2,6 saattir. TAFİNLAR terminal yarılanma ömrü, tek oral dozdan sonra, oral uygulama sonrasındaki emilim-kısıtlı eliminasyon nedeniyle 8 saattir (iki durumlu farmakokinetik). IV plazma klirensi 12 l/saattir.
Oral dozdan sonra TAFİNLAR‘ın başlıca eliminasyon yolu CYP3A4 ve CYP2C8 aracılı metabolizmadır. TAFİNLAR ile ilgili bileşikler temelde feçes ile atılır; oral dozun %71'i feçeste ve %23'i idrarda sadece metabolitler olarak tespit edilir.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Bir popülasyon farmakokinetik analizi, hafif düzeyde yüksek bilirubin ve/veya AST düzeylerinin (Ulusal Kanser Enstitüsü [NCI] sınıflandırmasına göre) TAFİNLAR oral klirensini anlamlı ölçüde etkilemediğini göstermektedir. Ayrıca, bilirubin ve AST ile tanımlanan hafif karaciğer bozukluğunun, TAFİNLAR'ın metabolit plazma konsantrasyonları üzerinde anlamlı etkisi olmamıştır. Orta şiddette veya şiddetli karaciğer yetmezliği olan hastalar ile ilgili herhangi bir veri mevcut değildir. Hepatik metabolizma ve safra yoluyla atılım, TAFİNLAR'ın ve metabolitlerinin primer eliminasyon yolları olduğundan, TAFİNLAR, orta ila şiddetli düzeyde karaciğer yetmezliği bulunan hastalarda dikkatli şekilde uygulanmalıdır (bkz. Bölüm 4.2).
Böbrek yetmezliği:
Bir popülasyon farmakokinetik analizi, hafif böbrek bozukluğunun TAFİNLAR'ın oral klirensini etkilemediğini göstermektedir. Orta dereceli böbrek bozukluğu olan hastalarda klinik veriler sınırlı olmakla birlikte bu veriler klinik açıdan anlamlı bir etkiye işaret etmemektedir. Şiddetli böbrek bozukluğu olan hastalarda klinik veri yoktur (bkz. Bölüm 4.2).
Geriyatrik popülasyon:
Popülasyon farmakokinetik analizine göre, yaşın TAFİNLAR farmakokinetiği üzerinde önemli bir etkisi yoktur. Karboksi- ve desmetil-dabrafenib plazma konsantrasyonları için yaşın 75'ten büyük olması önemli bir belirteç olmuştur; ≥75 yaş hastalarda < 75 yaş hastalara kıyasla %40 daha fazla maruziyet saptanmıştır.
Vücut ağırlığı ve cinsiyet:
Popülasyon farmakokinetik analizine göre, cinsiyet ve ağırlık TAFİNLAR'ın oral klerensini etkilemiştir, ayrıca ağırlık oral hacmin dağılımı ve dağılma klerensini de etkilemiştir. Bu farmakokinetik farklılıklar klinik olarak anlamlı kabul edilmemiştir.
Irk:
Popülasyon farmakokinetiği analizi Asyalı ve Beyaz hastalar arasında TAFİNLAR farmakokinetiği bakımından anlamlı farklılıklar göstermemiştir. Diğer ırkların TAFİNLAR
4
farmakokinetiği üzerindeki potansiyel etkisinin değerlendirebilmek için yetersiz veri mevcuttur.
Pediyatrik popülasyon:
Pediyatrik hastalarda TAFİNLAR farmakokinetiğini araştıran çalışmalar yapılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
TAFİNLAR ile karsinojenite çalışmaları yapılmamıştır. TAFİNLAR, bakteri ve kültüre edilmiş memeli hücrelerindeki in vitro testlerde ve in vivo kemirgen mikronükleus değerlendirme testinde mutajenik veya klastojenik değildir.
Birleşik dişi fertilitesinde, sıçanlarda erken embriyonik ve embriyofetal gelişim çalışmalarında overiyen korpora lutea sayıları hamile dişilerde 300 mg/kg/gün seviyesine düşmüştür (EAA bazında insan klinik maruziyetinin yaklaşık 3 katı), fakat östrojen döngüsü, çiftleşme veya fertilitede etkileri yoktur. 300 mg/kg/gün dozunda embriyo-letalite ve ventriküler septal kusurlar ve timüs şeklinde varyasyon ve ≥20 mg/kg/gün dozlarında (EAA bazında insan klinik maruziyetinin ≥ 0,5 katı) iskelet gelişiminde gecikme ve fetüs ağırlığında azalma dahil gelişimsel toksisite görülmüştür.
TAFİNLAR ile erkek fertilite çalışmaları yapılmamıştır. Fakat tekrarlanan doz çalışmalarında sıçanlarda ve köpeklerde (EAA bazında insan klinik maruziyetinin ≥ 0,2 katı) testiküler dejenerasyon/deplesyon görülmüştür. Sıçan ve köpeklerdeki testiküler değişiklikler 4 haftalık iyileşme döneminden sonra da devam etmiştir (bkz. Bölüm 4.6).
Köpeklerde (EAA bazında klinik maruziyetin ≥ 2 katı) koroner arter dejenerasyon/nekroz ve/veya hemoraji, kardiyak atriyoventriküler kapak hipertrofisi/hemoraji ve atriyal fibrovasküler proliferasyon dahil olmak üzere kardiyovasküler etkiler görülmüştür. Farelerde çeşitli dokularda fokal arteriyel/perivasküler enflamasyon gözlenmiş olup, sıçanlarda enflamasyon eşliğinde spontan kardiyomiyosit dejenerasyonu (spontan kardiyomiyopati) ve hepatik arteriyel dejerasyon insidansında bir artış gözlenmiştir (sıçanlar ve fareler için klinik maruziyetin sırasıyla ≥0,5 ve 0,6 katı). Farelerde hepatoselüler nekroz ve enflamasyonu da içeren hepatik etkiler gözlenmiştir (klinik maruziyetin ≥0,6 katı).
Akciğerlerin bronkoalveolar inflamasyonu birçok köpekte ≥ 20 mg/kg/gün (EAA değerine göre insan klinik maruziyetinin ≥ 9 katı) dozunda görülmüştür ve yüzeysel ve/veya zorlu solunum ile birliktedir.
TAFİNLAR verilen köpek ve sıçanlarda geri dönüşümlü hematolojik etkiler gözlemlenmiştir. Köpek ve sıçanlarda, 13 haftaya kadar olan çalışmalarda retikülosit sayısı ve/veya kırmızı hücre kütlesi gözlenmiştir (sırasıyla klinik maruziyetin ≥ 10 ve 1,4 katı).
Farelerde jüvenil toksisite çalışmaları, büyüme üzerinde etki (uzun kemik boyunun daha kısa olması), renal toksisite (tübüler çökeltiler, artmış kortikal kist ve tübüler bazofili sıklığı, üre ve/veya kreatinin konsantrasyonlarında geri dönüşümlü artışlar) ve testiküler toksisite (dejenerasyon ve tübüler genişleme) gözlenmiştir (EAA bazında yetişkin insan klinik maruziyetinin ≥0,2 katı).
TAFİNLAR, bir fare fibroblast 3T3 Nötr Kırmızı Tutulumu (NRU) tayininde in vitro şartlarda ve tüysüz farelerdeki bir oral fototoksisite çalışmasında ≥ 100 mg/kg dozlarda (Cbazında klinik maruziyetin >44 katı) in vivo koşullarda fototoksik etki göstermiştir.
Trametinib ile kombinasyon
Köpeklerle yürütülen trametinib ve TAFİNLAR'ın 4 hafta süreyle kombinasyon halinde verildiği bir çalışmada, tek başına trametinib verilen köpeklere kıyasla gastrointestinal
5
toksisite ve azalan timus lenfoit selülaritesinde daha düşük maruziyetlerde gözlenmiştir. Bunun dışında, benzer monoterapi çalışmalarındakiler ile benzer toksisiteler gözlenmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Kapsül içeriği Mikrokristalin selüloz Magnezyum stearat Kolloidal silikon dioksit Kapsül kabuğu
Kırmızı demir oksit (E172) Titanyum dioksit (E171) Hipromelloz (E464)
Baskı mürekkebi
Siyah demir oksit (E172) Şellak (böcek kaynaklı) n-Butil alkol
İzopropil alkol Propilen glikol Amonyum hidroksit
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
tedbirler30°C'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Vidalı plastik kapaklı, opak, beyaz, yüksek yoğunluklu polietilen (HDPE) şişe ve silika jel kurutucu madde.
Ambalaj boyutları: 28 veya 120 sert kapsül. Tüm ambalaj boyutları pazarda bulunmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ
Novartis Sağlık, Gıda ve Tarım Ürünleri San. Ve Tic. A.Ş.
6
Kavacık/Beykoz/İstanbul
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A14983 |
| Satış Fiyatı | 117447.95 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 117447.95 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504151022 |
| Etkin Madde | Dabrafenib |
| ATC Kodu | L01EC02 |
| Birim Miktar | 75 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 120 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ve Beşeri bir ilaçdır. |