TALDEROL 90 mg film kaplı tablet (56 tablet) Farmakolojik Özellikler
{ Tikagrelor }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Trombosit agregasyon inhibitörleri (Heparin hariç) ATC kodu: B01AC24
Etki mekanizması
Tikagrelor, oral, doğrudan etkili, selektif ve geri dönüşümlü olarak bağlanan bir P2Yreseptör antagonisti olan ve ADP-aracılı P2Y'ye bağımlı trombosit aktivasyonunu ve agregasyonunu inhibe eden, siklopentiltriazolopirimidin (SPTP) kimyasal sınıfının bir üyesi olan tikagrelor içermektedir. Tikagrelor ADP'nin reseptöre bağlanmasını engellemez ancak P2Yreseptörüne bağlandığı zaman ADP-uyarılı sinyal iletimini engeller. Trombositler aterosklerotik hastalığın trombotik komplikasyonlarının başlaması ve/veya gelişmesine katıldıkları için, trombosit fonksiyonu inhibisyonunun ölüm, MI veya inme gibi KV olay riskini azalttıkları gösterilmiştir. Tikagrelor, aynı zamanda dengeleyici nükleozid taşıyıcısı-1 (ENT-1)'i inhibe ederek lokal endojen adenozin düzeylerini de arttırır.
Tikagrelorun, sağlıklı kişilerde ve AKS hastalarında aşağıdaki adenozin-uyarılı etkileri arttırdığı belgelenmiştir: vazodilatasyon (sağlıklı gönüllüler ve AKS hastalarında koroner kan akışı artışlarıyla ölçülür; baş ağrısı), trombosit fonksiyonu inhibisyonu (in vitro olarak insanda tam kanda) ve dispne. Bununla birlikte, gözlemlenen adenozin artışları ve klinik sonuçlar (örn.;morbidite-mortalite) arasındaki bağlantı açıkça ortaya konmamıştır.
Farmakodinamik etkiler
Etkinin başlaması
ASA tedavisi görmekte olan stabil koroner arter hastalığı (KAH) olan hastalarda, tikagrelor,
0.5 saatte 180 mg yükleme dozundan sonra yaklaşık %41'lik ortalama trombosit agregasyon inhibisyonu (TAİ) değeri ile hızlı farmakolojik etki başlangıcı göstermiştir; %89'luk maksimum TAİ etkisi dozdan 2-4 saat sonra ortaya çıkmış ve 2-8 saat arasında sürmüştür. Dozdan 2 saat sonra hastaların %90'ında nihai kapsamlı TAİ > %70'dir.
Etkinin sonlanması
Eğer KABG prosedürü planlanıyorsa, tikagrelorun prosedürden önce 96 saatten daha kısa bir süre içerisinde kesilmesi durumunda tikagrelor kanama riski klopidogrele göre artmaktadır.
Geçiş verileri
Klopidogrel 75 mg'dan günde iki kez tikagrelor 90 mg'a geçiş, %2Saklamaya yönelik özel tedbirler tedbirler mutlak TAİ artışı ile sonuçlanır ve tikagrelordan klopidogrele geçiş %24.5 mutlak TAİ azalması ile sonuçlanır. Hastalar antitrombositik etkide herhangi bir kesinti olmaksızın klopidogrelden tikagrelore geçebilir (Bkz. Bölüm 4.2).
Klinik etkililik ve güvenlilik
Tikagrelorun etkililiği ve güvenliliği için klinik bulgular iki faz 3 çalışmasından elde edilmiştir:
PLATO [PLATelet Inhibition and Patient Outcomes] çalışması, her ikisi de ASA ve diğer standart tedavi ile kombinasyon halinde verilen tikagrelorun klopidogrel ile karşılaştırılması
PEGASUS TIMI-54 [PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients] çalışması, ASA ile kombinasyon halinde tikagrelor tedavisinin tek başına ASA tedavisi ile karşılaştırılması
PLATO çalışması (Akut Koroner Sendromlar)
PLATO çalışması, stabil olmayan anjina (UA), ST yükselmesiz miyokard enfarktüsü (NSTEMI) veya ST yükselmeli miyokard enfarktüsü (STEMI) semptomlarının başlangıçlarının 24 saati içinde bulunan ve öncelikle tıbbi olarak veya perkutan koroner girişim (PKG) veya KABG ile tedavi edilen 18624 hastayı kapsamaktadır.
Klinik etkililik
Günde bir defa ASA uygulanan arka plan tedavisinde, günde iki defa 90 mg tikagrelorun KV ölüm, Mİ veya inmeden oluşan kompozit sonlanım noktasını önleme açısından günde bir defa 75 mg klopidogrelden üstün olduğu görülmüş olup, farka KV ölüm ve Mİ neden olmuştur. Hastalara 300 mg klopidogrel yükleme dozu (PKG uygulanacaksa 600 mg da verilebilir) veya 180 mg tikagrelor verilmiştir.
Bu sonuç erken dönemde ortaya çıkmış (30 günde mutlak risk azalması [MRA] %0.6 ve nispi risk azalması [NRA] %12), 12 aylık dönem süresince istikrarlı bir tedavi etkisi söz konusu olmuş,
%16'lık NRA ile senede %1.9'lık MRA sağlanmıştır. Bu sonuçlar, hastaların 12 ay süreyle günde iki kez tikagrelor 90 mg ile tedavi edilmesinin uygun olduğunu göstermektedir (Bkz. Bölüm 4.2). 54 AKS hastasının klopidogrel yerine tikagrelor ile tedavi edilmesi, 1 aterotrombotik vakayı önleyecek; 91 hastanın tedavi edilmesi ise 1 KV ölümü önleyecektir (Bkz. Şekil 1 ve Tablo 3).
Tikagrelorun klopidogrele kıyasla tedavi etkisi; kilo, cinsiyet, diyabet tıbbi öyküsü, geçici iskemik atak veya hemorajik olmayan inme veya revaskülarizasyon; heparinler, GpIIb/IIIa inhibitörleri ve proton pompası inhibitörleri içeren eşzamanlı tedaviler (Bkz. Bölüm 4.5); nihai indeks olgu tanısı (STEMI, NSTEMI veya UA) ve randomizasyonda hedeflenen tedavi yolağı (invazif veya tıbbi) dahil olmak üzere pek çok alt grup arasında tutarlıdır.
Birincil sonlanım noktasına ait tehlike oranının (TO) Kuzey Amerika'da klopidogreli desteklediği; ancak dünyanın geri kalanında tikagreloru desteklediği düşük düzeyde anlamlı bir tedavi etkileşimi gözlenmiş olup, bu etkileşimin incelenen genel popülasyonun yaklaşık
%10'unu temsil ettiği görülmüştür (etkileşim p-değeri = 0.045). Araştırmaya yönelik analizler, ASA dozunun artmasıyla birlikte tikagrelor ile etkililiğinin azaldığı gözlendiği için ASA dozuyla olası bir ilişki olduğunu ortaya koymaktadır. Tikagrelor ile birlikte verilecek olan kronik günlük ASA dozları 75 â 150 mg olmalıdır (Bkz. Bölüm 4.2 ve 4.4).
Şekil 1'de bileşik etkililik sonlanım noktasında herhangi bir olayın tahmini ilk görülme riski gösterilmektedir.
Şekil 1 â KV ölüm, Mİ ve inmenin birincil klinik bileşik sonlanım noktası analizi (PLATO)
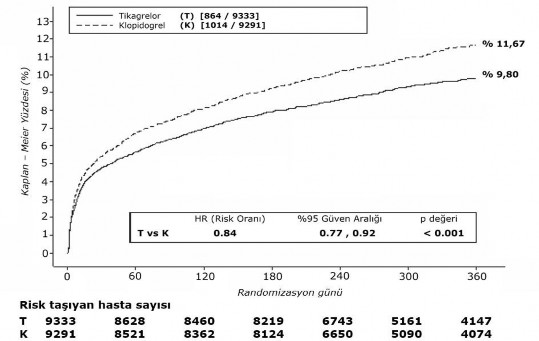
Tikagrelor, klopidogrel ile kıyaslandığında hem UA/NSTEMI hem de STEMI popülasyonunda birincil bileşik sonlanım noktasının ortaya çıkmasını azaltır (Tablo 3). Dolayısıyla, medikal tedavi gören hastalar ve perkutan koroner girişim (PKG) ya da koroner bypass grefti (KABG) ile tedavi edilen hastalar dahil olmak üzere AKS hastalarında (stabil olmayan anjina, ST yükselmesiz Miyokart İnfarktüsü [NSTEMI] ve ST yükselmeli Miyokart İnfarktüsü [STEMI]) düşük doz ASA ile birlikte günde iki kez tikagrelor 90 mg kullanılabilir.
Tablo 3â Birincil ve ikincil etkililik sonlanım noktalarının analizi (PLATO)
| Günde iki kez tikagrelor 90 mg (olay yaşayan hasta %'si) N=9333 | Günde bir kez klopidogrel 75 mg (olay yaşayan hasta %'si) N=9291 |
MRA (%/yıl) |
NRA(%) (%95 GA) |
p-değeri |
KV ölüm, Mİ (sessiz Mİ hariç) ya da inme |
9.3 |
10.9 |
1.9 |
16 (8, 23) |
0.0003 |
İnvazif müdahale | 8.5 | 10.0 | 1.7 | 16 (6, 25) | 0.0025 |
Medikal müdahale | 11.3 | 13.2 | 2.3 | 15 (0.3, 27) | 0.0444 |
KV ölüm | 3.8 | 4.8 | 1.1 | 21 (9, 31) | 0.0013 |
Mİ (sessiz Mİ hariç) | 5.4 | 1.1 | 16 (5, 25) | 0.0045 | |
İnme | 1.3 | 1.1 | -0.2 | -17 (-52, 9) | 0.2249 |
Tüm nedenlere bağlı mortalite, Mİ (sessiz Mİ hariç) ya da inme |
9.7 |
11.5 |
2.1 |
16 (8, 23) |
0.0001 |
KV ölüm, toplam Mİ, inme, CRİ, RI, GİA ya da diğer ATO |
13.8 |
15.7 |
2.1 |
12 (5, 19) |
0.0006 |
Tüm nedenlere bağlı mortalite |
4.3 |
5.4 |
1.4 |
22 (11, 31) |
0.0003 |
Belirli stent trombozu |
1.2 |
1.7 |
0.6 |
32 (8, 49) |
0.0123 |
aMRA = mutlak risk azalması; NRA = nispi risk azalması = (1-Tehlike oranı) x %100. Negatif NRA nispi risk artışını göstermektedir.
bSessiz Mİ hariç.
cCRİ = Ciddi reküren iskemi; RI = Reküren iskemi; GİA = Geçici iskemik atak; ATO = Arteriyel trombotik olay. Toplam Mİ, sessiz Mİ'yi içerir ve olayın tarihi, keşfedildiği tarih olarak belirlenir.
dNominal anlamlılık değeri; tüm diğerleri önceden tanımlanmış hiyerarşi testine göre resmi olarak ve istatistiksel açıdan anlamlıdır.
PLATO genetik alt çalışması
PLATO çalışmasında 10285 hastanın CYP2C19 ve ABCB1 genotiplerinin belirlenmesi, genotip gruplarının PLATO sonuçlarıyla ilişkilerini ortaya koymuştur. Tikagrelorun klopidogrele göre majör KV olayları azaltmadaki üstünlüğü, hastanın CYP2C19 ya da ABCB1 genotipinden anlamlı oranda etkilenmemiştir. Genel PLATO çalışmasına benzer şekilde, toplam PLATO majör kanama, CYP2C19 ya da ABCB1 genotipinden bağımsız olarak tikagrelor ve klopidogrel arasında farklılık göstermemiştir. KABG olmayan PLATO majör kanama, bir ya da daha fazla CYP2C19 fonksiyon kaybı alleli olan hastalarda klopidogrel ile karşılaştırıldığında tikagrelor ile artış göstermiştir; fakat fonksiyon kaybı alleli olmayan hastalarda klopidogrele benzerdir.
Kombine etkililik ve güvenlilik bileşimi
Kombine etkililik ve güvenlilik bileşimi (KV ölüm, Mİ, inme veya PLATO tanımlı âtoplam majörâ kanama) klopidogrel ile karşılaştırıldığında tikagrelorun etkililiğindeki faydanın, AKS'den sonraki 12 ayda majör kanama olayları ile dengelenmediğini göstermektedir (MRA
%1.4, NRA %8, TO 0.92; p=0.0257).
Klinik güvenlilik
Holter alt çalışması:
PLATO çalışması sırasında ventriküler duraklamaların ve diğer aritmik epizotların ortaya çıkışını incelemek üzere araştırmacılar yaklaşık 3000 hastadan oluşan bir alt grupta Holter izlemi yapmıştır; bu hastaların yaklaşık 2000'nininde hem AKS'lerinin akut fazında hem de bir ay sonrasında kayıtlar mevcuttur. İncelenen primer değişken, ≥ 3 saniyelik ventriküler duraklamaların ortaya çıkmasıdır. Akut fazda klopidogrele (%3.5) göre tikagrelor (%6.0) ile daha fazla hastada ventriküler duraksamalar olmuştur, 1 ay sonra bu oranlar sırasıyla %2.2 ve
%1.6'dır (Bkz. Bölüm 4.4). AKS'nin akut fazında ventriküler duraklamalardaki artış, KKY öyküsü olan tikagrelor hastalarında daha belirgin olmuştur (KKY öyküsü olmayan hastalarda
%9.2'ye karşı %5.4; klopidogrel hastalarında, KKY öyküsü olmayanlarda %3.6'ya karşı %4.0). Bu dengesizlik bir ayda ortaya çıkmamıştır: KKY öyküsü olan ve olmayan tikagrelor hastaları için sırasıyla %2.0'a karşı % 2.1 ve klopidogrel ile % 3.8'e karşı %1.4'tür. Bu hasta popülasyonunda bu dengesizlik ile ilişkili advers klinik sonuçlar söz konusu olmamıştır (pacemaker yerleştirilmesi durumları dahil).
PEGASUS Çalışması (Miyokart İnfarktüsü Öyküsü)
PEGASUS TIMI-54 çalışması, Mİ öyküsü ve aterotromboz açısından ek risk faktörleri olan hastalarda tek başına ASA tedavisi ile karşılaştırıldığında düşük doz ASA (75-150 mg) ile kombinasyon halinde 2 doz şeklinde (ya günde iki kez 90 mg ya da günde iki kez 60 mg) verilen tikagrelor ile aterotrombotik olayların önlenmesini değerlendiren 21,162 hastalı, olayların yön verdiği, randomize, çift kör, plasebo kontrollü, paralel gruplu, uluslararası çok merkezli bir çalışmadır.
50 yaş veya üzeri, Mİ öyküsü (randomizasyondan 1 ila 3 yıl önce) ve aşağıdaki aterotromboz risk faktörlerinden en azından birine sahip hastalar çalışmaya katılım açısından uygun bulunmuştur: ≥65 yaş, ilaç tedavisi gerektiren diabetes mellitus, önceden geçirilmiş ikinci bir Mİ, çoklu damar KAH bulgusu veya son evre olmayan kronik böbrek fonksiyon bozukluğu.
Hastalar şu durumlarda çalışmaya katılım açısından uygunsuz bulunmuştur: Çalışma süresince P2Y12 reseptör antagonisti, dipiridamol, silostazol veya antikoagülan tedavisi planlanmışsa;
pıhtılaşma bozukluğu varsa veya iskemik inme veya intrakraniyal kanama öyküsü varsa, santral sinir sistemi tümörü veya bir intrakraniyal vasküler anomali varsa; önceki 6 ay içinde gastrointestinal kanamaları olmuşsa veya önceki 30 gün içinde majör ameliyat geçirmişlerse.
Klinik etkililik
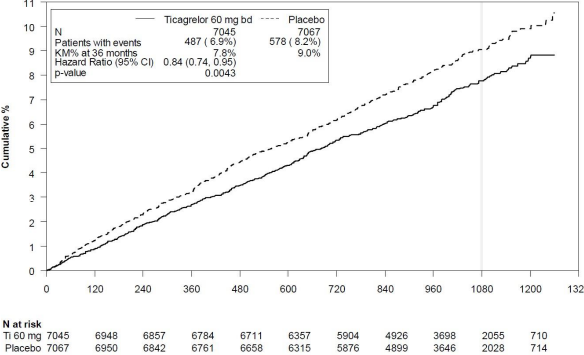
Risk taşıyan hasta sayısı
Randomizasyondan sonra günler
% Kümülatif
Şekil 2 â KV ölüm, Mİ ve inmenin birincil klinik bileşik sonlanım noktası analizi (PEGASUS)
Tablo 4 â Birincil ve İkincil Etkililik Sonlanım Noktalarının Analizi (PEGASUS)
| Günde iki kez tikagrelor 60 mg + ASA N=7045 | Tek başına ASA N=7067 |
p- değeri | |||
Özellikler | Olay görülen hastalar |
%KM | TO (%95 GA) | Olay görülen hastalar |
%KM | |
Birincil sonlanım noktası | ||||||
KV ölüm/Mİ/İnme bileşimi |
487 (%6.9) |
%7.8 | 0.84 (0.74, 0.95) |
578 (%8.2) |
%9.0 | 0.0043 (s) |
KV ölüm | 174 (%2.5) | %2.9 | 0.83 (0.68, 1.01) | 210 (%3.0) | %3.4 | 0.0676 |
Mİ | 285 (%4.0) | %4.5 | 0.84 (0.72, 0.98) | 338 (%4.8) | %5.2 | 0.0314 |
İnme | 91 (%1.3) | %1.5 | 0.75 (0.57, 0.98) | 122 (%1.7) | %1.9 | 0.0337 |
İkincil sonlanım noktası | ||||||
KV ölüm |
174 (%2.5) |
%2.9 | 0.83 (0.68, 1.01) |
210 (%3.0) |
%3.4 |
- |
Tüm nedenlere bağlı mortalite |
289 (%4.1) |
%4.7 | 0.89 (0.76, 1.04) |
326 (%4.6) |
%5.2 |
- |
Tehlike oranı ve p-değerleri, tek açıklayıcı değişken olarak tedavi grubu ile Cox orantılı tehlikeler modelinden hareketle tek başına ASA tedavisine karşın tikagrelor için ayrı ayrı hesaplanır.
36 ayda hesaplanan Kaplan-Meier yüzdesi.
Not: KV ölüm, Mİ ve İnme bileşenleri için ilk olayların sayısı her bir bileşen için ilk olayların gerçek sayısı olup, bileşik sonlanım noktasındaki olay sayısına ilave edilmez.
(s) İstatistiksel anlamı belirtir.
GA=Güven aralığı; KV=Kardiyovasküler; TO=Tehlike oranı; KM=Kaplan-Meier; Mİ=Miyokard infarktüsü.
ASA ile kombinasyon halinde hem günde iki kez 60 mg hem de günde iki kez 90 mg tikagrelor rejimleri çalışma periyodu boyunca tutarlı bir tedavi etkisi ile aterotrombotik olayların önlenmesinde (bileşik sonlanım noktası: KV ölüm, Mİ ve inme) tek başına ASA'dan üstün olup, tikagrelor 60 mg için %16 nispi risk azalması (NRA) ve %1.27 mutlak risk azalması (MRA) ve tikagrelor 90 mg için %15 NRA ve %1.19 MRA değerlerini vermektedir.
90 mg ve 60 mg'ın etkililik profili benzer olmasına rağmen, daha düşük dozun kanama ve dispne riski ile ilişkili olarak daha iyi güvenlilik profiline ve tolerabiliteye sahip olduğuna dair kanıtlar bulunmaktadır. Bu nedenle, ASA ile birlikte yalnızca günde iki kez uygulanan tikagrelor 60 mg Mİ öyküsü olan ve aterotrombotik olay gelişimi açısından yüksek risk taşıyan hastalarda aterotrombotik olayların (KV ölüm, Mİ ve inme) önlenmesi için önerilmektedir.
Tek başına ASA'ya göre günde iki kez tikagrelor 60 mg KV ölüm, Mİ ve inme birincil bileşik sonlanım noktasını anlamlı olarak azaltır. Bileşenlerin her biri birincil bileşik sonlanım noktasında azalmaya katkıda bulunmuştur (KV ölüm %17 NRA, Mİ %16 NRA ve inme %25 NRA).
Birinci günden 360. güne kadar (%17 NRA) ve 361 gün ve sonrasındaki (%16 NRA) bileşik sonlanım noktası NRA'ları benzerdir. Uzatılmış tedaviden 3 yıl sonrasında tikagrelore ait etkililik ve güvenlilik verileri sınırlıdır.
Mİ'den 2 yıldan fazla bir sürede klinik olarak stabil olan hastalarda veya önceki ADP reseptör inhibitörü tedavisi bırakıldıktan sonra bir yıldan fazla süre geçtiğinde günde iki kere tikagrelor 60 mg uygulandığında fayda olduğu yönünde kanıt söz konusu olmamıştır (KV ölüm, Mİ ve inmede birincil bileşik sonlanım noktasında azalma yoktur; ancak majör kanamada artış vardır) (ayrıca Bkz. Bölüm 4.2).
Klinik güvenlilik
Kanama ve dispne nedeniyle tikagrelor 60 mg ile tedaviyi kesme oranı, >75 yaş hastalarda (%42), daha genç hastalar ile karşılaştırıldığında daha yüksek olmuş (%23 - %31 aralığında),
>75 yaş hastalarda plaseboya karşın fark %10'dan yüksek bulunmuştur (%42'ye karşın %29).
Pediyatrik popülasyon
Avrupa İlaç Ajansı, akut koroner sendromlar (AKS) ve miyokard enfarktüsü (Mİ) öyküsüne sahip pediyatrik popülasyonun tüm alt kümelerinde tikagrelor ile çalışma sonuçlarını sunma zorunluluğunu iptal etmiştir (pediyatrik kullanım hakkında bilgi için Bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Tikagrelorun emilimi, ortalama tdeğeri 1,5 saat olup hızlıdır. Tikagrelorun dolaşımdaki başlıca metaboliti AR-C124910XX'in (aynı zamanda aktif metaboliti) oluşumu yaklaşık 2.5 saat ortalama tdeğeri ile hızlıdır. 90 mg tikagrelorun sağlıklı gönüllülerde açlık koşulları altında oral olarak uygulanmasının ardından Cdeğeri 529 ng/ml ve EAA değeri 3451 ng*s/ml'dir. Ana metabolit oranları Ciçin 0.28 ve EAA için 0.42'dir. Mİ öyküsü olan hastalarda tikagrelor ve AR-C124910XX'in farmakokinetiği, AKS popülasyondaki ile genel olarak benzer olmuştur. PEGASUS çalışmasının popülasyon farmakokinetik analizine dayalı olarak, medyan tikagrelor Cdeğeri 391 ng/mL ve tikagrelor 60 mg için kararlı durumda EAA değeri 3801 ng*s/mL'dir. Tikagrelor 90 mg için kararlı durumda C627 ng/mL ve EAA 6255 ng*s/mL'dir.
Tikagrelorun ortalama mutlak biyoyararlanımının %36 olması tahmin edilmektedir. Yüksek yağlı beslenmenin tikagrelorun Cdeğerinde ve aktif metabolitin EAA değerinde herhangi bir etkisi yoktur, fakat tikagrelorun EAA değerinde %21'lik artışa ve aktif metabolitin Cdeğerinde %22'lik azalmaya neden olmuştur. Bu küçük değişikliklerin minimal klinik öneme sahip olduğu değerlendirilmektedir, bu sebeple tikagrelor yemeklerle birlikte veya ayrı olarak alınabilir. Tikagrelor ve aktif metabolit, P-gp substratlarıdır.
Ezilmiş ve suyla karıştırılmış tikagrelor tabletler, oral olarak ya da bir nazogastrik tüp aracılığıyla mideye uygulandığında, tikagrelor ve aktif metabolitin EAA ve Cdeğerleri açısından, tam tabletlerle benzer bir biyoyararlanıma sahiptir. Ezilmiş ve suyla karıştırılmış tikagrelor tabletlerden başlangıç maruziyeti (dozdan 0.5 ve 1 saat sonra) tam tabletlere kıyasla daha yüksek olmuş, daha sonra (2 ila 48 saat) genellikle benzer bir konsantrasyon profili ortaya çıkmıştır.
Dağılım
Tikagrelorun kararlı durum dağılım hacmi 87.5 litredir. Tikagrelor ve aktif metaboliti insan plazma proteinine büyük ölçüde bağlanır (> %99.0).
Biyotransformasyon
CYP3A4, tikagrelorun metabolizmasından ve aktif metabolitin oluşumundan sorumlu majör enzimdir ve diğer CYP3A substratları ile etkileşimleri aktivasyondan inhibisyona kadar değişebilir.
Tikagrelorun majör metaboliti AR-C124910XX olup, aynı zamanda trombosit P2YADP- reseptörüne in vitro bağlanması değerlendirildiğinde etkili olduğu da bulunmuştur. Aktif metabolite sistemik maruziyet, tikagrelor için elde edilenin yaklaşık %30-40'ıdır.
Eliminasyon
Tikagrelor eliminasyonunun primer yolu hepatik metabolizmadır. Radyoizotopla işaretli tikagrelor uygulandığında, radyoaktivitenin ortalama geri eldesi yaklaşık olarak %84'tür (feçeste
%57.8, idrarda %26.5). Tikagrelor ve aktif metabolitinin idrarda geri eldesi dozun
%1'inden azdır. Aktif metabolit için primer eliminasyon yolu ağırlıklı olarak safra ile atılımdır. Ortalama t tikagrelor için yaklaşık 7 saat ve aktif metabolit için 8. 5 saattir.
Doğrusallık/doğrusal olmayan durum
Tikagrelor doğrusal farmakokinetik gösterir ve tikagrelore ve aktif metabolite (AR- C124910XX) maruziyet 1260 mg'a kadar yaklaşık olarak dozla orantılıdır.
Özel popülasyonlar:
Geriyatrik popülasyon
Popülasyon farmakokinetik analizi ile yaşlı (≥ 75 yaş) AKS hastalarında, daha genç hastalara oranla tikagrelor ve aktif metabolitine daha yüksek maruziyetler (Cve EAA için yaklaşık
%25) gözlenmiştir. Bu farklılıkların klinik olarak anlamlı olduğu düşünülmemektedir (Bkz. Bölüm 4.2).
Pediyatrik popülasyon
Tikagrelor pediyatrik popülasyonda değerlendirilmemiştir (Bkz. Bölüm 4.2 ve 5.1).
Cinsiyet
Erkekler ile kıyaslandığında kadınlarda tikagrelor ve aktif metabolite daha yüksek maruziyet gözlenmiştir. Bu farklılıkların klinik olarak anlamlı olduğu düşünülmemektedir.
Böbrek yetmezliği
Normal böbrek fonksiyonlu gönüllülerle kıyaslandığında şiddetli böbrek yetmezliği (kreatinin klerensi < 30 mL/dak) olan hastalarda tikagrelora maruziyet yaklaşık %20 daha düşüktür ve aktif metabolite maruziyet yaklaşık %17 daha yüksektir.
Hemodiyaliz uygulanmakta olan terminal evre böbrek hastalığına sahip hastalarda diyaliz uygulanmayan bir günde uygulanan tikagrelor 90 mg'nin EAA ve Cdeğerinin normal böbrek fonksiyonuna sahip gönüllülerdekine kıyasla %38 ve %51 daha yüksek olduğu görülmüştür. Tikagrelorun diyalizle temizlenebilir olmadığını gösterir şekilde, tikagrelor diyalizden hemen önce uygulandığında maruziyette benzer bir artış gözlenmiştir (sırasıyla %49 ve %61). Aktif metabolite maruziyet daha düşük boyutta artış sergilemiştir (EAA %13-14, C%17-36). Terminal evre böbrek hastalığı bulunan hastalarda tikagrelorun trombosit agregasyonu inhibisyonu (IPA) etkisinin diyalizden bağımsız olduğu ve normal böbrek fonksiyonuna sahip gönüllülerdekiyle benzer olduğu görülmüştür (Bkz. Bölüm 4.2).
Karaciğer yetmezliği
Eşlenmiş sağlıklı gönüllülerle karşılaştırıldığında hafif karaciğer yetmezliği olan hastalarda tikagrelor için Cve EAA değerleri sırasıyla %12 ve %23 daha yüksektir; bununla birlikte tikagrelorun TAİ etkisi iki grup arasında benzerdir. Hafif derecede karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Tikagrelor, ağır derecede karaciğer yetmezliği olan hastalarda çalışılmamış olup, orta derecede karaciğer yetmezliği olan hastalarla ilgili farmakokinetik bilgi bulunmamaktadır. Başlangıçta bir veya daha fazla karaciğer fonksiyonu testinde orta veya şiddetli yükselmesi olan hastalarda tikagrelor plazma konsantrasyonları, başlangıçta yükselmeleri olmayan hastalar ile karşılaştırıldığında ortalama olarak benzer veya hafif şekilde daha yüksek olmuştur. Orta derecede karaciğer yetmezliği olan hastalarda herhangi bir doz ayarlaması önerilmemektedir (Bkz. Bölüm 4.2 ve Bölüm 4.4).
Irk
Beyaz ırktan hastalarla kıyaslandığında Asya kökenli hastalarda ortalama biyoyararlanım %39 daha yüksektir. Beyaz ırktan hastalarla kıyaslandığında tikagrelorun biyoyararlanımı siyah ırktan
hastalarda %18 daha düşüktür.Klinikfarmakolojiçalışm
alarında, beyaz ırkla
kıyaslandığında Japon hastalarda tikagrelore maruziyet (Cve EAA) yaklaşık %40 (vücut ağırlığı için ayarlandıktan sonra %20) daha yüksektir.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi, tek ve tekrarlanan doz toksisitesi ve genotoksik potansiyel klasik çalışmaları baz alındığında, tikagrelor ve majör metaboliti için klinik öncesi verileri insanlar için advers olaylar açısından kabul edilemez bir risk göstermemiştir.
Çeşitli hayvan türlerinde, klinik açıdan anlamlı maruziyet düzeylerinde gastrointestinal irritasyon gözlenmiştir (Bkz. Bölüm 4.8).
Dişi sıçanlarda, yüksek dozdaki tikagrelor rahim tümörleri (adenokarsinomlar) ve hepatik adenomlar için artmış insidans göstermiştir. Rahim tümörlerinin mekanizması olasılıkla sıçanlarda tümörlere neden olabilen hormon dengesizliğidir. Hepatik adenomların mekanizması ise olasılıkla karaciğerde kemirgenlere özgü enzim indüksiyonuna bağlıdır. Bu nedenlerle, karsinojenisite bulgularının insanlarla ilişkili olabileceği düşünülmektedir.
Sıçanlarda, maternal toksik dozda (güvenlilik sınırı 5.1) minör gelişim anomalileri görülmüştür. Tavşanlarda, yüksek dozda dişilerin fetüslerinde, maternal toksisite göstermeksizin (güvenlilik sınırı 4.5) hepatik matüritede ve iskelet gelişiminde hafif bir gecikme görülmüştür.
Sıçan ve tavşanlardaki çalışmalar, anne vücut ağırlığı artışında hafif düşüş ve yeni doğan viyabilitesinde ve büyümede gecikme ile doğum ağırlığında azalmayla üreme toksisitesi göstermiştir. Tikagrelor dişi sıçanlarda düzensiz siklüslere (çoğunlukla uzamış siklüsler) neden olmuş ancak erkek ve dişi sıçanlarda genel fertiliteyi etkilememiştir. Radyoaktif işaretli tikagrelor ile yürütülen farmakokinetik çalışmalar, ana bileşenin ve metabolitlerinin sıçanların sütü ile atıldığını göstermiştir (Bkz. bölüm 4.6).
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
İLAÇ GENEL BİLGİLERİ
Santa Farma İlaç Sanayi A.Ş.
| Satış Fiyatı | 977.42 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 977.42 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699527090995 |
| Etkin Madde | Tikagrelor |
| ATC Kodu | B01AC24 |
| Birim Miktar | 90 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Kan ve Kan Yapıcı Organlar > Antitrombotik İlaçlar > Tikagrelor |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |