TASIGNA 200 mg 112 kapsül Kısa Ürün Bilgisi
{ Nilotinib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
TASİGNA 200 mg kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Nilotinib (hidroklorür monohidrat olarak) 200 mg
Yardımcı maddeler
Laktoz monohidrat 156,11 mg
Yardımcı maddeler için, 6.1'e bakınız.
3. FARMASÖTİK FORMU
Kapsül.
Üzerinde boylamasına kırmızı renkli “NVR/TKI†baskısı olan 0 boyutunda açık sarı opak sert jelatin kapsül içerisinde beyaz ila hafif sarımsı toz.
Kan sayımları düşük seyrettiği takdirde, dozun günde bir kez 400 mg olacak şekilde azaltılması gerekebilir.
Kan sayımları düşük seyrettiği takdirde, dozun günde bir kez 400 mg olacak şekilde azaltılması gerekebilir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
TASİGNA,
Yeni tanı konmuş Philadelphia kromozomu pozitif kronik evre kronik miyeloid lösemili yetişkin hastaların tedavisinde ve,
4.2. Pozoloji ve uygulama şekli
Tedavi, KML hastalarının tedavisinde deneyimli bir hekim tarafından başlatılmalıdır.
Pozoloji:
Tedavi, klinik yarar gözlendiği sürece veya kabul edilemez toksisite ortaya çıkana kadar sürdürülmelidir.
Bir dozun atlanması durumunda, hasta ilave bir doz almayıp, reçete edilen bir sonraki doz ile devam etmelidir.
Yeni tanı konmuş Ph+ KML hastalarında:
TASİGNA için önerilen doz günde iki kez 300 mg'dır.
İmatinib tedavisine dirençli veya intolere KF (Kronik Faz) veya AF (Akselere Faz) KML hastalarında;
TASİGNA'nın önerilen dozu, günde iki kez 400 mg'dır.
Günde iki kez 300 mg dozu için (bkz. aşağıda doz ayarlamaları), 150 mg kapsüller mevcuttur.
Birinci basamak tedavi olarak TASİGNA ile tedavi edilen ve sürekli derin moleküler yanıt elde eden kronik fazdaki yetişkin Philadelphia kromozomu pozitif KML hastaları (MY4.5)
En az 3 yıl süreyle günde iki kez 300 mg dozunda TASİGNA ile tedavi edilmiş olan kronik fazdaki yetişkin Philadelphia kromozomu pozitif (Ph+) uygun KML hastalarında eğer tedavinin kesilmesinden hemen önce en az 1 yıl süreyle derin moleküler yanıt devam etmişse tedavinin kesilmesi düşünülebilir. TASİGNA tedavisinin kesilmesi süreci, KML hastalarının tedavisinde deneyimli bir hekim tarafından başlatılmalıdır (bkz. bölüm 4.4 ve 5.1).
TASİGNA tedavisinin sonlandırıldığı uygun hastaların BCR-ABL transkript düzeyleri ve diferansiyelli tam kan sayımları bir yıl süreyle her ay, ardından ikinci yılda 6 haftada bir ve sonrasında 12 haftada bir izlenmelidir. BCR-ABL transkript düzeyleri izlemi, Uluslararası Ölçekte (IS) moleküler yanıt düzeylerini ölçmek üzere valide edilmiş olan, en az MY4.5 (BCR-ABL/ABL ≤%0,0032 IS) hassasiyete sahip bir kantitatif tanı testi ile gerçekleştirilmelidir.
Tedavisiz faz sırasında MY4 (MY4=BCR-ABL/ABL ≤%0,01 IS) yanıtını kaybeden fakat MMY'ı (MMY=BCR-ABL/ABL ≤%0,1 IS) kaybetmeyen hastalarda BCR-ABL transkript düzeyleri, BCR-ABL düzeyleri MY4 ile MY4.5 arası bir aralığa dönene kadar 2 haftada bir izlenmelidir. BCR-ABL düzeylerinin arka arkaya en az 4 ölçümde MMY ile MY4 arasında korunduğu hastalar orijinal izlem planına geri dönebilir.
MMY'yi kaybeden hastalar, remisyon kaybının meydana geldiğinin bilindiği tarihi izleyen 4 hafta içinde tedaviye yeniden başlamalıdır. Nilotinib tedavisi günde iki kez 300 mg veya eğer hastada tedavi kesilmeden önce doz azaltımı yapılmışsa, günde bir kez 400 mg azaltılmış doz düzeyinde yeniden başlatılmalıdır. TASİGNA tedavisine yeniden başlayan hastalar, MMY tekrar elde edilene kadar ayda bir ve sonrasında 12 haftada bir BCR-ABL transkript düzeylerini ölçtürmelidir (bkz. bölüm 4.4).
İmatinib tedavisinden sonra TASİGNA tedavisi sırasında sürekli derin moleküler yanıt elde eden kronik fazdaki yetişkin Philadelphia kromozomu pozitif KML hastaları (MY4.5)
En az 3 yıl süreyle TASİGNA ile tedavi edilmiş olan kronik fazdaki yetişkin Philadelphia kromozomu pozitif (Ph+) uygun KML hastalarında eğer tedavinin kesilmesinden hemen önce en az 1 yıl süreyle derin moleküler yanıt devam etmişse tedavinin kesilmesi düşünülebilir. TASİGNA tedavisinin kesilmesi süreci, KML hastalarının tedavisinde deneyimli bir hekim tarafından başlatılmalıdır (bkz. bölüm 4.4 ve 5.1).
TASİGNA tedavisinin sonlandırıldığı uygun hastaların BCR-ABL transkript düzeyleri ve diferansiyelli tam kan sayımları bir yıl süreyle her ay, ardından ikinci yılda 6 haftada bir ve sonrasında 12 haftada bir izlenmelidir. BCR-ABL transkript düzeyleri izlemi, Uluslararası Ölçekte (IS) moleküler yanıt düzeylerini ölçmek üzere valide edilmiş olan, en az MY4.5 (BCR-ABL/ABL ≤%0,0032 IS) hassasiyete sahip bir kantitatif tanı testi ile gerçekleştirilmelidir
Tedavisiz dönemde doğrulanmış MY4(MY4=BCR-ABL/ABL ≤0,01 %IS) kaybı (MY4 kaybını gösteren en az 4 hafta aralıklı iki ardışık ölçüm) veya majör moleküler yanıt (MMY=BCR-ABL/ABL ≤0,1 %IS) kaybı olan hastalar, remisyonun kaybının meydana geldiğinin bilindiği tarihi izleyen 4 hafta içinde tedaviye yeniden başlamalıdır. TASİGNA tedavisinegündeikikez300mgyada400 mg ile yeniden başlanmalıdır.
TASİGNA tedavisine yeniden başlayan hastalar, önceki major moleküler yanıtları ya da MY4 düzeyleri tekrar elde edilene kadar ayda bir ve sonrasında 12 haftada bir BCR-ABL transkript düzeylerini ölçtürmelidir (bkz. bölüm 4.4).
Doz ayarlamaları ya da doz değişiklikleri:
Temelde yatan lösemi ile ilişkili olmayan hematolojik toksisiteler (nötropeni, trombositopeni) nedeniyle TASİGNA tedavisinin geçici olarak kesilmesi ve/veya dozunun azaltılması gerekebilir (bkz. Tablo 1).
Tablo 1: Nötropeni ve Trombositopeni için Doz Ayarlamaları
Yeni tanı konmuş KML kronik evrede günde iki kez 300 mg'lık dozda
İmatinib tedavisine dirençli veya intolere kronik Faz KML'de günde iki kez 400 mg'lık dozda | (ANC)* < 1 x 10/L ve/veya trombosit sayısı < 50 x 10/L | |
İmatinib tedavisine dirençli veya intolere akselere Faz KML'de günde iki kez 400 mg'lık dozda | (ANC)* < 0.5 x 10/L ve/veya trombosit sayısı < 10 x 10/L |
TASİGNA tedavisi kesilir ve kan sayımları izlenir.
4.3. Kontrendikasyonlar
TASİGNA, nilotinibe ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kullanılmamalıdır.
TASİGNA QT intervalini uzatmaktadır. TASİGNA kullanımı ile ani ölüm vakaları bildirilmiştir. Bu nedenle TASİGNA, hipokalemi, hipomagnezemi veya uzun QT sendromlu hastalarda kullanılmamalıdır.
4.4. Özel kullanım uyarıları ve önlemleri
TASİGNA QT intervalini uzatmaktadır. TASİGNA uygulamasına başlanmadan önce hipokalemi veya hipomagnezemi düzeltilmeli ve tedavi sırasında periyodik olarak kontrol edilmelidir. TASİGNA tedavisine başlamadan önce bazal EKG, başladıktan sonra 7. günde ve klinik olarak endike olduğu takdirde daha sonra tekrar EKG çekilmesi uygundur.
TASİGNA alan hastalarda ani ölüm vakaları raporlanmıştır. TASİGNA hipokalemi, hipomagnezemi veya uzun QT sendromlu hastalarda kullanılmamalıdır.
Güçlü CYP3A4 inhibitörleri ve/veya QT'yi uzatma potansiyeli olduğu bilinen ilaçlarla birlikte kullanımdan kaçınılmalıdır.
İlaç alınmadan en az 2 saat öncesine kadar ve ilaç alındıktan sonra en az 1 saat herhangi bir gıda tüketilmemelidir.
QT Uzaması:
TASİGNA'nın konsantrasyona bağlı olarak erişkin ve pediyatrik hastalarda yüzey EKG'sinde QT aralığı ölçümü ile kardiyak ventriküler repolarizasyonu uzattığı gösterilmiştir.
Faz III çalışmasında yeni tanı konmuş Ph+ KML kronik faz hastalarında kararlı durumda başlangıca göre ortalama QTcF (Fridericia yöntemi ile düzeltilen QT) aralığı ortalama zamanı günde iki kez nilotinib 300 mg grubunda 6 milisaniye olmuştur. Günde iki kez
300 mg olan önerilen dozda hiçbir hastada mutlak QTcF 480 milisaniye üzerine çıkmamıştır ve torsades de pointes (geçici ya da uzun süreli) epizodu gözlenmemiştir.
İmatinibe karşı dirençli ve intolere, kronik ve akselere faz KML hastalarında gerçekleştirilen Faz II çalışmasında, günde iki kez 400 mg nilotinib ile tedavide, kararlı durumda zaman ortalamalı QTcF aralığı açısından başlangıca göre ortalama değişim sırasıyla 5 ve 8 milisaniye olarak ölçülmüştür. >500 msn QTcF değeri bu hastaların
<%1'inde gözlenmiştir. Klinik çalışmalarda hiçbir torsade de pointes epizodu gözlenmemiştir.
Hastalardakilere benzer maruziyetlerin gözlendiği bir sağlıklı gönüllü çalışmasında, plasebo kolunun çıkarıldığı ortalama QTcF değişimi başlangıca göre 7 milisaniye (güven aralığı 4 milisaniye) olarak bulunmuştur. Hiçbir denekte 450 milisaniyenin üzerinde bir QTcF gözlenmemiştir. İlave olarak, çalışma sırasında klinik olarak anlamlı bir aritmi vakası meydana gelmemiştir. Özellikle de, herhangi bir torsades de pointes (geçici ya da uzun süreli) epizodu gözlenmemiştir.
TASİGNA besinlerle ve/veya güçlü CYP3A4 inhibitörleri ve/veya QT'yi uzatma potansiyeli olduğu bilinen tıbbi ürünlerle birlikte yanlış biçimde alındığında QT aralığında anlamlı uzama meydana gelebilir. Bu nedenle, besinlerle birlikte uygulamaktan ve güçlü CYP3A4 inhibitörleri ve/veya QT'yi uzatma potansiyeli olduğu bilinen tıbbi ürünlerle birlikte kullanımdan kaçınılmalıdır (bkz. bölüm 4.4 ve bölüm 4.5).
Hipokalemi ve hipomagnezemi varlığı, bu etkiyi daha da arttırabilir. QT aralığı uzaması hastaları ölümcül sonuç riskine maruz bırakabilir.
QTc (düzeltilmiş QT) aralığında uzama görülen veya uzama riski olan aşağıdaki hastalarda TASİGNA dikkatli kullanılmalıdır:
Konjenital uzun QT sendromu olanlar,
![]()
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
TASİGNA, eğer klinik endikasyon mevcut ise eritropoietin veya granülosit koloni uyarıcı faktör (G-CSF) gibi hematopoetik büyüme faktörleri ile kombinasyon halinde verilebilir. Eğer klinik olarak endike ise hidroksiüre veya anagrelid ile verilebilir.
Nilotinib ağırlıklı olarak karaciğerde metabolize olup CYP3A4'ün oksidatif metabolizmaya katkısı olan başlıca faktör olması beklenir. Nilotinib ayrıca çoklu organ dışa akış pompası P-glikoproteinin (P-gp) bir substratıdır. Bu nedenle, sistemik emilen nilotinibin absorpsiyonu ve sonraki eliminasyonu CYP3A4 ve/veya P-gp'yi etkileyen ilaçlar tarafından etkilenebilir.
Nilotinibin serum konsantrasyonlarını arttırabilecek ilaçlar:
İmatinib (P-gp ve CYP3A4'ün bir substratı ve moderatörü) ile kombinasyon halinde verilen nilotinib ile yapılan bir Faz I çalışmada her iki ilaç da CYP3A4 ve/veya P-gP üzerinde hafif bir inhibitör etki göstermiştir. Bu iki ilaç eş zamanlı olarak uygulandığında, imatinibin EAA değeri %18 - %39, nilotinibin EAA değeri ise %18 -
%40'a yükselmiştir. Bu değişikliklerin klinik önemi olması muhtemel değildir.
Sağlıklı deneklerde güçlü CYP3A4 inhibitörü ketokonazol ile birlikte uygulandığında nilotinibin biyoyararlanımı 3 misli artmıştır. Bu nedenle güçlü CYP3A4 inhibitörleri (ketokonazol, itrakonazol, vorikonazol, ritonavir, klaritromisin ve telitromisin dahil olmakla birlikte bunlarla sınırlı değildir) ile eş zamanlı tedaviden kaçınılmalıdır (bkz. Bölüm 4.2 ve Bölüm 4.4). Nilotinibe artmış maruziyet aynı zamanda orta güçte CYP3A4 inhibitörleri ile de beklenebilir. CYP3A4 inhibisyonuna yol açmayan ya da minimum düzeyde yol açan alternatif ilaçlarla eşzamanlı tedavi düşünülmelidir.
Nilotinibin serum konsantrasyonlarını azaltabilecek ilaçlar:
Potent bir CYP3A4 indükleyicisi olan rifampisin nilotinib Cdeğerini %64 azaltır ve nilotinib EAA'sını %80 azaltır. Rifampisin ve nilotinib bir arada kullanılmamalıdır.
CYP3A4 aktivitesini indükleyen ilaçlar nilotinibin metabolizmasını artırmak suretiyle plazma konsantrasyonlarını azaltabilir. CYP3A4'ü indükleyen ilaçların (örneğin; fenitoin, rifampisin, karbamazepin, fenobarbital ve St. John's Wort) eşzamanlı kullanımı nilotinibe olan maruziyeti azaltabilir. CYP3A4 indükleyicilerinin endike olduğu
hastalarda, nispeten düşük bir indüksiyon potansiyeline sahip alternatif ajanların kullanımı düşünülmelidir.
Nilotinibin çözünürlüğü pH'a bağlıdır ve yüksek pH'da daha az çözünür. 5 gün boyunca günde bir kere 40 mg esomeprazol alan sağlıklı gönüllülerde, gastrik pH belirgin biçimde artmış, fakat nilotinibin emilimi sadece orta düzeyde bir düşüş göstermiştir (C'ta %27 düşüş ve EAA'da %34 düşüş). TASİGNA ihtiyaca göre esomeprazolle ve diğer proton pompası inhibitörleri ile eş zamanlı olarak kullanılabilir.
Sağlıklı gönüllülerde yapılan bir çalışmada, 400 mg'lık tekli TASİGNA dozu famotidinden 10 saat sonra ve 2 saat önce uygulandığında nilotinibin farmakokinetiğinde anlamlı bir değişiklik gözlenmemiştir. Bu nedenle, H2 blokörü ile eşzamanlı kullanım gerekli olduğunda, TASİGNA dozundan yaklaşık 10 saat önce ve yaklaşık 2 saat sonra uygulanabilir.
Yukarıda bahsedilen aynı çalışmada, 400 mg'lık tekli TASİGNA dozundan 2 saat önce veya sonra bir antiasit uygulaması da (alüminyum hidroksit/magnezyum hidroksit/simetikon) nilotinib farmakokinetiğini değiştirmemiştir. Bu nedenle, gerekli olduğunda, TASİGNA dozundan yaklaşık 2 saat önce veya 2 saat sonra bir antiasit uygulanabilir.
Sistemik konsantrasyonları nilotinib tarafından değiştirilebilecek ilaçlar:
Nilotinib CYP3A4, CYP2C8, CYP2C9, CYP2D6 ve UGT1A1'in in vitro olarak görece güçlü inhibitörü olup, en düşük Ki değeri CYP2C9 içindir (Ki=0,13 mikroM).
Duyarlı bir CYP2C9 substratı olan 25 mg varfarin ile sağlıklı gönüllülerle yürütülen tek doz ilaç-ilaç etkileşimi çalışmasında 800 mg nilotinib, varfarinin farmakokinetik parametrelerinde ve protrombin zamanı (PT) ve uluslararası normalize oran (INR) ile ölçüldüğünde varfarin farmakodinamiğinde herhangi bir değişikliğe yol açmamıştır. Kararlı durum verisi bulunmamaktadır. Bu çalışma, varfarin ile nilotinib arasında klinik açıdan anlamlı ilaç-ilaç etkileşiminin varfarinin 25 mg'a kadarki dozlarında daha az olası olduğunu göstermektedir. Kararlı durum verileri bulunmadığından varfarin tedavisine başlandıktan sonra (en az ilk 2 hafta boyunca) varfarin farmakodinamik parametrelerinin (INR ya da PT) kontrolü önerilir.
KML hastalarında 12 gün süreyle günde iki kez 400 mg dozunda uygulanan nilotinib, oral midazolamın (CYP3A4 substratı) sistemik maruziyetini (EAA ve Cmaks) sırasıyla 2,6 kat ve 2,0 kat artırmıştır. Nilotinib orta kuvvetli bir CYP3A4 inhibitörüdür. Bunun sonucu olarak, temelde CYP3A4 ile metabolize olan diğer ilaçların (örn. belirli HMG- CoA redüktaz inhibitörleri) sistemik maruziyeti, nilotinib ile bir arada uygulamada artabilir. CYP3A4 substratları olan ve dar terapötik indekse sahip ilaçlar (bunlarla sınırlı olmamakla birlikte alfentanil, siklosporin, dihidroergotamin, ergotamin, fentanil, sirolimus ve takrolimus dahil) nilotinib ile bir arada uygulandığında uygun izlem ve doz ayarlaması gerekli olabilir.
Nilotinibin esas olarak CYP3A4 ile elimine edilen statinlerle kombinasyonu, rabdomiyaliz de dahil, statinle indüklenen miyopati olasılığını arttırabilir.
Anti-aritmik ilaçlar ve QT uzamasına neden olabilecek diğer ilaçlar:
Nilotinib; amiodaron, disopiramid, prokainamid, kinidin ve sotatol gibi anti-aritmik tıbbi ürünleri kullanan hastalar dahil QT aralığı uzaması görülmüş veya bu durumun gelişebileceği hastalarda ve klorokin, halofantrin, klaritromisin, haloperidol, metadon ve moksifloksasin gibi QT uzamasına yol açabilecek diğer tıbbi ürünleri kullanan hastalarda dikkatli kullanılmalıdır (bkz. Bölüm 4.4).
Besin etkileşimleri:
TASİGNA'nın emilimi, yemekle birlikte alındığında artarak, daha yüksek bir serum konsantrasyonuna yol açmaktadır (bkz. Bölüm 4.2, Bölüm 4.4 ve Bölüm 5.2). Greyfurt suyu ya da CYP3A4'ü inhibe ettiği bilinen diğer besinler tüketilmemelidir.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyon:
Pediyatrik popülasyona ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi D'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Çocuk doğurma potansiyeli olan kadınlara, TASİGNA tedavisi sırasında ve bitiminden 2 hafta sonrasına kadar çok etkili bir doğum kontrol yöntemi uygulamaları tavsiye edilmelidir.
Gebelik dönemi
Nilotinib'in gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. TASİGNA gerekli olmadıkça gebelik döneminde kullanılmamalıdır. TASİGNA, kadının klinik durumu nilotinib ile tedavi gerektirmedikçe gebelik sırasında kullanılmamalıdır. Gebelik sırasında kullanılırsa, hasta fetüs için potansiyel risk konusunda bilgilendirilmelidir.
Eğer nilotinib ile tedavi edilmekte olan bir hasta gebelik düşünüyorsa, Bölüm 4.2 ve
4.4'te tarif edilen tedavinin kesilmesine uygunluk kriterlerine dayalı olarak tedavinin kesilmesi düşünülebilir. Tedavisiz remisyon (TFR) denenirken hastalarda gebeliklere ilişkin sınırlı miktarda veri mevcuttur. Eğer TFR fazında gebelik planlanıyorsa hasta, gebelik sırasında TASİGNA tedavisine olası bir yeniden başlama gerekliliği konusunda bilgilendirilmelidir (bkz. Bölüm 4.2 ve 4.4).
Laktasyon dönemi
Nilotinibin insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlardan elde edilen toksikolojik veriler, nilotinibin sütle atıldığını göstermektedir (bkz. Bölüm 5.3). Yeni doğanlar/bebekler için risk olasılık dışı bırakılamadığından, TASİGNA tedavisi sırasında ve son dozdan sonraki 2 hafta boyunca kadınların emzirmemesi gerekir.
Üreme yeteneği /Fertilite
Hayvan çalışmaları erkekvedişisıçanlardafertiliteüzerinde etki göstermemiştir (bkz.
4.7. Araç ve makine kullanımı üzerindeki etkiler
TASİGNA'nın araç ve makine kullanma becerisi üzerinde etkisi yoktur ya da göz ardı edilebilir etkiye sahiptir. Baş dönmesi, yorgunluk, görme bozukluğu ya da güvenli taşıt kullanma ya da makine kullanma yeteneği üzerinde potansiyel bir etkiye sahip diğer istenmeyen yan etkiler yaşayan hastalar, bu yan etkiler devam ettiği sürece bu aktiviteleri gerçekleştirmemelidir (bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Aşağıda tarif edilen veriler, önerilen günde 300 mg dozunda tedavi edilen yeni tanı almış kronik fazdaki Ph+ KML'li hastalardaki randomize bir Faz III çalışmadan (n=279) ve önerilen günde 400 mg dozunda tedavi edilen imatinibe dirençli veya toleranssız kronik (n=321) ve akselere (n=137) fazlarda KML hastalarındaki açık etiketli, çok merkezli bir Faz II çalışmadan toplam 737 hastada TASİGNA'ya maruziyeti yansıtmaktadır. Ayrıca iki TASİGNA tedavisi kesme çalışmasına ve imatinibe dirençli veya kronik fazda intolere KML'si olan yetişkin hastalarda yapılan ve inceleme periyodu iki yıl olan (n=507) prospektif bir gözlemsel çalışmaya ait veriler de sunulmaktadır.
Yeni tanı almış kronik fazdaki KML'li yetişkin hastalar
Medyan maruziyet süresi 60,5 aydır (aralık 0,1-70,8 ay).
En sık görülen (≥ %10) hematolojik olmayan advers reaksiyonlar döküntü, kaşıntı, baş ağrısı, bulantı, yorgunluk, saç dökülmesi, miyalji ve üst karın ağrısı olmuştur. Bu advers reaksiyonların çoğunun hafif ila orta arası şiddette olduğu görülmüştür. Kabızlık, deri kuruluğu, asteni, kas spazmları, ishal, artralji, karın ağrısı, kusma ve periferik ödem daha düşük bir sıklıkla görülmüş (<%10 ve ≥ %5), hafif ila orta şiddette olmuş, kontrol edilebilir olduğu belirlenmiş ve genellikle dozun azaltılmasını gerektirmemiştir.
Tedavi kaynaklı hematolojik toksisiteler miyelosupresyonu içermektedir: trombositopeni (%18), nötropeni (%15) ve anemi (%8). Biyokimyasal advers ilaç reaksiyonları alanin aminotransferaz artışı (%24), hiperbilirubinemi (%16), aspartat aminotransferaz artışı (%12), lipaz artışı (%11), kan bilirubin düzeyinde artış (%10), hiperglisemi (%4), hiperkolesterolemi (%3) ve hipertrigliseridemiyi (<%1) içermektedir. Plevral ve perikardiyal efüzyonlar, nedensellik ilişkisine bakılmaksızın, günde iki kez TASİGNA 300 mg alan hastaların sırasıyla %2 ve <%1'inde görülmüştür. Gastrointestinal hemoraji, yine nedensellik ilişkisine bakılmaksızın, bu hastaların
%3'ünde bildirilmiştir.
Kararlı durumda ortalama zaman için averajı alınan QTcF aralığında başlangıca göre değişiklik 6 milisaniye bulunmuştur. Hiçbir hastada, çalışmada incelenen tıbbi ürün kullanımı sırasında >500 milisaniye mutlak QTcF değeri söz konusu olmamıştır. Başlangıç değeri ile karşılaştırıldığında 60 milisaniyeyi aşan QTcF artışı, incelenen tıbbi ürün kullanımı sırasında hastaların <%1'inde gözlenmiştir. Herhangi bir ani ölüm ya da torsade de pointes (geçici veya kalıcı) epizodu gözlenmemiştir. Tedavi sırasında herhangi bir zamanda ortalama sol ventriküler ejeksiyon fraksiyonunda (LVEF) başlangıç değerinden bir düşüş gözlenmemiştir. Tedavi sırasında hiçbir hastada <%45 LVEF ya da LVEF değerinde %15'ten fazla mutlak azalma olmamıştır.
Advers olaylara bağlı olaraktedavidenayrılma,hastaların %10'unda gözlenmiştir.
İmatinibe dirençli veya toleranssız kronik faz ve akselere fazdaki KML'li yetişkin hastalarda
Aşağıda tarif edilen veriler, önerilen günde 400 mg dozunda tedavi edilen imatinibe dirençli veya toleranssız kronik (n=321) ve akselere (n=137) fazlarda KML hastalarındaki açık etiketli, çok merkezli bir Faz II çalışmada 458 hastada TASİGNA'ya maruziyeti yansıtmaktadır
En sık görülen (≥ %10) hematolojik olmayan advers reaksiyonlar döküntü, kaşıntı, bulantı, yorgunluk, baş ağrısı, kusma, miyalji, kabızlık ve ishal olmuştur. Bu advers reaksiyonların çoğunun hafif ile orta arası şiddette olduğu görülmüştür. Saç dökülmesi, kas spazmları, iştah azalması, artralji, karın ağrısı, kemik ağrısı, periferik ödem, asteni, üst karın ağrısı, deri kuruluğu, eritem ve ekstremitede ağrı daha düşük bir sıklıkla gözlenmiş (<%10 ve ≥ %5) ve hafif ila orta şiddette (Derece 1 veya 2) olduğu görülmüştür. Advers ilaç reaksiyonları nedeniyle tedaviden ayrılma, kronik faz hastalarının %16'sında ve akselere faz hastaların %10'unda gözlenmiştir
Tedavi kaynaklı hematolojik toksisiteler miyelosupresyonu içermektedir: trombositopeni (%31), nötropeni (%17) ve anemi (%14). TASİGNA alan hastaların
<%1'inde plevral ve perikardiyal efüzyonların yanı sıra sıvı tutulumunun komplikasyonları görülmüştür. Hastaların <%1'inde kalp yetmezliği gözlenmiştir. Gastrointestinal ve CNS hemoraji hastaların sırasıyla %1 ve <%1'inde bildirilmiştir.
500 milisaniyeyi aşan QTcF hastaların <%1'inde gözlenmiştir. Herhangi bir torsade de pointes (geçici veya kalıcı) epizodu gözlenmemiştir.
En sık bildirilen yan etkiler:
Tüm TASİGNA klinik çalışmalarında hastaların en az % 5'inde bildirilen ve hematolojik olmayan advers ilaç reaksiyonları (laboratuvar anormallikleri dışında), Tablo 2'de verilmektedir:
Bu olaylar, aşağıdaki sistem kullanılarak, en sık gözlenen ilk sırada yer almak üzere görülme sıklıklarına ve her bir sıklık grubu içindeki advers ilaç reaksiyonları azalan ciddiyetlerine göre sıralanmıştır. Ayrıca her bir advers ilaç reaksiyonu için ilgili sıklık kategorisinde aşağıdaki (CIOMS III) dönüşüm temel alınmaktadır:
çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 2: Hematolojik olmayan advers reaksiyonlar (Tüm Hastaların ≥%5'i)*
| Yeni tanı almış KML-KF Günde iki kez 300 mg n=279 | İmatinibe dirençli veya imatinibi tolere edemeyen KML-KF ve KML-AF Günde iki kez 400 mg n=458 | ||||||
| 60 aylık analiz | 24 aylık analiz | ||||||
Sistem organ sınıfı/ Advers reaksiyon |
Sıklık |
Tüm Dereceler |
Derece 3-4 |
Sıklık |
Tüm Dereceler |
Derece 3-4 | KML- KF n=321 Derece 3-4 | KML- AP n=137 Derece 3-4 |
| % | % |
| % | % | % | % | |
Metabolizma ve beslenme hastalıkları | ||||||||
İştah azalması ** | Yaygın | 4 | 0 | Yaygın | 8 | <1 | <1 | 0 |
Sinir sistemi hastalıkları | ||||||||
Baş ağrısı | Çok yaygın | 16 | 2 | Çok yaygın | 15 | 1 | 2 | <1 |
Gastrointestinal hastalıklar | ||||||||
Bulantı | Çok yaygın | 14 | <1 | Çok yaygın | 20 | <1 | <1 | <1 |
Kabızlık | Yaygın | 10 | 0 | Çok yaygın | 12 | <1 | <1 | 0 |
İshal | Yaygın | 9 | <1 | Çok yaygın | 11 | 2 | 2 | <1 |
Kusma | Yaygın | 6 | 0 | Çok yaygın | 10 | <1 | <1 | 0 |
Üst abdominal ağrı |
Çok yaygın |
10 |
1 |
Yaygın |
5 |
<1 |
<1 |
0 |
Abdominal ağrı | Yaygın | 6 | 0 | Yaygın | 6 | <1 | <1 | <1 |
Dispepsi | Yaygın | 5 | 0 | Yaygın | 3 | 0 | 0 | 0 |
Deri ve deri altı doku hastalıkları | ||||||||
Döküntü | Çok yaygın | 33 | <1 | Çok yaygın | 28 | 1 | 2 | 0 |
Kaşıntı | Çok yaygın | 18 | <1 | Çok yaygın | 24 | <1 | <1 | 0 |
Alopesi | Çok yaygın | 10 | 0 | Yaygın | 9 | 0 | 0 | 0 |
Kuru cilt | Yaygın | 10 | 0 | Yaygın | 5 | 0 | 0 | 0 |
Eritem | Yaygın | 3 | 0 | Yaygın | 5 | <1 | <1 | 0 |
Kas-iskelet ve bağ dokusu hastalıkları | ||||||||
Miyalji | Çok yaygın | 10 | <1 | Çok yaygın | 10 | <1 | <1 | <1 |
Kas spazmları | Yaygın | 9 | 0 | Yaygın | 8 | <1 | <1 | 0 |
Artralji | Yaygın | 8 | <1 | Yaygın | 7 | <1 | 1 | 0 |
Kemik ağrısı | Yaygın | 4 | 0 | Yaygın | 6 | <1 | <1 | 0 |
Ekstremite ağrısı | Yaygın | 5 | <1 | Yaygın | 5 | <1 | <1 | <1 |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | ||||||||
Yorgunluk | Çok yaygın | 12 | 0 | Çok yaygın | 17 | 1 | 1 | <1 |
Asteni | Yaygın | 9 | <1 | Yaygın | 6 | 0 | 0 | 0 |
Periferik ödem | Yaygın | 5 | <1 | Yaygın | 6 | 0 | 0 | 0 |
* Bu tabloda gösterim için yüzdeler tamsayıya yuvarlanmıştır. Ancak, en az %5 sıklıktaki terimleri tanımlamak ve terimleri sıklık kategorilerine göre sınıflandırmak için bir ondalık hassasiyetli yüzdeler kullanılır.
** Tercihli terim anoreksiyi de içerir.
Klinik çalışmalardan elde edilen ilave veriler
Aşağıdaki advers ilaç olayları, TASİGNA ile gerçekleştirilen tüm klinik çalışmalarda erişkin hastalarda %5'den düşük bir sıklıkta bildirilmiştir (çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila
<1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor kategorisindedir). Yukarıya dahil edilmeyen, laboratuvar bulguları kapsamındaki çok yaygın advers olaylar (≥1/10) aşağıda “laboratuvar bulguları†başlığı altında verilmektedir.
Enfeksiyonlar ve enfestasyonlar
Yaygın: Folikülit, üst solunum yolu enfeksiyonu (farenjit, nazofarenjit ve rinit dahil), pnömoni*
Yaygın olmayan: Üriner sistem enfeksiyonu, gastroenterit, bronşit, herpes virüs enfeksiyonu, kandidiyazis (oral kandidiyazis dahil)
Bilinmiyor: Sepsis, subkutan apse, anal apse, çıban, tinea pedis, hepatit B reaktivasyonu.
Kist ve polipler de dahil olmak üzere iyi huylu ve kötü huylu neoplazmalar
Yaygın: Deri papilloması
Bilinmiyor: Oral papilloma, paraproteinemi
Kan ve lenf sistemi hastalıkları
Yaygın: Eozinofili, lökopeni, ateşli nötropeni, lenfopeni, pansitopeni Yaygın olmayan: Trombositemi, lökositoz
Bağışıklık sistemi hastalıkları:
Bilinmiyor: Hipersensitivite
Endokrin hastalıkları
Yaygın olmayan: Hipertiroidizm, hipotiroidizm Bilinmiyor: Sekonder hiperparatiroidizm, tiroidit
Metabolizma ve beslenme hastalıkları
Çok yaygın: Hipofosfatemi (kan fosfor seviyesi düşüşü dahil)
Yaygın: Elektrolit dengesizliği (hiperkalemi, hipomagnezemi, hipokalemi, hiponatremi, hipokalsemi, hiperkalsemi, hiperfosfatemiyi içerir), diabetes mellitus, hiperglisemi, hiperkolestrolemi, hiperlipidemi, hipertrigliseridemi
Yaygın olmayan: Gut, dehidratasyon, iştahta artış, dislipidemi Bilinmiyor: Hiperürisemi,hipoglisemi
Psikiyatrik hastalıklar
Yaygın: Depresyon, uykusuzluk, anksiyete
Bilinmiyor: Konfüzyon durumu, dezoryantasyon, amnezi, disföri
Sinir sistemi hastalıkları
Yaygın: Baş dönmesi, hipoestezi, parestezi, periferik nöropati
Yaygın olmayan: İntrakraniyal kanama, iskemik inme, geçici iskemik atak, serebral infarktüs, bilinç kaybı (senkop dahil), migren, tremor, dikkat bozukluğu, hiperestezi Bilinmiyor: Serebrovasküler olay, baziler arter stenozu, beyin ödemi, optik nörit, huzursuz bacak sendromu, disestezi, letarji
Göz hastalıkları
Yaygın: Göz kaşıntısı, konjonktivit, gözde kuruma (kseroftalmi dahil), periorbital ödem, göz hemorajisi
Yaygın olmayan: Hiperemi (skleral, konjonktival, okular), göz kapağı ödemi, fotopsi, konjonktival kanama, görme bozukluğu, bulanık görme, azalmış görme keskinliği, göz tahrişi
Bilinmiyor: Periorbital ödem, blefarit, göz ağrısı, koriyoretinopati, allerjik konjonktivit, oküler yüzey hastalığı, diplopi, göz şişliği, papilödem, fotofobi
Kulak ve iç kulak hastalıkları
Yaygın: Vertigo
Yaygın olmayan: İşitme bozukluğu, kulak ağrısı, kulak çınlaması
Kardiyak hastalıklar
Yaygın: Angina pektoris, aritmi (atriyoventriküler blok, taşikardi, atriyal fibrilasyon, ventriküler ekstrasistoller, bradikardiyi içerir), elektrokardiyogramda QT uzaması, çarpıntı, kalp yetmezliği*
Yaygın olmayan: Siyanoz, miyokard infarktüsü, koroner arter hastalığı, kardiyak üfürüm, perikardiyal efüzyon
Bilinmiyor: Ejeksiyon fraksiyonunda azalma, perikardit, ventriküler fonksiyon bozukluğu
Vasküler hastalıklar
Yaygın: Hipertansiyon, al basması, periferik arter stenozu
Yaygın olmayan: Hipertansif kriz, tıkayıcı periferik arter hastalığı, aralıklı kladikasyon, arteryel stenozlu uzuv, hematom, arterioskleroz
Bilinmiyor: Hemorajik şok, hipotansiyon, tromboz
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın: Dispne, eforlu dispne, epistaksis, öksürük, disfoni
Yaygın olmayan: Pulmoner ödem, plevral efüzyon, interstisyel akciğer hastalığı, plevra ağrısı, yutak-gırtlak ağrısı, plörezi, boğaz tahrişi
Bilinmiyor: Pulmoner hipertansiyon, hırıltı, orofaringeal ağrı
Gastrointestinal hastalıklar
Yaygın: Pankreatit, karında rahatsızlık, karında şişkinlik, gaz, disguzi
Yaygın olmayan: Gastrointestinal kanama, gastroözofageal reflü, melena, ağız ülserasyonu, stomatit, ağız kuruluğu, özofajiyal ağrı, dişlerde hassasiyet, gastrit
Bilinmiyor: Gastrik ülser, gastrointestinal ülser perforasyonu, enterokolit, retroperitoneal kanama, hematemez, ülseratif özofajit, subileus (barsak tıkanıklığı), hemoroidler, hiatus hernisi, rektal kanama, diş eti iltihabı
Hepato-biliyer hastalıklar
Çok yaygın: Hiperbilirubinemi (kan bilirubin değerlerinde artış dahil) Yaygın: Hepatik fonksiyon anormalliği
Yaygın olmayan: Toksik hepatit, hepatotoksisite, sarılık Bilinmiyor: Kolestazis, hepatomegali
Deri ve deri altı doku hastalıkları
Yaygın: Gece terlemeleri, hiperhidroz, egzama, ürtiker, dermatit (alerjik, eksfolyatif ve akneli), kontüzyon, akne
Yaygın olmayan: Eksfolyatif döküntü, ekimoz, yüzde şişme, ilaç döküntüsü, deri ağrısı Bilinmiyor: Eritema multiforme, eritema nodosum, deri ülseri, palmar-plantar eritrodisestezi sendromu, peteşi, fotosensitivite, blister, dermal kist, sebasöz hiperplazi, deri atrofisi, deride renk değişikliği, deride eksfoliasyon, deride hiperpigmentasyon, deri hipertrofisi, hiperkeratoz, psoriyazis
Kas-iskelet ve bağ dokusu hastalıkları
Yaygın: Kas-iskelet göğüs ağrısı, sırt ağrısı, kas-iskelet ağrısı, boyun ağrısı, vücudun yan tarafında ağrı, kas zayıflığı
Yaygın olmayan: Kas-iskelet sertliği, eklemde şişkinlik Bilinmiyor: Artrit
Böbrek ve idrar yolu hastalıkları
Yaygın: Pollakiüri, böbrek yetersizliği*
Yaygın olmayan: Dizüri, idrar sıkışması, noktüri Bilinmiyor: Hematüri, üriner inkontinans, kromatüri
Üreme sistemi ve meme hastalıkları
Yaygın olmayan: Meme ağrısı, erektil fonksiyon bozukluğu, jinekomasti Bilinmiyor: Memede indurasyon, menoraji, meme başında şişlik
Genel bozukluklar ve uygulama bölgesine ilişkin bozukluklar
Yaygın: Pireksi, göğüs ağrısı (kardiyak olmayan göğüs ağrısı dahil), ağrı, halsizlik, göğüste rahatsızlık hissi
Yaygın olmayan: Grip benzeri hastalık, titremeler, yüzde ödem, yerçekimine bağlı ödem, vücut sıcaklığında hissedilen değişiklikler (sıcak hissetme ve soğuk hissetme dahil) Bilinmiyor: Lokalize ödem
Laboratuvar bulguları
Çok yaygın: Alanin aminotransferaz düzeylerinde artış, aspartat aminotransferaz düzeylerinde artış, lipaz düzeylerinde artış, lipoprotein kolesterol düzeyinde artış (düşük yoğunluklu ve yüksek yoğunluklu dahil), total kolesterol düzeyinde artış, kan trigliseritleri düzeyinde artış
Yaygın: Hemoglobin düzeyinde düşüş, kan amilaz düzeyinde artış, kan alkalen fosfataz düzeyinde artış, gama-glutamiltransferaz düzeyinde artış, kan kreatinin fosfokinaz düzeyinde artış, vücut ağırlığında artış, vücut ağırlığında düşüş, azalmış globülinler, kan insülin düzeyinde artış
Yaygın olmayan: Kan laktat dehidrojenaz düzeyinde artış, kan üre düzeyinde artış, kan glukoz düzeylerinde azalma
Bilinmiyor: Troponin düzeyinde artış, kanda konjuge olmayan bilirubin düzeyinde artış, kan insulin düzeyinde azalma, insulin C-peptid düzeyinde azalma, kanda paratiroit hormon artışı
* Sıklık hesabı imatinibe dirençli veya kronik fazda intolere KML'si olan yetişkin hastalarda yapılan ve inceleme periyodu iki yıl olan (n=507) prospektif bir gözlemsel çalışmaya dayanmaktadır.
Rutin hematolojik veya biyokimya laboratuvar değerlerinde klinik anlama sahip ya da şiddetli anormallikler Tablo 3'te sunulmaktadır.
Tablo 3 Derece 3-4 laboratuvar anormallikleri *
| Yeni tanı almış KML-KF Günde iki kez 300 mg | İmatinibe dirençli veya imatinibi tolere edemeyen KML-KF ve KML-AF Günde iki kez 400 mg | |
| n=279 (%) | KML-KF n=321 (%) | KML-AF n=137 (%) |
Hematolojik parametreler |
|
|
|
Miyelosüpresyon |
|
|
|
- Nötropeni | 12 | 31 | 42 |
- Trombositopeni | 10 | 30 | 42 |
- Anemi | 4 | 11 | 27 |
Biyokimyasal parametreler |
|
|
|
- Kreatinin düzeyinde artış | 0 | 1 | <1 |
- Lipaz düzeyinde artış | 9 | 18 | 18 |
- SGOT (AST) düzeyinde artış | 1 | 3 | 2 |
- SGPT (ALT) düzeyinde artış | 4 | 4 | 4 |
- Hipofosfatemi | 8 | 17 | 15 |
- Bilirubin (total) düzeyinde artış | 4 | 7 | 9 |
- Glukoz düzeyinde artış | 7 | 12 | 6 |
- Kolesterol (total) düzeyinde artış | 0 | ** | ** |
- Trigliseritler düzeyinde artış 0 | 0 | ** | ** |
* Tek ondalık haneli yüzdeler kullanılmış ve bu tabloda tam sayıya yuvarlanarak sunulmuştur.
** Toplanmayan parametreler
hastalarındatedavininkesilmesiXZ1Ax
Tedavisiz remisyon (TFR) denemesi çerçevesinde TASİGNA tedavisinin kesilmesinden sonra hastalar, tedavinin kesilmesi öncesi ile karşılaştırıldığında daha sık miyalji, ekstremite ağrısı, artralji, kemik ağrısı, spinal ağrı veya kas-iskelet ağrısı gibi kas-iskelet semptomları yaşayabilir.
Yeni tanı almış kronik fazdaki yetişkin Ph+ KML hastalarındaki (N=190) bir Faz II klinik çalışmada kas-iskelet semptomları, TASİGNA'nın kesilmesini takip eden bir yıl içinde %24,7 oranında bildirilirken bu oran TASİGNA tedavisi sırasında bir önceki yılda
%16,3 olmuştur.
TASİGNA tedavisi görmekte olan ve önceden imatinib ile tedavi edilmiş yetişkin Ph+ KML hastalarındaki (N=126) bir Faz II klinik çalışmada, hastaların %14,3'ünde TASİGNA tedavisinde önceki bir yıl içinde, %42,1'inde ise tedavinin kesilmesini izleyen bir yıl içinde kas-iskelet semptomları bildirilmiştir.
Seçili advers reaksiyonların tanımlanması
Ani ölüm
Kalp hastalığı tıbbi öyküsü veya anlamlı kardiyak risk faktörleri bulunan imatinibe dirençli veya imatinibi tolere edemeyen kronik ve akselere faz KML hastalarında gerçekleştirilen klinik çalışmalarda ve/veya erken erişim programlarında TASİGNA kullanımı ile yaygın olmayan sıklıkta (%0,1-1) ani ölüm vakaları bildirilmiştir (bkz. Bölüm 4.4).
Hepatit B reaktivasyonu
BCR-ABL TKI'lerle ilişkili olarak hepatit B reaktivasyonu bildirilmiştir. Bazı vakalarda, karaciğer nakliyle veya ölümle sonuçlanan akut karaciğer yetmezliği veya fulminan hepatit ortaya çıkmıştır (bkz. Bölüm 4.4).
Pazarlama sonrası deneyim
Pazarlama sonrası deneyim, spontan vaka bildirimleri, literatür vakaları, genişletilmiş erişim programları ve global ruhsatlandırma çalışmaları dışındaki klinik çalışmalardan aşağıdaki advers reaksiyonlar elde edilmiştir. Bu reaksiyonlar boyutu tam olarak bilinmeyen bir popülasyondan bildirilmiş olduğundan, bunların sıklığını güvenilir bir şekilde hesaplamak ya da nilotinib maruziyeti ile nedensel bir ilişki kurmak her zaman mümkün olmamaktadır.
Seyrek: Nilotinib ile tedavi edilen vakalarda tümör lizis sendromu vakaları bildirilmiştir. Bilinmiyor: Nilotinib ile tedavi edilen hastalarda yüz felci vakaları bildirilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35
99)
4.9. Doz aşımı ve tedavisi
Nilotinible, belirtilmeyensayıdaTASİGNAkapsülünalkol veya diğer ilaçlarla birlikte
kusma ve sersemlik olmuştur. EKG değişiklikleri veya hepatoksisite bildirilmemiştir. Bildirilen sonuçlar olayların reversibl olduğu yönündedir.
Doz aşımı durumunda, hasta gözlem altında tutulmalı ve uygun destekleyici tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajan: Protein kinaz inhibitörü ATC Kodu: L01EA03
Etki mekanizması:
Nilotinib, hem hücre dizilerinde hem de Philadelphia-kromozomu pozitif primer lösemi hücrelerinde, BCR-ABL onkoproteininin ABL tirozin kinaz aktivitesinin güçlü bir inhibitörüdür. İlaç, ATP bağlanma yerine son derece yüksek bir afinite ile bağlanarak, vahşi-tip BCR-ABL'yi güçlü bir şekilde inhibe etmekte ve BCR-ABL'nin imatinibe karşı dirençli 32/33 mutant formuna karşı etkinlik sağlamaktadır. Bu biyokimyasal etkinliğin bir sonucu olarak, nilotinib KML hastalarından alınan Philadelphia- kromozomu pozitif primer lösemi hücrelerinde ve hücre dizilerinde selektif olarak proliferasyonu inhibe etmekte ve apopitozu indüklemektedir. KML sıçan modellerinde, nilotinib monoterapi olarak oral uygulamayı takiben tümör yükünü azaltmakta ve sağ kalımı uzatmaktadır.
Farmakodinamik etkiler:
Nilotinibin, KML tedavisi için önerilen terapötik dozlarda oral uygulamayı takiben elde edilen aralıktaki konsantrasyonlarda inhibe ettiği PDGF (Platelet kaynaklı büyüme faktörü), KIT CSF-1R, DDR ve Efrin reseptör kinazları dışında, Src de dahil olmak üzere incelenen diğer protein kinazların çoğuna karşı herhangi bir etkisi yoktur ya da çok az bir etkisi vardır (Bkz. Tablo 4).
Tablo 4: Nilotinibin Kinaz Profili (Fosforilasyon IC nM)
BCR-ABL | PDGFR | KIT |
20 | 69 | 210 |
Klinik etkililik:
Yeni tanı almış kronik faz KML'de klinik çalışmalar
Sitogenetik olarak doğrulanmış yeni tanı konmuş yetişkin Ph+ KML-KF (kronik faz) hastalarında nilotinib ve imatinib etkinliklerinin karşılaştırılması amacıyla 846 yetişkin hastada açık etiketli, çok merkezli, randomize bir Faz III çalışması yürütülmüştür. Hastalar altı ay önce tanı almıştır ve hidroksiüre ve/veya anagrelid hariç önceden tedavi görmemişlerdir. Hastalar günde iki kez nilotinib 300 mg (n=282), günde iki kez nilotinib 400 mg (n=281) veya günde bir kez imatinib 400 mg (n=283) almak üzere 1:1:1 oranında randomize edilmiştir. Randomizasyon, tanı anındaki Sokal risk skoruna göre katmanlandırılmıştır.
Başlangıç karakteristikleri üç tedavi kolu arasında dengeli olmuştur. Medyan yaş her iki nilotinib kolunda 47 yıl ve imatinib kolunda 46 yıl olmuş, günde iki kez nilotinib 300 mg, günde iki kez nilotinib 400 mg ve günde bir kez imatinib 400 mg kollarında
hastaların sırasıyla %12,8, %10,0ve%12,4'ünün≥65
yaşında olduğu belirlenmiştir.
nilotinib 300 mg, günde iki kez nilotinib 400 mg ve günde bir kez imatinib 400 mg kollarında sırasıyla %56,0, %62,3 ve %55,8). Hastaların %60'ından fazlası Beyazdır ve tüm hastaların %25'i Asyalıdır.
Birincil veri analizi zaman noktası 846 hastanın tümünün 12 aylık tedaviyi tamamladığı (ya da daha önce ayrıldığı) zaman olmuştur. Müteakip analizler hastaların 24, 36, 48, 60 ve 72 aylık tedavi tamamladığı (ya da daha önce ayrıldığı) zamanları yansıtmaktadır. Tedavide geçen medyan süre nilotinib tedavi kollarında yaklaşık 70 ay ve imatinib grubunda 64 aydır. Kullanılan medyan doz yoğunluğu günde iki kez 300 mg nilotinib için 593 mg/gün, günde iki kez 400 mg nilotinib için 772 mg/gün ve günde bir kez 400 mg imatinib için 400 mg/gün şeklindedir. Bu çalışma devam etmektedir.
Birincil sonlanım noktası 12. ayda majör moleküler yanıt (MMY) olmuştur. MMY, RQ PCR ile ölçülen uluslararası ölçeğe (IS) göre ≤%0,1 BCR ABL/ABL% şeklinde tanımlanmış olup standardize başlangıç değerinden ≥3 log BCR ABL transkript azalmasına karşılık gelmektedir. 12. ayda MMY oranı, günde iki kez 300 mg nilotinib grubunda, günde bir kez 400 mg imatinib grubu ile karşılaştırıldığında istatistiksel olarak anlamlı düzeyde daha yüksek olmuştur (%44,3 karşısında %22,3, p<0,0001). 12. ayda MMY oranı günde iki kez 400 mg nilotinib grubunda da, günde bir kez 400 mg imatinib grubu ile karşılaştırıldığında, istatistiksel olarak anlamlı düzeyde daha yüksek bulunmuştur (%42,7 karşısında %22,3, p<0,0001).
3, 6, 9 ve 12. aylarda MMY oranları günde iki kez 300 mg nilotinib grubu için sırasıyla
%8,9, %33,0, %43,3 ve %44,3, günde iki kez 400 mg nilotinib grubu için sırasıyla %5,0,
%29,5%, %38,1 ve %42,7 ve günde bir kez 400 mg imatinib için sırasıyla %0,7, %12,0,
%18,0 ve %22,3 olmuştur.
12, 24, 36, 48, 60 ve 72. aylardaki MMY oranları Tablo 5'te gösterilmektedir.
| TASİGNA günde iki kez 300 mg n=282 (%) | TASİGNA günde iki kez 400 mg n=281 (%) | İmatinib günde bir kez 400 mg n=283 (%) |
12. ayda Major Moleküler Yanıt Yanıt için % 95 CI | 44,3 (38,4,50,3) | 42,7 (36,8,48,7) | 22,3 (17,6, 27,6) |
24. ayda Major Moleküler Yanıt Yanıt için % 95 CI | 61,7 (55,8,67,4) | 59,1 (53,1,64,9) | 37,5 (31,8,43,4) |
36. ayda Major Moleküler Yanıt Yanıt için % 95 CI | 58,5 (52,5,64,3) | 57,3 (51,3,63,2) | 38,5 (32,8,44,5) |
48. ayda Major Moleküler Yanıt Yanıt için % 95 CI | 59,9 (54,0,65,7) | 55,2 (49,1,61,1) | 43,8 (38,0,49,8) |
60. ayda Major Moleküler Yanıt Yanıt için % 95 CI | 62,8 (56,8,68,4) | 61,2 (55,2,66,9) | 49,1 (43,2,55,1) |
72. ayda Major Moleküler Yanıt Yanıt için % 95 CI | 52,5 (46,5,58,4) |
57,7 (51,6,63,5) | 41,7 (35,9,47,7) |
Tablo 5 MMY oranı
Farklı zaman noktalarına göre MMY oranları (o zaman noktasında veya öncesinde yanıt veren hasta olarak MMY'ye ulaşan hastalar dahil), kümülatif MMY insidansında sunulmaktadır (Bkz. Şekil 1).
Şekil 1 Kümülatif MMY insidansı
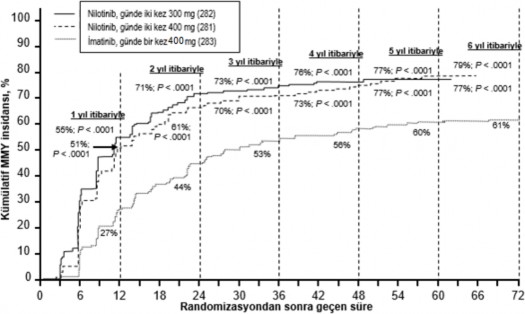
Tüm Sokal risk gruplarında (KML hastalarının sağkalımını belirlemede hasta yaşı, dalak büyüklüğü, periferik kanda blast ve trombosit sayısını içeren bir skorlama sistemidir) tüm zaman noktalarındaki MMY oranı iki nilotinib grubunda da imatinib grubundan daha yüksek olmuştur.
Retrospektif bir analizde, günde iki kez 300 mg nilotinib kullanan hastaların %91'i (234/258) tedavinin 3. ayında ≤%10 BCR-ABL düzeyleri elde ederken, bu oran günde bir kez imatinib 400mgkullananhastalarda%67'dir(176/264). Tedavinin 3. ayında
≤%10 BCR-ABL düzeylerine sahip hastalar, bu moleküler yanıt düzeyini elde etmeyenlere kıyasla 72 ayda daha fazla genel sağkalım göstermiştir (sırasıyla %94,5 karşısında %77,1 [p=0,0005]).
İlk MMY'ye kadar geçen sürenin Kaplan-Meier analizine göre, farklı zaman noktalarında MMY elde etme olasılığı, hem günde iki kez 300 mg hem de günde iki kez 400 mg nilotinib için, günde bir kez 400 mg imatinib ile karşılaştırıldığında, daha yüksek olmuştur (günde iki kez 300 mg ile günde bir kez 400 mg imatinib arasında HR=2,17 ve katmanlandırılmış log sıra p<0,0001, günde iki kez 400 mg ile günde bir kez 400 mg imatinib arasında HR=1,88 ve katmanlandırılmış log sıra p<0,0001).
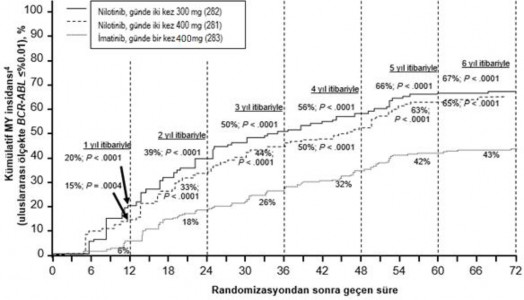
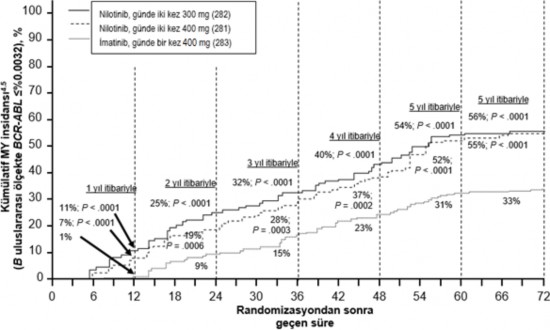
Farklı zaman noktalarında IS ile %≤0,01 ve ≤%0,0032 düzeylerinde moleküler yanıtı olan hastaların oranı Tablo 6'da sunulmakta ve farklı zaman noktalarına göre IS ile
%≤0,01 ve ≤%0,0032 değerlerinde moleküler yanıtı olan hastaların oranı Şekil 2 ve 3'te gösterilmektedir. IS ile ≤%0,01 ve ≤%0,0032 moleküler yanıt oranları, standardize bir başlangıç değerinden sırasıyla ≥4 ve ≥4,5 log BCR ABL transkriptler azalmasına karşılık gelmektedir.
Tablo 6 %≤0,01 (4 log azalma) ve ≤%0,0032 (4,5 log azalma) düzeyinde moleküler yanıtı olan hastaların oranları
| Nilotinib günde iki kez 300 mg n=282 (%) | Nilotinib günde iki kez 400 mg n=281 (%) | İmatinib günde bir kez 400 mg n=283 (%) | |||
| ≤%0,01 | ≤%0,0032 | ≤%0,01 | ≤%0,0032 | ≤%0 ,01 | ≤%0,0032 |
12 ayda | 11,7 | 4,3 | 8,5 | 4,6 | 3,9 | 0,4 |
24 ayda | 24,5 | 12,4 | 22,1 | 7,8 | 10,2 | 2,8 |
36 ayda | 29,4 | 13,8 | 23,8 | 12,1 | 14,1 | 8,1 |
48 ayda | 33,0 | 16,3 | 29,9 | 17,1 | 19,8 | 10,2 |
60 ayda | 47,9 | 32,3 | 43,4 | 29,5 | 31,1 | 19,8 |
72 ayda | 44,3 | 31,2 | 45,2 | 28,8 | 27,2 | 18,0 |
Şekil 2 ≤%0,01 (4 log azalma) moleküler yanıtın kümülatif insidansı
Şekil 3 ≤%0,0032 (4,5 log azalma) moleküler yanıtın kümülatif insidansı
İlk MMY'nin süresine ilişkin Kaplan Meier tahminlerine dayalı olarak, MMY'ye ulaşan hastalar arasında yanıtını 72 ay sürdüren hastaların oranları günde iki kez 300 mg nilotinib grubunda %92,5 (%95 GA: %88,6 %96,4), günde iki kez 400 mg nilotinib
grubunda %92,2 (%95 GA: %88,5 %95,9) ve günde bir kez 400 mg imatinib grubunda
%88,0 (%95 GA: %83,0%93,1)olmuştur.
Tam sitogenetik yanıt (TSY):
Tam sitogenetik yanıt (TSY), değerlendirilen minimum 20 metafaza dayalı olarak kemik iliğinde %0 Ph+ metafazı şeklinde tanımlanır. 12 ay itibariyle en iyi TSY oranı (yanıt veren hastalar olarak 12. ay zaman noktasında veya öncesinde TSY'ye ulaşan hastaları içerir), hem günde iki kez nilotinib 300 mg hem de günde iki kez 400 mg nilotinib için günde bir kez 400 mg imatinibe kıyasla istatistiksel olarak daha yüksektir (bkz. Tablo 7).
24 ay itibariyle TSY oranı (yanıt veren hastalar olarak 24. ay zaman noktasında veya öncesinde TSY'ye ulaşan hastaları içerir), hem günde iki kez 300 mg nilotinib hem de günde iki kez 400 mg nilotinib için günde bir kez 400 mg imatinibe kıyasla istatistiksel olarak daha yüksektir.
Tablo 7 En iyi TSY oranı
| Nilotinib Günde iki kez 300 mg n=282 (%) | Nilotinib Günde iki kez 400 mg n=281 (%) | İmatinib Günde bir kez 400 mg n=283 (%) |
12 ay itibariyle |
|
|
|
Yanıt (%95 GA) | 80,1 (75,0; 84,6) | 77,9 (72,6; 82,6) | 65,0 (59,2; 70,6) |
Yanıt yok | 19,9 | 22,1 | 35,0 |
Yanıt oranı için CMH testi p değeri (günde bir kez imatinib 400 mg karşısında) | <0,0001 | 0,0005 |
|
24 ay itibariyle |
|
|
|
Yanıt (%95 GA) | 86,9 (82,4; 90,6) | 84,7 (79,9; 88,7) | 77,0 (71,7; 81,8) |
Yanıt yok | 13,1 | 15,3 | 23,0 |
Yanıt oranı için CMH testi p değeri (günde bir kez imatinib 400 mg karşısında) | 0,0018 | 0,0160 |
|
Kaplan-Meier tahminlerine dayalı olarak, TSY'ye ulaşan hastalar arasında yanıtını 72 ay süreyle sürdüren hastaların oranları, günde iki kez 300 mg nilotinib grubunda %99,1 (%95 GA: %97,9-%100), günde iki kez 400 mg nilotinib grubunda %98,7 (%95 GA:
%97,1-%100) ve günde bir kez imatinib 400 mg grubunda %97,0 (%95 GA: %94,7-
%99,4) şeklindedir.
Tedavi sırasında akselere faza (AF) veya blast krize (BK) progresyon, randomizasyon tarihinden itibaren akselere faza veya blast krize ilk belgelenen hastalık progresyonuna ya da KML ilişkili ölüme kadar geçen süre şeklinde tanımlanmıştır. Tedavi sırasında akselere faza veya blast krize progresyon toplam 17 hastada gözlenmiştir: günde iki kez nilotinib 300 mg'da 2 hasta, günde iki kez nilotinib 400 mg'da 3 hasta ve günde bir kez imatinib 400 mg'da 12 hasta. 72. ayda akselere faza veya blast krize progresyonu olmayan hastaların tahmini oranları sırasıyla %99,3, %98,7 ve %95,2 olmuştur (HR=0,1599 ve katmanlandırılmış log sıra günde iki kez nilotinib 300 mg ile günde bir kez imatinib arasında p=0,0059, HR=0,2457 ve katmanlandırılmış log sıra günde iki kez
tedavide herhangi bir yeni AF/BK'ye progresyon olayı bildirilmemiştir.
Progresyon kriteri olarak klonal evrilme dahil, veri kesme tarihi itibariyle toplam 25 hasta tedavideyken akselere faza veya blast krize progrese olmuştur (günde iki kez nilotinib 300 mg grubunda 3, günde iki kez nilotinib 400 mg grubunda 5 ve günde bir kez imatinib 400 mg grubunda 17). 72. ayda klonal evrilme dahil akselere faza veya blast krize progresyonu olmayan hastaların tahmini oranları sırasıyla %98,7, %97,9 ve %93,2 olmuştur (HR=0,1626 ve katmanlandırılmış log sıra günde iki kez nilotinib 300 mg ile günde bir kez imatinib arasında p=0,0009, HR=0,2848 ve katmanlandırılmış log sıra günde iki kez nilotinib 400 mg ile günde bir kez imatinib arasında p=0,0085).
Toplam 55 hasta tedavi sırasında ya da tedavinin kesilmesinden sonrasındaki takip sırasında yaşamını kaybetmiştir (günde iki kez 300 mg nilotinib grubunda 21, günde iki kez 400 mg nilotinib grubunda 11 ve günde bir kez 400 mg imatinib grubunda 23). Bu 55 ölümün 26'sı KML ile ilişkili olmuştur (günde iki kez 300 mg nilotinib grubunda 6, günde iki kez 400 mg nilotinib grubunda 4 ve günde bir kez 400 mg imatinib grubunda
16). 72. ayda hayatta kalan hastaların tahmini oranı sırasıyla %91,6, %95,8 ve %91,4'tür (HR=0,8934 ve katmanlandırılmış log sıra günde iki kez 300 mg nilotinib ile imatinib arasında p=0,7085, HR=0,4632 ve katmanlandırılmış log sıra günde iki kez 400 mg nilotinib ile imatinib arasında p=0,0314). Olay olarak sadece KML ile ilişkili ölümler göz önünde bulundurulduğunda, 72. ayda tahmini genel sağkalım oranları sırasıyla
%97,7, %98,5 ve %93,9 olmuştur (HR=0,3694 ve katmanlandırılmış log sıra günde iki kez 300 mg nilotinib ile imatinib arasında p=0,0302, HR=0,2433 ve katmanlandırılmış log sıra günde iki kez 400 mg nilotinib ile imatinib arasında p=0,0061).
Kronik faz ve akselere fazda imatinibe dirençli veya imatinibi tolere edemeyen KML'de klinik çalışmalar
Kronik ve akselere fazdaki hastalık için ayrı tedavi kollarıyla imatinibe dirençli veya imatinibi tolere edemeyen KML'li hastalarda TASİGNA'nın etkililiğini saptamak üzere açık etiketli, kontrolsüz, çok merkezli bir Faz II çalışma gerçekleştirilmiştir. Etkililik, çalışmaya alınan 321 KML-KF hastası ve 137 KML-AF hastasına dayanmıştır. Medyan tedavi süresi KML-KF hastalarında 561 gün ve KML-AF hastalarında 264 gün olmuştur (bkz. Tablo 8). Yetersiz yanıt ya da hastalık ilerlemesi yönünde bir kanıt olmadığı sürece TASİGNA kesintisiz olarak uygulanmıştır (günde iki kez bir öğünden 2 saat sonra ve uygulamadan sonra en az bir saat süreyle besin alınmayarak). Doz günde iki kez 400 mg olmuş ve günde iki kez 600 mg'a doz yükseltmeye izin verilmiştir.
Tablo 8 Nilotinib ile maruziyet süresi
| Kronik faz n=321 | Akselere faz n=137 |
Medyan tedavi süresi (gün) (25-75. persentiller) | 561 (196-852) | 264 (115-595) |
İmatinibe direnç; tam hematolojik yanıt elde edememe (3 ayda), sitogenetik yanıt elde edememe (6 ayda) veya majör sitogenetik yanıt elde edememeyi (12 ayda) ya da önceki bir sitogenetik veya hematolojik yanıt sonrasında hastalık progresyonunu içermiştir. İmatinibe toleranssızlık, toksisite nedeniyle imatinib tedavisini bırakan ve çalışmaya giriş tarihinde majör sitogenetik yanıtta olmayan hastaları içermiştir.
Toplamda hastaların %73'ünün imatinibe dirençli olduğu, %27'sinin ise imatinibi tolere edemediği belirlenmiştir. Hastaların çoğunda, imatinib, hidroksiüre, interferon dahil diğer antineoplastik ajanlar ile önceki kapsamlı bir tedaviyi de içeren uzun KML öyküsünün olduğu, hatta bazılarında organ nakli başarısızlığının da bulunduğu saptanmıştır (Tablo 9). Önceki medyan en yüksek imatinib dozu 600 mg/gün olmuştur. En yüksek önceki imatinib dozu, hastaların %74'ünde ≥ 600 mg/gün olup hastaların
%40'ı ≥ 800 mg/gün dozları almıştır.
Tablo 9 KML hastalık öyküsü karakteristikleri
| Kronik faz (n=321) | Akselere faz (n=137)* |
Tanıdan sonra geçen süre (ay) (aralık) | 58 (5–275) | 71 (2–298) |
İmatinib Dirençli MSY olmadan toleranssız |
226 (70%) 95 (30%) |
109 (80%) 27 (20%) |
Medyan imatinib tedavisi süresi (gün) (25-75. persentiller) | 975 (519-1,488) | 857 (424-1,497) |
Hidroksiüre öyküsü | 83% | 91% |
İnterferon öyküsü | 58% | 50% |
Kemik iliği nakli öyküsü | 7% | 8% |
* Bir hasta için imatinib direnci/toleranssızlığı durumu hakkında eksik bilgi. | ||
KF hastalarında birincil sonlanım noktası, Ph+ hematopoetik hücrelerin eliminasyonu (TSY, tam sitogenetik yanıt) veya <%35 Ph+ metafaz düzeyine anlamlı azalma (kısmi sitogenetik yanıt) şeklinde tanımlanan majör sitogenetik yanıt (MSY) olmuştur. KF hastalarında tam hematolojik yanıt (THY) ikincil sonlanım noktası olarak değerlendirilmiştir. AF hastalarında birincil sonlanım noktası genel doğrulanmış hematolojik yanıt (HY) olup ya tam hematolojik yanıt, lösemi kanıtının olmaması ya da kronik faza dönüş şeklinde tanımlanmıştır.
Kronik faz
321 KF hastasında MSY oranı %51 olmuştur. Yanıt veren hastaların çoğu MSY yanıtlarını hızla, nilotinib tedavine başladıktan sonra 3 ay içinde (medyan 2,8) elde etmiştir ve bu yanıtlar kalıcı olmuştur. TSY elde etmek için geçen medyan sürenin 3 aydan çok az daha uzun olduğu görülmüştür (medyan 3,4 ay). MSY elde eden hastaların
%77'sinin (%95 GA: %70 - %84) 24 ayda yanıtı korudukları belirlenmiştir. Medyan MSY süresine o tarihte ulaşılmamıştır. TSY elde eden hastaların %85'inin (%95 GA:
%78 - %93) 24 ayda yanıtı korudukları gözlenmiştir. Medyan TSY süresine o tarihte ulaşılmamıştır. Başlangıçta THY'si olan hastalar MSY'ye daha hızlı ulaşmıştır (1,9 karşısında 2,8 ay). Başlangıçta THY'si olmayan KF hastalarının %70'i THY elde etmiş olup THY'ye kadar geçen medyan süre 1 ay ve medyan THY süresi 32,8 ay bulunmuştur. KML-KF hastalarında hesaplanan 24 aylık genel sağkalım oranı % 87 olmuştur.
Akselere faz
137 AF hastasında genel doğrulanmış HY (Hematolojik Yanıt) oranı %50 olmuştur. Yanıt veren hastaların çoğu HY'yi nilotinib tedavisinin başlarında elde etmiş (medyan 1,0 ay) ve bu yanıtlar kalıcı olmuştur (doğrulanmış HY'nin medyan süresi 24,2 ay
bulunmuştur). HY elde eden hastaların %53'ünün (%95 GA: %39 - %67) 24 ayda yanıtı
korudukları saptanmıştır. MSY oranı %30 olup yanıta kadar geçen medyan süre 2,8 ay olmuştur. MSY elde eden hastaların %63'ünün (%95 GA: %45 - %80) 24 ayda yanıtı korudukları görülmüştür. Medyan MSY süresi 32,7 ay olmuştur. KML-AF hastalarında hesaplanan 24 aylık genel sağkalım oranı % 70 olmuştur.
İki tedavi kolu için yanıt oranları Tablo 10'da bildirilmektedir.
Tablo 10 KML'de yanıt
(En iyi yanıt oranı) | Kronik faz | Akselere faz | ||||
| Tolere edemeyen (n=95) | Dirençli (n=226) | Toplam (n=321) | Tolere edemeyen (n=27) | Dirençli (n=109) | Toplam* (n=137) |
Hematolojik yanıt (%) | ||||||
Genel (%95 GA) Tam NEL KF'ye dönüş | - 87 (74-94) - - | - 65 (56-72) - - | - 70 (63-76) - - | 48 (29-68) 37 7 4 | 51 (42-61) 28 10 13 | 50 (42-59) 30 9 11 |
Sitogenetik yanıt (%) | ||||||
Majör (95%CI) Tam Kısmi | 57 (46-67) 41 16 | 49 (42-56) 35 14 | 51 (46-57) 37 15 | 33 (17-54) 22 11 | 29 (21-39) 19 10 | 30 (22-38) 20 10 |
NEL = Kemik iliği yanıtı/Lösemi kanıtı yok/
* Bir hasta için imatinib direnci/toleranssızlığı durumu hakkında eksik bilgi.
KML-BK hastalarında etkililik verileri henüz hazır değildir. İmatinibe ek olarak bir tirozin kinaz inhibitörü ajanını da içeren çoklu tedaviler ile önceden yoğun bir şekilde tedavi edilmiş olan KF ve AF hastalarından oluşan bir grupta TASİGNA'yı araştırma amacıyla Faz II çalışmaya ayrı tedavi kolları da dahil edilmiştir. Bu hastaların 30/36'sı (%83) tedaviye dirençli olup tedaviye toleranssız değildir. Etkililik için değerlendirilen 22 KF hastasında TASİGNA %32'lik MSY oranı ve %50'lik THY oranı sağlamıştır. Etkililik için değerlendirilen 11 AF hastasında ise tedavi %36'lık bir genel HY oranı sağlamıştır.
İmatinib ile başarısızlık sonrasında, mutasyonlar açısından değerlendirilen kronik faz KML hastalarının %42'sinde ve akselere faz KML hastalarının %54'ünde 24 farklı BCR-ABL mutasyonu tespit edilmiştir. TASİGNA, T315I hariç imatinib direnci ile bağlantılı çeşitli BCR-ABL mutasyonları taşıyan hastalarda etkililik göstermiştir.
Birinci basamak tedavi olarak TASİGNA ile tedavi edilmiş ve sürekli derin moleküler yanıt elde etmiş olan kronik fazdaki yetişkin Ph+ KML hastalarında tedavinin kesilmesi Açık etiketli, tek kollu bir çalışmada, birinci basamakta ≥ 2 yıl süreyle nilotinib ile tedavi edilip MolecularMD MRDxâ„¢ BCR-ABL testi ile ölçüldüğünde MY4.5 etmiş olan kronik fazdaki 215 yetişkinPh+KMLhastası,52haftadaha nilotinibe devam edecekleri
fazı sırasında aşağıdaki kriterler ile tanımlanan sürekli derin moleküler yanıt elde ettikten sonra Tedavisiz Faza (TFR) girmiştir:
üç ayda bir yapılan (12 haftada bir alınan) değerlendirmelerin en az 4'ü en az MY4 (BCR-ABL/ABL ≤%0,01 IS) olmuş ve bir yıl korunmuştur
5.2. Farmakokinetik özellikler
Genel özellikler
TASİGNA (nilotinib) tirozin kinaz inhibitörüdür ve antineoplastik bir ajandır. Nilotinib beyaz ila hafif sarımsı renkte tozdur. Nilotinibin sulu çözeltilerdeki çözünürlüğü pH'nın yükselmesi ile azalır. Nilotinib optik olarak aktif değildir. pK'sı 2,1'dir.
Emilim:
Oral uygulamadan 3 saat sonra nilotinibin doruk konsantrasyonlarına ulaşılmaktadır. Oral uygulamayı takiben nilotinibin emilimi yaklaşık % 30 olarak belirlenmiştir. Nilotinibin mutlak biyoyararlanımı henüz belirlenmemiştir. Bir oral çözeltiye kıyasla (pH 1,2 ila 1,3), nilotinib kapsülün bağıl biyoyararlanımı yaklaşık % 50'dir. Sağlıklı gönüllülerde TASİGNA yemekle birlikte verildiğinde, nilotinibin Cdeğeri ve konsantrasyon-zaman eğrisinin altında kalan alanı (EAA), aç karnına alınmasına kıyasla sırasıyla % 112 ve % 82 oranında artmıştır. TASİGNA'nın yemekten 30 dakika ya da 2 saat sonra alınması nilotinibin biyoyararlanımını sırasıyla % 29 ve % 15 oranında artırmıştır (bkz. bölüm 4.2., bölüm 4.4., bölüm 4.5.). Nilotinibin emilimi (bağıl biyoyararlanım) sırasıyla total gastrektomi ve kısmi gastroktemi geçirmiş hastalarda yaklaşık % 48 ve % 22 azalabilir.
Dağılım:
Nilotinibin kan-plazma oranı 0,71'dir. Plazma proteinlerine bağlanma, in vitro deneylere dayalı olarak yaklaşık %98 oranındadır.
Biyotransformasyon:
Sağlıklı deneklerde tanımlanan ana metabolik yollar karaciğerde oksidasyon ve hidroksilasyondur. Nilotinib, serumdaki başlıca dolaşan bileşendir. Metabolitlerin hiçbiri nilotinibin farmakolojik aktivitesine anlamlı bir katkıda bulunmamaktadır. Nilotinib CYP2C8'den olası minör bir katkı ile başlıca CYP3A4 ile metabolize edilir.
Eliminasyon:
Sağlıklı gönüllülerde radyoaktif madde ile işaretlenmiş nilotinibin tek bir dozunun uygulanmasından sonra, dozun %90'ından fazlası 7 gün içerisinde çoğunlukla feçes ile (dozun %94'ü) atılmıştır. Değişmemiş ana ilaç, dozun %69'unu teşkil etmiştir.
Günlük doz uygulaması ile çoklu doz farmakokinetiğinden hesaplanmış belirgin eliminasyon yarılanma ömrü yaklaşık 17 saattir. Nilotinib farmakokinetiğinde hastalar arasında gözlenen değişkenlik orta düzeyde veya yüksektir.
Doğrusallık / doğrusal olmayan durum:
Kararlı durumda nilotinib maruziyetinin, günde bir kez 400 mg'ın üzerindeki doz düzeylerinde sistemik maruziyette doz ile orantılı artıştan daha az bir artış olmak üzere, doza bağımlı olduğu gözlenmiştir. Kararlı durumda, günde iki kez 400 mg'lık dozda uygulanan nilotinibe olan günlük sistemik maruziyetin, günde bir kez 800 mg'lık doza kıyasla %35 daha yüksek olduğu görülmüştür. Günde iki kez nilotinib 400 mg ile kararlı durumdaki sistemik maruziyet (EAA) günde iki kez 300 mg doza göre yaklaşık %13,4 daha yüksek bulunmuştur. 12 ayda nilotinib vadi ve tepe ortalama konsantrasyonu günde iki kez 400 mg ile günde iki kez 300 mg doza göre sırasıyla %15,7 ve %14,8 daha yüksek bulunmuştur. Doz, günde iki kez 400 mg'dan günde iki kez 600 mg'a çıkarıldığında, nilotinib maruziyetindeanlamlıbirartış olmamıştır.
Kararlı durum koşullarına 8. gün itibariyle erişilir. İlk doz ve kararlı durum arasında nilotinibe sistemik maruziyette bir artış, günde bir kez 400 mg doz uygulama için yaklaşık 2 katken, günde iki kez 400 mg doz uygulama için 3,8 kattır.
Biyoeşdeğerlik/biyoyararlanım çalışmaları:
Her bir kapsül içeriğinin bir tatlı kaşığı elma sosunda dağıtıldığı 200 mg'lık 2 kapsül ile 400 mg'lık tekli nilotinib doz uygulamasının, 200 mg'lık açılmamış 2 kapsül ile tekli doz uygulamasına biyoeşdeğer olduğu gösterilmiştir.
Hastalardaki karakteristik özellikler
Pediyatrik hastalar:
Pediyatrik hastalarda en yakın 50 mg doza yuvarlanan günde iki kez 230 mg/m dozunda (maksimum tek doz 400 mg) nilotinib uygulanmasının ardından nilotinibin kararlı durum maruziyeti ve klirensinin, günde iki kez 400 mg ile tedavi edilen erişkinler ile benzer olduğu bulunmuştur (2 kat içinde). Tek ve çoklu dozlar sonrasında nilotinibin farmakokinetik maruziyetinin 2 ila <10 yaş hastalar ile ≥10 ila <18 yaş hastalar arasında birbirine yakın olduğu görülmüştür.
5.3. Klinik öncesi güvenlilik verileri
Nilotinib güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, genotoksisite, üreme sistemi toksisitesi, fototoksisite ve karsinojenisite (sıçan ve fare) çalışmalarında değerlendirilmiştir.
Güvenlilik farmakolojisi çalışmaları
Nilotinibin MSS ya da solunum fonksiyonları üzerinde herhangi bir etkisi olmamıştır. İn vitro kardiyak güvenlilik çalışmaları, nilotinib ile izole tavşan kalplerinde aksiyon potansiyeli süresinde uzama ve hERG dalgalarının bloke edilmesi temelinde QT uzaması için klinik öncesi bir sinyal göstermiştir. Köpeklerde özel bir telemetri çalışmasında veya 39 haftaya kadar tedavi edilen köpeklerde veya maymunlarda EKG ölçümlerinde hiçbir etki görülmemiştir.
Tekrarlı doz toksisitesi çalışmaları
4 haftalık bir süreye kadar köpeklerde ve 9 aylık bir süreye kadar sinomolog maymunlarında gerçekleştirilen tekrarlanan doz toksisite çalışmaları karaciğerin, nilotinibin toksisitesi için başlıca hedef organ olduğunu göstermiştir. Değişimler artmış alanin aminotransferaz ve alkalin fosfataz aktivitesini ve histopatoloji bulgularını (çoğunlukla sinüzoidal hücre ya da Kupffer hücresi hiperplazisi/hipertrofisi, safra kanalı hiperplazisi ve periportal fibrozit) kapsamıştır.
Genelde, klinik kimyadaki değişiklikler 4 haftalık bir iyileşme döneminden sonra tamamen düzelirken, histolojik değişiklikler yalnızca kısmi bir tersinirlik ortaya koymuştur. Karaciğer etkilerinin görüldüğü en düşük doz düzeylerindeki maruziyetlerin, insanlarda 800 mg/gün'lük bir dozdaki maruziyetten daha düşük olduğu gözlenmiştir. 26 haftaya kadar tedavi edilen farelerde ya da sıçanlarda yalnızca küçük karaciğer değişiklikleri gözlenmiştir.
Sıçan, köpek ve maymunlarda kolesterol düzeylerinde çoğunlukla geri dönüşümlü artışlar gözlenmiştir.
Genotoksisite çalışmaları
Bakteriyel in vitro sistemlerde ve in vitro ve in vivo memeli sistemlerinde metabolik aktivasyonla ve metabolik aktivasyon olmaksızın gerçekleştirilen genotoksisite çalışmaları, nilotinibin mutajenik potansiyeline ilişkin herhangi bir kanıt ortaya koymamıştır.
Karsinojenisite çalışmaları
Sıçanlar üzerinde yapılan 2 yıllık karsinojenisite çalışmasında neoplastik olmayan lezyonlar için başlıca hedef organın uterus olduğu görülmüştür (dilatasyon, vasküler ektazi, hiperplazi endotelyal hücre, enflamasyon ve/veya epitelyal hiperplazi). 5, 15 ve
40 mg/kg/gün dozlarında nilotinib uygulanmasını takiben karsinojenisite kanıtına rastlanmamıştır. En yüksek doz düzeyindeki maruziyetler (EAA cinsinden) insanlarda 800 mg/gün dozda nilotinibe günlük kararlı durum maruziyetinin (EAA'ya dayalı) yaklaşık 2 ila 3 katını temsil etmiştir.
Nilotinibin 30, 100 ve 300 mg/kg/gün dozunda uygulandığı 26 haftalık Tg.rasH2 fare karsinojenisite çalışmasında, 800 mg/kg'lık maksimum onaylı dozda (günde iki kez 400 mg olarak uygulanan) insan maruziyetinin yaklaşık 30 ila 40 katını (EAA cinsinden) temsil eden 300 mg/kg'da deri papillomu/karsinomları tespit edilmiştir. Deri neoplastik lezyonları için Etki Gözlenmeyen Düzey, 800 mg/kg'lık maksimum onaylı dozda (günde iki kez 400 mg olarak uygulanan) insan maruziyetinin yaklaşık 10 ila 20 katını temsil eden 100 mg/kg'dır. Neoplastik olmayan lezyonlar için başlıca hedef organlar deri (epidermal hiperplazi), gelişmekte olan dişler (üst kesici dişlerde enamel organın dejenerasyonu/atrofisi ve üst kesici dişlerin diş etleri odontojenik epitelyumunda enflamasyon) ve timus (lenfosit azalması insidansında ve/veya şiddetinde artış) olmuştur.
Üreme toksisitesi ve fertilite çalışmaları
Nilotinib teratojeniteyi indüklememiş, fakat maternal toksisiteye de yol açan dozlarda embriyo- ve fetotoksisiteye yol açmıştır. Hem erkeklerin hem de kadınların tedavi edildiği fertilite çalışmasında da, kadınların tedavi edildiği embriyotoksisite çalışmasında da artmış bir postimplantasyon kaybı gözlenmiştir. Embriyotoksisite çalışmalarında, sıçanlarda embriyo-letalite ve fötal etkiler (çoğunlukla azalmış fetus ağırlıkları, viseral ve iskeletsel değişimler) ve tavşanlarda ise artmış fetus rezorpsiyonu ve iskeletsel değişimler gözlenmiştir. Dişilerde Advers Etki Gözlenmeyen Düzeylerdeki nilotinib maruziyetinin genellikle, insanlarda 800 mg/gün ile elde edilenden daha düşük ya da buna eşit olduğu gözlenmiştir.
İnsanlar için önerilen dozun yaklaşık 5 katı olan test edilen en yüksek doza kadar, erkek ve dişi sıçanlarda sperm sayısı/motilitesi ya da fertilite üzerinde herhangi bir etki gözlenmemiştir.
Juvenil hayvan çalışmaları
Bir çalışmada, juvenil sıçanlara oral gavaj yoluyla doğumun ilk haftasından genç erişkinlik dönemine kadar (doğumdan sonra 70. güne kadar) 2, 6 ve 20 mg/kg/gün dozlarında nilotinib uygulanmıştır. Etkiler 20 mg/kg/gün dozunda sınırlı olmuş, vücut ağırlığı ve gıda tüketimi parametrelerinde azalmalardan oluşmuş ve dozun kesilmesinin ardından düzelmiştir. Juvenil sıçanlarda Etki Gözlenmeyen Düzey, 6 mg/kg/gün olarak kabul edilmiştir. Genelde juvenil sıçanlardaki toksisite profili erişkin sıçanlarda gözlemlenene benzerbulunmuştur.
Fototoksisite çalışmaları
Nilotinibin UV-B ve UV-A aralığında ışığı absorbe ettiği ve deriye dağılarak in vitro olarak fototoksik bir potansiyel gösterdiği ortaya konmuştur. Bununla birlikte, in vivo ortamda fototoksisite görülmemiştir. Bu nedenle, nilotinibin hastalarda fotosensitizasyona yol açma riski çok düşük kabul edilmektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Kapsül içeriği
Laktoz monohidrat 156,11 mg (inek kaynaklı) Krospovidon
Poloksamer 188
Susuz koloidal silika/Koloidal silikon dioksit Magnezyum stearat
Boş kapsül bileşimi Jelatin (sığır kaynaklı) Titanyum dioksit (E171) Demir oksit, sarı (E 172)
Baskı mürekkebi Shellac (E 904) Dehidrate alkol İzopropil alkol N-bütil alkol Propilen glikol
Amonyak çözeltisi Potasyum hidroksit Demir oksit, siyah (E172)
Demir oksit, kırmızı (E 172)
6.2. Geçimsizlikler
Yeterli veri yoktur.
6.3. Raf ömrü
36 aydır.
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altındaki oda sıcaklığında ve orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
PVC/PVDC blisterler.
28 ve 112 kapsül içeren blister ambalaj.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıklar Kontrolü Yönetmeliğiâ€'ne uygun olarak imha edilmelidir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |