TECENTRIQ 1200 mg/20 ml infüzyonluk çözelti hazırlamak için konsantre Farmakolojik Özellikler
{ Atezolizumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastikler ve immünomodülatör ajanlar, monoklonal antikorlar ve antikor ilaç konjugatları, PD-1/PDL-1 (Programlanmış Hücre Ölüm Proteini 1/ Ölüm Ligandı 1) İnhibitörleri
ATC kodu: L01FF05
Etki mekanizması:
PD-L1, tümör hücreleri ve/veya tümör infiltre eden immün hücrelerinde eksprese olabilir ve tümör mikroortamında anti-tümör immün yanıtının inhibisyonuna katkıda bulunabilir. PD- L1'in T hücrelerinde ve antijen sunan hücrelerde bulunan PD-1 ve B7.1 reseptörlerine bağlanması sitotoksik T hücresi aktivitesini, T hücresi çoğalmasını ve sitokin üretimini baskılar.
Atezolizumab Fc bölgesi değiştirilmiş, hümanize bir immünoglobülin G1 (IgG1) monoklonal bir antikorudur; doğrudan PD-L1'e bağlanır ve PD-1 ve B7.1 reseptörlerinin ikili blokajını sağlayarak, antikor bağımlı sellüler sitotoksisiteyi indüklemeden antitümör immün yanıtın yeniden aktive edilmesi de dahil, immün yanıtın PD-L1/PD-1 aracılı inhibisyonunu serbest bırakır. Atezolizumab, PD-L2/PD-1 etkileşimini koruyarak PD-L2/PD-1 aracılı inhibitör sinyallerin devam etmesine izin verir.
Klinik etkililik ve güvenlilik:
Küçük hücreli dışı akciğer kanseri:
Erken evre küçük hücreli dışı akciğer kanserinin adjuvan tedavisi
IMpower010 (GO29527): Rezeke edilmiş KHDAK'lı hastalarla sisplatin bazlı kemoterapiden sonra randomize faz III çalışma
Evre IB (tümörler ≥ 4cm) – IIIA KHDAK'lı hastaların adjuvan tedavisi için atezolizumabın etkililiğini ve güvenliliğini değerlendirmek üzere bir faz III, açık etiketli, çok merkezli, randomize çalışma olan GO29527 (IMpower010) yürütülmüştür (Kanser evrelendirme sistemine ilişkin Uluslararası Kanser Kontrolü Birliği/Amerikan Ortak Kanser Komitesi, 7. Baskısına göre).
Aşağıdaki seçim kriterleri, terapötik endikasyona dahil olan ve 7. baskı evreleme sistemine göre evre II - IIIA hasta popülasyonunu yansıtan yüksek nüks riski olan hastaları tanımlar:
Tümör boyutu ≥ 5 cm veya N1 veya N2 durumunun eşlik ettiği herhangi bir boyuttaki tümörler veya torasik yapılara invaze olan tümörler (doğrudan parietal plevra, göğüs duvarı, diyafram, frenik sinir, mediastinal plevra, parietal perikard, mediasten, kalp, büyük damarlar, trakea, rekürren laringeal sinir, özofagus, vertebral gövde, karinaya invaze) veya ana bronşu karinanın
< 2 cm distalinde tutan ancak karina tutulumu olmayan tümörler veya tüm akciğerin atelektazisi veya obstrüktif pnömonisi ile bağlantılı tümörler veya primer olarak aynı lobda veya farklı ipsilateral lobda ayrı nodül(ler)e sahip tümörler.
Çalışma, mediasten, kalp, büyük damarlar, trakea, rekürren laringeal sinir, özofagus, vertebral cisim ve karinaya invaze tümörleri olan N2 durumundaki hastaları veya farklı bir ipsilateral lobda ayrı tümör nodülleri olan hastaları içermemiştir.
Toplamda 1280 kaydedilmiş hasta tam tümör rezeksiyonu yaptırmış ve 4 sikluse kadar sisplatin bazlı kemoterapi almaya uygun olmuştur. Sisplatin bazlı kemoterapi rejimleri Tablo 3'te tarif edilmektedir.
Tablo 3: Adjuvan tedavi rejimleri (IMpower010)
Sisplatin bazlı adjuvan kemoterapi: Belirtilen tedavi rejimlerinden biri ile her 21 günlük siklusun 1.gününde IV olarak 75 mg/m sisplatin | 1. ve 8. gün intravenöz olarak 30 mg/m vinorelbin |
1. gün intravenöz olarak 75 mg/m dosetaksel | |
1. ve 8. gün intravenöz olarak 1250 mg/m gemsitabin | |
1. gün intravenöz olarak 500 mg/m pemetreksed (non-skuamöz) |
Sisplatin bazlı kemoterapinin (dört siklusa kadar) tamamlanmasından sonra toplamda 1005 hasta 1:1 oranında atezolizumab (Kol A) veya en iyi destekleyici bakımı (BSC) (Kol B) almaya randomize edilmiştir. Atezolizumab, hastalık nüksü veya kabul edilemez toksisite görülmediği sürece 16 döngüye kadar her 3 haftada bir IV infüzyonla 1200 mg'lık sabit dozda uygulanmıştır. Randomizasyon cinsiyet, hastalık evresi ve PD-L1 ekspresyonuna göre sınıflandırılmıştır.
Hastalar, otoimmün hastalık öyküsüne sahiplerse; randomizasyondan önceki 28 gün içinde canlı, attenüe aşı uygulaması yapılmışsa; randomizasyondan önceki 4 hafta içinde sistemik immunostimulatör ajanlar veya 2 hafta içinde immunosupresif ilaçlar uygulanmışsa hariç
tutulmuştur. Tümör değerlendirmeleri randomizasyon fazının başlangıcında ve 1. siklus, 1. gününün ardından ilk yıl boyunca her 4 ayda bir ve ardından beş yıla kadar her 6 ayda bir ve sonrasında yılda bir yürütülmüştür.
ITT popülasyonunun demografik bilgileri ve başlangıçtaki hastalık özellikleri tedavi kolları arasında iyi dengelenmiştir. Medyan yaş 62 olup (aralık: 26 ila 84) hastaların %67'si erkektir. Hastaların çoğu Beyaz (%73) ve %24'ü Asyalıdır. Çoğu hasta sigara içicisidir veya geçmişte içmiştir (%78) ve hastalarda başlangıç ECOG performans durumu 0 (%55) veya 1'dir (%44). Genelde hastaların %12'sinde evre IB, %47'sinde evre II ve %41'inde evre IIIA hastalık mevcuttur. Tümörleri VENTANA PD-L1 (SP263) Analizi ile ölçüldüğü üzere TC'de PD-L1 ekspresyonu ≥ %1 ve ≥ %50 olan tümörleri olan hastaların yüzdesi sırasıyla %55 ve %26 olmuştur.
Birincil etkililik sonucu ölçümü araştırmacı tarafından değerlendirilen hastalıksız sağkalımdır (HS). Hastalıksız sağkalım, randomizasyon tarihinden aşağıdakilerden birinin meydana geldiği tarihe kadar geçen süre olarak tanımlanmıştır: ilk belgelenmiş hastalık nüksü, yeni primer KHDAK veya herhangi bir nedenle ölüm (hangisi daha önce olursa). Birincil etkililik hedefi, PD-L1 ≥ %1 TC evre II IIIA hasta popülasyonunda HS'yi değerlendirmektir. Kritik ikincil etkililik hedefleri, PD-L1 ≥ %50 TC evre II-IIIA hasta popülasyonunda HS'yi ve ITT popülasyonunda genel sağkalımı (GS) değerlendirmektir.
Ara hastalıksız sağkalım analizi zamanında, çalışma birincil sonlanım noktasını sağlamıştır. Medyan takip süresi yaklaşık 32 aydır. EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan PD-L1 ≥ %50 TC evre II- IIIA hastalarının analizinde (n = 209), BSC koluna kıyasla atezolizumab kolunda HS'de klinik olarak anlamlı bir iyileşme gözlenmiştir (Tablo 4). Genel sağkalım (GS) verileri EGFR mutasyonları ve ALK yeniden düzenlemeleri olmaksızın, PD-L1
≥ %50 TC evre II- IIIA hasta popülasyonunda genel olarak bildirilen yaklaşık %16,3 oranında ölüm ile hastalıksız sağkalımda ara analizi sırasında olgunlaşmamıştır. Genel sağkalımın keşifsel analizi bu hasta popülasyonunda 0,39'luk sınıflandırılmış bir HR (%95 GA:0,18, 0,82) ile en iyi destekleyici bakıma karşı atezolizumab lehine bir eğilimi düşündürmüştür.
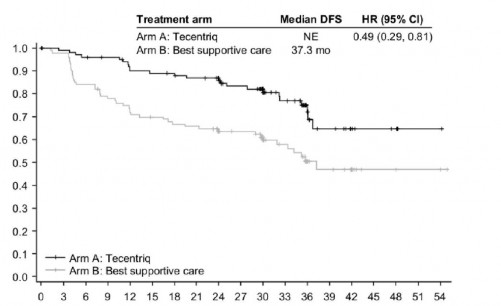
EGFR mutasyonları ve ALK yeniden düzenlemeleri olmayan PD-L1 ≥ %50 TC evre II- IIIA hasta popülasyonu için ana etkililik bulguları Tablo 4'te özetlenmektedir. Hastalıksız sağkalım için Kaplan-Meier eğrisi Şekil 1'de sunulmaktadır.
Tablo 4: EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan PD-L1 ekspresyonu ≥ %50 TC evre II- IIIA hasta popülasyonunda etkililik özeti (IMpower010)
Etkililik sonlanım noktası | A kolu (Atezolizumab) | B kolu (En iyi destekleyici tedavi) |
Araştırmacı tarafından değerlendirilen hastalıksız sağkalım (HS) |
n=106 |
n=103 |
Olayların sayısı (%) | 24 (%22,6) | 45 (%437) |
Hastalıksız sağkalımın (HS) medyan süresi (ay) | NE | 37,3 |
%95 GA | NE, NE | 30,1, NE |
Sınıflandırılmış risk oranı (%95 GA) | 0,49 (0,29,0,81) | |
3 yıllık hastalıksız | 75,1 | 50,4 |
sağkalım oranı (%)
HS=Hastalıksız sağkalım, GA=Güven Aralığı, NE=öngörülemiyor
Şekil 1: EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan PD-L1 ekspresyonu ≥ %50 TC evre II- IIIA hasta popülasyonunda (IMpower010) hastalıksız sağkalım için Kaplan-Meier eğrisi
|
Süre (ay)
![]()
NE=öngörülemiyor
En iyi destekleyici tedavi koluna kıyasla atezolizumab kolunda gözlenen hastalıksız sağkalım iyileşmesi, hem non-skuamoz KHDAK hastaları (sınıflandırılmamış risk oranı: 0,35 , %95 GA: 0,18, 0,69; medyan hastalıksız sağkalım NE'ye (NE= öngörülemiyor) karşı 35,7 ay) hem de skuamoz KHDAK hastaları (sınıflandırılmamış risk oranı: 0,60 ,%95 GA: 0,29 , 1,26; medyan hastalıksız sağkalım 36,7'ye karşı NE (NE=öngörülemiyor) ay) içeren EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan PD-L1 ≥%50 TC evre II-IIIA hasta popülasyonunda önceden belirtilmiş alt grupların çoğu arasında tutarlı şekilde gösterilmiştir.
Birinci basamak küçük hücreli dışı akciğer kanseri
IMpower130 (GO29537): Daha önce kemoterapi uygulanmamış metastatik non- skuamoz KHDAK hastalarında nab-paklitaksel ve karboplatinle kombinasyona yönelik randomize faz III çalışma.
Daha önce kemoterapi uygulanmamış metastatik non-skuamoz KHDAK hastalarında nab- paklitaksel ve karboplatinle kombinasyon halinde atezolizumabın etkililik ve güvenliliğini değerlendirmek üzere bir faz III, açık etiketli, randomize çalışma (GO29537 (IMpower130)) gerçekleştirilmiştir. EGFR mutasyonları veya ALK rearanjmanları olan hastalarda daha önce tirozin kinaz inhibitörleriyle tedavi almış olma koşulu aranmıştır.
Hastalar, Amerikan Ortak Kanser Komitesi (AJCC) 7. baskıya göre evrelendirilmiştir. Otoimmün hastalık öyküsü olan, randomizasyondan önceki 28 gün içinde canlı ve zayıflatılmış
aşı uygulanmış, randomizasyondan önceki 4 hafta içinde immünostimülatör ajan veya randomizasyondan önceki 2 hafta içinde sistemik immünosüpresif ilaç uygulanmış ve aktif veya tedavi edilmemiş MSS metastazları olan hastalar çalışmaya alınmamıştır. Daha önce CD137 agonistleri veya immün kontrol noktası blokaj tedavileri (anti-PD-1 ve anti-PD-L1 terapötik antikorları) almış hastalar çalışmaya uygun değildir. Bununla birlikte, daha önce anti- CTLA-4 tedavisi almış olan hastalar, en son dozun randomizasyondan en az 6 hafta önce alınmış olması ve anti-CTLA-4'ten kaynaklanan şiddetli immün ilişkili advers etki öyküsü (NCI 3 ve 4. Derece) olmaması koşuluyla çalışmaya alınmıştır. Tümör değerlendirmeleri, 1. Siklustan sonra ilk 48 hafta boyunca 6 haftada bir ve daha sonra 9 haftada bir yapılmıştır. Tümör numuneleri, tümör hücreleri (TC) ve tümörü infiltre eden immün hücreler (IC) üzerindeki PD-L1 ekspresyonu bakımından değerlendirilmiştir ve bulgular, aşağıda açıklanan analizler için PD-L1 ekspresyonu alt gruplarının tanımlanmasında kullanılmıştır.
EGFR mutasyonları veya ALK rearanjmanları olanlar dahil olmak üzere hastalar, Tablo 5'te açıklanan tedavi rejimlerinden biri uygulanmak üzere çalışmaya alınmış ve 2:1 oranında randomize edilmiştir. Randomizasyon grupları; cinsiyet, karaciğer metastazları varlığı ve TC ve IC üzerindeki PD-L1 ekspresyonuna göre oluşturulmuştur. Tedavi rejimi B alan hastaların hastalık progresyonundan sonra çapraz geçiş yaparak atezolizumab monoterapisi almasına izin verilmiştir.
Tablo 5: İntravenöz tedavi rejimleri (IMpower130)
Tedavi Rejimi | İndüksiyon (Dört veya altı kez 21 günlük sikluslar) | İdame (21 günlük sikluslar) |
A | Atezolizumab (1200 mg) + nab-paklitaksel (100 mg/m) + karboplatin (EAA 6) | Atezolizumab (1200 mg) |
B | Nab-paklitaksel (100 mg/m) + karboplatin (EAA 6) | En iyi destekleyici tedavi veya pemetrexed |
ITT-WT olarak tanımlanan çalışma popülasyonunun (n=679) demografik özellikleri ve başlangıçtaki hastalık özelliklerinin tedavi kolları arasında dengeli olduğu görülmüştür. Medyan yaş 64'tür (aralık: 18-86 yaş). Hastaların çoğu erkek (%59) ve beyazdır (%90). Hastaların %14,7'sinde başlangıçta karaciğer metastazı olduğu ve çoğu hastanın (%90) sigara kullanmakta olduğu veya geçmişte kullandığı görülmüştür. Hastaların çoğunun başlangıç ECOG performans durumunun 1 olduğu (%59) ve <%1 oranında PD-L1 ekspresyonu sergilediği (yaklaşık %52) görülmüştür. İndüksiyon tedavisinin ardından yanıt durumu stabil hastalık, kısmi yanıt veya tam yanıt olan 107 Kol B hastası arasında 40 hasta pemetrexed geçiş idame tedavisi almıştır.
Primer analiz, EGFR mutasyonları veya ALK rearanjmanları olanlar hariç olmak üzere, ITT- WT olarak tanımlanan bütün hastalarda (n=679) gerçekleştirilmiştir. Hastalarda medyan sağkalım takip süresi 18,6 ay olup, hastalar kontrole kıyasla atezolizumab, nab-paklitaksel ve
karboplatinle OS ve PFS'de iyileşme göstermiştir. Temel bulgular, Tablo 6'da özetlenmiştir ve OS ve PFS'ye ait Kaplan-Meier eğrileri sırasıyla Şekil 2 ve 4'te sunulmuştur. PD-L1 ekspresyonuna göre OS ve PFS için elde edilen keşifsel bulgular, sırasıyla Şekil 3 ve 5'te özetlenmiştir. Karaciğer metastazları olan hastalar, nab-paklitaksel ve karboplatine kıyasla atezolizumab, nab-paklitaksel ve karboplatinle PFS veya OS'de iyileşme göstermemiştir (sırasıyla PFS için 0,93 HR, %95 CI: 0,59, 1,47 ve OS için 1,04 HR, %95 CI: 0,63, 1,72).
Atezolizumab, nab-paklitaksel ve karboplatin kolundaki hastaların %7,3'üne karşılık nab- paklitaksel ve karboplatin kolundaki hastaların %59'u hastalık progresyonunun ardından çapraz geçiş tedavisi olarak atezolizumab (bütün hastaların %41'i) dahil olmak üzere herhangi bir kanser immünoterapisi almıştır.
Daha uzun takip süresine (medyan: 24,1 ay) sahip bir keşifsel analizde, her iki koldaki medyan OS birincil analize göre değişmemiş olup, HR=0,82'dir (%95 CI: 0,67, 1,01).
Tablo 6: Primer analizde IMpower130'da kanıtlanan etkililiğin özeti (ITT-WT popülasyon)
Etkililik sonlanım noktaları Kol A Atezolizumab + nab-paklitaksel + karboplatin | Kol B Nab- paklitaksel + karboplatin |
Ortak-birincil sonlanım noktaları | |
OS n=451 n=228 Ölüm sayısı (%) 226 (%50,1) 131 (%57,5) Olaylara kadar geçen medyan süre (ay) 18,6 13,9 %95 GA (16, 21,2) (12, 18,7) Gruplandırılmış risk oranı (%95 GA) 0,79 (0,64, 0,98) p-değeri 0,033 12 aylık OS (%) 63 56 | |
Araştırmacı tarafından değerlendirilen PFS (RECIST v1.1) n=451 n=228 Olay sayısı (%) 347 (%76,9) 198 (%86,8) Medyan PFS süresi (ay) 7 5,5 %95 GA (6,2, 7,3) (4,4, 5,9) Gruplandırılmış risk oranı (95% GA) 0,64 (0,54, 0,77) p-değeri < 0,0001 12 aylık PFS (%) %29 %14 | |
Diğer sonlanım noktaları |
Araştırmacı tarafından değerlendirilen ORR (RECIST v1.1)^ n=447 n=226 Doğrulanmış yanıt veren sayısı (%) 220 (%49,2) 72 (%31,9) %95 GA (44,5, 54) (25,8, 38,4) Tam yanıt sayısı (%) 11 (%2,5) 3 (%1,3) Kısmi yanıt sayısı (%) 209 (%46,8) 69 (%30,5) |
Araştırmacı tarafından değerlendirilen doğrulanmış DOR (RECIST 1.1)^ n=220 n=72 Medyan (ay olarak) 8,4 6,1 %95 GA (6,9, 11,8) (5,5, 7,9) |
^ Doğrulanmış ORR ve DoR, keşifsel sonlanım noktalarıdır
PFS=progresyonsuz sağkalım; RECIST=Solid Tümörlerde Yanıt Değerlendirme Kriterleri v1.1.; GA=güven aralığı; ORR=objektif yanıt oranı; DOR=yanıt süresi; OS=Genel sağkalım
Ban-pac
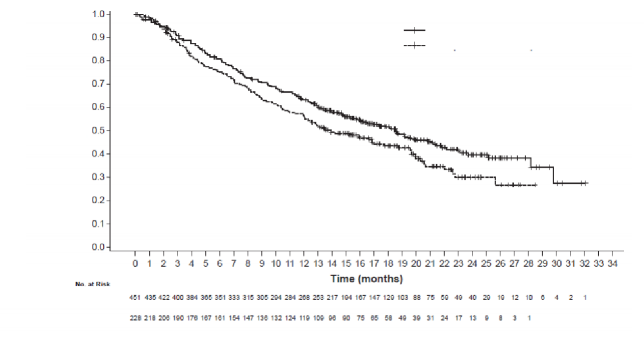
Şekil 2: Genel sağkalıma ait Kaplan-Meier eğrileri (IMpower130)
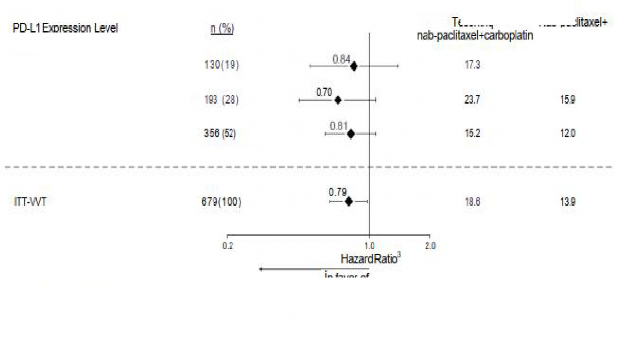
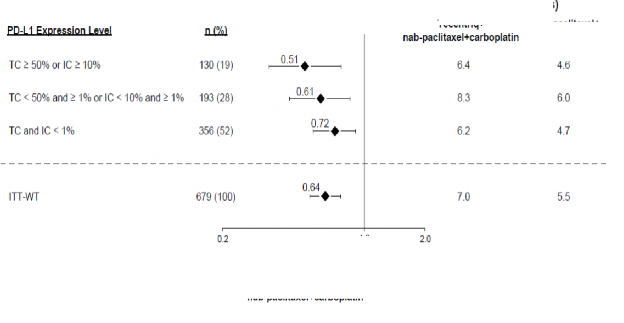
TC > %50 veya IC > %10
TC < %50 ve > %1 veya IC
<%10 ve ≥ %1
TC ve IC < %1
Şekil 3: PD-L1 ekspresyonuna göre genel sağkalımı gösteren meta analiz diyagramı (IMpower130)
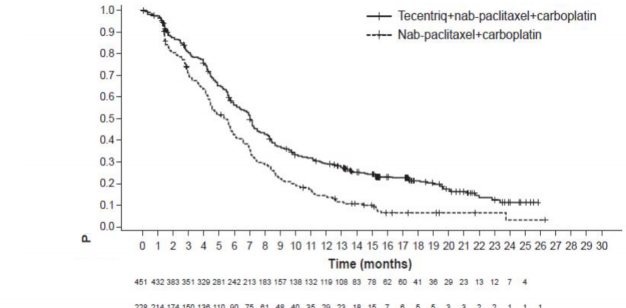
Şekil 4: Progresyonsuz sağkalıma ait Kaplan-Meier eğrileri (IMpower130)
TC≥ %50 veya IC ≥ %10
TC < %50 ve ≥ %1 veya IC
<%10 ve ≥ %1
TC ve IC < %1
Şekil 5: PD-L1 ekspresyonuna göre progresyonsuz sağkalımı gösteren meta analiz diyagramı (IMpower130)
IMpower110 (GO29431): Kemoterapi tedavisi almamış metastatik KHDAK hastalarında yapılan randomize Faz III çalışma
Kemoterapi kullanmamış, metastatik KHDAK hastalarında atezolizumabın etkililiğini ve güvenliliğini değerlendirmek için Faz III, açık etiketli, çok merkezli, randomize bir çalışma olan IMpower110 yürütülmüştür. Hastalardaki PD-L1 ekspresyonu ≥%1 TC (PD-L1 tümör hücrelerinin ≥%1'i boyanmıştır) veya ≥%1 IC (tümör bölgesinin ≥%1'ini kapsayan tümör- infiltre edici immün hücreleri PD-L1 boyanmıştır) VENTANA PD-L1 (SP142) Testine dayanmaktadır.
Toplamda 572 hasta randomize edilmiş ve 1:1 oranında atezolizumab (A kolu) veya kemoterapi (B kolu) verilmiştir. Atezolizumab, araştırmacı tarafından değerlendirildiği şekilde klinik fayda kaybına veya kabul edilmeyen toksisiteye kadar üç haftada bir intravenöz yolla 1200 mg sabit dozla verilmiştir. Kemoterapi rejimleri Tablo 7'de gösterilmektedir. Randomizasyon cinsiyet, ECOG performans statüsü, histoloji ve TC ile IC'de PD-L1 tümör ekspresyonu ile katmanlaştırılmıştır.
Tablo 7: Kemoterapi intravenöz tedavi rejimleri (IMpower110)
Tedavi rejimi | İndüksiyon (Dört veya altı 21 günlük sikluslar) | İdame (21 günlük sikluslar) |
B (Skuamoz olmayan) | Sisplatin (75 mg/m) + pemetreksed (500 mg/m) veya karboplatin (EAA 6) + pemetreksed (500 mg/m) | Pemetreksed (500 mg/m) |
B (Skuamoz) | Sisplatin (75 mg/m) + gemsitabin (1250 mg/m) veya karboplatin (EAA 5) + | En iyi destekleyici bakım |

gemsitabin (1000 mg/m)
Otoimmün hastalık, randomizasyondan önceki 28 gün içinde canlı, zayıflatılmış aşı uygulaması, 4 hafta içinde sistemik immün sistemi uyarıcı ajanların uygulanması veya randomizasyondan önceki 2 hafta içinde sistemik immün sistemi baskılayıcı ilaçlar öyküsü, aktif veya tedavi edilmemiş merkezi sinir sistemi metastazları olan hastalar çalışma dışı bırakılmıştır. Tümör değerlendirmeleri, 1. siklus, 1.gün ve bunu takip eden ilk 48 hafta boyunca 6 haftada bir ve daha sonra her 9 haftada bir yürütülmüştür.
EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan (n=554) PD-L1 ekspresyonu
≥ %1 TC veya ≥ %1 IC olan hastalarda demografik ve çalışma başlangıcı hastalık özellikleri tedavi kolları arasında iyi dengelenmiştir. Medyan yaş 64,5 (dağılım: 30 ila 87) olup hastaların %70'i erkektir. Hastaların çoğunluğu beyaz (%84) ve Asyalıdır (%14). Hastaların çoğu halen sigara kullanmaktadır veya öncesinde kullanmıştır (%87) ve hastalarda başlangıç ECOG performans durumu 0 (%36) veya 1'dir (%64).
Genel olarak, hastaların %69'unda skuamoz olmayan hastalık ve hastaların %31'inde skuamoz hastalık vardır. EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan (n=205) yüksek PD-L1 ekspresyonu olan (PD-L1 ≥ %50 TC veya ≥ %10 IC) hastalarda demografik ve çalışma başlangıcı hastalık özellikleri genellikle daha geniş çalışma popülasyonunu temsil etmiş ve tedavi kolları arasında dengeli olmuştur.
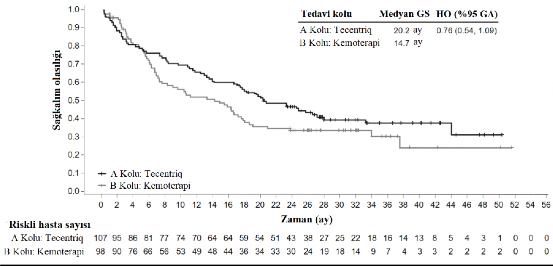
Birincil sonlanım noktası, genel sağkalım (GS) olmuştur. Geçici genel sağkalım analizi sırasında, EGFR mutasyonları veya ALK yeniden düzenlemeleri olanlar (n=205) hariç olmak üzere yüksek PD-L1 ekspresyonu olan hastalar, kemoterapiye kıyasla atezolizumaba (Kol A) randomize edilen hastalar için genel sağkalımda istatistiksel olarak anlamlı iyileşme göstermiş (B kolu) (risk oranı 0,59, %95 GA: 0,4, 0,89; medyan genel sağkalım 20,2 aya karşı 13,1 ay) olup iki taraflı p değeri 0,0106 bulunmuştur. Yüksek PD-L1 ekspresyonu olan hastalarda ortanca sağkalım takip süresi 15,7 ay olmuştur.
Bu hastalarda daha uzun bir takip süresi (medyan: 31,3 ay) içeren bir keşifsel genel sağkalım analizinde atezolizumab kolu için medyan genel sağkalım, birincil genel sağkalım ara analizine göre (20,2 ay) değişmemiş ve kemoterapi kolu için 14,7 olmuştur (risk oranı 0,76, %95 GA: 0,54, 1,09). Keşifsel analizdeki anahtar sonuçlar Tablo 8'de özetlenmiştir. Yüksek PD-L1 ekspresyonu olan hastalarda genel sağkalım ve progresyonsuz sağkalım için Kaplan-Meier eğrileri Şekil 6 ve 7'de sunulmaktadır. Atezolizumab kolunda (16/107, %15) kemoterapi koluna kıyasla (10/98, %10,2) hastaların daha yüksek bir oranı ilk 2,5 ay içinde ölüm yaşamıştır. Erken ölümlerle ilişkili herhangi bir spesifik faktör/faktörler tanımlanamamıştır.
Tablo 8: Yüksek PD-L1 ekspresyonu ≥%50 TC veya ≥%10 IC olan hastalarda etkililik özeti (IMpower110)
Etkililik sonlanım noktaları | A Kolu (Atezolizumab) | B Kolu (Kemoterapi) |
Birincil sonlanım noktası | ||
Genel sağkalım | n=107 | n=98 |
Ölüm sayısı (%) | 64 (%59,8) | 64 (%65,3) |
Olaylara kadar geçen medyan süre (ay) | 20,2 | 14,7 |
%95 GA | (17,2, 27,9) | (7,4, 17,7) |
Sınıflandırılmış risk oranı (%95 GA) | 0,76 (0,54, 1,09) | |
12 aylık genel sağkalım (%) | 66,1 | 52,3 |
İkincil sonlanım noktaları | ||
Araştırmacı tarafından değerlendirilen PS (RECIST v1.1) | n=107 | n=98 |
Olay sayısı (%) | 82 (%76,6) | 87 (%88,8) |
Medyan PS süresi (ay) | 8,2 | 5 |
%95 GA | (6,8, 11,4) | (4,2, 5,7) |
Sınıflandırılmış risk oranı (%95 GA) | 0,59 (0,43, 0,81) | |
12 aylık progresyonsuz sağkalım (%) | 39,2 | 19,2 |
Araştırmacı tarafından değerlendirilen OYO (RECIST v1.1)^ | n=107 | n=98 |
Yanıt verenlerin sayısı (%) | 43 (%40,2) | 28 (%28,6) |
%95 GA | (30,8, 50,1) | (19,9, 38,6) |
Tam yanıt sayısı (%) | 1 (%0,9) | 2 (%2) |
Kısmi yanıt sayısı (%) | 42 (%39,3) | 26 (%26,5) |
Araştırmacı Tarafından Değerlendirilen YS (RECIST v1.1)^ | n=43 | n=28 |
Medyan (ay) | 38,9 | 8,3 |
%95 GA | (16,1, TE) | (5,6, 11) |
Şekil 6: Yüksek PD-L1 ekspresyonu ≥%50 TC veya ≥%10 IC olan hastalarda genel sağkalım için Kaplan-Meier eğrisi (IMpower110)
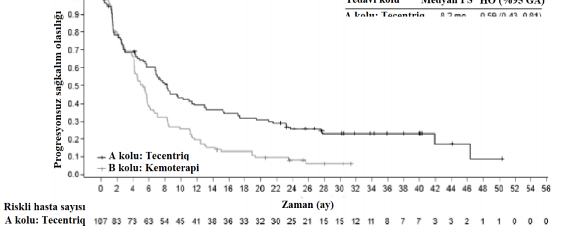
A kolu: Tecentriq 8.2 ay 0.59 (0.43 , 0.81)
B kolu: Kemoterapi 5 ay
Şekil 7: Yüksek PD-L1 ekspresyonu ≥%50 TC veya ≥%10 IC olan hastalarda progresyonsuz sağkalım için Kaplan-Meier eğrisi (IMpower110)
Kemoterapi koluna kıyasla atezolizumab kolunda gözlemlenen genel sağkalım iyileşmesi, hem skuamoz olmayan küçük hücreli dışı akciğer kanseri hastaları HR 0,62, %95 GA: 0,4, 0,96; medyan genel sağkalım 20,2'ye karşı 10,5 ay) hem de skuamoz küçük hücreli dışı akciğer kanseri hastalarını (HR 0,56, %95 GA: 0,23, 1,37; 15,3 aya karşı medyan genel sağkalıma ulaşılamaması) içeren alt gruplarda tutarlı bir şekilde gösterilmiştir. 75 yaş ve üzeri hastalara ve hiç sigara içmemiş hastalara ilişkin veriler, bu alt gruplarda sonuç çıkarmak için çok sınırlıdır.
İkinci basamak küçük hücreli dışı akciğer kanseri
OAK (GO28915): kemoterapi tedavisi almış lokal ileri veya metastatik KHDAK hastalarında yapılan randomize Faz III çalışma
Platin içeren bir rejim uygulanırken veya sonrasında progresyon görülmüş, lokal ileri veya metastatik KHDAK olan hastalarda, atezolizumab ile dosetakselin etkililik ve güvenlilik
karşılaştırılmasının yapıldığı Faz III, açık etiketli, çok merkezli, uluslararası, randomize bir çalışma olan GO28915 (OAK) yürütülmüştür. Bu çalışma, otoimmün hastalık öyküsü olan, aktif veya kortikosteroid-bağımlı beyin metastazı öyküsü olan, başlangıçtan önceki 28 gün içinde canlı, attenüe aşı olmuş, başlangıçtan önceki 4 hafta içinde sistemik immunostimulatör ajan uygulanmış veya başlangıçtan önceki 2 hafta içinde sistemik immunosupresif tıbbi ürün kullanmış hastalar çalışmaya alınmamıştır. Tümör değerlendirmeleri ilk 36 hafta boyunca her 6 haftada bir ve sonra her 9 haftada bir gerçekleştirilmiştir. Tümör örnekleri, tümör hücrelerinde (TC) ve tümör sızdıran bağışıklık hücrelerinde (IC) PD-L1 ifadesi için prospektif olarak değerlendirilmiştir.
Toplamda 1225 hasta kayıt edilmiştir ve analiz planına göre randomize edilen ilk 850 hasta primer etki analizine dahil edilmiştir. Randomizasyon PD-L1 IC ekspresyon durumu, önceki kemoterapi rejimlerinin sayısı ve histolojiye göre tabakalandırılmıştır. Hastalar 1:1 oranında atezolizumab veya dosetaksel almak üzere randomize edilmiştir.
Atezolizumab üç haftada bir intravenöz infüzyon yoluyla 1200 mg sabit dozda uygulanmıştır. Doz azaltımına izin verilmemiştir. Hastalar, araştırmacı tarafından değerlendirilecek klinik fayda kaybına kadar tedavi edilmiştir. Dosetaksel, progresyona kadar her üç haftalık siklusun
1. gününde intravenöz infüzyon yoluyla 75 mg/m uygulanmıştır. Tedavi edilen tüm hastalar için, medyan tedavi süresi dosetaksel kolu için 2,1 ay ve atezolizumab kolu için 3,4 aydır.
Primer analiz hasta popülasyonunun demografik ve başlangıç özellikleri tedavi kolları arasında genel olarak iyi değerlendirilmiştir. Medyan yaş 64 yaştır (aralık: 33-85) ve hastaların %61'i erkektir. Hastaların çoğu beyaz ırktandır (%70). Hastaların yaklaşık olarak üçte birinde non- skuamoz hastalık vardır (%74). %10'unda EGFR mutasyonu, %0,2'sinde ALK yeniden düzenlenmesi ve %10'unda başlangıçta santral sinir sistemi metastazları vardır. Hastaların çoğu halen veya önceden tütün kullanıcısıdır (%82). Başlangıçta ECOG performans skoru 0 (%37) veya 1'dir (%63). Hastaların %75'i önceden yalnızca bir platin bazlı tedavi rejimi almıştır.
Birincil etkililik sonlanım noktası, randomizasyon tarihinden herhangi bir nedenle ölüme kadar geçen süre olarak tanımlanan GS'dir (genel sağkalım). 21 aylık medyan sağkalım takip süresini içeren bu çalışmanın anahtar sonuçları Tablo 9'da özetlenmiştir. ITT popülasyonu (tedavi amaçlı) için Kaplan-Meier eğrileri Şekil 8'de sunulmuştur. Şekil 9, ITT ve PD-L1 alt gruplarındaki GS sonuçlarını özetlemekte olup , TC ve IC'de % 1'in altında PD-L1 ekspresyonu olanları da içeren tüm alt gruplarda atezolizumab ile GS faydasını göstermektedir.
Tablo 9: OAK çalışmasından primer analiz popülasyonunda etkililik çalışması (tüm gelenler)*
Etkililik sonlanım noktası | Atezolizumab (n=425) | Dosetaksel (n=425) |
Birincil Etkililik Sonlanım Noktası |
|
|
GS |
|
|
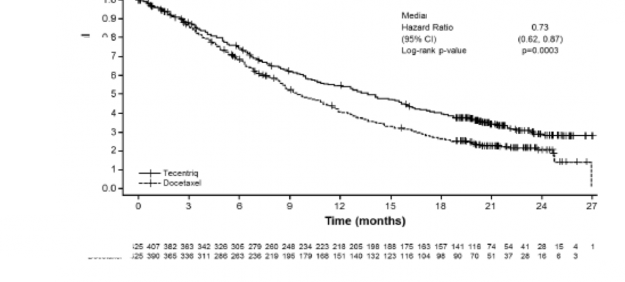
Ölüm sayısı (%) | 271 (%64) | 298 (%70) |
Olaylara kadar geçen medyan süre (ay) | 13,8 | 9,6 |
%95 GA | (11,8; 15,7) | (8,6; 11,2) |
Sınıflandırımış risk oranı (%95 GA) | 0,73 (0,62; 0,87) | |
p değeri** | 0,0003 |
|
Etkililik sonlanım noktası | Atezolizumab (n=425) | Dosetaksel (n=425) |
12 aylık GS*** | 218 (%55) | 151 (%41) |
18 aylık GS*** | 157 (%40) | 98 (%27) |
İkincil Etkililik Sonlanım Noktaları |
|
|
Araştırmacı tarafından değerlendirilen PS (RECIST v1.1) | ||
Olay sayısı (%) | 380 (%89) | 375 (%88) |
Medyan PS süresi (ay) | 2,8 | 4 |
%95 GA | (2,6; 3) | (3,3; 4,2) |
Sınıflandırılmış risk oranı (%95 GA) | 0,95 (0,82; 1,1) | |
Araştırmacı Tarafından Değerlendirilen OYO (RECIST v1.1) | ||
Yanıt verenlerin sayısı (%) | 58 (%14) | 57 (%13) |
%95 GA | (10,5; 17,3) | (10,3;17) |
Araştırmacı Tarafından Değerlendirilen YS (RECIST v1.1) | ||
| n=58 | n=57 |
Medyan (ay) | 16,3 | 6,2 |
%95 GA | (10; TE) | (4,9; 7,6) |
GA=güven aralığı; YS=yanıt süresi; TE=Tahmin edilemiyor; OYO=objektif yanıt oranı; GS=genel sağkalım; PS=progresyonsuz sağkalım; RECIST-STCDK=Solid Tümörlerde Cevap Değerlendirme Kriterleri v1.1.
*Primer analiz popülasyonu randomize edilen ilk 850 hastayı içerir
†IC düzeyleri, tümör sızdıran bağışıklık hücrelerindeki PD-L1 ekspresyonuna, önceki kemoterapi rejimi sayısı ve histolojiye göre sınıflandırılmıştır.
** sınıflandırılmış log-sıra sıralamasına göre
*** Kaplan-Meier hesaplamalarına göre
Zaman (ay)
Sağkalım olasılığı
Şekil 8: Primer analiz popülasyonunda genel sağkalım için Kaplan-Meier eğrisi (tüm gelenler) (OAK)
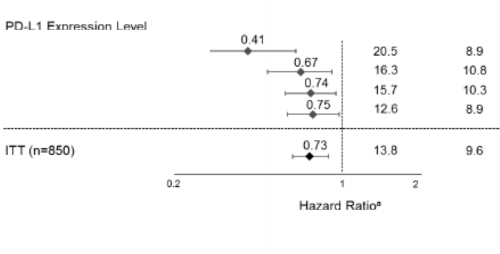
Şekil 9: Primer analiz popülasyonunda PD-L1 ekspresyonuna göre genel sağkalım meta- analiz diyagramı (OAK)
PD-L1 Ekspresyon Seviyesi
TC≥ %50 veya IC ≥ %10 (n=137) TC veya IC ≥ %5 (n=265)
TC veya IC ≥ %1 (n=463) TC ve IC < %1 (n=379)
Medyan GS (ay) TECENTRIQ Dosetaksel
TECENTRIQ
lehine
TC ve IC ≥ % 1için sınıflandırılmış HR. Diğer açıklayıcı altgruplar içi sınıflandırılmamış HR
TC: Tümör hücreleri; IC: İmmün hücreleri; HR: Risk oranı
Hem non-skuamoz KHDAK hastalarında (atezolizumab and dosetaksel için sırasıyla; risk oranı [HR]: 0,73, 95% GA: 0,6, 0,89; medyan GS< 15,6'ya karşı 11,2 ay) hem de skuamoz KHDAK
hastalarında (atezolizumab and dosetaksel için sırasıyla HR: 0,73, 95% GA: 0,54, 0,98; medyan GS: 8,9 vs. 7,7 ay) dosetaksel ile karşılaştırılan GS değerlerinde gelişme görülmüştür. Gözlemlenen GS gelişimi, başlangıçta beyin metastazı olanlar (atezolizumab and dosetaksel için sırasıyla; risk oranı [HR]: 0,54, 95% GA: 0,31, 0,94; medyan GS< 20,1 vs. 11,9 ay) ve hiç tütün tüketmemiş olanlar (atezolizumab and dosetaksel için sırasıyla; risk oranı [HR]: 0,71, 95% GA: 0,47, 1,08; medyan GS< 16,3 vs. 12,6 ay) dahil olmak üzere altgruplar arasında tutarlı bir biçimde gösterilmiştir. Bununla birlikte, EGFR mutasyonlu hastalar dosetaksele karşılık atezolizumab kullanımında gelişmiş GS göstermemişlerdir (atezolizumab ve dosetaksel için sırasıyla; risk oranı [HR]: 1,24, 95% GA: 0,71, 2,18; medyan GS< 10,5 ‘e karşı 16,2 ay).
EORTC QLQ-LC13 ile ölçüldüğünde, hasta bildirimli göğüs ağrısındaki kötüleşmeye kadar zamanın, dosetaksele karşılık atezolizumab için (HR: 0,71, 95% GA: 0,49, 1,05; iki kolda da medyana ulaşılmamıştır) uzadığı görülmüştür. EORTC QLQ-LC13 ile ölçülen diğer akciğer kanseri semptomları (örn. öksürük, dispne ve kol/omuz ağrısı) için kötüleşme süreleri atezolizumab ve dosetaksel için benzerdir. Bu sonuçlar çalışmanın açık etiketli dizaynına dayanarak dikkatle yorumlanmıştır.
POPLAR (GO28753): kemoterapi tedavisi almış lokal ileri veya metastatik KHDAK hastalarında yapılan randomize Faz II çalışma
PD-L1 ekspresyonundan bağımsız olarak platin içeren rejim uygulanırken ya da sonrasında progresyon görülmüş, lokal ileri veya metastatik KHDAK olan hastalarda Faz II, çok merkezli, uluslararası, randomize, açık etiketli, kontrollü bir çalışma olan GO28753 (POPLAR) çalışması da yürütülmüştür. Birincil etkililik sonlanım noktası, genel sağkalımdır. Toplam 287 hasta 1:1 oranında TECENTRIQ (klinik fayda kaybına kadar üç haftada bir intravenöz infüzyon yoluyla 1200 mg) ya da dosetaksel (progresyona kadar her üç haftalık siklusun 1. (birinci) gününde intravenöz infüzyon yoluyla 75 mg/m) almak üzere randomize edilmiştir. Randomizasyon, PD-L1 IC ekspresyon durumu, önceki kemoterapi rejimlerinin sayısı ve histolojiye göre
tabakalandırılmıştır.
Gözlemlenen toplam 200 ölüm ve 22 aylık medyan sağkalım takibi ile güncelleştirilmiş analiz; dosetaksel ile tedavi edilen hastalarda medyan sağkalım 9,7 ay ve atezolizumab ile tedavi edilen hastalarda medyan sağkalım 12,6 ay (HR: 0,69% 95 GA: 0,52, 0,92) olarak göstermiştir. Atezolizumab ve dosetaksel için Objektif Yanıt Oranı (OYO) sırasıyla %15,3'e karşı %14,7, medyan Yanıt Süresi (YS) ise 18,6 ay ve 7,2 aydır.
Küçük hücreli akciğer kanseri:
IMpower133 (GO30081): kemoterapi tedavisi almamış yaygın evre KHAK hastalarında karboplatin ve etoposidle kombinasyon halinde yapılan randomize Faz I/III çalışma
Kemoterapi kullanmamış, yaygın evre KHAK hastalarında atezolizumabın karboplatin ve etoposid ile kombinasyon halinde kullanıldığında etkililiğini ve güvenliliğini değerlendirmek için Faz I/III, randomize, çok merkezli, çift-kör, plasebo kontrollü bir çalışma olan IMpower133 yürütülmüştür.
Aktif veya tedavi edilmemiş beyin metastazı olan, otoimmün hastalık öyküsü olan, randomizasyondan önceki 4 hafta içinde canlı, attenüe aşı olmuş, randomizasyondan önceki 1 (bir) hafta içinde sistemik immunostimulatör ajan uygulanmış hastalar çalışmaya alınmamıştır.
Tümör değerlendirmeleri 1. (birinci) siklusun 1. (birinci) gününü takiben ilk 48 hafta boyunca her 6 haftada bir ve sonra her 9 haftada bir gerçekleştirilmiştir. Hastalık progresyonundan sonra tedavi edilen hastaların tümör değerlendirmeleri kullanımın bırakılmasına kadar her 6 haftada bir gerçekleştirilmiştir.
Toplamda 403 hasta kayıt edilmiştir ve 1:1 oranında Tablo 10'daki tedavi rejimlerinden birini almak üzere randomize edilmiştir. Randomizasyon cinsiyet, ECOG performans skoru ve beyin metastaz varlığına göre sınıflandırılmıştır.
Tablo 10: Intravenöz tedavi rejimi (IMpower133)
Tedavi rejimi | İndüksiyon (21-günlük 4 siklus) | İdame (21-günlük siklus) |
A | atezolizumab (1200 mg) + karboplatin (EAA 5) ve etoposid (100 mg/m) | atezolizumab (1200 mg) |
B | plasebo + karboplatin (EAA 5) ve etoposid (100 mg/m) | plasebo |
Hasta popülasyonunun demografik ve başlangıç özellikleri tedavi kolları arasında genel olarak benzer değerlendirilmiştir. Hastaların %10'u 75 yaş ve üzeri olmakla beraber medyan yaş 64 yıldır (aralık: 26-90 yaş). Hastaların çoğunluğu erkektir (%65), beyaz ırktandır (%80), %9'unda beyin metastazı vardır ve çoğu halen veya önceden tütün kullanıcısıdır (%97). Başlangıçta
ECOG performans skoru 0 (%35) veya 1(bir)'dir (%65).
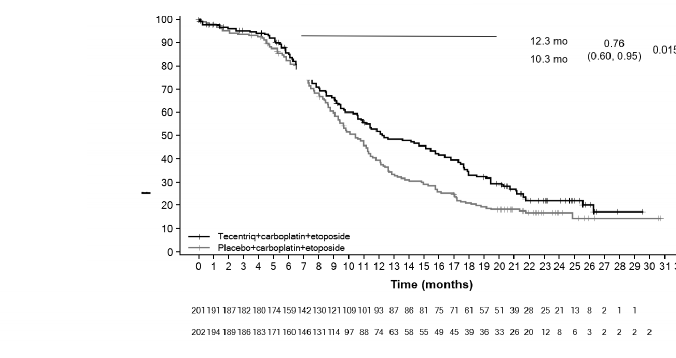
Primer analizde, hastaların medyan sağkalım takip süresi 13,9 aydır. Kontrol koluna kıyasla atezolizumab ile karboplatin ve etoposid kombinasyonu ile genel sağkalımda istatistiksel olarak anlamlı bir gelişme gözlendi (risk oranı (HR) 0,7 %95 GA: 0,54, 0,91; ortalama genel sağkalım : 12,3 aya 10,3 ay). Uzun dönem takipli araştırma genel sağkalım analizinde (ortalama: 22,9 ay), her iki koldaki ortalama genel sağkalım, başlangıç genel sağkalım ara analizine göre değişmemiştir. Araştırma analizi yanında başlangıç analiziden elde edilen Progresyonsuz Sağkalım (PS), Objektif Yanıt Oranı (OYO)ve Yanıt Süresi (YS) sonuçları Tablo 11'de özetlenmiştir. Genel sağkalım ve progresyonsuz sağkalım sonuçlarını gösteren Kaplan-Meier eğrileri Şekil 10'da ve 11'de sunulmuştur. Beyin metastazı olan hastalar için veriler bu popülasyonla ilgili sonuç çıkarmak için çok sınırlıdır.
Tablo 11: Etkililik özeti (IMpower133)
Etkililik sonlanım noktası | A kolu (atezolizumab + karboplatin + etoposid) | B kolu (plasebo + karboplatin + etoposid) |
Eş Sonlanım Noktaları | ||
GS analizi | n=201 | n=202 |
Ölüm sayısı (%) | 142 (%70,6) | 160 (%79,2) |
Olaylara kadar geçen medyan süre (ay) | 12,3 | 10,3 |
%95 GA | (10,8; 15,8) | (9,3; 11,3) |
Tabakalandırılmış risk oranı (%95 GA) | 0,76 (0,6; 0,95) | |
p değeri |
0,0154*** | |
12 aylık GS (%) | 51,9 | 39 |
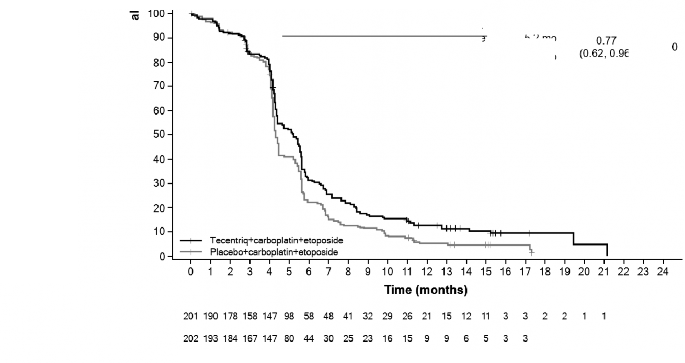
Araştırmacı tarafından değerlendirilen PS (RECIST-STCDK v1.1)** ^ | n=201 | n=202 |
Olay sayısı (%) | 171 (%85,1) | 189 (%93,6) |
Medyan PS süresi (ay) | 5,2 | 4,3 |
%95 GA | (4,4; 5,6) | (4,2; 4,5) |
Sınıflandırılmış risk oranı (%95 GA) | 0,77 (0,62; 0,96) | |
p değeri | 0,017 |
|
6 aylık PS (%) | 30,9 | 22,4 |
12 aylık PS (%) | 12,6 | 5,4 |
Diğer sonlanım noktaları | ||
Araştırmacı Tarafından Değerlendirilen OYO (RECIST-STCDK v1.1)** ^ | n=201 | n=202 |
Yanıt verenlerin sayısı (%) | 121 (%60,2) | 130 (%64,4) |
%95 GA | (53,1; 67) | (57,3; 71) |
Tam yanıt sayısı (%) | 5 (%2,5) | 2 (%1) |
Parsiyel yanıt sayısı (%) | 116 (%57,7) | 128 (%63,4) |
Araştırmacı Tarafından Değerlendirilen YS (RECIST-STCDK v1.1)** ^ | n=121 | n=130 |
Etkililik sonlanım noktası | A kolu (atezolizumab + karboplatin + etoposid) | B kolu (plasebo + karboplatin + etoposid) |
Medyan (ay) | 4,2 | 3,9 |
%95 GA | (4,1; 4,5) | (3,1; 4,2) |
PS=progresyonsuz sağkalım; RECIST-STCDK=Solid Tümörlerde Cevap Değerlendirme Kriterleri v1.1.; GA=güven aralığı; OYO=objektif yanıt oranı; YS=objektif yanıt süresi;
GS=genel sağkalım
* Araştırma GS final analizi klinik kesim tarihi 21 Ocak 2019
**PS, OYO ve YS analizi klinik kesim tarihi 24 Nisan 2018
*** Sadece tanımlayıcı amaçlar için
^ Onaylanan OYO ve YS araştırma sonlanım noktasıdır
Tedavi kolu
Medyan GS HR (%95 GA) p-değeri
Genel sağkalım (%)
Şekil 10: Genel sağkalım için Kaplan-Meier eğrisi (IMpower133)
Progresyonsuz sağkalım (%)
Şekil 11: Progresyonsuz sağkalım için Kaplan-Meier eğrisi (IMpower133)
Ürotelyal Kanser:
IMvigor211 (GO29294): Daha önce kemoterapi ile tedavi edilmiş lokal ileri veya metastatik evre ürotelyal kanserli hastalar üzerinde yapılan randomize çalışma
Platin içeren bir rejim sırasında veya sonrasında hastalık ilerlemesi görülen lokal ileri veya metastatik evre ürotelyal kanserli hastalarda kemoterapiye (araştırmacının seçimine bağlı olarak vinflunin, dosetaksel veya paklitaksel) kıyasla atezolizumabın etkililiğini ve güvenliliğini değerlendirmek için faz III, açık etiketli, çok merkezli, uluslararası, randomize bir çalışma (IMvigor211) yürütülmüştür. Otoimmün hastalık öyküsü olan, aktif veya kortikosteroid-bağımlı beyin metastazı olan, kayıttan önceki 28 gün içinde canlı, attenüe aşı uygulanmış ve kayıttan önceki 4 (dört) hafta içinde sistemik immunostimulatör ajan veya 2 (iki) hafta içinde sistemik immunosupresif tıbbi ürün uygulanmış hastalar bu çalışmadan dışlanmıştır. Tümör değerlendirmeleri ilk 54 hafta boyunca her 9 (dokuz) haftada bir ve sonrasında her 12 haftada bir gerçekleştirilmiştir. Tümör örnekleri, tümörü infiltre eden immün hücrelerde (IC) PD-L1 ekspresyonu için prospektif olarak değerlendirilmiş ve sonuçlar aşağıda açıklanan analizler için PD-L1 ekspresyon alt gruplarını tanımlamak için kullanılmıştır.
Toplam 931 hasta kaydedilmiştir. Hastalar atezolizumab ya da kemoterapi almak üzere randomize edilmiştir (1 (bir):1(bir)). Randomizasyon kemoterapi (vinflunin ya da taksan), IC'de PD-L1 ekspresyon durumu (<%5 (beş)'e karşı ≥%5 (beş)), prognostik risk faktörlerinin sayısı (0'a karşı 1(bir)-3 (üç)) ve karaciğer metastazına (evete karşı hayır) göre sınıflandırılmıştır. Prognostik risk faktörleri arasında önceki kemoterapiden itibaren 3 (üç) ay geçmesi,  0 ECOG performans durumu ve  10 g/dL hemoglobin yer almıştır.
Atezolizumab, 3 (üç) haftada bir intravenöz infüzyon yoluyla 1200 mg sabit dozda
uygulanmıştır. Atezolizumab dozunun azaltımına izin verilmemiştir. Hastalar, araştırmacı tarafından değerlendirildiği şekilde klinik faydanın kaybedilmesine veya kabul edilemez toksisite görülene kadar tedavi edilmiştir. Vinflunin, hastalığın ilerlemesine veya kabul edilemez toksisite görülene kadar her 3 (üç) haftalık döngünün 1. (birinci) gününde intravenöz infüzyon yoluyla 320 mg/m dozunda uygulanmıştır. Paklitaksel, hastalığın ilerlemesine veya kabul edilemez toksisite görülene kadar her 3 (üç) haftalık döngünün 1. (birinci) gününde 3 (üç) saat boyunca intravenöz infüzyon yoluyla 175 mg/m dozunda uygulanmıştır. Dosetaksel, hastalığın ilerlemesine veya kabul edilemez toksisite görülene kadar her 3 (üç) haftalık döngünün 1. (birinci) gününde intravenöz infüzyon yoluyla 75 mg/m dozunda uygulanmıştır. Tedavi edilen tüm hastalarda medyan tedavi süresi atezolizumab kolu için 2,8 ay, vinflunin ve paklitaksel kolları için 2,1 ay ve dosetaksel kolu için 1,6 ay olmuştur.
Primer analiz popülasyonunun demografik ve başlangıç hastalık özellikleri tedavi kolları arasında dengeli olmuştur. Medyan yaş 67 (aralık: 31-88) olup hastaların %77,1'i erkektir. Hastaların çoğunluğu (%72,1) beyaz ırktan olup kemoterapi kolundaki hastaların %53,9'u vinflunin almış, başlangıçta hastaların %71,4'ünde en az bir kötü prognostik risk faktörü ve %28,8'inde karaciğer metastazı mevcuttur. Başlangıç ECOG performans durumu 0 (%45,6) veya 1 (%54,4) olmuştur. Hastaların %71,1'inde primer tümör yeri mesanedir ve hastaların %25,4'ünde üst sistem ürotelyal karsinomu mevcuttur. Hastaların %24,2'si daha önce sadece platin içeren adjuvan veya neoadjuvan tedavi almış ve bu hastalarda 12 ay içinde hastalık ilerlemesi görülmüştür.
IMvigor211 için primer etkililik sonlanım noktası genel sağkalımdır (GS). Araştırmacı tarafından değerlendirilen Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) v1.1'e göre değerlendirilen sekonder etkililik sonlanım noktaları objektif yanıt oranı (OYO), progresyonsuz sağkalım (PS) ve yanıt süresidir (YS). IC2/3, IC1/2/3ve ITT (tedavisi amaçlanan, yani tüm katılanlar) popülasyonlarında tedavi kolu ve kontrol kolu arasındaki GS karşılaştırmaları, aşağıdaki şekilde %5'lik iki taraflı seviyede sınıflandırılmış bir log-sıra testine dayalı hiyerarşik, sabit sıralı bir prosedür kullanılarak test edilmiştir: aşama 1) IC2/3popülasyonu; aşama 2) IC1/2/3 popülasyonu; aşama 3) tüm katılanlar popülasyonu. Aşama 2 ve 3'ün her birine ait GS sonuçları, ancak önceki aşamaya ait sonuç istatistiksel olarak anlamlıysa, istatistiksel anlamlılık açısından resmi olarak test edilebilmiştir.
Medyan sağkalım takibi 17 aydır. IMvigor211 çalışmasının primer analizi primer genel sağkalım sonlanım noktasını karşılamamıştır. Atezolizumab, daha önce tedavi edilmiş, lokal ileri evre veya metastatik ürotelyal karsinomlu hastalarda kemoterapiye kıyasla istatistiksel olarak anlamlı bir sağkalım faydası göstermemiştir. Önceden belirlenmiş hiyerarşik test sırasına göre, 0,87'lik bir genel sağkalım risk oranı ile önce IC 2/3popülasyonu test edilmiştir (%95 GA: 0,63, 1,21; atezolizumab ve kemoterapi için medyan genel sağkalım sırasıyla 11,1 aya karşı 10,6 ay). Sınıflandırılmış log-sıra p değeri 0,41'dir ve bu nedenle sonuçlar bu popülasyonda istatistiksel olarak anlamlı kabul edilmemiştir. Sonuç olarak, IC1/2/3 veya tüm katılanlar popülasyonunda genel sağkalım için herhangi bir istatistiksel anlamlılık testi gerçekleştirilememiş ve bu analizlerin sonuçları açıklayıcı olarak değerlendirilmiştir. Tüm katılanlar popülasyonundaki kilit sonuçlar Tablo 12'de özetlenmiştir. Tüm katılanlar popülasyonunda Kaplan Meier genel sağkalım eğrisi Şekil 12'de sunulmaktadır.
ITT popülasyonunda 34 aylık bir medyan sağkalım takip süresi ile açıklayıcı bir güncellenmiş sağkalım analizi gerçekleştirilmiştir. Medyan genel sağkalım, 0,82'lik bir risk oranı (%95 GA: 0,71, 0,94) ile atezolizumab kolunda 8,6 ay (%95 GA: 7,8, 9,6) ve kemoterapi kolunda 8 ay (%95 GA: 7,2, 8,6) olmuştur. 12 aylık genel sağkalım oranları için primer analizde gözlemlenen eğilim ile uyumlu olarak, atezolizumab kolundaki hastalarda, ITT popülasyonundaki
kemoterapi koluna kıyasla sayısal olarak daha yüksek 24 ve 30 aylık genel sağkalım oranları gözlemlenmiştir. 24. ayda sağ olan hastaların yüzdesi (KM tahmini) kemoterapi kolunda %12,7 ve atezolizumab kolunda %22,5; 30. ayda sağ olan hastaların yüzdesi (KM tahmini) ise kemoterapi kolunda %9,8 ve atezolizumab kolunda %18,1 olmuştur.
Tablo 12: Tüm katılanlarda etkililik özeti (IMvigor211)
Etkililik sonlanım noktası | Atezolizumab (n = 467) | Kemoterapi (n = 464) |
Primer etkililik sonlanım noktası | ||
GS* | ||
Ölüm sayısı (%) | 324 (%69,4) | 350 (%75,4) |
Olaylara kadar geçen medyan süre (ay) | 8,6 | 8 |
%95 GA | 7,8, 9,6 | 7,2, 8,6 |
Sınıflandırılmış risk oranı (%95 GA) | 0,85 (0,73, 0,99) | |
12 aylık GS (%)** | %39,2 | %32,4 |
Sekonder ve açıklayıcı sonlanım noktaları | ||
Araştırmacı tarafından değerlendirilen PS (RECIST v1.1) | ||
Olay sayısı (%) | 407 (%87,2) | 410 (%88,4) |
Medyan PS süresi (ay) | 2,1 | 4 |
%95 GA | 2,1, 2,2 | 3,4, 4,2 |
Sınıflandırılmış risk oranı (%95 GA) | 1,1 (0,95, 1,26) | |
Araştırmacı tarafından değerlendirilen OYO (RECIST v1.1) | n = 462 | n = 461 |
Doğrulanmış yanıt verenlerin sayısı (%) | 62 (%13,4) | 62 (%13,4) |
%95 GA | 10,45, 16,87 | 10,47, 16,91 |
Tam yanıt sayısı (%) | 16 (%3,5) | 16 (%3,5) |
Kısmi yanıt sayısı (%) | 46 (%10) | 46 (%10) |
Stabil hastalık sayısı (%) | 92 (%19,9) | 162 (%35,1) |
Araştırmacı tarafından değerlendirilen YS (RECIST v1.1) | n = 62 | n = 62 |
Medyan (ay) *** | 21,7 | 7,4 |
%95 GA | 13, 21,7 | 6,1, 10,3 |
GA=güven aralığı; YS=yanıt süresi; OYO=objektif yanıt oranı; GS=genel sağkalım; PS=progresyonsuz sağkalım; RECIST = Katı Tümörlerde Yanıt Değerlendirme Kriterleri v1.1.
* Tüm katılanlar popülasyonunda GS analizi sınıflandırılmış log-sıra testine göre gerçekleştirilmiş ve sonuç sadece açıklama amaçlı olarak sunulmuştur (p = 0,0378); önceden belirlenmiş analiz hiyerarşisine göre, tüm katılanlar popülasyonunda GS analizi için p değeri istatistiksel olarak anlamlı kabul edilememektedir.
Ç‚ Kemoterapi (vinflunin ya da taksan), IC'de durum (< %5 (beş)'e karşı ≥ %5(beş)), prognostik risk faktörlerinin sayısı (0'a karşı 1(bir)-3(üç)) ve karaciğer metastazına (evete karşı hayır) göre sınıflandırıldı.
** Kaplan-Meier tahminine göre.
*** Yanıtlar atezolizumab kolunda yanıt verenlerin %63'ünde ve kemoterapi kolunda yanıt verenlerin %21'inde devamlıydı.
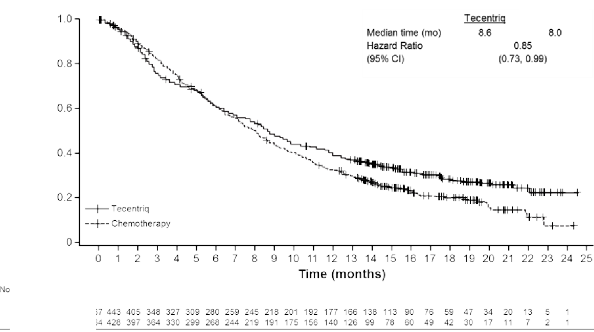
Şekil 12: Kaplan Meier genel sağkalım eğrisi (IMvigor211)
IMvigor210 (GO29293): Sisplatin tedavisi için uygun bulunmayan, daha önceden tedavi edilmemiş ürotelyal kanserli hastalar üzerinde yapılan tek kollu çalışma
Lokal ileri veya metastatik evre ürotelyal kanserli (ürotelyal mesane kanseri olarak da bilinir) hastalar üzerinde faz II, çok merkezli, uluslararası, iki kohortlu, tek kollu bir klinik çalışma (IMvigor210) yürütülmüştür.
Çalışmada toplam 438 hasta ve iki hasta kohortu vardır. Kohort 1'e, sisplatin bazlı kemoterapiye uygun bulunmayan veya uygun olmayan ya da platin içeren bir neoadjuvan veya adjuvan kemoterapi rejimi ile uygulanan tedaviden en az 12 ay sonra hastalık ilerlemesi görülen, daha önce tedavi görmemiş, lokal ileri veya metastatik evre ürotelyal kanserli hastalar dahil edilmiştir. Kohort 2'ye ise, lokal ileri veya metastatik evre ürotelyal kanserli için en az bir platin bazlı kemoterapi rejimi alan veya platin içeren bir neoadjuvan veya adjuvan kemoterapi rejimi ile uygulanan tedaviden sonraki 12 ay içinde hastalık ilerlemesi görülen hastalar dahil edilmiştir.
Kohort 1'de, 119 hasta hastalığın ilerlemesine kadar intravenöz infüzyon yoluyla 3 (üç) haftada bir 1200 mg atezolizumab ile tedavi edilmiştir. Medyan yaş 73'tür. Hastaların çoğu (%81) erkek ve çoğunluğu (%91) beyaz ırktan olmuştur.
Kohort 1'e, ECOG performans durumu 0 olan 45 hasta (%38), ECOG performans durumu 1 olan 50 hasta (%42) ve ECOG performans durumu 2 olan 24 hasta (%20), Bajorin risk faktörü (ECOG performans durumu ≥ 2 ve viseral metastaz) olmayan 35 hasta (%29), bir Bajorin risk faktörü olan 66 hasta (%56) ve iki Bajorin risk faktörü olan 18 hasta (%15), böbrek işlev bozukluğu olan (glomerüler filtrasyon hızı [GFR] < 60 mL/dk) 84 hasta (%71) ve karaciğer metastazı olan 25 hasta (%21) dahil edilmiştir.
Kohort 1'in primer etkililik sonlanım noktası, bağımsız bir değerlendirme tesisi (IRF) tarafından RECIST v1.1 kullanılarak değerlendirilen objektif yanıt oranı (OYO) olarak doğrulanmıştır.
Primer analiz, tüm hastalar en az 24 hafta süreyle takip edildiğinde gerçekleştirilmiştir. Tüm katılanlarda medyan tedavi süresi 15 hafta ve medyan sağkalım takip süresi 8,5 ay olmuştur. RECIST v1.1'e göre IRF tarafından değerlendirilen klinik olarak anlamlı OYO'lar gösterilmiş; ancak önceden belirlenmiş %10'luk bir geçmiş kontrol yanıt oranı ile karşılaştırıldığında, anlamlı faydaya ulaşılamamıştır. IRF RECIST v1.1'e göre doğrulanmış OYO'lar PD-L1 ekspresyonu ≥%5 olan hastalarda %21,9 (%95 GA: 9,3, 40), PD-L1 ekspresyonu ≥%1 olan
hastalarda %18,8 (%95 GA: 10,9, 29) ve tüm katılanlarda %19,3 (%95 GA: 12,7, 27,6) olmuştur. Herhangi bir PD-L1 ekspresyon alt grubunda veya tüm katılanlarda medyan yanıt süresine (YS) ulaşılmamıştır. Yaklaşık %40'lık bir olay-hasta oranı ile genel sağkalım matür değildir. Tüm hasta alt gruplarında (PD-L1 ekspresyonu  %5 ve %1) ve tüm katılanlarda medyan genel sağkalım 10,6 ay olmuştur.
Kohort 1 için gerçekleştirilen ve 17,2 aylık bir medyan sağkalım takip süresi ile güncellenmiş olan analiz Tablo 13'te özetlenmektedir. Herhangi bir PD-L1 ekspresyon alt grubunda veya tüm katılanlarda medyan YS'ye ulaşılmamıştır.
Tablo 13: Güncellenmiş etkililik özeti (IMvigor210 Kohort 1)
Etkililik sonlanım noktası | IC'de PD-L1 ekspresyonu ≥%5 olanlar | IC'de PD-L1 ekspresyonu ≥%1 olanlar |
Tüm Katılanlar |
OYO (IRF tarafından değerlendirilen; RECIST v1.1) | n = 32 | n = 80 | n = 119 |
Yanıt verenlerin sayısı (%) | 9 (%28,1) | 19 (%23,8) | 27 (%22,7) |
%95 GA | 13,8, 46,8 | 15, 34,6 | 15,5, 31,3 |
Tam yanıt sayısı (%) %95 GA | 4 (%12,5) (3,5, 29) | 8 (%10) (4,4, 18,8) | 11 (%9,2) (4,7, 15,9) |
Kısmi yanıt sayısı (%) %95 GA | 5 (%15,6) (5,3, 32,8) | 11 (%13,8) (7,1, 23,3) | 16 (%13,4) (7,9, 20,9) |
YS (IRF tarafından değerlendirilen; RECIST v1.1) | n = 9 | n = 19 | n = 27 |
Olay görülen hastalar (%) | 3 (%33,3) | 5 (%26,3) | 8 (%29,6) |
Medyan (ay) (%95 GA) | TE (11,1, TE) | TE (TE) | TE (14,1, TE) |
PS (IRF tarafından değerlendirilen; RECIST v1.1) | n = 32 | n = 80 | n = 119 |
Olay görülen hastalar (%) | 24 (%75) | 59 (%73,8) | 88 (%73,9) |
Medyan (ay) (%95 GA) | 4.1 (2,3, 11,8) | 2.9 (2,1, 5,4) | 2.7 (2,1, 4,2) |
GS | n = 32 | n = 80 | n = 119 |
Olay görülen hastalar (%) | 18 (%56,3) | 42 (%52,5) | 59 (%49,6) |
Medyan (ay) (%95 GA) | 12,3 (6, TE) | 14,1 (9,2, TE) | 15,9 (10,4, |
|
|
| TE) |
1 yıllık GS oranı (%) | %52,4 | %54,8 | %57,2 |
GA = güven aralığı; YS = yanıt süresi; IC = tümörü infiltre eden immün hücreler; IRF = bağımsız değerlendirme tesisi; TE = tahmin edilemiyor; OYO = objektif yanıt oranı; GS = genel sağkalım; PS = progresyonsuz sağkalım; RECIST = Katı Tümörlerde Yanıt Değerlendirme Kriterleri v1.1.
Kohort 2'de, ko-primer etkililik sonlanım noktaları, bir IRF tarafından RECIST v1.1 kullanılarak değerlendirilen OYO ve Modifiye RECIST (mRECIST) kriterlerine göre araştırmacı tarafından değerlendirilen OYO olarak doğrulanmıştur. 310 hasta, klinik faydanın kaybedilmesine kadar 3 (üç) haftada bir intravenöz infüzyon yoluyla 1200 mg atezolizumab ile tedavi edilmiştir. Kohort 2'nin primer analizi, tüm hastalar en az 24 hafta süreyle takip edildiğinde gerçekleştirilmiştir. Çalışma Kohort 2'deki ko-primer sonlanım noktalarını karşılamış; bu da önceden belirlenmiş %10'luk bir geçmiş kontrol yanıt oranı ile karşılaştırıldığında, IRF tarafından RECIST v1.1 kullanılarak değerlendirilen ve araştırmacı tarafından mRECIST kullanılarak değerlendirilen istatistiksel olarak anlamlı OYO'lar göstermiştir.
Kohort 2'de 21,1 aylık bir medyan sağkalım takip süresi ile de analiz gerçekleştirilmiştir. IRF RECIST v1.1'e göre doğrulanmış OYO'lar, PD-L1 ekspresyonu ≥%5 olan hastalarda %28 (%95 GA: 19,5, 37,9), PD-L1 ekspresyonu ≥%1 olan hastalarda %19,3 (%95 GA: 14,2, 25,4)
ve tüm katılanlarda %15,8 (%95 GA: 11,9, 20,4) olmuştur. Araştırmacı tarafından değerlendirilen mRECIST'e göre doğrulanmış OYO ise PD-L1 ekspresyonu ≥%5 olan hastalarda %29 (%95 GA: 20,4, 38,9), PD-L1 ekspresyonu ≥%1 olan hastalarda %23,7 (%95
GA: 18,1, 30,1) ve tüm katılanlarda %19,7 (%95 GA: 15,4, 24,6) olmuştur. Tüm katılanlar popülasyonunda IRF RECIST v1.1'e göre tam yanıt oranı %6,1 (%95 GA: 3,7, 9,4) olmuştur. Kohort 2'de, herhangi bir PD-L1 ekspresyon alt grubunda veya tüm katılanlarda medyan YS'ye ulaşılmamış; ancak PD-L1 ekspresyonu <%1 olan hastalarda ulaşılmıştır (13,3 ay; %95 GA 4,2, TE). 12. ayda GS oranı tüm katılanlarda %37 olmuştur.
IMvigor130 (WO30070): Tedavi edilmemiş lokal ileri evre veya metastatik ürotelyal karsinomlu hastalarda monoterapi olarak ve platin bazlı kemoterapi ile kombinasyon halinde atezolizumabın değerlendirildiği faz III çok merkezli, randomize, plasebo kontrollü çalışma.
Sağkalım verilerinin ilk aşamada gözden geçirilmesini takiben bağımsız bir Veri İzleme Kurulu (İDMC) tarafından verilen tavsiyeye dayanılarak, tümörlerinde PD-L1 ekspresyonu düşük olan (PD-L1 ile boyanmış, tümörü infiltre eden immün hücrelerin [IC], tümör alanının <%5'ini kaplaması) hastaların atezolizumab monoterapisi koluna eklenmesi, bu alt grubun genel sağkalımında azalma gözlemlendikten sonra durdurulmuştur. İDMC, halihazırda monoterapi koluna randomize edilmiş ve monoterapi kolunda tedavi görmekte olan hastalar için herhangi bir tedavi değişikliği tavsiye etmemiştir. Başka bir değişiklik tavsiye edilmemiştir.
Hepatoselüler kanser:
IMbrave150 (YO40245): Bevacizumab ile kombinasyon halinde, daha önce sistemik tedavi almamış rezeke edilemeyen hepatoselüler kanserli hastalarda randomize faz III çalışma
Daha önce sistemik tedavi görmemiş lokal ileri veya metastatik evre ve/veya rezeke edilemeyen hepatoselüler kanserli hastalarda bevacizumab ile kombinasyon halinde atezolizumabın
etkililiği ve güvenliliğini değerlendirmek üzere, faz III, randomize, çok merkezli, uluslararası, açık etiketli bir çalışma olan IMbrave150 yürütülmüştür. Toplamda 501 hasta (2:1) oranında ya intravenöz infüzyon ile her 3 haftada bir uygulanan atezolizumab (1200 mg) ve 15 mg/kg bevacizumaba ya da günde iki kez oral yolla uygulanan sorafenib 400 mg'a randomize edilmiştir. Randomizasyon coğrafi bölge (geri kalan dünya ülkelerine karşı Japonya hariç Asya), makrovasküler invazyon ve/veya ekstrahepatik yayılma (yoka karşı var), başlangıç âº- fetoprotein (AFP) (≥400 ng/mL'ye karşı <400 ng/mL) ve ECOG performans durumuna (1'e karşı 0) göre sınıflandırılmıştır. Her iki koldaki hastalar klinik fayda kaybına veya kabul edilemez toksisiteye kadar tedavi almıştır. Hastalar atezolizumab veya bevacizumabı bırakıp (örn. advers olaylardan dolayı) klinik fayda kaybı veya tekli ajan ile ilişkili kabul edilemez toksisiteye kadar tekli ajan tedavisine devam edebilmiştir.
Çalışmaya hastalığı cerrahi ve/veya bölgesel tedavilere uygun olmayan veya cerrahi ve/veya bölgesel tedavilerden sonra ilerleyen Child-Pugh A, ECOG 0/1'e sahip ve daha önce sistemik tedavi almamış yetişkinler kaydedeilmiştir. Kanama (ölümcül olaylar dahil) bevacizumab ile bilinen bir advers reaksiyondur ve üst gastrointestinal kanama HSK'li hastalarda yaygın ve hayati risk taşıyan bir komplikasyondur. Bu nedenle, hastaların tedaviden önceki 6 ay içinde varis varlığı açısından değerlendirilmesi zorunlu tutulmuş ve tedaviden önceki 6 ay içinde varise bağlı kanama geçirmişlerse, kanama veya yüksek kanama riski olan tedavi edilmemiş ya da yeterince tedavi edilmemiş varisleri varsa çalışmadan hariç tutulmuştur. Aktif hepatit B'li hastalar için çalışma tedavisine başlamadan önce 28 gün içinde HBV DNA< 500 IU/mL ve çalışmaya dahil olmadan önce ve çalışma boyunca minimum 14 günlük standart anti-HBV tedavisi gerekli olmuştur.
Hastalar ayrıca, orta şiddette veya şiddetli asitleri; hepatik ensefalopati öyküleri, hepatik ensefalopati öyküsü, bilinen fibrolameller HSKsi, sarkomatoid HSK'si, mikst kolanjiokarsinomu ve HSK'si, HBV ve HCV'nin aktif koenfeksiyonu, otoimmün hastalık öyküleri varsa, randomizasyondan önceki 4 (dört) hafta içinde canlı, attenüe aşı uygulanmışsa; randomizasyondan önceki 4 (dört) hafta içinde sistemik immunostimulatör ajan veya 2 (iki) hafta içinde immunsupresif ilaçlar uygulanmışsa; tedavi edilmemiş veya kortikosteroide bağımlı beyin metastazları varsa da hariç tutulmuştur. Tümör değerlendirmeleri 1. (birinci) Döngü, 1. (birinci) Günden sonraki ilk 54 hafta boyunca her 6 (altı) haftada bir, ardından her 9 (dokuz) haftada bir yürütülmüştür.
Çalışma popülasyonunun demografik ve başlangıç hastalık özellikleri tedavi kolları arasında iyi dengelenmiştir. Medyan yaş 65 olup (aralık: 26 ila 88), hastaların %83'ü erkektir. Hastaların çoğu Asyalı (%57) ve beyazdır (%35). %40'ı Asya'dan (Japonya hariç), %60'ı geri kalan dünya ülkelerindendir. Hastaların yaklaşık %75'i makrovasküler invazyon ve/veya esktrahepatik yayılma ile başvururken, %37'sinde başlangıç AFP değeri ≥400 ng/mL'dir. Başlangıç ECOG performans durumu 0 (%62) veya 1 (bir)'dir (%38). HSK gelişimi açısından birincil risk faktörleri hastaların %48'inde Hepatit B virüsü enfeksiyonu, hastaların %22'sinde Hepatit C virüsü enfeksiyonu ve hastaların %31'inde viral olmayan hastalıktır. HSK, hastaların
%82'sinde Barselona Kliniği Karaciğer Kanseri (BCLC) evre C, hastaların %16'sında evre B ve hastaların %3 (üç)'ünde evre A olarak sınıflandırılmıştır.
Eş-primer etkililik sonlanım noktaları RECIST v1.1'e göre GS (genel sağkalım) ve bağımsız değerlendirme merkezi (IRF) tarafından değerlendirilen PS'dir (progresyonsuz sağkalım). Birincil analiz zamanında hastalar 8,6 aylık medyan sağkalım takibi süresine sahiptir. Veriler sorafenibe kıyasla atezolizumab + bevacizumab ile RECIST v1.1'e göre IRF tarafından değerlendirildiği üzere PS ve GS'de istatistiksel anlamlı bir iyileşme göstermiştir. İstatistiksel anlamlı bir iyileşme, ayrıca RECIST v1.1'e ve HSK değiştirilmiş RECIST'e (mRECIST) göre
IRF tarafından doğrulanmış objektif yanıt oranında da (OYO) gözlenmiştir. Primer analize ait kritik etkililik bulguları Tablo 14'te özetlenmektedir.
15,6 aylık ortanca sağkalım takip süresi ile tanımlayıcı bir güncellenmiş etkililik analizi yürütülmüştür. Medyan GS, atezolizumab + bevacizumab kolunda 19,2 ay (%95 GA: 17, 23,7)
iken sorafenib kolunda 13,4 ay (%95 GA: 11,4, 16,9) olup risk oranı 0,66'dır (%95 GA: 0,52, 0,85). RECIST v1.1 doğrultusunda IRF değerlendirmesine göre medyan progresyonsuz sağkalım, atezolizumab + bevacizumab kolunda 6,9 ay (%95 GA: 5,8, 8,6) iken sorafenib
kolunda 4,3 ay (%95 GA: 4, 5,6) olup risk oranı değeri 0,65'tir (%95 GA: 0,53, 0,81).
RECIST v1.1'e göre IRF ile değerlendirilen genel yanıt oranı, atezolizumab + bevacizumab kolunda %29,8 (%95 GA: 24,8, 35) iken sorafenib kolunda %11,3 (%95 GA: 6,9, 17,3) olmuştur. Doğrulanmış yanıt verenlerde RECIST v1.1 doğrultusunda IRF değerlendirmesine göre ortanca yanıt süresi (YS), atezolizumab + bevacizumab kolunda 18,1 aya (%95 GA: 14,6, tahmin edilemiyor (TE)) kıyasla sorafenib kolunda 14,9 ay bulunmuştur (%95 GA: 4,9, 17).
Genel sağkalım (güncellenmiş analiz) ve progresyonsuz sağkalım (primer analiz) için Kaplan- Meier eğrileri Şekil 13 ve 14'te sunulmaktadır.
Tablo 14: Etkililik özeti (IMbrave150 primer analiz)
Kritik etkililik sonlanım noktası: | Atezolizumab+bevacizumab | Sorafenib |
GS | n=336 | n=165 |
Ölüm sayısı (%) | 96 (%28,6) | 65 (%39,4) |
Olaya kadar geçen medyan süre (ay) | TE | 13,2 |
%95 GA | (TE, TE) | (10.4, TE) |
Sınıflandırılmış risk oranı | 0,58 (0,42, 0,79) | |
p değeri | 0,0006 | |
6 aylık GS (%) | %84,8 | %72,3 |
IRF tarafından değerlendirilen PS, RECIST 1.1 | n=336 | n=165 |
Olay sayısı (%) | 197 (%58,6) | 109 (%66,1) |
Medyan PS süresi (ay) | 6,8 | 4,3 |
%95 GA | (5,8, 8,3) | (4, 5,6) |
Sınıflandırılmış risk oranı | 0,59 (0,47, 0,76) | |
p değeri | <0,0001 | |
6 aylık PS | %54,5 | %37,2 |
IRF tarafından değerlendirilen OYO, RECIST 1.1 | n=326 | n=159 |
Doğrulanmış yanıt veren sayısı (%) | 89 (%27,3) | 19 (%11,9) |
%95 GA | (22,5, 32,5) | (7,4, 18) |
p-değeri | <0,0001 | |
Kritik etkililik sonlanım noktası: | Atezolizumab+bevacizumab | Sorafenib |
Tam yanıtların sayısı (%) | 18 (%5,5) | 0 |
Kısmi yanıtların sayısı (%) | 71 (21,8) | 19 (%11,9) |
Stabil hastalık sayısı (%) | 151 (%46,3) | 69 (43,4) |
IRF ile değerlendirilen YS, RECIST 1.1 | n=89 | n=19 |
Ay cinsinden medyan | TE | 6,3 |
%95 GA | (TE, TE) | (4,7, TE) |
Aralık (ay) | (1,3+, 13,4+) | (1,4+, 9,1+) |
IRF tarafından değerlendirilen OYO, HSK mRECIST | n=325 | n=158 |
Doğrulanmış yanıt veren sayısı (%) | 108 (%33,2) | 21 (%13,3) |
%95 GA | (28,1, 38,6) | (8,4, 19,6) |
p-değeri | <0,0001 | |
Tam yanıtların sayısı (%) | 33 (%10,2) | 3 (%1,9) |
Kısmi yanıtların sayısı (%) | 75 (%23,1) | 18 (%11,4) |
Stabil hastalık sayısı (%) | 127 (%39,1) | 66 (%41,8) |
IRF ile değerlendirilen YS, HSK mRECIST | n=108 | n=21 |
Ay cinsinden medyan | TE | 6,3 |
%95 GA | (TE, TE) | (4,9, TE) |
Aralık (ay) | (1,3+, 13,4+) | (1,4+, 9,1+) |
Coğrafi bölgeye (geri kalan dünya ülkelerine karşı Japonya hariç Asya), makrovasküler invazyon ve/veya ekstrahepatik yayılma (yoka karşı var), başlangıç âº-fetoprotein (AFP) (≥400'e karşı <400 ng/mL) göre sınıflandırılmıştır + Sansürlü bir değeri gösterir PS = progresyonsuz sağkalım; RECIST = Solid Tümörlerde Yanıt Değerlendirme Kriterleri v1.1; CC mRECIST = Hepatoselüler Karsinom İçin Değiştirilmiş RECIST Değerlendirmesi; GA = güven aralığı; OYO = objektif yanıt oranı; YS = yanıt süresi; GS = genel sağkalım; TE = Tahmin edilemiyor; N/A=geçerli değildir | ||
İki taraflı sınıflandırılmış log-sıra testi temelinde
5.2. Farmakokinetik özellikler
Genel özelliklerAtezolizumaba maruziyet 1 (bir) mg/kg vücut ağırlığı - 20 mg/kg vücut ağırlığı doz aralığında 3 (üç) haftada bir uygulanan sabit doz 1200 mg doz ile orantılı olarak artmıştır. 472 hastayı içeren bir popülasyon analizi, aşağıdaki doz aralığı için atezolizumab farmakokinetiğini açıklamıştır: Birinci derece eliminasyonla bir doğrusal iki bölmeli dağılım modeli ile 1 - 20 mg/kg vücut ağırlığı. Bir popülasyon farmakokinetik analizi, 6 (altı)-9 (dokuz) hafta tekrarlı dozlamadan sonra kararlı durumun elde edildiğini öne sürmektedir. Eğri altındaki alanda, maksimum konsantrasyon ve en düşük konsantrasyonda sistemik birikim sırasıyla 1,91; 1,46 ve 2,75 kat olmuştur.
Emilim:
Atezolizumab intravenöz infüzyon şeklinde uygulanır. Diğer uygulama yollarıyla yapılan çalışmalar olmamıştır.
Dağılım:
Popülasyon farmakokinetik analizi, bir hastada merkezi kompartman dağılım hacminin 3,28 L ve kararlı durumunda hacmin 6,91 L olduğunu göstermektedir.
Biyotransformasyon:
Atezolizumabın metabolizması doğrudan araştırılmamıştır. Antikor klerensi esas olarak katabolizmayla gerçekleşir.
Eliminasyon:
Popülasyon farmakokinetik analizi, atezolizumabın klerensinin 0,2 L/gün ve tipik terminal eliminasyon yarı ömrünün 27 gün olduğunu göstermektedir.
Özel popülasyonlara ilişkin ek bilgiler:
Popülasyon farmakokinetiği ve maruziyet-yanıt analizlerine göre aşağıdaki faktörlerin atezolizumabın farmakokinetiği üzerinde bir etkisi yoktur: yaş, (21-89 yaş), bölge, etnik köken, böbrek bozukluğu, hafif karaciğer bozukluğu, PD-L1 ekspresyonu düzeyi veya ECOG durumu. Vücut ağırlığı, cinsiyet, pozitif ADA durumu, albümin seviyeleri ve tümör yükünün atezolizumab farmakokinetiği üzerindeki etkisi istatistiki olarak anlamlı ancak klinik olarak
anlamlı değildir. Doz ayarlanması önerilmemektedir. Pediyatrik popülasyon:
Pediyatrik (<18 yaş, n= 69) ve genç erişkin (18-30 yaş, n=18) hastalarda yapılan bir erken faz, çok merkezli, açık etiketli çalışmadan elde edilen farmakokinetik sonuçlar, atezolizumab klerensi ve dağılım hacminin, normal vücut ağırlığında her 3 (üç) hafta 15 mg/kg vücut ağırlığı alan pediyatrik hastalar ve 1200 mg atezolizumab alan genç erişkin hastalar arasında karşılaştırılabilir olduğunu göstermiştir. Maruziyetin ise, vücut ağırlığı düştükçe pediyatrik hastalarda arttığı gözlenmiştir. Bu değişiklikler, atezolizumab konsantrasyonunun terapötik hedef maruziyetinin altına düşmesi ile bağlantılı değildir. 2 yaş altındaki çocuklar için veriler sınırlıdır, bu nedenle kesin sonuçlara varılamamaktadır.
Geriyatrik popülasyon:
Yaşlı hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Yaşın atezolizumabın farmakokinetiği üzerindeki etkisi bir popülasyon farmakokinetik analizinde değerlendirilmiştir. Yaş, 21-89 yaş aralığındaki (n=472) ve medyan 62 yaşındaki hastalar temel alındığında, atezolizumabın farmakokinetiğini etkileyen önemli bir kovaryant olarak tanımlanmamıştır. <65 yaşındaki (n=274), 65-75 yaşındaki (n=152) ve >75 yaşındaki (n=46) hastalarda atezolizumabın farmakokinetiğinde klinik açıdan anlamlı bir fark gözlenmemiştir (bkz. Bölüm 4.2).
Böbrek yetmezliği:
Böbrek bozukluğu olan hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Popülasyon farmakokinetik analizinde, böbrek fonksiyonu normal (90 mL/dk/1,73 m veya üzeri eGFR; n=140) olan hastalarla karşılaştırıldığında, hafif (60 - 89 mL/dk/1,73 m eGFR; n=208) veya orta şiddetli (30 - 59 mL/dk/1,73 m eGFR; n=116) böbrek bozukluğu olan hastalarda atezolizumabın klerensinde klinik açıdan önemli farklar bulunmamıştır. Yalnızca birkaç hastada şiddetli böbrek bozukluğu vardır (eGFR 15 - 29 mL/dk/1,73 m; n=8) (bkz. Bölüm 4.2). Şiddetli böbrek yetmezliğinin atezolizumabın farmakokinetiği üzerindeki etkisi bilinmemektedir.
Karaciğer yetmezliği:
Karaciğer bozukluğu olan hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Popülasyon farmakokinetik analizinde hafif karaciğer bozukluğu (bilirubin ≤NÜS ve AST>NÜS veya bilirubin <1 – 1,5 x NÜS ve herhangi bir AST) veya orta düzeyde karaciğer bozukluğu (bilirubin <1,5 – 3 x NÜS ve herhangi bir AST) olan hastalarda normal karaciğer fonksiyonu (bilirubin ve AST ≤NÜS) olan hastalara kıyasla atezolizumabın klerensi bakımından klinik olarak önemli farklar bulunmamıştır. Şiddetli karaciğer bozukluğu olan hastalara ilişkin veri mevcut değildir (bilirubin > 3 x NÜS ve herhangi bir AST). Karaciğer bozukluğu, Ulusal Kanser Enstitüsü (NCI) karaciğer fonksiyon bozukluğu kriterlerine göre tanımlanmıştır (bkz. Bölüm 4.2). Şiddetli karaciğer yetmezliğinin (bilirubin > 3 x NÜS ve herhangi bir AST) atezolizumabın farmakokinetiği üzerindeki etkisi bilinmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Karsinojenisite:TECENTRIQ'in karsinojenik potansiyelini belirlemek için karsinojenisite çalışması yapılmamıştır.
Mutajenisite:
TECENTRIQ'in mutajenik potansiyelini belirlemek için mutajenisite çalışması yapılmamıştır. Bununla birlikte, monoklonal antikorların DNA veya kromozomları değiştirmesi beklenmemektedir.
Fertilite:
TECENTRIQ ile herhangi bir fertilite çalışması yapılmamıştır. Bununla birlikte, kronik toksisite çalışmasına sinomolgus maymunlarında erkek ve dişi üreme organlarının değerlendirilmesi dahil edilmiştir. Atezolizumabın dişi maymunlara tahmini EAA'da uygulanması (önerilen dozu alan hastalardaki EAA'nın yaklaşık 6 katı), geri dönüşümlü olarak düzensiz adet döngüsü paternine ve yumurtalıklarda yeni oluşturulmuş korpus lutea eksikliğine neden olmuştur. Erkek üreme organları üzerinde herhangi bir etki olmamıştır.
Teratojenisite:
TECENTRIQ ile hayvanlarda üreme veya teratojenisite çalışmaları yapılmamıştır. Hayvan çalışmaları, PD-L1/PD-1 yolağının inhibisyonunun büyümekte olan fetüsün reddi riskinde immünite ile ilişkili artışa ve böylelikle fetal ölüme yol açabileceğini ortaya koymuştur. TECENTRIQ uygulamasının gebelik üzerinde advers bir reaksiyona yol açması beklenir ve embriyo-fetal letalitesi de dahil olmak üzere insan fetüsü için bir risk oluşturur.
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Satış Fiyatı | 92271.53 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 92271.53 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505763460 |
| Etkin Madde | Atezolizumab |
| ATC Kodu | L01XC32 |
| Birim Miktar | 1200/20 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |