TECFIDERA 240 mg enterik sert kapsül (56 kapsül) Farmakolojik Özellikler
{ Dimetil Fumarat }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer İmmünosüspresanlar ATC kodu: L04AX07
Etki mekanizması
Multipl sklerozda, dimetil fumarat tarafından sergilenen terapötik etki mekanizması tam olarak anlaşılamamıştır. Klinik öncesi çalışmalar, dimetil fumaratın farmakodinamik yanıtlarının esas olarak Nükleer faktör (eritroid-derived 2)-like 2 (Nrf2) transkripsiyon yolağının aktivasyonu aracılığıyla gerçekleştiğini göstermektedir. Dimetil fumaratın, hastalarda Nrf2-bağımlı antioksidan genlerini regüle ettiği gösterilmiştir (örn. NAD(P)H dehidrojenaz, kinon 1; [NQO1]).
Farmakodinamik etkiler
İmmün sistem üzerine etkiler
Klinik öncesi ve klinik çalışmalarda, dimetil fumarat anti-inflamatuar ve immünomodülatör özellikler göstermiştir. Dimetil fumarat ve dimetil fumaratın primer metaboliti monometil fumarat, klinik öncesi modellerde inflamatuvar uyaranlara yanıt olarak immün hücre aktivasyonunu ve sonrasında meydana gelen pro-inflamatuvar sitokinlerin salınımını azaltmıştır. Psöriyazisi olan hastalarda yapılan klinik çalışmalarda, dimetil fumarat pro- inflamatuvar sitokin profillerinin (T1, T17) down-regülasyonu ile lenfosit fenotiplerini etkilemiş ve anti-inflamatuvar üretimine (T2) eğilim göstermiştir. Dimetil fumarat, multiple inflamatuvar ve nöroinflamatuvar hasar modelinde terapötik aktivite göstermiştir. MS hastalarda faz 3 çalışmalarda, (DEFINE, CONFIRM ve ENDORSE), TECFIDERA ile tedavi, ortalama lenfosit sayımlarından sonra ortalama bir plato göstermiştir; bu, ilk yıl boyunca başlangıç değerlerinin yaklaşık %30'u kadar azalmış ve ardından bir plato izlemiştir. Bu
çalışmalarda, lenfosit sayıları normalin alt sınırının (LLN, 910 hücre/mm3) altındayken TECFİDERA tedavisini bırakan hastalar, lenfosit sayılarının LLN'ye geri kazanılması için izlenmiştir.
Şekil 1, uzamış şiddetli lenfopeni olmaksızın Kaplan-Meier yöntemine dayalı olarak LLN'ye ulaştığı tahmin edilen hastaların oranını göstermektedir. İyileşme başlangıç çizgisi (RBL), TECFİDERA'nın kesilmesinden önceki tedavideki son ALC olarak tanımlandı. RBL'de hafif, orta veya şiddetli lenfopenisi olan 12. Hafta ve 24. Haftada LLN'ye (ALC ≥ 0.9 x 10//L) iyileşen hastaların tahmini oranı, %95 noktasal güven aralıklarıyla Tablo 1, Tablo 2 ve Tablo 3'te sunulmaktadır. Hayatta kalma fonksiyonunun Kaplan-Meier tahmin edicisinin standart hatası Greenwood formülü kullanılarak hesaplanır.
Şekil 1: Kaplan-Meier Metodu; İyileşme Başlangıç Noktasından (RBL) ≥ 910 hücre/mm 3 LLN'ye İyileşen Hastaların Oranı
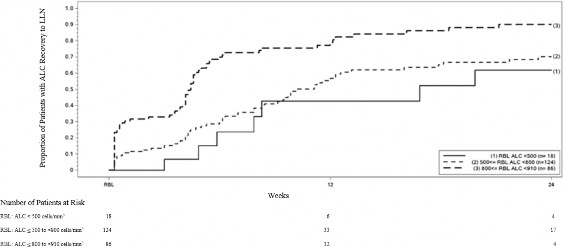
Tablo 1: Kaplan-Meier Yöntemi; Uzamış şiddetli lenfopenisi olan hastalar hariç, LLN'ye ulaştığı tahmin edilen hastaların oranı, iyileşme başlangıcında (RBL) hafif lenfopeni
Risk altındaki hafif lenfopenisi olan hasta sayısı | Taban Çizgisi N=86 | Hafta 12 N=12 | Hafta 24 N=4 |
LLN'ye ulaşan oran (%95 GA) |
| 0.81 (0.71, 0.89) | 0.90 (0.81, 0.96) |
Tablo 2: Kaplan-Meier Yöntemi; Uzamış şiddetli lenfopenisi olan hastalar hariç, LLN'ye ulaştığı tahmin edilen hastaların oranı, iyileşme başlangıcında (RBL) orta derecede lenfopeni
Risk altındaki orta derecede lenfopenisi olan hasta sayısı | Taban Çizgisi N=124 | Hafta 12 N=33 | Hafta 24 N=17 |
LLN'ye ulaşan oran (%95 GA) |
| 0.57 (0.46, 0.67) | 0.70 (0.60, 0.80) |
Tablo 3: Kaplan-Meier Yöntemi; Uzamış şiddetli lenfopenisi olan hastalar hariç, LLN'ye ulaştığı tahmin edilen hastaların oranı, iyileşme başlangıcında (RBL) şiddetli lenfopeni
Risk altındaki ciddi derecede lenfopenisi olan hasta sayısı | Taban Çizgisi N=18 | Hafta 12 N=6 | Hafta 24 N=4 |
LLN'ye ulaşan oran (%95 GA) |
| 0.43 (0.20, 0.75) | 0.62 (0.35, 0.88) |
Klinik etkililik ve güvenlilik
Relapsing-remitting multipl sklerozlu (RRMS) hastalar ile iki adet, 2 yıllık, randomize, çift kör, plasebo kontrollü çalışmalar [1234 hasta ile DEFINE ve 1417 hasta ile CONFIRM] yapılmıştır. MS'in ilerleyici formları olan hastalar bu çalışmalara dahil edilmemiştir. Etkililik (bkz. aşağıdaki tablo) ve güvenlilik, randomizasyondan önceki bir yıllık süreçte en az 1 nüks yaşayan hastalarda veya randomizasyondan önce altı haftada en az bir gadolinyum-tutan (Gd+) lezyon geliştirerek bir beyin Manyetik Rezonans Görüntülemesi ( MRI) yapılan hastaları kapsayan 0'dan 5'e değişen Genişletilmiş Engellilik Durum Ölçeği (EDSS) skorlu hastalarda kanıtlanmıştır. CONFIRM, glatiramer asetatın referans karşılaştırıcısı olarak değerlendirici bir kör (örn. tedavi çalışmasının sonuçlarını değerlendiren çalışma hekimi/araştırmacı körleştirilmiştir) içermiştir.
DEFINE'da, hastalar aşağıdaki medyan başlangıç özelliklerine sahipti: yaş 39, hastalık süresi
7.0 yıl, EDSS puanı 2.0. Ek olarak, hastaların %16'sının EDSS puanı > 3.5 ve %28'i önceki yıl en az 2 nüks yaşamış ve %42'si halihazırda onaylanmış başka MS tedavileri almıştı.. MRG kohortunda, çalışmaya giren hastaların %36'sında başlangıçta Gd+ lezyonları mevcuttur (ortalama Gd+ lezyon sayısı 1,4).
CONFIRM'de, hastalar şu özellikleri sergilemiştir: yaş 37, hastalık süresi 6,0 yıl, EDSS skoru 2,5. Buna ek olarak, hastaların %17'si EDSS skoru >3,5'dir ve %32'si önceki yıl en az 2 nüks geçirmiş ve %30'u önceden başka onaylı MS tedavileri almıştır. MRI kohortunda, çalışmaya giren hastaların %45'inde başlangıçta Gd+ lezyonları mevcuttur (ortalama Gd+ lezyon sayısı 2,4).
Plaseboyla karşılaştırıldığında, TECFİDERA ile tedavi edilen hastalarda şu değerlerde klinik açıdan anlamlı ve istatistiksel açıdan önemli bir azalma gözlenmiştir: DEFINE'da primer sonlanım noktası, 2 yılda nüks yapan hasta oranı; ve Çalışma 2'de primer sonlanım noktası, 2 yılda yıllık nüks oranı (ARR).
CONFIRM'de; glatiramer asetat ve plasebo için ARR, onaylanmış kısa ürün bilgisi ve kullanma talimatına uygun olarak %29'luk bir azalmaya karşılık gelecek şekilde, sırasıyla 0,286 ve 0,401 olarak belirlenmiştir.
| DEFINE | CONFIRM | |||
| Plasebo | Tecfidera günde iki kez 240 mg | Plasebo | Tecfidera günde iki kez 240 mg | Glatiramer asetat |
Klinik Sonlanım Noktaları | |||||
Hasta sayısı | 408 | 410 | 363 | 359 | 350 |
Yıllık nüks oranı | 0,364 | 0,172*** | 0,401 | 0,224*** | 0,286* |
İnsidans yoğunluk oranı (%95 GA) |
| 0,47 (0,37, 0,61) |
| 0,56 (0,42, 0,74) | 0,71 (0,55, 0,93) |
Nüks oranı | 0,461 | 0,270*** | 0,410 | 0,291 ** | 0,321 ** |
Risk oranı (%95 GA) |
| 0,51 (0,40, 0,66) |
| 0,66 (0,51, 0,86) | 0,71 (0,55, 0,92) |
12 haftalık doğrulanmış engellilik progresyon oranı | 0,271 | 0,164 ** | 0,169 | 0,128 | 0,156 |
Risk oranı (%95 GA) |
| 0,62 (0,44, 0,87) |
| 0,79 (0,52, 1,19) | 0,93 (0,63, 1,37) |
24 haftalık doğrulanmış engellilik progresyon oranı | 0,169 | 0,128# | 0,125 | 0,078# | 0,108# |
Risk oranı (%95 GA) |
| 0,77 (0,52, 1,14) |
| 0,62 (0,37, 1,03) | 0,87 (0,55, 1,38) |
MRI Sonlanım Noktaları |
|
|
|
|
|
Hasta sayısı | 165 | 152 | 144 | 147 | 161 |
2 yılda yeni gelişen veya gelişmekte olan T2 lezyonlarının ortalama (medyan) sayısı | 16,5 (7,0) | 3,2 (1,0)*** | 19,9 (11,0) | 5,7 (2,0)*** | 9,6 (3,0)*** |
Ortalama lezyon oranı (%95 GA) |
| 0,15 (0,10, 0,23) |
| 0,29 (0,21, 0,41) | 0,46 (0,33, 0,63) |
2 yılda Gd lezyonların ortalama (medyan) sayısı | 1,8 (0) | 0,1 (0)*** | 2,0 (0,0) | 0,5 (0,0)*** | 0,7 (0,0)** |
Risk oranı (%95 GA) |
| 0,10 (0,05, 0,22) |
| 0,26 (0,15 , 0,46) | 0,39 (0,24, 0,65) |
2 yılda yeni T1 hipointens lezyonlarının ortalama (medyan) sayısı | 5,7 (2,0) | 2,0 (1,0)*** | 8,1 (4,0) | 3,8 (1,0)*** | 4,5 (2,0)** |
Lezyon ortalama oranı (%95 GA) |
| 0,28 (0,20, 0,39) |
| 0,43 (0,30, 0,61) | 0,59 (0,42, 0,82) |
*P-değeri <0,05; **P-değeri <0,01; ***P-değeri <0,0001; #istatistiksel açıdan anlamlı değil
Kontrolsüz 8 yıllık bir uzatma çalışmasına (ENDORSE), pivot çalışmalardan (DEFINE ve CONFIRM) 1.736 uygun RRMS hastasını kaydetmiştir. Çalışmanın birincil amacı, RRMS'li hastalarda TECFİDERA'nın uzun vadeli güvenliğini değerlendirmekti. 1.736 hastanın yaklaşık yarısı (909, %52) 6 yıl veya daha uzun süre tedavi görmüştür. 3 çalışmanın tamamında 501 hasta sürekli olarak günde iki kez 240 mg TECFİDERA ile tedavi edildi ve daha önce DEFINE ve CONFIRM çalışmalarında plasebo ile tedavi edilen 249 hasta,
ENDORSE çalışmasında günde iki kez 240 mg tedavi aldı. Sürekli olarak günde iki kez tedavi alan hastalar 12 yıla kadar tedavi edildi.
ENDORSE çalışması sırasında, günde iki kez 240 mg TECFİDERA ile tedavi edilen tüm hastaların yarısından fazlasında nüks olmadı. 3 çalışmanın tamamında sürekli olarak günde iki kez tedavi edilen hastalar için, ayarlanmış ARR, DEFINE ve CONFIRM çalışmalarında
0.187 (95% GA: 0.156, 0.224) ve ENDORSE çalışmasında 0.141 (95% GA: 0.119, 0.167) 'dir.
Daha önce plasebo ile tedavi edilen hastalar için, DEFINE ve CONFIRM çalışmalarında 0,330 olan düzeltilmiş ARR (95% GA: 0.266, 0.408), ENDORSE çalışmasında 0,149 (95% GA: 0.116, 0.190)'a düşmüştür.
ENDORSE çalışmasında, hastaların çoğu (> %75) sakatlığın ilerlemesini doğrulamamıştır (6 aylık kalıcı sakatlık ilerlemesi olarak ölçülmüştür). Üç çalışmadan elde edilen havuzlanmış sonuçlar, TECFİDERA ile tedavi edilen hastaların, ENDORSE genelinde ortalama EDSS puanlarında hafif bir artış ile tutarlı ve düşük doğrulanmış engellilik ilerleme oranlarına sahip olduğunu göstermiştir. MRI değerlendirmeleri (6 yıla kadar, daha önce DEFINE ve CONFIRM çalışmalarının MRI kohortuna dahil edilmiş 752 hasta dahil olmak üzere) hastaların çoğunluğunda (yaklaşık %90) Gd'yi artıran lezyonları olmadığını göstermiştir.
6 yıl boyunca, yeni veya yeni genişleyen T2 ve yeni T1 lezyonlarının yıllık düzeltilmiş ortalama sayısı düşük kalmıştır.
Yüksek hastalık aktivitesi gösteren hastalarda etkililik
3 aylık uzamış engellilik progresyonuna kadar geçen zamana etkisi net bir şekilde belirlenmemişken, yüksek hastalık aktivitesine sahip bir hasta alt grubunda nüksler üzerine uygun bir tedavi etkisi gözlenmiştir. Çalışmaların dizaynı nedeni ile, yüksek hastalık aktivitesi aşağıdaki şekilde tanımlanmıştır:
5.2. Farmakokinetik özellikler
Oral olarak uygulanan dimetil fumarat esterazlar tarafından presistemik olarak hızlıca hidrolize uğrar ve aktif olan monometil fumarat adlı primer metabolitine dönüştürülür. Dimetil fumarat, TECFİDERA'nın oral olarak alınmasından sonra plazmada ölçülemez. Bu nedenle dimetil fumarat ile ilgili tüm farmakokinetik analizler plazma monometil fumarat konsantrasyonlarıyla gerçekleştirilmiştir. Farmakokinetik veriler, multipl sklerozlu ve sağlıklı gönüllülerden oluşan deneklerden elde edilmiştir.
Emilim:
Monometil fumaratın Tdeğeri 2 ila 2,5 saattir. TECFİDERA, enterik sert kapsül, enterik bir kaplama tarafından korunan mikrotabletler içerdiğinden, emilim kapsüller mideyi terk edene kadar başlamaz (genellikle 1 saatten az). Günde iki kez yiyeceklerle birlikte alınan 240 mg'in ardından, multipl sklerozlu deneklerde medyan pik (C) 1,72 mg/L ve genel eğri altındaki alan (EAA) maruziyet 8,02 saat.mg/L olmuştur. Genel olarak, çalışılan doz aralığında (120 mg ila 360 mg) Cve EAA, yaklaşık olarak dozla orantılı şekilde artmıştır. Multipl sklerozlu hastalarda, iki 240 mg'lık doz bir günlük doz rejimi olarak 4 saat arayla günde üç kez uygulanmıştır. Bu durum, hiçbir güvenlik önlemi olmaksızın günde iki kez uygulanan dozlamaya kıyasla %12'lik medyan C'ında bir artış sağlayarak maruziyetin minimum birikimi ile sonuçlanmıştır (günde üç kez yapılan uygulama için 1,93 mg/L'ye karşı, günde iki kez yapılan uygulama için 1,72 mg/L).
Yiyecek, dimetil fumaratın maruziyeti üzerine klinik açıdan bir etki göstermemektedir. Bununla birlikte, TECFİDERA kızarma veya gastrointestinal advers olaylar ile ilgili gelişmiş tolere edilebilirlik nedeni ile yiyeceklerle birlikte alınmalıdır (bkz. Bölüm 4.2).
Dağılım:
240 mg dimetil fumaratın oral yolla alınmasının ardından görülen dağılım hacmi 60 L ve 90 L arasında değişmektedir. Monometil fumaratın insan plazma proteinine bağlanma oranı genelde %27 ile %40 arasındadır.
Biyotransformasyon:
İnsanlarda, dimetil fumarat büyük ölçüde metabolize olup %0,1'den azı idrarda değişmemiş olarak atılmaktadır. Dimetil fumarat, sistemik dolaşıma ulaşmadan önce ilk olarak gastrointestinal kanal, kan ve dokularda bulunan esterazlarla metabolize olur. Başka bir metabolizma, sitokrom P450 (CYP) sisteminin dahil olmadığı, trikarboksilik asit döngüsü
aracılığı ile meydana gelmektedir. Tek bir 240 mg C-dimetil fumarat dozu ile yapılan çalışmada, glukoz insan plazmasındaki baskın metabolit olarak tanımlanmıştır. Dolaşımdaki diğer metabolitleri fumarik asit, sitrik asit ve monometil fumarattır. Fumarik asitin daha sonra metabolizması trikarboksilik asitten CO'in uzaklaştırılması ile olur ve bu eliminasyonun primer yoludur.
Eliminasyon:
COuzaklaştırılması, dozun %60'ının eliminasyonundan sorumlu olan primer dimetil fumarat eliminasyon yoludur. Renal ve fekal eliminasyon, sırasıyla dozun %15,5'i ve %0,9'unu elimine eden sekonder eliminasyon yollarıdır.
Monometil fumaratın terminal yarı ömrü kısadır (yaklaşık 1 saat) ve monometil fumarat bireylerin çoğunda 24 saatte dolaşımda kalmaz. Terapötik rejimde çoklu dimetil fumarat dozları ile ana ilaç veya monometil fumarat birikimi meydana gelmez.
Doğrusallık/Doğrusal olmayan durum:
Tek ve çoklu 120 mg ve 360 mg'lık doz aralığında çalışılmış olan dimetil fumaratın maruziyeti, dozla orantılı bir biçimde artmaktadır.
Özel hasta gruplarındaki farmakokinetik özellikler
Varyans Analizi (ANOVA) bulgularına dayalı olarak, RRMS hastalarında maruziyetin ana orta değişkeni (Cve EAA'ya göre) vücut ağırlığıdır. Ancak klinik çalışmalarda değerlendirilen güvenlilik ve etkililik ölçümlerini etkilememiştir.
Cinsiyet ve yaş, dimetil fumaratın farmakokinetik özellikleri üzerine klinik açıdan önemli bir etki göstermemiştir. 65 yaş ve üzeri hastalarda farmakokinetik özellikler çalışılmamıştır.
Pediyatrik popülasyon
Günde iki kez 240 mg kullanılan dimetil fumaratın farmakokinetik profili, RRMS'li 13-17 yaş arası pediyatrik hastada yapılan küçük, açık uçlu, kontrolsüz bir çalışmada değerlendirilmiştir (n=21). TECFİDERA'nın bu adolesan hastalardaki farmakokinetiği daha öncesinde yetişkin hastalarda gözlenenler ile tutarlıdır. (C: 2,00±1,29 mg/l; EAA: 3,62±1,16 sa.mg/l, tam bir günlük EAA: 7,24 sa.mg/l'ye denk gelen).
Böbrek yetmezliği:
Renal yolak, dimetil fumarat için uygulanan dozun %16'sından azının atıldığı sekonder bir eliminasyon yolu olduğundan, böbrek yetmezliği olan bireylerde farmakokinetik özellikleri değerlendirilmemiştir.
Karaciğer yetmezliği
Dimetil fumarat ve monometil fumarat, CYP450 sistemi dahil olmadan esterazlar tarafından metabolize edildiğinden, karaciğer bozukluğu olan bireylerde farmakokinetik özellik değerlendirmesi yürütülmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Aşağıdaki toksikoloji ve üreme toksisitesi bölümlerinde açıklanan advers reaksiyonlar, klinik
çalışmalarda gözlenmemiştir. Ancak klinik maruziyet düzeylerine benzer maruziyet düzeylerinde hayvanlarda görülmüştür.
Mutajenezis:
Dimetil fumarat ve monometil fumarat bir seri in vitro testte negatif sonuç vermiştir (Ames, memeli hücrelerinde kromozomalsapma ). Dimetil fumarat sıçanlarda in vivo mikroçekirdek testinde negatif sonuç vermiştir.
Karsinojenezis:
Dimetil fumaratın karsinojenite çalışmaları, fare ve sıçanlarda 2 yıla varan bir süre boyunca gerçekleştirilmiştir. Dimetil fumarat farelere 25, 75, 200 ve 400 mg/kg/gün ve sıçanlara 25, 50, 100 ve 150 mg/kg/gün'lük dozlarda oral yolla uygulanmıştır. Farelerde, önerilen insan dozuna eşdeğer maruziyette (EAA) 75 mg/kg/gün dozunda renal tübüler karsinom insidansı artmıştır. Sıçanlarda, renal tübüler karsinom ve testiküler Leydig hücre adenomu insidansı, önerilen insan dozundan yaklaşık 2 kat daha yüksek, 100 mg/kg/gün'de artmıştır.Bu bulguların insandaki risk ile ilişkisi bilinmemektedir.
Farelerde, önerilen insan dozu ile eşdeğer maruziyette ve sıçanlarda önerilen insan dozu maruziyetinin altında, nonglandüler midede (ön mide) skuamöz hücre papilloma ve karsinomu insidansı artmıştır (EAA baz alınarak). Kemirgenlerdeki ön midenin insanlarda bir karşılığı yoktur.
Toksikoloji:
Kemirgenlerde, tavşanlarda ve maymunlarda oral gavaj yoluyla uygulanan dimetil fumarat süspansiyonu (%0,8 hidroksipropil metilselülozda dimetil fumarat) ile klinik dışı çalışmalar yürütülmüştür. Kronik köpek çalışması, dimetil fumarat kapsülün oral yolla uygulanmasıyla gerçekleştirilmiştir.
Farelerde, sıçanlarda, köpeklerde ve maymunlarda dimetil fumaratın tekrarlı şekilde oral alınmasından sonra böbrek üzerinde etkiler gözlenmiştir. Hasarı düşündüren renal tübül epitelyum rejenerasyonu tüm türlerde gözlenmiştir. Renal tübüler hiperplazisi yaşam boyu dozlama ile (2 yıllık çalışma) sıçanlarda gözlenmiştir. 11 ay boyunca dimetil fumaratın günlük oral dozlarını alan köpeklerde kortikal atrofi için hesaplanan marj, EAA'ya dayalı olarak önerilen dozun 3 katında gözlenmiştir. 12 ay boyunca dimetil fumaratın günlük oral dozlarını alan maymunlarda tek hücre nekrozu, EAA'ya dayalı olarak önerilen dozun 2 katında gözlenmiştir. İnterstisyel fibrozis ve kortikal atrofi, EAA'ya dayalı olarak önerilen dozun 6 katında gözlenmiştir. Bu bulguların insanlarla ilişkisi bilinmemektedir.
Testislerdeki seminiferöz epitelin dejenerasyonu sıçanlarda ve köpeklerde görülmüştür. Bulgular sıçanlarda yaklaşık olarak önerilen dozda ve köpeklerde önerilen dozun 3 katında (EAA'ya dayalı olarak) gözlenmiştir. Bu bulguların insanlarla ilişkisi bilinmemektedir.
3 ay ya da daha uzun süreli çalışmalarda, farelerin ve sıçanların ön midesinde skuamöz epitel hiperplazisi ve hiperkeratozu; inflamasyonu ve skuamöz hücre papilloma ve karsinomu olduğu gözlenmiştir. Fare ve sıçanlardaki ön midenin insanlarda bir karşılığı yoktur.
Üreme toksisitesi:
Çiftleşme öncesinde veya sırasında 75, 250 ve 375 mg/kg/gün'de erkek sıçanlara oral dimetil fumarat uygulaması, test edilen en yüksek doza kadar (EAA'ya dayalı olarak önerilen dozun en az 2 katı) erkek fertilitesi üzerine etki göstermemiştir. Çiftleşme öncesinde ve sırasında ve gebeliğin 7. gününe kadar devam eden 25, 100 ve 250 mg/kg/gün'de dişi sıçanlara oral dimetil fumarat uygulaması, 14 günlük östrus evresi sayısını azaltmış ve test edilen en yüksek dozda (EAA'ya dayalı olarak önerilen dozun 11 katı) uzamış diöstrus gözlenen hayvan sayısını arttırmıştır. Bununla birlikte, bu değişimler fertiliteyi veya oluşan canlı fetüs sayısını etkilememiştir.
Sırasıyla 0,48 ila 0,64 ve 0,1'lik fetal/maternal plazma konsantrasyonu oranları ile dimetil fumaratın sıçanlarda ve tavşanlarda plasenta membranından geçerek fetal kana karıştığı gösterilmiştir. Sıçanlarda veya tavşanlarda uygulanan herhangi bir dimetil fumarat dozunda hiçbir malformasyon gözlenmemiştir. Organogenez dönemi boyunca gebe sıçanlara 25, 100 ve 250 mg/kg/gün'lük oral dozlarda yapılan dimetil fumarat uygulaması EAA'ya dayalı olarak önerilen dozun 4 katında maternal advers etkilere yol açmış ve EAA'ya dayalı olarak önerilen dozun 11 katında düşük fetüs ağırlığına ve gecikmiş osifikasyona (metatarsallar ve arka bacak falenksleri) neden olmuştur. Daha düşük fetüs ağırlığı ve gecikmiş osifikasyon maternal toksisiteye (azalmış vücut ağırlığı ve gıda tüketimi) sekonder kabul edilmiştir.
Organogenez sırasında gebe tavşanlara 25, 75 ve 150 mg/kg/gün'lük oral dozlarda yapılan dimetil fumarat uygulaması, embriyo-fetal gelişim üzerine etki göstermemiştir. EAA'ya dayalı olarak önerilen dozun 7 katında azalmış maternal vücut ağırlığına neden olmuş ve önerilen dozun 16 katında da düşük artışına yol açmıştır.
Jüvenil sıçanlarda, doğum sonrası (PND) 28. günden PND 90 ila 93'e kadar (insanlarda yaklaşık 3 yaş ve üzerindekilere eşdeğer) günlük oral dimetil fumarat uygulaması ile yapılan iki toksisite çalışması, yetişkin hayvanlarda gözlenene benzer şekilde böbrek ve ön midede benzer hedef organ toksisitelerini ortaya çıkarmıştır. İlk çalışmada, dimetil fumarat, 140 mg/kg/günlük en yüksek doza kadar gelişimi, nörodavranışı veya erkek ve kadın doğurganlığını etkilememiştir (pediyatrik hastalarda sınırlı EAA verilerine göre önerilen insan dozunun yaklaşık 4.6 katı). Benzer şekilde, erkek jüvenil sıçanlarda yapılan ikinci çalışmada (önerilen pediyatrik dozda varsayılan EAA'nın yaklaşık 15 katı) en yüksek 375 mg/kg/gün dimetil fumarat dozuna kadar erkek üreme ve aksesuar organları üzerinde hiçbir etki gözlenmemiştir. Bununla birlikte, erkek jüvenil sıçanlarda femur ve lomber vertebralarda azalmış kemik mineral içeriği ve yoğunluğu belirgindi. İn vivo olarak aynı aktif metabolit monometil fumarata metabolize olan başka bir fumarik ester olan oral diroksimel fumarat uygulamasını takiben jüvenil sıçanlarda kemik dansitometrisi değişiklikleri de gözlenmiştir. Jüvenil sıçanlarda dansitometri değişiklikleri için NOAEL, önerilen pediyatrik dozda
varsayılan EAA'nın yaklaşık 1.5 katıdır. Kemik etkilerinin daha düşük vücut ağırlığı ile ilişkisi mümkündür, ancak doğrudan bir etkinin dahil edilmesi göz ardı edilemez. Kemik bulguları yetişkin hastalar için sınırlı bir öneme sahiptir. Pediyatrik hastalar için alaka düzeyi bilinmemektedir.
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ GENEL BİLGİLERİ
Gen İlaç Ve Sağlık Ürünleri San. Ve Tic. Ltd. Sti.
| Geri Ödeme Kodu | A16055 |
| Satış Fiyatı | 10488.23 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 10488.23 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699783160029 |
| Etkin Madde | Dimetil Fumarat |
| ATC Kodu | L04AX07 |
| Birim Miktar | 240 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |