TICASA 60 mg film KAPLT tablet (56 tablet) Farmakolojik Özellikler
{ Tikagrelor }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Trombosit agregasyon inhibitörleri (Heparin hariç) ATC kodu: B01AC24
Etki mekanizması:
Tikagrelor, oral, doğrudan etkili, P2Y12 reseptörüne selektif ve geri dönüşümlü olarak bağlanan ve ADP-aracılı P2Y12'ye bağımlı trombosit aktivasyonunu ve agregasyonunu engelleyen, siklopentiltriazolopirimidin (SPTP) kimyasal sınıfının bir üyesi olan tikagrelor içermektedir. Tikagrelor ADP'nin bağlanmasını engellemez; ancak P2Y12 reseptörüne bağlandığı zaman ADP-uyarılı sinyal iletimini engeller. Trombositler aterosklerotik hastalığın trombotik komplikasyonlarının başlaması ve/veya gelişmesinde yer aldıklarından, trombosit fonksiyon inhibisyonunun ölüm, Mİ veya inme gibi KV olay riskini azalttığı gösterilmiştir.
Tikagrelor aynı zamanda, dengeleyici nükleozit taşıyıcısı-1'i (ENT-1) inhibe ederek lokal endojen adenozin düzeylerini de artırır.
Tikagrelorun sağlıklı gönüllülerde ve AKS hastalarında adenozin kaynaklı aşağıdaki etkileri güçlendirdiği belirlenmiştir: vazodilatasyon (sağlıklı gönüllülerde ve AKS hastalarında koroner kan akışı artışları ile ölçülür; baş ağrısı), trombosit fonksiyonu inhibisyonu (in vitro koşullarda insan tam kanında) ve dispne. Bununla birlikte, adenozinde gözlenen artışlar ve klinik sonuçlar (örn., morbidite-mortalite) arasındaki bağ henüz tam olarak açıklığa kavuşturulmuş değildir.
Farmakodinamik etkiler:
Etkinin başlaması
Tikagrelor için 180 mg yükleme dozundan 0,5 saat sonra yaklaşık %41'lik ortalama trombosit agregasyon inhibisyonu (TAİ) değeri ile gösterildiği üzere, ASA tedavisi görmekte olan stabil koroner arter hastalığı (KAH) olan hastalarda tikagrelor hızlı bir farmakolojik etki başlangıcı gösterir; %89'luk maksimum TAİ etkisi dozdan 2-4 saat sonra ortaya çıkar ve 2-8 saat arasında sürer. Hastaların %90'ında son uzatılmış TAİ, dozdan 2 saat sonra >%70 olmuştur.
Etkinin sonlanması
Eğer bir KABG prosedürü planlanıyorsa, tikagrelorun prosedürden önce 96 saatten daha kısa bir süre içerisinde kesilmesi durumunda tikagrelor kanama riski klopidogrele göre artmaktadır.
Geçiş verileri
Klopidogrel 75 mg'dan günde iki kez tikagrelor 90 mg'a geçiş, %26,4 mutlak TAİ artışı ile sonuçlanır ve tikagrelordan klopidogrele geçiş %24,5 mutlak TAİ azalması ile sonuçlanır. Hastalar antitrombositik etkide herhangi bir kesinti olmaksızın klopidogrelden tikagrelore geçebilir (bkz. Bölüm 4.2).
Klinik etkililik ve güvenlilik:
Tikagrelorun etkililiği ve güvenliliği için klinik bulgular üç faz 3 çalışmasından elde edilmiştir:
PLATO [PLATelet Inhibition and Patient Outcomes] çalışması, her ikisi de ASA ve diğer standart tedavi ile kombinasyon halinde verilen tikagrelorun klopidogrel ile karşılaştırılması
PEGASUS TIMI-54 [PrEvention with TicaGrelor of SecondAry Thrombotic Events in HighRiSk AcUte Coronary Syndrome Patients] çalışması, ASA ile kombinasyon halinde tikagrelor tedavisinin tek başına ASA tedavisi ile karşılaştırılması
THEMIS çalışması KAH ve tip 2 DM'li hastalarda tek başına ASA tedavisine kıyasla düşük doz ASA (75-150 mg) ile kombinasyon halinde verilen tikagrelor tedavisi ile karşılaştırılması
PLATO çalışması (Akut Koroner Sendromlar)
PLATO çalışmasına stabil olmayan anjina (UA), ST yükselmesiz Mİ (NSTEMI) veya ST yükselmeli Mİ (STEMI) semptomları başladıktan sonraki 24 saat içerisinde gelen ve ilk tedavisi medikal veya PKG ya da KABG olan 18.624 hasta dahil edilmiştir.
Klinik etkililik
Arka plan tedavisi olarak günde bir kez ASA kullanıldığında, günde iki kez tikagrelor 90 mg, KV ölüm, Mİ veya inmeden oluşan bileşik sonlanım noktasını önlemede günde bir kez 75 mg klopidogrele göre üstünlük göstermiş, oluşan farka ise KV ölüm ve Mİ sebebiyet vermiştir. Hastalar 300 mg klopidogrel yükleme dozu (PKM varsa 600 mg olması mümkündür) veya 180 mg tikagrelor dozu almıştır.
Bu sonuç erken dönemde ortaya çıkmış (30 günde mutlak risk azalması [MRA] %0,6 ve nispi risk azalması [NRA] %12), 12 aylık dönemin tamamında sabit bir tedavi etkisi söz konusu olmuş, %16'lık NRA ile yıl başına %1,9 MRA verimini sağlamıştır. Bu bulgu, hastaların 12 ay süreyle günde iki kez tikagrelor 90 mg ile tedavisinin uygun olduğunu düşündürmektedir (bkz. Bölüm 4.2). 54 AKS hastasının klopidogrel yerine tikagrelor ile tedavi edilmesi 1 aterotrombotik olayı önleyecektir; 91 hastanın tedavisi ile bir KV ölüm önlenecektir (bkz. Şekil 1 ve Tablo 3).
Tikagrelorun, klopidogrele üstün olan tedavi edici etkisi vücut ağırlığı; cinsiyet; DM, geçici iskemik atak veya hemorajik olmayan inme veya revaskülarizasyon dahil tıbbi öykü; heparinler, GpIIb/IIIa inhibitörleri ve proton pompa inhibitörlerini içeren eşzamanlı tedaviler (bkz. Bölüm 4.5); son indeks olay tanısı (STEMI, NSTEMI veya UA); ve randomizasyonda hedeflenen tedavi yolağı (invazif veya medikal) dahil bir çok alt grup arasında tutarlı olmuştur.
Bölge ile zayıf anlamlılığa sahip bir tedavi etkileşimi gözlenmiş olup bunun neticesinde birincil sonlanım noktasının risk oranı (RO), dünyanın geri kalanında tikagrelor lehine iken incelenen toplam popülasyonun yaklaşık %10'unu temsil eden Kuzey Amerika'da klopidogrel lehinedir (etkileşim p-değeri=0,045). Keşif amaçlı analizler ASA dozu ile olası bir etkileşim akla getirmektedir: Artan ASA dozları ile tikagrelorda azalan etkililik gözlenmiştir. TİCASA ile verilecek kronik günlük ASA dozları 75-150 mg olmalıdır (bkz. Bölüm 4.2 ve Bölüm 4.4).
Şekil 1'de bileşik etkililik sonlanım noktasında herhangi bir olayın ilk meydana gelmesine ait riskin tahmini gösterilmektedir.
Şekil 1 â KV ölüm, Mİ ve inmenin birincil klinik bileşik sonlanım noktası analizi (PLATO)
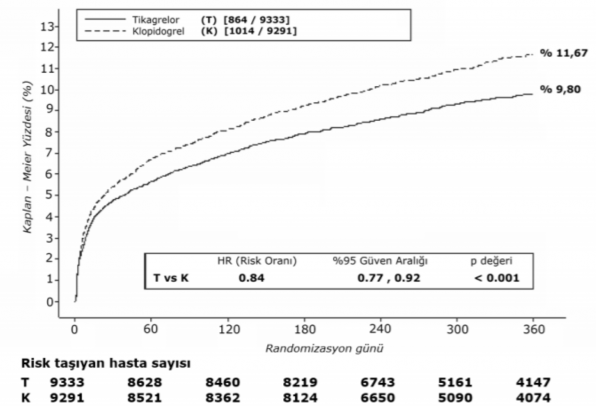
Tikagrelor hem UA/NSTEMI hem de STEMI popülasyonunda (Tablo 3) klopidogrel ile karşılaştırıldığında birincil bileşik sonlanım noktasının oluşma oranını azaltmıştır. Dolayısıyla, medikal tedavi gören hastalar ve perkutan koroner müdahale (PKM) ya da koroner bypass grefti (KABG) ile tedavi edilen hastalar dahil olmak üzere AKS hastalarında (stabil olmayan anjina, ST yükselmesiz Miyokard İnfarktüsü [NSTEMI] ve ST yükselmeli Miyokard İnfarktüsü [STEMI]) düşük doz ASA ile birlikte günde iki kez TİCASA 90 mg kullanılabilir.
Tablo 4 â Birincil ve ikincil etkililik sonlanım noktalarının analizi (PLATO)
| Günde iki kez tikagrelor 90 mg (% olay yaşayan hasta yüzdesi) N=9333 | Günde bir kez klopidogrel 75 mg (% olay yaşayan hasta yüzdesi) N=9291 | MRA (%/yıl) | NRA (%) (%95 GA) | p-değeri |
KV ölüm, Mİ (sessiz Mİ hariç) veya inme | 9,3 | 10,9 | 1,9 | 16 (8, 23) | 0,0003 |
İnvazif müdahale | 8,5 | 10,0 | 1,7 | 16 (6, 25) | 0,0025 |
Medikal müdahale | 11,3 | 13,2 | 2,3 | 15 (0,3, 27) | 0,0444 |
KV Ölüm | 3,8 | 4,8 | 1,1 | 21 (9, 31) | 0,0013 |
Mİ (sessiz Mİ hariç) | 5,4 | 6,4 | 1,1 | 16 (5, 25) | 0,0045 |
1,3 |
Tüm nedenlere bağlı ölüm, Mİ (sessiz Mİ hariç) veya inme | 9,7 | 11,5 | 2,1 | 16 (8, 23) | 0,0001 |
KV ölüm, toplam Mİ, inme, CRİ, Rİ, GİA veya diğer ATO | 13,8 | 15,7 | 2,1 | 12 (5, 19) | 0,0006 |
Tüm nedenlere bağlı ölüm | 4,3 | 5,4 | 1,4 | 22 (11, 31) | 0,0003 |
Belirli stent trombozu | 1,2 | 1,7 | 0,6 | 32 (8, 49) | 0,0123 |
PLATO genetik alt çalışması
PLATO çalışmasında 10285 hastanın CYP2C19 ve ABCB1 genotiplerinin belirlenmesi, genotip grupları ile PLATO sonuçları arasındaki ilişkileri göstermiştir. Majör KV olayları azaltmada tikagrelorun klopidogrele üstünlüğü, hasta CYP2C19 veya ABCB1 genotipinden anlamlı derecede etkilenmemiştir. Genel olarak PLATO çalışmasına benzer şekilde, toplam PLATO Majör kanama, CYP2C19 veya ABCB1 genotipinden bağımsız olarak tikagrelor ve klopidogrel arasında farklılık göstermemiştir. KABG olmayan PLATO Majör kanama, bir veya daha fazla CYP2C19 işlev kaybı alleline sahip hastalarda klopidogrel ile karşılaştırıldığında tikagrelor ile artmıştır fakat işlev kaybı alleli olmayan hastalarda klopidogrel ile benzer olmuştur.
Kombine etkililik ve güvenlilik bileşimi
Kombine etkililik ve güvenlilik bileşimi (KV ölüm, Mİ, inme veya PLATO tanımlı âToplam Majörâ kanama), klopidogrel ile karşılaştırıldığında tikagrelorun etkililiğindeki faydanın, AKS'den sonraki 12 ayda majör kanama olayları ile dengelenmediğini göstermektedir (MRA
%1,4, NRA %8, RO 0,92; p=0,0257).
Klinik güvenlilik
Holter alt çalışması
PLATO çalışması sırasında ventriküler duraklamaların ve diğer aritmik epizotların ortaya çıkışını incelemek üzere araştırmacılar yaklaşık 3000 hastadan oluşan bir alt grupta Holter izlemi yapmıştır; bu hastaların yaklaşık 2000'nininde hem AKS'lerinin akut fazında hem de bir ay sonrasında kayıtlar mevcuttur. İncelenen ana değişken ≥3 saniyelik ventriküler duraklamaların meydana gelmesi olmuştur. Akut fazla klopidogrel (%3,5) ile karşılaştırıldığında tikagrelor (%6,0) ile daha fazla hastada ventriküler duraklamalar olmuştur; ve 1 ay sonrasında sırasıyla %2,2 ve %1,6 olmuştur (bkz. Bölüm 4.4). AKS'nin akut fazında ventriküler duraklamalardaki artış, KKY öyküsü olan tikagrelor hastalarında daha belirgin
olmuştur (KKY öyküsü olmayan hastalarda %9,2'ye karşın %5,4; klopidogrel hastaları için,
%4,0'a karşın KKY öyküsü olmayan hastalarda %3,6'dır). Bu dengesizlik bir ayda meydana gelmemiştir: tikagrelor hastalarında KKY öyküsü olan ve olmayanlarda sırasıyla %2,0'a karşın
%2,1 ve klopidogrel ile %3,8'e karşın %1,4'tür. Bu hasta popülasyonunda bu dengesizlik ile ilişkili advers klinik sonuçlar söz konusu olmamıştır (pacemaker yerleştirilmesi durumları dahil).
PEGASUS Çalışması (Miyokard İnfarktüsü Öyküsü)
PEGASUS TIMI-54 çalışması, Mİ öyküsü ve aterotromboz açısından ek risk faktörleri olan hastalarda tek başına ASA tedavisi ile karşılaştırıldığında düşük doz ASA (75-150 mg) ile kombinasyon halinde 2 doz şeklinde (ya günde iki kez 90 mg ya da günde iki kez 60 mg) verilen tikagrelor ile aterotrombotik olayların önlenmesini değerlendiren 21162 hastalı, olayların yön verdiği, randomize, çift kör, plasebo kontrollü, paralel gruplu, uluslararası çok merkezli bir çalışmadır.
50 yaş veya üzeri, Mİ öyküsü (randomizasyondan 1 ila 3 yıl önce) ve aşağıdaki aterotromboz risk faktörlerinden en azından birine sahip hastalar çalışmaya katılım açısından uygun bulunmuştur: ≥65 yaş, ilaç tedavisi gerektiren diabetes mellitus, önceden geçirilmiş ikinci bir Mİ, çoklu damar KAH bulgusu veya son evre olmayan kronik böbrek yetmezliği.
Hastalar şu durumlarda çalışmaya katılım açısından uygunsuz bulunmuştur: Çalışma süresince P2Y12 reseptör antagonisti, dipiridamol, silostazol veya antikoagülan tedavisi planlanmışsa; pıhtılaşma bozukluğu varsa veya iskemik inme veya intrakraniyal kanama öyküsü varsa, santral sinir sistemi tümörü veya bir intrakraniyal vasküler anomali varsa; önceki 6 ay içinde gastrointestinal kanamaları olmuşsa veya önceki 30 gün içinde majör ameliyat geçirmişlerse.
Klinik etkililik
Şekil 2 â KV ölüm, Mİ ve inmenin birincil klinik bileşik sonlanım noktası analizi (PEGASUS)
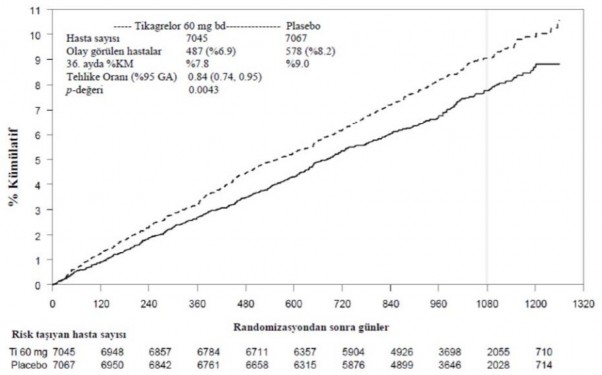
Tablo 5 â Birincil ve İkincil Etkililik Sonlanım Noktalarının Analizi (PEGASUS)
| Günde iki kez tikagrelor 60 mg +ASA N = 7045 | Tek başına ASA N = 7067 | p-değeri | |||
Özellikler | Olay görülen hastalar | KM % | TO (95% GA) | Olay görülen hastalar | KM % | |
Birincil sonlanım noktası | ||||||
KV | 487 | %7,8 | 0,84 | 578 | %9,0 | 0,0043 (s) |
ölüm/Mİ/İnme | (%6,9) |
| (0,74, 0,95) | (%8,2) |
|
|
bileşimi |
|
|
|
|
|
|
KV ölüm | 174 (%2,5) | %2,9 | 0,83 | 210 | %3,4 | 0,0676 |
|
|
| (0,68, 1,01) | (%3,0) |
|
|
Mİ | 285 (%4,0) | %4,5 | 0,84 | 338 | %5,2 | 0,0314 |
|
|
| (0,72, 0,98) | (%4,8) |
|
|
İnme | 91 (%1,3) | %1,5 | 0,75 | 122 | %1,9 | 0,0337 |
|
|
| (0,57, 0,98) | (%1,7) |
|
|
İkincil sonlanım noktası | ||||||
KV ölüm | 174 | %2,9 | 0,83 | 210 | %3,4 | - |
| (%2,5) |
| (0,68, 1,01) | (%3,0) |
|
|
Tüm nedenlere | 289 | %4,7 | 0.89 | 326 | %5,2 | - |
bağlı mortalite | (%4,1) |
| (0,76, 1,04) | (%4,6) |
|
|
RO ve p-değerleri, tek açıklayıcı değişken olarak tedavi grubu ile Cox orantısal risk modelinden hareketle tek başına ASA tedavisine karşın tikagrelor için ayrı ayrı hesaplanır.
36. ayda hesaplanan Kaplan-Meier yüzdesi.
Not: KV ölüm, Mİ ve İnme bileşenleri için ilk olayların sayısı her bir bileşen için ilk olayların gerçek sayısı olup, bileşik sonlanım noktasındaki olay sayısına ilave edilmez.
(s) İstatistiksel anlamı belirtir. GA=Güven aralığı; KV=Kardiyovasküler;
![]()
RO= Risk oranı; KM=Kaplan-Meier; Mİ=Miyokard infarktüsü; N=Hasta sayısı
ASA ile kombinasyon halinde hem günde iki kez 60 mg hem de günde iki kez 90 mg tikagrelor rejimleri çalışma periyodu boyunca tutarlı bir tedavi etkisi ile aterotrombotik olayların önlenmesinde (bileşik sonlanım noktası: KV ölüm, Mİ ve inme) tek başına ASA'dan üstün olup, tikagrelor 60 mg için %16 nispi risk azalması (NRA) ve %1,27 mutlak risk azalması (MRA) ve tikagrelor 90 mg için %15 NRA ve %1,19 MRA değerlerini vermektedir.
90 mg ve 60 mg'ın etkililik profili benzer olmasına rağmen, daha düşük dozun kanama ve dispne riski ile ilişkili olarak daha iyi güvenlilik profiline ve tolerabiliteye sahip olduğuna dair kanıtlar bulunmaktadır. Bunedenle,ASAile birlikteyalnızca günde iki kez uygulanan
tikagrelor 60 mg Mİ öyküsü olan ve aterotrombotik olay gelişimi açısından yüksek risk taşıyan hastalarda aterotrombotik olayların (KV ölüm, Mİ ve inme) önlenmesi için önerilmektedir.
Tek başına ASA'ya göre günde iki kez tikagrelor 60 mg KV ölüm, Mİ ve inme birincil bileşik sonlanım noktasını anlamlı olarak azaltır. Bileşenlerin her biri birincil bileşik sonlanım noktasında azalmaya katkıda bulunmuştur (KV ölüm %17 NRA, Mİ %16 NRA ve inme %25 NRA).
Birinci günden 360. güne kadar (%17 NRA) ve 361 gün ve sonrasındaki (%16 NRA) bileşik sonlanım noktası NRA'ları benzerdir. Uzatılmış tedaviden 3 yıl sonrasında tikagrelore ait etkililik ve güvenlilik verileri sınırlıdır.
Mİ'den sonra 2 yıldan fazla bir sürede klinik olarak stabil olan hastalarda veya önceki ADP reseptör inhibitörü tedavisi bırakıldıktan sonra bir yıldan fazla süre geçtiğinde günde iki kere tikagrelor 60 mg uygulandığında fayda olduğu yönünde kanıt söz konusu olmamıştır (KV ölüm, Mİ ve inmede birincil bileşik sonlanım noktasında azalma yoktur: ancak majör kanamada artış vardır (ayrıca bkz. Bölüm 4.2.).
Klinik güvenlilik
Kanama ve dispne nedeniyle tikagrelor 60 mg ile tedaviyi kesme oranı, >75 yaş hastalarda (%42), daha genç hastalar ile karşılaştırıldığında daha yüksek olmuş (%23 - %31 aralığında),
>75 yaş hastalarda plaseboya karşın fark %10'dan yüksek bulunmuştur (%42'ye karşın %29).
THEMIS çalışması (PKG Öyküsü ile Birlikte KAH ve tip 2 DM Bulunan Hastalar)
THEMIS çalışması, KAH ve tip 2 DM'li hastalarda tek başına ASA tedavisine kıyasla düşük doz ASA (75-150 mg) ile kombine tikagrelor ile aterotrombotik olayların önlenmesini değerlendirmeye yönelik 19220 hastadan oluşan, olay odaklı, randomize, çift kör, plasebo kontrollü, paralel gruplu, uluslararası çok merkezli bir çalışmadır. Medyan tikagrelor tedavi süresi 33,2 aydır.
50 yaş veya üzerinde, PKG (çalışma popülasyonunun %58'i) veya KABG (%29) öyküsü olan veya koroner revaskülarizasyon öyküsü bulunmayan ve KAH olarak tanımlanan, ancak en az 1 koroner arterde ≥%50 lümen stenozuna ilişkin anjiyografik kanıt bulunan (%20) ve çalışma başlamadan önce en az 6 ay süreyle glukoz düşürücü ilaçla tedavi edilen tip 2 DM hastası çalışmaya uygundur.
Mİ veya inme öyküsü olması; ADP reseptör antagonistlerinin planlanmış kullanımı, ASA tedavisi günde iki kez >150 mg, dipiridamol veya silostazol kullanımı; planlanmış koroner, serebrovasküler veya periferik arteriyel revaskülarizasyon veya dar terapötik indeks veya güçlü CYP3A4 inhibitörlerine sahip CYP3A4 substratlarının öngörülen kullanımı; bilinen yüksek kanama riski (örneğin, kronik oral antikoagülan ihtiyacı, bilinen kanama diyatezi, pıhtılaşma bozukluğu, yakın zamanda yapılan majör cerrahi, önceki intraserebral kanama veya son 6 ay içinde GI kanama öyküsü vb.) veya kalp pili ile tedavi edilmedikçe bradikardik olaylar; kontrolsüz hipertansiyon veya diyaliz gerektiren böbrek yetmezliği veya tikagrelor tedavisi almak için herhangi bir kontrendikasyonun bulunması halinde hastalar çalışmaya katılmak için uygun bulunmamıştır.
maruz bırakılmıştır. 48 ayda, 1175 (%12,3) hasta tikagrelor'a maruz bırakılmıştır. Hastalar, çalışma ilacının kesilip kesilmediğine bakılmaksızın çalışmanın sonlandırılmasına kadar takip edilmiştir.
Toplam THEMIS çalışma popülasyonunda, tek başına ASA ile karşılaştırıldığında ASA ile kombinasyon halinde tikagrelor tedavisi, %10'luk rölatif risk azalmasına (RRR) ve %0,73'lük mutlak risk azalmasına (ARR) (36 aylık tedaviden sonra tedavi edilmesi gerekenlerin sayısı [NNT] 138) karşılık gelen 0,9 (%95 GA: 0,81, 0,99, p=0,0378) RO ile aterotrombotik olayların (bileşik sonlanım noktası: KV ölüm, Mİ ve inme) önlenmesiyle sonuçlanmıştır. Etki, KV ölümlerde fark olmaksızın (RO: 1,02, %95 GA: 0,88, 1,18), Mİ (RO 0,84, %95 GA 0,71, 0,98) ve inme (RO 0,82, %95 GA: 0,67, 0,99) bileşenlerinin her biri ile yönlendirilmiştir. Tikagrelor, primer bileşik sonlanım noktasının bir parçası olarak değerlendirilmeyen ikincil sonlanım noktalarından tüm nedenlere bağlı ölümde (RO 0,98, %95 GA 0,87, 1,10) hiçbir fark olmaksızın iskemik inme olaylarının sayısını azaltmıştır (RO 0,80, %95 GA: 0,64, 0,99). Toplam THEMIS çalışma popülasyonunda tikagrelor'un fayda-risk profili, tikagrelor kullanımını desteklemek açısından uygun görülmemiş ve bu nedenle toplam çalışma popülasyonu için bir endikasyon verilmemiştir.
Toplam çalışma popülasyonunun %58'ine karşılık gelen önceden belirlenmiş bir alt grup olan PKG öyküsü olan THEMIS hastalarında, tek başına ASA ile karşılaştırıldığında ASA ile kombinasyon halinde tikagrelor tedavisi, aterotrombotik olayların önlenmesiyle sonuçlanmıştır (bileşik sonlanım noktası: KV ölüm, Mİ ve inme) (Bkz. Tablo 6). Tikagrelor tedavisi %15 RRR,
%1,19 ARR (36 aylık tedaviden sonra NNT 84) ve toplam THEMIS çalışma popülasyonundan daha olumlu bir fayda-risk profili sağlamıştır. Yine, tedavi yararı, bileşik sonlanım noktasının Mİ ve inme bileşenleri ile yönlendirilmiştir.
PKG öyküsü olan hasta alt grubundaki temel özellikler, her iki tedavi kolunda da benzerdir.
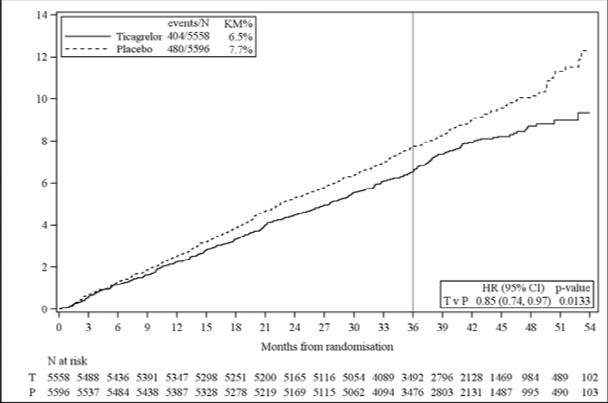
| Günde iki kez tikagrelor + ASA N=5558 | Tek başına ASA N=5596 |
%RRR |
Risk Oranı (RO) (%95 GA) |
p-değeri |
Özellik | Olayların görüldüğü hastalar | Olayların görüldüğü hastalar | |||
Primer sonlanım noktası | |||||
Bileşik KV Ölüm/MI/İnme | 404 (%7,3) | 480 (%8,6) | %15 | 0,85 (0,74, 0,97) | 0,0133 |
KV ölüm | 174 (%3,1) | 183 (%3,3) | %4 | 0,96 (0,78, 1,18) | 0,6803 |
MI | 171 (%3,1) | 216 (%3,9) | %20 | 0,80 (0,65, 0,97) | 0,0266 |
İnme | 96 (%1,7) | 131 (%2,3) | %26 | 0,74 (0,57, 0,96) | 0,0243 |
Sekonder sonlanım noktası rulama Kodu: 1ZW56ak1USHY3M0FyRG83RG83Q3NRYnUy | |||||
Tablo 6 â PKG öyküsü olan THEMIS hastaları alt grubunda primer ve sekonder etkililik sonlanım noktalarının analizi (tam analiz seti)
KV ölüm | 174 (%3,1) | 183 (%3,3) | %4 | 0,96 (0,78, 1,18) | - |
MI | 171 (%3,1) | 216 (%3,9) | %20 | 0,80 (0,65, 0,97) | - |
İskemik İnme | 88 (%1,6) | 113 (%2,0) | %21 | 0,79 (0,59, 1,04) | - |
Tüm nedenlere bağlı ölüm | 282 (%5,1) | 323 (%5,8) | %12 | 0,88 (0,75, 1,03) | - |
RO ve p-değerleri, günde iki kez tek başına ASA karşısında tikagrelor + ASA için tedavinin tek açıklayıcı değişken olduğu Cox orantısal risk modelinden hesaplanır.
KV ölüm, MI ve inme bileşenleri için ilk olayların sayısı, her bir bileşen için ilk olayların fiili sayısıdır ve bileşik sonlanım noktasındaki olayların sayısına eşit değildir.
GA = Güven aralığı; KV = Kardiyovasküler; RO = Risk oranı; MI = Miyokard infarktüsü; N = Tedavi grubundaki hasta sayısı; RRR = Bağıl risk düşüşü.
p-değerleri nominaldir.
KAH, tip 2 DM ve PKG öyküsü bulunan hastalarda TİCASA ile tedaviye, hasta üç yıla kadar yüksek aterotrombotik olay riski ve düşük kanama riski altında olduğu sürece devam edilmelidir. Etkililik ve güvenlilik verileri, TİCASA'nın faydalarının, üç yıllık uzun süreli tedaviden sonra halen risklere ağır basıp basmadığını belirlemek için yetersizdir.
Şekil 3 â PKG öyküsü olan THEMIS hastalarında KV ölüm, Mİ ve inmenin primer klinik bileşik sonlanım noktasının Kaplan-Meier grafiği ve analizi (tam analiz seti)
Randomizasyondan sonra aylar
% Kümülatif
Risk taşıyan hasta sayısı
Pediyatrik popülasyon
Avrupa İlaç Ajansı, akut koroner sendromlar (AKS) ve miyokard enfarktüsü (Mİ) öyküsü olan pediyatrik popülasyonun tüm alt kümelerinde tikagrelor ile çalışma sonuçlarını sunma zorunluluğunu iptal etmiştir (pediyatrik kullanım hakkında bilgi için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim:
Tikagrelorun emilimi, medyan tmaks değeri ile yaklaşık 1,5 saat olup hızlıdır. Tikagrelorun dolaşımdaki başlıca metaboliti AR-C124910XX'in (aynı zamanda aktif metaboliti) oluşumu yaklaşık 2,5 saat medyan tmaks değeri ile hızlıdır. 90 mg tikagrelorun sağlıklı gönüllülere aç karnına oral yolla uygulanmasının ardından Cdeğeri 529 ng/mL ve EAA değeri 3451 ng*s/mL'dir. Ana metabolit oranları Ciçin 0,28 ve EAA için 0.42'dir. Mİ öyküsü olan hastalarda tikagrelor ve AR-C124910XX'in farmakokinetiği, AKS popülasyondaki ile genel olarak benzer olmuştur. PEGASUS çalışmasının popülasyon farmakokinetik analizine dayalı olarak, medyan tikagrelor Cdeğeri 391 ng/mL ve tikagrelor 60 mg için kararlı durumda EAA değeri 3801 ng*s/mL'dir. Tikagrelor 90 mg için kararlı durumda C627 ng/mL ve EAA 6255 ng*s/mL'dir.
Tikagrelorun ortalama mutlak biyoyararlanımı %36 olarak tahmin edilmektedir. Yüksek oranda yağ içeren bir öğünün alınması, tikagrelor EAA değerinde %21'lik artışa ve aktif metabolitin Cdeğerinde %22'lik düşüşe neden olmuştur; fakat tikagrelorun Cdeğerinde veya aktif metabolitin EAA değeri üzerinde herhangi bir etkisi olmamıştır. Bu küçük değişikliklerin minimal klinik öneme sahip olduğu düşünülmektedir; bu nedenle tikagrelor aç veya tok karnına alınabilir. Gerek tikagrelor gerekse aktif metaboliti P-gp substratlarıdır.
Ezilmiş ve suyla karıştırılmış tikagrelor tabletler, oral olarak ya da bir nazogastrik tüp aracılığıyla mideye uygulandığında, tikagrelorun ve aktif metabolitin EAA ve Cdeğerleri göz önünde bulundurulduğunda tam tabletlerle benzer bir biyoyararlanıma sahip oldukları görülmektedir. Ezilmiş ve suyla karıştırılmış tikagrelor tabletlerden başlangıç maruziyeti (dozdan 0,5 ve 1 saat sonra) tam tabletlere kıyasla daha yüksek olmuş, daha sonra (2 ila 48 saat) genellikle benzer bir konsantrasyon profili ortaya çıkmıştır.
Dağılım:
Tikagrelorun kararlı durum dağılım hacmi 87.5 litredir. Tikagrelor ve aktif metaboliti insan plazma proteinine büyük ölçüde bağlanır (>%99,0).
Biyotransformasyon:
CYP3A4, tikagrelorun metabolizmasından ve aktif metabolitin oluşumundan sorumlu majör enzimdir ve diğer CYP3A substratları ile etkileşimleri aktivasyondan inhibisyona kadar değişebilir.
Tikagrelorun majör metaboliti AR-C124910XX olup, aynı zamanda trombosit P2Y12 ADP reseptörüne in vitro bağlanması değerlendirildiğinde aktif olduğu da belirlenmiştir. Aktif metabolite sistemik maruziyet, tikagrelor için elde edilenin yaklaşık olarak %30-40'ıdır.
Eliminasyon:
Tikagrelor eliminasyonunun primer yolu hepatik metabolizmadır. Radyoaktif işaretli tikagrelor uygulandığında, radyoaktivitenin ortalama geri eldesi yaklaşık olarak %84'tür (feçeste %57,8, idrarda %26,5). Tikagrelor ve aktif metabolitinin her ikisinin de idrardan geri eldesi dozun
%1'inden daha azdır. Aktif metabolit için primer eliminasyon yolu ağırlıklı olarak safra ile atılımdır. Ortalama ttikagrelor için yaklaşık olarak 7 saat ve aktif metabolit için 8,5 saattir.
Doğrusallık/doğrusal olmayan durum:
Tikagrelor doğrusal farmakokinetik sergiler ve tikagrelora ve aktif metabolite (ARC124910XX) maruziyet 1260 mg'a kadar yaklaşık olarak dozla orantılıdır.
Özel Popülasyonlar :
Yaşlı hastalarda:
Popülasyon farmakokinetik analizine göre yaşlı (≥75 yaş) AKS hastalarında daha genç hastalara kıyasla tikagrelore (Cve EAA'nın her ikisi için yaklaşık %25) ve aktif metabolite daha yüksek maruziyetler gözlenmiştir. Bu farklılıkların klinik olarak anlamlı olduğu düşünülmemektedir (bkz. Bölüm 4.2).
Pediyatrik hastalarda:
Tikagrelor pediyatrik popülasyonda değerlendirilmemiştir (bkz. Bölüm 4.2 ve Bölüm 5.1).
Cinsiyet:
Erkeklere kıyasla kadınlarda tikagrelora ve aktif metabolitine daha yüksek maruziyetler gözlenmiştir. Bu farklılıkların klinik olarak anlamlı olduğu düşünülmemektedir.
Böbrek yetmezliği:
Böbrek fonksiyonları normal olan gönüllülerle karşılaştırıldığında ağır derecede böbrek yetmezliği olan hastalarda (kreatinin klerensi <30 mL/dakika) tikagrelora maruziyet yaklaşık
%20 daha düşüktür ve aktif metabolite maruziyet yaklaşık %17 daha yüksektir (bkz. Bölüm 4.2).
Hemodiyaliz uygulanmakta olan terminal evre böbrek yetmezliğine sahip hastalarda diyaliz uygulanmayan bir günde uygulanan tikagrelor 90 mg'nin EAA ve Cdeğerinin normal böbrek fonksiyonuna sahip gönüllülerdekine kıyasla %38 ve %51 daha yüksek olduğu görülmüştür. Tikagrelorun diyalizle temizlenebilir olmadığını gösterir şekilde, tikagrelor diyalizden hemen önce uygulandığında maruziyette benzer bir artış gözlenmiştir (sırasıyla %49 ve %61). Aktif metabolite maruziyet daha düşük boyutta artış sergilemiştir (EAA %13-14, C%17-36). Terminal evre böbrek yetmezliği bulunan hastalarda tikagrelorun trombosit agregasyonu inhibisyonu (IPA) etkisinin diyalizden bağımsız olduğu ve normal böbrek fonksiyonuna sahip gönüllülerdekiyle benzer olduğu görülmüştür (Bkz. Bölüm 4.2).
Karaciğer yetmezliği:
Eşlenmiş sağlıklı gönüllülerle karşılaştırıldığında hafif derecede karaciğer yetmezliği olan hastalarda tikagrelor için Cve EAA değerleri sırasıyla %12 ve %23 daha yüksektir; bununla birlikte tikagrelorun TAİ etkisi iki grup arasında benzerdir. Hafif derecede karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Tikagrelor, ağır derecede karaciğer yetmezliği olan hastalarda çalışılmamış olup,ortaderecedekaraciğeryetmezliği olan hastalarla ilgili
farmakokinetik bilgi bulunmamaktadır. Başlangıçta bir veya daha fazla karaciğer fonksiyonu testinde orta veya şiddetli yükselmesi olan hastalarda tikagrelor plazma konsantrasyonları, başlangıçta yükselmeleri olmayan hastalar ile karşılaştırıldığında ortalama olarak benzer veya hafif şekilde daha yüksek olmuştur. Orta derecede karaciğer yetmezliği olan hastalarda herhangi bir doz ayarlaması önerilmemektedir (bkz. Bölüm 4.2 ve Bölüm 4.4)
Irk:
Beyaz ırktan hastalarla kıyaslandığında Asya kökenli hastalarda ortalama biyoyararlanım %39 daha yüksektir. Beyaz ırktan hastalarla kıyaslandığında tikagrelorun biyoyararlanımı kendilerini siyah ırk olarak tanımlayan hastalarda %18 daha düşük; klinik farmakoloji çalışmalarında beyaz ırkla kıyaslandığında Japon gönüllülerde tikagrelore maruziyet (Cve EAA) yaklaşık %40 (vücut ağırlığı için ayarlandıktan sonra %20) daha yüksektir. Kendilerini İspanyol veya Latin kökenli olarak tanımlayan hastalarda maruziyet beyaz ırk ile benzerdir.
5.3. Klinik öncesi güvenlilik verileri
Tikagrelor ve majör metaboliti için klinik öncesi veriler, güvenlilik farmakolojisi, tek ve tekrarlanan doz toksisitesi ve genotoksik potansiyel konvansiyonel çalışmalara dayalı olarak insanlar için kabul edilemez riskli advers etkiler göstermemiştir.
Çeşitli hayvan türlerinde klinik açıdan anlamlı maruziyet düzeylerinde gastrointestinal iritasyon gözlenmiştir (bkz. Bölüm 4.8).
Dişi sıçanlarda yüksek dozda tikagrelor uterus tümörleri (adenokarsinomalar) insidansında artış ve hepatik adenomların insidansında artış göstermiştir. Uterus tümörlerinin mekanizması olasılıkla sıçanlarda tümörlere neden olan hormonal dengesizliktir. Hepatik adenomların mekanizması olasılıkla karaciğerde kemirgenlere özgü enzim indüksiyonudur. Dolayısıyla, karsinojenisite bulgularının insanlarla ilişkisinin olası olmadığı düşünülmektedir.
Sıçanlarda maternal toksik dozda (güvenlilik sınırı 5,1) minör gelişimsel anomaliler görülmüştür. Tavşanlarda yüksek dozda dişilerin fetüslerinde, maternal toksisite görülmeksizin (güvenlilik sınırı 4,5) karaciğer olgunlaşmasında ve iskelet gelişiminde hafif bir gecikme görülmüştür.
Sıçanlar ve tavşanlar üzerinde yürütülen çalışmalar, anne vücut ağırlığı artışında hafif azalma ve gecikmiş doğum ile yenidoğan yaşama kapasitesi ve doğum ağırlığında azalma ile üreme toksisitesi göstermiştir. Tikagrelor dişi sıçanlarda düzensiz siklüslere (genellikle uzamış siklüsler) neden olmuş; fakat erkek ve dişi sıçanlarda genel fertiliteyi etkilememiştir. Radyoaktif işaretli tikagrelor ile yürütülen farmakokinetik çalışmalar, ana bileşiğin ve metabolitlerinin, sıçanların sütü ile atıldığını göstermiştir (bkz. Bölüm 4.6).
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Nobel İlaç Sanayii ve Tic. Anomim Şirketi
| Satış Fiyatı | 890.12 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 890.12 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699540025684 |
| Etkin Madde | Tikagrelor |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |