TOBLAIR 300 mg/5 ml nebulizasyon çözeltisi (56 ampül) Klinik Özellikler
{ Tobramisin }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
6 yaş ve üstündeki kistik fibroz (KF) hastalarında Pseudomonas aeruginosa'ya bağlı kronik akciğer enfeksiyonunun tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
TOBLAİR solunum yoluyla kullanılmak üzere hazırlanmıştır ve parenteral kullanım için uygun değildir.
Pozoloji/uygulama sıklığı ve süresi:
Kullanılacak TOBLAİR dozu yaş ve kiloya bakılmaksızın tüm hastalarda aynıdır. Yetişkinler ve çocuklar (6 yaş ve üzeri) için önerilen doz, 28 gün boyunca günde iki kez bir şişedir (tek kullanımlık 5 ml'lik şişeler). Doz aralığı mümkün olduğunca 12 saat olmalı ve 6 saatten az olmamalıdır. 28 günlük tedaviden sonra, hastalar TOBLAİR tedavisine müteakip 28 gün ara vermelidir. 28 günlük aktif tedavi ve 28 günlük dinlenme devreleri tekrarlanmalıdır.
Kontrollü klinik çalışmalarda tobramisin doz rejimi
Döngü 1 | Döngü 2 | Döngü 3 | |||
28 Gün | 28 Gün | 28 Gün | 28 Gün | 28 Gün | 28 Gün |
Günde 2 kere |
| Günde 2 kere |
| Günde 2 kere |
|
tobramisin | Standart | tobramisin | Standart | tobramisin | Standart |
tedavisi + | bakım | tedavisi | bakım | tedavisi | bakım |
standart bakım |
| + standart bakım |
| + standart bakım |
|
*Standart bakım: Kistik fibrozlu hastaların tedavisinde standart olarak kullanılan oral veya parenteral antipsödomonal antibiyotikleri, betaagonistleri, kromolini, inhale kortikosteroidleri, hava yollarını temizlemeye yönelik teknikleri içermektedir. Ek olarak hastaların yaklaşık %77'si dornaz alfa kullanmaktadır.
Altı yaşından daha küçük hastalarda, beklenen FEV'i (1 saniyede zorlu ekspiratuvar hacim)
<%25 veya >%75 olan hastalarda veya Burkholderia cepacia kolonizasyonu olan hastalarda güvenlilik ve etkililik gösterilmemiştir.
Tedaviye kistik fibroz tedavisinde deneyimli bir hekim tarafından başlanmalıdır. TOBLAİR tedavisine, hekim hastanın TOBLAİR tedavisinden klinik yarar sağladığını düşündüğü sürece belirtilen devreler şeklinde devam edilmelidir. Akciğerlerde klinik olarak kötüleşme söz konusuysa ayrıca antipsödomonal tedavi uygulanmalıdır.
Klinik çalışmalar, ilaca karşı in vitro direnç gösterildiğini belirten mikrobiyolojik raporlar bulunsa bile hastaların klinik açıdan fayda görebildiğini göstermektedir.
Uygulama şekli:
TOBLAİR, folyo içinde yer alan, her biri 300 mg tobramisin içeren tek dozluk, kullanıma hazır şişeler şeklinde satılır. Bir TOBLAİR şişesinin içeriği nebülizöre boşaltılır, sonra elle kullanılan PARI LC PLUS tekrar kullanılabilir tip nebülizör ve uygun bir kompresör ile yaklaşık 15 dakika solunur. Kompresörün uygun sayılması için PARI LC PLUS nebülizöre takıldığında 4-6 litre/dakika akış hızı ve/veya 110-217 kPa geri basınç sağlaması gerekir. Üreticilerin nebülizör ve kompresör bakımına ve kullanımına ilişkin talimatları yerine getirilmelidir. Tobramisinin PARI LC PLUS dışındaki nebülizörlerle birlikte kullanılması yeterince araştırılmamıştır.
Hastalar dik otururken veya ayakta dururken ve nebülizörün ağızlığından normal nefes alırken TOBLAİR solunmalıdır. Hastaların ağızlarından nefes almasına yardımcı olması için burun klipsleri kullanılabilir. Hastalar kendi standart göğüs fizyoterapisi doz rejimlerine devam etmelidir. Klinik açıdan gerekli görüldüğü takdirde uygun bronkodilatörler kullanmaya devam edilmelidir. Hastalar solunum sistemine doğrudan etkili birden fazla tedavi görüyorsa bunların aşağıda belirtilen sıraya göre uygulanması tavsiye edilir:
Bronkodilatör,
Şişenin tüm içeriğini nebülizörün alt kısmına boşaltınız.
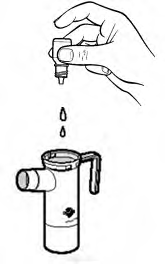
Nebülizörün parçalarını kurumaya bırakınız veya temiz, liflenmeyen bir bezle siliniz. Tüm parçalar kuruduğunda, tekrar bir araya getirip nebülizörünüzü kaldırınız.
4.3. Kontrendikasyonlar
TOBLAİR aminoglikozidlerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Ototoksisite:
Parenteral yoldan aminoglikozid uygulanan hastalarda hem işitsel (işitme kaybı) hem de vestibüler toksisite olarak ortaya çıkan ototoksisite bildirilmiştir. Vestibüler toksisite belirtileri arasında vertigo, ataksi veya sersemlik bulunabilir. Tinnitus, ototoksisitenin başlangıç bulgusu olabilir ve bu nedenle bu semptomun ortaya çıkması önlem alınmasını gerektirir.
Klinik çalışmalarda tobramisin tedavisi sırasında işitme kaybı şikâyeti veya odyometrik incelemelerle saptanan ototoksisite gözlenmemiştir. Pazarlama sonrası deneyimlerde, tobramisin kullanan hastalarda işitme kaybı bildirilmiştir. Bunlardan bazıları önceden veya eş zamanlı sistemik aminoglikozid tedavisi görmüş hastalarda bildirilmiştir. İşitme kaybı olan hastalarda tinnitus sıklıkla bildirilmiştir.
Bilinen veya şüpheli bir işitsel ya da vestibüler disfonksiyonu olan hastalara TOBLAİR reçete edilirken dikkatli olunmalıdır. Hekimler, aminoglikozidlerin vestibüler veya kohlear toksisiteye yol açma potansiyelini dikkate almalı ve TOBLAİR tedavisi sırasında işitme ile ilgili işlevleri uygun şekilde ölçmelidirler. Önceden uzun süreli sistemik aminoglikozid tedavisine bağlı olarak risk bulunan hastalarda, TOBLAİR tedavisine başlanmadan önce odyolojik değerlendirme yapılması gerekebilir.
Kulak çınlamasının başlaması önemli bir uyarıdır, çünkü ototoksisitenin uyarıcı belirtilerinden biridir. Eğer bir hasta aminoglikozid tedavisi sırasında kulak çınlaması veya işitme kaybı şikâyeti bildirirse hekim odyolojik inceleme yaptırmalıdır. Aynı zamanda parenteral aminoglikozid tedavisi gören hastalar, kümülatif toksisite riski dikkate alınarak klinik açıdan uygun şekilde gözlenmelidir. Serum tobramisin konsantrasyonlarının takibi ile ilgili olarak âLaboratuvar testi ve takibiâ bölümüne bakınız.
Nefrotoksisite:
Parenteral aminoglikozid tedavisinde nefrotoksisiteye rastlanmıştır, ancak tobramisin ile yapılan klinik çalışmalar sırasında nefrotoksisite kanıtına rastlanmamıştır. TOBLAİR, böbrek fonksiyon bozukluğu bilinen veya şüphelenilen hastalarda dikkatli kullanılmalıdır ve tobramisin serum konsantrasyonları gözlenmelidir. Serum tobramisin konsantrasyonlarının takibi ile ilgili olarak âLaboratuvar testi ve takibiâ bölümüne bakınız.
Şiddetli böbrek yetmezliği olan hastalar, örneğin serum kreatinini 2 mg/dl (176,8 µmol/l)'nin üzerinde olanlar, klinik çalışmalara dahil edilmemiştir.
Mevcut klinik uygulamalara göre, böbrek fonksiyonunun alt sınırı incelenmelidir. Tamamlanan her altı TOBLAİR tedavi devresinin ardından (180 günlük nebülizör ile uygulanan aminoglikozid tedavisi) üre ve kreatinin değerleri tekrar değerlendirilmelidir. Nefrotoksisiteyi gösteren bir kanıt bulunursa, serum konsantrasyonları 2 mcg/ml'nin altına düşene kadar tüm tobramisin tedavisi durdurulmalıdır. Daha sonra hekimin görüşüne göre TOBLAİR tedavisine devam edilebilir. TOBLAİR ve beraberinde parenteral aminoglikozid tedavisi gören hastalar kümülatif toksisite riski dikkate alınarak klinik açıdan uygun şekilde gözlenmelidir.
Klinik olarak gerekli görüldüğünde de böbrek fonksiyonuna ilişkin laboratuvar testleri yapılmalıdır.
Laboratuvar testleri ve takibi - serum konsantrasyonları:
Bilinen veya şüpheli işitsel veya renal fonksiyon bozukluğu olan hastalarda serum tobramisin konsantrasyonlarının takip edilmesi gerekir. TOBLAİR kullanan hastalarda ototoksisite veya nefrotoksisite görülmesi halinde serum konsantrasyonları 2 mcg/ml'nin altında düşene kadar tobramisin tedavisinin kesilmesi gerekir.
Böbrek fonksiyonları normal olan ve TOBLAİR tedavisi gören hastalarda serum tobramisin konsantrasyonlarının doz uygulamasından bir saat sonra yaklaşık 1 mcg/ml olması gerekir.
Eş zamanlı parenteral aminoglikozid tedavisi (veya böbrek atılımı etkileyebilecek diğer ilaçları kullanan) gören hastalarda serum tobramisin konsantrasyonlarının takip edilmesi gerekir. Bu hastalar klinik olarak gerekli görüldüğünde takip edilmelidir.
Serum tobramisin konsantrasyonu, parmak ucundan kan örneklemesi ile değil, sadece ven ponksiyonu ile kan örneklemesi ile takip edilmelidir. Parmak derisi ile tobramisinin temas etmesi ilacın serum düzeylerinde yanlış yüksek sonuçlar elde edilmesine yol açabilir. Bu bulaşma, testten önce ellerin yıkanmasıyla bütünüyle önlenemez.
Bronkospazm:
Tıbbi ürünler inhalasyon yolu ile alındığında bronkospazm meydana gelebilir. Tobramisinin nebülizör ile uygulanmasında bronkospazm meydana geldiği bildirilmiştir. İlk TOBLAİR dozu gözetim altında verilmeli ve eğer hastanın mevcut doz rejiminin bir parçası ise ön nebülizasyon ile bronkodilatör ilaç kullanılmalıdır. Nebülizasyondan önce ve sonra FEVdeğeri ölçülmelidir. Eğer bronkodilatör ilaç almayan bir hastada tedavinin bronkospazma yol açtığı saptanırsa, test başka bir zamanda bronkodilatör kullanarak tekrar yapılmalıdır. Bronkodilatör ilaç tedavisi sırasında bronkospazmın meydana gelmesi alerjik bir yanıtı belirtiyor olabilir. Alerjik bir yanıttan şüphelenilirse TOBLAİR kullanımına son verilmelidir. Bronkospazm uygun bir tıbbi yöntemle tedavi edilmelidir.
Nöromüsküler hastalıklar:
Myastenia gravis veya Parkinson hastalığı gibi bilinen veya şüpheli bir nöromüsküler hastalığı olan hastalara TOBLAİR reçete ederken dikkatli olunmalıdır. Aminoglikozidler nöromüsküler fonksiyon üzerindeki potansiyel kürar benzeri etkileri ile kas zayıflığını artırabilir.
Hemoptizi (Kan tükürme):
Nebülizör ile uygulanan çözeltilerin teneffüs edilmesi, öksürük refleksini artırabilir. Aktif, şiddetli hemoptizisi olan hastalarda TOBLAİR, sadece tedavinin faydalarının kanamayı artırma riskinden fazla olması durumunda uygulanmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Tobramisin ile yapılmış klinik ilaç etkileşimi çalışması bulunmamaktadır. Bazı diüretikler serum ve dokudaki antibiyotik konsantrasyonlarını değiştirerek aminoglikozid toksisitesini artırabilmektedir. TOBLAİR'ın etakrinik asit, furosemid, üre veya intravenöz mannitol ile eş zamanlı kullanılmaması gerekir.
TOBLAİR'ın nörotoksik, nefrotoksik veya ototoksik potansiyele sahip diğer ilaçlarla eş zamanlı ve/veya ardışık kullanımından kaçınılmalıdır.
Etkileşim yokluğu:
Tobramisin ile yapılan klinik çalışmalarda tobramisin ile eş zamanlı olarak dornaz alfa, beta agonist, inhaler kortikosteroid, diğer antipsödomonal antibiyotikleri veya parenteral aminoglikozidleri kullanan hastalarda gözlenen advers olay profilleri çalışma popülasyonunun geneli ile benzerlik göstermiştir.
Parenteral olarak uygulanan aminoglikozidlerin olası toksisitesini artırdığı bildirilen diğer ilaçlar aşağıda belirtilmiştir:
Amfoterisin B, sefalotin, siklosporin, takrolimus, polimiksin (nefrotoksisiteyi artırma riski)
Platin bileşikleri (nefrotoksisiteyi ve ototoksisiteyi artırma riski)
Antikolinesterazlar, botulinum toksinleri (nöromüsküler etkiler)
4.6. Gebelik ve laktasyon
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Herhangi bir veri yoktur.
Gebelik dönemi
Tobramisinin gebe kadınlarda inhalasyon yoluyla kullanımına ilişkin yeterli veri bulunmamaktadır. Aminoglikozidler gebe kadınlarda yüksek sistemik konsantrasyonlara ulaştıklarında fetüste hasara yol açabilirler (ör. konjenital sağırlık).
TOBLAİR, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
İnhalasyon yoluyla uygulama sonrasında anne sütüne geçen tobramisin miktarı bilinmemektedir. Bebeklerde ototoksisite ve nefrotoksisite potansiyeli nedeniyle, ilacın anne açısından olan önemi de dikkate alınarak emzirmenin sonlandırılması veya TOBLAİR tedavisinin sürdürülmesi konusunda bir karar verilmelidir.
Üreme yeteneği/Fertilite
Hayvanlarda subkutan tobramisin uygulamasına ilişkin veriler erkek veya dişilerde fertiliteye ilişkin bir soruna veya olası bir soruna işaret etmemiştir (bkz. Bölüm 5.3Klinik öncesi güvenlilik verileri).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Bildirilen advers etki reaksiyonlarına göre, TOBLAİR'ın araç ve makine kullanma üzerine etkisi olmadığı tahmin edilmektedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Tobramisinin güvenlilik profili iki randomize, çift kör, plasebo kontrollü çalışmada (paralel olarak yürütülmüş) ve iki ardışık açık etiketli takip çalışmasında değerlendirilmiştir. Dört çalışmanın tümünde de hastalara 28 gün ilaç kullanılan ve 28 gün ilaç kullanılmayan sikluslar halinde günde iki kez çalışma ilacı verilmiştir. Çift kör çalışmalarda hastalar tobramisin veya plasebo ile tedavi gruplarına randomize edilmiştir. Açık etiketli çalışmalarda tüm hastalara tobramisin verilmiştir.
Plasebo kontrollü çalışmalarda 24 haftalık tedavi dönemleri uygulanmış ve çalışma serilerinin açık etiketli izlem çalışmalarını da içeren toplam süresi 96 hafta olmuştur. 24 haftalık iki çift kör çalışmayı tamamlayan 464 hastanın 396'sı açık etiketli uzatma çalışmalarına katılmıştır. Toplamda 313, 264 ve 120 hasta sırasıyla 48, 72 ve 96 haftalık tobramisin tedavilerini tamamlamıştır.
Bu çalışma serileri boyunca tüm hastalara çalışma ilacının yanı sıra doktorlarının takdirine göre kistik fibroza yönelik standart bakım verilmiştir.
İki paralel 24 haftalık plasebo kontrollü klinik çalışmada tobramisin yaşları 6 ila 48 arasındaki 258 kistik fibroz hastasında genel olarak iyi tolere edilmiştir.
En yaygın (≥%10) bildirilen advers olaylar (çalışma ilacı ile ilişkisine bakılmaksızın) ve bunların plasebo kontrollü çalışmalardaki sıklıkları (tobramisine karşılık plasebo) şu şekildedir:
Advers olay | Sıklık |
Öksürük | %46,1'e karşılık %47,3 |
Farenjit | %38'e karşılık %39,3 |
Balgamlı öksürük | %37,6'ya karşılık %39,7 |
Asteni | %35,7'ye karşılık %39,3 |
Rinit | %34,5'e karşılık %33,6 |
Dispne | %33,7'ye karşılık %38,5 |
Pireksi | %32,9'a karşılık %43,5 |
Akciğer hastalığı | %31,4'e karşılık %31,3 |
Baş ağrısı | %26,7'ye karşılık %32,1 |
Göğüs ağrısı | %26'ya karşılık %29,8 |
Balgamda renk değişikliği | %21,3'e karşılık %19,8 |
Hemoptizi | %19,4'e karşılık %23,7 |
Anoreksi | %18,6'ya karşılık %27,9 |
Akciğer fonksiyon testlerinde azalma | %16,3'e karşılık %15,3 |
Astım | %15,9'a karşılık %20,2 |
Kusma | %14'e karşılık %22,1 |
Karın ağrısı | %12,8'e karşılık %23,7 |
Disfoni | %12,8'e karşılık %6,5 |
Bulantı | %11,2'ye karşılık %16 |
Kilo kaybı | %10,1'e karşılık %15,3 |
Plasebo grubuna kıyasla tobramisin grubunda anlamlı olarak daha sık bildirilen tek advers ilaç reaksiyonu disfoni (tobramisin ve plasebo tedavi gruplarında sırasıyla %12,8 ve %6,5) ve
tinnitus (sırasıyla %3,1 ve %0) olmuştur. Disfoni genel olarak hafif olmuştur ve ilaç kullanılan dönemlerde daha sık görülmüştür.
Tüm tinnitus olayları geçici karakterde olmuş ve tedavinin bırakılması ile düzelmiş, işitme kaybına yol açmamıştır. Baş dönmesi gibi vestibüler advers deneyimler bildiren hastaların sayısı tobramisin ve plasebo gruplarında benzer bulunmuştur. Ayrıca tobramisin ile yapılan çift kör çalışmalarda, 8000 Hz'e kadarki işitmenin değerlendirildiği odyometrik testlerde işitme kaybı saptanmamıştır. Pazarlama sonrası deneyimde, tobramisin kullanan hastalarda işitme kaybı bildirilmiştir. Bu raporlardan bazıları önceden ve eş zamanlı sistemik aminoglikozid tedavisi görmüş hastalarda bildirilmiştir. İşitme kaybı olan hastalarda tinnitus sıklıkla bildirilmiştir.
İlacın piyasaya verilmesinden sonra meydana gelen aşağıdaki advers ilaç reaksiyonları, MedDRA sistem organ sınıfına göre sıralanmıştır. Advers reaksiyonlar her bir sistem organ sınıfı içinde aşağıdaki kategoriler altında azalan sıklık sırasına göre dizilmiştir (CIOMS III): Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Yaygın: Larenjit
Çok seyrek: Oral kandidiyazis, mantar enfeksiyonu
Kan ve lenf sistemi hastalıkları
Çok seyrek: Lenfadenopati
Bağışıklık sistemi hastalıkları
Çok seyrek: Aşırı duyarlılık
Metabolizma ve beslenme hastalıkları
Çok yaygın: Anoreksiya
Sinir sitemi hastalıkları
Seyrek: Baş ağrısı, baş dönmesi, afoni
Çok seyrek: Uyuklama
Kulak ve iç kulak hastalıkları Yaygın: Kulak çınlaması Seyrek: İşitme kaybı
Çok seyrek: Kulak rahatsızlığı, kulak ağrısı
Solunum, göğüs hastalıkları ve mediastinal hastalıklar
Çok yaygın: Akciğer hastalığı, rinit, ses değişikliği, balgamda renk değişikliği, farenjit, öksürük, balgamlı öksürük, dispne, astım, kan tükürme
Seyrek: Bronkospazm, göğüste rahatsızlık hissi, burun kanaması Çok seyrek: Hiperventilasyon, hipoksi, sinüzit
Gastrointestinal hastalıklar
Çok yaygın: Kusma, bulantı, kilo kaybı, karın ağrısı Seyrek: Tat algısında değişiklik, ağızda ülserasyon Çok seyrek: Diyare
Deri ve deri altı doku hastalıkları
Seyrek: Döküntü
Çok seyrek: Ürtiker, kaşıntı
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Miyalji
Çok seyrek: Sırt ağrısı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Keyifsizlik, asteni, ateş, göğüs ağrısı Seyrek: Ağrı
Araştırmalar
Çok yaygın: Akciğer fonksiyon testlerinde bozulma
Açık etiketli çalışmalarda ve ürün piyasaya çıktıktan sonra elde edilen deneyimlere göre, daha önceden uzun süreli intravenöz aminoglikozid kullanım öyküsü olan hastalarda veya tobramisin ile beraber intravenöz aminoglikozid kullanan hastalarda işitme kaybı meydana gelmiştir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri). Parenteral aminoglikozidler; aşırı duyarlılık, ototoksisite ve nefrotoksisite ile ilişkilendirilmiştir (bkz. Bölüm 4.3 ve bölüm 4.4.).
İki açık etiketli uzatma çalışmasında, tobramisine maruziyetin süresi arttıkça balgamlı öksürük ve akciğer fonksiyon testlerinde bozulmada artış; fakat disfoni insidansında düşüş gözlenmiştir. Genel olarak aşağıdaki MedDRA Sistem Organ Sınıfına (SOC) ilişkin advers olayların insidansı tobramisine maruziyetin artmasıyla azalmıştır: Solunum, göğüs hastalıkları ve mediastinal hastalıklar, gastrointestinal hastalıklar ve genel ve uygulama bölgesine ilişkin hastalıklar.
Spontan bildirimlerden elde edilen advers ilaç reaksiyonları
Aşağıda yer alan spontan bildirilen advers reaksiyonlar gönüllü olarak bildirilmiştir ve sıklık veya ilaca maruziyet ile nedensel ilişkinin kurulması her zaman için mümkün değildir.
Kulak ve labirent bozuklukları
İşitme kaybı
Deri ve subkutan doku bozuklukları
Aşırı duyarlılık, kaşıntı, ürtiker, döküntü
Sinir sistemi bozuklukları
Afoni, disgözi
Solunum, toraks ve mediasten bozuklukları
Bronkospazm, orofaringeal ağrı
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 09).
4.9. Doz aşımı ve tedavisi
Tobramisinin tolere edilebilen maksimum dozu belirlenmemiştir. Tobramisin serum konsantrasyonları doz aşımının takibinde yararlı olabilmektedir.
Akut toksisite, TOBLAİR derhal kesilerek tedavi edilmeli ve temel renal fonksiyon testleri yapılmalıdır.
Tobramisinin gastrointestinal sistemden emilimi çok az olduğundan, TOBLAİR'ın yanlışlıkla oral yoldan alınması halinde sistemik toksisite beklenmez.
TOBLAİR'ın yanlışlıkla intravenöz yoldan uygulanması halinde baş dönmesi, tinnitus, vertigo, yüksek tonda işitme keskinliği kaybı, solunum sıkıntısı, nöromüsküler blokaj ve böbrek bozukluğu gibi parenteral tobramisin doz aşımı belirti ve semptomları ortaya çıkabilir. Hemodiyaliz tobramisinin vücuttan uzaklaştırılmasında yararlı olabilmektedir.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
İLAÇ GENEL BİLGİLERİ
Vem İlaç Sanayi Ve Ticaret Ltd. Şti
| Satış Fiyatı | 29403.69 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 29403.69 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699844523350 |
| Etkin Madde | Tobramisin |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |