TOUJEO 300 U/ml (1.5 ml) SOLOSTAR SC enjeksiyonluk çözelti içeren kullanıma hazır enjeksiyon kalemi (5 kalem) Kısa Ürün Bilgisi
{ Insulin Glarjin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
TOUJEO 300 U/mL SoloStar SC enjeksiyonluk çözelti içeren kullanıma hazır enjeksiyon kalemi
Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Enjeksiyonluk çözeltinin her bir mL'si, 300 U (10,91 mg'a eşdeğer) insülin glarjin* içermektedir.
Her bir kalem 450 U'ye eşdeğer 1,5 mL enjeksiyonluk çözelti içermektedir.
*İnsülin glarjin rekombinant DNA teknolojisi kullanılarak Escherichia coli içerisinde üretilmiş proteindir.
Yardımcı maddeler
Sodyum hidroksit 0,10 mg/mL Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
SoloStar; Kullanıma hazır enjeksiyon kalemi içinde enjeksiyonluk çözelti. Berrak ve renksiz çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Yetişkinlerde, adolesanlarda ve 6 yaşından itibaren çocuklarda diabetes mellitus tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi
TOUJEO, tercihen her gün aynı saatte olmak üzere, günün herhangi bir saatinde günde bir kez uygulanan bazal bir insülindir.
TOUJEO doz rejimi (doz ve zamanlama) bireysel yanıta göre ayarlanmalıdır.
TOUJEO, Tip 1 diabetes mellitus hastalığına sahip hastalarda, öğün zamanı için gereken insülini karşılaması amacıyla kısa/hızlı etkili insülin ile kombine olarak kullanılmalıdır.
Tip 2 diabetes mellitus hastalığına sahip hastalarda TOUJEO diğer antihiperglisemik tıbbi ürünlerle birlikte de uygulanabilir.
Bu tıbbi ürünün potensi ünite bazında belirtilmektedir. Bu üniteler TOUJEO'ya özeldir ve diğer insülin analoglarının potensini ifade etmek için kullanılan IU veya ünitelerle aynı değildir (Bkz. Bölüm 5.1).
Dozlama zamanı esnekliği
Gerektiğinde hastalar TOUJEO'yu normal uygulama zamanından önce veya sonraki 3 saat içinde uygulayabilir (Bkz. Bölüm 5.1).
Bir dozu unutan hastaların kan şekeri düzeylerini kontrol etmeleri, ardından normal günlük doz programına devam etmeleri önerilir. Hastalar, unutulan dozu dengelemek için çift doz enjekte etmemeleri konusunda bilgilendirilmelidir.
Başlangıç
Tip 1 diabetes mellitus hastaları
TOUJEO yemek zamanında alınan insülin ile birlikte günde bir kez alınacaktır ve doz bireysel olarak ayarlanmalıdır.
Tip 2 diabetes mellitus hastaları
Önerilen başlangıç dozu günde 0.2 U/kg olup daha sonra doz bireysel olarak ayarlanmalıdır.
İnsülin glarjin 100 U/mL‘den TOUJEO'ya geçiş
İnsülin glarjin 100 U/mL ve TOUJEO biyoeşdeğer değildir ve doğrudan birbirinin yerine kullanılamaz.
İnsülin glarjin 100 U/mL ‘den TOUJEO'ya geçiş ünite bazında hesaplanarak yapılabilir fakat hedef plazma glukoz düzeylerine ulaşılması için daha yüksek TOUJEO dozu gerekli olabilir. (Bkz. Bölüm Farmakodinamik özellikler).
4.3. Kontrendikasyonlar
Etkin madde
![]()
4.4. Özel kullanım uyarıları ve önlemleri
TOUJEO, diyabetik ketoasidozun tedavisi için uygun bir insülin seçeneği değildir. Bu gibi durumlarda intravenöz olarak uygulanan regüler insülin tavsiye edilmektedir.
Yetersiz kan şekeri kontrolü veya hiper veya hipoglisemik epizotlara bir eğilim olması durumunda, doz ayarlaması yapmadan önce hastanın tedavi şemasına uyumu, enjeksiyon yerleri, uygun enjeksiyon tekniği ve diğer ilgili faktörler gözden geçirilmelidir.
Hastalar, lipodistrofi ve kütanöz amiloidoz riskini azaltmak için belirlenen enjeksiyon yerlerini her enjeksiyonda dönüşümlü olarak kullanmaları konusunda bilgilendirilmelidir. Bu reaksiyonların oluştuğu enjeksiyon bölgelerine insülin enjeksiyonu yapılmasından sonra, insülin emiliminde gecikme ve glisemik kontrolde kötüleşme olması potansiyel bir risktir. Enjeksiyon yerinin, etkilenmemiş bir bölgeye doğru anlık olarak değiştirilmesinin hipoglisemiye neden olduğu bildirilmiştir. Enjeksiyon bölgesinde değişiklik sonrasında kan glukoz izlemi tavsiye edilmektedir ve antidiyabetik ilaçlarda doz ayarlaması dikkate alınabilir.
Hipoglisemi
Hipogliseminin ortaya çıkma zamanı kullanılan insülinlerin etki profiline bağlıdır ve dolayısıyla tedavi rejimi değiştiğinde değişebilir.
Hipoglisemik epizotların özel bir klinik anlam taşıyabileceği hastalarda özellikle dikkatli olunmalıdır ve kan şekeri izlenmesinin yoğunlaştırılması tavsiye edilebilir. Bu hastalar koroner arter veya beyni besleyen kan damarlarında anlamlı daralması (kardiyak veya serebral hipoglisemi komplikasyonları riski) ya da özellikle fotokoagülasyonla tedavi edilmemiş proliferatif retinopatisi olan hastaları (hipoglisemi sonrası geçici körlük riski) içerir.
Hastalar, hipogliseminin uyarıcı semptomlarının azaldığı durumların farkında olmalıdır. Bazı risk gruplarında hipogliseminin uyarıcı semptomları değişebilir, daha az belirgin olabilir veya hiç görünmeyebilir. Bu hastalar şunlardır;
kan şekeri kontrolü belirgin biçimde düzelmiş olanlar
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Çok sayıda madde glukoz metabolizmasını etkiler ve insülin glarjinin dozunun ayarlanmasını gerektirebilir.
Kan şekerini düşürücü etkiyi artırabilecek ve hipoglisemi yatkınlığını arttırabilecek maddeler; antihiperglisemik tıbbi ürünler, anjiyotensin dönüştürücü enzim (ADE) inhibitörleri, disopiramid, fibratlar, fluoksetin, monoamin oksidaz (MAO) inhibitörleri, pentoksifilin, propoksifen, salisilatlar ve sülfonamid antibiyotikleri içermektedir.
Kan şekerini düşürücü etkiyi azaltabilecek maddeler; kortikosteroitler, danazol, diazoksid, diüretikler, glukagon, izoniazid, östrojenler ve projestojenler, fenotiazin türevleri, somatropin, sempatomimetik ilaçlar (örneğin, epinefrin [adrenalin], salbutamol, terbutalin), tiroid hormonları, atipik antipsikotik ilaçlar (örneğin klozapin ve olanzapin) ve proteaz inhibitörlerini içermektedir.
Beta-blokörler, klonidin, lityum tuzları veya alkol, insülinin kan şekerini düşürücü etkisini kuvvetlendirebilir veya zayıflatabilir. Pentamidin hipoglisemiye yol açabilir ve bazen bunu hiperglisemi izleyebilir.
Bunun yanı sıra, beta-blokörler, klonidin, guanetidin ve rezerpin gibi sempatolitik ilaçların etkisiyle, adrenerjik karşı-düzenleme belirtileri azalabilir veya kaybolabilir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi : C
Çocuk doğurma potansiyeli olan kadınlar/doğum kontrolü (Kontrasepsiyon)
Oral kontraseptiflerin içindeki östrojen ve progestojenler TOUJEO'nun kan glukozunu düşürücü etkisini azaltabilir.
Gebelik dönemi
TOUJEO'nun gebe kadınlarda kullanımına ilişkin klinik deneyim bulunmamaktadır.
İnsülin glarjin için gebelikte maruziyet ile ilgili olarak kontrollü klinik çalışmalardan elde edilmiş klinik veri bulunmamaktadır. Gebe kadınlardan elde edilen çok sayıda veri insülin glarjin 100U/mL içeren tıbbi ürünler ile 1.000'den fazla gebelikteki sonuçlar gebelik üzerinde özgün bir advers etki veya fetüs ya da yenidoğanda özgün bir malformasyon ya da toksisite göstermemiştir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve veya/ ![]() doğum /ve veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz.
doğum /ve veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz.
Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Klinik olarak gerekli olmadıkça gebelikte TOUJEO kullanılmamalıdır.
![]()
Klinik olarak gerekli ise gebelikte TOUJEO kullanımı düşünülebilir.
Önceden var olan veya gestasyonal diyabeti olan hastalar için tüm gebelik süresince hiperglisemi ile ilişkili advers sonlanımları önlemek için iyi metabolik kontrolün sürdürülmesi çok önemlidir. İnsülin gereksinimi ilk trimesterde azalabilir ve genellikle ikinci ve üçüncü trimesterde artar. Doğumdan hemen sonra, insülin gereksinimi hızla düşer (hipoglisemi riski artar). Kan şekerinin dikkatli izlenmesi çok önemlidir.
Laktasyon dönemi
İnsülin glarjinin insan sütüne geçip geçmediği bilinmemektedir. Bir peptit olan insülin glarjin insan sindirim sisteminde sindirilerek aminoasitlere indirgendiğinden, ağızdan alınan insülin glarjinin emzirilen yenidoğan/süt çocuklarında metabolik etki yapması beklenmez. Emziren kadınlarda insülin dozu ve diyette ayarlama yapılması gerekebilir.
Üreme yeteneği / Fertilite
Hayvanlarda yürütülen çalışmalar, fertilite açısından herhangi bir doğrudan zararlı etki göstermemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Hipoglisemi veya hiperglisemi veya örneğin görme bozukluğunun bir sonucu olarak hastanın konsantre olma ve tepki verme yeteneği bozulabilir. Bu durum, bu yeteneklerin özellikle önemli olduğu (örn. araç veya makine kullanma gibi) durumlarda bir risk oluşturabilir.
Hastalara araba kullanırken hipoglisemiden kaçınmak için önlemler almaları tavsiye edilmelidir. Bu durum, hipogliseminin uyarıcı semptomlarına farkına varma yeteneği azalmış veya kaybolmuş kişilerde ya da sık hipoglisemi epizotları yaşayan kişilerde özellikle önemlidir. Bu koşullarda araç veya makine kullanmanın tavsiye edilebilir olup olmadığı düşünülmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
TOUJEO ile gerçekleştirilen klinik çalışmalarda (Bkz. Bölüm 5.1) ve insülin glarjin 100 U/mL ile klinik deneyim sırasında aşağıdaki advers reaksiyonlar gözlenmiştir.
Genellikle insülin tedavisinin en sık görülen advers reaksiyonu olan hipoglisemi, insülin dozunun insülin gereksinimine göre çok yüksek olması sonucu görülebilir.
Aşağıda klinik çalışmalarda gözlenen ilgili advers reaksiyonlar sistem organ sınıf temelinde ve azalan sıklığa göre listelenmiştir: Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1.000 ila < 1/100); seyrek (≥ 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her bir sıklık grubunda, istenmeyen etkiler azalan ciddiyet (şiddet) düzeyine göre sıralanmıştır.
Bağışıklık sistemi hastalıkları
Seyrek: Alerjik reaksiyonlar
İnsüline karşı ani gelişen tipte alerjik reaksiyonlar seyrektir. İnsülinlere (insülin glarjin dahil) veya yardımcı maddelere karşı görülen bu tip reaksiyonlar genel deri reaksiyonları, anjiyo- ödem, bronkospazm, hipotansiyon ve şok ile bağlantılı olabilir ve yaşamı tehdit edici olabilir. Yetişkinlerde yürütülen TOUJEO klinik çalışmalarında alerjik reaksiyon insidansı TOUJEO ile tedavi edilen hastalarda (%5,3) ve insülin glarjin 100 U/mL ile tedavi edilen hastalarda (%4,5) benzer bulunmuştur.
Metabolizma ve beslenme hastalıkları
Çok yaygın: Hipoglisemi
Şiddetli hipoglisemik ataklar, özellikle eğer tekrarlayan ataklar ise, nörolojik hasarlara yol açabilirler. Uzayan veya şiddetli hipoglisemik epizotlar yaşamı tehdit edici olabilir.
Pek çok hastada, nöroglikopeni belirti ve semptomları adrenerjik karşı düzenleme belirtilerini takip eder. Genellikle, kan glukozundaki düşüş ne kadar fazla ve hızlı olursa, karşı-düzenleme fenomeni ve bunun semptomları o kadar belirgin olur.
Sinir sistemi hastalıkları
Çok seyrek: Tat alma duyusunda bozukluk
Göz hastalıkları
Seyrek: Görme bozukluğu
Glisemik kontrolde belirgin bir değişiklik, lensin dolgunluğu ve refraktif indeksinde geçici değişiklikler nedeniyle geçici görme bozukluğuna neden olabilir.
Seyrek: Retinopati
Uzun süreli düzelen glisemik kontrol diyabetik retinopatinin ilerleme riskini azaltır. Bununla birlikte, glisemik kontrolde ani düzelme sağlayan yoğun insülin tedavisi de diyabetik retinopatinin geçici bir süre kötüleşmesine neden olabilir. Proliferatif retinopatisi olan hastalarda, özellikle fotokoagülasyon ile tedavi edilmemişse, şiddetli hipoglisemik epizotlar geçici görme kaybına yol açabilir.
Deri ve derialtı doku hastalıkları
Yaygın: Lipohipertrofi Yaygın olmayan: Lipoatrofi
Bilinmiyor: Kütanöz amiloidoz
Enjeksiyon yerinde lipodistrofi ve kütanöz amiloidoz oluşabilir ve lokal insülin absorpsiyonunu geciktirebilir. Enjeksiyon yerinin devamlı olarak değiştirilmesi bu reaksiyonların azalmasına veya önlenmesine yardımcı olabilir (Bkz. Bölüm 4.4)
Kas iskelet bozuklukları, bağ doku ve kemik hastalıkları
Çok seyrek: Kas ağrısı (miyalji)
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Enjeksiyon yeri reaksiyonları
Bu reaksiyonlar, kızarıklık, ağrı, kaşıntı, ürtiker, şişme veya enflamasyonu içermektedir. İnsülinlere karşı enjeksiyon yerinde gözlenen çoğu minör reaksiyonlar çoğunlukla birkaç gün veya birkaç hafta içinde kaybolur. Yetişkinlerde yürütülen TOUJEO klinik çalışmalarında enjeksiyon yeri reaksiyonu insidansı TOUJEO ile tedavi edilen hastalarda (%2,5) ve insülin glarjin 100 U/mL ile tedavi edilen hastalarda (%2,8) benzer bulunmuştur.
Seyrek: Ödem
Seyrek olarak ve özellikle daha önceki zayıf metabolik kontrol yoğun insülin tedavisi ile düzeltildiğinde, insülin ödeme neden olabilir.
Pediyatrik popülasyon
TOUJEO'nun güvenliliği ve etkililiği 6 yaş ila 18 yaşın altındaki çocuklarda gerçekleştirilen bir çalışmada gösterilmiştir. Pediyatrik popülasyondaki advers reaksiyonların sıklığı, tipi ve şiddeti, genel diyabet popülasyonundaki deneyimle farklılık göstermemektedir (Bkz. Bölüm 5.1). Klinik çalışma güvenlilik verisi 6 yaşın altındaki çocuklarda mevcut değildir.
Diğer özel popülasyonlar
Klinik çalışmalardan elde edilen sonuçlar temelinde yaşlı hastalarda ve böbrek yetmezliği olan hastalarda TOUJEO'nun güvenlik profili genel popülasyondaki güvenlik profili ile benzerdir
(Bkz. Bölüm 5.1).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirilmesi gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
İnsülin doz aşımı şiddetli ve bazen uzun süreli ve yaşamı tehdit edebilen hipoglisemiye yol açabilir.
Tedavi
Hafif hipoglisemi epizotları çoğunlukla oral karbonhidratlarla tedavi edilebilir. Tıbbi ürünün dozu, öğün alışkanlıkları veya fiziksel aktivitede ayarlamalar gerekebilir.
Koma, nöbet veya nörolojik bozukluğun eşlik ettiği daha şiddetli epizotlar intramuskuler/subkutan glukagon ya da konsantre intravenöz glukoz ile tedavi edilebilir. Hipoglisemi belirgin klinik düzelmeden sonra da tekrarlayabileceği için karbonhidrat alınımının ve hastanın izlenmesinin sürdürülmesi gerekebilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Enjeksiyonluk uzun etkili insülinler ve analogları. ATC Kodu: A10A E04
Etki mekanizması
İnsülin glarjin dahil olmak üzere insülinin primer aktivitesi, glukoz metabolizmasının düzenlenmesidir. İnsülin ve analogları, özellikle iskelet kası ve yağ dokusunda olmak üzere periferik glukoz alımını uyararak ve hepatik glukoz üretimini baskılayarak kan glukoz düzeyini düşürür. İnsülin yağ hücresindeki lipolizi baskılar, proteolizi baskılar ve protein sentezini artırır.
Farmakodinamik etkiler
İnsülin glarjin, nötral pH'de düşük çözünürlük göstermek üzere tasarlanmış bir insan insülin analoğudur. Asidik pH değerinde (pH 4) insülin glarjin tamamen çözünür. Subkutan dokuya enjeksiyon sonrasında, asidik çözelti nötral hale gelerek az miktarda insülin glarjinin sürekli olarak salındığı çökeltinin oluşmasına yol açar.
Tip 1 diyabet hastalarındaki öglisemik klemp çalışmalarında TOUJEO'nun glukoz düşürücü etkisi, subkutan insülin glarjin 100 U/mL ile karşılaştırıldığında daha stabil ve uzun bulunmuştur. Şekil 1'de, tip 1 diyabeti olan 18 hastada enjeksiyon sonrası maksimum 36 saat sürdürülerek yürütülen çapraz bir çalışmanın sonuçları verilmiştir. TOUJEO'nun etkisi klinik dozlarda 24 saati geçmiştir (36 saate kadar).
İnsülin 100 U/mL ile karşılaştırıldığında TOUJEO çökeltisinden insülin glarjinin daha istikrarlı salınması, yüzey alanında daha az çökelti oluşmasına yol açan üçte iki oranındaki hacim azalmasına atfedilmektedir.
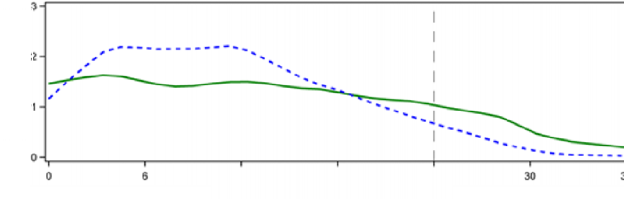
Şekil 1: 36 saatlik öglisemik klemp çalışmasında tip 1 diyabet hastalarında kararlı durum aktivite profili
![]()
![]()
Tedavi: TOUJEO 0,4 U/kg İnsülin glarjin (100 U/mL) 0,4 U /kg
*GIR: Glukoz infüzyon hızı: sabit plazma glukoz düzeyinin sürdürülmesi için uygulanan glukoz miktarı olarak belirlenir (saatlik ortalama değerler). Gözlem periyodunun sonu 36 saattir.
İnsülin glarjin M1 ve M2 olmak üzere 2 aktif metabolite metabolize olur. (Bkz. Bölüm 5.2).
İnsülin reseptörüne bağlanma: İn vitro çalışmalar, insülin glarjin ile M1 ve M2 metabolitlerinin insan insülin reseptörüne afinitesinin insan insülini ile benzer olduğunu göstermektedir.
IGF-1 reseptörüne bağlanma: İnsülin glarjinin insan IGF-1 reseptörüne afinitesi insan insülinin afinitesinden yaklaşık 5 ila 8 kat daha fazladır (ancak IGF-1'in afinitesinden yaklaşık 70 ila 80 kat daha düşüktür), oysa M1 ve M2, IGF-1 reseptörüne insan insülinine kıyasla biraz daha düşük affiniteye bağlanmaktadır.
Tip I diyabetik hastalarda bulunan total insülin konsantrasyonunun (insülin glarjin ve metabolitleri), IGF-1 reseptörlerin yarı maksimal işgali ve sonrasında IGF-1 reseptörü ile başlatılan mitojenik-proliferatif yolağın aktivasyonu için gerekenden belirgin olarak daha düşük olduğu gösterilmiştir. Endojen IGF-1'in fizyolojik konsantrasyonları mitojenik-proliferatif yolağı aktive edebilir; ancak, TOUJEO tedavisi dahil olmak üzere insülin tedavisinde bulunan terapötik konsantrasyonlar IGF-1 yolağını aktive etmek için gereken farmakolojik konsantrasyonlardan belirgin olarak daha düşüktür.
Bir klinik farmakoloji çalışmasında, aynı dozlarda verildiğinde, intravenöz insülin glarjin ve insan insülininin eşdeğer etki gücüne sahip olduğu gösterilmiştir.
Tüm insülinlerde olduğu gibi, insülin glarjinin etki süresi fiziksel aktivite ve diğer değişkenlerden etkilenebilmektedir.
![]() Klinik etkililik ve güvenlilik
Klinik etkililik ve güvenlilik
Günde tek doz TOUJEO'nun (insülin glarjin 300 U/mL) glisemik kontroldeki etkililik ve güvenliliği günde tek doz uygulanan insülin glarjin 100 U/mL ile süresi 26 haftaya kadar uzayan açık etiketli, randomize, aktif kontrollü, paralel çalışmalarda 546 tip 1 ve 2.474 tip 2 diabetes mellitus hastasında karşılaştırılmıştır (Tablo 1 ve 2).
Bu çalışmaların sonuçları başlangıca göre çalışma sonunda HbA1c düşüşünün insülin glarjin 100 U/mL ile benzer olduğunu göstermiştir. Çalışma sonunda plazma glukoz düzeyindeki azalma TOUJEO ve insülin glarjin 100 U/mL ile benzer olup düşüş TOUJEO ile titrasyon fazında daha kademeli olmuştur. Glisemik kontrol TOUJEO günde bir kez sabah ya da akşam uygulandığında benzer bulunmuştur.
HbA1C'deki düzelme cinsiyet, etnik köken, yaş, diyabet süresi (<10 yıl ve ≥10 yıl), başlangıçtaki HbA1c değeri (<%8 veya ≥%8) veya başlangıçtaki vücut kitle indeksinden (VKİ) etkilenmemiştir.
![]()
Bu hedefe yönelik tedavili çalışmaların sonunda, hasta popülasyonuna ve eşzamanlı tedaviye bağlı olarak TOUJEO grubunda karşılaştırma grubuna göre %10-18 oranında daha yüksek doz gözlenmiştir (Tablo 1 ve 2). Gerçek yaşam verilerini içeren daha uzun dönem çalışmalarda ise (faz 4 çalışmaları) insülin glarjin 100 U/mL ve diğer analog bazal insülinlerden TOUJEO'ya geçişte TOUJEO dozunda artış görüldüğü gibi, dozun değişmediği ya da azaldığı sonuçlar da elde edilmiştir.
Klinik çalışmalardan elde edilen sonuçlar, doğrulanmış hipoglisemi (günün herhangi bir zamanında ve gece) insidansının, insülin glarjin 100 U/mL ile tedavi edilen hastalarla karşılaştırıldığında TOUJEO ile tedavi edilen hastalarda daha düşük olduğunu göstermiştir. İnsülin dışı antihiperglisemik ilaç ya da öğün sırasında kullanılan insülin kombinasyonu kullanan tip 2 diabetes mellitus hastalarında doğrulanmış gece hipoglisemisi riskinin azaltılmasında TOUJEO'nun insülin glarjin 100 U/mL'ye üstünlüğü, 9. haftadan çalışma sonuna kadarki zaman aralığında, önceden bazal insülin ve oral antihiperglisemik ilaç (%18 risk azaltma) ya da öğün sırasında kullanılan insülin (%21 risk azaltma) kombinasyonu ile tedavi edilmiş hastalarda gösterilmiştir.
Özet olarak, hipoglisemi riskine ilişkin bu etkiler, insülin glarjin 100 U/mL ile tedavi edilen hastalarla karşılaştırıldığında TOUJEO ile tedavi edilen hastalarda yaş, cinsiyet, VKİ ve diyabet süresinden (<10 yıl ve ≥10 yıl) bağımsız olarak gözlenmiştir.
Tip 1 diyabeti olan hastalarda, hipoglisemi insidansı, TOUJEO ile tedavi edilen hastalarda insülin glarjin 100 U/mL ile tedavi edilen hastalarla karşılaştırıldığında benzer bulunmuştur (Tablo 3).
Tablo 1: Tip 1 diabetes mellitus klinik çalışmalarından elde edilen sonuçlar
26 haftalık tedavi | ||
| TOUJEO | IGlar |
Kombinasyon tedavisi | Öğün sırasında kullanılan insülin analoğu | |
Tedavi edilen hasta sayısı (mITT) | 273 | 273 |
HbA1c | ||
Başlangıç ortalaması | 8,13 | 8,12 |
Ayarlanmış başlangıca göre ortalama değişim | -0,40 | -0,44 |
Ayarlanmış Ortalama farkı | 0,04 [-0,098 ila 0,185] | |
Bazal insülin dozu (U/kg) | ||
Başlangıç ortalaması | 0,32 | 0,32 |
Başlangıca göre ortalama değişim | 0,15 | 0,09 |
Vücut ağırlığı(kg) | ||
Başlangıç ortalaması Başlangıçtan ortalama değişiklik | 81,89 0,46 | 81,80 1,02 |
IGlar: İnsülin glarjin 100 U/mL
a mITT: Değiştirilmiş tedaviye niyetlenilmiş popülasyon
b Tedavi farkı: TOUJEO – İnsülin glarjin 100 U/mL; [%95 Güvenlik Aralığı]
c Başlangıca göre 6 aydaki değişiklik (gözlemlenen olgu)
d Başlangıca göre 6 aylık temel tedavinin son değerindeki değişim
Tablo 2: Tip 2 diabetes mellitus klinik çalışmalarından elde edilen sonuçlar
26 haftalık tedavi | ||||||
| Önceden bazal insülin ile tedavi edilen hastalar | Önceden bazal insülin ile tedavi edilen hastalar | Önceden insülin kullanmamış hastalar | |||
Kombinasyon tedavisi | Öğün sırasında kullanılan insülin analoğu± metformin | İnsülin içermeyen antihiperglisemik ilaçlar | ||||
| TOUJEO | IGlar | TOUJEO | IGlar | TOUJEO | IGlar |
Tedavi edilen hasta sayısı | 404 | 400 | 403 | 405 | 432 | 430 |
HbA1c | ||||||
Başlangıç ortalaması
Ayarlanmış başlangıca göre ortalama değişim Ayarlanmış ortalama farkı | 8,13
-0,90 | 8,14
-0,87 | 8,27
-0,73 | 8,22
-0,70 | 8,49
-1,42 | 8,58
-1,46 |
-0,03 [-0,144 ila 0,083] |
-0,03 [-0,168 ila 0,099] |
0,04 [-0,090 ila 0,174] | ||||
Bazal insülin dozu (U/kg) | ||||||
Başlangıç ortalaması
Başlangıca göre ortalama değişim | 0,67
0,31 | 0,67
0,22 | 0,64
0,30 | 0,66
0,19 | 0,19
0,43 | 0,19
0,34 |
Vücut ağırlığı (kg) | ||||||
Başlangıç ortalaması
Başlangıca göre ortalama değişim | 106,11
0,93 | 106,50
0,90 | 98,73
0,08 | 98,17
0,66 | 95,14
0,50 | 95,65
0,71 |
IGlar: İnsülin glarjin 100 U/mL
a mITT: Değiştirilmiş tedaviye niyetlenilmiş popülasyon
b Tedavi farkı: TOUJEO – İnsülin 100 U/mL; [%95 Güvenlik Aralığı]
c Başlangıca göre 6 aydaki değişiklik (gözlemlenen olgu)
d Başlangıca göre 6 aylık temel tedavinin son değerindeki değişim
Tablo 3 - Tip 1 ve tip 2 diabetes mellitus klinik çalışmalarındaki hipoglisemik epizotlarının özeti
Diyabetik popülasyon | Tip 1 diabetes mellitus Önceden bazal insülin ile tedavi edilen hastalar | Tip 2 diabetes mellitus Önceden bazal insülin ile tedavi edilen hastalar | Tip 2 diabetes mellitus Önceden insülin kullanmamış veya bazal insülin kullanan hastalar | ||||
Kombinasyon tedavisi | Öğün sırasında kullanılan insülin analoğu | Öğün sırasında kullanılan insülin analoğu± metformin | İnsülin içermeyen antihiperglisemik ilaçlar | ||||
| TOUJEO | IGlar | TOUJEO | IGlar | TOUJEO | IGlar | |
Şiddetli hipoglisemi insidansı (%) (n/Toplam N) | |||||||
Tüm çalışma periyotu |
| 6,6 | 9,5 | 5,0 | 5,7 | 1,0 | 1,2 |
| (18/274) | (26/275) | (20/404) | (23/402) | (8/838) | (10/844) | |
RR*: 0,69 [0,39; 1,23] | RR: 0,87 [0,48; 1,55] | RR: 0,82 [0,33; 2,00] | |||||
Doğrulanmış hipoglisemi insidansı (%) (n/Toplam N) | |||||||
Tüm çalışma periyodu |
| 93,1 | 93,5 | 81,9 | 87,8 | 57,6 | 64,5 |
| (255/274) | (257/275) | (331/404) | (353/402) | (483/838) | (544/844) | |
RR: 1,00 [0,95;1,04] | RR: 0,93 [0,88; 0,99] | RR: 0,89 [0,83; 0,96] | |||||
Doğrulanmış gece hipoglisemi insidansı (%) (n/Toplam N) | |||||||
9.haftadan çalışma sonuna kadar | 59,3 | 56,0 | 36,1 | 46,0 | 18,4 | 22,5 | |
(162/273) | 153/273) | (184/400) | (184/400) | (154/835) | (188/835) | ||
RR: 1,06 [0,92;1,23] | RR: 0,79 [0,67;0,93] | RR: 0,82 [0,68;0,99] | |||||
IGlar: İnsülin glarjin 100 U/mL
a Şiddetli hipoglisemi: Karbonhidrat, glukagon veya diğer kurtarma eylemlerini aktif olarak uygulamak için başka bir kişinin yardımını gerektiren epizot.
b Doğrulanmış hipoglisemi: Herhangi şiddetli hipoglisemi ve/veya ≤3,9 mmol/l plazma glukoz değeri ile doğrulanan hipoglisemi
c Gece hipoglisemisi: 00:00 ve 05:59 saatleri arasında meydana gelen epizot
d 6 aylık tedavi süresi
*RR: Rölatif risk oranı; [%95 Güvenlik Aralığı]
Dozlama zamanı esnekliği
Sabit veya esnek dozlama zamanı ile kullanılan TOUJEO'nun güvenlilik ve etkililiği 3 aylık randomize, açık etiketli iki klinik çalışmada değerlendirilmiştir. Tip 2 diyabet hastaları (n=194) TOUJEO'yu günde bir kez akşam ya günün aynı saatinde (sabit dozlama zamanı) ya da normal uygulama zamanından önce veya sonraki 3 saat içinde (esnek dozlama zamanı) kullanmıştır. Esnek dozlama zamanı ile uygulama, glisemik kontrol ve hipoglisemi insidansını etkilememiştir.
Antikorlar
TOUJEO ve insülin glarjin 100 U/mL'yi karşılaştıran çalışmalardan elde edilen sonuçlar, TOUJEO ve insülin glarjin 100 U/mL arasında anti-insülin antikorlarının gelişimi, etkililiği, güvenliliği veya bazal insülin dozu açısından bir fark göstermemiştir.
Vücut ağırlığı
![]()
TOUJEO ile tedavi edilen hastalarda 6 aylık periyot sonunda vücut ağırlığındaki ortalama değişimin 1 kg'dan az olduğu gözlenmiştir (Bkz. Tablo 1 ve 2).
Diyabetik retinopatinin progresyonuna ilişkin bir çalışmanın sonuçları
İnsülin glarjin 100 U/mL'nin (günde bir kez) diyabetik retinopati üzerindeki etkileri, Erken Tedavi Diyabetik Retinopati Çalışması (ETDRS) ölçeğinde 3 veya daha fazla retinopati progresyonunun fundus fotoğrafı kullanılarak araştırıldığı, tip 2 diyabeti olan 1024 hastada yürütülen açık etiketli 5 yıllık NPH kontrollü (günde iki kere verilen NPH) bir çalışmada değerlendirilmiştir. İnsülin glarjin 100 U/mL, NPH insülinle karşılaştırıldığında diyabetik retinopatinin progresyonunda anlamlı bir fark görülmemiştir.
Uzun süreli etkililik ve güvenlilik sonlanım çalışması
Çok merkezli, randomize, 2x2 faktorial tasarımlı ORIGIN (Outcome Reduction with Initial Glargine INtervention: Başlangıçta glarjin müdahalesi ile sonlanım azalması) çalışması, yüksek kardiyovasküler (KV) riski olup açlık glukozu (IFG) ya da glukoz toleransı (IGT) bozuk (katılımcıların %12'si) ya da tip 2 diyabet hastası (en fazla bir antidiyabetik oral ilaç ile tedavi edilen) (katılımcıların %88'i) 12537 katılımcı ile yürütülmüştür. Katılımcılar APG ≤95 mg/dl (5,3 mM) olacak şekilde titre edilen insülin glarjin 100 U/mL (n=6264) tedavisine ya da standart bakıma (n=6273) randomize edilmiştir (1:1).
İlk primer ortak etkililik sonlanımı KV ölüm, ölümcül olmayan miyokard enfarktüsü (MI) ya da ölümcül olmayan inmenin ilk ortaya çıktığı zaman ve ikinci primer ortak etkililik sonlanımı ilk primer ortak sonlanımdaki herhangi bir olay, revaskülarizasyon girişimi (koroner, karotik ya da periferik) ya da kalp yetmezliği nedeniyle hastane yatışının ilk ortaya çıktığı zamandır.
Sekonder sonlanım noktaları tüm nedenlere bağlı mortalite ve bir birleşik mikrovasküler sonlanımı içermiştir.
İnsülin glarjin 100 U/mL standart bakım ile karşılaştırıldığında KV hastalık ve KV mortalite için rölatif riski değiştirmemiştir. İnsülin glarjin ve standart bakım arasında iki primer ortak sonlanım; bu sonlanımları oluşturan birleşik sonlanımlardan herhangi biri; tüm nedenlere bağlı mortalite ya da birleşik mikrovasküler sonlanım açısından fark saptanmamıştır.
Çalışma sonunda ortalama insülin glarjin 100 U/mL dozu 0,42 U/kg olarak saptanmıştır. Başlangıçta katılımcıların medyan HbA1c değeri %6,4 iken, medyan HbA1c değer aralığı tedavi sırasında insülin glarjin 100 U/mL grubunda %5,9 - 6,4 ve izlem boyunca standart bakım grubunda %6,2-6,6 bulunmuştur.
Şiddetli hipoglisemi oranı (etkilenen katılımcı/100 katılımcı maruziyet yılı) insülin glarjin 100 U/mL grubunda 1,05 ve standart bakım grubunda 0,30; doğrulanmış ciddi olmayan hipoglisemi oranları insülin glarjin 100 U/mL grubunda 7,71 ve standart bakım grubunda 2,44 bulunmuştur.
6 yıllık çalışma boyunca insülin glarjin 100 U/mL grubunun %42'sinde herhangi bir hipoglisemi olayı ortaya çıkmamıştır.
Son tedavi muayenesinde, vücut ağırlığında başlangıca göre insülin glarjin 100 U/mL grubunda ortalama 1,4 kg artış ve standart bakım grubunda ortalama 0,8 kg azalma saptanmıştır.
Pediyatrik popülasyon
TOUJEO'nun etkililiği ve güvenliliği, tip I diabetes mellitusu olan çocuklarda ve adolesanlarda,
26 haftalık bir periyod için 1:1 randomize kontrollü açık etiketli bir klinik çalışmada değerlendirilmiştir (n=463). TOUJEO kolundaki hastalar 12 yaşın altındaki 73 çocuk ve 12 yaş ve üzeri 160 çocuktan oluşmuştur. Günde bir doz uygulanan TOUJEO, 100 ünite/mL insülin glarjinle kıyaslandığında, HbA1c ve APG değerlerinde başlangıçtan 26. haftaya kadar benzer bir düşüş göstermiştir.
Doz-yanıt analizi, pediyatrik hastalarda başlangıç titrasyon fazını takiben vücut ağırlığına göre
ayarlanan dozların, kararlı durumdaki yetişkin hastalardan daha yüksek olduğunu göstermiştir.
Herhangi bir kategoride hastalardaki genel hipoglisemi insidansı her iki tedavi grubunda da benzer olmuştur (TOUJEO grubundaki hastalarda en az bir olay bildiren % 97,9 ve 100 ünite/mL insülin glarjin grubunda en az bir olay bildiren %98,2). Benzer şekilde, nokturnal hipoglisemi TOUJEO ve 100 ünite/mL insülin glarjin tedavi gruplarında benzer olmuştur. Şiddetli hipoglisemi bildiren hastaların oranı TOUJEO grubunda, 100 ünite/mL insülin glarjin grubu ile kıyaslandığında, sırasıyla %6 ve %8,8 olmak üzere daha düşük olmuştur. Ketoz ile birlikte hiperglisemik episodlar gösteren hastaların oranı TOUJEO grubunda, 100 ünite/mL insülin glarjin grubuna kıyasla, sırasıyla %6,4 ve %11,8 olmak üzere daha düşük olmuştur. TOUJEO ile advers olaylar ve standart güvenlilik parametreleri açısından herhangi bir güvenlilik sorunu tanımlanmamıştır. Antikor oluşumu seyrektir ve bir klinik etkisi yoktur. Tip II diyabetes mellitusu olan pediyatrik hastalar için etkililik ve güvenlilik verileri, tip I diyabetes mellitusu olan adolesan ve yetişkin hastalar ve tip II diyabetes mellitusu olan yetişkin hastalara ait verilerden ekstrapole edilmiştir. Sonuçlar TOUJEO'nun tip II diyabetes mellitusu olan pediyatrik hastalarda kullanımını desteklemektedir.
5.2. Farmakokinetik özellikler
Emilim:
Sağlıklı bireylerde ve diyabetik hastalarda, insülin glarjin 100 U/mL ile karşılaştırıldığında, TOUJEO subkutan enjeksiyonu sonrasında insülin serum konsantrasyonları, oldukça düzleşmiş bir zaman konsantrasyon profili oluşturacak şekilde daha yavaş ve uzun süreli emilim göstermiştir.
TOUJEO'nun farmakokinetik profili farmakodinamik aktivitesi ile tutarlı bulunmuştur.
Dağılım:
Terapötik aralıkta günlük TOUJEO uygulamasında kararlı duruma 3-4 gün sonra ulaşılır. Subkutan TOUJEO uygulaması sonrasında 24 saatlik insülin maruziyetindeki değişim katsayısı olarak tanımlanan hastadaki maruziyet değişkenliği kararlı durumda düşük bulunmuştur (%17,4).
Biyotransformasyon:
Subkutan insülin glarjin enjeksiyonundan sonra, insülin glarjin Beta zincirinin karboksil ucunda hızla metabolize olarak, iki aktif metabolit olan M1 (21A-Gly-insülin) ve M2 (21A-Gly-des- 30B-Thr-insülin) oluşmaktadır. Plazmada, dolaşımdaki başlıca bileşik M1 metabolitidir. M1 metabolitine maruziyet uygulanan insülin glarjin dozuyla birlikte artar. Farmakokinetik ve farmakodinamik bulgular, insülin glarjin ile subkutan enjeksiyonun etkisinin esas olarak M1'e maruziyete dayandığını göstermektedir. İnsülin glarjin ve M2 metaboliti bireylerin büyük çoğunluğunda saptanabilir düzeyde bulunmamıştır ve saptanabildiklerinde konsantrasyonlarının uygulanan insülin glarjin dozundan ve formülasyonundan bağımsız olduğu bulunmuştur.
Eliminasyon:
İntravenöz yoldan uygulandığında insülin glarjin ve insan insülininin eliminasyon yarılanma ömrü benzerdir.
Subkutan enjeksiyon sonrasında TOUJEO'nun yarılanma ömrü subkutan dokudan emilim oranı ile hesaplanır. Subkutan enjeksiyon sonrasında TOUJEO'nun yarılanma ömrü dozdan bağımsız olarak 18-19 saattir.
Doğrusallık/doğrusal olmayan durum:
TOUJEO subkutan enjeksiyonu ardından sistemik maruziyeti doza oranlı olarak artar.
Pediyatrik popülasyon
TOUJEO için popülasyon farmakokinetik analizi, tip I diyabeti olan 75 pediyatrik gönüllüye ait (6 ila <18 yaş arası) veriler kullanılarak, ana metaboliti M1'in konsantrasyon verilerine dayanarak gerçekleştirilmiştir. Vücut ağırlığı TOUJEO'nun klirensini doğrusal olmayan bir yönde etkilemektedir. Sonuç olarak, pediyatrik hastalarda maruziyet (EAA), vücut ağırlığına göre ayarlanmış aynı dozu aldıklarında, yetişkin hastalara kıyasla hafif oranda daha düşüktür.
5.3. Klinik öncesi güvenlilik verileri
Konvansiyonel güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme toksisitesi ile ilgili çalışmalar temelinde klinik öncesi veriler insanlar için özel bir tehlike göstermemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Çinko klorür Metakresol Gliserol
Hidroklorik asit (pH ayarlaması için) Sodyum hidroksit (pH ayarlaması için) Enjeksiyonluk su
6.2. Geçimsizlikler
TOUJEO başka bir insülinle ya da diğer tıbbi ürünlerle karıştırılmamalı veya seyreltilmemelidir. TOUJEO'nun karıştırılması veya seyreltilmesi zaman/etki profilini değiştirir ve karıştırma çökelmeye neden olur.
6.3. Raf ömrü
30 ay
Kalemin ilk kullanımdan sonraki raf ömrü
Direkt ışık ve sıcaktan korumak koşulu ile tıbbi ürün maksimum 6 hafta süre ile 30 °C'nin altındaki oda sıcaklığında direkt ışıktan ve ısıdan korumak şartıyla saklanabilir. Kullanımdaki kalemler buzdolabında saklanmamalıdır. Her enjeksiyondan sonra ışıktan korumak için kalemin kapağı geri takılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
İlk kullanımdan önce
Buzdolabında (2oC -8oC'de) saklayınız. Dondurmayınız.
TOUJEO'yu buzdolabında dondurucu bölmeye yakın yere koymayınız veya soğutma paketi ile temas ettirmeyiniz.
Her kullanımdan sonra kullanıma hazır enjeksiyon kalemlerini ışıktan korumak için dış kutusunda saklayınız.
İlk kullanımdan sonra ya da yedek olarak taşınırken Açıldıktan sonraki saklama koşulları için Bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
Kullanıma hazır kalem
Gri piston (bromobütil kauçuk) ve tıpalı (izopren laminat ve bromobütil kauçuk) bir kapak (alüminyum halkalı) içeren kartuşlarda (Tip I, renksiz, cam). Kartuş kullanılıp atılabilen kalem içine yerleştirilmiştir. Her bir kartuş 1,5 mL çözelti içerir.
Ambalaj iğne ucu içermez.
3 ve 5 kalem içeren ambalajları bulunmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
İlk kullanımdan önce kalem oda sıcaklığında en az 1 saat tutulmalıdır.
TOUJEO SoloStar kullanıma hazır kalem kullanılmadan önce KULLANMA TALİMATI içinde yer alan kalem kullanma talimatları dikkatlice okunmalıdır. TOUJEO SoloStar kullanıma hazır kalem kullanma talimatlarında önerildiği gibi kullanılmalıdır (Bkz. Bölüm 4.2). Hastalar, Kullanma Talimatında yer alan talimatların 3. Adım başlığı altında açıklanan güvenlik testini yapmaları konusunda bilgilendirilmelidir. Bu testi yapmadıklarında, tam doz aktarılmayabilir. Böyle bir durum olursa hastalar, kan glukoz seviyelerinin kontrol sıklığını arttırmalıdır ve ilave insülin uygulamaları gerekebilir.
Kartuş kullanmadan önce incelenmelidir. Çözelti yalnızca berrak, renksiz ve katı parçacık içermiyor ve su gibi görünüyorsa kullanılmalıdır. TOUJEO çözelti olduğundan kullanım öncesi hazırlanması gerekmez.
TOUJEO ve diğer insülinler arasında ilaç kullanım hatalarını önlemek için insülin etiketi her enjeksiyondan önce kontrol edilmelidir. “300†dozu, etiket üzerinde bal sarısı renkte vurgulanmıştır (Bkz. Bölüm 4.4).
Hastalar, TOUJEO SoloStar kullanıma hazır kalemin doz penceresinde, enjekte edilecek olan TOUJEO dozunun gösterildiği konusunda bilgilendirilmelidir. Dozun yeniden hesaplanmasına gerek yoktur.
TOUJEO SoloStar kullanıma hazır kalem 450 ünite TOUJEO içerir. 1 ünitelik adımlarda, her enjeksiyon için 1-80 ünite doz enjekte edilebilir.
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| GLARIN | 869828950141 | |
| LANTUS | 8699809950634 | 1,118.16TL |
| TOUJEO | 8699809950863 | 1,787.24TL |
| Diğer Eşdeğer İlaçlar |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Gıda Alerjisi Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
İLAÇ GENEL BİLGİLERİ
Sanofi Sağlık Ürünleri Ltd.Şti
| Geri Ödeme Kodu | A15997 |
| Satış Fiyatı | 1787.24 TL [ 14 Apr 2025 ] |
| Önceki Satış Fiyatı | 1787.24 TL [ 7 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699809950863 |
| Etkin Madde | Insulin Glarjin |
| ATC Kodu | A10AE04 |
| Birim Miktar | 300 |
| Birim Cinsi | U/ML |
| Ambalaj Miktarı | 5 |
| Sindirim Sistemi ve Metabolizma > İnsülinler ve Analogları > İnsülin Glargine |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |