TOUJEO 300 U/ml (1.5 ml) SOLOSTAR SC enjeksiyonluk çözelti içeren kullanıma hazır enjeksiyon kalemi (5 kalem) Farmakolojik Özellikler
{ Insulin Glarjin }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Enjeksiyonluk uzun etkili insülinler ve analogları. ATC Kodu: A10A E04
Etki mekanizması
İnsülin glarjin dahil olmak üzere insülinin primer aktivitesi, glukoz metabolizmasının düzenlenmesidir. İnsülin ve analogları, özellikle iskelet kası ve yağ dokusunda olmak üzere periferik glukoz alımını uyararak ve hepatik glukoz üretimini baskılayarak kan glukoz düzeyini düşürür. İnsülin yağ hücresindeki lipolizi baskılar, proteolizi baskılar ve protein sentezini artırır.
Farmakodinamik etkiler
İnsülin glarjin, nötral pH'de düşük çözünürlük göstermek üzere tasarlanmış bir insan insülin analoğudur. Asidik pH değerinde (pH 4) insülin glarjin tamamen çözünür. Subkutan dokuya enjeksiyon sonrasında, asidik çözelti nötral hale gelerek az miktarda insülin glarjinin sürekli olarak salındığı çökeltinin oluşmasına yol açar.
Tip 1 diyabet hastalarındaki öglisemik klemp çalışmalarında TOUJEO'nun glukoz düşürücü etkisi, subkutan insülin glarjin 100 U/mL ile karşılaştırıldığında daha stabil ve uzun bulunmuştur. Şekil 1'de, tip 1 diyabeti olan 18 hastada enjeksiyon sonrası maksimum 36 saat sürdürülerek yürütülen çapraz bir çalışmanın sonuçları verilmiştir. TOUJEO'nun etkisi klinik dozlarda 24 saati geçmiştir (36 saate kadar).
İnsülin 100 U/mL ile karşılaştırıldığında TOUJEO çökeltisinden insülin glarjinin daha istikrarlı salınması, yüzey alanında daha az çökelti oluşmasına yol açan üçte iki oranındaki hacim azalmasına atfedilmektedir.
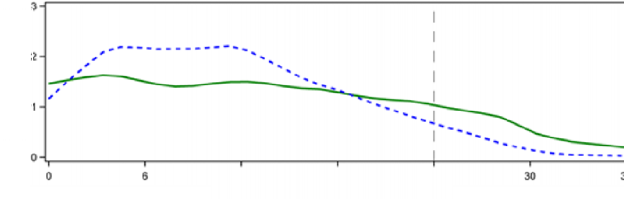
Şekil 1: 36 saatlik öglisemik klemp çalışmasında tip 1 diyabet hastalarında kararlı durum aktivite profili
![]()
![]()
Tedavi: TOUJEO 0,4 U/kg İnsülin glarjin (100 U/mL) 0,4 U /kg
*GIR: Glukoz infüzyon hızı: sabit plazma glukoz düzeyinin sürdürülmesi için uygulanan glukoz miktarı olarak belirlenir (saatlik ortalama değerler). Gözlem periyodunun sonu 36 saattir.
İnsülin glarjin M1 ve M2 olmak üzere 2 aktif metabolite metabolize olur. (Bkz. Bölüm 5.2).
İnsülin reseptörüne bağlanma: İn vitro çalışmalar, insülin glarjin ile M1 ve M2 metabolitlerinin insan insülin reseptörüne afinitesinin insan insülini ile benzer olduğunu göstermektedir.
IGF-1 reseptörüne bağlanma: İnsülin glarjinin insan IGF-1 reseptörüne afinitesi insan insülinin afinitesinden yaklaşık 5 ila 8 kat daha fazladır (ancak IGF-1'in afinitesinden yaklaşık 70 ila 80 kat daha düşüktür), oysa M1 ve M2, IGF-1 reseptörüne insan insülinine kıyasla biraz daha düşük affiniteye bağlanmaktadır.
Tip I diyabetik hastalarda bulunan total insülin konsantrasyonunun (insülin glarjin ve metabolitleri), IGF-1 reseptörlerin yarı maksimal işgali ve sonrasında IGF-1 reseptörü ile başlatılan mitojenik-proliferatif yolağın aktivasyonu için gerekenden belirgin olarak daha düşük olduğu gösterilmiştir. Endojen IGF-1'in fizyolojik konsantrasyonları mitojenik-proliferatif yolağı aktive edebilir; ancak, TOUJEO tedavisi dahil olmak üzere insülin tedavisinde bulunan terapötik konsantrasyonlar IGF-1 yolağını aktive etmek için gereken farmakolojik konsantrasyonlardan belirgin olarak daha düşüktür.
Bir klinik farmakoloji çalışmasında, aynı dozlarda verildiğinde, intravenöz insülin glarjin ve insan insülininin eşdeğer etki gücüne sahip olduğu gösterilmiştir.
Tüm insülinlerde olduğu gibi, insülin glarjinin etki süresi fiziksel aktivite ve diğer değişkenlerden etkilenebilmektedir.
![]() Klinik etkililik ve güvenlilik
Klinik etkililik ve güvenlilik
Günde tek doz TOUJEO'nun (insülin glarjin 300 U/mL) glisemik kontroldeki etkililik ve güvenliliği günde tek doz uygulanan insülin glarjin 100 U/mL ile süresi 26 haftaya kadar uzayan açık etiketli, randomize, aktif kontrollü, paralel çalışmalarda 546 tip 1 ve 2.474 tip 2 diabetes mellitus hastasında karşılaştırılmıştır (Tablo 1 ve 2).
Bu çalışmaların sonuçları başlangıca göre çalışma sonunda HbA1c düşüşünün insülin glarjin 100 U/mL ile benzer olduğunu göstermiştir. Çalışma sonunda plazma glukoz düzeyindeki azalma TOUJEO ve insülin glarjin 100 U/mL ile benzer olup düşüş TOUJEO ile titrasyon fazında daha kademeli olmuştur. Glisemik kontrol TOUJEO günde bir kez sabah ya da akşam uygulandığında benzer bulunmuştur.
HbA1C'deki düzelme cinsiyet, etnik köken, yaş, diyabet süresi (<10 yıl ve ≥10 yıl), başlangıçtaki HbA1c değeri (<%8 veya ≥%8) veya başlangıçtaki vücut kitle indeksinden (VKİ) etkilenmemiştir.
![]()
Bu hedefe yönelik tedavili çalışmaların sonunda, hasta popülasyonuna ve eşzamanlı tedaviye bağlı olarak TOUJEO grubunda karşılaştırma grubuna göre %10-18 oranında daha yüksek doz gözlenmiştir (Tablo 1 ve 2). Gerçek yaşam verilerini içeren daha uzun dönem çalışmalarda ise (faz 4 çalışmaları) insülin glarjin 100 U/mL ve diğer analog bazal insülinlerden TOUJEO'ya geçişte TOUJEO dozunda artış görüldüğü gibi, dozun değişmediği ya da azaldığı sonuçlar da elde edilmiştir.
Klinik çalışmalardan elde edilen sonuçlar, doğrulanmış hipoglisemi (günün herhangi bir zamanında ve gece) insidansının, insülin glarjin 100 U/mL ile tedavi edilen hastalarla karşılaştırıldığında TOUJEO ile tedavi edilen hastalarda daha düşük olduğunu göstermiştir. İnsülin dışı antihiperglisemik ilaç ya da öğün sırasında kullanılan insülin kombinasyonu kullanan tip 2 diabetes mellitus hastalarında doğrulanmış gece hipoglisemisi riskinin azaltılmasında TOUJEO'nun insülin glarjin 100 U/mL'ye üstünlüğü, 9. haftadan çalışma sonuna kadarki zaman aralığında, önceden bazal insülin ve oral antihiperglisemik ilaç (%18 risk azaltma) ya da öğün sırasında kullanılan insülin (%21 risk azaltma) kombinasyonu ile tedavi edilmiş hastalarda gösterilmiştir.
Özet olarak, hipoglisemi riskine ilişkin bu etkiler, insülin glarjin 100 U/mL ile tedavi edilen hastalarla karşılaştırıldığında TOUJEO ile tedavi edilen hastalarda yaş, cinsiyet, VKİ ve diyabet süresinden (<10 yıl ve ≥10 yıl) bağımsız olarak gözlenmiştir.
Tip 1 diyabeti olan hastalarda, hipoglisemi insidansı, TOUJEO ile tedavi edilen hastalarda insülin glarjin 100 U/mL ile tedavi edilen hastalarla karşılaştırıldığında benzer bulunmuştur (Tablo 3).
Tablo 1: Tip 1 diabetes mellitus klinik çalışmalarından elde edilen sonuçlar
26 haftalık tedavi | ||
| TOUJEO | IGlar |
Kombinasyon tedavisi | Öğün sırasında kullanılan insülin analoğu | |
Tedavi edilen hasta sayısı (mITT) | 273 | 273 |
HbA1c | ||
Başlangıç ortalaması | 8,13 | 8,12 |
Ayarlanmış başlangıca göre ortalama değişim | -0,40 | -0,44 |
Ayarlanmış Ortalama farkı | 0,04 [-0,098 ila 0,185] | |
Bazal insülin dozu (U/kg) | ||
Başlangıç ortalaması | 0,32 | 0,32 |
Başlangıca göre ortalama değişim | 0,15 | 0,09 |
Vücut ağırlığı(kg) | ||
Başlangıç ortalaması Başlangıçtan ortalama değişiklik | 81,89 0,46 | 81,80 1,02 |
IGlar: İnsülin glarjin 100 U/mL
a mITT: Değiştirilmiş tedaviye niyetlenilmiş popülasyon
b Tedavi farkı: TOUJEO – İnsülin glarjin 100 U/mL; [%95 Güvenlik Aralığı]
c Başlangıca göre 6 aydaki değişiklik (gözlemlenen olgu)
d Başlangıca göre 6 aylık temel tedavinin son değerindeki değişim
Tablo 2: Tip 2 diabetes mellitus klinik çalışmalarından elde edilen sonuçlar
26 haftalık tedavi | ||||||
| Önceden bazal insülin ile tedavi edilen hastalar | Önceden bazal insülin ile tedavi edilen hastalar | Önceden insülin kullanmamış hastalar | |||
Kombinasyon tedavisi | Öğün sırasında kullanılan insülin analoğu± metformin | İnsülin içermeyen antihiperglisemik ilaçlar | ||||
| TOUJEO | IGlar | TOUJEO | IGlar | TOUJEO | IGlar |
Tedavi edilen hasta sayısı | 404 | 400 | 403 | 405 | 432 | 430 |
HbA1c | ||||||
Başlangıç ortalaması
Ayarlanmış başlangıca göre ortalama değişim Ayarlanmış ortalama farkı | 8,13
-0,90 | 8,14
-0,87 | 8,27
-0,73 | 8,22
-0,70 | 8,49
-1,42 | 8,58
-1,46 |
-0,03 [-0,144 ila 0,083] |
-0,03 [-0,168 ila 0,099] |
0,04 [-0,090 ila 0,174] | ||||
Bazal insülin dozu (U/kg) | ||||||
Başlangıç ortalaması
Başlangıca göre ortalama değişim | 0,67
0,31 | 0,67
0,22 | 0,64
0,30 | 0,66
0,19 | 0,19
0,43 | 0,19
0,34 |
Vücut ağırlığı (kg) | ||||||
Başlangıç ortalaması
Başlangıca göre ortalama değişim | 106,11
0,93 | 106,50
0,90 | 98,73
0,08 | 98,17
0,66 | 95,14
0,50 | 95,65
0,71 |
IGlar: İnsülin glarjin 100 U/mL
a mITT: Değiştirilmiş tedaviye niyetlenilmiş popülasyon
b Tedavi farkı: TOUJEO – İnsülin 100 U/mL; [%95 Güvenlik Aralığı]
c Başlangıca göre 6 aydaki değişiklik (gözlemlenen olgu)
d Başlangıca göre 6 aylık temel tedavinin son değerindeki değişim
Tablo 3 - Tip 1 ve tip 2 diabetes mellitus klinik çalışmalarındaki hipoglisemik epizotlarının özeti
Diyabetik popülasyon | Tip 1 diabetes mellitus Önceden bazal insülin ile tedavi edilen hastalar | Tip 2 diabetes mellitus Önceden bazal insülin ile tedavi edilen hastalar | Tip 2 diabetes mellitus Önceden insülin kullanmamış veya bazal insülin kullanan hastalar | ||||
Kombinasyon tedavisi | Öğün sırasında kullanılan insülin analoğu | Öğün sırasında kullanılan insülin analoğu± metformin | İnsülin içermeyen antihiperglisemik ilaçlar | ||||
| TOUJEO | IGlar | TOUJEO | IGlar | TOUJEO | IGlar | |
Şiddetli hipoglisemi insidansı (%) (n/Toplam N) | |||||||
Tüm çalışma periyotu |
| 6,6 | 9,5 | 5,0 | 5,7 | 1,0 | 1,2 |
| (18/274) | (26/275) | (20/404) | (23/402) | (8/838) | (10/844) | |
RR*: 0,69 [0,39; 1,23] | RR: 0,87 [0,48; 1,55] | RR: 0,82 [0,33; 2,00] | |||||
Doğrulanmış hipoglisemi insidansı (%) (n/Toplam N) | |||||||
Tüm çalışma periyodu |
| 93,1 | 93,5 | 81,9 | 87,8 | 57,6 | 64,5 |
| (255/274) | (257/275) | (331/404) | (353/402) | (483/838) | (544/844) | |
RR: 1,00 [0,95;1,04] | RR: 0,93 [0,88; 0,99] | RR: 0,89 [0,83; 0,96] | |||||
Doğrulanmış gece hipoglisemi insidansı (%) (n/Toplam N) | |||||||
9.haftadan çalışma sonuna kadar | 59,3 | 56,0 | 36,1 | 46,0 | 18,4 | 22,5 | |
(162/273) | 153/273) | (184/400) | (184/400) | (154/835) | (188/835) | ||
RR: 1,06 [0,92;1,23] | RR: 0,79 [0,67;0,93] | RR: 0,82 [0,68;0,99] | |||||
IGlar: İnsülin glarjin 100 U/mL
a Şiddetli hipoglisemi: Karbonhidrat, glukagon veya diğer kurtarma eylemlerini aktif olarak uygulamak için başka bir kişinin yardımını gerektiren epizot.
b Doğrulanmış hipoglisemi: Herhangi şiddetli hipoglisemi ve/veya ≤3,9 mmol/l plazma glukoz değeri ile doğrulanan hipoglisemi
c Gece hipoglisemisi: 00:00 ve 05:59 saatleri arasında meydana gelen epizot
d 6 aylık tedavi süresi
*RR: Rölatif risk oranı; [%95 Güvenlik Aralığı]
Dozlama zamanı esnekliği
Sabit veya esnek dozlama zamanı ile kullanılan TOUJEO'nun güvenlilik ve etkililiği 3 aylık randomize, açık etiketli iki klinik çalışmada değerlendirilmiştir. Tip 2 diyabet hastaları (n=194) TOUJEO'yu günde bir kez akşam ya günün aynı saatinde (sabit dozlama zamanı) ya da normal uygulama zamanından önce veya sonraki 3 saat içinde (esnek dozlama zamanı) kullanmıştır. Esnek dozlama zamanı ile uygulama, glisemik kontrol ve hipoglisemi insidansını etkilememiştir.
Antikorlar
TOUJEO ve insülin glarjin 100 U/mL'yi karşılaştıran çalışmalardan elde edilen sonuçlar, TOUJEO ve insülin glarjin 100 U/mL arasında anti-insülin antikorlarının gelişimi, etkililiği, güvenliliği veya bazal insülin dozu açısından bir fark göstermemiştir.
Vücut ağırlığı
![]()
TOUJEO ile tedavi edilen hastalarda 6 aylık periyot sonunda vücut ağırlığındaki ortalama değişimin 1 kg'dan az olduğu gözlenmiştir (Bkz. Tablo 1 ve 2).
Diyabetik retinopatinin progresyonuna ilişkin bir çalışmanın sonuçları
İnsülin glarjin 100 U/mL'nin (günde bir kez) diyabetik retinopati üzerindeki etkileri, Erken Tedavi Diyabetik Retinopati Çalışması (ETDRS) ölçeğinde 3 veya daha fazla retinopati progresyonunun fundus fotoğrafı kullanılarak araştırıldığı, tip 2 diyabeti olan 1024 hastada yürütülen açık etiketli 5 yıllık NPH kontrollü (günde iki kere verilen NPH) bir çalışmada değerlendirilmiştir. İnsülin glarjin 100 U/mL, NPH insülinle karşılaştırıldığında diyabetik retinopatinin progresyonunda anlamlı bir fark görülmemiştir.
Uzun süreli etkililik ve güvenlilik sonlanım çalışması
Çok merkezli, randomize, 2x2 faktorial tasarımlı ORIGIN (Outcome Reduction with Initial Glargine INtervention: Başlangıçta glarjin müdahalesi ile sonlanım azalması) çalışması, yüksek kardiyovasküler (KV) riski olup açlık glukozu (IFG) ya da glukoz toleransı (IGT) bozuk (katılımcıların %12'si) ya da tip 2 diyabet hastası (en fazla bir antidiyabetik oral ilaç ile tedavi edilen) (katılımcıların %88'i) 12537 katılımcı ile yürütülmüştür. Katılımcılar APG ≤95 mg/dl (5,3 mM) olacak şekilde titre edilen insülin glarjin 100 U/mL (n=6264) tedavisine ya da standart bakıma (n=6273) randomize edilmiştir (1:1).
İlk primer ortak etkililik sonlanımı KV ölüm, ölümcül olmayan miyokard enfarktüsü (MI) ya da ölümcül olmayan inmenin ilk ortaya çıktığı zaman ve ikinci primer ortak etkililik sonlanımı ilk primer ortak sonlanımdaki herhangi bir olay, revaskülarizasyon girişimi (koroner, karotik ya da periferik) ya da kalp yetmezliği nedeniyle hastane yatışının ilk ortaya çıktığı zamandır.
Sekonder sonlanım noktaları tüm nedenlere bağlı mortalite ve bir birleşik mikrovasküler sonlanımı içermiştir.
İnsülin glarjin 100 U/mL standart bakım ile karşılaştırıldığında KV hastalık ve KV mortalite için rölatif riski değiştirmemiştir. İnsülin glarjin ve standart bakım arasında iki primer ortak sonlanım; bu sonlanımları oluşturan birleşik sonlanımlardan herhangi biri; tüm nedenlere bağlı mortalite ya da birleşik mikrovasküler sonlanım açısından fark saptanmamıştır.
Çalışma sonunda ortalama insülin glarjin 100 U/mL dozu 0,42 U/kg olarak saptanmıştır. Başlangıçta katılımcıların medyan HbA1c değeri %6,4 iken, medyan HbA1c değer aralığı tedavi sırasında insülin glarjin 100 U/mL grubunda %5,9 - 6,4 ve izlem boyunca standart bakım grubunda %6,2-6,6 bulunmuştur.
Şiddetli hipoglisemi oranı (etkilenen katılımcı/100 katılımcı maruziyet yılı) insülin glarjin 100 U/mL grubunda 1,05 ve standart bakım grubunda 0,30; doğrulanmış ciddi olmayan hipoglisemi oranları insülin glarjin 100 U/mL grubunda 7,71 ve standart bakım grubunda 2,44 bulunmuştur.
6 yıllık çalışma boyunca insülin glarjin 100 U/mL grubunun %42'sinde herhangi bir hipoglisemi olayı ortaya çıkmamıştır.
Son tedavi muayenesinde, vücut ağırlığında başlangıca göre insülin glarjin 100 U/mL grubunda ortalama 1,4 kg artış ve standart bakım grubunda ortalama 0,8 kg azalma saptanmıştır.
Pediyatrik popülasyon
TOUJEO'nun etkililiği ve güvenliliği, tip I diabetes mellitusu olan çocuklarda ve adolesanlarda,
26 haftalık bir periyod için 1:1 randomize kontrollü açık etiketli bir klinik çalışmada değerlendirilmiştir (n=463). TOUJEO kolundaki hastalar 12 yaşın altındaki 73 çocuk ve 12 yaş ve üzeri 160 çocuktan oluşmuştur. Günde bir doz uygulanan TOUJEO, 100 ünite/mL insülin glarjinle kıyaslandığında, HbA1c ve APG değerlerinde başlangıçtan 26. haftaya kadar benzer bir düşüş göstermiştir.
Doz-yanıt analizi, pediyatrik hastalarda başlangıç titrasyon fazını takiben vücut ağırlığına göre
ayarlanan dozların, kararlı durumdaki yetişkin hastalardan daha yüksek olduğunu göstermiştir.
Herhangi bir kategoride hastalardaki genel hipoglisemi insidansı her iki tedavi grubunda da benzer olmuştur (TOUJEO grubundaki hastalarda en az bir olay bildiren % 97,9 ve 100 ünite/mL insülin glarjin grubunda en az bir olay bildiren %98,2). Benzer şekilde, nokturnal hipoglisemi TOUJEO ve 100 ünite/mL insülin glarjin tedavi gruplarında benzer olmuştur. Şiddetli hipoglisemi bildiren hastaların oranı TOUJEO grubunda, 100 ünite/mL insülin glarjin grubu ile kıyaslandığında, sırasıyla %6 ve %8,8 olmak üzere daha düşük olmuştur. Ketoz ile birlikte hiperglisemik episodlar gösteren hastaların oranı TOUJEO grubunda, 100 ünite/mL insülin glarjin grubuna kıyasla, sırasıyla %6,4 ve %11,8 olmak üzere daha düşük olmuştur. TOUJEO ile advers olaylar ve standart güvenlilik parametreleri açısından herhangi bir güvenlilik sorunu tanımlanmamıştır. Antikor oluşumu seyrektir ve bir klinik etkisi yoktur. Tip II diyabetes mellitusu olan pediyatrik hastalar için etkililik ve güvenlilik verileri, tip I diyabetes mellitusu olan adolesan ve yetişkin hastalar ve tip II diyabetes mellitusu olan yetişkin hastalara ait verilerden ekstrapole edilmiştir. Sonuçlar TOUJEO'nun tip II diyabetes mellitusu olan pediyatrik hastalarda kullanımını desteklemektedir.
5.2. Farmakokinetik özellikler
Emilim:
Sağlıklı bireylerde ve diyabetik hastalarda, insülin glarjin 100 U/mL ile karşılaştırıldığında, TOUJEO subkutan enjeksiyonu sonrasında insülin serum konsantrasyonları, oldukça düzleşmiş bir zaman konsantrasyon profili oluşturacak şekilde daha yavaş ve uzun süreli emilim göstermiştir.
TOUJEO'nun farmakokinetik profili farmakodinamik aktivitesi ile tutarlı bulunmuştur.
Dağılım:
Terapötik aralıkta günlük TOUJEO uygulamasında kararlı duruma 3-4 gün sonra ulaşılır. Subkutan TOUJEO uygulaması sonrasında 24 saatlik insülin maruziyetindeki değişim katsayısı olarak tanımlanan hastadaki maruziyet değişkenliği kararlı durumda düşük bulunmuştur (%17,4).
Biyotransformasyon:
Subkutan insülin glarjin enjeksiyonundan sonra, insülin glarjin Beta zincirinin karboksil ucunda hızla metabolize olarak, iki aktif metabolit olan M1 (21A-Gly-insülin) ve M2 (21A-Gly-des- 30B-Thr-insülin) oluşmaktadır. Plazmada, dolaşımdaki başlıca bileşik M1 metabolitidir. M1 metabolitine maruziyet uygulanan insülin glarjin dozuyla birlikte artar. Farmakokinetik ve farmakodinamik bulgular, insülin glarjin ile subkutan enjeksiyonun etkisinin esas olarak M1'e maruziyete dayandığını göstermektedir. İnsülin glarjin ve M2 metaboliti bireylerin büyük çoğunluğunda saptanabilir düzeyde bulunmamıştır ve saptanabildiklerinde konsantrasyonlarının uygulanan insülin glarjin dozundan ve formülasyonundan bağımsız olduğu bulunmuştur.
Eliminasyon:
İntravenöz yoldan uygulandığında insülin glarjin ve insan insülininin eliminasyon yarılanma ömrü benzerdir.
Subkutan enjeksiyon sonrasında TOUJEO'nun yarılanma ömrü subkutan dokudan emilim oranı ile hesaplanır. Subkutan enjeksiyon sonrasında TOUJEO'nun yarılanma ömrü dozdan bağımsız olarak 18-19 saattir.
Doğrusallık/doğrusal olmayan durum:
TOUJEO subkutan enjeksiyonu ardından sistemik maruziyeti doza oranlı olarak artar.
Pediyatrik popülasyon
TOUJEO için popülasyon farmakokinetik analizi, tip I diyabeti olan 75 pediyatrik gönüllüye ait (6 ila <18 yaş arası) veriler kullanılarak, ana metaboliti M1'in konsantrasyon verilerine dayanarak gerçekleştirilmiştir. Vücut ağırlığı TOUJEO'nun klirensini doğrusal olmayan bir yönde etkilemektedir. Sonuç olarak, pediyatrik hastalarda maruziyet (EAA), vücut ağırlığına göre ayarlanmış aynı dozu aldıklarında, yetişkin hastalara kıyasla hafif oranda daha düşüktür.
5.3. Klinik öncesi güvenlilik verileri
Konvansiyonel güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme toksisitesi ile ilgili çalışmalar temelinde klinik öncesi veriler insanlar için özel bir tehlike göstermemektedir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
İLAÇ GENEL BİLGİLERİ
Sanofi Sağlık Ürünleri Ltd.Şti
| Geri Ödeme Kodu | A15997 |
| Satış Fiyatı | 1787.24 TL [ 2 May 2025 ] |
| Önceki Satış Fiyatı | 1787.24 TL [ 25 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699809950863 |
| Etkin Madde | Insulin Glarjin |
| ATC Kodu | A10AE04 |
| Birim Miktar | 300 |
| Birim Cinsi | U/ML |
| Ambalaj Miktarı | 5 |
| Sindirim Sistemi ve Metabolizma > İnsülinler ve Analogları > İnsülin Glargine |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |